一种无标记荧光检测胰蛋白酶的超分子组装体及其制备方法与流程
本发明一种无标记荧光检测胰蛋白酶的超分子组装体及其制备方法,属于材料、生物和分析化学交叉学科的技术领域。
背景技术:
胰蛋白酶是蛋白质分解中最重要的消化酶之一,胰蛋白酶原的分泌、活化、抑制以及循环的不平衡会导致急性或慢性的胰腺疾病,严重的例如胰腺癌。大约每年有35000例胰腺癌是由于丝氨酸蛋白酶尤其是胰蛋白酶的不平衡引起的。此外胰蛋白酶不仅起消化酶的作用,而且还能限制分解糜蛋白酶原、羧肽酶原、磷脂酶原等其它酶的前体,起活化作用。
目前发展起来的测定胰蛋白酶的方法主要有紫外分光光度法、比色法、荧光法、免疫法、质谱法(ms)、液相色谱法(hplc)、电泳法等。紫外分光光度法与比色法操作简单,但灵敏度低,重现性差。免疫法灵敏度高,但由于单克隆抗体的使用使得成本也高,且需要一定的操作技术。质谱仪器昂贵,对样品的纯度要求高,色谱以及电泳法需要比较复杂的操作和较长的检测时间。
相比这些方法,荧光法操作简便、灵敏度高、可实现实时监测,具有临床应用的潜在可能。一般荧光检测的方法是基于荧光标记的底物,如专利201410429549.2采用了荧光团标记的肽链,但这种方法成本较高而且荧光标记可能会对底物的选择性造成一定的影响。因而有研究者发展了基于非共价作用即超分子组装的无标记荧光检测方法,组装单元主要是应用水溶性荧光共轭聚合物以及新型的聚集诱导发光分子或者荧光量子点,如专利201510719927.5采用了荧光碳点作为探针,但这些荧光探针的合成与分离仍然比较复杂,提高了成本。因而建立制备简单、成本低的荧光检测方法具有重要的意义。
我们以前开发了一种无标记的胰蛋白酶检测方法,如专利201210116073.8所述,采用表面活性剂与带相反电荷的聚电解质进行组装,通过酶催化水解作用下的解组装来实现胰蛋白酶的检测。该体系是通过荧光减低来实现检测,相对于荧光升高的方法,荧光降低的干扰因素较多,此外该体系的抗盐性较差,限制了该体系在生理环境中的应用。因而本发明中采用抗盐性较好的双子表面活性剂来构建超分子组装体,并通过荧光升高的方式来实现检测。通过检索,未见双子表面活性剂用于荧光检测的专利与报道。
技术实现要素:
本发明一种无标记荧光检测胰蛋白酶的超分子组装体及其制备方法的目的是克服现有技术的不足,提供一种制备简单、成本低且具有良好抗盐性的无标记荧光检测胰蛋白酶的超分子组装体及其制备方法。
本发明一种无标记荧光检测胰蛋白酶的超分子组装体,其特征在于该超分子组装体是由季铵型阳离子双子表面活性剂与肝素钠通过静电作用形成的复合物水溶液,所述的季铵型阳离子双子表面活性剂化学结构式为:
其中n=12,14,16。
上述一种无标记荧光检测胰蛋白酶的超分子组装体的制备方法,其特征在于包括如下步骤:
ⅰ季铵型阳离子双子表面活性剂的临界胶束浓度cmc的测定;
将季铵型阳离子双子表面活性剂溶解于浓度为10mm,ph8.0的磷酸盐缓冲溶液中,配制浓度范围为10-2moll-1~10-7moll-1的梯度溶液;用微量进样器移取10~50μl尼罗红的丙酮溶液,加入到梯度溶液中,使梯度溶液中尼罗红的终浓度为10-6moll-1,以40~100khz敞口超声波处理10~60分钟,静置0.5~12小时后进行荧光发射光谱检测;以发射峰强度为纵坐标,表面活性剂的对数浓度为横坐标作图,得到s形曲线,曲线上第一个转折点对应浓度即为双子表面活性剂的临界胶束浓度cmc;
ⅱ肝素钠浓度的测定:
将肝素钠溶解于浓度为10mm,ph8.0的磷酸盐缓冲溶液中,配制浓度范围为10~10-5mgml-1的梯度溶液;根据步骤i得到的季铵型阳离子双子表面活性剂的临界胶束浓度cmc,确定阳离子双子表面活性剂的浓度为0.3~1.6cmc,按照体积比1:1加入到肝素钠的梯度溶液中;用微量进样器移取10~50μl尼罗红的丙酮溶液,加入到混合溶液中,使混合溶液中尼罗红的终浓度为10-6moll-1,以40~100khz敞口超声波处理10~60分钟,静置0.5~12小时后进行荧光发射光谱检测;以发射峰强度为纵坐标,肝素钠的对数浓度为横坐标作图,得到s形曲线,曲线上第二个转折点对应浓度即为形成稳定超分子组装体的肝素钠浓度;
ⅲ超分子组装体溶液的配制:
按照步骤ii中确定的季铵型阳离子双子表面活性剂与肝素钠的配比,将两种溶液按照体积比1:1混合;用微量进样器移取10~50μl尼罗红的丙酮溶液,加入到混合溶液中,使混合溶液中尼罗红的终浓度为10-6moll-1,以40~100khz敞口超声波处理10~60分钟,静置0.5~12小时后得到超分子组装体溶液。
本发明一种无标记荧光检测胰蛋白酶的超分子组装体的制备方法,与现有技术相比具有的有益效果:
(1)采用新型的双子表面活性剂构建组装体,通过超分子组装体解组装与恢复组装的方式进行检测,不需要任何有机合成过程,制备简单、成本低;
(2)双子表面活性剂具有良好的抗盐性,赋予超分子组装体在生理环境中良好的稳定性,扩展了体系在生理环境中的应用。
附图说明
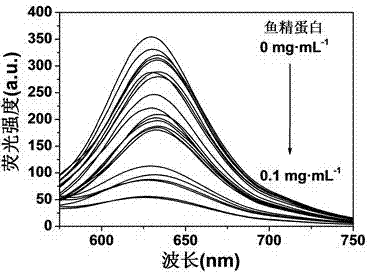
图1是超分子组装体系(乙撑基双十二烷基二甲基溴化铵+肝素钠)中加入不同浓度鱼精蛋白的荧光发射光谱图。
图2是超分子组装体系(乙撑基双十二烷基二甲基溴化铵+肝素钠)中加入鱼精蛋白(0.1mgml-1),再加入不同浓度胰蛋白酶的荧光发射光谱图。
具体实施方式
超分子组装体是由季铵型阳离子双子表面活性剂与肝素钠通过静电作用形成的复合物水溶液。首先测定季铵型阳离子表面活性剂的临界胶束浓度,在该浓度以下双子表面活性剂与肝素钠形成超分子组装体,疏水染料尼罗红进入组装体内腔,荧光发射增强。然后加入与肝素钠有特异性相互作用的鱼精蛋白,鱼精蛋白与肝素钠结合导致组装体解组装,荧光发射强度随鱼精蛋白浓度的增加而降低。选择荧光强度基本稳定的鱼精蛋白浓度,加入胰蛋白酶使鱼精蛋白水解,组装体恢复,荧光发射强度随酶浓度的增大而升高,以此实现酶活性的检测。下面的实施方式是对本发明的进一步说明,而不是限制本发明的范围。
实施方式1:
(1)超分子组装体溶液的制备
ⅰ季铵型阳离子双子表面活性剂的临界胶束浓度cmc的测定;
所用季铵型阳离子表面活性剂为乙撑基双十二烷基二甲基溴化铵,结构式如下式所示:
将乙撑基双十二烷基二甲基溴化铵溶解于浓度为10mm,ph8.0的磷酸盐缓冲溶液中,配制2ml浓度范围为10-2~10-7moll-1的梯度溶液;用微量进样器移取10μl尼罗红的丙酮溶液,加入到梯度溶液中,使梯度溶液中尼罗红的终浓度为10-6moll-1,以100khz敞口超声波处理10分钟,静置0.5小时后进行荧光发射光谱检测;以635nm处发射峰强度为纵坐标,表面活性剂的对数浓度为横坐标作图,得到s形曲线,曲线上第一个转折点对应浓度即为双子表面活性剂的临界胶束浓度cmc。荧光光谱测定得到双子表面活性剂的临界胶束浓度为1.75×10-5moll-1。
ⅱ肝素钠浓度的测定:
将肝素钠溶解于浓度为10mm,ph8.0的磷酸盐缓冲溶液中,配制浓度范围为10~10-5mgml-1的梯度溶液;根据步骤i得到的季铵型阳离子双子表面活性剂的临界胶束浓度cmc,确定双子表面活性剂的浓度为1.6cmc(2.8×10-5moll-1),按照体积比1:1加入到肝素钠的梯度溶液中;用微量进样器移取10μl尼罗红的丙酮溶液,加入到混合溶液中,使混合溶液中尼罗红的终浓度为10-6moll-1,以100khz敞口超声波处理10分钟,静置0.5小时后进行荧光发射光谱检测;以635nm处发射峰强度为纵坐标,肝素钠的对数浓度为横坐标作图,得到s形曲线,曲线上第二个转折点对应浓度即为形成稳定超分子组装体的肝素钠浓度。荧光光谱测定得到肝素钠浓度为0.05mgml-1。
ⅲ超分子组装体溶液的配制:
按照步骤ii中确定的季铵型阳离子双子表面活性剂与肝素钠的配比,将两种溶液按照体积比1:1混合;用微量进样器移取10μl尼罗红的丙酮溶液,加入到混合溶液中,使混合溶液中尼罗红的终浓度为10-6moll-1,以100khz敞口超声波处理10分钟,静置0.5小时后得到超分子组装体溶液。
(2)胰蛋白酶的检测
i鱼精蛋白浓度的确定:
在超分子组装体溶液中分别加入终浓度为10-7~1mgml-1的鱼精蛋白的磷酸盐缓冲溶液(10mm,ph=8),在37℃下放置10分钟后,检测荧光强度,以635nm处荧光发射峰强度下降的比率对加入鱼精蛋白浓度作图,得到检测标准曲线。
荧光强度下降的比率为(i0-i)/i0×100%,i0代表只加缓冲溶液的空白对照635nm处荧光发射峰强度,i代表加入不同浓度鱼精蛋白后635nm处荧光发射峰强度。荧光光谱检测结果表明:荧光发射峰强度下降比率与鱼精蛋白浓度有很好的线性关系,鱼精蛋白浓度达到0.1mgml-1荧光强度基本不再下降。
ⅱ胰蛋白酶的检测:
在超分子组装体溶液中加入0.1mgml-1的鱼精蛋白,然后分别加入终浓度为0.01~100μgml-1的胰蛋白酶的磷酸盐缓冲溶液(10mm,ph=8),在37℃下放置30分钟后,检测荧光强度,以635nm处荧光发射峰强度升高的比率对加入胰蛋白酶浓度作图,得到检测标准曲线。
荧光强度升高的比率为(i-i0)/i0×100%,i0代表只加缓冲溶液的空白对照635nm处荧光发射峰强度,i代表加入不同浓度胰蛋白酶后635nm处荧光发射峰强度。荧光光谱检测结果表明:荧光发射峰强度升高比率与胰蛋白酶浓度有很好的线性关系,超分子组装体在缓冲溶液中可以检测胰蛋白酶。
ⅲ抗盐性实验:
在超分子组装体溶液中加入0.1mgml-1的鱼精蛋白,分别加入终浓度为0~500mmoll-1的氯化钠溶液,检测荧光强度。最后分别加入终浓度为100μgml-1的胰蛋白酶溶液,在37℃下放置30分钟后,检测荧光强度。
荧光光谱检测结果表明:在不同盐浓度下,荧光强度都有很好的恢复,超分子组装体系具有良好的抗盐性。
实施方式2
(1)超分子组装体溶液的制备
ⅰ季铵型阳离子双子表面活性剂的临界胶束浓度cmc的测定;
所用季铵型阳离子表面活性剂为乙撑基双十四烷基二甲基溴化铵,结构式如下式所示:
将乙撑基双十四烷基二甲基溴化铵溶解于浓度为10mm,ph8.0的磷酸盐缓冲溶液中,配制2ml浓度范围为10-2~10-7moll-1的梯度溶液;用微量进样器移取30μl尼罗红的丙酮溶液,加入到梯度溶液中,使梯度溶液中尼罗红的终浓度为10-6moll-1,以70khz敞口超声波处理30分钟,静置2小时后进行荧光发射光谱检测;以635nm处发射峰强度为纵坐标,表面活性剂的对数浓度为横坐标作图,得到s形曲线,曲线上第一个转折点对应浓度即为双子表面活性剂的临界胶束浓度cmc。荧光光谱测定得到双子表面活性剂的临界胶束浓度为9.2×10-6moll-1。
ⅱ肝素钠浓度的测定:
将肝素钠溶解于浓度为10mm,ph8.0的磷酸盐缓冲溶液中,配制浓度范围为10~10-5mgml-1的梯度溶液;根据步骤i得到的季铵型阳离子双子表面活性剂的临界胶束浓度cmc,确定双子表面活性剂的浓度为cmc(9.2×10-6moll-1),按照体积比1:1加入到肝素钠的梯度溶液中;用微量进样器移取30μl尼罗红的丙酮溶液,加入到混合溶液中,使混合溶液中尼罗红的终浓度为10-6moll-1,以70khz敞口超声波处理30分钟,静置2小时后进行荧光发射光谱检测;以635nm处发射峰强度为纵坐标,肝素钠的对数浓度为横坐标作图,得到s形曲线,曲线上第二个转折点对应浓度即为形成稳定超分子组装体的肝素钠浓度。荧光光谱测定得到肝素钠浓度为0.03mgml-1。
ⅲ超分子组装体溶液的配制:
按照步骤ii中确定的季铵型阳离子双子表面活性剂与肝素钠的配比,将两种溶液按照体积比1:1混合;用微量进样器移取30μl尼罗红的丙酮溶液,加入到混合溶液中,使混合溶液中尼罗红的终浓度为10-6moll-1,以70khz敞口超声波处理30分钟,静置2小时后得到超分子组装体溶液。
(2)胰蛋白酶的检测
i鱼精蛋白浓度的确定:同实施方式1。
荧光光谱检测结果表明:荧光发射峰强度下降比率与鱼精蛋白浓度有很好的线性关系,鱼精蛋白浓度达到0.05mgml-1荧光强度基本不再下降。
ⅱ胰蛋白酶的检测:除了在超分子组装体溶液中加入0.05mgml-1的鱼精蛋白,其余同实施方式1。
荧光光谱检测结果表明:荧光发射峰强度下降比率与胰蛋白酶浓度有很好的线性关系,超分子组装体在缓冲溶液中可以检测胰蛋白酶。
ⅲ抗盐性实验:在超分子组装体溶液中加入0.05mgml-1的鱼精蛋白,其余同实施方式1。
荧光光谱检测结果表明:在不同盐浓度下,荧光强度都有很好的恢复,超分子组装体系具有良好的抗盐性。
实施方式3
(1)超分子组装体溶液的制备
ⅰ季铵型阳离子双子表面活性剂的临界胶束浓度cmc的测定;
所用季铵型阳离子表面活性剂为乙撑基双十六烷基二甲基溴化铵,结构式如下式所示:
将乙撑基双十六烷基二甲基溴化铵溶解于浓度为10mm,ph8.0的磷酸盐缓冲溶液中,配制2ml浓度范围为10-2~10-7moll-1的梯度溶液;用微量进样器移取50μl尼罗红的丙酮溶液,加入到梯度溶液中,使梯度溶液中尼罗红的终浓度为10-6moll-1,以40khz敞口超声波处理60分钟,静置12小时后进行荧光发射光谱检测;以635nm处发射峰强度为纵坐标,表面活性剂的对数浓度为横坐标作图,得到s形曲线,曲线上第一个转折点对应浓度即为双子表面活性剂的临界胶束浓度cmc。荧光光谱测定得到双子表面活性剂的临界胶束浓度为1.05×10-6moll-1。
ⅱ肝素钠浓度的测定:
将肝素钠溶解于浓度为10mm,ph8.0的磷酸盐缓冲溶液中,配制浓度范围为10~10-5mgml-1的梯度溶液;根据步骤i得到的季铵型阳离子双子表面活性剂的临界胶束浓度cmc,确定双子表面活性剂的浓度为0.3cmc(3.15×10-7moll-1),按照体积比1:1加入到肝素钠的梯度溶液中;用微量进样器移取50μl尼罗红的丙酮溶液,加入到混合溶液中,使混合溶液中尼罗红的终浓度为10-6moll-1,以40khz敞口超声波处理60分钟,静置12小时后进行荧光发射光谱检测;以635nm处发射峰强度为纵坐标,肝素钠的对数浓度为横坐标作图,得到s形曲线,曲线上第二个转折点对应浓度即为形成稳定超分子组装体的肝素钠浓度。荧光光谱测定得到肝素钠浓度为0.01mgml-1。
ⅲ超分子组装体溶液的配制:
按照步骤ii中确定的季铵型阳离子双子表面活性剂与肝素钠的配比,将两种溶液按照体积比1:1混合;用微量进样器移取50μl尼罗红的丙酮溶液,加入到混合溶液中,使混合溶液中尼罗红的终浓度为10-6moll-1,以40khz敞口超声波处理60分钟,静置12小时后得到超分子组装体溶液。
(2)胰蛋白酶的检测:
i鱼精蛋白浓度的确定:同实施方式1。
荧光光谱检测结果表明:荧光发射峰强度下降比率与鱼精蛋白浓度有很好的线性关系,鱼精蛋白浓度达到0.01mgml-1荧光强度基本不再下降。
ⅱ胰蛋白酶的检测:在超分子组装体溶液中加入0.01mgml-1的鱼精蛋白,其余同实施方式1。
荧光光谱检测结果表明:荧光发射峰强度下降比率与胰蛋白酶浓度有很好的线性关系,超分子组装体在缓冲溶液中可以检测胰蛋白酶。
ⅲ抗盐性实验:在超分子组装体溶液中加入0.01mgml-1的鱼精蛋白,其余同实施方式1。
荧光光谱检测结果表明:在不同盐浓度下,荧光强度都有很好的恢复,超分子组装体系具有良好的抗盐性。
实施方式4
(1)超分子组装体溶液的制备
ⅰ季铵型阳离子双子表面活性剂的临界胶束浓度cmc的测定:
同实施方式1。
荧光光谱测定得到阳离子双子表面活性剂的cmc。
ⅱ肝素钠浓度的测定:
将肝素钠溶解于浓度为10mm,ph8.0的磷酸盐缓冲溶液中,配制浓度范围为10~10-5mgml-1的梯度溶液;根据步骤i得到的季铵型阳离子双子表面活性剂的临界胶束浓度cmc,确定双子表面活性剂的浓度为0.8cmc,按照体积比1:1加入到肝素钠的梯度溶液中;用微量进样器移取20μl尼罗红的丙酮溶液,加入到混合溶液中,使混合溶液中尼罗红的终浓度为10-6moll-1,以80khz敞口超声波处理20分钟,静置1小时后进行荧光发射光谱检测,以635nm处发射峰强度为纵坐标,表面活性剂的对数浓度为横坐标作图,得到s形曲线,曲线上第二个转折点对应浓度即为形成稳定超分子组装体的肝素钠浓度。
ⅲ超分子组装体溶液的配制:
按照步骤ii中确定的季铵型阳离子双子表面活性剂与肝素钠的配比,将两种溶液按照体积比1:1混合;用微量进样器移取20μl尼罗红的丙酮溶液,加入到混合溶液中,使混合溶液中尼罗红的终浓度为10-6moll-1,以80khz敞口超声波处理20分钟,静置1小时后得到超分子组装体溶液。
(2)胰蛋白酶的检测
i鱼精蛋白浓度的确定:同实施方式1。
荧光光谱检测结果表明:荧光发射峰强度下降比率与鱼精蛋白浓度有很好的线性关系。
ⅱ胰蛋白酶的检测:同实施方式1。
荧光光谱检测结果表明:荧光发射峰强度下降比率与胰蛋白酶浓度有很好的线性关系,超分子组装体在缓冲溶液中可以检测胰蛋白酶。
ⅲ抗盐性实验:同实施方式1。
荧光光谱检测结果表明:在不同盐浓度下,荧光强度都有很好的恢复,超分子组装体系具有良好的抗盐性。
实施方式5
(1)超分子组装体溶液的制备
ⅰ季铵型阳离子双子表面活性剂的临界胶束浓度cmc的测定:
除所用季铵型阳离子双子表面活性剂结构式如下式所示,其余同实施方式1。
荧光光谱测定得到阳离子双子表面活性剂的cmc。
ⅱ肝素钠浓度的测定:
除所用季铵型阳离子双子表面活性剂结构式如上式所示,阳离子双子表面活性剂浓度为1.2cmc以外,其他同实施方式1。
荧光光谱测定得到形成稳定超分子组装体的肝素钠浓度。
ⅲ超分子组装体溶液的配制:同实施方式1。
(2)胰蛋白酶的检测
i鱼精蛋白浓度的确定:同实施方式1。
荧光光谱检测结果表明:荧光发射峰强度下降比率与鱼精蛋白浓度有很好的线性关系。
ⅱ胰蛋白酶的检测:同实施方式1。
荧光光谱检测结果表明:荧光发射峰强度下降比率与胰蛋白酶浓度有很好的线性关系,超分子组装体在缓冲溶液中可以检测胰蛋白酶。
ⅲ抗盐性实验:同实施方式1。
荧光光谱检测结果表明:在不同盐浓度下,荧光强度都有很好的恢复,超分子组装体系具有良好的抗盐性。
实施方式6
(1)超分子组装体溶液的制备
ⅰ季铵型阳离子双子表面活性剂的临界胶束浓度cmc的测定:
除所用季铵型阳离子双子表面活性剂结构式如下式所示,其余同实施方式2。
荧光光谱测定得到阳离子双子表面活性剂的cmc。
ⅱ肝素钠浓度的测定:
除所用季铵型阳离子双子表面活性剂结构式如上式所示,阳离子双子表面活性剂浓度为0.8cmc以外,其他同实施方式2。
荧光光谱测定得到形成稳定超分子组装体的肝素钠浓度。
ⅲ超分子组装体溶液的配制:同实施方式2。
(2)胰蛋白酶的检测
i鱼精蛋白浓度的确定:同实施方式2。
荧光光谱检测结果表明:荧光发射峰强度下降比率与鱼精蛋白浓度有很好的线性关系。
ⅱ胰蛋白酶的检测:同实施方式2。
荧光光谱检测结果表明:荧光发射峰强度下降比率与胰蛋白酶浓度有很好的线性关系,超分子组装体在缓冲溶液中可以检测胰蛋白酶。
ⅲ抗盐性实验:同实施方式2。
荧光光谱检测结果表明:在不同盐浓度下,荧光强度都有很好的恢复,超分子组装体系具有良好的抗盐性。
实施方式7
(1)超分子组装体溶液的制备
ⅰ季铵型阳离子双子表面活性剂的临界胶束浓度cmc的测定:
除所用季铵型阳离子双子表面活性剂结构式如下式所示,其余同实施方式3。
荧光光谱测定得到阳离子双子表面活性剂的cmc。
ⅱ肝素钠浓度的测定:
除所用季铵型阳离子双子表面活性剂结构式如上式所示,阳离子双子表面活性剂浓度为0.4cmc以外,其他同实施方式3。
荧光光谱测定得到形成稳定超分子组装体的肝素钠浓度。
ⅲ超分子组装体溶液的配制:同实施方式3。
(2)胰蛋白酶的检测
i鱼精蛋白浓度的确定:同实施方式3。
荧光光谱检测结果表明:荧光发射峰强度下降比率与鱼精蛋白浓度有很好的线性关系。
ⅱ胰蛋白酶的检测:同实施方式3。
荧光光谱检测结果表明:荧光发射峰强度下降比率与胰蛋白酶浓度有很好的线性关系,超分子组装体在缓冲溶液中可以检测胰蛋白酶。
ⅲ抗盐性实验:同实施方式3。
荧光光谱检测结果表明:在不同盐浓度下,荧光强度都有很好的恢复,超分子组装体系具有良好的抗盐性。
实施方式8
(1)超分子组装体溶液的制备
ⅰ季铵型阳离子双子表面活性剂的临界胶束浓度cmc的测定:
同实施方式5。
荧光光谱测定得到阳离子双子表面活性剂的cmc。
ⅱ肝素钠浓度的测定:
除所用季铵型阳离子双子表面活性剂结构式同实施方式5,阳离子双子表面活性剂浓度为0.6cmc以外,其余同实施方式4。
荧光光谱测定得到形成稳定超分子组装体的肝素钠浓度。
ⅲ超分子组装体溶液的配制:同实施方式4。
(2)胰蛋白酶的检测
i鱼精蛋白浓度的确定:同实施方式4。
荧光光谱检测结果表明:荧光发射峰强度下降比率与鱼精蛋白浓度有很好的线性关系。
ⅱ胰蛋白酶的检测:同实施方式4。
荧光光谱检测结果表明:荧光发射峰强度下降比率与胰蛋白酶浓度有很好的线性关系,超分子组装体在缓冲溶液中可以检测胰蛋白酶。
ⅲ抗盐性实验:同实施方式4。
荧光光谱检测结果表明:在不同盐浓度下,荧光强度都有很好的恢复,超分子组装体系具有良好的抗盐性。
- 还没有人留言评论。精彩留言会获得点赞!