一种利用金属氧化物催化制备Fe3O4的方法与流程
本发明涉及一种铁化合物的制备方法,具体涉及一种利用金属氧化物催化制备fe3o4的方法。
背景技术:
中国每年酸洗数百万吨的氧化铁,造成大量含有fe2+的酸洗废液。《钢铁工业水污染物排放标准》(gb13456.2012)u,明确规定总铁的含量小于10mg/l。然而,一般的钢材酸洗废液中,存在浓度大于100g/l的fe2+离子,无法直接排放,需要无害化处理。但作为废液排放,大量的fe2+被浪费,不仅造成巨大的环境负担,也是一种经济损失。因此,将废液中的fe2+转化成有经济价值的产物,是迫切需求。
以酸洗废液为原料制备fe3o4是一种回收fe2+的途径。由于fe含量较高,fe3o4可以直接回炉炼铁,此外,在颜料、磁性材料、医药生物及催化等领域均有应用,价值较高。最新发现,单晶八面体的fe3o4在燃料电池领域具有重要作用。
传统水热法或共沉淀法中,通过fe2+离子出发直接制备fe3o4,通常需要氧化剂,或添加一定配比的fe3+盐。为得到纯相fe3o4,氧化剂的供给量及fe2+与fe3+的比例需要严密调控。如果无法控制fe2+离子的氧化过程,产物中feooh、fe2o3等杂质含量较高,后处理困难,并极大地增加经济成本。因此,传统方法在实际fe2+的回收方面难度较大。
发明人在前期的研究中发现,向fe2+溶液中加入含有cu2+、ni2+和co2+等的盐溶液,可以高效制备高纯度fe3o4,如专利文献cn108751262a中所描述,该方法较传统方法大大简化了制备过程。后续的研究进一步探索了cu2+、ni2+和co2+等的盐在制备fe3o4的机理,在此基础上提出了新的制备方法。
技术实现要素:
为解决以上技术问题,本发明提供一种工艺简单、收率高、产物纯度高的制备fe3o4的方法。
技术方案如下:
一种利用金属氧化物催化制备fe3o4的方法,其关键在于按以下步骤进行:
向fe2+溶液中加入金属m氧化物粉末并分散,然后加入碱溶液得到混合溶液,该混合溶液进行水热反应,得到含有fe3o4颗粒的悬浊液,分离出产物fe3o4;
所述金属m氧化物为cuo、cu2o、coo或co3o4中的至少一种。
作为优选技术方案,上述金属m氧化物粉末中m元素与所述混合溶液中金属元素的原子百分比为m/(m+fe)=0.1~50at.%。
作为优选技术方案,上述金属m氧化物粉末中m元素与所述混合溶液中金属元素的原子百分比为m/(m+fe)=1~10at.%。
作为优选技术方案,上述水热反应的温度为100~200℃。
作为优选技术方案,上述水热反应的温度为120~150℃。
作为优选技术方案,上述水热反应时间为0.5~48h。
作为优选技术方案,上述水热反应时间为4~6h。
作为优选技术方案,上述fe2+溶液中fe2+的浓度为0.01~5mol/l。
作为优选技术方案,上述碱溶液中oh-的浓度为0.2~8mol/l。
附图说明
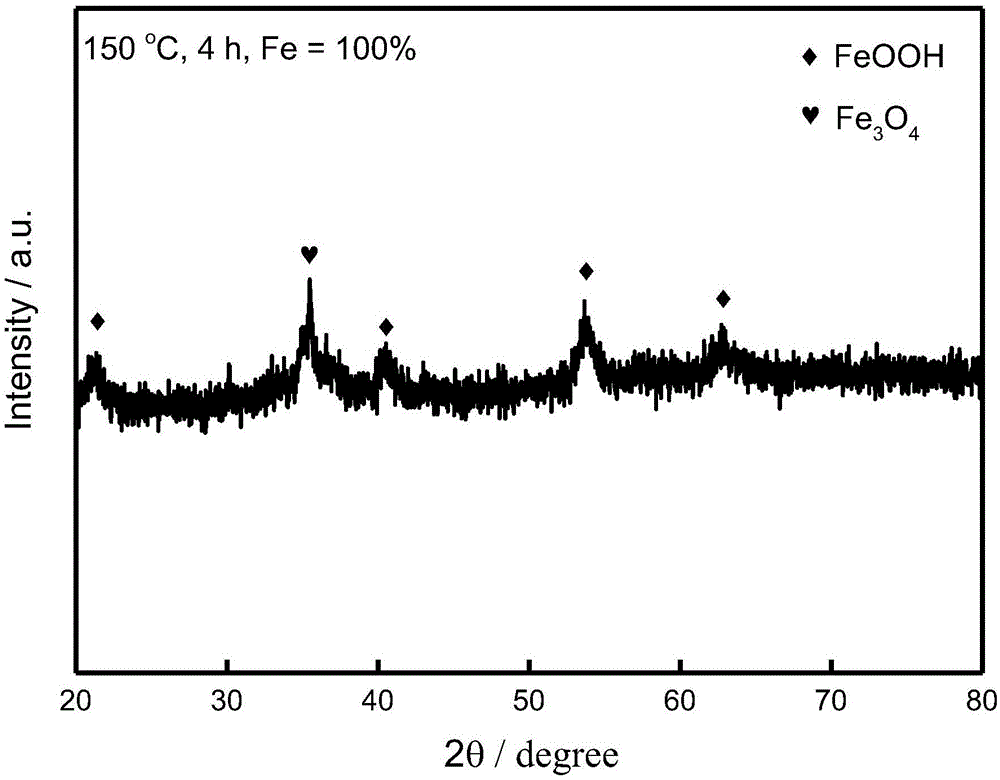
图1为对照例制备的样品x射线衍射(xrd)图谱;
图2为部分实施例方法制备得到的样品xrd图谱,其中:(a)实施例8;(b)实施例9(上)和实施例5(下);(c)实施例10;(d)实施例11;
图3为以氧化铜为催化剂制得样品的典型扫描电子显微镜(sem)图片及能谱仪(eds)面扫结果。
具体实施方式
下面结合实施例和附图对本发明作进一步说明。
(一)fe3o4的制备
一种利用金属氧化物催化剂制备fe3o4的方法,其步骤为:
向fe2+溶液中加入金属m的氧化物粉末并分散,添加量为,以金属m氧化物粉末中m元素与混合悬液中总的金属元素的原子百分比计,m/(m+fe)=0.1~50at.%;
然后搅拌加入碱溶液得到混合溶液,该混合溶液进行水热反应,得到含有fe3o4颗粒的悬浊液,分离出产物fe3o4。
金属m的氧化物为cuo、cu2o、coo或co3o4中的一种或几种的组合。产物可以通过离心、滤膜过滤、磁过滤等方式分离,使用cuo或cuo作为催化剂时,由于其无磁性,使用磁过滤可较方便将其去除。
表1给出了实施例1~20和对照例的反应物用量、浓度以及反应条件,其中,各实施例均加入金属m的氧化物粉末作为催化剂,而对照例不添加金属m的氧化物,其余步骤不变。其中,水热反应在反应釜中进行,反应温度为100~200℃,水热反应时间为0.5~48h。实验发现,当反应温度越高,反应时间可适当缩短,金属m的氧化物粉末的添加量也可适当降低。因此,根据预定的反应温度和时间,可调整添加金属m的氧化物粉末催化剂的用量。
所述fe2+溶液可以是氯化亚铁、硫酸亚铁等无机盐及其混合盐,也可使用柠檬酸盐、醋酸盐等有机盐及其混合盐。fe2+溶液中fe2+的浓度为0.01~5mol/l。
碱溶液可使用naoh,koh,lioh等常见的无机碱,也可使用如氨水以及聚乙烯亚胺(pei)等有机碱;此外,还可将无机碱与有机碱混合使用,使用pei时,其既可以作为分散剂以帮助金属氧化物分散在反应体系中,其本身又是碱试剂。碱溶液中oh-的浓度或完全电离的理论浓度为0.2~8mol/l。所有试剂均购自上海阿拉丁生化科技股份有限公司。
具体地,以实施例5为例,制备fe3o4的过程为:
反应试剂准备:取0.02mol的feso4,溶解在100ml水中,配置0.2m的硫酸亚铁溶液备用;取0.1mol的naoh,溶解在100ml水中,配置1m的naoh溶液备用;取cuo粉末备用。
制备fe3o4过程:取20mlfeso4溶液加入水热反应釜,然后加入0.03mmolcuo粉末,搅拌分散,再边搅拌边滴加10mlnaoh溶液。将水热反应釜封盖,放入恒温烘箱中,于120℃下反应1h,降至室温,得到黑色悬浊液。
反应完成后,使用磁性过滤器从上述黑色悬浊液中过滤分离出固体颗粒,洗涤、干燥,得到产物fe3o4。
对照例的实验过程类似,但硫酸亚铁溶液中不添加cuo粉末,加入naoh溶液后于150℃下反应4h,反应后产物为绿色,在收集过程中产物迅速氧化为橘红色。
表1不同实施例和对照例的反应物和反应条件
注:*oh-浓度是指碱溶液中已有的oh-、以及潜在的理论上可电离出的oh-的浓度,如氨水溶液中nh3·h2o的浓度。
(二)产物表征
x射线衍射(xrd)分析、扫描电子显微镜(sem)分析和能谱分析仪(eds)元素分析为常见的晶体表征方法,其中,xrd图谱能够反应测试样品的晶体结构,借助扫描电子显微镜(sem)能够直观观察样品形貌,采用能谱分析仪(eds)可对样品元素组成含量进行检测。
采用上述方法制备得到样品的典型xrd图谱如图1和图2所示。图1为对照例制备得到的样品,由图可知产物基本为feooh。根据反应过程中产物颜色变化,推测反应结束生成物为绿色的fe(oh)2,其在收集过程中迅速氧化为橘红色的feooh。
图2中分别为采用以下制备方法制备的样品的xrd图谱:(a)实施例8;(b)实施例9(上)和实施例5(下);(c)实施例10;(d)实施例11。由图谱可知,各工艺条件下均能制备得到fe3o4晶体。以cuo、cu2o为催化剂,产物fe3o4纯度较高。以coo和co3o4为催化剂,分离得到的产物中含有微量的不纯物。
对照例与实施例制得样品的对比表明,加入少量cuo、cu2o、coo或co3o4粉末进入反应体系,即可改变碱性条件下fe2+的反应方向,使其向着生成fe3o4晶体的方向进行,表明了这几种氧化物粉的催化作用。相较于传统制备方法,本方法制备工艺简单,反应体系无需严格控制为氧化或还原性气氛,对反应条件的适应性强。
制得样品的典型sem照片(a)及eds图谱(b,c,d,e)如图3所示,该样品由实施例5的方法制得。图3中(b)、(c)、(d)分别为元素o、fe、cu的面扫图,图中明亮部分代表相应元素的分布区域。可以看到,制得的fe3o4颗粒为正八面体单晶,颗粒尺寸在几百纳米到几微米范围。元素含量分析结果显示,产物中cu元素含量非常低,cu/(cu+fe)=0.63at.%。
有益效果:相较于传统制备方法,本发明利用cuo、cu2o、coo、co3o4等为催化剂,不需要再加氧化剂,碱性条件下从fe2+的盐溶液一步合成高纯微米级的单晶八面体的fe3o4,该制备方法工艺简单、高效快捷,成本低。此外,cuo、cu2o等不具有磁性,而fe3o4是一种顺磁性材料,在规模化应用中,可以通过磁性回收分离得到fe3o4,因而具有很好的工业应用前景,是一种用于工业钢铁酸洗废液的无害化、资源化处理方法。
最后需要说明的是,上述描述仅仅为本发明的优选实施例,本领域的普通技术人员在本发明的启示下,在不违背本发明宗旨及权利要求的前提下,可以做出多种类似的表示,这样的变换均落入本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!