一种回收利用碱性刻蚀废液的方法与流程
本发明涉及资源回收再利用领域,特别涉及一种回收利用碱性刻蚀废液的方法。
背景技术:
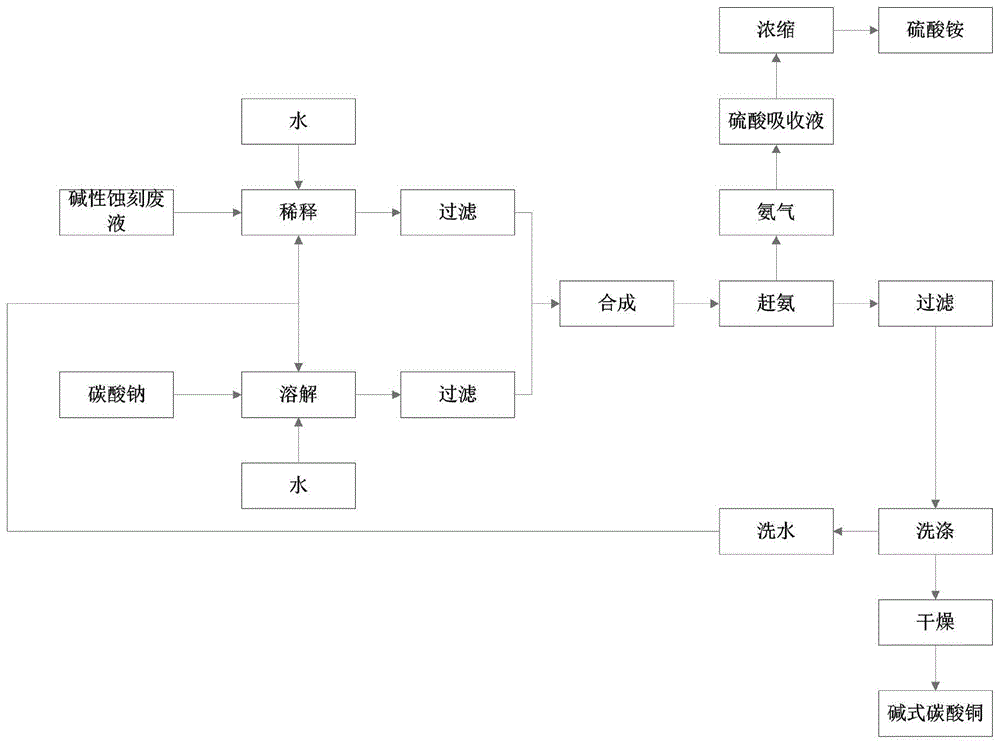
:印制线路板碱性蚀刻废液是印制线路板(pcb)生产过程中产生的一种碱性废水,其含有高达100~160g/l的铜,160~200g/l的氯离子,140~200g/l的氨氮。随着电子信息产业的快速发展,pcb行业也随之迅速发展。在印制线路板的生产过程中,蚀刻废液的处理和生产废水的治理是印制线路板生产企业遇到的两大环保问题。一般企业的蚀刻废液是外卖给定点处理企业,据统计,平均每生产1m2的印刷线路板会产生大约2.5l的蚀刻废液,不能回收利用蚀刻废液会增加企业的运营成本。目前,碱性蚀刻废液主要有在线方式、进线方式和线外方式等。在线方式主要是采用溶剂萃取法,与蚀刻产线工艺结合为一体,溶剂萃取后得到的低浓度含铜溶液经组分调节后直接返回主工艺,反萃液一般选择电积法回收金属铜。进线方式一般采用铝粉置换法和高压氢还原法,该方式未见工业应用报道。线外方式主要是加碱回收氧化铜、与酸性蚀刻废液中和回收碱式氯化铜和硫酸铜。碱性蚀刻废液中含有高浓度的氨氮,废液经过传统方法回收利用铜后,尾液中的氨氮浓度依然很高,因此尾液中的氨氮必须进行回收处理。蚀刻工艺是目前制造印刷电路板过程中必不可少的重要步骤,在印刷电路板生产过程中,通常用酸性或碱性蚀刻工艺生产电路板,因此,每年要产生大量的这种酸性或碱性蚀刻液。其中,酸性蚀刻液有盐酸、盐酸+氨酸钠、盐酸+双氧水等工艺,酸性蚀刻液的主要成分为cucl2、hc1、nh4c1或nacl等,在蚀刻过程中,cu2+与cu作用生成cu+,随着蚀刻反应的进行,cu+数量越来越多,cu2+减少,蚀刻液蚀刻能力很快下降,为保持稳定蚀刻能力,需加入氧化剂或鼓空气使cu+尽快转化为cu2+;同时当蚀刻缸内cu2+浓度达到一定数值时或者蚀刻缸的溶液超过一定体积时,需要及时排除部分蚀刻液以保证蚀刻工序的正常运转,该排出蚀刻液称之为蚀刻废液,此类废液如果不经妥善处理会造成极大的环境污染和资源的浪费。技术实现要素:本发明针对现有技术的不足,公开了一种济效益好,对环境零污染,实现资源的再利用的回收利用碱性刻蚀废液的方法,本发明的具体内容如下:本发明的目的在于提供一种回收利用碱性刻蚀废液的方法,其技术点在于,包括以下步骤:s1.首先将碱性蚀刻废液稀释到含有铜离子的物质的量浓度为0.4~0.6mol/l,配制物质的量浓度为0.4~0.6mol/l的碳酸钠溶液,然后先在容器中加入碳酸钠溶液,再加入稀释后的碱性蚀刻废液进行反应得到混合溶液,所述的反应的方程式如下:2cu(nh3)4cl2+na2co3+8h2o=cu2(oh)2co3+6nh3·h2o+2nh4cl+2naclcu2(oh)2co3+8nh3+h2o=2[cu(nh3)4](oh)2+co2↑;s2.设置所述的步骤s1中的容器的压力,然后边搅拌边往所述的容器中加入含有氢氧化钠的重量分数为30~35wt%氢氧化钠溶液调节所述混合溶液ph,加热负压抽出气体经过硫酸溶液吸收步骤s1中nh3,然后将容器中的混合溶液进行蒸馏至溶液开始有结晶析出,加入碱式碳酸铜晶种,继续蒸馏至碱式碳酸铜析出完全,停止加热,得到所述的碱式碳酸铜粗品,具体反应式如下:nh3·h2o=nh3↑+h202nh3+h2so4=(nh4)2so4;s3.将步骤s3制备得到的碱式碳酸铜粗品用热水冲洗,将冲洗后的碱式碳酸铜粗品干燥后得到所述的碱式碳酸铜;s4.当步骤s2中吸收nh3的硫酸溶液的ph>5时,集中浓缩得到硫酸铵固体。在本发明的有的实施例中,所述的步骤s1中碱性蚀刻废液和碳酸钠溶液的体积之比为1:1.2~1.4。在本发明的有的实施例中,所述的步骤s1中反应的时间为30~40min,所述反应的温度为20~30℃,所述反应的环境为ph为7~10。在本发明的有的实施例中,所述的步骤s2中调节的ph为9~11,所述的容器中的压力为-0.06~0mpa,所述加热的温度为75~85℃,所述硫酸溶液中含有硫酸的重量分数为18~22wt%。在本发明的有的实施例中,所述的步骤s2中加入的碱式碳酸铜晶种的重量为所述的溶液重量的1~3wt‰。在本发明的有的实施例中,所述的步骤s3中所述的碱式碳酸铜粗品和热水的重量之比为1:8~12,所述的热水的温度为60~65℃,所述的碱式碳酸铜的干燥温度为80~90℃。与现有技术相比,本发明的有益效果在于:本发明的一种回收利用碱性刻蚀废液的方法能利用碱性蚀刻废液生产碱式碳酸铜,同时对氨氮进行回收处理,具有良好的经济和环境效益。与传统的生产方法相比,环境友好,生产成本较低,生产出的碱式碳酸铜杂质指标可以满足各类工业生产需求。附图说明为了更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体实施方式或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施方式,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。图1为本发明的工艺流程图。具体实施方式碱性蚀刻液的主要成分是氯化铜、氨水、及氯化铵等物质,碱性蚀刻废液有高达100~160g/l的铜,160~200g/l的氯离子,140~200g/l的氨氮。在蚀刻阶段,印刷线路板上的铜箔被蚀刻液中的铜氨络合物氧化形成亚铜配合物,多余的铜箔会被不断腐蚀掉,其反应如下:cu+cu(nh3)4cl2=2cu(nh3)2cl。蚀刻铜箔后生成的cu(nh3)2cl,其中2cu(nh3)2+没有任何蚀刻能力,不过在过高的nh3·h2o和cl-浓度条件下,可以很快被空气氧化又一次产生具有蚀刻能力的cu(nh3)4cl2。反应方程式如下:总方程式入下,可以看出铜基本上是以cu(nh3)4cl2的形式存在于碱性蚀刻废液中。取某工厂产生的碱性蚀刻废液,废液检测结果如表1表1铜离子浓度氯离子浓度氨氮浓度138g/l190g/l156g/l下面将对本发明实施例中的技术方案进行清楚、完整地描述,以使本领域的技术人员能够更好的理解本发明的优点和特征,从而对本发明的保护范围做出更为清楚的界定。本发明所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例,基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动的前提下所获得的所有其他实施例,都属于本发明保护的范围。实施例1请参照附图1,一种回收利用碱性刻蚀废液的方法,包括以下步骤:s1.首先将碱性蚀刻废液稀释到含有铜离子的物质的量浓度为0.6mol/l,配制物质的量浓度为0.6mol/l的碳酸钠溶液,然后先在容器中加入碳酸钠溶液,再加入稀释后的碱性蚀刻废液进行反应得到混合溶液,所述的反应的方程式如下:2cu(nh3)4cl2+na2co3+8h2o=cu2(oh)2co3+6nh3·h2o+2nh4cl+2naclcu2(oh)2co3+8nh3+h2o=2[cu(nh3)4](oh)2+co2↑;s2.设置所述的步骤s1中的容器的压力,然后边搅拌边往所述的容器中加入含有氢氧化钠的重量分数为35wt%氢氧化钠溶液调节所述混合溶液ph,加热负压抽出气体经过硫酸溶液吸收步骤s1中nh3,然后将容器中的混合溶液进行蒸馏至溶液开始有结晶析出,加入碱式碳酸铜晶种,继续蒸馏至碱式碳酸铜析出完全,停止加热,得到所述的碱式碳酸铜粗品,具体反应式如下:nh3·h2o=nh3↑+h202nh3+h2so4=(nh4)2so4;s3.将步骤s3制备得到的碱式碳酸铜粗品用热水冲洗,将冲洗后的碱式碳酸铜粗品干燥后得到所述的碱式碳酸铜;s4.当步骤s2中吸收nh3的硫酸溶液的ph>5时,集中浓缩得到硫酸铵固体。其中,步骤s1中碱性蚀刻废液和碳酸钠溶液的体积之比为1:1.4。其中,步骤s1中反应的时间为40min,所述反应的温度为30℃,所述反应的环境为ph为10。其中,步骤s2中调节的ph为11,所述的容器中的压力为0mpa,所述加热的温度为85℃,所述硫酸溶液中含有硫酸的重量分数为22wt%。其中,步骤s2中加入的碱式碳酸铜晶种的重量为所述的溶液重量的3wt‰。其中,步骤s3中所述的碱式碳酸铜粗品和热水的重量之比为1:12,所述的热水的温度为65℃,所述的碱式碳酸铜的干燥温度为90℃。实施例2请参照附图1,一种回收利用碱性刻蚀废液的方法,包括以下步骤:s1.首先将碱性蚀刻废液稀释到含有铜离子的物质的量浓度为0.5mol/l,配制物质的量浓度为0.5mol/l的碳酸钠溶液,然后先在容器中加入碳酸钠溶液,再加入稀释后的碱性蚀刻废液进行反应得到混合溶液,所述的反应的方程式如下:2cu(nh3)4cl2+na2co3+8h2o=cu2(oh)2co3+6nh3·h2o+2nh4cl+2naclcu2(oh)2co3+8nh3+h2o=2[cu(nh3)4](oh)2+co2↑;s2.设置所述的步骤s1中的容器的压力,然后边搅拌边往所述的容器中加入含有氢氧化钠的重量分数为32wt%氢氧化钠溶液调节所述混合溶液ph,加热负压抽出气体经过硫酸溶液吸收步骤s1中nh3,然后将容器中的混合溶液进行蒸馏至溶液开始有结晶析出,加入碱式碳酸铜晶种,继续蒸馏至碱式碳酸铜析出完全,停止加热,得到所述的碱式碳酸铜粗品,具体反应式如下:nh3·h2o=nh3↑+h202nh3+h2so4=(nh4)2so4;s3.将步骤s3制备得到的碱式碳酸铜粗品用热水冲洗,将冲洗后的碱式碳酸铜粗品干燥后得到所述的碱式碳酸铜;s4.当步骤s2中吸收nh3的硫酸溶液的ph>5时,集中浓缩得到硫酸铵固体。其中,步骤s1中碱性蚀刻废液和碳酸钠溶液的体积之比为1:1.3。其中,步骤s1中反应的时间为35min,所述反应的温度为25℃,所述反应的环境为ph为8。其中,步骤s2中调节的ph为10,所述的容器中的压力为-0.03mpa,所述加热的温度为80℃,所述硫酸溶液中含有硫酸的重量分数为20wt%。其中,步骤s2中加入的碱式碳酸铜晶种的重量为所述的溶液重量的2wt‰。其中,步骤s3中所述的碱式碳酸铜粗品和热水的重量之比为1:10,所述的热水的温度为63℃,所述的碱式碳酸铜的干燥温度为85℃。实施例3请参照附图1,一种回收利用碱性刻蚀废液的方法,包括以下步骤:s1.首先将碱性蚀刻废液稀释到含有铜离子的物质的量浓度为0.4mol/l,配制物质的量浓度为0.4mol/l的碳酸钠溶液,然后先在容器中加入碳酸钠溶液,再加入稀释后的碱性蚀刻废液进行反应得到混合溶液,所述的反应的方程式如下:2cu(nh3)4cl2+na2co3+8h2o=cu2(oh)2co3+6nh3·h2o+2nh4cl+2naclcu2(oh)2co3+8nh3+h2o=2[cu(nh3)4](oh)2+co2↑;s2.设置所述的步骤s1中的容器的压力,然后边搅拌边往所述的容器中加入含有氢氧化钠的重量分数为30wt%氢氧化钠溶液调节所述混合溶液ph,加热负压抽出气体经过硫酸溶液吸收步骤s1中nh3,然后将容器中的混合溶液进行蒸馏至溶液开始有结晶析出,加入碱式碳酸铜晶种,继续蒸馏至碱式碳酸铜析出完全,停止加热,得到所述的碱式碳酸铜粗品,具体反应式如下:nh3·h2o=nh3↑+h202nh3+h2so4=(nh4)2so4;s3.将步骤s3制备得到的碱式碳酸铜粗品用热水冲洗,将冲洗后的碱式碳酸铜粗品干燥后得到所述的碱式碳酸铜;s4.当步骤s2中吸收nh3的硫酸溶液的ph>5时,集中浓缩得到硫酸铵固体。其中,步骤s1中碱性蚀刻废液和碳酸钠溶液的体积之比为1:1.2。其中,步骤s1中反应的时间为30min,所述反应的温度为20℃,所述反应的环境为ph为7。其中,步骤s2中调节的ph为9~11,所述的容器中的压力为-0.06mpa,所述加热的温度为75℃,所述硫酸溶液中含有硫酸的重量分数为18wt%。其中,步骤s2中加入的碱式碳酸铜晶种的重量为所述的溶液重量的1wt‰。其中,步骤s3中所述的碱式碳酸铜粗品和热水的重量之比为1:8,所述的热水的温度为60℃,所述的碱式碳酸铜的干燥温度为80℃。试验例取实施例1~3制备得到的碱式碳酸铜,检测其物化参数,具体结果如表2:表2实施例碱式碳酸铜酸不溶物氯化物铁钠其它金属(pb、sb等)199.1%0.002%0.001%0.001%0.008%未检出299.5%0.001%0.002%0.002%0.005%未检出399.4%0.0006%0.006%0.0008%0.006%未检出从表2可以看出,本发明制备得到的碱式碳酸铜的品质高,具有良好的经济效益,生产出的碱式碳酸铜杂质指标可以满足各类工业生产需求。最后应当说明的是,以上实施例仅用以说明本发明的技术方案,而非对本发明保护范围的限制,尽管参照较佳实施例对本发明作了详细地说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的实质和范围。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1