干细胞样肺癌细胞制备及其抗原组合物负载树突状细胞的方法与试剂盒与流程
本发明涉及制备干细胞样肿瘤细胞、其抗原组合物、负载该抗原树突状细胞的方法、使用所述方法的试剂盒、以及通过所述方法获得的树突细胞和疫苗特别地,本发明涉及制备干细胞样肺癌细胞及其抗原组合物负载该抗原树突状细胞的方法、使用所述方法的试剂盒、以及通过所述方法获得的树突细胞疫苗。
背景技术:
目前,现有技术已经在肺癌瘤中鉴定并分离到了具有干细胞/祖细胞特性的致瘤肺癌细胞。例如,“Sidepopulationinhumanlungcancercelllinesandtumorsisenrichedwithstem-likecancercells(人肺癌细胞系和肿瘤中亚群中富含干细胞样肿瘤细胞)”,MariaM.Ho等人,CancerResearch(癌症研究),第67卷第10期,第4827-4833页,2007年5月15日中公开了,其发现乳腺癌耐药蛋白ATP结合转运蛋白G超家族成员2(ABCG2)的细胞,专门保持致癌的活性并且显示出了干细胞样特性。即现有技术可以通过检测癌瘤处分离的疑似干细胞样肺癌细胞的ABCG2或Prominin1,来鉴定干细胞样肺癌细胞。但是在正常细胞中也有同样的ABCG2和Prominin1的性质,因此现有技术的方法无法将癌瘤处分离的干细胞样肺癌细胞和正常细胞高效准确的区分开,因而无法迅速有效地富集并体外繁殖干细胞样肺癌细胞。例如,在干细胞样肺癌细胞中特异性表达的蛋白激酶Ciota,在肺癌细胞中没有表达,但是在正常的肺泡巨噬细胞中也有表达。综上如何高效准确地得到干细胞样肺癌细胞,并且能否利用所得的干细胞样肺癌细胞来制备对抗供体中肺癌的疫苗,仍然是亟待解决的问题。
技术实现要素:
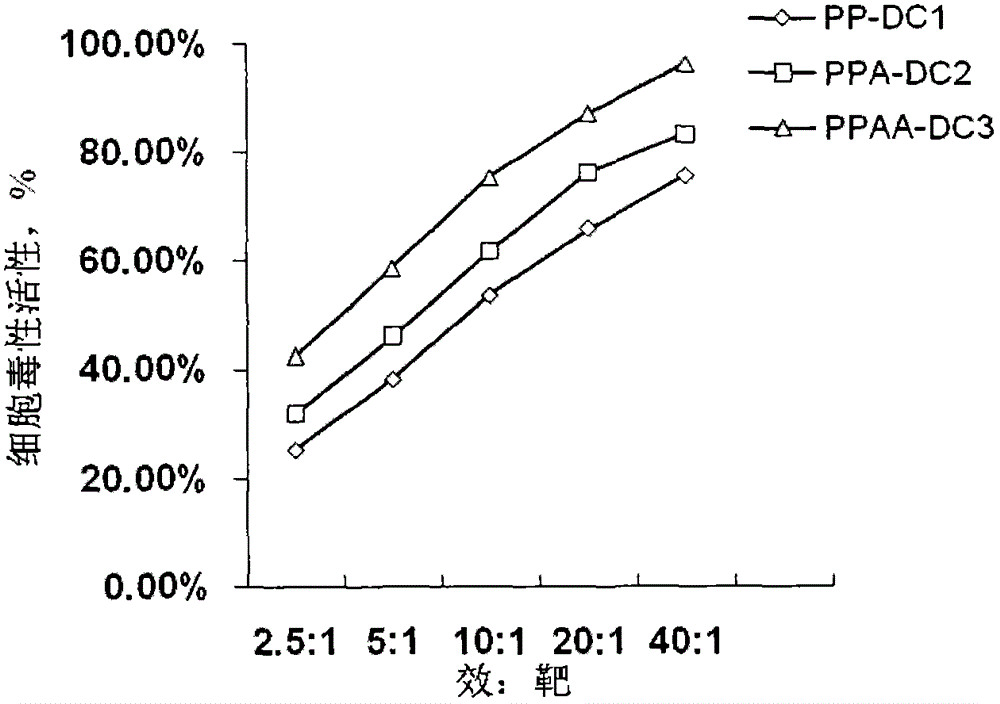
为了克服现有技术很难在短时间内高效准确得到纯度高且富集容易的干细胞样肺癌细胞的问题,本发明的目的是提供一种制备干细胞样肺癌细胞的方法,该方法可以在短时间内高效准确得到纯度高且富集容易的干细胞样肺癌细胞。本发明提供一种干细胞样肺癌细胞抗原组合物及其负载该抗原树突状细胞的方法,以及提供使用本发明所述方法的试剂盒,通过本发明所述方法获得的树突细胞疫苗。本发明提供了一种制备干细胞样肺癌细胞的方法,其中,所述方法包括鉴定待测肺癌细胞标本中是否存在干细胞样肺癌细胞的步骤:所述步骤包括检测所述待测肺癌细胞标本中是否特异表达以下差异蛋白的至少两种:蛋白激酶Ciota、五次跨膜单链糖蛋白Prominin1、乙醛脱氢酶1或乳腺癌耐药蛋白ATP结合转运蛋白G超家族成员2。本发明还提供了一种上述干细胞样肺癌细胞抗原组合物的制备方法,其中,该方法包括以下步骤:1)按照本发明所述的方法制备干细胞样肺癌细胞,2)用生理盐水洗涤并重悬所述干细胞样肺癌细胞,3)裂解所述干细胞样肺癌细胞。本发明还提供了一种干细胞样肺癌细胞抗原负载的树突状细胞的制备方法,其中,该方法包括:通过裂解干细胞样肺癌细胞得到干细胞样肺癌细胞抗原组合物,将正常树突状细胞与干细胞样肺癌细胞抗原组合物接触得到负载肿瘤抗原的抗肺癌树突状细胞,其中,所述方法包括使用本发明所述的方法制备干细胞样肺癌细胞,或者使用本发明的方法制备干细胞样肺癌细胞抗原组合物。本发明还提供了一种树突状细胞疫苗,所述树突状细胞疫苗包括树突状细胞,其中,所述树突状细胞为本发明所述的干细胞样肺癌细胞抗原负载的树突状细胞。本发明还提供了一种制备干细胞样肺癌细胞抗原负载的树突状细胞疫苗的试剂盒,其中,所述试剂盒包括:1)干细胞样肺癌细胞基础培养基;2)蛋白激酶Ciota、五次跨膜单链糖蛋白Prominin1、乙醛脱氢酶1或乳腺癌耐药蛋白ATP结合转运蛋白G超家族成员2的至少两种;3)消化细胞的酶;4)B27或N2、表皮细胞生长因子、碱性成纤维细胞生长因子和胰岛素;5)树突状细胞基础培养基;6)巨粒细胞-噬细胞集落刺激因子;7)白介素-4、干扰素α和肿瘤坏死因子α;以及6)使用说明书;其中,所述使用说明书包括本发明所述制备干细胞样肺癌细胞抗原负载的树突状细胞的方法。通过本发明的方法,仅仅通过检测蛋白激酶Ciota、五次跨膜单链糖蛋白Prominin1、乙醛脱氢酶1或乳腺癌耐药蛋白ATP结合转运蛋白G超家族成员2的至少两种,就能够高效准确地得到干细胞样肺癌细胞,基于所述方法所得干细胞样肺癌细胞纯度高且富集容易。由本发明提供的方法得到的干细胞样肺癌细胞以及由该干细胞样肺癌细胞得到的抗原组合物、负载该抗原的树突状细胞制备的药物,能够在体内和体外引发免疫应答来杀死引起肺癌复发的干细胞样肺癌细胞,从而为克服肺癌耐受性、根治肺癌的复发和转移提供了可能。附图说明图1表示由实施例1或/和2制备PKCiota、PROM1、ALDH1和ABCG2四阳性的干细胞样肺癌细胞抗原组合物负载树突状细胞表型图。图2表示由实施例1或/和2所得表特异达两种差异蛋白以上的干细胞样肺癌细胞抗原组合物负载树突状细胞产生的对PKCiota和PROM1双阳性干细胞样肺癌细胞的应答结果图。图3表示由实施例1或/和2所得PKCiota和PROM1双阳性的干细胞样肺癌细胞抗原组合物负载树突状细胞与由制备例1、4和对比例1所得三种抗原组合物分别负载树突状细胞,引发对PKCiota和PROM1双阳性干细胞样肺癌细胞产生的应答结果对比图。图4表示由实施例1或/和2所得PKCiota和PROM1双阳性的干细胞样肺癌细胞抗原组合物负载树突状细胞,以及由制备例1、4和对比例1所得三种抗原组合物分别负载树突状细胞引发对对比例1获得的干细胞样肺癌细胞产生的应答结果对比图。具体实施方式本发明提供了一种制备干细胞样肺癌细胞的方法,其中,所述方法包括鉴定待测肺癌细胞标本中是否存在干细胞样肺癌细胞的步骤:所述步骤包括检测所述待测肺癌细胞标本中是否特异表达以下差异蛋白的至少两种:蛋白激酶Ciota(ProteinkinaseCiota,PKCiota)、五次跨膜单链糖蛋白Prominin1(PROM1)、乙醛脱氢酶1(aldehydedehydrogenase1,ALDH1)或ABCG2。其中,蛋白激酶Ciota是是肺癌干细胞增殖的必需基因,在对放化疗产生抵抗、转化生长和侵润方面扮演的中心作用。优选地,所述特异表达差异蛋白是指使用蛋白免疫印迹技术检测所述肺癌细胞标本中的所述四种差异蛋白至少两种(含蛋白激酶Ciota在内)的结果为阳性;其中,以已知纯肺癌细胞为阴性对照,用蛋白免疫印迹技术检测100份所述阴性对照,每份含5×106个细胞,测得每种差异蛋白的灰度与标准内参β肌动蛋白的灰度比值,将所测该种差异蛋白灰度比值的平均值与标准方差之和定义为分界值;取100份待测肺癌细胞标本,每份标本含5×106个细胞,测得与阴性对照所测同种差异蛋白灰度比值的平均值,该灰度比值的平均值大于等于所述分界值,即该待测肺癌细胞标本的该种差异蛋白的蛋白免疫印迹技术检测结果为阳性。进一步优选地,所述特异表达差异蛋白是指使用蛋白免疫印迹技术检测所述肺癌细胞标本中的所述四种差异蛋白的结果均为阳性。优选地,当鉴定所述待测肺癌细胞标本中存在干细胞样肺癌细胞时,该方法还包括:使用免疫磁珠法和/或流式细胞仪分选法富集所述待测细胞中的干细胞样肺癌细胞的步骤;其中,利用针对得到蛋白激酶Ciota(ProteinkinaseCiota,PKCiota)、五次跨膜单链糖蛋白Prominin1(PROM1)、乙醛脱氢酶1(aldehydedehydrogenase1,ALDH1)或ABCG2的至少两种的抗体。所述方法还可以包括从离体肺癌肿瘤组织和/或肺癌细胞系中分离干细胞样肺癌细胞。手术从患者体内取出的肺癌肿瘤组织,属于废弃的离体肺癌肿瘤组织。本发明可以适用常规的方法得到肺癌细胞。此外,由现有商业上能够买到的细胞系培养物也能从中分离出相应的干细胞样肺癌细胞。例如,A549人非小细胞肺癌细胞就是可以从美国典型物保藏中心(ATCC)买到、并且能够从中分离出相应的干细胞样肺癌细胞的细胞株系。本发明还提供了一种上述干细胞样肺癌细胞抗原组合物的制备方法,其中,该方法包括以下步骤:1)按照本发明所述的方法制备干细胞样肺癌细胞,2)用生理盐水洗涤并重悬所述干细胞样肺癌细胞,3)裂解所述干细胞样肺癌细胞。其中,所述生理盐水的洗涤次数可以通过测定洗出液中残留的培养基组分来决定。将本发明的方法制得的干细胞样肺癌细胞抗原组合物在注射给患者时残留的培养基组分以及可能残留的化疗药物不会引起患者不适即可。裂解本发明的干细胞样肺癌细胞可以使用本领域常规的各种裂解方法实现。出于不在裂解干细胞样肺癌细胞后增加新的物质的考虑,优选所述裂解干细胞样肺癌细胞的步骤包括热休克和/或反复冻融;所述热休克裂解的条件包括在37~45℃下保持1h-6h,优选包括在38~43℃下保持2h-4h;所述反复冻融的次数为3-5次,每两次的间隔时间是10min-2h,优选为30min-1h,所述冷冻的温度范围是零下120℃-零下196℃(可以使用液氮、干冰等来实现),优选零下150℃-零下196℃,所述融化的温度范围是10℃-37℃,优选为20℃-37℃。由于经热休克后,本发明的干细胞样肺癌细胞会产生热休克蛋白,裂解后仍然存在所述热休克蛋白。热休克蛋白的存在有助于负载后的树突状细胞免疫应答。因此,更优选所述裂解干细胞样肺癌细胞的步骤包括热休克和反复冻融;所述热休克裂解的条件包括在37-45℃下保持1h-6h;所述反复冻融的次数为3-5次两次的间隔时间是10min-2h,所述冷冻的温度范围是零下120℃-零下196℃,所述融化的温度范围是20℃-37℃。裂解完成后,通常通过离心和过滤的步骤除去裂解液中过大的细胞碎片,例如,通过600rpm离心1min除去,然后上清用0.45μm滤膜过滤。所述组合物的基本成分包括生理盐水。裂解得到的本发明的抗原组合物可以在-80℃中保存。优选地,所述步骤1)中制备所得的干细胞样肺癌细胞的浓度为1×105到1×108细胞/mL。其中,所述干细胞样肺癌细胞基础培养基可以是本领域任何能够用于培养干细胞样肺癌细胞的培养基,例如DMEM/F12等。所述干细胞样肺癌细胞培养体系包括干细胞样肺癌细胞和3mL-50mL的干细胞样肺癌细胞基础培养基,在37℃、5%CO2培养箱中培养。所述消化细胞的酶可以为本领域常规的消化细胞的酶,优选为胰酶和/或阿尤替斯酶。其中,在干细胞样肺癌细胞基础培养基达3mL-50mL的时,所述胰酶和/或阿尤替斯酶(Accutase)优选作为肿瘤组织分离干细胞样肺癌细胞所使用试剂,可以使用本领域常规的用量,例如一般用量为1倍浓度的0.5mL-10mL来消化细胞,即基础培养基体积的1/6到1/5。所述细胞因子为B27或N2、表皮细胞生长因子、碱性成纤维细胞生长因子和胰岛素。其中,所述B27在培养干细胞样肺癌细胞时,向干细胞样肺癌细胞基础培养基(例如DMEM/F12)中添加,达终浓度为2ng/mL-50ng/mL。所述N2在培养干细胞样肺癌细胞时,向干细胞样肺癌细胞基础培养基(例如DMEM/F12)中添加,达终浓度为2ng/mL-50ng/mL。其中所述B27和N2是商业上可供的细胞培养添加剂(即细胞因子),例如,美国biotech公司、美国Gibco公司生产的B27和N2。所述表皮细胞生长因子在培养干细胞样肺癌细胞时,向干细胞样肺癌细胞基础培养基(例如DMEM/F12)中添加,达终浓度为5ng/mL-100ng/mL。所述碱性成纤维细胞生长因子在培养干细胞样肺癌细胞时,向干细胞样肺癌细胞基础培养基(例如DMEM/F12)中添加,达终浓度为5ng/mL-100ng/mL。所述胰岛素在培养干细胞样肺癌细胞时,向干细胞样肺癌细胞基础培养基(例如DMEM/F12)中添加,达终浓度为1mg/mL-50mg/mL。所述试剂盒还可以包括非必要的动物血清。所述动物血清可以是人血清和/或牛血清。所述血清可以作为消化酶的终止剂,其用量为现有技术中作为消化酶终止剂的常规用量,例如,与消化细胞的酶液相当0.1mL-10mL,即动物血清与消化细胞的酶液的体积比为1∶1至1∶5。本发明还提供了一种干细胞样肺癌细胞抗原负载的树突状细胞的制备方法,其中,该方法包括:通过裂解干细胞样肺癌细胞得到干细胞样肺癌细胞抗原组合物,将正常树突状细胞与干细胞样肺癌细胞抗原组合物接触得到负载肿瘤抗原的抗肺癌树突状细胞,其中,所述方法包括使用本发明所述的方法制备干细胞样肺癌细胞,或者使用本发明的方法制备干细胞样肺癌细胞抗原组合物。优选所述正常树突状细胞与制备干细胞样肺癌细胞抗原组合物的干细胞样肺癌细胞来自同一个体。这样可以最大限度地避免由于免疫排斥反应而引起的副作用。当然,如果所述正常树突状细胞与制备干细胞样肺癌细胞抗原组合物的干细胞样肺癌细胞并非来自同一个体,仍然可以使用本领域常用的抗免疫排斥反应的药物来减小副作用。所述抗免疫排斥反应的药物例如地塞米松等。本发明还提供了一种树突状细胞疫苗,所述树突状细胞疫苗包括树突状细胞,可来源于外周血、骨髓和脐带血等,其中,所述树突状细胞为本发明所述的干细胞样肺癌细胞抗原负载的树突状细胞。在制备树突状细胞疫苗之前,用生理盐水洗涤并重悬所述干细胞样肺癌细胞抗原负载的树突状细胞。所述生理盐水的洗涤次数可以通过测定洗出液中残留的培养基组分来决定。将本发明的树突状细胞疫苗在注射给患者时残留的培养基组分以及可能残留的化疗药物不会引起患者不适即可。所述疫苗优选包括1×105到5×107个/mL本发明的干细胞样肺癌细胞抗原负载的树突状细胞;更优选为5×105到1×107个/mL。所述疫苗还包括人血白蛋白;其中,以所述疫苗为基准,所述人血白蛋白的含量优选为1-5重量体积%,更优选为2-3重量体积%。本发明还提供了一种制备干细胞样肺癌细胞抗原负载的树突状细胞疫苗的试剂盒,其中,所述试剂盒包括:1)干细胞样肺癌细胞基础培养基;2)蛋白激酶Ciota(ProteinkinaseCiota,PKCiota)、五次跨膜单链糖蛋白Prominin1(PROM1)、乙醛脱氢酶1(aldehydedehydrogenase1,ALDH1)或ABCG2的至少两种;优选包括所述四种蛋白。3)消化细胞的酶;4)B27或N2、表皮细胞生长因子、碱性成纤维细胞生长因子和胰岛素;5)树突状细胞基础培养基;6)巨粒细胞-噬细胞集落刺激因子;7)白介素-4、干扰素α和肿瘤坏死因子α;以及6)使用说明书;其中,所述使用说明书包括本发明所述的干细胞样肺癌细胞抗原负载的树突状细胞的制备方法。优选地,所述试剂盒还包括针对所述蛋白激酶Ciota(ProteinkinaseCiota,PKCiota)、五次跨膜单链糖蛋白Prominin1(PROM1)、乙醛脱氢酶1(aldehydedehydrogenase1,ALDH1)或ABCG2的至少两种的抗体。利用所述抗体,使用免疫磁珠法和/或流式细胞仪可以分选法富集所述待测细胞中的干细胞样肺癌细胞。其中,所述干细胞样肺癌细胞基础培养基可以是本领域任何能够用于培养干细胞样肺癌细胞的培养基,例如DMEM/F12等。所述干细胞样肺癌细胞培养体系包括干细胞样肺癌细胞和3mL-50mL的干细胞样肺癌细胞基础培养基,在37℃、5%CO2培养箱中培养。所述消化细胞的酶可以为本领域常规的消化细胞的酶,优选为胰酶和/或阿尤替斯酶。其中,在干细胞样肺癌细胞基础培养基达3mL-50mL的时,所述胰酶和/或阿尤替斯酶(Accutase)优选作为肿瘤组织分离干细胞样肺癌细胞所使用试剂,可以使用本领域常规的用量,例如一般用量为1倍浓度的0.5mL-10mL来消化细胞,即基础培养基体积的1/6到1/5。其中,所述B27在培养干细胞样肺癌细胞时,向干细胞样肺癌细胞基础培养基(例如DMEM/F12)中添加,达终浓度为2ng/mL-50ng/mL。所述N2在培养干细胞样肺癌细胞时,向干细胞样肺癌细胞基础培养基(例如DMEM/F12)中添加,达终浓度为2ng/mL-50ng/mL。所述表皮细胞生长因子在培养干细胞样肺癌细胞时,向干细胞样肺癌细胞基础培养基(例如DMEM/F12)中添加,达终浓度为5ng/mL-100ng/mL。所述碱性成纤维细胞生长因子在培养干细胞样肺癌细胞时,向干细胞样肺癌细胞基础培养基(例如DMEM/F12)中添加,达终浓度为5ng/mL-100ng/mL。所述胰岛素在培养干细胞样肺癌细胞时,向干细胞样肺癌细胞基础培养基(例如DMEM/F12)中添加,达终浓度为1mg/mL-50mg/mL。所述试剂盒还可以包括非必要的动物血清。所述动物血清可以是人血清和/或牛血清。所述血清可以作为消化酶的终止剂,其用量为现有技术中作为消化酶终止剂的常规用量,例如,与消化细胞的酶液相当0.1mL-10mL。由本发明制备干细胞样肺癌细胞抗原组合物的方法所得到的干细胞样肺癌细胞抗原组合物来自细胞浓度优选为1×105到1×108细胞/mL,更优选为1×106到5×107细胞/mL的由本发明制备干细胞样肺癌细胞的方法所得到的干细胞样肺癌细胞。所述细胞浓度过大造成浪费,反之细胞浓度过小,则不足以使树突状细胞负载上足够的抗原。所述树突状细胞基础培养基可以是本领域任何能够用于培养树突状细胞的培养基,例如RPMI/1640等。所述树突状细胞培养体系包括干细胞样肺癌细胞和1mL-100mL、优选30-80mL的树突状细胞基础培养基,在37℃、5%CO2培养箱中培养。其中,所述巨粒细胞-噬细胞集落刺激因子(GM-CSF)在干细胞样肺癌细胞抗原负载树突状细胞时添加到树突状细胞基础培养基中,终浓度100IU/mL-2500IU/mL。所述白介素-4在干细胞样肺癌细胞抗原负载树突状细胞时添加到树突状细胞基础培养基中,终浓度100IU/mL-1500IU/mL。所述干扰素α在干细胞样肺癌细胞抗原负载树突状细胞时添加到树突状细胞基础培养基中,终浓度100IU/mL-2000IU/mL。所述肿瘤坏死因子α在干细胞样肺癌细胞抗原负载树突状细胞时添加到树突状细胞基础培养基中,终浓度0.5ng/mL-100ng/mL。本发明还提供了一种治疗癌症的方法,其包括给患者施用选自由本发明方法制备的干细胞样肺癌细胞抗原组合物、本发明的树突状细胞疫苗所组成的组中的药物。优选所述施用的方式为注射。具体地,施用干细胞样肺癌细胞抗原组合物的方式选自由肿瘤组织内注射、静脉注射、皮下注射和皮内注射中的一种或几种;施用所述树突状细胞疫苗的方式为在淋巴结部位皮下或皮内注射。优选施用所述树突状细胞疫苗的方式为在腹部沟或腋下进行皮下或皮内注射。所述干细胞样肺癌细胞抗原组合物优选来自细胞浓度为1×105到1×108细胞/mL的本发明的干细胞样肺癌细胞,其有效量为0.1mL-5mL/个体;所述树突状细胞疫苗优选包括1×105到5×107个/mL本发明的抗癌树突状细胞,其有效量为0.1mL-2mL/个体。更优选所述干细胞样肺癌细胞抗原组合物优选来自细胞浓度为1×105到1×108细胞/mL的本发明的干细胞样肺癌细胞,其有效量为0.2mL-2mL/个体;所述树突状细胞疫苗优选包括1×105到5×107个/mL本发明的抗癌树突状细胞,其有效量为0.5mL-2mL/个体。以上所述干细胞样肺癌细胞抗原组合物和所述树突状细胞疫苗都是一次注射的剂量,一个疗程四次注射,间隔一周。干细胞样肺癌细胞抗原组合物和所述树突状细胞疫苗一般在注射完第一针后的第三天到第七天起效。所述有效的标准是:起免疫促进的细胞因子如白介素2、白介素12、干扰素γ和肿瘤坏死因子α等的升高;起免疫抑制的细胞因子如白介素6、白介素10、转化生长因子β和表皮细胞生长因子等的降低;以及T淋巴细胞亚群变化,即:CD3、CD4和CD8的阳性率的升高或改善,CD16/56阳性率的升高,以及CD4CD25FoxP3三阳性率的降低。一个疗程结束后,可以间隔三个月后继续给药,可以治疗两个或四个疗程;如有必要,间隔时间为六个月或1年还可继续再治疗,只要患者一直存活在。其中,所述有效标准还可以分为以下三个等级:1.患者血液细胞因子检测:起免疫促进的细胞因子如白介素2、白介素12、干扰素γ和肿瘤坏死因子α等的升高;起免疫抑制的细胞因子如白介素6、白介素10、转化生长因子β和表皮细胞生长因子等的降低;以及T淋巴细胞亚群变化,即:CD3、CD4和CD8的阳性率的升高或改善,CD16/56阳性率的升高,以及CD4CD25FoxP3三阳性率的降低等。2.患者肺癌瘤标志物检测,如甲胎蛋白、癌胚抗原、糖蛋白等肺癌特异抗原的表达的降低,主要是通过酶免和化学发光检测等。3、影像学检测,如CT、核磁共振和B超检测,能检测到治疗前后肺癌瘤细胞缩小。优选所述干细胞样肺癌细胞和/或所述树突状细胞来自于同一患者,这样可以最大限度地避免免疫排斥反应造成的副作用。本发明提及的手术从患者体内取出的肺癌瘤组织,属于废弃的离体肺癌瘤组织,并非为实现本发明而特意从患者体内取出的肺癌瘤组织。此外,本发明提及的细胞可以是商业上可供的细胞系。并且现有长期冷冻保藏细胞的技术已经非常成熟,比如在液氮(零下196℃)下冻存细胞,例如脐带血细胞保藏。本领域技术人员完全可以利用上述技术保藏本发明涉及的肺癌瘤组织、肿瘤细胞系和树突状细胞,树突状细胞可以来源外周血、骨髓和脐带血等。以下,对本发明的具体实施例进行说明,但本发明的技术范围不限于这些示例。制备例1人肺癌细胞的差异蛋白表达检测将购自美国ATCC公司的人肺癌细胞(A549),在10mLRPMI1640培养基(含体积比10%胎牛血清和1×青霉素与链霉素混合液,北京索莱宝公司)中,75cm2培养瓶中,放置37℃、5%CO2培养箱中培养,当细胞生长达到培养瓶底面的90%汇合时,用2mL胰酶(北京索莱宝公司)消化后,苔盼兰计数,用新鲜RPMI1640培养基(含体积比10%胎牛血清和1×青霉素与链霉素混合液)进行传代培养。取100份50μL(5×106个)上述细胞悬液加入500μL预冷即用型总蛋白提取裂解液(RIPA,北京百泰克公司)(含体积比1%蛋白酶抑制剂,瑞士Roche公司),冰上孵育20分钟后,每分钟13000转,4℃离心20分钟。取上清,分装-80℃保存备用。按照二喹啉甲酸(BCA)蛋白定量试剂盒(武汉博士德公司)使用说明操作,测定蛋白浓度。以RIPA调整蛋白浓度,样品终浓度为1.0μg/μL,加入5×蛋白样品缓冲液,95℃下5分钟。根据目的蛋白的分子量,配制10%分离胶,浓缩胶浓度为5%。待检测蛋白样品上样量:20μg/孔。电泳条件:浓缩胶恒压90V,约20分钟;分离胶恒压120V,通过标准分子量预染蛋白来确定电泳停止时间。湿转法,转膜条件:300mA恒流;0.45μm孔径PVDF膜,转膜时间80分钟。转膜完成后丽春红染色试剂对膜进行染色,观察转膜效果。封闭:将膜完全浸没于5%(mg/mL)牛血清白蛋白(BSA)的转膜缓冲液(含体积比3%吐温-20,TBST)中,室温下水平摇床孵育1小时。一抗孵育:5%(mg/mL)BSA-TBST稀释一抗(如下表所示,均购自美国Santa公司;β肌动蛋白,Betaactin为内参对照),4℃水平摇床孵育过夜。膜编号一抗名称来源稀释比例稀释后体积1PKCiotaRabbit1∶2004mL2PROM1Mouse1∶2004mL3ALDH1Rabbit1∶2004mL4ABCG2Mouse1∶2004mL5BetaactinMouse1∶10004mL次日,洗膜:TBST洗3次,每次10分钟。二抗孵育:5%(mg/mL)BSA-TBST稀释二抗,山羊抗兔IgG(H+L)辣根过氧化酶(HRP)和山羊抗鼠IgG(H+L)HRP1∶10000,室温孵育40分钟。洗膜:TBST洗膜3次,每次10分钟。化学发光底物ECL滴加到膜的蛋白面,反应3-5分钟;胶片曝光:10秒-5分钟(曝光时间随不同光强度而调整),显影2分钟,定影。胶片用扫描仪扫描为大于300DPI的TIF格式图片,使用QuantityOne分析软件(Bio-Rad公司)进行灰度分析,结果显示PKCiota、PROM1、ALDH1和ABCG2与内参β-actin灰度比值的平均值分别为0.35、0.46、0.47和0.59,标准差分别为0.17、0.21、0.20和0.27。差异蛋白表达分界值按100份人肺癌细胞蛋白免疫印迹技术检测所得灰度比值的平均值+3倍标准差取值,即PKCiota分界值为0.86,PROM1分界值为1.09,ALDH1分界值为1.07以及ABCG2分界值为1.40。制备例2正常人肺泡上皮细胞的差异蛋白表达检测将购自美国ScienCell公司的正常细胞系的人肺泡上皮细胞(HPAEpiC),在10mL杜尔贝可改良伊格尔(DMEM)/高糖培养基(含20%胎牛血清和1×青霉素与链霉素混合液,北京索莱宝公司)中,75cm2培养瓶中,放置37℃、5%CO2培养箱中培养,当细胞生长达到培养瓶底面的90%汇合时,用2mL胰酶(北京索莱宝公司)消化后,苔盼兰计数,用新鲜DMEM/高糖培养基(含20%胎牛血清和1×青霉素与链霉素混合液)进行传代培养。根据制备例1中蛋白免疫印迹技术检测100份上述细胞的差异蛋白表达水平,经灰度分析,结果显示PKCiota、PROM1、ALDH1和ABCG2与内参β-actin灰度比值的平均值分别为0.00、0.53、0.61和0.35,均低于差异蛋白表达的分界值。制备例3正常人肺泡干细胞的差异蛋白表达检测将购自美国ATCC公司的正常细胞系的人肺间充质干细胞(HPMSC),在10mL杜尔贝可改良伊格尔(DMEM)/F12(1∶1)培养基(含体积比10%胎牛血清和1×青霉素与链霉素混合液,北京索莱宝公司)中,75cm2培养瓶中,放置37℃、5%CO2培养箱中培养,当细胞生长达到培养瓶底面的90%汇合时,用2mL胰酶(北京索莱宝公司)消化后,苔盼兰计数,用新鲜DMEM/F12(1∶1)培养基(含体积比10%胎牛血清和1×青霉素与链霉素混合液)进行传代培养。根据制备例1中蛋白免疫印迹技术检测100份上述细胞的差异蛋白表达水平,经灰度分析,结果显示PKCiota、PROM1、ALDH1和ABCG2与内参β-actin灰度比值的平均值分别为0.00、0.98、1.01和0.24,均低于表达分界值。制备例4肺癌患者组织来源干细胞样肺癌细胞的差异蛋白表达检测肺癌组织来自在患者进行手术时采集的,患者经病理检查确诊为肺癌,并与患者签署知情同意书,患者信息如下表所示。患者序号年龄性别病理分型是否签署知情同意书141男非小细胞肺腺癌是236男低分化肺鳞癌是352女非小细胞肺腺癌是446男小细胞肺癌是557女非小细胞肺腺癌是643男非小细胞肺腺癌是736女低分化肺鳞癌是827女非小细胞肺腺鳞癌是967女小细胞肺癌是1070男非小细胞肺腺癌是用眼科剪将肺癌瘤组织剪碎成为约1mm3的小块。所得剪碎的组织小块用0.25%胰酶溶液以1克:0.5mL的重量体积比消化5分钟后,加入胰酶溶液体积1/5的小牛血清(美国Hyclone公司)终止,以1000rpm离心收集消化好的组织小块,弃上清,所得离心沉淀用Accutase(阿尤替斯酶,美国西格玛公司)以1克:1mL的体积比在37℃下混匀消化10分钟,然后在1000rpm下离心5min收集细胞,用以1克:1mL的重量体积比用杜尔贝可改良伊格尔-F12培养基重悬。所得重悬液用40μm分子筛(美国BD公司)过滤。用所述孔径的分子筛过滤,截留的是大片细胞碎片和未被消化的细胞团,滤出的是细胞悬液。取1份50μL(2×106个)上述得到细胞悬液,根据蛋白免疫印迹技术,优选制备例1中蛋白免疫印迹技术,检测10位患者分别10份上述细胞的差异蛋白表达水平,经灰度分析,结果显示PKCiota、PROM1、ALDH1和ABCG2与内参β-actin灰度比值的平均值分别为0.00、0.80、0.91和1.27,差异蛋白均低于表达分界值。收集剩余的所述细胞悬液后,向其中含有5ng/mLB27、40ng/mL人表皮生长因子(epidermalgrowthfactor,EGF)、30ng/mL碱性成纤维细胞生长因子(bEGF)和30mg/mL胰岛素的杜尔贝可改良伊格尔-F12(Dulbecco’smodifiedEagle’smedium-F12)(DMEM/F12)培养基(美国Hyclone公司)使细胞悬液浓度被稀释为2×106细胞/mL。然后将每5mL所得稀释的细胞悬液转移至25cm2灭菌塑料培养瓶中在37℃、5%CO2培养箱中培养24h。培养所得细胞呈成神经球状悬浮生长,吸取培养基到15mL离心管中,每分钟1000转,4℃离心10分钟收集悬浮细胞,弃上清,沉淀细胞添加新鲜的含有8ng/mLB27、30ng/mL人表皮生长因子、20ng/mL碱性成纤维细胞生长因子和20mg/mL胰岛素的杜尔贝可改良伊格尔-F12(DMEM/F12)培养基。当细胞球生长达到1μm左右时,用Accutase消化成单细胞后,用含有8ng/mLB27、30ng/mL人表皮生长因子、20ng/mL碱性成纤维细胞生长因子和20mg/mL胰岛素的杜尔贝可改良伊格尔-F12(DMEM/F12)培养基进行传代培养(1瓶传几个瓶,每瓶起始培养的细胞密度为2×106细胞/mL)。按照上述传代条件再传4代,得到成神经球状的细胞。取1份50μL(2×106个)上述成神经球培养得到的干细胞样肺癌细胞悬液,根据制备例1中蛋白免疫印迹技术检测上述10位患者分别10份上述细胞的差异蛋白表达水平,经灰度分析,结果显示PKCiota、PROM1、ALDH1和ABCG2与内参β-actin灰度比值的平均值分别为2.31、3.46、7.97和6.48,差异蛋白均高于表达分界值,表明培养得到的干细胞样肺癌细胞特异表达该5种差异蛋白。对比例1利用MariaM.Ho等人记载的方法分离并制备干细胞样肺癌细胞及其抗原组合物肺癌患者肿瘤标本用5mL的1×磷酸缓冲液漂洗3次,使用无菌研磨棒在无菌细胞平皿中机械法磨碎后,加入2mL的DMEM培养基(含0.1胶原酶活性Wunschunits/mL,瑞士Roche诊断公司)在37℃,摇动培养箱中消化4小时。消化液用18.5G针管进一步去除团块,并用100μm细胞筛过筛,获得单细胞悬液。单细胞悬液用70%和40%的细胞分离液Percoll梯度离心,室温下每分钟2500转离心20分钟,收集在70%/40%界面的细胞。细胞用DMEM培养基(美国Invitrogen生命技术公司)(含体积比2%小牛血清和10mmol/LHEPES缓冲液)重悬至106/mL,加入终浓度荧光染料Hoechst33342至终浓度5μg/mL,在37℃下孵育90分钟,并间隔10分钟摇匀一次。然后细胞用冷的HBSS缓冲液(含体积比2%小牛血清和10mmol/LHEPES缓冲液)洗涤一次,并4℃下每分钟1000转离心5分钟收集细胞,并用冷的HBSS缓冲液(含体积比2%小牛血清和10mmol/LHEPES缓冲液)重悬。细胞分选前过40μm细胞筛得到细胞悬液,然后使用美国BD公司流式细胞仪FACSVantageSE分选,根据仪器使用说明书操作分选获得Hoechst33342染色的侧群细胞(SP),即干细胞样肺癌细胞。取1份50μL(2×106个)上述得到细胞悬液,根据制备例1中蛋白免疫印迹技术检测10位患者分别10份上述细胞的差异蛋白表达水平,经灰度分析,结果显示PKCiota、PROM1、ALDH1和ABCG2与内参β-actin灰度比值的平均值分别为0.05、0.98、0.61和2.27,除ABCG2灰度比值高于表达分界值外,其余的差异蛋白均低于表达分界值。实施例1免疫磁珠法富集特异表达差异蛋白的干细胞样肺癌细胞使用制备例4中传代培养获得108个细胞,用0.5mL孵育液PBE(含0.5%BSA和0.08%EDTA的pH7.21×PBS,真空抽滤除菌及液体内气体)充分混匀细胞,加入一抗(20μg/ml终浓度的兔抗人PKCiota抗体,美国Santa公司),4℃孵育30分钟。用20倍体积PBE洗细胞一次,再加0.3mLPBE充分混匀细胞后,加入50μL二抗山羊抗兔IgG(H+L)包被的超微磁珠(美国Invitrogen生命技术公司),混匀后置8℃孵育15分钟,然后加入5倍体积PBE洗细胞3次,再用0.3mLPBE充分混悬细胞。将分离柱安装入磁铁分离器中,加入0.5mlPBE,在重力作用下自然流尽,预处理分离柱。向分离柱中加入0.3mL细胞的PBE悬液,在重力作用下自然流尽PBE。将分离柱从磁铁分离器上取下,用特殊注射器吸取冲洗液加压注入,洗脱下吸附的PKCiota阳性细胞。使用一抗为小鼠抗人PROM1、兔抗人ALDH1和小鼠抗人ABCG2的抗体,以及相对应的二抗山羊抗鼠和山羊抗兔的IgG(H+L)包被的超微磁珠,可连续分选出表达PKCiota、PROM1、ALDH1和ABCG2中至少两种的干细胞样肺癌细胞。实施例2流式细胞仪分选法富集特异表达差异蛋白的干细胞样肺癌细胞使用制备例4中传代培养获得108个细胞,用1×PBS(pH7.2)(含体积比2%胎牛血清)重悬至2×106/mL,加入20μg/mL终浓度的兔抗人PKCiota抗体,在37℃下孵育90分钟,并间隔10分钟摇匀一次。然后细胞用冷的1×PBS(pH7.2)(含体积比2%胎牛血清)洗涤一次,并4℃下每分钟1000转离心5分钟收集细胞,加入5mL含50μLFITC标记的二抗山羊抗兔IgG(H+L)的冷的1×PBS(pH7.2),混匀后置4℃孵育30分钟,并用冷的1×PBS(pH7.2)(含体积比2%小牛血清)洗涤3次,重悬于5mL的1×PBS(pH7.2)(含体积比2%小牛血清)中。细胞悬液然后使用美国BD公司流式细胞仪FACSVantageSE分选,根据仪器使用说明书操作分选获得PKCiota阳性细胞。使用一抗为小鼠抗人PROM1、兔抗人ALDH1和小鼠抗人ABCG2的抗体,以及相对应的FITC标记的二抗山羊抗鼠和山羊抗兔的IgG(H+L),使用美国BD公司流式细胞仪FACSVantageSE连续富集表达PKCiota、PROM1、ALDH1和ABCG2中至少两种的的干细胞样肺癌细胞。也可以先使用磁珠法富集PKCiota阳性细胞,然后使用流式细胞仪富集其他差异蛋白阳性的细胞,这样也可以获得富集特异表达两种以上差异蛋白的干细胞样肺癌细胞。实施例3干细胞样肺癌细胞抗原组合物制备利用本发明所述的方法分离并制备干细胞样肺癌细胞及其抗原组合物。取上述制备例1和4所得的肺癌细胞和干细胞样肺癌细胞以及上述实施例1-2中富集特异表达PKCiota、PROM1、ALDH1和ABCG2中至少两种的干细胞样肺癌细胞,选择富集PKCiota和PROM1双阳性,PKCiota、PROM1和ALDH1三阳性,PKCiota、PROM1、ALDH1和ABCG2四阳性的干细胞样肺癌细胞;并取对比例1获得的干细胞样肺癌细胞。在液氮中和室温(25℃)下反复冻融5次,通过倒置显微镜检测到所述细胞完全裂解。所得裂解液在600rpm下离心1min,收集上清用0.45μm滤膜过滤,收集滤液。所述裂解液即干细胞样肺癌细胞的抗原组合物,储存在-80℃中备用。实施例4树突状细胞获取取100mL外周血经Ficoll-Hypaque密度梯度离心,得到单个核细胞。外周血单个核细胞用RPMI1640培养基重悬,并加入6孔板中贴壁。在37℃、5%CO2培养箱中孵育90min后,未贴壁细胞洗涤收集下来,用于诱导CIK细胞。贴壁细胞加入完全培养基RPMI1640诱导培养,含有5%的自体血清、2000IU/mL重组人粒细胞巨噬集落刺激因子和1500IU/mLIL-4。在培养到第三天时细胞更换新鲜培养基(含2000IU/mLGM-CSF和1500IU/mLIL-4)。培养到第五天收获未成熟树突状细胞(DCs),成熟DCs采用完全RPMI1640培养基在诱导到第七天得到,含0.1μg/mL脂多糖和20ng/mL肿瘤坏死因子α。在第五天时添加特殊抗原(如PKCiota、PROM1、ALDH1和ABCG2四阳性干细胞样肺癌细胞抗原),负载DCs。实施例5肺癌细胞抗原负载DCs培养5天后,3×106个未成熟DCs用制备例1和4、实施例1-2和对比例1所述的干细胞样肺癌细胞裂解抗原组合物(得自1×106干细胞样肺癌细胞)在37℃、5%CO2培养箱中负载4小时。抗原负载的DCs通过离心(10min,1000rpm)收获得到。所得DCs经生理盐水洗涤3次,后重悬到生理盐水中,至浓度为3×106成熟DC/mL,并添加终浓度为质量体积比2%的人血白蛋白,从而制备成干细胞样肺癌细胞裂解抗原组合物负载的DC疫苗。实施例1或/和2制备获得的PKCiota、PROM1、ALDH1和ABCG2四阳性干细胞样肺癌细胞抗原负载树突状细胞通过CD86-PE、CD80-PE、CD40-FITC、CD83-PE、CD11c-FITC和HLA-DR-PerCP(BD公司)染色,流式细胞仪检测负载后DC表型变化。图1显示制备的DC表型为CD11c+/HLA-DR+为99.0%,CD11c+/CD83+为98.5%,CD86+/HLA-DR+为99.6%,CD80+/HLA-DR+为99.1%和CD40+/HLA-DR+为99.7%,符合DC细胞特异表型,并高表达共刺激分子。效果说明例1:制备例1和4、实施例1-2和对比例1所得的肺癌细胞抗原负载的DC疫苗体外杀瘤试验在6孔板内,仍以含5%小牛血清的RPMI1640为培养基,按上述抗原负载的成熟树突状细胞∶T细胞=1∶5的比例混合上述抗原负载的成熟树突状细胞和T细胞,同时加入GM-CSF(终浓度为800U/mL)和IL-4(终浓度为20ng/mL),共培养7天,期间每隔1天均半量换液(含5%小牛血清、终浓度为800U/mL的GM-CSF和终浓度为20ng/mL的IL-4的RPMI1640培养基),得到CTL细胞。选择相应的肺癌细胞作为靶细胞,用51Cr标记,即靶细胞(2×106/mL)通过与300μCi51Cr在RPMI1640培养基中37℃孵育2小时。标记好的靶细胞用1×PBS洗涤三次,并最终用RPMI1640(含10%小牛血清)重悬到2×105的浓度。以每孔2×104个标记的靶细胞(0.1mL)添加到96孔板的孔中。将上述产生的CTL细胞(效应细胞)分别以2.5∶1、5∶1、10∶1、20∶1和40∶1的效靶比加入对应的孔中,在37℃孵育4小时。孵育后,取上清75μL组分用γ放射计数器计数。特异的51Cr释放的百分比根据下述的公式进行计算。其中,自发释放的每分脉冲数通过单独培养靶细胞(未加效应细胞)获得,最大释放的每分脉冲数是用终浓度2%NP-40(表面活性剂,上海生工)处理的单独培养靶细胞后获得的。检测的每分脉冲数通过添加效应细胞的靶细胞培养获得的。图2显示了由实施例1或/和2所得PKCiota和PROM1双阳性,PKCiota、PROM1和ALDH1三阳性,PKCiota、PROM1、ALDH1和ABCG2四阳性的干细胞样肺癌细胞抗原组合物负载树突状细胞,得到细胞毒性T淋巴细胞(CTL),由该CTL细胞产生的对PKCiota和PROM1双阳性干细胞样肺癌细胞的应答结果。如图2所示,随着效靶比不断提高,对干细胞样肺癌细胞产生的CTL应答也特异升高,并且由富集四种阳性差异蛋白的实施例效果佳。其中,PP-DC1表示为PKCiota和PROM1双阳性干细胞样肺癌细胞抗原负载的树突状细胞引发对PKCiota和PROM1双阳性干细胞样肺癌细胞的毒性活性;PPA-DC2表示为PKCiota、PROM1和ALDH1三阳性干细胞样肺癌细胞抗原负载的树突状细胞引发对PKCiota和PROM1双阳性干细胞样肺癌细胞的毒性活性;PPAA-DC3表示为PKCiota、PROM1、ALDH1和ABCG2四阳性干细胞样肺癌细胞抗原负载的树突状细胞引发对PKCiota和PROM1双阳性干细胞样肺癌细胞的毒性活性。所述PKCiota和PROM1双阳性干细胞样肺癌细胞按照实施例1或/和2制备。图3显示了由实施例1或/和2所得PKCiota和PROM1双阳性的干细胞样肺癌细胞抗原组合物负载树突状细胞(PP-DC1),以及由制备例1、4和对比例1所得三种抗原组合物分别负载树突状细胞,得到四种细胞毒性T淋巴细胞(CTL),由该四种CTL细胞分别对PKCiota和PROM1双阳性干细胞样肺癌细胞产生的应答结果对比图。其中,PP-DC1表示为PKCiota和PROM1双阳性干细胞样肺癌细胞抗原负载的树突状细胞引发对PKCiota和PROM1双阳性干细胞样肺癌细胞的毒性活性;A549-DC4表示制备例1肺癌细胞A549抗原负载的树突状细胞引发对PKCiota和PROM1双阳性干细胞样肺癌细胞的毒性活性,LSC-DC5表示制备例4的肺癌成神经球细胞抗原负载的树突状细胞对PKCiota和PROM1双阳性干细胞样肺癌细胞的毒性活性,DLSC-DC6表示对比例1的干细胞样肺癌细胞抗原负载的树突状细胞对PKCiota和PROM1双阳性干细胞样肺癌细胞的毒性活性。如图3所示由实施例1或/和2所得PKCiota和PROM1双阳性的干细胞样肺癌细胞抗原组合物负载树突状细胞(PP-DC1)引发对PKCiota和PROM1双阳性干细胞样肺癌细胞的细胞毒性活性要分别高于A549-DC4、LSC-DC5和DLSC-DC6引发对PKCiota和PROM1双阳性干细胞样肺癌细胞的细胞毒性活性。所述PKCiota和PROM1双阳性干细胞样肺癌细胞按照实施例1或2制备。图4显示了由实施例1或/和2所得PKCiota和PROM1双阳性的干细胞样肺癌细胞抗原组合物负载树突状细胞,以及由制备例1、4和对比例1所得三种抗原组合物分别负载树突状细胞,得到四种细胞毒性T淋巴细胞(CTL),由该四种CTL细胞分别对对比例1获得的干细胞样肺癌细胞产生的应答结果对比图。其中,PP-DC1’表示为PKCiota和PROM1双阳性干细胞样肺癌细胞抗原负载的树突状细胞引发对对比例1获得的干细胞样肺癌细胞的毒性活性;A549-DC4’表示肺癌细胞A549抗原负载的树突状细胞引发对对比例1获得的干细胞样肺癌细胞的毒性活性,LSC-DC5’表示制备例4的肺癌成神经球细胞抗原负载的树突状细胞对对比例1获得的干细胞样肺癌细胞的毒性活性,DLSC-DC6’表示对比例1的干细胞样肺癌细胞抗原负载的树突状细胞对对比例1获得的干细胞样肺癌细胞的毒性活性。如图4所示由实施例1或/和2所得PKCiota和PROM1双阳性的干细胞样肺癌细胞抗原组合物负载树突状细胞(PP-DC1)引发对对比例1获得的干细胞样肺癌细胞的细胞毒性活性要分别高于A549-DC4、LSC-DC5和DLSC-DC6引发对对比例1获得的干细胞样肺癌细胞的细胞毒性活性。效果说明例2:制备例1和4、实施例1-2和对比例1所得的肺癌细胞在体内杀瘤实验中的作用以含5%小牛血清的RPMI1640为培养基,将3×106个的未成熟树突状细胞用上述制备例1和4、实施例1-2和对比例1所得的肺癌细胞裂解抗原组合物(得自1×106干细胞样肺癌细胞)在37℃、5%CO2培养箱中负载4小时。抗原负载的成熟树突状细胞通过1000rpm离心10min得到。将所述抗原负载的成熟树突状细胞用生理盐水洗涤3次,然后重悬至1×106个/mL的浓度,4℃下保存备用。干细胞样肺癌细胞建立荷肺癌瘤鼠模型(参见“人结肠癌细胞在免疫缺陷小鼠中能诱发肿瘤的生长”,O′BrienCA等人,自然,第445卷,第106-110页,2008年2月3日;O′BrienCA,PollettA,GallingerS,etal.Ahumancoloncancercellcapableofinitiatingtumourgrowthinimmunodeficientmice.Nature,2007,445(7123):106-110.),随机分为A、B、C、D、E、F和G7组,每组6只:A组为富集PKCiota和PROM1双阳性的干细胞样肺癌细胞抗原负载的树突状细胞治疗组;B组为PKCiota、PROM1和ALDH1三阳性的干细胞样肺癌细胞抗原负载的树突状细胞治疗组;C组为PKCiota、PROM1、ALDH1和ABCG2四阳性的干细胞样肺癌细胞抗原负载的树突状细胞治疗组;D组为制备例1制备的肺癌细胞A549抗原负载的树突状细胞对比组(注射液制备方法与A组相同);E组为制备例4制备的干细胞样肺癌细胞抗原负载的树突状细胞对比组(注射液制备方法与A组相同);F组为对比例1获得的的干细胞样肺癌细胞抗原负载的树突状细胞为对比组(注射液制备方法与A组相同);G组为同体积生理盐水空白组。A、B、C、D、E和F六组在第0天荷瘤鼠模型皮下输注0.5-2×106个/mL树突状细胞,各0.5mL,半个月后再同样剂量免疫1次。注射后分别于7、14、21、28、35d计算鼠模型荷瘤大小,G组于相同时间点在皮下注射0.5mL生理盐水并计算鼠模型荷瘤大小。经干细胞样肺癌细胞抗原负载的树突状细胞疫苗对荷瘤鼠模型的抑制生长情况(mm3,)如下表所示。注:*空白组与治疗组相比P远小于0.01;#对比组与治疗组相比P<0.01。此外,有关实施例1或/和2富集所得两种差异蛋白阳性以上的干细胞样肺癌细胞负载DC引发的体内杀瘤活性,远远好于有关制备例1、4和对比例1的肺癌细胞的体内杀瘤活性。此外有关实施例5或/和6所得PKCiota、PROM1、ALDH1和ABCG2四阳性的干细胞样肺癌细胞的体内杀瘤活性,好于有关实施例1或/和2所得两种差异蛋白阳性和三种差异蛋白阳性的干细胞样肺癌细胞的体内杀瘤活性。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1