马铃薯栽培种J3的制作方法与工艺
马铃薯栽培种J3相关专利申请的交叉引用本申请要求提交于2013年5月2日的美国临时专利申请序列号。61/818,752的优先权权益,该临时专利申请全文以引用方式并入本文。
背景技术:
本发明涉及一种名为J3的新型马铃薯栽培种,并且涉及该马铃薯品种生成的块茎、植物、植物部分、组织培养物和种子。本发明还涉及由马铃薯栽培种J3制成的食品,例如炸薯条、薯片、脱水马铃薯材料、马铃薯雪花片和马铃薯颗粒。本申请中引用的所有出版物均以引用的方式并入本文。马铃薯为世界上第四大最重要的粮食作物以及目前为止最重要的蔬菜。当前美国几乎每个州均商业种植马铃薯。在美国每年的马铃薯产量超过一千八百万吨,整个世界有3亿吨。马铃薯的普及主要源自其多功能性以及营养价值。马铃薯可新鲜、冷冻或干燥使用,或者可加工成面粉、淀粉或酒精。它们含有复杂的碳水化合物并且富含钙、烟酸和维生素C。在食品产业中马铃薯的品质受两个关键因素的不利影响:(1)马铃薯含有大量的天冬酰胺,其在煎炸或烘培时会快速氧化而形成丙烯酰胺(一种致癌物)的非必需游离氨基酸;以及(2)马铃薯十分易受酶促褐变和变色的影响,受酶促褐变和变色是在多酚氧化酶从擦伤的马铃薯的受损质体泄露出来时发生的不期望事件。在细胞质中,该酶使酚氧化,后者然后快速聚合而产生暗色素。块茎含有大量的磷酸化淀粉,在存储期间一些磷酸化淀粉降解而产生葡萄糖和果糖。这些还原糖在高于120℃的温度下加热时会与氨基酸反应生成包含丙烯酰胺的美拉德产物。参与淀粉磷酸化反应的两种酶是水二激酶R1和磷酸化酶-L(R1和PhL)。褐变也因为淀粉部分降解成葡萄糖和果糖而以非酶促的方式触发。迄今为止,尚没有可产生具有低的丙烯酰胺含量、增加的黑斑擦伤耐受性以及降低的衰老甜化的块茎的马铃薯植物品种。因而,需要开发具有降低水平的毒性化合物的马铃薯品种,但不使用未知或外来的核酸。本发明满足这种需求。上述的相关领域实例以及与其相关的局限性旨在是示例性的以及非排他性的。在阅读本说明书后相关领域的其他局限性对本领域技术人员将变得显而易见。
技术实现要素:
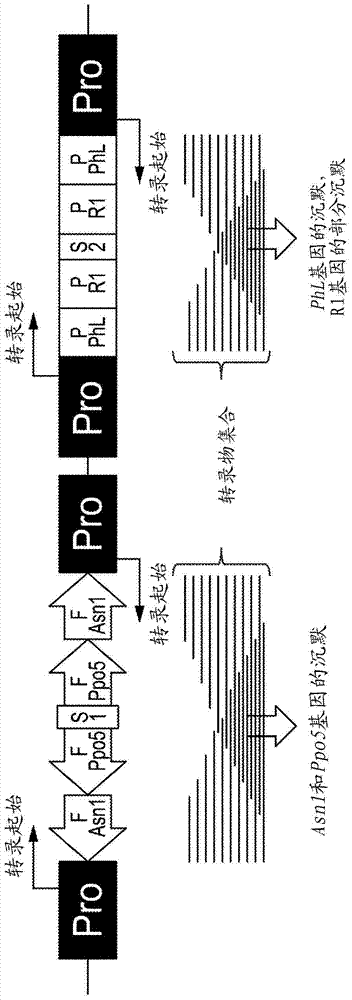
下面的实施例及其各方面与系统、工具以及方法结合描述的,所述系统、工具和方法意在是示例性的,不限制范围。在多个实施例中,已减少或消除了上述问题中的一者或多者,而其他实施例则针对其他改善。为此,本发明提供了用核酸序列转化的新型马铃薯品种J3,所述核酸序列是马铃薯植物基因组天然的并且不包含外来DNA、农杆菌(Agrobacterium)DNA、病毒标志物或载体骨架序列。更确切地说,插入马铃薯品种J3基因组的DNA是马铃薯、野生马铃薯、与马铃薯性亲和的植物的天然非编码多核苷酸,其使参与表达黑斑擦伤、天冬酰胺积聚和衰老甜化的基因沉默。因而,在一个实施例中,本发明提供一种植物载体,称为pSIM278,其包含:第一沉默盒,第一沉默盒含有两个拷贝的DNA片段,所述两个拷贝的DNA片段以反义取向包含天冬酰胺合成酶-1基因(fAsn1)片段和多酚氧化酶-5基因的3'-非翻译序列;和第二沉默盒,第二沉默盒含有两个拷贝的DNA片段,所述两个拷贝的DNA片段以反义取向包含马铃薯磷酸化酶-L(pPhL)基因片段和马铃薯R1基因片段。该pSIM1278载体包含:一9,511bp骨架区,其在植物转化之前支持植物DNA的维持并且在植物细胞转化后不转移进植物细胞中;和一10,147bpDNA插入区,其包含天然的DNA,在转化后该天然的DNA稳定整合进植物细胞的基因组中。在一不同的实施例中,本发明提供转化有本发明的植物载体的植物细胞。在一另外的实施例中,本发明提供一种马铃薯植物品种,其包含一个或多个转化有本发明的载体的细胞。在本发明的一个方面,该马铃薯植物品种表达所述载体的两个沉默盒中的至少一者,并且所述沉默盒的表达导致天冬酰胺合成酶-1基因和多酚氧化酶-5基因在该转入杂交亲和物种基因的(intragenic)植物的块茎中下调。在本发明的一个优选的方面,表达至少一个沉默盒的所述马铃薯植物品种的块茎展现出两种或更多种期望的性状,所述性状不存在于相同品种的未转化植株的块茎中。在本发明的最优选的方面中,所述两种或更多种期望的性状选自低的天冬酰胺积聚、降低的黑斑擦伤以及降低的热诱导的丙烯酰胺形成。在本发明的一个不同方面,该马铃薯植物品种表达所述植物DNA载体的两个沉默盒,并且所述沉默盒的表达导致天冬酰胺合成酶-1基因、多酚氧化酶-5基因、磷酸化酶-L基因和二激酶R1基因在该马铃薯植物品种的块茎中下调。在本发明的一个优选的方面,表达所述植物DNA载体的两个沉默盒的所述马铃薯植物品种的块茎展现出两种或更多种期望的性状,所述性状不存在于相同品种的未转化植株的块茎中。在本发明的一个优选的实施例中,所述两种或更多种期望的性状选自低的天冬酰胺积聚、降低的黑斑擦伤、储存期间降低的还原糖积聚以及降低的热诱导的丙烯酰胺形成。在本发明的一个方面,表达植物DNA载体的两个沉默盒的马铃薯植物品种是AtlanticJ3品种。因此,根据本发明,提供了名为J3的马铃薯(SolanumtuberosumL.)种属的新马铃薯栽培种。本发明因此涉及马铃薯栽培种J3、马铃薯栽培种J3的块茎、马铃薯栽培种J3的植株、马铃薯栽培种J3的种子、由马铃薯栽培种J3制成的食品、通过将马铃薯栽培种J3自交或通过将马铃薯栽培种J3与其他马铃薯栽培种杂交生成马铃薯植株的方法、以及通过马铃薯栽培种J3的突变或转化而引起的变体形成。因此,任何此类使用栽培种J3的方法均是本发明的实施例:自交、回交、杂交生产、杂交产生群体等等。使用马铃薯栽培种J3作为至少一个亲本生成的所有植株在本发明的范围内。有利的是,可将该马铃薯栽培种用于与其他的、不同的马铃薯植株杂交以产生具有优异特性的第一代(F1)马铃薯杂种块茎、种子和植株。在另一个实施例中,本发明提供了马铃薯栽培种J3的单个或多个基因转化植株。在一个实施例中,该转移基因可以是显性的或隐性的等位基因。在一些实施例中,该转移基因将赋予诸如除草剂抗性、昆虫抗性、对细菌性、真菌性或病毒性病害的抗性、雄性能育性、雌性能育性、增强的营养品质、均一性以及淀粉及其他碳水化合物的浓度增加、擦伤趋势降低以及淀粉转化为糖的速率降低之类的性状。该基因可以是自然存在的马铃薯基因或通过遗传工程技术、回交或突变而引入的转基因。在另一个实施例中,本发明提供了用于马铃薯栽培种J3的组织培养物中的可再生细胞。在一个实施例中,该组织培养物将能够再生具有上述马铃薯植物的全部生理和形态特性的植株,以及能够再生具有与上述马铃薯植株基本相同的基因型的植株。在一些实施例中,这种组织培养物中的可再生细胞将是胚、原生质体、分生组织细胞、愈伤组织、花粉、叶、花药、雌蕊、子叶、下胚轴、根、根尖、花、种子、叶柄、块茎、芽眼或茎。另外,本发明提供由本发明的组织培养物再生的马铃薯植株。在另一个实施例中,本发明提供了由马铃薯植株品种AtlanticJ3的块茎制得的食品。优选地,该食品为经热处理的产品。更优选地,该食品为炸薯条、薯片、脱水马铃薯材料、马铃薯雪花片或马铃薯颗粒。除了上述示例性的方面和实施例以外,通过研究如下说明,另外的方面和实施例将变得显而易见。附图说明图1示出了pSIM1278转化载体。左边的载体骨架区为9,511bp长,在位置9,957bp处开始并在位置19,468bp处结束。该骨架DNA主要由细菌DNA组成,在植物转化之前该细菌DNA支持DNA插入物的维持。DNA插入区(右边)(包括旁侧边界序列)为10,147bp长(从19,469bp到19,660bp以及从1bp到9,956bp)。该DNA插入物仅由天然的DNA组成并且在转化时稳定地整合进马铃薯基因组中。图2提供了插入pSIM1278转化载体中的DNA插入物中的沉默盒的示意图。每个沉默盒含有由间隔序列分开的两个拷贝的二基因片段。包含四个靶标基因(即Asn-1、Ppo-5、Phl和R1)的片段的两个拷贝的DNA片段作为反向重复插入在两个会聚启动子(标为Pro)之间,该启动子主要在块茎中有活性。含有所得的沉默盒的植物在块茎中产生多样的并且未多聚腺苷酸化的大量RNA分子,其动态地且有力地使预期的靶基因沉默。该RNA分子的大小通常小于所采用的两个启动子之间的距离,因为会聚转录导致碰撞转录。具体实施方式在随后的说明和表中,使用了许多术语。为了清晰和一致地理解本说明书和权利要求书(包括给予这些术语的范围),提供了以下定义:等位基因。等位基因为基因的一种或多种备选形式中的任一者,这些备选形式与一种性状或特性相关。在二倍体细胞或生物体中,给定基因的两个等位基因占据一对同源染色体上的对应基因座。氨基酸序列。如本文所用,包括从植物分离的、植物天然的或植物中自然存在的,或者以合成方式制备但包含内源对应物的核酸序列的寡肽、肽、多肽或蛋白质以及它们的片段。人为操纵。如本文所用,“人为操纵”意指通过手或通过机械手段或重组手段,例如通过遗传工程技术,移动、布置、操作或控制植物或植物细胞,以便产生与未经操纵的自然存在的对应物相比具有不同生物学、生物化学、形态学或生理学表型和/或基因型的植物或植物细胞。无性繁殖。通过从叶切片、茎切片、根切片、块茎芽眼、匍匐茎、单植物细胞原生质体、愈伤组织等生成整株植株来产生子代,不涉及配子融合。骨架。不包括打算转移的DNA插入序列的二元载体的核酸序列。回交。回交为育种者反复地将杂种子代返回去与其中一个亲本杂交,例如,第一代杂种F1与该F1杂种的亲本基因型中的一者杂交。细菌环腐病。细菌环腐病是一种由细菌密执安棍状杆菌(Clavibactermichiganense)亚种引起的疾病。细菌环腐病的名字来源于块茎内维管束环的特征性破坏。该环通常以乳黄色到浅褐色干酪质腐烂出现。在马铃薯的外表面,严重染病的块茎可能会显示出稍微凹陷的干裂区域。受感染块茎的维管组织中的细菌环腐病症状较于上述可能较不明显,仅仅以断裂的、零星出现的暗色线条或以连续的泛黄的污点出现。黑斑擦伤。存在于擦伤的块茎组织中的黑斑是称为黑色素的颜料引起的,黑色素在细胞损伤后产生并且使组织具有褐色、灰色或黑色外观。黑色素在苯酚底物和适当的酶因为细胞损坏而彼此形成接触时形成。该损坏不要求破裂的细胞。然而,底物和酶的混合必须出现,通常在组织受到碰撞时。黑斑主要是在刚好在维管环下面的髓周组织中出现,但可以大到足以包括皮层组织的一部分。边界样序列。“边界样”序列分离自所选择的待修饰的植物物种,或分离自与待修饰的植物物种性亲和的植物,并且像农杆菌的边界序列一样发挥功能。也就是说,本发明的边界样序列促进和有利于其所连接的多核苷酸的整合。本发明的DNA插入物优选含有边界样序列。DNA插入物的边界样序列长度介于5-100bp之间、长度介于10-80bp之间、长度介于15-75bp之间、长度介于15-60bp之间、长度介于15-50bp之间、长度介于15-40bp之间、长度介于15-30bp之间、长度介于16-30bp之间、长度介于20-30bp之间、长度介于21-30bp之间、长度介于22-30bp之间、长度介于23-30bp之间、长度介于24-30bp之间、长度介于25-30bp之间或者长度介于26-30bp之间。DNA插入物左边界序列和右边界序列分离自待修饰的植物的基因组和/或对待修饰的植物的基因组而言是天然的。DNA插入物边界样序列在核苷酸序列方面与任何已知的农杆菌衍生的T-DNA边界序列不同一。因而,DNA插入物边界样序列可具有1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20或更多个不同于来自农杆菌物种如根癌农杆菌(Agrobacteriumtumefaciens)或发根农杆菌(Agrobacteriumrhizogenes)的T-DNA边界序列的核苷酸。也就是说,本发明的DNA插入物边界序列或边界样序列与来自农杆菌物种如根癌农杆菌或发根农杆菌的T-DNA边界序列具有至少95%、至少90%、至少80%、至少75%、至少70%、至少60%或至少50%序列同一性,但不是100%序列同一性。如本文所用,描述性术语“DNA插入物边界”和“DNA插入物边界样”是可互换的。边界样序列可分离自植物基因组并且可经修饰或突变以改变其能够将核苷酸序列整合进另一核苷酸序列中的效率。其他多核苷酸序列可添加或掺入进本发明的边界样序列内。因而,DNA插入物左边界或DNA插入物右边界可经修饰以具有5’-和3’-多克隆位点,或额外的限制性位点。DNA插入物边界序列可经修饰以增加来自伴随载体的骨架DNA不整合进植物基因组中的可能性。基本上由…组成。“基本上由某些元件组成”的组合物局限于包括那些元件,以及局限于不实质地影响本发明组合物的基本特性和新特性的那些元件。因而,只要组合物不影响本发明的基本特性和新特性,即不含有不来自于所选择植物物种或与所选择的植物物种性亲和的植物的外来DNA,则该组合物可视为通过语言“基本上由…组成”表征的本发明组合物的组分。子叶。子叶为种子叶子的一种类型。子叶含有种子的食物储藏组织。简并引物。“简并引物”为含有足够核苷酸变异的寡核苷酸,在与相似但非完全同源的序列杂交时该变异可适应碱基错配。双子叶植物。其胚具有两片子叶的显花植物。双子叶的例子包括但不限于烟草、番茄、马铃薯、甘薯、木薯、豆科植物(包括苜蓿和大豆)、胡萝卜、草莓、莴苣、橡树、枫树、胡桃、玫瑰、薄荷、南瓜属植物、雏菊和仙人掌。DNA插入物。根据本发明,待插入进植物基因组中的DNA插入物包含该植物天然的多核苷酸序列或者具有该植物天然的遗传元件。在一个例子中,例如,本发明的马铃薯品种J3的DNA插入物是10,147bp的非编码多核苷酸,该非编码多核苷酸对于马铃薯、野生马铃薯、与马铃薯性亲和的植物而言是天然的,在转化后稳定整合进植物细胞的基因组中,并且使参与表达黑斑擦伤、天冬酰胺积聚和衰老甜化的基因沉默。DNA插入物优选包含两个表达盒并且插入进称为pSIM1278转化载体的转化载体中。第一表达盒包含天冬酰胺合成酶-1基因(Asn1)和多酚氧化酶-5基因(Ppo5)二者的片段,所述片段在ADP葡萄糖焦磷酸化酶基因(Agp)的Agp启动子与颗粒结合合酶基因(Gbss)的Gbss启动子之间以反向重复排列。这些启动子主要在块茎中有活性。第二表达盒的功能是使淀粉相关基因二激酶-R1(R1)和磷酸化酶-L基因(PhL)的启动子沉默。该表达盒由淀粉相关基因二激酶-R1(R1)和磷酸化酶-L基因(PhL)的启动子的片段构成,所述片段有效连接至与第一表达盒相同的Agp和Gbss启动子。这些表达盒不含外来DNA,并且仅由来自所选植物物种或来自与所选植物物种性亲和的植物的DNA组成。胚。胚是成熟种子内所含的未成熟植株。外来的。关于核酸的“外来的”意指该核酸源自非植物生物体,或者源自与待转化的植物物种不同的植物,或者不源自与待转化的植物不可杂交的、不属于目标植物的物种的植物。根据本发明,外来DNA或RNA代表自然存在于真菌、细菌、病毒、哺乳动物、鱼或鸟的遗传组成中、但不天然存在于待转化植物中的核酸。因而,外来核酸为编码例如不由转化植物自然产生的多肽的核酸。外来核酸不必编码蛋白质产物。根据本发明,所需的转入杂交亲和物种基因的植物是不含有任何整合进其基因组中的外来核酸的植物。基因。如本文所用,“基因”是指编码区并且不包括该区5’或3’的核苷酸序列。功能基因是与启动子或终止子有效连接的编码区。基因可利用转化或各种育种方法引入进物种的基因组中,无论是从不同物种还是从相同物种引入。基因转换的(转换)。基因转换的(转换)植物是指通过称为回交的植物育种技术开发的植物,其中除了通过该回交技术、通过遗传工程改造或通过突变转移进一品种中的一个或多个基因外,该品种的基本上所有的所需形态学和生理学特性得以恢复。还可以转移一个或多个基因座。遗传重排。是指可体内以及体外自发发生的遗传元件的重新组合,其引入了遗传物质的新组织。例如,在植物发育和有性重组过程中不同染色体基因座处的多核苷酸剪接在一起可在体内自发发生。因此,体外通过非自然的遗传修饰技术的遗传元件重组近似于也可通过体内有性重组发生的重组事件。金线虫。马铃薯金线虫(Globoderarostochiensis)(通称为金线虫)是影响马铃薯植物的根和块茎的植物寄生线虫。症状包括植物生长差、萎蔫、水胁迫和营养缺乏。下胚轴。下胚轴是胚或籽苗介于子叶与根之间的部分。因此,其可视为介于苗与根之间的过渡区。框内。核苷酸三联体(密码子)在植物细胞中翻译成所需重组蛋白质的新生氨基酸序列。具体而言,本发明设想在阅读框内连接至第二核酸的第一核酸,其中第一核苷酸序列为基因而第二核苷酸为启动子或类似的调控元件。整合。是指来自所选植物物种、或来自物种与所选植物相同的植物、或来自与所选植物物种性亲和的植物的核酸序列插入进所选植物物种的细胞的基因组中。“整合”是指仅天然的遗传元件掺入进植物细胞基因组中。为了整合天然遗传元件,例如通过同源重组,本发明可“利用”非天然DNA作为这种方法中的一个步骤。因而,本发明在特定DNA分子的“利用”与特定DNA分子“整合”进植物细胞基因组中之间做了区分。引入。如本文所用,是指核酸序列通过包括感染、转染、转化或转导在内的方法插入进细胞中。分离的。“分离的”是指与其正常的天然环境物理分离的任何核酸或化合物。分离的物质可维持在含有例如溶剂、缓冲剂、离子或其他组分的合适溶液中,并且可以是以纯化的、或不纯化的形式。前导序列。基因之前(或基因5’)的转录但未翻译的序列。基因座。基因座可赋予一个或多个性状,例如雄性不育性、除草剂耐性、抗虫性、抗病性、蜡质淀粉、改良的脂肪酸代谢、改良的植酸代谢、改良的碳水化合物代谢以及改良的蛋白质代谢。性状可以例如由通过回交、天然的或诱导的突变引入进品种的基因组中的自然存在的基因赋予,或由通过遗传转化技术引入的转基因赋予。基因座可包含在单个染色体位置处整合的一个或多个等位基因。商品产量。商品产量是直径介于2到4英寸的所有收获的块茎的重量。商品产量以cwt(百分比重量)测量,其中cwt=100磅。单子叶植物。其胚具有一片子叶的显花植物。单子叶植物的例子包括但不限于草皮草、玉蜀黍、水稻、燕麦、小麦、大麦、高粱、兰花、鸢尾属植物、百合、洋葱和棕榈树。天然的。“天然的”遗传元件是指天然存在于、起源于或属于待转化植物的基因组的核酸。因而,分离自待转化植物或植物物种的基因组或分离自与待转化植物物种性亲和或可杂交的植物或物种的任何核酸、基因、多核苷酸、DNA、RNA、mRNA或cDNA分子对所述植物物种而言是“天然的”,即原生的。换句话讲,天然遗传元件代表植物育种者可及以通过经典的植物育种改善植物的所有遗传物质。根据本发明天然核酸的任何变体也视为“天然的”。就此而论,“天然的”核酸也可分离自植物或其性亲和物种并且经修饰或突变以便所得的变体在核苷酸序列上与分离自植物的未经修饰的、天然核酸具有大于或等于99%、98%、97%、96%、95%、94%、93%、92%、91%、90%、89%、88%、87%、86%、85%、84%、83%、82%、81%、80%、79%、78%、77%、76%、75%、74%、73%、72%、71%、70%、69%、68%、67%、66%、65%、64%、63%、62%、61%或60%的相似性。天然核酸变体也可在核苷酸序列上具有少于约60%、少于约55%或少于约50%的相似性。分离自植物的“天然”核酸也可编码从该核酸转录并翻译的自然存在的蛋白质产物的变体。因而,天然核酸可编码在氨基酸序列上与在分离该核酸的植物中表达的未经修饰的、天然蛋白质具有大于或等于99%、98%、97%、96%、95%、94%、93%、92%、91%、90%、89%、88%、87%、86%、85%、84%、83%、82%、81%、80%、79%、78%、77%、76%、75%、74%、73%、72%、71%、70%、69%、68%、67%、66%、65%、64%、63%、62%、61%或60%的相似性的蛋白质。天然遗传元件。根据本发明可将“天然遗传元件”掺入和整合进所选择的植物物种基因组中。天然遗传元件分离自属于所选择的植物物种的植物或分离自与所选择的植物物种性亲和的植物。例如,掺入进栽培马铃薯(Solanumtuberosum)中的天然DNA可源自栽培马铃薯的任何基因型或与栽培马铃薯性亲和的野生马铃薯物种(例如S.demissum)的任何基因型。自然存在的核酸。自然存在的核酸存在于所选择的植物物种的基因组中并且可以是DNA分子或RNA分子。可将通常存在于植物物种的基因组中的限制性位点序列工程改造进外源DNA分子(例如载体或寡核苷酸)中,即使该限制性位点不与该基因组物理分离。因而,本发明允许合成产生核苷酸序列,例如限制性酶识别序列,只要该序列自然存在于所选择的植物物种的基因组中或者自然存在于与所选择的待转化的植物物种性亲和的植物中。有效连接。将两个或更多个分子以使得它们在组合中在植物细胞中正常发挥功能的方式组合。例如,当启动子控制结构基因的转录时,则该启动子有效连接至该结构基因。植物。如本文所用,术语“植物”包括但不限于被子植物和裸子植物如马铃薯、番茄、烟草、苜蓿、莴苣、胡萝卜、草莓、甜菜、木薯、甘薯、大豆、玉蜀黍、草坪草、小麦、水稻、大麦、高粱、燕麦、橡树、桉树、胡桃和棕榈树。因而,植物可以是单子叶植物或双子叶植物。如本文所用,单词“植物”还涵盖植物细胞、种子、植物子代、繁殖体(无论是通过有性生殖生成的还是通过无性生殖生成的)以及这些中任一者的后代,例如扦插物或种子。植物细胞包括悬浮培养物、愈伤组织、胚、分生组织区、愈伤组织、叶、根、苗、配子体、孢子体、花粉、种子和小孢子。植物可以处于各种成熟阶段并且可以在液体或固体培养中生长,或者在罐子、温室或田地中的土壤或合适介质中生长。引入的前导序列、尾部序列(trailer)或基因序列在植物中的表达可以是暂时的或永久的。“选择的植物物种”可以是但不限于这些“植物”中的任一者的物种。植物部分。如本文所用,术语“植物部分”(或马铃薯植物,或其部分)包括但不限于原生质体、叶、茎、根、根尖、花药、雌蕊、种子、胚、花粉、胚珠、子叶、下胚轴、花、块茎、芽眼、组织、叶柄、细胞、分生组织细胞等等。植物物种。属于各种官方命名的植物物种的植物群体,其展现出至少某些性亲和性。植物转化和细胞培养。广义地指将植物细胞进行遗传修饰并转移至适当的植物培养基以进行维持、进一步生长和/或进一步发育的过程。精确育种。是指通过将核酸,例如分离自所选择的植物物种、或分离自物种与所选择的植物相同的另一植物、或分离自与所选择的植物物种性亲和的物种的天然基因或调控元件引入进独立植物细胞中,并随后使这些经遗传修饰的植物细胞再生成整株植物来改良植物。因为没有未知的或外来的核酸被永久地掺入进植物基因组中,所以本发明技术利用也可通过常规植物育种可及的相同遗传物质。子代。如本文所用,子代包括由两株马铃薯植株杂交生成的F1马铃薯植株,其中至少一株植株包括马铃薯栽培种J3,并且子代还包括但不限于与回归亲本品系的后续F2、F3、F4、F5、F6、F7、F8、F9和F10世代杂交。数量性状基因座(QTL)。数量性状基因座(QTL)是指在一定程度上控制通常连续分布的可用数字代表的性状的遗传基因座。重组的。如本文所用,广义地描述借此可以克隆基因、可以对DNA进行测序以及可制备蛋白质产物的各种技术。如本文所用,该术语还描述已在基因转移进植物宿主系统的细胞中后产生的蛋白质。再生。再生是指从组织培养物发育植株。调控序列。是指标准的且本领域技术人员已知的可包括在表达载体中以增加和/或最大化植物系统中所关注基因的转录或所得的RNA的翻译的那些序列。这包括但不限于启动子、肽输出信号序列、内含子、多腺苷酸化位点和转录终止位点。用于修饰核酸构建体以增加在植物中的表达水平的方法也是本领域众所周知的(参见例如Rogersetal.,260J.Biol.Chem.3731-38,1985(Rogers等人,《生物化学杂志》,第260卷,第3731-38页,1985年);Cornejoetal.,23PlantMol.Biol.567:81,1993)(Cornejo等人,《植物分子生物学》,第567卷,第23期,第81页,1993年)。在工程改造植物系统以影响蛋白质的转录速率时,本领域已知的各种因素(包括调控序列如正向作用或负向作用序列、增强子和沉默子,以及染色质结构)可具有影响。本发明提供,这些因素中的至少一者可用于工程改造植物以表达所关注的蛋白质。本发明的调控序列是天然遗传元件,即分离自所选择的待修饰的植物物种。可选标记。“可选标记”通常是编码赋予某种类型的针对抗生素、除草剂或毒性化合物的抗性的蛋白质的基因,并且用于鉴定转化事件。可选标记的例子包括编码链霉素抗性的链霉素磷酸转移酶(spt)基因、将甘露糖-6-磷酸转化成果糖-6-磷酸的磷酸甘露糖异构酶(pmi)基因、编码卡那霉素和遗传霉素抗性的新霉素磷酸转移酶(nptII)基因、编码潮霉素抗性的潮霉素磷酸转移酶(hpt或aphiv)基因、编码磺酰脲类除草剂抗性的乙酰乳酸合酶(als)基因、编码针对用于抑制谷氨酰胺合酶的作用的除草剂如草丁瞵或basta的抗性的基因(例如bar基因)、或本领域已知的其他类似基因。有义抑制。通过在转基因植物中表达一个或多个额外拷贝的内源基因的全部或部分来减少该基因的表达。比重。如本文所用,“比重”是密度的表现并且为马铃薯品质的量度。在块茎比重与淀粉含量和干物质或总固形物的百分比之间存在高的相关性。较高的比重促成较高的回收率以及较好的加工品品质。T-DNA样。“T-DNA样”序列为分离自所选择的植物物种、或分离自与所选择的植物物种性亲和的植物,并且与农杆菌物种T-DNA具有至少75%、80%、85%、90%或95%但非100%序列同一性的核酸。T-DNA样序列可含有一个或多个边界或边界样序列,其各自能使核苷酸序列整合进另一多核苷酸中。总产量。总产量是指全部收获的块茎的总重量。尾部序列。基因之后(或基因3’)的转录但未翻译的序列。转录的DNA。既含有基因又含有与该基因相关的非翻译前导序列和尾部序列的DNA,其通过前面的启动子的作用转录为单条mRNA。植物细胞的转化。DNA稳定整合进植物细胞基因组中的过程。“稳定”是指多核苷酸在细胞基因组中永久或非暂时的保留和/或由细胞基因组永久或非暂时的表达。因而,稳定整合的多核苷酸是这样一种核苷酸:其为转化细胞基因组内的固定物并且可以复制和遗传到该细胞或所得的转化植株的后续子代。转化可使用本领域熟知的各种方法在天然或人工条件下进行。转化可依靠任何已知的用于将核酸序列插入进原核或真核宿主细胞中的方法,包括农杆菌介导的转化规程、病毒感染、晶须法(whiskers)、电穿孔、热休克、脂质转染、聚乙二醇处理、显微注射和粒子轰击。转基因。将要插入进宿主基因组中的基因,包含蛋白质编码区。在本发明的上下文中,包含转基因的元件分离自宿主基因组。转基因植物。含有至少一个转基因的经遗传修饰的植物。变体。如本文所用,“变体”理解为意指偏离特定基因或蛋白质的标准的或给定的核苷酸或氨基酸序列的核苷酸或氨基酸序列。术语“同等型”、“同种型”和“类似物”也指核苷酸或氨基酸序列的“变体”形式。通过添加、移除或置换一个或多个氨基酸进行变更的氨基酸序列,或核苷酸序列的改变可视为“变体”序列。变体可具有“保守”改变,其中置换的氨基酸具有类似的结构或化学特性,例如用异亮氨酸替代亮氨酸。变体可具有“非保守”改变,例如用色氨酸替代甘氨酸。类似的微小变异还可包括氨基酸缺失或插入或这二者。确定哪个氨基酸残基可以被置换、插入或缺失的指导可使用本领域熟知的计算机程序如VectorNTISuite(InforMax,MD)软件找到。藤成熟度。藤成熟度是指植物继续利用碳水化合物和进行光合作用的能力。藤成熟度在1至5的范围内打分,其中1=死藤,而5=藤绿色,仍开花。所需性状插入进马铃薯植物的基因组中是特别困难的,因为马铃薯是四倍体的、高度杂合的并且对近交衰退敏感。因此,在通过常规育种进行加工的过程中,很难有效培育出可生成较少丙烯酰胺和较少有害美拉德反应产物的转基因马铃薯植物,所述美拉德反应产物包括N-亚硝基-N-(3-酮基-1,2-丁二醇)-3'-硝基酪胺(Wangetal.,ArchToxicol70:10-5,1995(Wang等人,《毒理学文献》,第70卷,第10-5页,1995年))、5-羟甲基-2-糠醛(Janzowskietal.,FoodChemToxicol38:801-9,2000(Janzowski等人,《食品与化学品毒理学》,第38卷,第801-809页,2000年))以及其他具有突变特性的美拉德反应产物(Shibamoto,ProgClinBiolRes304:359-76,1989(Shibamoto,《临床与生物学研究进展》,第304卷,第359-376页,1989年))。已经测试了若干方法并且正在进行研究以通过工艺改变、右旋糖减少以及添加剂如天冬酰胺酶、柠檬酸盐和竞争性氨基酸来减少丙烯酰胺。在整个马铃薯产业中实施工艺改变所需的资本支出将耗费数百万美元。除了费用以外,工艺改变具有明显的缺点,包括与添加剂如天冬酰胺酶或柠檬酸盐相关的潜在不好的味道。通常,油炸食品制造商在炸薯条加工的过程中添加右旋糖来产生所需的金黄色,但右旋糖还可通过美拉德反应增加丙烯酰胺的形成。在该过程中仅省去右旋糖,会使丙烯酰胺显著减少;但标志性的金黄色稍后必须通过一些其他方式形成(例如通过添加色素如胭脂树红)。替代性色素的使用导致缺少通过那些褐变反应形成的典型味道。使用添加剂来减少像天冬酰胺之类的反应物的另一挑战是冷冻保存期间发生的水分迁移,结果是天冬酰胺返回至表面而增加丙烯酰胺。最后,在马铃薯擦伤后发生的变黑影响在加工炸薯条和薯片过程中的品质和回收率。在加工之前必须对损坏和擦伤的马铃薯进行修整或不要,从而导致质量挑战或经济损失。本发明的“天然技术”策略通过减少多酚氧化酶-5(PPO-5)(其为造成黑斑擦伤的原因)的表达、天冬酰胺合成酶-1(Asn-1)(其为造成天冬酰胺积聚的原因,天冬酰胺为丙烯酰胺形成的前体)的表达和/或磷酸化酶-L和激酶-R1(它们为与还原糖积聚相关的酶,还原糖通常与氨基酸如天冬酰胺反应,并形成毒性美拉德产物,包括丙烯酰胺)的表达解决了马铃薯产业对改善马铃薯农艺特性和营养价值的需要。块茎中这些基因的部分沉默或完全沉默可降低产生丙烯酰胺的可能性。使用本发明的天然技术使得能通过仅仅用“天然”遗传物质转化有商业价值的马铃薯植物品种而使所需性状掺入进该马铃薯的基因组中,所述“天然”遗传物质是从马铃薯植物或与马铃薯植物性亲和的植物获得的遗传物质,其仅含有非编码调控区,没有任何外来遗传物质整合进该植物的基因组中。所需的性状包括对碰撞诱导的黑斑擦伤的高耐受性、丙烯酰胺前体天冬酰胺形成减少以及还原糖积聚减少(伴随后续的毒性美拉德产物(包括丙烯酰胺)的积聚降低)、改善的品质和食品颜色控制。这些所需性状掺入进现有的马铃薯品种中不可能通过传统的育种来实现,因为马铃薯为四倍体、高度杂合的,并且对近交衰退敏感。本发明中所用的非编码马铃薯植物DNA插入序列是马铃薯植物基因组天然的并且不含有任何农杆菌DNA。DNA插入物优选包含两个表达盒并且插入进称为pSIM1278转化载体的转化载体中。第一表达盒包含天冬酰胺合成酶-1基因(Asn1)和多酚氧化酶-5基因(Ppo5)二者的片段,所述片段在ADP葡萄糖焦磷酸化酶基因(Agp)的Agp启动子与颗粒结合合酶基因(Gbss)的Gbss启动子之间以反向重复排列。这些启动子主要在块茎中有活性。第二表达盒的功能是使淀粉相关基因二激酶-R1(R1)和磷酸化酶-L基因(PhL)的启动子沉默。该表达盒由淀粉相关基因二激酶-R1(R1)和磷酸化酶-L基因(PhL)的启动子的片段构成,所述片段有效连接至与第一表达盒相同的Agp和Gbss启动子。这些表达盒不含外来DNA,并且仅由来自所选植物物种或来自与所选植物物种性亲和的植物的DNA组成。用于本发明的有商业价值的马铃薯植物品种是Atlantic。Atlantic植株为中等大小,具有直立的粗茎和轻微膨胀、疏生短柔毛的节点。其叶为亮到中绿色,叶面光滑,被适度短柔毛,带突出翼瓣,包括大的不对称一级叶片以及多个二级和三级叶片。其花具有被短柔毛的绿色锥形萼裂片、淡紫色花冠、橙色花药和丰富的可育花粉。Atlantic栽培种可抗疮痂病和黄萎病,抗粉红芽眼,并且高度抗A型金线虫、病毒、块茎网形坏死病和黑斑擦伤。Atlantic的块茎易于发生内部热坏死,尤其是在温暖干燥季节的砂质土壤中。在一些生长区域,较大直径块茎(>0.83mm)的空心病可能会很严重。块茎为椭圆形至圆形,并具有轻度到重度的鳞状网格薯皮、适度浅的芽眼和白色薯肉,并且块茎休眠期为中等长度。Atlantic具有高产潜力、高比重以及均匀的块茎大小和形状,是来源于田地或储存期极短的用于炸片加工的标准品种(Webb等人,1978)。该品种是可育的,主要生长在东北和东南地区,专用于生产薯片。本发明提供了具有重要市场价值的马铃薯品种,即Atlantic,其使用转化载体pSIM1278转化而成,通过聚合酶链反应而不是标记鉴定,并成功繁殖。还提供了由本发明的马铃薯植物品种J3的块茎制成的食品。马铃薯栽培种J3具有由经济合作与发展组织(OECD)认证的以下唯一植物品种标识符:使用天然DNA实现的定向基因沉默降低了马铃薯植物品种J3的块茎中靶标基因的RNA转录物水平。Asn1和Ppo5基因沉默足以显著减少丙烯酰胺形成二到四倍而不另外抑制淀粉相关基因激酶R1(R1)和磷酸化酶-L(PhL)。因此,本发明的转入杂交亲和物种基因的马铃薯植物品种J3的块茎掺入了高度期望的性状,包括较低比率的游离酰胺氨基酸天冬酰胺和谷氨酰胺,这与煎炸或烘培后减少的丙烯酰胺形成相关。具体地讲,本发明的马铃薯品种J3的特征在于游离天冬酰胺的含量降低至1/2到少于1/4。此外,本发明的马铃薯品种J3在储存期间显示出淀粉降解为还原糖(葡萄糖和果糖)的延迟。淀粉向糖转化的削弱还可降低衰老甜化和丙烯酰胺形成并可限制热诱导的褐变。因此,本发明的马铃薯品种J3在马铃薯工业和食品市场中极具价值,这是因为其块茎在热加工后产生的丙烯酰胺大大减少并且不携带任何可能有害的外来基因。实例本发明技术使用天然技术来使天然非编码DNA整合进所选择的马铃薯植物品种的基因组中以开发新的转入杂交亲和物种基因的马铃薯植物品种。该方法包括性状鉴定、载体设计、载体掺入农杆菌中、选择受体马铃薯品种、植物转化、开放阅读框缺少的证据以及确认新马铃薯植物品种仅含有该天然DNA。本发明的马铃薯栽培种J3形成丙烯酰胺的可能性较小,并且与其未转化的对应物相比蔗糖含量较低。实例1.pSIM1278转化载体用于本发明的转化载体pSIM1278源自pSIM106,pSIM106通过这样产生:将一0.4kb马铃薯植物DNA片段(以GenBank登录号AY566555保藏)与pCAMBIA1301(CAMBIA,澳大利亚堪培拉市(Canberra,Australia))的一5.9kbSacII-SphI片段连接,该SacII-SphI片段携带来自质粒pVS1和pBR322的细菌复制起始区,以及细菌抗卡那霉素的nptIII基因。将一表达盒作为一2.6kbSacII片段引入该载体骨架中(Rommens等人,2004),该表达盒包含前接Ubi-3启动子(Garbarino和Belknap,1994)并且后接Ubi-3终止子的农杆菌ipt基因。将携带两个沉默盒的一天然10kbDNA片段插入进pSIM106的DNA插入物中,得到pSIM1278。该载体用于全部转化。pSIM1278载体图谱示于图1.载体骨架区为9,511bp,在位置9,957bp处开始并在位置19,468bp处结束。该骨架DNA主要由细菌DNA组成并且在植物转化之前支持DNA插入物的维持。骨架部分未转移进植物细胞中。该骨架的各元件在表1中描述。表1实例2.植物DNA插入物及其开放阅读框(ORF)用于pSIM1278中的DNA插入区(包括旁侧边界序列)为10,147bp长,从19,469bp到19,660bp以及从1bp到9,956bp。该DNA插入物仅由天然DNA组成并且稳定地整合进马铃薯基因组中。该DNA插入物及其功能性部分为载体pSIM1278中整合进本发明的马铃薯植物品种中的唯一遗传物质。该DNA插入物示于下面的图2和表2中。表2用于构建本发明的马铃薯品系J3的表2所示DNA插入物不激活相邻基因,并且不会对马铃薯植物品种J3的表型造成不利影响。此外,本发明的马铃薯植物品种J3未产生与DNA插入物编码的开放阅读框相关的新型蛋白质。实例3.农杆菌菌株和转染通过精确地缺失超毒力质粒pTiBo542的转移DNA而发展出C58衍生的农杆菌菌株AGL1(Lazo等人,1991)。常见重组基因(recA)中的转座子插入使诸如pSIM1278的重组质粒载体稳定(图1)。AGL1表现出针对羧苄青霉素和利福平的抗性,并且用特美汀(timentin)将其从转化的马铃薯组织消除。Atlantic品种的母株维持在装有40ml半强度M516培养基的Magenta盒子中,该培养基包含3%蔗糖和2g/lgelrite(繁殖培养基)。从四周龄植物切取4到6毫米的马铃薯节间节段,用携带pSIM1278的农杆菌AGL1菌株感染,并转移至含有3%蔗糖和6g/l琼脂的组织培养基(共培养培养基)。两天后,将感染的外植体转移至含有3%蔗糖、6g/l琼脂和150mg/l特美汀的M404培养基(无激素培养基)以消除农杆菌。该方法的细节在Richael等人(2008)中有所描述。一个月以后,将感染的外植体转移至缺少任何合成激素的新鲜培养基并在Percival生长室中在16小时光周期下于24℃温育,其中它们开始形成苗。许多苗表达ipt基因并表现出细胞分裂素过度产生表型;这些苗不考虑用于进一步分析。PCR基因型分析证明,其余苗的约0.3至1.5%含有P-DNA的至少一部分而同时缺少ipt基因。因而,没有标记被用于选择转化植物。有关基于ipt的无标记植物转化的细节已在Richael等人(2008)中公布。消除农杆菌的过程在外植体感染后两天开始。为此,使组织经受抗生素特美汀(150mg/L)处理直到证明没有活的农杆菌。证据通过将转化事件的茎节段在营养肉汤-酵母提取液(NBY培养基)上于28℃温育2周(重复两次)获得。根据97CFRPart340,仅在没有活的农杆菌时将转化的植物运送并种植于田地中。通过DNA凝胶印迹分析对马铃薯植物品种J3进行分析,以确定整合的DNA插入序列的结构和拷贝数并证实载体骨架序列的缺失。此外,将分子表征用于确定该DNA插入物旁侧的接合点的序列以及显示插入的DNA的稳定性。接合点的测序信息提供了用以针对转入杂交亲和物种基因的马铃薯植物品种J3开发特异性PCR测试的基础。据发现,马铃薯栽培种J3包含在左边界侧反向连接的一个近乎完整的DNA插入物和一个部分拷贝的DNA插入物,其中缺失LB区和相邻AGP启动子的一部分,如当各种DNA消化物与AGP、ASN、PHL和GBS分子探针杂交时从杂交结果推导出的那样。实例4.缺少载体骨架DNA的证据与许多商业转基因作物不同,本发明的马铃薯栽培种J3被证实不含用于转化的由农杆菌衍生的DNA序列,例如载体骨架DNA,采用了如下三种不同方法:1)首先,确定异戊烯异构酶(ipt)负可选标记基因在载体骨架中的存在与否,因为意外从农杆菌转移包含ipt基因表达盒的骨架DNA至植物细胞将引发ipt基因表达,并因此引发细胞分裂素类型激素异戊烯腺苷的形成,2)然后将DNA印迹杂交用于已通过第一个筛选方法的转化马铃薯植物以确认骨架DNA的不存在,以及3)然后设计PCR来扩增可指示DNA插入物边界区与旁侧骨架DNA之间的接合点或骨架DNA内处于DNA插入物旁侧的区域的片段。该方法的功效通过将pSIM1278DNA用作阳性对照来确认。本发明的马铃薯栽培种J3未产生指示载体骨架DNA的存在的PCR条带。实例5.插入的DNA的稳定性使用DNA凝胶印迹杂交和性状评价二者,在初始的转化株中并然后再在繁殖的植物材料中评价了DNA插入物的稳定性。进行这些研究以确保转入杂交亲和物种基因的事件以一致且可靠的方式表达掺入的性状。不稳定性可通过罕见的重组事件引发或者也可由甲基化引起。因为马铃薯通常是无性繁殖,因此用于有性繁殖作物的标准评估不是直接适用的,将块茎而不是种子用于定义后代。DNA印迹杂交的结果证明,在多个世代中存在连续的条带,从而表明了稳定性。通过在第一代和第二代块茎种子中确认性状功效获得了稳定性的进一步证据。通过提取并评价来自体外繁殖并且从未在土壤中种植的植物的叶子的DNA,在初始转化的材料(G0)中证明了DNA插入物稳定性。对于第一代(G1)分析,将来自各转入杂交亲和物种基因的品种的两株繁殖植物和来自各对照的一株植物种植于温室中;将从各植物收获的块茎中的一者进行种植以从G1植物获得叶子,将该叶子用于分离DNA并评价G1代。再次种植来自该代的块茎,将所得的G2植物的叶子用于进行该世代的表征。在所有泳道中,从本发明的Atlantic马铃薯栽培种J3分离出的DNA与GBS探针的杂交显示具有三根共有条带(8.6kb、7.8kb和7.1kb),并且与AGP探针的杂交显示具有四根条带(7.2kb、5.0kb、2.0kb和1.4kb)。这些条带可指示未经修饰的基因组的DNA片段。从所有转入杂交亲和物种基因的材料分离出的DNA中三根额外条带(其中一根为2.2kb的条带,指示内部DNA插入片段;另外两根表示DNA插入物连接片段(在与GBS的杂交中,为5.9kb和约13kb;在与AGP的杂交中,为1.6kb和5.7kb))的存在指示初始转化株(G0)的插入物在第一无性世代G1和第二无性世代G2中保持稳定。AtlanticG2块茎不能使用儿茶酚检测法分析Ppo活性,因为未转化的Atlantic品种的切割块茎表面在暴露于儿茶酚时不能显影棕色沉淀剂。可能的是,未转化的Atlantic马铃薯不产生催化多酚氧化的酶。取而代之的是,通过PCR分析来证明插入的DNA的稳定性,结果表明,J3块茎包含扩增的0.8kb产物并且未表现出G2块茎中的不稳定性,所述产物是Asn1/Ppo5基因的一部分。实例6.接合点分析和品种特异性检测至少一个DNA插入物/旁侧植物DNA接合点用接头连接介导的PCR或热不对称交错PCR进行了测序。使用连接序列设计马铃薯栽培种J3的引物,并且这些引物被应用于品种特异性的基于PCR的检测方法。可使用引物扩增464kb的J3特异性DNA片段,得到用于品种J3的品系特异性测试方法。将开发的方法用于监测田地和储存中的植物和块茎以确认块茎或加工的食品中转入杂交亲和物种基因的材料的不存在,以及确保有机种植的纯净。实例7.基因沉默的功效和组织特异性利用基因沉默方法降低Asn1、Ppo5、PhL和R1天然蛋白质的活性,并评价转录物水平而不是蛋白质含量,以将新的表型性状与分子水平的变化相关联。因为涉及叶子和茎中的ASN(天冬酰胺)形成的Asn1基因的强沉默可能会不利地影响生长,所以将Agp启动子和Gbss启动子(其为块茎特异性启动子和匍匐茎特异性启动子并且在光合作用活跃组织和根中活性低很多)用于驱动块茎和匍匐茎中的基因沉默。通过RNA印迹分析确定植物品种J3及其未转化的对应物的不同组织中的四个靶标基因的转录物水平。在未转化的对照的块茎中,对于Asn1、PhL和R1基因,转录物水平“高”(可通过RNA印迹杂交容易地检测),对于Ppo5基因转录物水平“低”。将RNA印迹分析进行比较表明,在来自温室和田间的块茎中Asn1、Ppo5和PhL以相似水平表达。相比之下,在温室培养的对照块茎中比在来自田间的块茎中R1基因得到稍微更有效的沉默。品种J3的块茎中Asn1和Ppo5基因的转录物水平大幅降低与产生丙烯酰胺的低可能性相关联。品系J3的块茎中PhL基因的转录物水平部分降低。该变化与葡萄糖和果糖的量降低相关联。J3块茎中的R1转录物部分减少(“降低”),有助于限制淀粉降解成糖。在未转化的植物的匍匐茎中Asn1、Ppo5和R1基因以低水平表达。相比之下,对照中的高转录物水平与PhL基因相关。在转入杂交亲和物种基因的品种J3的匍匐茎中,PhL基因的表达也被下调。品种J3的匍匐茎中的R1基因的转录物含量轻微减少(“降低”)。该分子改变有助于限制淀粉降解成糖。品系J3与其未转化的对应物的叶组织中的Asn1基因转录物水平类似。在所有情况下,均未检测到用于Ppo5基因表达的转录物水平,而PhL基因的含量在初始品种Atlantic和转化后的衍生物J3中始终较高。与其对照相比,品种J3中的R1基因的转录物水平保持不变。在茎组织中,事件J3与其对照的Asn1基因转录物水平类似。在本发明的品种J3中,Ppo5基因的转录物水平降低。品系J3与其对照的PhL基因表达非常类似,并且R1基因表达未降低。在品种J3的根组织中,Asn1和Ppo5基因的转录物水平均降低。这些结果表明,用于驱动沉默的启动子在地下组织中具有部分功能。本发明的品种J3的花组织中的Asn1基因转录物水平比初始品种Atlantic低。未检出Ppo5基因的转录物,并且PhL和R1基因的表达水平与对照类似。这些结果表明,马铃薯品种J3的块茎和匍匐茎中的Asn1和Ppo5基因的表达水平被下调,并且R1和PhL基因在品种J3的块茎和匍匐茎中至少部分地沉默。沉默在块茎和匍匐茎中最有效。所选马铃薯品种J3在Asn1和Ppo5基因的表达水平方面受到的影响比在R1和PhL基因的表达水平方面受到的影响强。这些结果与本发明人的如下意图相一致:(1)以最大可能的程度防止Ppo蛋白和游离ASN的形成,以及(2)仅仅部分阻断淀粉向葡萄糖和果糖的转化。转录物水平在除了块茎和匍匐茎之外的组织中的偶尔改变证明了块茎/匍匐茎特异性启动子有一定渗漏。还有可能的是,块茎中通过沉默盒的表达产生的小RNA迁移进其他组织中,尤其是根和茎中(Molnar等人,2010)。在除了块茎和匍匐茎之外的组织中表达水平改变的大多数情形中,差异较小。在转入杂交亲和物种基因的马铃薯栽培种J3的特定组织中的下调转录物水平汇总示于表3中。在表3中,A=Asn1,P=Ppo5,L=PhL,R=R1。表3中带下划线的字母指示下调基因表达水平。表3品种块茎匍匐茎根茎叶花J3APLRAPRAPLRA实例8.田间表现和块茎评价2009、2010和2011年的试验用机械化种植以方便收获并且确保转入杂交亲和物种基因的马铃薯保持与未修饰材料分离。对于2009年的评价,将来自每个事件和对照品种的“核心种子(nuclearseed)”微型种薯(minituber)用于种植四到五个单行样区(single-rowplot)(20个微型种薯/样区),其中样区随机分布在整个田地的区组内。该随机化完全区组设计(RCB)对于新马铃薯品种和事件而言是典型的。在2010年和2011年进行的方法是每个点每个事件和对照使用三个随机样区,还使用了重复数(每个事件的样区数)等于区组数的RCB。2010年的每个样区包括三行、每行20个种子片,均来自2009年在内布拉斯加州切里县(CherryCounty,NE)生产的Atlantic的“核心种子”微型种薯。用于2011年试验的Atlantic种子是2010年在内布拉斯加州切里县(CherryCounty,NE)生产的第一代(G1)。在所有试验中,转入杂交亲和物种基因的品系的种子类似于其未经修饰的对照进行处理。田间生长的块茎比微型种薯更合适作为种子,因为它们生成更有活力且更均一的产生更高块茎产量和品质的植物。针对对昆虫、病害和环境胁迫的差异性响应对每个样块进行定性评价(在一些情形中使用标准化的监测尺度),所述环境胁迫不是人工诱导的而是在生长季节期间可能自发出现的。在2009、2010和2011年刚好在早期行铺满(rowclosure)和开花之前或在早期行铺满和开花期间(对于大多数试验在六月到七月,弗罗里达的试验除外,其在四月进行评价)进行季节中期监测,以评估植物活力、叶颜色、叶尺寸、叶卷曲、病害症状(存在/不存在),以及昆虫相关的植物损害。在2011年,对生长区域普通的特定昆虫、病害和非生物胁迫因素进行评价。在季节中期和晚期期间病害和昆虫压力通常是最高的,但从七月到九月(对于弗罗里达的试验是从三月到五月)针对病原体和昆虫引起的症状对植物进行监测。在杀藤(旨在确保块茎成熟和季节晚期表皮长好(skinset)的过程)之前进行藤成熟度和病害的季节晚期监测。藤杀死通过收割或扑打藤或通过根据制造商的建议(明尼苏达州罗斯维尔市(Roseville,MN)的JRJohnson公司)使用批准的除草剂如Reglone来诱导。在此时,还针对病害症状和昆虫损害对植物进行评估。在鉴别了病害症状时的一些情形中,还进行发芽测试以确认该发现。使用JMP9.0.2计算了平均值、标准偏差和90%置信区间。通过获得实验中包括的所有常规品种的最小和最大平均值(年份*位置*条目(entry))生成常规品种范围。在JMP9.0.2中,通过合并多年多个位置的数据,分析Atlantic品种的所有特性。实例9.马铃薯栽培种J3特征汇总马铃薯品种J3通过降低反应物(即,天冬酰胺)的浓度来减少丙烯酰胺的形成,同时减少糖的形成,从而满足了马铃薯产业提高质量的需求。马铃薯品种J3使用马铃薯植物基因组天然的核酸序列进行转化,并且不包含外来DNA、农杆菌DNA、病毒标志物或载体骨架序列。此外,进行农艺学研究以确保该事件以与常规对照相同的方式生长,但与性状相关的特性除外。农艺学特性对2009年、2010年和2011年生长的马铃薯品种J3事件和对照的农艺学特性的评价示于表4至表7中。在可能的情况下通过统计方法分析了结果。总体数据表明,在Atlantic对照与J3Atlantic事件之间没有重大差异。表4示出了针对品种J3测试的每种特性的位点-年数目。J3和Atlantic对照的农艺学特性示于表5中。其中五种农艺学特性在J3与对照之间未检测出统计意义上的显著差异。叶片卷曲和藤成熟度等级数据不能进行统计学比较,因为J3的叶片卷曲平均值与对照相同,并且J3的观测值在常规品种总范围之外(分别为2.89与3.00-3.50)。在J3与对照之间检测出每株植物的茎(3.42与3.14)和衰老(52.37与47.37)存在统计意义上的显著差异;然而,在两种情况下,J3的值均在常规品种范围内。在表5中,每株植物的茎和最终出苗数据仅来自2011年的记录;常规品种(ConV)范围等于常规的Ranger、Burbank和Atlantic品种的平均值范围;NA表示不能进行统计学比较。J3和Atlantic对照的产量和等级特性示于表6中。在总产量、A级%、拣选率(pickouts)%或总内部缺陷方面未检测出统计意义上的显著差异。无法对B级%进行统计分析,但J3的平均值在常规的品种范围内。在J3和对照之间检测到三方面的统计意义上的显著差异:U.S.#1(分别为84.7与87.1)、过大率%(5.4与8.3)和比重(1.094与1.092)。在这些差异方面,J3的所有值均在常规品种范围内。在表6中,常规品种(ConV)范围等于常规的Ranger、Burbank和Atlantic品种的平均值范围;NA表示不能进行统计学比较。J3和Atlantic对照的花颜色示于表7中。对于每个条目,在不同样区中观察到紫色和混合的花颜色。表4表5表6表7基于表4至表7提供的关于马铃薯栽培种J3的数据,可以推断出,未转化的Atlantic品种与马铃薯栽培种J3之间在农艺学特性、花颜色、产量和等级、以及生态相互作用方面没有重大差异。因此,基于多年的数据,Atlantic品种J3不会因杂草性或产生植物害虫的可能性而在环境方面造成重大的持久性风险。天冬酰胺和丙烯酰胺水平天冬酰胺合成酶基因的沉默导致马铃薯品种J3中游离天冬酰胺平均减少77%。较低的天冬酰胺水平(其在美拉德反应中与还原糖化合而形成丙烯酰胺)导致炸薯条中平均减少67%的丙烯酰胺。Atlantic对照与马铃薯J3在天冬酰胺和丙烯酰胺方面的差异示于表8中。在测试丙烯酰胺之前,将对照和J3制成炸薯条。所有结果均来自收获不久时分析的块茎。表8马铃薯栽培种J3是具有改进质量的Atlantic品种,其具有降低的丙烯酰胺水平。本发明的另外的实施例得到组合了上面提及的有利特性的马铃薯品种的研究大部分是经验性的。该研究需要大量投入时间、劳力和金钱。马铃薯栽培种的开发从温室到商业利用通常耗费八年或更久。育种始于对优异亲本的仔细选择以将最重要的特性掺入子代中。因为所有所需性状通常并不通过仅一次杂交而出现,所以育种必须是累积的。当前的育种技术一直是对亲本克隆进行控制授粉。通常,花粉收集于明胶胶囊中以供后面用于对母本进行授粉。将杂种种子播种于温室中并从数以千计的独立籽苗收获块茎并保留。下一年,将来自每株所得籽苗的一到四个块茎种植于田地中,其中要极其小心以避免病毒和病害传播。从该第一年的籽苗作物,来自每个杂种个体(其通过了选择过程)的数个“种子”块茎被保留用于下一年的种植。在第二年之后,获取样品以供密度测量以及煎炸测试来确定块茎对于商业利用的合适性。然后将到目前为止已通过选择过程的植物以扩大量种植第三年,以供更复杂的一系列煎炸测试和密度测定。在开发的第四年阶段,将存留下来的选择株在数个州接受田间试验,以确定它们对不同生长条件的适应性。最终,将具有优异品质的品种转移至其他农场并将种子增加至商业规模。一般而言,到此时,已经投入了八年或更多年的种植、收获和测试以图开发新的且改良的马铃薯栽培种。随着使得能对编码特定蛋白质产物的基因进行分离和表征的分子生物学技术的出现,植物生物学领域中的科学家在工程改造植物基因组以含有和表达外来基因、或者天然或内源基因的额外形式或修饰形式(或许通过不同的启动子驱动)以通过特定方式改变植物的性状方面产生了强烈的兴趣。这种外来的额外的和/或经修饰的基因在本文中统称为“转基因”。在最后的十五到二十年间,已经开发了若干用于产生转基因植物的方法,并且在特定的实施例中,本发明还涉及要求权利保护的品种或品系的转化形式。植物转化涉及构建将会在植物细胞中有功能的表达载体。这样一种载体包含DNA,该DNA包含处于调控元件(例如启动子)的控制下的基因,或与调控元件(例如启动子)有效连接的基因。表达载体可以含有一个或多个这种有效连接的基因/调控元件组合。载体可以是以质粒的形式,并且可以单独使用或与其他质粒组合使用,以利用下面描述的将转基因掺入进马铃薯植物的遗传物质中的转化方法来提供转化的马铃薯植物。传统的植物育种通常依赖于植物染色体的随机重组来产生具有新的且改良的特性的品种。根据标准的、众所周知的技术,包含基因和调控元件的遗传“表达盒”插入在农杆菌分离的转移DNA(T-DNA)的边界序列内并整合进植物基因组中。农杆菌介导的T-DNA物质的转化通常包括如下标准程序:(1)体外重组遗传元件以产生用于转化选择的表达盒,所述遗传元件的至少一者是外源的,(2)将该表达盒(通常与至少一个含有外来DNA的其他表达盒一起)插入进二元载体的T-DNA区中,所述二元载体通常由旁侧为T-DNA边界序列的数百个碱基对的农杆菌DNA组成,(3)位于T-DNA边界序列之间的序列(通常伴随有来自农杆菌的额外二元载体序列的一些或全部)转移至植物细胞,以及(4)选择表现出所需性状(如产量增加、活力改善、对病害和昆虫的抗性增强或者在胁迫下存活的能力更强)的稳定转化的植物细胞。因而,遗传改造方法依赖于引入外来的非原生核酸,包括调控元件如启动子和终止子,以及来自病毒、细菌和植物的涉及作为转化株的鉴定和选择的标记的新性状或功能的表达的基因。标记基因通常源于细菌来源并且赋予抗生素或除草剂抗性。经典的育种方法是费力费时的,并且新品种通常仅表型出相对适度的改善。在该“反义”技术中,将天然基因的序列反转以沉默转基因植物中的基因的表达。然而,反向DNA通常含有插入在启动子和终止子之间的新的未表征的开放阅读框,这些开放阅读框编码外来氨基酸序列,所述氨基酸序列可能是不期望的,因为它们干扰植物发育和/或降低其营养价值。用于马铃薯转化的表达载体:标记基因表达载体包括至少一个与调控元件(例如启动子)有效连接的遗传标记,该遗传标记使得含有该标记的转化细胞能通过负向选择(即抑制不含该可选标记基因的细胞的生长),或通过正向选择(即针对该遗传标记编码的产物进行筛选)进行回收。用于植物转化的许多通常使用的可选标记基因是转化领域熟知的,并且包括例如编码通过代谢使选择性化学剂(其可以是抗生素或除草剂)解毒的酶的基因,或编码对抑制剂不敏感的变更的靶标物的基因。许多正向选择方法也是本领域已知的。用于植物转化的一种通常使用的可选标记基因是新霉素磷酸转移酶II(nptII)基因,其在处于植物调控信号的控制下时,赋予针对卡那霉素的抗性。Fraleyetal.,Proc.Natl.Acad.Sci.U.S.A.,80:4803(1983)(Fraley等人,《美国国家科学院院刊》,第80卷,第4803页,1983年)。另一通常使用的可选标记基因是潮霉素磷酸转移酶基因,其赋予针对抗生素潮霉素的抗性。VandenElzenetal.,PlantMol.Biol.,5:299(1985)(VandenElzen等人,《植物分子生物学》,第5卷,第299页,1985年)。赋予抗生素抗性的细菌起源的其他可选标记基因包括庆大霉素乙酰转移酶、链霉素磷酸转移酶和氨基糖苷-3'-腺苷酰转移酶、博来霉素抗性决定子。Hayfordetal.,PlantPhysiol.86:1216(1988)(Hayford等人,《植物生理学》,第86卷,第1216页,1988年);Jonesetal.,Mol.Gen.Genet.,210:86(1987)(Jones等人,《分子和普通遗传学》,第210卷,第86页,1987年);Svabetal.,PlantMol.Biol.14:197(1990)(Svab等人,《植物分子生物学》,第14卷,第197页,1990年);Hilleetal.,PlantMol.Biol.7:171(1986)(Hille等人,《植物分子生物学》,第7卷,第171页,1986年)。其他可选标记赋予针对除草剂如草甘膦、草铵膦、溴草腈的抗性。Comaietal.,Nature317:741-744(1985)(Comai等人,《自然》,第317卷,第741-744页,1985年);Gordon-Kammetal.,PlantCell2:603-618(1990)(Gordon-Kamm等人,《植物细胞》,第2卷,第603-618页,1990年);以及Stalkeretal.,Science242:419-423(1988)(Stalker等人,《科学》,第242卷,第419-423页,1988年)。非细菌起源的用于植物转化的可选标记基因包括(例如)小鼠二氢叶酸还原酶、植物5-烯醇丙酮莽草酸-3-磷酸合酶和植物乙酰乳酸合酶。Eichholtzetal.,SomaticCellMol.Genet.13:67(1987)(Eichholtz等人,《体细胞和分子遗传学》,第13卷,第67页,1987年);Shahetal.,Science233:478(1986)(Shah等人,《科学》,第233卷,第478页,1986年);Charestetal.,PlantCellRep.8:643(1990)(Charest等人,《植物细胞报告》,第8卷,第643页,1990年)。用于植物转化的另一类标记基因需要针对对毒性物质如抗生素的抗性筛选推定转化的植物细胞而不是直接遗传选择转化的细胞。这些基因尤其可用于对特定组织中基因表达的空间模式进行定量或可视化,并且常常称为报告基因,因为它们可融合至基因或基因调控序列以供基因表达的调查研究。用于筛选推定转化的细胞的通常使用的基因包括β-葡萄糖醛酸苷酶(GUS)、β-半乳糖苷酶、荧光素酶和氯霉素乙酰转移酶。Jefferson,R.A.,PlantMol.Biol.Rep.5:387(1987)(Jefferson,R.A.,《植物分子生物学报告》,第5卷,第387页,1987年);Teerietal.,EMBOJ.8:343(1989)(Teeri等人,《欧洲分子生物学学会杂志》,第8卷,第343页,1989年);Konczetal.,Proc.Natl.Acad.Sci.USA84:131(1987)(Koncz等人,《美国国家科学院院刊》,第84卷,第131页,1987年);DeBlocketal.,EMBOJ.3:1681(1984)(DeBlock等人,《欧洲分子生物学学会杂志》,第3卷,第1681页,1984年)。用于使GUS活性可视化而不需要破坏植物组织的体内方法是可用的。MolecularProbespublication2908,IMAGENEGREEN,p.1-4(1993)(分子探针出版物2908,IMAGENEGREEN,第1-4页,1993年)和Nalewayetal.,J.CellBiol.115:151a(1991)(Naleway等人,《细胞生物学杂志》,第115卷,第151a页,1991年)。然而,因为低灵敏度、高荧光背景和与使用荧光素酶基因作为可选标记相关的局限性,这些用于可视化GUS活性的体内方法尚未证实可用于回收转化的细胞。更近些时候,编码绿色荧光蛋白(GFP)的基因已被用作原核细胞和真核细胞中基因表达的标记。Chalfieetal.,Science263:802(1994)(Chalfie等人,《科学》,第263卷,第802页,1994年)。GFP和GFP的突变体可用作筛选标记。用于马铃薯转化的表达载体:启动子表达载体中包括的基因必须由包含调控元件例如启动子的核苷酸序列驱动。数种类型的启动子是转化领域熟知的,可单独使用或与启动子组合使用的其他调控元件也是转化领域所熟知的。如本文所用,“启动子”包括提及处于转录起始区上游并且涉及RNA聚合酶及其他蛋白质的识别和结合以启动转录的DNA区。“植物启动子”是能够在植物细胞中启动转录的启动子。处于发育控制下的启动子的例子包括优先在某些组织如叶、根、种子、纤维、木质部导管、管胞或厚壁组织中启动转录的启动子。这类启动子称为“组织偏好的”。仅在某些组织中启动转录的启动子称为“组织特异性的”。“细胞型”特异性启动子主要在一种或多种器官中的某些细胞类型(例如根或叶中的维管细胞)中驱动表达。“诱导型”启动子是在环境控制下的启动子。可通过诱导型启动子实现转录的环境条件的例子包括无氧条件或光的存在。组织特异性启动子、组织偏好启动子、细胞类型特异性启动子和诱导型启动子构成一类“非组成型”启动子。“组成型”启动子是在大多数环境条件下有活性的启动子。A.诱导型启动子诱导型启动子与要在马铃薯中表达的基因有效连接。任选地,诱导型启动子与编码信号序列的核苷酸序列有效连接,该信号序列与要在马铃薯中表达的基因有效连接。使用诱导型启动子,转录速率响应诱导剂而增加。任何诱导型启动子均可用于本发明。参见Wardetal.,PlantMol.Biol.22:361-366(1993)(Ward等人,《植物分子生物学》,第22卷,第361-366页,1993年)。示例性诱导型启动子包括但不限于:响应于铜的来自ACEI系统的启动子(Mettetal.,PNAS90:4567-4571(1993)(Mett等人,《美国国家科学院院刊》,第90卷,第4567-4571页,1993年))、响应于苯磺酰胺除草剂安全剂的来自玉蜀黍的In2基因(Hersheyetal.,Mol.GenGenetics227:229-237(1991)(Hershey等人,《分子和普通遗传学》,第227卷,第229-237页,1991年)和Gatzetal.,Mol.Gen.Genetics243:32-38(1994)(Gatz等人,《分子和普通遗传学》,第243卷,第32-38页,1994年))或来自Tn10的Tet阻遏物(Gatzetal.,Mol.Gen.Genetics227:229-237(1991)(Gatz等人,《分子和普通遗传学》,第227卷,第229-237页,1991年))。特别优选的诱导型启动子是响应植物通常不响应的诱导剂的启动子。示例性的诱导型启动子是来自类固醇激素基因的诱导型启动子,该启动子的转录活性受糖皮质类固醇激素的诱导。Schenaetal.,Proc.Natl.Acad.Sci.USA88:0421(1991)(Schena等人,《美国国家科学院院刊》,第88卷,第0421页,1991年)。B.组成型启动子组成型启动子与要在马铃薯中表达的基因有效连接,或者组成型启动子与编码信号序列的核苷酸序列有效连接,该信号序列与要在马铃薯中表达的基因有效连接。在本发明中可利用许多不同的组成型启动子。示例性组成型启动子包括但不限于:来自植物病毒的启动子,例如来自CaMV的35S启动子(Odelletal.,Nature313:810-812(1985)(Odell等人,《自然》),第313卷,第810-812页,1985年),以及来自诸如水稻肌动蛋白的此类基因的启动子(McElroyetal.,PlantCell2:163-171(1990)(McElroy等人,《植物细胞》,第2卷,第163-171页,1990年));泛素(Christensenetal.,PlantMol.Biol.12:619-632(1989)(Christensen等人,《植物分子生物学》,第12卷,第619-632页,1989年)和Christensenetal.,PlantMol.Biol.18:675-689(1992)(Christensen等人,《植物分子生物学》,第18卷,第675-689页,1992年));pEMU(Lastetal.,Theor.Appl.Genet.81:581-588(1991)(Last等人,《理论与应用遗传学》,第81卷,第581-588页,1991年));MAS(Veltenetal.,EMBOJ.3:2723-2730(1984)(Velten等人,《欧洲分子生物学学会杂志》,第3卷,第2723-2730页,1984年))和玉蜀黍H3组蛋白(Lepetitetal.,Mol.Gen.Genetics231:276-285(1992)(Lepetit等人,《分子和普通遗传学》,第231卷,第276-285页,1992年)和Atanassovaetal.,PlantJournal2(3):291-300(1992)(Atanassova等人,《植物杂志》,第2卷,第3期,第291-300页,1992年))。ALS启动子为欧洲油菜(Brassicanapus)ALS3结构基因5'的Xba1/Ncol片段(或类似于所述Xba1/Ncol片段的核苷酸序列),其代表一特别有用的组成型启动子。参见PCT申请WO96/30530。C.组织特异性启动子或组织偏好启动子组织特异性启动子与要在马铃薯中表达的基因有效连接。任选地,组织特异性启动子与编码信号序列的核苷酸序列有效连接,该信号序列与要在马铃薯中表达的基因有效连接。转化有与组织特异性启动子有效连接的所关注基因的植物在特定组织中仅仅或优先产生所述转基因的蛋白质产物。任何组织特异性或组织偏好启动子均可用于本发明。示例性组织特异性或组织偏好启动子包括但不限于:根偏好启动子,例如来自菜豆素基因的启动子(Muraietal.,Science23:476-482(1983)(Murai等人,《科学》,第23卷,第476-482页,1983年)和Sengupta-Gopalanetal.,Proc.Natl.Acad.Sci.USA82:3320-3324(1985)(Sengupta-Gopalan等人,《美国国家科学院院刊》,第82卷,第3320-3324页,1985年));叶特异性的光诱导型启动子,例如来自cab或rubisco的启动子(Simpsonetal.,EMBOJ.4(11):2723-2729(1985)(Simpson等人,《欧洲分子生物学学会杂志》,第4卷,第11期,第2723-2729页,1985年)和Timkoetal.,Nature318:579-582(1985)(Timko等人,《自然》,第318卷,第579-582页,1985年));花药特异性启动子,例如来自LAT52的启动子(Twelletal.,Mol.Gen.Genetics217:240-245(1989)(Twell等人,《分子和普通遗传学》,第217卷,第240-245页,1989年));花粉特异性启动子,例如来自Zm13的启动子(Guerreroetal.,Mol.Gen.Genetics244:161-168(1993)(Guerrero等人,《分子和普通遗传学》,第244卷,第161-168页,1993年))或小孢子偏好启动子,例如来自apg的启动子(Twelletal.,Sex.PlantReprod.6:217-224(1993)(Twell等人,《植物有性生殖》,第6卷,第217-224页,1993年))。用于将靶标蛋白质靶向至亚细胞区室的信号序列将转基因产生的蛋白质运输至亚细胞区室如叶绿体、液泡、过氧化物酶体、乙醛酸循环体、细胞壁或线粒体或者用于分泌进质外体中可通过将编码信号序列的核苷酸序列与编码所关注蛋白质的基因的5’和/或3’区有效连接来实现。结构基因5’和/或3’端处的靶向序列可在蛋白质合成和加工期间决定所编码的蛋白质最终在哪区室化。信号序列的存在将多肽引导至细胞内的细胞器或亚细胞区室,或用于分泌进质外体。许多信号序列是本领域已知的。参见例如Beckeretal.,PlantMol.Biol.20:49(1992)(Becker等人,《植物分子生物学》,第20卷,第49页,1992年);Close,P.S.,Master’sThesis,IowaStateUniversity(1993)(Close,P.S.,硕士论文,爱荷华州立大学,1993年);Knox,C.,etal.,PlantMol.Biol.9:3-17(1987)(Knox,C.等人,《植物分子生物学》,第9卷,第3-17页,1987年);Lerneretal.,PlantPhysiol.91:124-129(1989)(Lerner等人,《植物生理学》,第91卷,第124-129页,1989年);Frontesetal.,PlantCell3:483-496(1991)(Frontes等人,《植物细胞》,第3卷,第483-496页,1991年);Matsuokaetal.,Proc.Natl.Acad.Sci.88:834(1991)(Matsuoka等人,《美国国家科学院院刊》,第88卷,第834页,1991年);Gouldetal.,J.Cell.Biol.108:1657(1989)(Gould等人,《细胞生物学杂志》,第108卷,第1657页,1989年);Creissenetal.,PlantJ.2:129(1991)(Creissen等人,《植物杂志》,第2卷,第129页,1991年);Kalderon,etal.,Cell39:499-509(1984)(Kalderon等人,《细胞》,第39卷,第499-509页,1984年);Steifel,etal.,PlantCell2:785-793(1990)(Steifel等人,《植物细胞》,第2卷,第785-793页,1990年)。外来蛋白质基因和农艺学基因使用根据本发明的转基因植物,可以商业量产生外来蛋白质。因而,转基因植物选择和繁殖的技术(其为本领域周知的)可产生以常规方式收获的许多转基因植物,并然后可从所关注的组织或从总生物质提取外来蛋白质。植物生物质中的蛋白质提取可通过已知方法实现,所述已知方法在例如HeneyandOrr,Anal.Biochem.114:92-6(1981)(Heney和Orr,《分析生物化学》,第114卷,第92-6页,1981年)中有所论述。根据一个优选的实施例,提供外来蛋白质的商业生产的转基因植物是马铃薯植物。在另一个优选的实施例中,所关注的生物质是种子或块茎。对于数目相对较少的显示较高表达水平的转基因植物,可以生成遗传图谱,主要通过常规的RFLP、PCR和SSR分析生成,其可鉴定整合的DNA分子大概的染色体位置。对于这一方面的示例性方法,参见GlickandThompson,MethodsinPlantMolecularBiologyandBiotechnologyCRCPress,BocaRaton269:284(1993)(Glick和Thompson,《植物分子生物学和生物技术方法》),CRC出版社,博卡拉顿市,第269卷,第284页,1993年)。有关染色体位置的图谱信息可用于对主题转基因植物的专有保护。如果进行了未授权的繁殖以及与其他种质杂交,则可将整合区的图谱与可疑植物的类似图谱进行比较,以确定后者是否与主题植物具有共同的系谱(parentage)。图谱比较将涉及杂交、RFLP、PCR、SSR和测序,所有这些均是常规的技术。同样,借助于本发明,可在转化植物中表达农艺学基因。更具体而言,可对植物进行遗传改造以表达农艺学感兴趣的各种表型。在这一方面所牵涉的示例性基因包括但不限于下面归类的那些:1.赋予针对害虫或病害的抗性并编码以下各方面的基因:A.植物抗病基因。植物防御往往由植物中的抗病基因(R)的产物与病原体中的相应无毒(Avr)基因的产物之间的特异性相互作用激活。可用克隆的抗性基因转化植物品种,以工程构建出对特定的病原体株系有抗性的植物。参见例如Jonesetal.,Science266:789(1994)(Jones等人,《科学》,第266卷,第789页,1994年)(用于抵抗黄枝孢菌(Cladosporiumfulvum)的番茄Cf-9基因的克隆);Martinetal.,Science262:1432(1993)(Martin等人,《科学》,第262卷,第1432页,1993年)(用于抵抗丁香假单胞杆菌番茄致病变种(Pseudomonassyringaepv.tomato)的番茄Pto基因编码一种蛋白质激酶);Mindrinosetal.Cell78:1089(1994)(Mindrinos等人,《细胞》,第78卷,第1089页,1994年)(用于抵抗丁香假单胞菌(Pseudomonassyringae)的拟南芥RSP2基因)。B.赋予针对害虫如大豆异皮线虫的抗性的基因。参见例如PCT申请WO96/30517;PCT申请WO93/19181。C.苏云金杆菌蛋白、其衍生物或模拟其的合成多肽。参见例如,Geiseretal.,Gene48:109(1986)(Geiser等人,《基因》,第48卷,第109页,1986年),其公开了Btδ-内毒素基因的克隆和核苷酸序列。此外,编码δ-内毒素基因的DNA分子可购自弗吉尼亚州马纳萨斯市的美国模式培养物保藏所(AmericanTypeCultureCollection,Manassas,Virginia),例如以ATCC登录号40098、67136、31995和31998。D.凝集素。参见例如VanDammeetal.,PlantMolec.Biol.24:25(1994)(VanDamme等人,《植物分子生物学》,第24卷,第25页,1994年),其公开了多种君子兰(Cliviaminiata)甘露糖结合凝集素基因的核苷酸序列。E.维生素结合蛋白,如亲和素。参见PCT申请US93/06487,其教导了亲和素及亲和素同系物作为对抗昆虫害虫的杀幼虫剂的用途。F.酶抑制剂,例如蛋白酶或蛋白酶抑制剂或淀粉酶抑制剂。参见例如Abeetal.,J.Biol.Chem.262:16793(1987)(Abe等人,《生物化学杂志》,第262卷,第16793页,1987年)(水稻半胱氨酸蛋白酶抑制剂的核苷酸序列);Huubetal.,PlantMolec.Biol.21:985(1993)(Huub等人,《植物分子生物学》,第21卷,第985页,1993年)(编码烟草蛋白酶抑制剂I的cDNA的核苷酸序列);Sumitanietal.,Biosci.Biotech.Biochem.57:1243(1993)(Sumitani等人,《生物科学,生物技术与生物化学》,第57卷,第1243页,1993年)(硝孢链霉菌(Streptomycesnitrosporeus)α-淀粉酶抑制剂的核苷酸序列)和美国专利No.5,494,813(Hepher和Atkinson,公布于1996年2月27日)。G.昆虫特异性激素或信息素,如蜕皮类固醇或保幼激素、其变体、基于其的模拟物或者其拮抗剂或激动剂。参见例如,Hammocketal.,Nature344:458(1990)(Hammock等人,《自然》,第344卷,第458页,1990年)的公开内容,其公开了克隆的保幼激素酯酶(保幼激素的失活剂)的杆状病毒表达。H.在表达时能破坏受影响的害虫的生理的昆虫特异性肽。例如,参见以下文献的公开内容:Regan,J.Biol.Chem.269:9(1994)(Regan,J,《生物化学》,第269卷,第9页,1994年)(表达克隆生成编码昆虫利尿激素受体的DNA)和Prattetal.,Biochem.Biophys.Res.Comm.163:1243(1989)(Pratt等人,《生物化学与生物物理研究通讯》,第163卷,第1243页,1989年)(在太平洋折翅蠊(Diplopterapuntata)中鉴定出抑咽侧体素)。还可参见颁给Tomalski等人的美国专利No.5,266,317,其公开了编码昆虫特异性麻痹性神经毒素的基因。I.在自然界由蛇、黄蜂等产生的昆虫特异性毒液。例如,参见Pangetal.,Gene116:165(1992)(Pang等人,《基因》,第116卷,第165页,1992年),了解有关在具有编码蝎子昆虫毒性肽的基因的植物中进行异源表达的公开内容。J.负责单萜、倍半萜、类固醇、异羟肟酸、苯丙素衍生物或者另一具有杀昆虫活性的非蛋白质分子的超量积聚的酶。K.涉及生物活性分子的修饰(包括翻译后修饰)的酶;例如糖酵解酶、蛋白水解酶、脂肪分解酶、核酸酶、环化酶、转氨酶、酯酶、水解酶、磷酸酶、激酶、磷酸化酶、聚合酶、弹性蛋白酶、几丁质酶和葡聚糖酶,无论是天然的还是合成的。参见PCT申请WO93/02197(Scott等人),其公开了愈创葡聚糖酶(callase)基因的核苷酸序列。含有几丁质酶编码序列的DNA分子可例如以登录号39637和67152从ATCC获得。还可参见Krameretal.,InsectBiochem.Molec.Biol.23:691(1993)(Kramer等人,《昆虫生物化学与分子生物学》,第23卷,第691页,1993年),其提出了编码烟草天蛾(tobaccohornworm)几丁质酶的cDNA的核苷酸序列;和Kawallecketal.,PlantMolec.Biol.21:673(1993)(Kawalleck等人,《植物分子生物学》,第21卷,第673页,1993年),其提供了欧芹ubi4-2多聚泛素基因的核苷酸序列。L.刺激信号转导的分子。例如,参见以下文献的公开内容:Botellaetal.,PlantMolec.Biol.24:757(1994)(Botella等人,《植物分子生物学》,第24卷,第757页,1994年),其提供了绿豆钙调蛋白cDNA克隆的核苷酸序列;和Griessetal.,PlantPhysiol.104:1467(1994)(Griess等人,《植物生理学》,第104卷,第1467页,1994年),其提供了玉蜀黍钙调蛋白cDNA克隆的核苷酸序列。M.疏水力矩肽。参见PCT申请WO95/16776,其公开了鲎素(Tachyplesin)的肽衍生物,该衍生物可抑制真菌植物病原体;以及PCT申请WO95/18855,其教导了合成的抗微生物肽,该肽可赋予抗病性。N.透膜酶、通道形成剂(channelformer)或通道阻断剂。例如,参见Jaynes等人,PlantSci(《植物科学》)89:43(1993)的公开内容,其公开了异源表达天蚕抗菌肽-β裂解肽类似物以赋予转基因烟草植物针对青枯假单胞菌(Pseudomonassolanacearum)的抗性。O.病毒侵入性蛋白(viral-1nvasiveprotein)或由其衍生的复合毒素。例如,病毒外壳蛋白在转化的植物细胞中积累可赋予针对由衍生该外壳蛋白基因的病毒以及相关病毒造成的病毒感染和/或病害发展的抗性。参见Beachyetal.,Ann.Rev.Phytopathol.28:451(1990)(Beachy等人,《植物病理学年评》,第28卷,第451页,1990年)。外壳蛋白介导的抗性已被赋予转化植物以对抗苜蓿花叶病毒、黄瓜花叶病毒和烟草花叶病毒。P.昆虫特异性抗体或由其衍生的免疫毒素。因此,靶向昆虫肠道中的关键代谢功能的抗体将会使受影响的酶失活,从而杀死昆虫。参阅Tayloretal.,Abstract#497,SeventhInt'lSymposiumonMolecularPlant-MicrobeInteractions(Edinburgh,Scotland)(Taylor等人,第497号摘要,《第七届分子植物-微生物相互作用国际学术报告会》(苏格兰爱丁堡),1994年,通过产生单链抗体片段在转基因烟草中进行酶失活)。Q.病毒特异性抗体。参见例如,Tavladorakietal.,Nature366:469(1993)(Tavladoraki等人,《自然》,第366卷,第469页,1993年),其表明表达重组抗体基因的转基因植物免于病毒攻击。R.在自然界由病原体或寄生虫产生的发育迟滞蛋白。因此,真菌内切-α-1,4-D-聚半乳糖醛酸酶通过溶解植物细胞壁同型-α-1,4-D-半乳糖醛酸酶而有利于真菌定植和植物营养物释放。参见Lambetal.,Bio/Technology10:1436(1992)(Lamb等人,《生物技术》,第10卷,第1436页,1992年)。Toubartetal.,PlantJ.2:367(1992)(Toubart等人,《植物杂志》,第2卷,第367页,1992年)描述了编码豆类内切聚半乳糖醛酸酶抑制蛋白的基因的克隆和表征。S.在自然界由植物产生的发育迟滞蛋白。例如,Logemannetal.,Bio/Technology10:305(1992)(Logemann等人,《生物技术》,第10卷,第305页,1992年)已表明表达大麦核糖体失活基因的转基因植物具有增加的针对真菌病害的抗性。T.涉及系统获得性抗性(SAR)响应的基因和/或发病相关基因。Briggs,S.CurrentBiology,5(2)(1995)(Briggs,S.,《当代生物学》,第5卷,第2期,1995年)。U.抗真菌基因。参见CornelissenandMelchers,PlantPhysiol.,101:709-712(1993)(Cornelissen和Melchers,《植物生理学》,第101卷,第709-712页,1993年);Parijsetal.,Planta183:258-264(1991)(Parijs等人,《植物》,第183卷,第258-264页,1991年)和Bushnelletal.,Can.J.ofPlantPath.20(2):137-149(1998)(Bushnell等人,《加拿大植物病理学杂志》,第20卷,第2期,第137-149页,1998年)。V.赋予针对疫霉枯萎病(Phytophthorablight)的基因,如R1、R2、R3、R4及其他抗性基因。参见Naess,S.K.,et.al.,(2000)ResistancetolateblightinSolanumbulbocastanumismappedtochromosome8.Theor.Appl.Genet.101:697-704(Naess,S.K.等人,2000年,马铃薯野生种(Solanumbulbocastanum)的晚疫病抗性被映射到8号染色体,《理论与应用遗传学》,第101卷,第697-704页)和Li,X.,et.al.,(1998)AutotetraploidsandgeneticmappingusingcommonAFLPmarkers:theR2alleleconferringresistancetoPhytophthorainfestansmappedonpotatochromosome4.Theor.Appl.Genet.96:1121-1128(Li,X.等人,1998年,使用常见AFLP标记进行同源四倍体和遗传图谱绘制:赋予致病疫霉(Phytophthorainfestans)抗性的R2等位基因被映射到马铃薯4号染色体,《理论与应用遗传学》,第96卷,第1121-1128页)。2.赋予针对除草剂的抗性的基因,例如以下除草剂:A.抑制生长点或分生组织的除草剂,如咪唑啉酮或磺酰脲。此类别中的示例性基因编码突变ALS和AHAS酶,分别如例如Leeetal.,EMBOJ.7:1241(1988)(Lee等人,《欧洲分子生物学学会杂志》,第7卷,第1241页,1988年)和Mikietal.,Theor.Appl.Genet.80:449(1990)(Miki等人,《理论与应用遗传学》,第80卷,第449页,1990年)中所述。B.草甘膦(抗性分别由突变的5-烯醇丙酮酰莽草酸-3-磷酸合酶(EPSP)基因和aroA基因削弱)和其他膦酰基化合物如草铵膦(草铵膦乙酰转移酶(PAT)基因和吸水链霉菌(Streptomyceshygroscopicus)PATbar基因)和吡啶氧基或苯氧基丙酸和环己酮(cyclohexone)(ACC酶抑制剂编码基因)。参见例如,颁给Shah等人的美国专利No.4,940,835,其公开了EPSP形式的能赋予草甘膦抗性的核苷酸序列。编码突变型aroA基因的DNA分子可以以ATCC登录号39256获得,该突变基因的核苷酸序列在颁给Comai的美国专利No.4,769,061中公开。颁给Kumada等人的欧洲专利申请No.0333033和颁给Goodman等人的美国专利No.4,975,374公开了赋予对除草剂如L-草铵膦的抗性的谷氨酰胺合成酶基因的核苷酸序列。PAT基因的核苷酸序列在颁给Leemans等人的欧洲专利No.0242246中提供。DeGreefetal.,Bio/Technology7:61(1989)(DeGreef等人,《生物技术》,第7卷,第61页,1989页),其描述了表达编码草铵膦乙酰转移酶活性的嵌合bar基因的转基因植物的产生。赋予苯氧基丙酸和环己酮(例如拿捕净和甲禾灵)抗性的示例性基因为Acc1-S1、Acc1-S2和Acc2-S3基因,如Marshalletal.,Theor.Appl.Genet.83:435(1992)(Marshall等人,《理论与应用遗传学》,第83卷,第435页,1992年)。C.抑制光合作用的除草剂,如三嗪(psbA基因和gs+基因)和苄腈(腈水解酶基因)。Przibilaetal.,PlantCell3:169(1991)(Przibila等人,《植物细胞》,第3卷,第169页,1991年)描述了用编码突变型psbA基因的质粒转化衣藻(Chlamydomonas)。腈水解酶基因的核苷酸序列在颁给Stalker的美国专利No.4,810,648中公开,含有这些基因的DNA分子可以以ATCC登录号53435,67441和67442获得。编码谷胱甘肽S-转移酶的DNA的克隆和表达如Hayesetal.,Biochem.J.285:173(1992)(Hayes等人,《生物化学杂志》,第285卷,第173页,1992年)中所述。D.乙酰羟酸合酶(其已被发现能使表达这种酶的植物能抵抗多种类型的除草剂)已被引入到多种植物中。参见Hattorietal.,Mol.Gen.Genet.246:419,1995(Hattori等人,《分子和普通遗传学》,第246卷,第419页,1995年)。赋予除草剂抗性的其他基因包括编码大鼠细胞色素P4507A1和酵母NADPH-细胞色素P450氧化还原酶的嵌合蛋白的基因(Shiotaetal.,PlantPhysiol.,106:17,1994(Shiota等人,《植物生理学》,第106卷,第17页,1994年))、谷胱甘肽还原酶和超氧化物歧化酶的基因(Aonoetal.,PlantCellPhysiol.36:1687,1995(Aono等人,《植物细胞生理学》,第36卷,第1687页,1995年))和各种磷酸转移酶的基因(Dattaetal.,PlantMol.Biol.20:619,1992(Datta等人,《植物分子生物学》,第20卷,第619页,1992年))。E.原卟啉原氧化酶(protox)是叶绿素的生成所必需的,而叶绿素是所有植物存活所必需的。该protox酶充当多种除草化合物的靶标。这些除草剂还抑制所存在的所有不同植物物种的生长,从而造成它们全部毁灭。具有改变的protox活性且抗这些除草剂的植物的培育在美国专利No.6,288,306、No.6,282,837、No.5,767,373和国际公布WO01/12825中有所描述。3.赋予或促成增值性状的基因,例如以下增值性状:A.经修饰的脂肪酸代谢,例如,通过用硬脂酰-ACP去饱和酶的反义基因转化植物以增加该植物的硬脂酸含量。参见Knultzonetal.,Proc.Natl.Acad.Sci.USA89:2625(1992)(Knultzon等人,《美国国家科学院院刊》,第89卷,第2625页,1992年)。B.降低的植酸盐含量-1)引入植酸酶编码基因将会增强植酸盐的分解,从而为该转化植物增加更多的游离磷酸盐。例如,参见VanHartingsveldtetal.,Gene127:87(1993)(VanHartingsveldt等人,《基因》,第127卷,第87页,1993年)关于黑曲霉(Aspergillusniger)植酸酶基因的核苷酸序列的公开内容。2)可引入降低植酸盐含量的基因。在玉蜀黍中,例如,这可通过克隆并然后再引入与一单个等位基因相关的DNA来实现,该单个等位基因是造成表征为低水平植酸的玉蜀黍突变体的原因。参见Raboyetal.,Maydica35:383(1990)(Raboy等人,《Maydica》,第35卷,第383页,1990年)。C.经修饰的碳水化合物组成,例如通过用编码可改变淀粉的分支模式的酶的基因转化植物来实现。参见Shirozaetal.,J.Bacteriol.170:810(1988)(Shiroza等人,《细菌学杂志》,第170卷,第810页,1988年)(变形链球菌(Streptococcusmutants)果糖基转移酶基因的核苷酸序列);Steinmetzetal.,Mol.Gen.Genet.20:220(1985)(Steinmetz等人,《分子和普通遗传学》,第20卷,第220页,1985年)(枯草芽孢杆菌(Bacillussubtilis)果聚糖蔗糖酶基因的核苷酸序列);Penetal.,Bio/Technology10:292(1992)(Pen等人,《生物技术》,第10卷,第292页,1992年)(表达地衣芽孢杆菌(Bacilluslichenifonnis)α-淀粉酶的转基因植物的产生);Elliotetal.,PlantMolec.Biol.21:515(1993)(Elliot等人,《植物分子生物学》,第21卷,第515页,1993年)(番茄转化酶基因的核苷酸序列);etal.,J.Biol.Chem.268:22480(1993)(等人,《生物化学杂志》,第268卷,第22480页,1993年)(大麦α-淀粉酶基因的定点诱变)和Fisheretal.,PlantPhysiol.102:1045(1993)(Fisher等人,《植物生理学》,第102卷,第1045页,1993年)(玉蜀黍胚乳淀粉分支酶II)。D.通过FAD-2基因修饰使油酸升高和/或通过FAD-3基因修饰使亚麻酸减少。参见美国专利No.6,063,947、No.6,323,392和国际公布WO93/11245。4.控制雄性不育的基因A.引入处于毯毡层特异性启动子的控制下的脱乙酰酶以及应用化学N-Ac-PPT。参见国际专利申请公布WO01/29237。B.引入多种雄蕊特异性启动子。参见国际专利申请公布WO92/13956和WO92/13957。C.引入barnase基因和barstar基因。参见Pauletal.,PlantMol.Biol.19:611-622,1992(Paul等人,《植物分子生物学》,第19卷,第611-622页,1992年)。马铃薯转化的方法已经开发出用于植物转化的许多方法,包括生物学和物理植物转化方案。参见例如Mikietal.,“ProceduresforIntroducingForeignDNAintoPlants”inMethodsinPlantMolecularBiologyandBiotechnology,Glick,B.R.andThompson,J.E.Eds.(CRCPress,Inc.BocaRaton,1993)pages67-88(Miki等人,《植物分子生物学和生物技术方法》中的“将外来DNA引入植物的步骤”,Glick,B.R.和Thompson,J.E.编辑,CRC出版社,博卡拉顿,1993年,第67-88页)。另外,用于植物细胞或组织转化和再生植物的表达载体及体外培养方法是可用的。参见例如Gruberetal.,“VectorsforPlantTransformation”inMethodsinPlantMolecularBiologyandBiotechnology,Glick,B.R.andThompson,J.E.Eds.(CRCPress,Inc.,BocaRaton,1993)pages89-119(Gruber等人,《植物分子生物学和生物技术方法》中的“用于植物转化的载体”,Glick,B.R.和Thompson,J.E.编辑,CRC出版社,博卡拉顿,1993年,第89-119页)。A.农杆菌介导的转化-一种用于将表达载体引入植物中的方法是基于农杆菌的天然转化系统。参见例如Horschetal.,Science227:1229(1985)(Horsch等人,《科学》,第227卷,第1229页,1985年)。根癌农杆菌(A.tumefaciens)和发根农杆菌(A.rhizogenes)是在遗传上转化植物细胞的植物病原性土壤细菌。根癌农杆菌的Ti质粒和发根农杆菌的Ri质粒携带负责植物的遗传转化的基因。参见例如Kado,C.I.,Crit.Rev.PlantSci.10:1(1991)(Kado,C.I.,《植物科学评论》,第10卷,第1页,1991年)。有关农杆菌载体系统和农杆菌介导的基因转移方法的描述由Gruber等人(出处同上)、Miki等人(出处同上)以及Moloney等人,PlantCellReports(《植物细胞报道》)8:238(1989)提供。还可参见1996年10月8日颁发的美国专利No.5,563,055(Townsend和Thomas)。B.直接基因转移-已经开发了数种植物转化方法(统称为直接基因转移)作为农杆菌介导的转化的备选。植物转化普遍可适用的方法是微粒介导的转化,其中在测量为1至4μm的微粒的表面上携带DNA。用生物射弹装置将表达载体引入植物组织中,所述生物射弹装置将微粒加速到300至600m/s的速度,其足以穿透植物细胞壁和细胞膜。Sanfordetal.,Part.Sci.Technol.5:27(1987)(Sanford等人,《颗粒科学与技术》,第5卷,第27页,1987年);Sanford,J.C.,TrendsBiotech.6:299(1988)(Sanford,J.C.,《生物技术趋势》,第6卷,第299页,1988年);Kleinetal.,Bio/Tech.6:559-563(1988)(Klein等人,《生物技术》,第6卷,第559-563页,1988年);Sanford,J.C.PhysiolPlant7:206(1990)(Sanford,J.C.,《植物生理学》,第7卷,第206页,1990年);Kleinetal.,Biotechnology10:268(1992)(Klein等人,《生物技术》,第10卷,第268页,1992年)。还可参见1991年5月14日颁发的美国专利No.5,015,580(Christou等人))以及1994年6月21日颁发的美国专利No.5,322,783(Tomes等人)。另一种用于将DNA物理投递至植物的方法是对靶细胞的超声处理。Zhangetal.,Bio/Technology9:996(1991)(Zhang等人,《生物技术》,第9卷,第996页,1991年)。作为另一种选择,已使用脂质体和原生质球融合来将表达载体引入植物中。Deshayesetal.,EMBOJ.,4:2731(1985)(Deshayes等人,《欧洲分子生物学学会杂志》,第4卷,第2731页,1985年);Christouetal.,ProcNatl.Acad.Sci.USA84:3962(1987)(Christou等人,《美国国家科学院院刊》,第84卷,第3962页,1987年)。还已经报道了使用CaCl2沉淀、聚乙烯醇或多聚-L-鸟氨酸来使DNA直接摄取进原生质体中。Hainetal.,Mol.Gen.Genet.199:161(1985)(Hain等人,《分子和普通遗传学》,第199卷,第161页,1985年)和Draperetal.,PlantCellPhysiol.23:451(1982)(Draper等人,《植物细胞生理学》,第23卷,第451页,1982年)。还已经描述了原生质体及全细胞和组织的电穿孔。Donnetal.,InAbstractsofVIIthInternationalCongressonPlantCellandTissueCultureIAPTC,A2-38,p53(1990)(Donn等人,IAPTC第七届国际植物细胞和组织培养会议摘要,第A2-38卷,第53页,1990年);D’Halluinetal.,PlantCell4:1495-1505(1992)(D’Halluin等人,《植物细胞》,第4卷,第1495-1505页,1992年)和Spenceretal.,PlantMol.Biol.24:51-61(1994)(Spencer等人,《植物分子生物学》,第24卷,第51-61页,1994年)。转化马铃薯靶标组织后,上述可选标记基因的表达容许优先选择经转化的细胞、组织和/或植物,其中使用本领域中公知的再生和选择方法来实现。前述转化方法通常会用于产生转基因品种。然后可以将转基因品种与另一(非转化的或经转化的)品种杂交,以产生新转基因品种。或者,可以使用植物育种领域中公知的传统回交技术将已使用前述转化技术工程改造进特定马铃薯品系中的遗传性状移入另一品系中。例如,可以使用回交方法来将工程改造的性状从公共的、非良种品种移进良种品种中,或者从在其基因组中含有外来基因的品种移进不含该基因的一个或多个品种中。如本文所用,“杂交”可以指简单的X×Y杂交,或回交过程,这取决于上下文。本领域的普通技术人员将认识到,在本发明的上下文中使用术语马铃薯植物时,这还包括保留了J3的关键区分特性的衍生品种,例如该品种的基因转化植物或具有一个或多个掺入其中的增值基因(例如除草剂或害虫抗性)的转基因衍生物。回交方法可与本发明一起使用来改善该品种或将特性引入进该品种中。本文所用的术语“回交”是指杂种子代回过来与亲本重复杂交1、2、3、4、5、6、7、8、9或更多次。贡献一种或多种所需特性的基因的亲本马铃薯植株被称为非回归亲本或供体亲本。该术语是指这样一个事实:该非回归亲本在该回交方案中使用一次并因而不回归。转移得到来自非回归亲本的一个或多个基因的亲本马铃薯植物称为回归亲本,因为在该回交方案中其被用了数轮。在典型的回交方案中,将所关注的最初品种(回归亲本)与携带要转移的所关注基因的第二品种(非回归亲本)杂交。然后使所得到的来自该杂交的子代再次与回归亲本杂交并重复该过程直到获得一马铃薯植株,在该马铃薯植株中,除了从非回归亲本转移的一个或多个基因以外,另外回归亲本的基本上全部的理想形态学和生理学特性得到恢复。对于成功的回交程序而言,对合适回归亲本的选择是一个重要的步骤。回交方案的目的是改变或置换初始品种中的一个或多个性状或特性。为了实现这一点,将回归品种的一个或多个基因进行修饰或用来自非回归亲本的理想基因替代或补充,而同时保留初始品种的基本上其余全部所需基因、并因而保留其理想生理学和形态学组成。对特定非回归亲本的选择将取决于回交的目的。其中一个主要目的是给植物增添某些在商业上理想的、在农艺学上重要的性状。精确回交方案将取决于被变更或增添以确定合适的测试方案的特性或性状。尽管在被转移的特性是显性等位基因时回交方法得到简化,但可以转移隐性等位基因。在这种情况下,可能必需引入对子代的测试,以确定理想的特性是否已成功转移。同样,可使用多种本领域技术人员所熟知的已确立的重组方法中的任一者来将转基因引入进植物中,例如如下方法:Gressel,1985,BiotechnologicallyConferringHerbicideResistanceinCrops:ThePresentRealities,InMolecularFormandFunctionofthePlantGenome,L.vanVloten-Doting,(ed.),PlenumPress,NewYork(Gressel,1985年,《植物基因组的分子形式和功能》中的“利用生物技术为作物赋予除草剂抗性:当前现状”,L.vanVloten-Doting编辑,Plenum出版社,纽约);Huttner,S.L.,etal.,1992,RevisingOversightofGeneticallyModifiedPlants,Bio/Technology(Huttner,S.L.等人,1992年,经遗传修饰植物的修正管理,《生物技术》);Klee,H.,etal.,1989,PlantGeneVectorsandGeneticTransformation:PlantTransformationSystemsBasedontheuseofAgrobacteriumtumefaciens,CellCultureandSomaticCellGeneticsofPlants(Klee,H.等人,1989年,植物基因载体和遗传转化:基于使用根癌农杆菌、细胞培养物和植物体细胞遗传学的植物转化系统);Koncz,C.,etal.,1986,ThePromoterofTL-DNAGene5ControlstheTissue-SpecificExpressionofChimericGenesCarriedbyaNovelTypeofAgrobacteriumBinaryVector;MolecularandGeneralGenetics(Koncz,C.等人,1986年,TL-DNA基因5的启动子控制新型农杆菌二元载体所携带的嵌合基因的组织特异性表达,《分子和普通遗传学》);Lawson,C.,etal.,1990,EngineeringResistancetoMixedVirusInfectioninaCommercialPotatoCultivar:ResistancetoPotatoVirusXandPotatoVirusYinTransgenicRussetBurbank,Bio/Technology(Lawson,C.等人,1990年,工程化改造商用马铃薯栽培种的混合病毒感染抗性:转基因RussetBurbank对马铃薯病毒X和马铃薯病毒Y的抗性;《生物技术》);Mitsky,T.A.,etal.,1996,PlantsResistanttoInfectionbyPLRV.U.S.PatentNo.5,510,253(Mitsky,T.A.等人,1996年,植物的PLRV感染抗性,美国专利No.5,510,253);Newell,C.A.,etal.,1991,Agrobacterium-MediatedTransformationofSolanumtuberosumL.Cv.RussetBurbank,PlantCellReports(Newell,C.A.等人,1991年,由农杆菌介导的马铃薯栽培种RussetBurbank的转化,《植物细胞报告》);Perlak,F.J.,etal.,1993,GeneticallyImprovedPotatoes:ProtectionfromDamagebyColoradoPotatoBeetles,PlantMolecularBiology(Perlak,F.J.等人,1993年,遗传改良的马铃薯:防止科罗拉多马铃薯甲虫的侵害,《植物分子生物学》);所有这些文献均以引用方式并入本文用于此目的。已经鉴定了许多性状,在新品种的开发中不通常选用这些性状但可通过回交和遗传工程技术改善这些性状。这些性状可以是转基因的或者可以不是转基因的;这些性状的例子包括但不限于:除草剂抗性;对细菌、真菌或病毒病害的抗性;昆虫抗性;淀粉及其他碳水化合物浓度的均一性或淀粉及其他碳水化合物浓度的增加;增加的营养品质;块茎擦伤趋势降低;以及淀粉转化成糖的速率降低。这些基因通过细胞核遗传继承。这些性状中的数种在美国专利No.5,500,365、美国专利No.5,387,756、美国专利No.5,789,657、美国专利No.5,503,999、美国专利No.5,589,612、美国专利No.5,510,253、美国专利No.5,304,730、美国专利No.5,382,429、美国专利No.5,503,999、美国专利No.5,648,249、美国专利No.5,312,912、美国专利No.5,498,533、美国专利No.5,276,268、美国专利No.4,900,676、美国专利No.5,633,434和美国专利No.4,970,168中进行了描述。保藏信息上文所公开的及所附权利要求书所引用的辛普劳公司(J.R.SimplotCompany)专有的马铃薯栽培种J3的块茎保藏物由弗吉尼亚州马纳萨斯市大学路10801号的美国模式培养物保藏所(邮编20110)(AmericanTypeCultureCollection(ATCC),10801UniversityBoulevard,Manassas,Virginia20110)保藏。保藏日期为2013年5月23日。保藏的25瓶微型块茎在本申请提交日期之前取自由辛普劳公司(J.R.SimplotCompany)保存的同一保藏物。在授予专利后所有限制将不可撤回的取消,并且该保藏旨在满足37C.F.R.§§1.801-1.809的全部要求。其ATCC登录号为PTA-120371。该保藏物将维持在保藏所三十年,或最后要求后5年,或该专利的有效期,以较长者为准,并且在该期间内如有必要将进行替换。虽然在上面已经论述了许多示例性方面和实施例,但本领域技术人员将认识到某些修改、置换、增加以及它们的子组合。因此,意图是如下随附的权利要求及此后引入的权利要求应该理解为包括所有这些修改、置换、增加和子组合,因为它们在其真正的精神和范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1