双重衍生化壳聚糖纳米颗粒及制备方法和使用其体内基因转移的方法与流程
本发明一般涉及包含双重衍生化壳聚糖的纳米颗粒,及制备方法和使用其递送核酸如体内基因转移的方法。
发明背景
壳聚糖是N-乙酰基-D-葡糖胺与D-葡糖胺的无毒阳离子共聚物。壳聚糖可与核酸形成复合物,并作为一种生物相容且无毒的多糖已经用作DNA递送媒介物来转染细胞。由于病毒载体的复杂性和潜在毒性,所以将壳聚糖用于核酸的非病毒递送中引起了人们的极大兴趣。
为了鉴别非常适合基因转染的组合物,已经检查了许多壳聚糖/DNA复合物,包括经过修饰的壳聚糖与核酸的复合物。参见如WO2010/088565;WO2008/082282。已经发现所述复合物除其它性质之外在溶解性、聚集倾向、复合物稳定性、粒度、释放DNA的能力和转染效率方面不同。
因此,需要具有改善的转染效率的用于体内基因转移的新型组合物和方法。本文所述的组合物和方法有助于满足这些和其它需求。
发明概述
本文提供了令人惊讶的发现:用特定Arg:HP比率的(1)精氨酸(Arg)和(2)亲水性多元醇(HP)官能化的壳聚糖展现出显著改善的转染效率。精氨酸和葡萄糖酸已显示可协同用作提高壳聚糖纳米颗粒的转染效率的官能团。参见如PCT/CA2013/050218。本文公开了令人惊讶的发现:其它分子可被葡萄糖酸取代成壳聚糖的衍生物,并仍然表现出该协同作用。此外,提供在衍生化壳聚糖展现出最大转染效率内的两种取代基的优化官能化程度比率。因此,本文提供了促进如体内递送核酸至细胞、组织和器官的新型组合物。特别地,本文提供了基于双重衍生化壳聚糖的纳米颗粒,其中所述壳聚糖用阳离子氨基酸精氨酸(Arg)和亲水性多元醇(HP)以优化的Arg最终官能化程度:HP最终官能化程度(即Arg:HP)比率官能化。
在优选的实施方案中,所述纳米颗粒包含与多个精氨酸和多个亲水性多元醇偶联的壳聚糖,参见如式I
其中n是1至650的整数,
α是精氨酸的官能化程度,
β是亲水性多元醇的官能化程度,且
每个R1独立地选自氢、乙酰基、精氨酸和亲水性多元醇。
在一个优选的实施方案中,所述纳米颗粒包含与精氨酸偶联的壳聚糖。参见式II。在一个优选的实施方案中,所述精氨酸有助于提高壳聚糖的溶解度和/或使衍生化壳聚糖在较高的pH下结合核酸。
在另一个实施方案中,所述纳米颗粒包含与亲水性多元醇偶联的壳聚糖,所述亲水性多元醇优选具有用于偶联至壳聚糖的羧基或醛基。在一个实施方案中,所述亲水性多元醇选自由具有用于偶联至壳聚糖的羧基或醛基的分子和糖组成的组,其中所述亲水性多元醇不是葡萄糖酸。在一个实施方案中,所述亲水性多元醇具有羧基。在一个实施方案中,所述具有用于偶联至壳聚糖的羧基的亲水性多元醇选自由葡萄糖酸和苏糖酸组成的组。在一个实施方案中,所述亲水性多元醇是葡萄糖酸,参见如式III。在另一个实施方案中,所述亲水性多元醇是苏糖酸,参见如式IV。在另一个实施方案中,所述亲水性多元醇是可为天然或合成的糖,或者糖的酸形式。非限制性实例包括甘油醛、苏阿糖、赤藓糖、核糖、阿拉伯糖、木糖、来苏糖、阿洛糖、葡萄糖、阿卓糖、甘露糖、古洛糖、艾杜糖、半乳糖和塔罗糖。在一个实施方案中,所述亲水性多元醇是葡萄糖,参见如式V。在一个实施方案中,所述亲水性多元醇是苏阿糖,参见如式VI。
如本文所述的双重衍生化壳聚糖包含优化的Arg:HP最终官能化程度比率的精氨酸和亲水性多元醇。在一个优选的实施方案中,所述双重衍生化壳聚糖具有约1:1至约10:1的Arg:HP最终官能化程度比率或摩尔比率。在另一个实施方案中,所述Arg:HP最终官能化程度比率为约3:1至约7:1。在另一个实施方案中,所述Arg:HP最终官能化程度比率为约5:1。
特别地,与此类双重衍生化壳聚糖(“DD-壳聚糖”)形成的壳聚糖-核酸多聚物比与非官能化壳聚糖形成的核酸多聚物、仅衍生化壳聚糖或Arg:HP最终官能化程度比率为1:1至10:1的双重衍生化的壳聚糖展现出更高的转染效率。通过在本文所述的多聚物中使用双重官能化壳聚糖所赋予的其它所需的性质包括改善的穿透粘膜屏障的能力、在大于6.5的pH下增强的多聚物稳定性、在高多聚物浓度下减少的聚集、减少的细胞毒性和增强的核酸胞内释放。此外,在一些优选的实施方案中,主题DD-壳聚糖多聚物组合物可在生理pH下施用(如全身施用)。
因此,在一方面,本发明提供了DD-壳聚糖核酸多聚物。所述DD-壳聚糖核酸多聚物包含被精氨酸和亲水性多元醇双重衍生化的壳聚糖。
在一个实施方案中,所述DD-壳聚糖核酸多聚物的核酸是DNA。
在一个实施方案中,所述DD-壳聚糖核酸多聚物的核酸是RNA。
在一个实施方案中,所述DD-壳聚糖核酸多聚物的核酸是人工核酸。在一个优选的实施方案中,所述人工核酸选自由肽核酸(PNA)、磷酰二胺吗啉代寡核苷酸(PMO)、锁核酸(LNA)、二醇核酸(GNA)和苏阿糖核酸(TNA)组成的组。
在一个实施方案中,所述DD-壳聚糖核酸多聚物的核酸是治疗性核酸。在一个实施方案中,所述治疗性核酸是治疗性RNA。在一个优选的实施方案中,所述治疗性RNA选自由反义RNA、siRNA、短发夹RNA、微小RNA和酶促RNA组成的组。
在一个实施方案中,所述治疗性核酸是DNA。
在一个实施方案中,所述治疗性核酸包含编码治疗性蛋白质的核酸序列。
在一方面,本发明提供了包含多种DD-壳聚糖核酸多聚物的组合物。
在一个实施方案中,所述组合物具有3.0-8.0、更优选4.0-7.0且最优选4.5-6.5的pH。
在一方面,本发明提供了包含本发明的DD-壳聚糖核酸多聚物的药物组合物。在一个优选的实施方案中,所述DD-壳聚糖核酸多聚物包含治疗性核酸。
在一方面,本发明提供了治疗疾病的方法,所述方法包括向患者施用治疗有效量的本发明的药物组合物。
在一个实施方案中,主题药物组合物在生理pH下施用。
在一个实施方案中,主题药物组合物全身施用。
在一个实施方案中,主题药物组合物局部施用至靶组织。在一个优选的实施方案中,主题药物组合物施用至粘膜组织。在一个实施方案中,所述粘膜组织是胃肠(GI)组织。
在一方面,本发明提供了包含DD-壳聚糖核酸多聚物的疫苗,其中所述核酸编码抗原。
在一方面,本发明提供了用于接种患者的方法。所述方法包括向患者施用本发明的疫苗。
在一方面,本发明提供了包含DD-壳聚糖核酸多聚物的免疫原性组合物,其中所述核酸编码免疫原。
在一方面,本发明提供了用于开始或增加对目标分子的免疫反应的方法。所述方法包括向患者施用本发明的免疫原性组合物,其中所述核酸编码目标分子的表位。在另一方面,本发明提供了调控免疫反应的方法,所述方法包括向患者施用本发明的壳聚糖-核酸多聚物,其中所述核酸编码免疫调节细胞因子。
附图概述
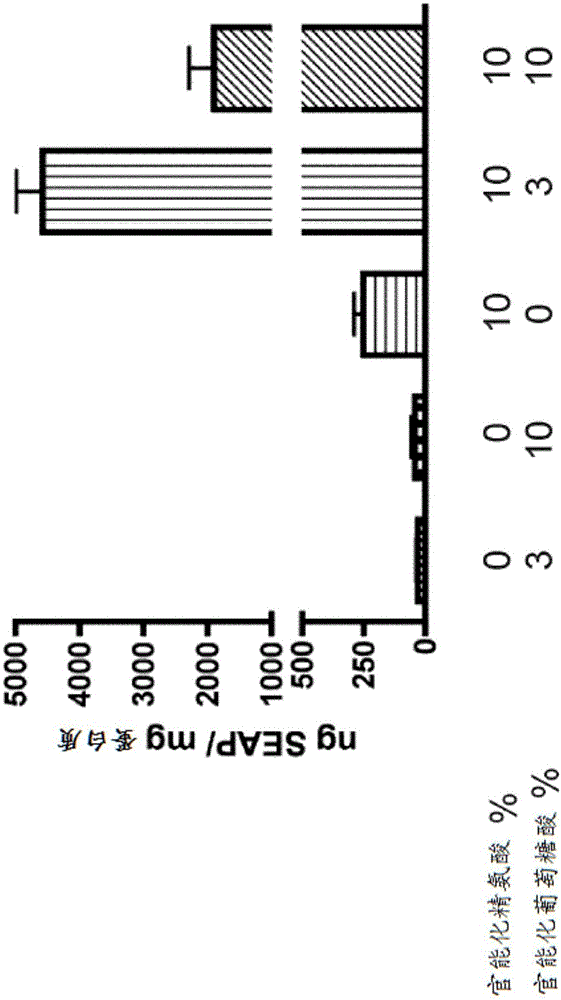
图1显示了仅用葡萄糖酸以3%或10%的最终官能化程度官能化、仅用精氨酸以10%的最终官能化程度官能化或者用葡萄糖酸和精氨酸两者以约1:1或约3.3:1的精氨酸与葡萄糖酸最终官能化程度比率官能化的5kDa壳聚糖(x-轴)的体外转染效率(ng SEAP/mg蛋白质;y-轴)。
图2显示了仅用葡萄糖酸以3%至10%的最终官能化程度官能化、仅用精氨酸以52%的最终官能化程度官能化或者用葡萄糖酸和精氨酸两者以约6:1或约17:1的精氨酸与葡萄糖酸最终官能化程度比率官能化的5kDa壳聚糖(x-轴)的转染效率(ng SEAP/mg蛋白质;y-轴)。
图3显示了仅用葡萄糖酸以3%至10%的最终官能化程度官能化、仅用精氨酸以26%的最终官能化程度官能化或者用葡萄糖酸和精氨酸两者以约4:1的精氨酸与葡萄糖酸最终官能化程度比率官能化的5kDa壳聚糖(x-轴)的转染效率(ng SEAP/mg蛋白质;y-轴)。
图4显示了仅用苏糖酸以3%的最终官能化程度官能化、或仅用精氨酸以29%的最终官能化程度官能化或者用苏糖酸和精氨酸两者以约10:1的精氨酸与苏糖酸最终官能化程度比率官能化的5kDa壳聚糖(x-轴)的转染效率(ng SEAP/mg蛋白质;y-轴)。
详述
壳聚糖是几丁质的去乙酰化形式,其是为甲壳纲动物(如虾、螃蟹、龙虾)外骨骼主要组分的N-乙酰基葡糖胺的聚合物。壳聚糖通过去乙酰化从几丁质形成,并且其本身并不是单个聚合物分子,但是一类具有不同分子量和不同去乙酰化程度的分子。商业壳聚糖的去乙酰化百分比通常在50-100%。
本文所述的壳聚糖衍生物通过用如本文所述的带正电的和/或亲水性部分官能化所得的游离氨基产生。本文所述的衍生化壳聚糖具有多种有利于核酸递送媒介物的性质,包括:它们有效地结合和复合带负电的核酸,它们可形成可控尺寸的纳米颗粒,它们可由细胞占据并且它们可在适当的时间在细胞内释放核酸。
任何去乙酰化(DDA)程度大于50%的壳聚糖可用于本发明,其官能化为1%至50%。(官能化百分比相对于壳聚糖聚合物上游离氨基部分的数目测定)。去乙酰化和官能化的程度赋予官能化壳聚糖衍生物以特定电荷密度。所得的电荷密度影响溶解度、核酸结合和随后释放及与哺乳动物细胞膜的相互作用。因此,根据本发明,这些性质必须为了最佳功效进行优化。示例性壳聚糖衍生物描述于Baker等;2007年1月24日提交的11/657,382中,其通过引用并入本文。在一个实施方案中,本文所述的双重衍生化壳聚糖包含具有至少50%的去乙酰化程度的壳聚糖。在一个实施方案中,去乙酰化程度是至少60%、更优选至少70%、更优选至少80%、更优选至少90%且最优选至少95%。在一个优选的实施方案中,本文所述的双重衍生化壳聚糖包含具有至少98%的去乙酰化程度的壳聚糖。
本文所述的壳聚糖衍生物具有一定范围的平均分子量,其可在中性和生理pH下溶解并且为了本发明的目的包括3–110kDa范围内的分子量。本文所述的实施方案的特征为衍生化壳聚糖较低的平均分子量(<25kDa,如约5kDa至约25kDa),其可具有所需的递送和转染性质并且尺寸小且具有有利的溶解度。较低的平均分子量衍生化壳聚糖通常比具有更高分子量的壳聚糖更可溶,前者因此产生了将更容易释放核酸且提供对细胞增加的转染的核酸/壳聚糖复合物。大量文献致力于优化基于壳聚糖的递送系统的所有这些参数。
普通技术人员将认识到壳聚糖是指具有式I结构的多个分子,其中n是任何整数且每个R1独立地选自乙酰基或氢,其中选自氢的R1的程度为50%至100%。此外,被称为具有如3kD至110kD的平均分子量的壳聚糖通常是指分别具有如3kD至110kD的重均分子量的多个壳聚糖分子,其中壳聚糖分子的每一个可具有不同链长(n+2)。还公认的是被称为“n-聚体壳聚糖”的壳聚糖不必包含式I的壳聚糖分子,其中每个壳聚糖分子具有n+2个的链长。相反,如本文所用的“n-聚体壳聚糖”是指多个壳聚糖分子,其每一个可具有不同链长,其中大多数具有与具有n个链长的壳聚糖分子基本上类似或相等的平均分子量。例如,24-聚体壳聚糖可包含多个壳聚糖分子,其各自具有范围为如7-50的不同链长但其具有与具有24个链长的壳聚糖分子基本上类似或相等的重均分子量。
本文所述的官能化壳聚糖衍生物是双重衍生化-壳聚糖化合物,如壳聚糖-Arg-HP化合物。通常,所述壳聚糖-Arg-HP化合物具有以下式I结构
其中n是1至650的整数,
α是Arg的最终官能化程度,
β是HP的最终官能化程度;且
每个R1独立地选自氢、乙酰基、Arg和HP。
本发明的双重衍生化壳聚糖可被阳离子氨基酸精氨酸官能化。
本发明的双重衍生化壳聚糖还可被亲水性多元醇官能化,所述亲水性多元醇可有助于提高壳聚糖(包括Arg-壳聚糖)的亲水性和/或可提供羟基。
提供了包含被精氨酸(Arg)和式VII的亲水性多元醇(HP)官能化的壳聚糖的壳聚糖-衍生物纳米颗粒:
其中:
R2选自:H和羟基;
R3选自:H和羟基;且
X选自:被一个或多个羟基取代基任选取代的C2-C6亚烷基。
在一些实施方案中,所述壳聚糖-衍生物纳米颗粒包含式VII的亲水性多元醇:
其中:
R2选自:H和羟基;
R3选自:H和羟基;且
X选自:被一个或多个羟基取代基任选取代的C2-C6亚烷基;前提是所述亲水性多元醇不是葡萄糖酸。
如本文所用的术语“C2-C6亚烷基”是指任选地含有一个或多个碳-碳三键的直链或支链二价烃基。为免生疑问,如本文所用的术语“C2-C6亚烷基”涵盖烷烃、烯烃和炔烃的二价基团。
根据本发明的亲水性多元醇可具有3、4、5、6或7个碳主链。在一个实施方案中,具有3至7个碳的根据本发明的亲水性多元醇可具有2、3、4、5或6个羟基。在一个实施方案中,具有3至7个碳的根据本发明的亲水性多元醇可具有一个或多个碳-碳多键。在一个优选的实施方案中,根据本发明的亲水性多元醇包含羧基。在另一个优选的实施方案中,根据本发明的亲水性多元醇包含醛基。技术人员将认识到当根据本发明的亲水性多元醇包含醛基时,此类亲水性多元醇涵盖开链构象(醛)和环状构象(半缩醛)两者。
亲水性多元醇的非限制性实例包括葡萄糖酸、苏糖酸、葡萄糖和苏阿糖,参见如式III-VI。可具有羧基和/或醛基或可为其糖或酸形式的其它此类亲水性多元醇的实例包含于下表1-3中。技术人员将认识到表1-3提供了亲水性多元醇的非限制性实例,并且此外所显示的亲水性多元醇不限于所显示的立体化学。
表1:某些亲水性多元醇羧酸和醛的化学结构
表2:某些亲水性多元醇羧酸的化学名称
表3:某些亲水性多元醇醛的化学名称
在一个优选的实施方案中,所述HP可选自由2,3-二羟基丙酸;2,3,4,5,6,7-六羟基庚醛;2,3,4,5,6-戊羟基己醛;2,3,4,5-四羟基己醛;和2,3-二羟基丙醛组成的组。
在一个优选的实施方案中,所述HP可选自由D-甘油酸、L-甘油酸、L-甘油基-D-甘露庚糖、D-甘油基-L-甘露庚糖、D-葡萄糖、L-葡萄糖、D-岩藻糖、L-岩藻糖、D-甘油醛和L-甘油醛组成的组。
在一个优选的实施方案中,α:β比率为约1:1至约10:1。在一个优选的实施方案中,所述比率为约3:1至约7:1。在一个最优选的实施方案中,所述比率为约5:1。
本文描述了用于根据本发明在水性介质中用精氨酸或亲水性多元醇缀合壳聚糖的非限制性方法。所述方法使用了熟知的水溶性1-乙基-3-(3-二甲基氨基丙基)-碳二亚胺(EDC)和N-羟基琥珀酰亚胺(NHS)以催化在壳聚糖主链上的氨基与Boc-保护的Arg上的羧酸或具有羧基的亲水性多元醇之间形成酰胺。
通常,于稀HCl溶液中的壳聚糖(其针对靶向偶联pH的调节pH为如6.0±0.5且更优选6.0±0.2)首先偶联至Arg如Boc-Arg或具有羧基的亲水性多元醇、纯化,然后与第二官能团偶联。例如,如果壳聚糖首先偶联至Arg,则Arg-偶联的壳聚糖(Arg-壳聚糖)可被纯化,然后偶联至亲水性多元醇。相反,如果壳聚糖首先偶联至亲水性多元醇,则亲水性多元醇-偶联的壳聚糖可被纯化,然后偶联至Arg。不考虑偶联的顺序,所述Arg和亲水性多元醇可使用熟知的方法偶联至壳聚糖。
例如,Arg可通过添加具有调节的pH的Boc-Arg和NHS水溶液的混合物至于稀HCl中的壳聚糖中、然后添加EDC水溶液以开始在室温下偶联24小时,偶联至壳聚糖或多元醇-官能化壳聚糖(多元醇-壳聚糖)。壳聚糖胺的浓度、反应pH和Arg-COOH与壳聚糖-胺和EDC:NHS:Arg-COOH的摩尔比率可经预计算并满足以具有可重现的Arg最终官能化程度。Boc-Arg-壳聚糖可被纯化,之后进行De-Boc反应。De-Boc可在具有经控制的HCl浓度和反应时间的HCl介质中进行。壳聚糖在de-Boc期间的任何解聚可通过测量证明可忽略不计的反应溶液的粘度变化来监测,并且de-Boc的效率可通过对de-Boc-Arg-壳聚糖和Boc-Arg-壳聚糖进行的核磁共振(NMR)法确定。官能化程度可根据经纯化的de-Boc-Arg-壳聚糖的C、N元素分析测定。
具有羧基的亲水性多元醇可在6.0±0.3的反应pH下偶联至壳聚糖或Arg-偶联的壳聚糖(Arg-壳聚糖)。在该pH下,所述亲水性多元醇的羧酸基团可根据亲核取代反应机制被壳聚糖主链上未偶联的胺攻击。普通技术人员将认识到当偶联此类亲水性多元醇至Arg-壳聚糖时,还可能的是少量的亲水性多元醇可通过相同的机制与Arg的胺基团形成共价键,尽管可能亲核取代反应可能主要与壳聚糖主链的胺基团发生。
为天然糖的亲水性多元醇可使用还原胺化、然后用NaCNBH3或NaBH4还原,偶联至壳聚糖或Arg-偶联的壳聚糖(Arg-壳聚糖)。
Boc-Arg-壳聚糖、de-Boc-Arg-壳聚糖、多元醇-壳聚糖和/或双重衍生化壳聚糖可经由沉淀或柱处理或常规透析或使用适当的分子量截止值(MWCO)的透析管针对水的回流透析或通过切向流过滤(TFF)和透滤柱纯化。
因此,“双重衍生化-壳聚糖”或“DD-壳聚糖”还指已被双重官能化的壳聚糖(“双重官能化-壳聚糖”或“DF-壳聚糖),如与Arg和亲水性多元醇两者偶联,所述Arg和亲水性多元醇两者共价连接至壳聚糖。所述Arg可以单一氨基酸或多肽形式共价连接至壳聚糖。
如本文所用,除非另外说明,否则术语“肽”和“多肽”可互换使用。
术语“多肽”以其最广泛的意义用于指代常规多肽(即含有L或D-氨基酸的短多肽),以及保留所需官能活性的肽等效物、肽类似物和肽模拟物。肽等效物可能通过用相关的有机酸、氨基酸等置换一个或多个氨基酸或者侧链或官能团的取代或修饰而不同于常规肽。
肽模拟物可具有如本领域已知的被替代性键联替换的一个或多个肽键。如本领域已知,部分或所有肽主链还可被构象上受约束的环状烷基或芳基取代基替代以限制官能性氨基酸侧链的活动性。
本发明的多肽可由公认的方法诸如本领域熟知的重组和合成方法产生。用于合成肽的技术是熟知的并且包括Merrifield,J.Amer.Chem.Soc.85:2149-2456(1963)、Atherton,等,Solid Phase Peptide Synthesis:A Practical Approach,IRL Press(1989)和Merrifield,Science 232:341-347(1986)中描述的那些。
如本文所用,“线性多肽”是指缺乏共价连接至其组成氨基酸侧链的支化基团的多肽。如本文所用,“支化多肽”是指包含共价连接至其组成氨基酸侧链的支化基团的多肽。
如上文中提及的,本发明的DD-壳聚糖的Arg最终官能化程度或多元醇最终官能化程度可通过元素分析测定。下文描述了如偶联至壳聚糖主链的精氨酸和葡萄糖酸的最终官能化程度的示例性计算。为清楚起见,以下实例使用100%DDA的20-聚体壳聚糖分子。
100%DDA的壳聚糖是D-葡糖胺的均聚物;该重复单元具有6个C原子和1个N原子,使得C/N的摩尔比率为6/1。
由于解聚过程,所述聚合物一端处的末端单元是2,5-脱水-D-甘露糖。该单元具有6/0的C/N比率。
结果,在20-聚体壳聚糖实例中,存在19个单元的D-葡糖胺和1个单元的2,5-脱水-D-甘露糖。因此,C/N的总比率是:
该比率被标准化为6个碳(其为每单元C原子平均数目)除以已知的平均氮整数:
在偶联如精氨酸至壳聚糖期间,所述精氨酸部分具有6个C和4个N。对于具有R%的平均精氨酸官能化程度的20个重复单元的精氨酸-修饰的壳聚糖,以下关系描述了来自壳聚糖和精氨酸的C和N的贡献:
C/N的摩尔比率根据实验来源的C/N质量比率的计算。结果,一旦C/N摩尔比率已知,可导出R%的官能化程度,即壳聚糖主链上与精氨酸基团偶联的氨基的百分比。
偶联葡萄糖酸至壳聚糖:
所述葡萄糖酸部分具有6个C和0个N。对于具有G%的官能化程度的20重复单元的葡萄糖酸-修饰的壳聚糖,以下关系描述了来自壳聚糖和葡萄糖酸的C和N的贡献:
C/N的摩尔比率根据实验来源的C/N质量比率计算。结果,一旦C/N摩尔比率已知,可导出G%的官能化程度,即壳聚糖主链上与葡萄糖酸部分偶联的胺基的百分比。
偶联精氨酸至壳聚糖,然后葡萄糖酸偶联:
当偶联葡萄糖酸至具有预定的精氨酸最终官能化程度(R%)的20重复单元的R-壳聚糖时,以下关系描述了来自壳聚糖、精氨酸和葡萄糖酸的C和N的贡献:
C/N的摩尔比率根据实验来源的C/N质量比率计算。结果,因为之前测定了R%,一旦C/N摩尔比率已知,可导出G%的官能化程度。
如上所述,如本文所用的Arg或HP的“最终官能化程度”是指分别用Arg或HP官能化的壳聚糖主链上氨基酸的百分比。因此,“α:β比率”、“最终官能化程度比率”(如Arg最终官能化程度:HP最终官能化程度比率)等可与术语“摩尔比率”或“数目比率互换使用。
在一个实施方案中,所述双重衍生化的壳聚糖不是如PCT申请No.PCT/CA2013/050218、特别是PCT/CA2013/050218的实施例中所例举的壳聚糖-衍生物纳米颗粒或壳聚糖-衍生物纳米颗粒多聚物。在一个实施方案中,所述壳聚糖-衍生物纳米颗粒不是以下纳米颗粒之一:
a.壳聚糖-衍生物纳米颗粒,其中所述纳米颗粒包含以52%的最终官能化程度与精氨酸和以8%的最终官能化程度与葡萄糖酸偶联的24聚体壳聚糖
b.胺/磷酸根(N/P)比率为20的壳聚糖-衍生物纳米颗粒,其中所述纳米颗粒包含以26%的最终官能化程度与精氨酸和以3%的最终官能化程度与葡萄糖酸偶联的24聚体壳聚糖;
c.胺/磷酸根(N/P)比率为20的壳聚糖-衍生物纳米颗粒,其中所述纳米颗粒包含以26%的最终官能化程度与精氨酸和以5%的最终官能化程度与葡萄糖酸偶联的24聚体壳聚糖;
d.胺/磷酸根(N/P)比率为20的壳聚糖-衍生物纳米颗粒,其中所述纳米颗粒包含以26%的最终官能化程度与精氨酸和以6%的最终官能化程度与葡萄糖酸偶联的24聚体壳聚糖;
e.胺/磷酸根(N/P)比率为20的壳聚糖-衍生物纳米颗粒,其中所述纳米颗粒包含以26%的最终官能化程度与精氨酸和以9%的最终官能化程度与葡萄糖酸偶联的24聚体壳聚糖;
f.胺/磷酸根(N/P)比率为40的壳聚糖-衍生物纳米颗粒,其中所述纳米颗粒包含以26%的最终官能化程度与精氨酸和以5%的最终官能化程度与葡萄糖酸偶联的24聚体壳聚糖;
g.胺/磷酸根(N/P)比率为10的壳聚糖-衍生物纳米颗粒,其中所述纳米颗粒包含以26%的最终官能化程度与精氨酸和以5%的最终官能化程度与葡萄糖酸偶联的24聚体壳聚糖;
h.壳聚糖-衍生物纳米颗粒,其中所述纳米颗粒包含以26%的最终官能化程度与精氨酸和以5%的最终官能化程度与葡萄糖酸偶联的24聚体壳聚糖;
i.壳聚糖-衍生物纳米颗粒,其中所述纳米颗粒包含以26%的最终官能化程度与精氨酸和以6%的最终官能化程度与葡萄糖酸偶联的24聚体壳聚糖;或者
j.壳聚糖-衍生物纳米颗粒,其中所述纳米颗粒包含以52%的最终官能化程度与精氨酸和以8%的最终官能化程度与葡萄糖酸偶联的24聚体壳聚糖。
在一个实施方案中,所述壳聚糖-衍生物纳米颗粒包含以1%、2%、4%、7%、8%、10%、15%、20%、25%、30%或更大的最终官能化程度与葡萄糖酸偶联的壳聚糖。在一个实施方案中,所述壳聚糖衍生物纳米颗粒包含以约1%至约25%的最终官能化程度与精氨酸偶联的壳聚糖。在另一个实施方案中,所述壳聚糖衍生物纳米颗粒包含以约27%至约51%的最终官能化程度与精氨酸偶联的壳聚糖。在一个实施方案中,所述壳聚糖衍生物纳米颗粒包含以精氨酸的约53%至约70%的最终官能化程度与精氨酸偶联的壳聚糖。在另一个实施方案中,所述壳聚糖衍生物纳米颗粒包含以并非26%或52%的最终官能化程度与精氨酸偶联的壳聚糖。
在一个实施方案中,所述壳聚糖衍生物纳米颗粒包含以26%的最终官能化程度与精氨酸偶联和以并非3%的最终官能化程度与葡萄糖酸偶联的壳聚糖。
在一个实施方案中,所述壳聚糖衍生物纳米颗粒包含以26%的最终官能化程度与精氨酸偶联和以并非5%的最终官能化程度与葡萄糖酸偶联的壳聚糖。在一个实施方案中,所述壳聚糖衍生物纳米颗粒包含以26%的最终官能化程度与精氨酸偶联和以并非6%的最终官能化程度与葡萄糖酸偶联的壳聚糖。在一个实施方案中,所述壳聚糖衍生物纳米颗粒包含以26%的最终官能化程度与精氨酸偶联和以并非9%的最终官能化程度与葡萄糖酸偶联的壳聚糖。在一个实施方案中,所述壳聚糖衍生物纳米颗粒包含以26%的最终官能化程度与精氨酸偶联和以并非3%、5%、6%或9%的最终官能化程度与葡萄糖酸偶联的壳聚糖。在一个实施方案中,所述壳聚糖衍生物纳米颗粒包含以52%的最终官能化程度与精氨酸偶联和以并非8%的最终官能化程度与葡萄糖酸偶联的壳聚糖。在一个实施方案中,所述壳聚糖衍生物纳米颗粒包含以选自3%、5%、6%和9%的最终官能化程度与葡萄糖酸偶联和以并非26%的最终官能化程度与精氨酸偶联的壳聚糖。在一个实施方案中,所述壳聚糖衍生物纳米颗粒包含以8%的最终官能化程度与葡萄糖酸偶联和以并非52%的最终官能化程度与精氨酸偶联的壳聚糖。
在一些实施方案中,在适当的情况下,DD-壳聚糖包括DD-壳聚糖衍生物,如掺入另外的官能化的DD壳聚糖,如具有连接的配体的DD-壳聚糖。“衍生物”将被理解为包括一大类包含共价修饰的N-乙酰基-D-葡糖胺和/或D-葡糖胺单元的基于壳聚糖的聚合物,以及掺入其它单元或连接至其它部分的基于壳聚糖的聚合物。衍生物通常基于诸如用精氨酸-官能化壳聚糖进行的葡糖胺羟基或胺基的修饰。壳聚糖衍生物的实例包括但不限于三甲基化壳聚糖、PEG化壳聚糖、硫醇化壳聚糖、半乳糖化壳聚糖、烷基化壳聚糖、PEI-掺入的壳聚糖、糖醛酸修饰的壳聚糖、二醇壳聚糖等。对于关于壳聚糖衍生物的另外教导,参见例如“Non-viral Gene Therapy”,K.Taira,K.Kataoka,T.Niidome(编辑),Springer-Verlag Tokyo,2005,ISBN 4-431-25122-7的第63-74页;Zhu等,Chinese Science Bulletin,2007年12月,第52(23)卷,第3207-3215页;和Varma等,Carbohydrate Polymers 55(2004)77–93。
分散系统由已知为分散于整个连续介质的分散相的颗粒物组成。DD-壳聚糖核酸多聚物的“分散体”是包含氢化DD-壳聚糖核酸多聚物的组合物,其中多聚物分散于整个介质中。
如本文所用,“预浓缩的”分散体是尚未经历浓缩过程以形成浓缩分散体的分散体。
如本文所用,“基本上不含”多聚物沉淀意指所述组合物基本上不含目测可观察到的颗粒。
如本文所用,生理pH是指6至8的pH。
“DD-壳聚糖核酸多聚物”或其语法等同物意指包含多个DD-壳聚糖分子和多个核酸分子的复合物。在一个优选的实施方案中,所述双重衍生化-壳聚糖与所述核酸复合。
所述DD-壳聚糖核酸多聚物包含核酸组分和DD-壳聚糖组分。壳聚糖和DD-壳聚糖核酸多聚物可通过本领域已知的任何方法制备。例如,可调节官能化壳聚糖和核苷酸原料浓度以适应各种胺-与-磷酸根比率(N/P)、混合比率和靶核苷酸浓度。在一些实施方案中,特别是小批次,如低于2mL的批次,所述官能化壳聚糖和核苷酸原料可通过滴入核苷酸原料至官能化壳聚糖原料中同时涡旋所述容器来混合。在其它实施方案中,所述官能化壳聚糖和核苷酸原料可通过内联混合两种液流混合。在其它实施方案中,所得的多聚物分散体可通过TFF浓缩。用于多聚物形成的优选方法公开于WO 2009/039657中,其通过引用以其整体明确地并入本文。
本发明的核酸通常将含有磷酸二酯键,尽管在一些情况下包括可为了多个目的如稳定性和保护使替代性的主链或其它修饰或部分掺入的核酸类似物。设想的其它类似物核酸包括那些具有非-核糖主链的类似物核酸。此外,可制备天然存在的核酸、类似物和两者的混合物。所述核酸可为单链或双链或含有双链或单链序列两者的一部分。核酸包括但不限于DNA、RNA和杂合体,其中所述核酸含有脱氧核糖-核苷酸和核糖-核苷酸的任何组合和碱基的任何组合,所述碱基包括尿嘧啶、腺嘌呤、胸腺嘧啶、胞嘧啶、鸟嘌呤、肌苷、黄嘌呤(xanthanine)、次黄嘌呤(hypoxanthanine)、异胞嘧啶、异鸟嘌呤等。核酸包括任何形式的DNA、任何形式的RNA,包括三链体、双链体或单链、反义、siRNA、核酶、脱氧核酶、多核苷酸、寡核苷酸、嵌合体、微小RNA及其衍生物。核酸包括人工核酸,包括但不限于肽核酸(PNA)、磷酰二胺吗啉代寡核苷酸(PMO)、锁核酸(LNA)、二醇核酸(GNA)和苏阿糖核酸(TNA)。
在一个实施方案中,所述核酸组分包含治疗性核酸。主题DD-壳聚糖核酸多聚物适于使用本领域已知的任何治疗性核酸。治疗性核酸包括治疗性RNA,其为能够在哺乳动物细胞中发挥疗效的RNA分子。治疗性RNA包括但不限于反义RNA、siRNA、短发夹RNA、微小RNA和酶促RNA。治疗性核酸包括但不限于意在形成三链体分子的核酸、蛋白质结合核酸、核酶、脱氧核酶及小核苷酸分子。
许多类型的治疗性RNA是本领域已知的。例如,参见Grimm等,Therapeutic application of RNAi is mRNA targeting finally ready for prime time?J.Clin.Invest.,117:3633-3641,2007;Aagaard等,RNAi therapeutics:Principles,prospects and challenges,Adv.Drug Deliv.Rev.,59:75-86,2007;Dorsett等,siRNAs:Applications in functional genomics and potential as therapeutics,Nat.Rev.Drug Discov.,3:318-329,2004。这些包括双链短干扰RNA(siRNA)。
治疗性核酸还包括编码治疗性蛋白质、包括细胞毒性蛋白质和前药的核酸。
在一个优选的实施方案中,所述核酸组分包含治疗性核酸构建体。所述治疗性核酸构建体是能够发挥疗效的核酸构建体。治疗性核酸构建体可包含编码治疗性蛋白质的核酸以及产生为治疗性RNA的转录物的核酸。治疗性核酸可通过用作缺陷基因的置换或增强用于实现基因疗法或通过编码治疗性产物用于补偿特定基因产物的缺乏。治疗性核酸还可展现出内源基因的表达。治疗性核酸可编码翻译产物的所有或一部分,并且可通过与细胞中已存在的DNA重组来起作用,从而替代基因的缺陷部分。其还可蛋白质的一部分并凭借基因产物的共表达发挥其作用。在一个优选的实施方案中,所述治疗性核酸选自U.S.S.N.11/694,852中公开的那些,所述文献通过引用明确并入本文。
在一个优选的实施方案中,所述治疗性核酸编码选自由以下组成的组的治疗性蛋白质:激素、酶、细胞因子、趋化因子、抗体、有丝分裂因子、生长因子、分化因子、影响血管生成的因子、影响血凝块形成的因子、影响血液葡萄糖水平的因子、影响葡萄糖代谢的因子、影响脂质代谢的因子、影响血液胆固醇水平的因子、影响血液LDL或HDL水平的因子、影响细胞凋亡的因子、影响食物摄取的因子、影响能量消耗的因子、影响食欲的因子、影响营养吸收的因子、影响炎症和影响骨形成的因子。特别优选编码胰岛素、瘦素、胰高糖素拮抗剂、GLP-1、GLP-2、胃饥饿素、缩胆囊素、生长激素、凝血因子、PYY、红细胞生成素、炎症抑制剂、IL-10、IL-17拮抗剂、TNFα拮抗剂、生长激素释放激素或甲状旁腺激素的治疗性核酸。
表达控制区
在一个优选的实施方案中,本发明的多聚物包含治疗性核酸,其为包含可操作地连接至编码区的表达控制区的治疗性构建体。所述治疗性构建体产生治疗性核酸,所述治疗性核酸本身可具有治疗性或可编码治疗性蛋白质。
在一些实施方案中,治疗性构建体的表达控制区具有组成性活性。在多个优选的实施方案中,治疗性构建体的表达控制区不具有组成性活性。这提供了治疗性核酸的动态表达。“动态”表达意指随着时间推移而变化的表达。动态表达可包括数个此类由可检测表达时期间隔开的低或缺乏表达的时期。在多个优选的实施方案中,所述治疗性核酸可操作地连接至可调控的启动子。这提供了治疗性核酸的可调控表达。
表达控制区包含可影响可操作连接的治疗性核酸表达的调控性多核苷酸(在本文中有时被称为元件),诸如启动子和增强子。
本文中包括的表达控制元件可来自细菌、酵母、植物或动物(哺乳动物或非-哺乳动物)。表达控制区包含全长启动子序列,诸如天然启动子和增强子元件,以及保留全部或部分全长或非-变体功能(如保留一些量的营养调控或细胞/组织特异性表达)的子序列或多核苷酸变体。如本文所用,术语“功能性”及其语法变型当用于指代核酸序列、子序列或片段时,意指所述序列具有天然核酸序列(如非-变体或未经修饰的序列)的一种或多种功能。如本文所用,术语“变体”意指序列取代、缺失或添加或其它修饰(如化学衍生物诸如对核酸酶耐受的经修饰的形式)。
如本文所用,术语“可操作的键联”是指如此描述以使得它们以预期方式起作用的所述组分的物理上地并置。在与核酸的可操作的键联中表达控制元件的实例中,所述关系是使得控制元件调节所述核酸表达。通常地,调节转录的表达控制区并置于转录核酸的5'末端(即“上游”)附近。表达控制区还可位于转录序列的3'末端(即“下游”)或在转录物内(如在内含子内)。表达控制元件可位于远离转录序列的一定距离处(如远离所述核酸100至500、500至1000、2000至5000或更多个核苷酸)。表达控制元件的一个特定实例是通常位于转录序列的5'的启动子。表达控制元件的另一个实例是可位于转录序列的5'或3'或转录序列内的增强子。
一些表达控制区赋予可操作连接的治疗性核酸以可调控的表达。信号(有时被称为刺激源)可增加或减少可操作连接至此类表达控制区的治疗性核酸的表达。此类响应于信号而增加表达的表达控制区通常被称为可诱导的。此类响应于信号而减少表达的表达控制区通常被称为可阻遏的。通常地,由此类元件赋予的增加或减少的量与存在的信号的量成比例;信号量越大,则表达的增加或减少越大。
多个可调控的启动子是本领域已知的。优选的诱导型表达控制区包含包用小分子化学化合物刺激的含诱导型启动子的那些。在一个实施方案中,表达控制区响应于经口可递送但通常不在食物中存在的化学物质。优选的实例可见例如美国专利No.5,989,910;5,935,934;6,015,709;和6,004,941。
在一个实施方案中,所述治疗性构建体还包含整合序列。在一个实施方案中,所述治疗性构建体包含单条整合序列。在另一个实施方案中,所述治疗性构建体包含用于整合所述治疗性核酸或其一部分至靶细胞的基因组中的第一和第二整合序列。在一个优选的实施方案中,所述整合序列与用于整合的工具(means)组合起作用,所述用于整合的工具选自由mariner、睡美人(sleeping beauty)、FLP、Cre、ФC31、R、λ和用于从整合病毒诸如AAV、逆转录病毒和慢病毒整合的工具组成的组。
在一个实施方案中,主题组合物除了治疗性构建体之外还包含非-治疗性构建体,其中所述非-治疗性构建体包含编码可操作连接至第二表达控制区的整合工具的核酸序列。该第二表达控制区和可操作连接至所述治疗性核酸的表达控制区可相同或不同。用于整合的编码工具优选选自由mariner、睡美人、FLP、Cre、ФC31、R、λ和用于从整合病毒诸如AAV、逆转录病毒和慢病毒整合的工具组成的组。
对于另外的教导,参见WO2008020318,其通过引用以其整体明确地并入本文。在一个实施方案中,所述DD-壳聚糖核酸多聚物的核酸是人工核酸。
优选的人工核酸包括但不限于肽核酸(PNA)、磷酰二胺吗啉代寡核苷酸(PMO)、锁核酸(LNA)、二醇核酸(GNA)和苏阿糖核酸(TNA)。
在一个实施方案中,所述DD-壳聚糖核酸多聚物的核酸是治疗性核酸。在一个实施方案中,所述治疗性核酸是治疗性RNA。优选的治疗性RNA包括但不限于反义RNA、siRNA、短发夹RNA、微小RNA和酶促RNA。
在一个实施方案中,所述治疗性核酸是DNA。
在一个实施方案中,所述治疗性核酸包含编码治疗性蛋白质的核酸序列。
在优选的实施方案中,所述双重衍生化的(DD)壳聚糖核酸多聚物不是包含编码复合至以下壳聚糖-衍生物纳米颗粒之一的分泌型碱性磷酸酶(SEAP)或荧光素酶的核酸的多聚物:
a.壳聚糖-衍生物纳米颗粒,其中所述纳米颗粒包含以52%的最终官能化程度与精氨酸和以8%的最终官能化程度与葡萄糖酸偶联的24聚体壳聚糖;
b.胺/磷酸根(N/P)比率为20的壳聚糖-衍生物纳米颗粒,其中所述纳米颗粒包含以26%的最终官能化程度与精氨酸和以3%的最终官能化程度与葡萄糖酸偶联的24聚体壳聚糖;
c.胺/磷酸根(N/P)比率为20的壳聚糖-衍生物纳米颗粒,其中所述纳米颗粒包含以26%的最终官能化程度与精氨酸和以5%的最终官能化程度与葡萄糖酸偶联的24聚体壳聚糖;
d.胺/磷酸根(N/P)比率为20的壳聚糖-衍生物纳米颗粒,其中所述纳米颗粒包含以26%的最终官能化程度与精氨酸和以6%的最终官能化程度与葡萄糖酸偶联的24聚体壳聚糖;
e.胺/磷酸根(N/P)比率为20的壳聚糖-衍生物纳米颗粒,其中所述纳米颗粒包含以26%的最终官能化程度与精氨酸和以9%的最终官能化程度与葡萄糖酸偶联的24聚体壳聚糖;
f.胺/磷酸根(N/P)比率为40的壳聚糖-衍生物纳米颗粒,其中所述纳米颗粒包含以26%的最终官能化程度与精氨酸和以5%的最终官能化程度与葡萄糖酸偶联的24聚体壳聚糖;
g.胺/磷酸根(N/P)比率为10的壳聚糖-衍生物纳米颗粒,其中所述纳米颗粒包含以26%的最终官能化程度与精氨酸和以5%的最终官能化程度与葡萄糖酸偶联的24聚体壳聚糖;
h.壳聚糖-衍生物纳米颗粒,其中所述纳米颗粒包含以26%的最终官能化程度与精氨酸和以5%的最终官能化程度与葡萄糖酸偶联的24聚体壳聚糖;
i.壳聚糖-衍生物纳米颗粒,其中所述纳米颗粒包含以26%的最终官能化程度与精氨酸和以6%的最终官能化程度与葡萄糖酸偶联的24聚体壳聚糖;或者
j.壳聚糖-衍生物纳米颗粒,其中所述纳米颗粒包含以52%的最终官能化程度与精氨酸和以8%的最终官能化程度与葡萄糖酸偶联的24聚体壳聚糖。
多聚物
在一个优选的实施方案中,所述组合物的多聚物包含在官能化前具有小于110kDa、更优选小于65kDa、更优选小于50kDa、更优选小于40kDa且最优选小于30kDa的平均分子量的壳聚糖分子。在一些实施方案中,所述组合物的多聚物包含在官能化前具有小于15kDa、小于10kDa、小于7kDa或小于5kDa的平均分子量的壳聚糖。
在一个优选的实施方案中,所述多聚物包含具有平均小于680个葡糖胺单体单元、更优选小于400个葡糖胺单体单元、更优选小于310个葡糖胺单体单元、更优选小于250个葡糖胺单体单元且最优选小于190个葡糖胺单体单元的壳聚糖分子。在一些实施方案中,所述多聚物包含具有平均小于95个葡糖胺单体单元、小于65个葡糖胺单体单元、小于45个葡糖胺单体单元或小于35个葡糖胺单体单元的壳聚糖分子。
在一个优选的实施方案中,主题多聚物具有2至100、如2至50、如2至40、如2至30、如2至20、如2至5的胺与磷酸根(N/P)比率。优选地,所述N/P比率与壳聚糖分子量成反比,即较小的分子量DD-壳聚糖需要更高的N/P比率,而反之亦然。
在一个优选的实施方案中,主题多聚物具有小于1000nm、更优选小于500nm且最优选小于200nm的平均流体力学直径。
在一个实施方案中,所述DD-壳聚糖核酸多聚物在酸性pH如低于7的pH、最优选约4至6的pH下具有至少0mV的平均ζ电势。
在一个实施方案中,所述DD-壳聚糖核酸多聚物在酸性pH下具有+1至+60mV、更优选+1至+40mV、更优选+1至+30mV的平均ζ电势。
在一个优选的实施方案中,所述多聚物在生理pH和低于6的pKa下具有低净正、中性或净负电荷。此类DD-壳聚糖核酸多聚物展现出减少的细胞毒性和增强的核酸胞内释放。
所述组合物的DD-壳聚糖核酸多聚物就关于多聚物尺寸方面优选是均匀的。因此,在一个优选的实施方案中,所述组合物具有低平均多分散指数(“PDI”)。在一个特别优选的实施方案中,所述DD-壳聚糖核酸多聚物分散体的PDI小于0.5、更优选小于0.4、更优选小于0.3且最优选小于0.25。
主题组合物的多聚物在所述组合物中优选是基本上尺寸稳定的。在一个优选的实施方案中,本发明的组合物包含在室温下在6小时、更优选12小时、更优选24小时且最优选48小时内平均直径增加小于100%、更优选小于50%且最优选小于25%的多聚物。在一个特别优选的实施方案中,本发明的组合物包含在室温下在至少24小时或至少48小时内平均直径增加小于25%的多聚物。
主题组合物的多聚物在冷却条件下优选是基本上尺寸稳定的。在一个优选的实施方案中,本发明的组合物包含在2-8摄氏度下在6小时、更优选12小时、更优选24小时且最优选48小时内平均直径增加小于100%、更优选小于50%且最优选小于25%的多聚物。
主题组合物的多聚物在冻融条件下优选是基本上尺寸稳定的。在一个优选的实施方案中,本发明的组合物包含在室温下在从-20至-80摄氏度的冷冻解冻之后6小时、更优选12小时、更优选24小时且最优选48小时内平均直径增加小于100%、更优选小于50%且最优选小于25%的多聚物。
在一个优选的实施方案中,所述组合物具有大于0.5mg/ml的核酸浓度,且基本上不含沉淀的多聚物。更优选,所述组合物具有至少0.6mg/ml、更优选至少0.75mg/ml、更优选至少1.0mg/ml、更优选至少1.2mg/ml且最优选至少1.5mg/ml的核酸浓度,且基本上不含沉淀的多聚物。所述组合物是水合的。在一个优选的实施方案中,所述组合物基本上不含未复合的核酸。
在一个优选的实施方案中,所述DD-壳聚糖核酸多聚物组合物是等渗的。获得等渗性同时维持多聚物稳定性在配制药物组合物中是非常需要的,并且这些优选的组合物非常适于药物配制和治疗应用。
通常,包含DD-壳聚糖核酸多聚物的组合物用于接触靶细胞。此类接触通常导致所述核酸的递送以用于由靶向细胞表达。适用于本文所述的DD-壳聚糖核酸多聚物的组合物是本领域熟知的,并且通常描述如下。
在一个优选的实施方案中,所述组合物的多聚物包含在官能化之前平均分子量小于50kDa、平均小于310个葡糖胺单体单元、N/P比率为2至20、平均流体力学直径小于500nm、在酸性pH下平均ζ电势为至少0mV、PDI小于0.5、核酸浓度大于0.5mg/ml的壳聚糖分子,基本上不含沉淀的多聚物,并且所述多聚物是尺寸稳定的,因为它们的平均直径在室温下在至少6小时、至少12小时、至少24小时或至少48小时内增加小于100%。在一个优选的实施方案中,所述DD-壳聚糖核酸多聚物组合物是等渗的并且在冻融条件下是基本上尺寸稳定的。
在一个优选的实施方案中,所述组合物的多聚物包含在官能化之前平均分子量小于65kDa、平均小于400个葡糖胺单体单元、N/P比率为2至20、平均流体力学直径小于500nm、在酸性pH下平均ζ电势为+1至+40mV、PDI小于0.4、核酸浓度大于0.5mg/ml的壳聚糖分子,基本上不含沉淀的多聚物,且所述多聚物是尺寸稳定的,因为它们的平均直径在室温下在至少6小时、至少12小时、至少24小时或至少48小时内增加小于50%。在一个优选的实施方案中,所述DD-壳聚糖核酸多聚物组合物是等渗的且在冻融条件下基本上是尺寸稳定的。
在一个优选的实施方案中,所述组合物的多聚物包含官能化之前平均分子量小于40kDa、平均小于250个葡糖胺单体单元、N/P比率为2至20、平均流体力学直径小于500nm、在酸性pH下平均ζ电势为+1至+30mV、PDI小于0.3、核酸浓度大于0.5mg/ml的壳聚糖分子,基本上不含沉淀的多聚物,且所述多聚物是尺寸稳定的,因为它们的平均直径在室温下在至少6小时、至少12小时、至少24小时或至少48小时内增加小于50%。在一个优选的实施方案中,所述DD-壳聚糖核酸多聚物组合物是等渗的且在冻融条件下基本上是尺寸稳定的。
在一个优选的实施方案中,所述组合物的多聚物包含在官能化前平均分子量小于30kDa、平均小于190个葡糖胺单体单元、N/P比率为2至5、平均流体力学直径小于500nm、在酸性pH下平均ζ电势为+1至+30mV、PDI小于0.25、核酸浓度大于0.5mg/ml的壳聚糖分子,基本上不含沉淀的多聚物,且所述多聚物是尺寸稳定的,因为它们的平均直径在室温下在至少6小时、至少12小时、至少24小时或至少48小时内增加小于25%。在一个优选的实施方案中,所述DD-壳聚糖核酸多聚物组合物是等渗的且在冻融条件下基本上是尺寸稳定的。
在一个优选的实施方案中,所述组合物的多聚物包含在官能化前平均分子量小于30kDa、平均小于190个葡糖胺单体单元、N/P比率为2至5、平均流体力学直径小于500nm、在酸性pH下平均ζ电势为+1至+30mV、PDI小于0.25、核酸浓度大于0.75mg/ml的壳聚糖分子,基本上不含沉淀的多聚物,且所述多聚物是尺寸稳定的,因为它们的平均直径在室温下在至少6小时、至少12小时、至少24小时或至少48小时内增加小于25%。在一个优选的实施方案中,所述DD-壳聚糖核酸多聚物组合物是等渗的且在冻融条件下基本上是尺寸稳定的。
在一个优选的实施方案中,所述组合物的多聚物包含在官能化前平均分子量小于15kDa、平均小于95个葡糖胺单体单元、N/P比率为2至5、平均流体力学直径小于200nm、在酸性pH下平均ζ电势为+1至+30mV、PDI小于0.25、核酸浓度大于1.0mg/ml的壳聚糖分子,基本上不含沉淀的多聚物,且所述多聚物是尺寸稳定的,因为它们的平均直径在室温下在至少6小时、至少12小时、至少24小时或至少48小时内增加小于50%。在一个优选的实施方案中,所述DD-壳聚糖核酸多聚物组合物是等渗的且在冻融条件下基本上是尺寸稳定的。
粉末化制剂
本发明的DD-壳聚糖核酸多聚物组合物包括粉末。在一个优选的实施方案中,本发明提供了干粉末DD-壳聚糖核酸多聚物组合物。在一个优选的实施方案中,所述干粉末DD-壳聚糖核酸多聚物组合物通过本发明的壳聚糖-核酸多聚物分散体的脱水产生。
药物制剂
本发明还提供了包含本发明的DD-壳聚糖核酸多聚物组合物的“药学上可接受的”或“生理学上可接受的”制剂。此类制剂可体内施用至受试者以实施治疗方法。
如本文所用,术语“药学上可接受的”和“生理学上可接受的”是指可向受试者施用优选不产生过多的不利副作用(如恶心、腹痛、头痛等)的载体、稀释剂、赋形剂等。用于施用的此类制剂包括无菌水性或非-水性溶液、混悬液和乳液。
药物制剂可从与向受试者施用相容的载体、稀释剂、赋形剂、溶剂、分散介质、包衣、抗细菌剂和抗真菌剂、等渗剂和吸收延迟剂等制备。此类制剂可包含于片剂(包衣或未包衣的)、胶囊(硬或软)、微珠、乳剂、粉末剂、颗粒剂、晶体、混悬剂、糖浆剂或酏剂中。除了其它添加剂之外还可存在补充性活性化合物和防腐剂,例如抗微生物剂、抗氧化剂、螯合剂和惰性气体等。
赋形剂可包括盐、等渗剂、血清蛋白质、缓冲液或其它pH-控制剂、抗氧化剂、增稠剂、不带电的聚合物、防腐剂或冷冻保护剂。本发明组合物所用的赋形剂还可包括等渗剂和缓冲液或其它pH-控制剂。可添加这些赋形剂以获得优选范围的pH(约6.0-8.0)和同渗容摩(约50-400mmol/L)。适合的缓冲液的实例是乙酸盐、硼酸盐、碳酸盐、柠檬酸盐、磷酸盐和磺化有机分子缓冲液。此类缓冲液可以0.01至1.0%(w/v)的浓度存在于组合物中。等渗剂可选自本领域已知的那些的任一种,如甘露醇、右旋糖、葡萄糖和氯化钠,或其它电解质。优选地,所述等渗剂是葡萄糖或氯化钠。所述等渗剂可以赋予所述组合物以与引入其的生物环境的渗透压相同或类似的渗透压的量使用。等渗剂在所述组合物中的浓度将取决于使用的特定等渗剂的性质,并且可在约0.1至10%的范围内。当使用葡萄糖时,其优选以1至5%w/v、更具体的5%w/v的浓度使用。当所述等渗剂是氯化钠时,其优选以高达1%w/v、特别是0.9%w/v的量采用。本发明的组合物还可含有防腐剂。示例性防腐剂是聚六亚甲基双胍、苯扎氯铵、稳定的氧氯复合物(诸如被称为的那些)、醋酸苯汞、氯丁醇、山梨酸、氯己定、苯甲醇、对羟基苯甲酸酯和硫柳汞。通常地,此类防腐剂以约0.001至1.0%的浓度存在。此外,本发明的组合物还可含有冷冻保护剂。优选的冷冻保护剂是葡萄糖、蔗糖、甘露醇、乳糖、海藻糖、山梨糖醇、胶态二氧化硅、分子量优选低于100,000g/mol的葡聚糖、甘油和分子量低于100,000g/mol的聚乙二醇或其混合物。最优选的是葡萄糖、海藻糖和聚乙二醇。通常地,此类冷冻保护剂以约0.01至10%的浓度存在。
药物制剂可被配制为与其预期施用途径相容。例如,对于经口施用,组合物可掺入赋形剂并以片剂、含片、胶囊(如明胶胶囊)或包衣(如肠溶包衣(或))的形式使用。药学上相容的结合剂和/或辅助材料可包含于经口制剂中。片剂、丸剂、胶囊、含片等可含有以下成分或具有类似性质的化合物的任一种:粘合剂诸如微晶纤维素、黄蓍胶或明胶;赋形剂诸如淀粉或乳糖,崩解剂诸如藻酸、Primogel或玉米淀粉;润滑剂诸如硬脂酸镁或其它硬脂酸酯;助流剂诸如胶态二氧化硅;甜味剂诸如蔗糖或糖精;或调味剂诸如薄荷、水杨酸甲酯或调味剂。
制剂还可包含载体以保护所述组合物免于从身体快速降解或消除,诸如控制释放制剂,包括植入物和微胶囊化递送系统。例如,可采用延时材料,诸如单独或与蜡组合的单硬脂酸甘油酯或硬脂酸甘油酯。
还可考虑栓剂和其它经直肠施用的制剂(如通过灌肠施用的那些)。进一步关于经直肠递送,参见例如Song等,Mucosal drug delivery:membranes,methodologies,and applications,Crit.Rev.Ther.Drug.Carrier Syst.,21:195-256,2004;Wearley,Recent progress in protein and peptide delivery by noninvasive routes,Crit.Rev.Ther.Drug.Carrier Syst.,8:331-394,1991。
另外适于施用的药物制剂是本领域已知的并且可适用于本发明的方法和组合物中(参见如Remington's Pharmaceutical Sciences(1990)第18版,Mack Publishing Co.,Easton,Pa.;The Merck Index(1996)第12版,Merck Publishing Group,Whitehouse,N.J.;and Pharmaceutical Principles of Solid Dosage Forms,Technonic Publishing Co.,Inc.,Lancaster,Pa.,(1993))。
施用
在一个实施方案中,在DD-壳聚糖核酸多聚物中使用DD-壳聚糖提供在生理pH下延长的多聚物稳定性。这提供了有效全身施用以及其它施用模式。
多个施用途径的任何一个是可能的,并且特定途径的选择将部分取决于靶组织。可使用注射器、内窥镜、套管、插管、导管和其它制品用于施用。
用于治疗受试者的剂量或“有效量”优选地足以缓解所述疾患的一个、若干个或所有症状至可测量或可检测的程度,尽管预防或抑制所述病症或疾患或症状的进展或恶化是令人满意的结果。因此,在通过在靶组织中表达治疗性核酸可治疗的疾患或病症的情况下,产生的治疗性RNA或治疗性蛋白质缓解通过本发明的方法可治疗的疾患的量将取决于所述疾患和所需结果,并且可由本领域技术人员容易地确定。适当的量将取决于经治疗的疾患、所需的疗效、以及单独的受试者(如受试者内的生物利用率、性别、年龄等)。有效量可通过测量相关生理效果确定。
本发明还考虑了兽医学应用。因此,在一个实施方案中,本发明提供了治疗非人哺乳动物的方法,其涉及向需要治疗的非人哺乳动物施用本发明的基于壳聚糖的纳米颗粒。
胃肠外施用
本发明的化合物可直接施用至血液、肌肉或内部器官中。适用于胃肠外施用的方法包括静脉内、动脉内、腹腔内、鞘内、心室内、尿道内、胸骨内、颅内、肌内和皮下。适用于胃肠外施用的装置包括针(包括微针)注射器、无针注射器和输注技术。
胃肠外制剂通常是可含有赋形剂诸如盐、碳水化合物和缓冲剂的水溶液,但对于一些应用,它们可更适于配制为无菌非水溶液或待连同适合的媒介物诸如无菌、无热原水使用的干燥形式。
在无菌条件下例如通过冻干配制胃肠外制剂可使用本领域技术人员熟知的标准药学技术完成。
用于制备胃肠外溶液的化合物的溶解度可通过使用适当的配制技术诸如掺入溶解度-增强剂增加。
用于胃肠外施用的制剂可被配制为立即和/或调节释放。调节释放制剂包括延迟释放、持续释放、脉冲释放、控制释放、靶向释放和程序化释放。因此本发明的化合物可被配制为固体、半固体或触变性液体以作为提供活性化合物的调节释放的植入库施用。
经口施用
主题组合物可经口施用。经口施用可涉及吞咽,使得所述化合物进入胃肠道。本发明的组合物还可直接施用至胃肠道。
适用于经口施用的制剂包括固体制剂,诸如片剂、胶囊、含有颗粒或包衣颗粒的包衣胶囊、液体或粉末剂、锭剂(包括液体填充的)、咀嚼物、多-颗粒剂和纳米-颗粒剂、凝胶剂、膜、胚珠(ovule)和喷雾剂。
液体制剂包括混悬剂、溶液、糖浆剂和酏剂。液体制剂可通过复溶固体制备。
片剂剂型通常含有崩解剂。崩解剂的实例包括羟基乙酸淀粉钠、羧甲基纤维素钠、羧甲基纤维素钙、交联羧甲基纤维素钠、交聚维酮、聚乙烯吡咯烷酮、甲基纤维素、微晶纤维素、低级烷基-取代的羟丙基纤维素、淀粉、预胶化的淀粉和海藻酸钠。通常,所述崩解剂将包含1重量%至25重量%、优选5重量%至20重量%的所述剂型。
粘合剂通常用于赋予片剂制剂以粘着性质。适合的粘合剂包括微晶纤维素、明胶、糖、聚乙二醇、天然和合成树胶、聚乙烯吡咯烷酮、预胶化的淀粉、羟丙基纤维素和羟丙基甲基纤维素。片剂还可含有稀释剂,诸如乳糖(单水合物,喷雾干燥的单水合物、无水物等)、甘露醇、木糖醇、右旋糖、蔗糖、山梨糖醇、微晶纤维素、淀粉和磷酸氢钙二水合物。
片剂还可任选地包含表面活性剂诸如十二烷基硫酸钠和聚山梨醇酯80,及助流剂诸如二氧化硅和滑石。当存在时,表面活性剂可包含0.2重量%至5重量%的片剂,并且助流剂可包含0.2重量%至1重量%的片剂。
片剂通常还含有润滑剂,诸如硬脂酸镁、硬脂酸钙、硬脂酸锌、硬脂富马酸钠及硬脂酸镁与十二烷基硫酸钠的混合物。润滑剂通常占片剂的0.25重量%至10重量%、优选0.5重量%至3重量%。
其它可能的成分包括抗氧化剂、着色剂、调味剂、防腐剂和掩味剂。
片剂掺混物可直接压缩或通过滚轮形成片剂。片剂掺混物或掺混物一部分可另外被湿法-、干法-或熔体-粒化、熔体凝结或挤出,之后压片。最终制剂可包含一层或多层,并且可为包衣或未包衣的;其甚至可被封装。
所述片剂的配制于Pharmaceutical Dosage Forms:Tablets,第1卷,H.Lieberman和L.Lachman(Marcel Dekker,New York,1980)中讨论。
用于人或兽医学用途的可消耗的经口膜通常是柔韧的水溶性或水溶胀性薄膜剂型,其可快速溶解或粘膜粘附且通常包含成膜性聚合物、粘合剂、溶剂、润湿剂、增塑剂、稳定剂或乳化剂、粘度调节剂和溶剂。所述制剂的一些组分可执行一种以上的功能。
本发明还包括包含本发明的组合物的多颗粒物珠。
其它可能的成分包括抗氧化剂、着色剂、调味剂和增味剂、防腐剂、唾液刺激剂、冷却剂、共-溶剂(包括油)、软化剂、膨胀剂、消泡剂、表面活性剂和掩味剂。
根据本发明的膜通常通过蒸发干燥涂覆至可剥离后撑或纸张上薄水性膜制备。这可在干燥烘箱或通道(通常是结合式涂覆器干燥器(combined coater dryer))中进行,或通过冻干或抽真空进行。
用于经口施用的固体制剂可被配制为立即和/或调节释放。调节释放制剂包括延迟释放、持续释放、脉冲释放、控制释放、靶向释放和程序化释放。
其它适合的释放技术诸如高能分散及渗透性颗粒和包衣颗粒是已知的。
局部施用
本发明的化合物还可局部施用至皮肤或粘膜,即经皮或透皮施用。为了该目的的典型制剂包括凝胶剂、水凝胶剂、洗剂、溶液、乳膏剂、软膏剂、除尘粉、敷料、泡沫剂、膜、皮肤贴剂、干胶片、植入物、海绵、纤维、绷带和微乳剂。
其它局部施用方式包括通过电穿孔、离子电渗疗法、超声透入疗法、超声波导入术和微针或无针(如PowderjectTM、BiojectTM等)注射递送。
用于局部施用的制剂可被配制为立即和/或调节释放。调节释放制剂包括延迟释放、持续释放、脉冲释放、控制释放、靶向释放和程序化释放。
吸入/鼻内施用
本发明的化合物还可在使用或不使用适合的推进剂的情况下鼻内或通过吸入、通常从干粉吸入器以干粉末剂的形式(单独,作为混合物例如以与乳糖的干掺混物的形式,或作为混合组分颗粒)或作为气雾剂喷雾从压力容器、泵、喷雾器(spray)、雾化器或喷雾器(nebuliser)施用。
用于吸入器或吹入器中的胶囊、泡罩和药盒可被配制为含有本发明化合物的、适合粉末基料(例如乳糖或淀粉)和改性剂(例如I-亮氨酸、甘露醇或硬脂酸镁)的粉末混合物。
用于吸入/鼻内施用的制剂可配制为立即和/或调节释放。调节释放制剂包括延迟释放、持续释放、脉冲释放、控制释放、靶向释放和程序化释放。
经直肠/阴道内施用
本发明的化合物可经直肠或经阴道、例如以栓剂、阴道栓或灌肠剂的形式施用。可可脂是常规栓剂基料,但各种替代物可视情况使用。
用于经直肠/经阴道施用的制剂可配制为立即和/或调节释放。调节释放制剂包括延迟释放、持续释放、脉冲释放、控制释放、靶向释放和程序化释放。
经眼/经耳施用
本发明的化合物还可直接施用至眼或耳,通常以滴剂的形式。其它适用于经眼和经耳施用的制剂包括软膏剂、生物可降解的(如可吸收的凝胶海绵、胶原)和非-生物可降解的(如硅酮)植入物、晶片、透镜和微粒系统。制剂还可通过离子电渗疗法递送。
用于经眼/经耳施用的制剂可配制为立即和/或调节释放。调节释放制剂包括延迟释放、持续释放、脉冲释放、控制释放、靶向释放或程序化释放。
使用方法
在一个实施方案中,本发明的DD-壳聚糖核酸多聚物组合物可用于治疗性治疗。此类组合物在本文中有时被称为治疗性组合物。
如下所讨论的本发明的治疗性蛋白由包含治疗性核酸的本发明的多聚物产生。如下所述使用主题蛋白质是指使用主题多聚物影响此类蛋白质使用。
考虑用于本发明的治疗性蛋白质具有多种活性并且可用于治疗多种疾患。治疗性蛋白质活性和可用本发明的治疗性蛋白质治疗的适应症的以下描述是示例性的并且不意在是详尽的。术语“受试者”是指动物,其中哺乳动物是优选的,并且人类是特别优选的。
治疗性蛋白质和靶疾病的部分列表示于表4中。
表4.
在另一个实施方案中,本发明的治疗性组合物包含不编码治疗性蛋白质的治疗性核酸,如治疗性RNA。例如,通过选择参与疾病和/或非所需的细胞或生理疾患的机制的靶基因即治疗性RNA,主题组合物可用于治疗各种疾病和疾患。主题组合物具有此类特征,即所用的治疗性RNA靶选择范围方面不受限制。因此,主题组合物可用于涉及适合的靶的任何疾病或疾患。
优选的组织、疾病和疾患包括以下,其为示例性的而不是限制的:
高血糖和体重
治疗性蛋白质包括胰岛素和胰岛素类似物。糖尿病是由从胰腺β-细胞产生胰岛素缺乏(1型)或不足(2型)导致的使人衰弱的代谢性疾病(Unger,R.H.等,Williams Textbook of Endocrinology Saunders,Philadelphia(1998))。β-细胞是制造和贮藏胰岛素以用于在餐后释放的特化内分泌细胞(Rhodes,等J.Cell Biol.105:145(1987))并且胰岛素是促进葡萄糖从血液转移至需要其的组织中的激素。糖尿病患者必需频繁监测血液葡萄糖水平并且许多需要多次每日胰岛素注射以存活。然而,此类患者很少通过胰岛素注射获得理想的葡萄糖水平(Turner,R.C.等JAMA 281:2005(1999))。此外,胰岛素水平的长期升高可导致有害的副作用,诸如身体对胰岛素的反应即低糖血症性休克和脱敏。结果,糖尿病患者仍将出现长期并发症,诸如心血管疾病、肾病、失明、神经损伤和伤口愈合病症(UK Prospective Diabetes Study(UKPDS)Group,Lancet 352,837(1998))。
通过本发明的方法可治疗的病症包括高血糖疾患,诸如胰岛素依赖性(1型)或胰岛素非依赖性(2型)糖尿病,以及与高血糖疾患相关的或由高血糖疾患导致的生理疾患或病症。因此,通过本发明的方法可治疗的高血糖疾患还包括与慢性或急性高血糖(如糖尿病)相关的组织病理学变化。具体实例包括胰腺变性(β-细胞破坏)、肾小管钙化、肝变性、眼损伤(糖尿病性视网膜病变)、糖尿病足、粘膜诸如口和龈中的溃疡、过量出血、延迟血液凝血或伤口愈合及冠心病、中风、周围性血管疾病、血脂异常、高血压和肥胖症风险增加。
主题组合物可用于减少葡萄糖、改善葡萄糖耐受性、治疗高血糖疾患(如糖尿病)或治疗与高血糖疾患相关或由高血糖疾患导致的生理病症。此类病症包括例如糖尿病性神经病变(自主性)、肾病(肾损伤)、皮肤感染及其它皮肤病症、损伤或伤口(如其导致糖尿病性痈)愈合减缓或延迟、可导致失明的眼损伤(视网膜病变、白内障)、糖尿病足和加速牙周炎。此类病症还包括出现冠心病、中风、周围性血管疾病、血脂异常、高血压和肥胖症的风险增加。
如本文所用,术语“高血糖性”或“高血糖”当用于指代受试者疾患时意指受试者血液中存在的葡萄糖的暂时或慢性异常高水平。所述疾患可由葡萄糖代谢或吸收延迟引起,使得所述受试者展现出葡萄糖不耐受或通常在正常受试者中不存在的升高的葡萄糖状态(如处于出现糖尿病风险的葡萄糖-非耐受性轻度糖尿病(subdiabetic)受试者中的或糖尿病受试者中的)。对于血糖量正常的空腹血浆葡萄糖(FPG)水平小于约110mg/dl,对于受损葡萄糖代谢为约110至126mg/dl,且对于糖尿病大于约126mg/dl。
通过在肠粘膜组织中产生蛋白质可治疗的病症还包括肥胖症或不理想体重。瘦素、缩胆囊素、PYY和GLP-1减少了饥饿感、增加了能量消耗、诱导体重减轻或提供正常葡萄糖体内平衡。因此,在各个实施方案中,本发明的用于治疗肥胖症或不理想体重或高血糖的方法涉及使用编码瘦素、缩胆囊素、PYY或GLP-1的治疗性核酸。在另一个实施方案中,使用治疗性RNA靶向胃饥饿素。胃饥饿素提高了食欲和饥饿感。因此,在各个实施方案中,本发明的用于治疗肥胖症或不理想体重或高血糖的方法涉及使用治疗性RNA靶向胃饥饿素减少其表达。可治疗的病症还包括通常与肥胖症相关的那些,例如导致血管变窄或堵塞的异常升高的血清/血浆LDL、VLDL、甘油三酯、胆固醇、斑块形成、升高风险的高血压/中风、冠心病等。
如本文所用,术语“肥胖”或“肥胖症”是指与年龄和性别匹配的正常受试者相比体重增加至少30%的受试者。“不理想体重”是指与匹配的正常受试者以及就体重而言正常但希望降低或防止其体重增加的受试者相比体重高1%-29%的受试者。
在一个实施方案中,本发明的治疗性蛋白质是胰高糖素拮抗剂。胰高血糖素是由胰岛中的β-细胞产生的肽激素并且是葡萄糖代谢的主要调节剂(Unger R.H.&Orci L.N.Eng.J.Med.304:1518(1981);Unger R.H.Diabetes 25:136(1976))。与胰岛素一样,血液葡萄糖浓度介导胰高血糖素分泌。然而,与胰岛素相反,胰高血糖素响应于血液葡萄糖降低分泌。因此,胰高血糖素的循环浓度在禁食期间最高且在用餐期间最低。胰高血糖素水平增加以减少胰岛素促进葡萄糖贮藏并刺激肝释放葡萄糖至血液中。胰高糖素拮抗剂的特定实例是[des-His1、des-Phe6、Glu9]胰高血糖素-NH2。在链脲霉素糖尿病大鼠中,血液葡萄糖水平在该胰高糖素拮抗剂静脉内快速浓注(0.75μg/体重g)的15分钟内降低37%(Van Tine B.A.等Endocrinology 137:3316(1996))。在另一个实施方案中,本发明提供了用于治疗糖尿病或高血糖的方法,所述方法包括使用治疗性RNA降低从胰腺产生的胰高血糖素水平。
在另一个实施方案中,本发明的用于治疗高血糖疾患或不理想体重(如肥胖症)的治疗性蛋白质是胰高血糖素-样肽-1(GLP-1)。GLP-1是在用餐期间从肠中L-细胞释放的激素,其刺激胰腺β-细胞增加胰岛素分泌。GLP-1具有另外的活性,使其成为用于治疗肥胖症和糖尿病的有吸引力的治疗剂。例如,GLP-1减少胃排空、抑制食欲、降低胰高血糖素浓度、增加β-细胞质量、以葡萄糖-依赖性方式刺激胰岛素生物合成和分泌,并且可能提高对胰岛素的组织敏感性(Kieffer T.J.,Habener J.F.Endocrin.Rev.20:876(2000))。因此,与用餐相符的在肠中调控释放GLP-1可为高血糖疾患或不理想体重提供治疗性益处。对二肽基肽酶IV(DPP IV)耐受的GLP-1类似物提供更长的作用持续时间和改善的治疗价值。因此,GLP-1类似物是优选的治疗性多肽。在另一个实施方案中,本发明提供了用于治疗糖尿病或高血糖的方法,所述方法包括使用治疗性RNA降低DPP IV的水平。
在另一个实施方案中,本发明的可用于治疗高血糖疾患的治疗性蛋白质是激素抵抗素的拮抗剂。抵抗素是脂肪细胞-来源的因子,对于其表达在饮食-诱导的且遗传形式的肥胖症中升高。中和循环抵抗素改善了肥胖小鼠中血液葡萄糖和胰岛素作用。相反,在正常小鼠中施用抵抗素损害了葡萄糖耐受性和胰岛素作用(Steppan CM等Nature 409:307(2001))。产生拮抗肠中抵抗素的生物作用的蛋白质可因此提供用于肥胖症-相关联的胰岛素耐受性和高血糖疾患的有效疗法。在另一个实施方案中,本发明提供了用于治疗糖尿病或高血糖的方法,所述方法包括使用治疗性RNA降低脂肪组织中抵抗素表达的水平。
在另一个实施方案中,本发明用于治疗高血糖疾患或不理想体重(如肥胖症)的治疗性多肽是瘦素。瘦素,尽管主要由脂肪细胞产生,但还以较小量以用餐-依赖性方式在胃中产生。瘦素依赖于关于脂肪细胞代谢和体重至脑内食欲中心的信息,其中其发出信号减少的食物摄取(促进满足)并增加身体能量消耗。
在另一个实施方案中,本发明用于治疗高血糖疾患或不理想体重(如肥胖症)的治疗性多肽是脂肪细胞补体-相关的蛋白质(Acrp30)的C-末端球状头部结构域。Acrp30是由分化脂肪细胞产生的蛋白质。施用Acrp30的由球状头部结构域组成的蛋白水解裂解产物导致体重显著减轻(Fruebis J.等Proc.Natl Acad.Sci USA 98:2005(2001))。
在另一个实施方案中,本发明的用于治疗高血糖疾患或不理想体重(如肥胖症)的治疗性多肽是缩胆囊素(CCK)。CCK是响应于肠道中的特定营养物质从肠分泌的胃肠肽。CCK释放与所消费的食物的质量成比例并且据信对脑发出信号终止用餐(Schwartz M.W.等Nature 404:661-71(2000))。结果,升高的CCK可减少用餐规模(meal size)并促进体重减轻或体重稳定(即防止或抑制体重增加)。
就PYY而言,参见例如le Roux等,Proc Nutr Soc.2005年5月;64(2):213-6。
免疫病
在一个实施方案中,本发明的治疗性组合物具有免疫调节活性。例如,本发明的治疗性多肽可用于通过激活或抑制增殖、分化或动员(趋化性)免疫细胞治疗免疫系统的缺陷或病症。免疫细胞通过血细胞生成过程发育,从而从多能干细胞产生髓样(血小板、红细胞、中性粒细胞和巨噬细胞)和淋巴样(B和T淋巴细胞)细胞。这些免疫缺陷或病症的病原学可为遗传性的、躯体的(诸如癌症或一些自身免疫性病症)、获得性(如通过化疗或毒素)或传染性的。
本发明的治疗性组合物可用于治疗造血细胞的缺陷或病症。例如,本发明的治疗性多肽可用于增加造血细胞(包括多能干细胞)的分化或增殖,为了治疗与某些(或许多)类型造血细胞减少相关的那些病症。免疫缺陷综合征的实例包括但不限于:血液蛋白质病症(如丙种球蛋白缺乏血症、异常γ球蛋白血)、共济失调毛细血管扩张、常见变异型免疫缺陷、迪格奥尔格综合征(DiGeorge Syndrome)、HIV感染、HTLV-BLV感染、白细胞粘附缺陷综合征、淋巴细胞减少症、噬菌细胞杀菌功能障碍、重症综合性免疫缺陷(SCID)、Wiskott-Aldrich症、贫血、血小板减少症或血红蛋白尿。
本发明的治疗性组合物还可用于治疗自身免疫性病症。选多自身免疫性病症由免疫细胞不适当地识别自身为外源物质导致。该不适当的识别导致免疫反应,从而导致破坏宿主组织。因此,施用抑制免疫反应、特别是T-细胞的增殖、分化或趋化性的本发明的治疗性组合物可为预防自身免疫性病症的有效疗法。
可由本发明治疗的自身免疫性病症的实例包括但不限于:爱迪生氏病(Addison's Disease)、溶血性贫血、抗磷脂综合征、风湿性关节炎、皮炎、变应性脑脊髓炎、肾小球性肾炎、古德帕斯彻氏综合征(Goodpasture's Syndrome)、格雷夫斯氏病(Graves'Disease)、多发性硬化、重症肌无力、神经炎、眼炎、大疱性类天疱疮、天疱疮、多内分泌腺疾病、紫癜、莱特氏病(Reiter's Disease)、僵人综合征、自身免疫性甲状腺炎、全身性红斑狼疮、自身免疫性肺炎、格林-巴利综合征(Guillain-Barre Syndrome)、胰岛素-依赖性糖尿病、克罗恩病(Crohn’s disease)、溃疡性结肠炎和自身免疫性炎性眼病。
类似地,变应性反应和疾患,诸如哮喘(特别是变应性哮喘)或其它呼吸问题,还可由本发明的治疗性组合物治疗。此外,这些分子可用于治疗过敏反应、对抗原分子超敏或血型不合。
本发明的治疗性组合物还可用于治疗和/或预防器官排斥或移植物抗宿主病(GVHD)。器官排斥通过经由免疫反应进行的移植组织的宿主免疫细胞破坏发生。类似地,免疫反应还参与GVHD,但在这种情况下外源移植的免疫细胞破坏宿主组织。施用抑制T-细胞的免疫反应、特别是增殖、分化或趋化性的本发明的治疗性组合物可为防止器官排斥或GVHD的有效疗法。
类似地,本发明的治疗性组合物还可用于调控炎症,例如,所述治疗性多肽可抑制免疫反应中涉及的细胞的增殖和分化。这些分子可用于治疗炎性疾患,慢性和急性疾患两者,包括与感染相关的炎症(如败血性休克、败血症或全身炎症反应综合征(SIRS))、局部缺血-再灌注损伤、内毒素致死率、关节炎、胰腺炎、补体-介导的超急性排斥、肾炎、细胞因子或趋化因子诱导的肺损失、炎性肠病(IBD)、克罗恩氏病(Crohn's disease),或者由于细胞因子(如TNF或IL-1)过度产生导致。在一个实施方案中,靶向TNFα的治疗性RNA可用于主题组合物中以治疗炎症。在另一个优选的实施方案中,靶向IL-1的治疗性RNA用于主题组合物中以治疗炎症。siRNA治疗性RNA是特别优选的。用于在本发明中治疗的目标炎性病症包括但不限于慢性阻塞性肺病(COPD)、间质性膀胱炎和炎性肠病。
凝血病症
在一些实施方案中,本发明的治疗性组合物也可用于调控止血(停止出血)或溶血栓活性(血块形成)。例如,通过提高止血或溶血栓活性,本发明的治疗性组合物可用于治疗血液凝血病症(如无纤维蛋白原血症、因子缺乏)、血小板病症(如血小板减少症)或由创伤、手术或其它原因导致的伤口。可选地,可降低止血或溶血栓活性的本发明的治疗性组合物可用于抑制或溶解凝血。这些治疗性组合物可在可能在治疗心脏发作(梗塞)、中风或疤痕形成中是重要的。在一个实施方案中,本发明的治疗性多肽是用于治疗血友病或其它凝血/凝血病症的凝血因子(如因子VIII、IX或X)。
过度增殖病症
在一个实施方案中,本发明的治疗性组合物能够调控细胞增殖。此类治疗性多肽可用于治疗过度增殖病症,包括赘生物。
可由本发明的治疗性组合物治疗的过度增殖病症的实例包括但不限于位于以下部位中的赘生物:腹部、骨、乳房、消化系统、肝、胰腺、腹膜、内分泌腺(肾上腺、甲状旁腺、垂体、睾丸、卵巢、胸腺、甲状腺)、眼、头颈、神经(中枢和外周)、淋巴系统、骨盆、皮肤、软组织、脾、胸和泌尿生殖器。
类似地,其它过度增殖病症还可由本发明的治疗性组合物治疗。此类过度增殖病症的实例包括但不限于:高丙种球蛋白血症、淋巴组织增生性病症、副蛋白血症、紫癜、结节病、塞扎里综合征(Sezary Syndrome)、瓦尔登斯特伦氏巨球蛋白血(Waldenstron's Macroglobulinemia)、戈谢病(Gaucher's Disease)、组织细胞增多病和任何其它过度增殖疾病,除了位于以上所列器官系统中的肿瘤之外。
递送至循环系统提供了用于使治疗性蛋白质接近多种组织的循环系统。可选地,本发明的治疗性组合物可刺激可抑制过度增殖病症的其它细胞增殖。
例如,通过增加免疫反应、特别是增加过度增殖病症的抗原质量或通过增殖、分化或动员T-细胞,可治疗过度增殖病症。该免疫反应可通过增强现有的免疫反应或通过开始新的免疫反应增加。可选地,减少免疫反应还可为诸如用化疗剂治疗过度增殖病症的方法。
传染病
在一个实施方案中,本发明的治疗性组合物可用于治疗传染病。例如,通过增加免疫反应、特别是增加B和/或T细胞的增殖和分化,可治疗传染疾病。所述免疫反应通过增强现有的免疫反应或通过开始新的免疫反应增加。可选地,本发明的治疗性组合物还可直接抑制传染因子而不必引发免疫反应。
病毒是可引起可由本发明的治疗性组合物治疗的疾病或症状的传染因子的一个实例。病毒的实例包括但不限于以下DNA和RNA病毒家族:虫媒病毒、腺病毒科、沙粒病毒科、动脉炎病毒属、双核糖核酸病毒科、布尼亚病毒科、杯状病毒科、环病毒科、冠状病毒科、黄病毒科、肝脱氧核糖核酸病毒科(肝炎)、疱疹病毒科(诸如巨细胞病毒、单纯性疱疹、带状疱疹)、单分子负链RNA病毒目(如副黏液病毒科、麻疹病毒属、弹状病毒科)、正黏病毒科(如流行性感冒)、乳多空病毒科、小DNA病毒科、微小核糖核酸病毒科、痘病毒科(诸如天花或牛痘)、呼肠病毒科(如轮状病毒)、逆转录病毒科(HTLV-I、HTLV-II、慢病毒)和披膜病毒科(如风疹病毒属)。落在这些家族范围内的病毒可引起多种疾病或症状,包括但不限于:关节炎、细支气管炎、脑炎、眼部感染(如结膜炎、角膜炎)、慢性疲劳综合征、肝炎(甲型、乙型、丙型、戊型、慢性活性型、Δ型)、脑膜炎、机会性感染(如AIDS)、肺炎、伯基特淋巴瘤(Burkitt's Lymphoma)、水痘、出血热、麻疹、腮腺炎、副流行性感冒、狂犬病、普通感冒、小儿麻痹症、白血病、风疹、性传播疾病、皮肤疾病(如卡波西氏(Kaposi's)病、疣)和病毒血症。本发明的治疗性组合物可用于治疗任何这些症状或疾病。
类似地,可引起疾病或症状并可由本发明的治疗性组合物治疗的细菌因子或真菌因子包括但不限于以下革兰氏阴性和革兰氏阳性细菌家族和真菌:放线菌目(如棒状杆菌属、分枝杆菌属、诺卡氏菌属)、曲霉菌病、芽胞杆菌科(如炭疽、梭菌属)、拟杆菌科、芽生菌病、包特菌属、包柔氏螺旋体属、布鲁氏菌病、念珠菌病、弯曲菌属、球孢子菌病、隐球菌病、皮肤真菌症(Dermatocycoses)、肠杆菌科(克雷伯氏菌属、沙门氏菌属、沙雷氏菌属、耶尔森菌属)、丹毒丝菌属、螺杆菌属、军团杆菌病、细螺旋体病、李斯特菌属、枝原体目、奈瑟氏菌科(如不动杆菌属、淋病、脑膜炎球菌的)、巴斯德氏菌科感染(如放线杆菌属、嗜血杆菌、巴氏杆菌属)、假单胞菌属、立克次氏体科、衣原体科、梅毒和葡萄球菌属。这些细菌或真菌家族可引起以下疾病或症状,包括但不限于:菌血症、心内膜炎、眼部感染(结膜炎、肺结核、葡萄膜炎)、牙龈炎、机会性感染(如AIDS相关感染)、甲沟炎、假体-相关的感染、莱特氏病、呼吸道感染诸如百日咳或积脓、败血症、莱姆病(Lyme Disease)、猫抓病、痢疾、副伤寒热、食物中毒、伤寒、肺炎、淋病、脑膜炎、衣原体属、梅毒、白喉、麻风病、副结核病、肺结核、狼疮、肉毒中毒、坏疽、破伤风、脓疱病、风湿热、猩红热、性传播疾病、皮肤病(如蜂窝组织炎、皮肤真菌症)、毒血症、尿道感染、伤口感染。本发明的治疗性组合物可用于治疗任何这些症状或疾病。
此外,引起可用本发明的治疗性组合物治疗的疾病或症状的寄生因子包括但不限于以下家族:变形虫病、巴贝西虫病、球虫病、隐孢子虫病、双核阿米巴病、媾疫、外寄生物、贾第虫病、蠕虫病、利什曼病、泰勒虫病、弓形体病、锥体虫病和毛滴虫属。这些寄生虫可引起多种疾病或症状,包括但不限于:疥疮、恙螨病、眼部感染、肠病(如痢疾、贾第虫病)、肝病、肺病、机会性感染(如AIDS相关的)、疟疾、妊娠并发症和弓形体病。本发明的治疗性组合物可用于治疗任何这些症状或疾病。
再生
本发明的治疗性组合物可用于分化、增殖和吸引细胞,从而养育组织的再生。(参见Science 276:59-87(1997))。组织的再生可用于修复、替代或保护由先天性缺陷、创伤(伤口、烧伤、切口或溃疡)、年龄、疾病(如骨质疏松症、骨关节炎、牙周病、肝衰竭)、手术(包括整形美容手术)、纤维化、再灌注损伤,或全身细胞因子损伤而损伤的组织。
本发明的治疗性组合物可促进多种组织的再生,所述组织包括但不限于器官(如胰腺、肝、肠、肾、皮肤、内皮)、肌肉(平滑肌、骨骼肌或心肌)、血管(包括血管内皮)、神经、造血和骨骼(骨、软骨、腱和韧带)组织。优选地,再生导致少量的疤痕形成,或在没有疤痕形成的情况下发生。再生还可包括血管生成。
此外,本发明的治疗性组合物可增加难于愈合的组织的再生。例如,增加的腱/韧带再生将加快损伤后恢复时间。本发明的治疗性组合物还可预防性使用以努力避免损伤。可治疗的特定疾病包括肌腱炎、腕管综合症及其它腱或韧带缺陷。非-愈合伤口的组织再生的另一个实例包括压力性溃疡、与血管功能不全相关的溃疡、手术伤口和创伤伤口。
类似地,神经和脑组织还可使用本发明的治疗性组合物再生以增殖和分化神经细胞。可使用该方法治疗的疾病包括中枢和外周神经系统疾病、神经病或机械病症和创伤病症(如脊髓病症、头部创伤、脑血管疾病和中风)。特别地,与外周神经损伤相关的疾病、周围神经病变(如由化疗或其它医学疗法导致的)、局限性神经病和中枢神经系统疾病(如阿尔茨海默病(Alzheimer's disease)、帕金森氏病(Parkinson's disease)、亨廷顿氏症(Huntington's disease)、肌肉萎缩性侧索硬化症和夏伊-德雷格综合征(Shy-Drager syndrome))均可使用本发明的治疗性组合物治疗。就CNS病症而言,多种方式是本领域已知可用于促进治疗性接近脑组织的,包括用于打破血脑屏障的方法和偶联治疗剂与提供转运至CNS中的部分的方法。在一个实施方案中,治疗性核酸被工程化以编码融合蛋白质,所述融合蛋白质包含转运部分和治疗性蛋白质。可选地,主题组合物可直接递送至CNS。
趋化性
在一个实施方案中,本发明的治疗性组合物可调控趋化性。例如,在一个实施方案中,本发明的治疗性多肽具有趋化性活性。趋化性分子吸引或动员细胞(如单核细胞、成纤维细胞、中性粒细胞、T-细胞、肥大细胞、嗜酸性粒细胞、上皮和/或内皮细胞)至体内的特定位点,诸如炎症、感染或过度增殖位点。所动员的细胞然后可排斥和/或愈合特定创伤或异常。
例如,本发明的治疗性多肽可提高特定细胞的趋化性活性。这些趋化性分子然后可用于通过增加靶向体内特定位置的细胞的数目而治疗炎症、感染、过度增殖病症或任何免疫系统病症。例如,趋化性分子可用于通过吸引免疫细胞至损伤位置治疗组织的伤口和其它创伤。本发明的趋化性分子还可吸引成纤维细胞,损伤成纤维细胞可用于治疗伤口。
还考虑了本发明的治疗性组合物可抑制趋化性活性。这些治疗性组合物还可用于治疗病症。因此,本发明的治疗性组合物可用作趋化性的抑制剂。
特别优选使用的是在靶组织附近激活的促治疗性蛋白质。
考虑使用的另外的治疗性多肽包括但不限于生长因子(如生长激素、胰岛素-样生长因子-1、血小板-来源的生长因子、表皮生长因子、酸性和碱性成纤维细胞生长因子、转化生长因子-β等)以治疗生长病症或消耗综合征;和抗体(如人或人源化)以提供被动免疫或针对外源抗原或病原体(如幽门螺杆菌(H.Pylori))对受试者的保护或提供对癌症、关节炎或心血管疾病的治疗;细胞因子、干扰素(如干扰素(IFN)、IFN-α2b和2α、IFN-αN1、IFN-β1b、IFN-γ)、白介素(如IL-1至IL-10)、肿瘤坏死因子(TNF-αTNF-β)、趋化因子、粒细胞巨噬细胞集落刺激因子(GM-CSF)、多肽激素、抗微生物多肽(如抗细菌多肽、抗真菌多肽、抗病毒多肽和/或抗寄生虫多肽)、酶(如腺苷脱氨酶)、促性腺激素、趋化素、脂质-结合蛋白质、非格司亭(Neupogen)、血红蛋白、红细胞生成素、胰岛素调理素、伊米苷酶、沙格司亭(sarbramostim)、组织纤维蛋白溶酶原激活剂(tPA)、尿激酶、链激酶、苯丙氨酸解氨酶、脑-来源的神经营养因子(BDNF)、神经生长因子(NGF)、血小板生成素(TPO)、超氧化物歧化酶(SOD)、腺苷脱酰胺酶、过氧化氢酶、降钙素、内皮素、L-天冬酰胺酶胃蛋白酶、尿酸酶、胰蛋白酶、胰凝乳蛋白酶、弹性酶、羧肽酶、乳糖酶、蔗糖酶、内因子、甲状旁腺激素(PTH)-样激素、可溶性CD4及其抗体和/或抗原-结合片段(如FAb)(如orthoclone OKT-e(抗-CD3)、GPIIb/IIa单克隆抗体)。另外考虑的是编码此类因子的治疗性RNA靶向核酸。
疫苗
在一个实施方案中,本发明提供了用于接种患者的方法。所述方法包括施用能够产生所需表位的本发明的组合物。在一个优选的实施方案中,所述组合物包含能够表达包含所述表位的蛋白质的治疗性核酸构建体。
美容应用
在一个实施方案中,本发明提供了用于美容用途的DD-壳聚糖核酸多聚物。主题化妆品包含于适用于美容用途的制剂中的DD-壳聚糖核酸多聚物。
实施例
实施例1:形成双重衍生化壳聚糖和形成DNA多聚物
壳聚糖用精氨酸和葡萄糖酸或用精氨酸和苏糖酸根据熟知的方法双重衍生化(DD-壳聚糖)。DD-壳聚糖与编码分泌型碱性磷酸酶(SEAP)或荧光素酶siRNA的DNA载体多聚合。
实施例2:用DNA多聚物体外转染
通常,用DD-壳聚糖核酸多聚物制剂体外转染293T细胞以两步进行:制备细胞,然后转染。
实施例3:维持细胞系
293T细胞系蒙英属哥伦比亚大学(University of British Columbia (Vancouver,Canada))的Timothy Kieffer博士实验室(Dr.Timothy Kieffer’s lab)提供,并且如下制备。将人肾细胞用SV40T-抗原转染;在含有10%胎牛血清(FBS)和青霉素/链霉素的高葡萄糖达尔伯克改良伊格尔培养基(Dulbecco's Modified Eagle Medium,DMEM)中生长;及维持低于80%汇合。
实施例4:制备细胞用于转染
如下制备细胞用于转染。在转染前一天,将293T细胞添加至6-孔组织培养板(4.5x 105个细胞/孔)的3mL完全培养基(高葡萄糖DMEM+10%FBS+青霉素/链霉素)内。在转染当天,通过用磷酸盐缓存盐水(PBS)洗涤细胞1次、用0.5mL 0.05%胰蛋白酶胰蛋白酶化细胞、添加0.5mL完全培养基并使用血细胞计数板计数10μL,测定两种选择的细胞的细胞计数。如果细胞~50%汇合(~7x105个细胞/孔),然后进行转染。(如果细胞太稀疏或太汇合,则转染不能进行)。
实施例5:转染细胞
如下进行转染。首先,将培养基从每个孔去除,然后添加1mLOpti-mem(pH 7.4)至每个孔,轻轻涡旋,然后去除。(一次洗涤六个孔,以防止细胞移出)。然后再小心添加1mL Opti-mem(pH 7.4)至每个孔以不能移出细胞。接着,添加多聚物样品至每个孔(2μg DNA的靶)、涡旋并在37℃下孵育2h。孵育后,去除培养基并用2mL完全培养基替换并在37℃下再孵育。在所需的时间点,去除上清液并在-20℃下贮藏以用于随后SEAP测定。
实施例6:SEAP蛋白质测定
所述SEAP测定使用SEAP Chemiluminescent Assay试剂盒进行。用于测定的所有试剂在使用前在25℃下平衡30分钟。用于测定的标准品通过于掺有0.1%牛血清白蛋白和50%甘油的试剂盒1X稀释缓存液中溶解胎盘碱性磷酸酶至1mg/mL、然后用DMEM进行的10-倍连续稀释稀释至0.01pg/uL制备。然后用稀释缓冲液将标准品和解冻的样品稀释四分之一,在65℃下加热失活30分钟,在冰上孵育2分钟、离心(16100x rcf,2分钟,在室温下),并将上清液转移至新管中。在25℃下平衡5分钟后,将50uL样品和标准品一式两份添加至Microlite-1板的每个孔。然后将失活缓冲液(50uL)添加至每个孔并轻轻上下吸打以混合而不产生泡泡并孵育5分钟。在5分钟孵育期间以底物与增强剂1:19的比率制备底物/增强试剂。将底物/增强剂然后添加至各孔,孵育20分钟,然后将板在光度计(Lmax11384,Molecular Devices)中读取,而积分时间为1秒。
实施例7:结果
图1-3显示了用不同%的精氨酸或葡萄糖酸衍生的壳聚糖及用葡萄糖酸和精氨酸两者双重衍生化的壳聚糖的转染效率。图1-3显示了当壳聚糖用精氨酸和葡萄糖酸两者双重衍生化时的协同作用。当壳聚糖用精氨酸以10%的最终官能化程度和用葡萄糖酸以3%和10%的最终官能化程度双重官能化时,可见所述协同作用,尽管在葡萄糖酸最终官能化程度为约3%时可见最佳效果(图1)。当壳聚糖用精氨酸以52%的最终官能化程度和用葡萄糖酸以3%至8%的最终官能化程度双重官能化时,还可见所述协同作用,尽管在葡萄糖酸最终官能化程度为约8%时可见最佳效果(图2)。此外,用精氨酸和葡萄糖酸两者以26%和6%的最终官能化程度双重官能化的壳聚糖表明在转染效率方面最佳的协同作用(图3)。最终,当壳聚糖用精氨酸和替代性部分诸如苏糖酸而不是葡萄糖酸双重衍生化时,还可见协同作用。当壳聚糖用精氨酸以29%的最终官能化程度和用苏糖酸以范围为3%的最终官能化程度双重官能化时,观察到所述协同作用(图4)。
实施例8:
将壳聚糖用精氨酸和选自由以下组成的组的HP双重衍生化(DD-壳聚糖):2,3-二羟基丙酸;2,3,4,5,6,7-六羟基庚醛;2,3,4,5,6-戊羟基己醛;2,3,4,5-四羟基己醛;和2,3-二羟基丙醛,并且根据实施例1-7测定。使DD-壳聚糖与编码分泌型碱性磷酸酶(SEAP)或荧光素酶siRNA的DNA载体多聚化。
所有引用通过引用以其整体明确并入本文中。
本文提及的所有专利和专利公布在此通过引用并入。
本领域的技术人员在阅读前文描述后将进行某些修改和改善。应理解所有此类修改和改善在本文中为了简洁性和可读性都被删除了,但适当地在随后的权利要求的范围内。
- 还没有人留言评论。精彩留言会获得点赞!