一种人工合成的抗虫蛋白及其相关生物材料与应用的制作方法
本发明涉及基因工程和农业有害生物防治技术领域中一种人工合成的抗虫蛋白及其相关生物材料与应用。
背景技术:
我国是世界上最大的棉花生产国和消费国,也是最大的纺织品和服装生产国与出口国。棉花总产量占世界棉花产量的25%左右。棉花生产的兴衰,对我国国民经济的发展,乃至人民生活水平的提高都产生着一定的影响。我国常年植棉面积600-830万公顷,占世界总植棉面积的1/5-1/6,位居世界第二位;常年总产皮棉600万吨左右,占世界总产的1/4左右,为世界第一位。
棉花是受害虫危害最为严重的农作物之一,我国棉花害虫至少有300种。在转基因抗虫棉(指抗棉铃虫)培育之前,以棉蚜(Aphis gossypii)、棉铃虫(Heliothis armigera)、棉叶螨(Tetranychus cinnabarinus)和棉红铃虫(Petinophera gossypiella)四大害虫危害棉花最为严重,每年因虫害造成的棉花产量损失达15%-20%,每年为防治害虫投入的农药费用每公顷高达1200-1800元。特别是上世纪九十年代初期,由于长期大量使用化学农药,最终导致棉花害虫抗药性增强,直接引起棉铃虫在我国黄河流域大爆发,危害程度历史上罕见(Wu,2005)。
随着生物技术的发展,转Bt基因棉花的大面积种植,从根本上有效控制了棉铃虫等鳞翅目害虫的发生危害,棉田化学农药使用量因此大幅度减少,棉田生态系统也随之发生了一系列变化,导致棉田非Bt靶标害虫盲蝽蟓数量增加,危害加重,2000年以来,盲蝽蟓的危害不断加重并逐渐由一种次要害虫上升为主要害虫之一(Wu等,2002),各地开始对其重点防治。
盲蝽蟓属于半翅目(Heteroptera)盲蝽科(Miridae),是棉花生产上的一类重要害虫。目前我国常见的种类有绿盲蝽Apolygus lucorum(Meyer-Dür)、中黑盲蝽Adelphocoris suturalis(Jakovlev)、三点盲蝽Adelphocoris fasciaticollis(Reuter)、苜蓿盲蝽Adelphocoris lineolatus(Goeze)和牧草盲蝽Lygus pratensis(Linnaeus)等。盲蝽蟓的寄主含棉花、果树、蔬菜、苜蓿、茶树和各种杂草等50余科200多种植物,其中包括多种重要的农业作物(Lu等,2008)。盲蝽蟓喜食植物的花、蕾、果实等生殖器官,在棉花苗期,主要危害生长点,形成无头棉,在棉花蕾期危害生长点与幼蕾,可使棉花叶片破损,营养生长缓慢,枝叶丛生,棉株中空,减少花蕾数,从而延迟成熟期、减产。此外,盲蝽蟓具有食性杂、迁飞扩散能力强、世代重叠严重、隐蔽性高等生物学特征,降低了农药防治效果。
由于缺乏合适的抗盲蝽蟓品种,目前解决虫害的主要方式是在棉花生长过程中持 续喷施化学杀虫剂。但是化学杀虫剂同时杀死多种棉田昆虫,不利于棉田生态平衡,并造成环境污染,增加植棉成本,使得转Bt基因的抗虫棉比较优势下降。近年来由于田间对盲蝽蟓的化学防治力度不断加大,其抗药性问题开始凸显。根据国外的报道,盲蝽蟓已经对有机磷类、菊酯类、氨基甲酸酯类和环戊二烯类杀虫剂产生了抗性,抗性问题会给将来的防治工作造成较大的困难。因此通过转基因技术将抗盲蝽蟓基因导入棉花品种中,培育具有抗盲蝽蟓的棉花品种,既可以降低农药的使用量,降低环境污染,维持生态平衡,又可以节省人力、物力及社会资源,产生巨大的经济效益。
黄大昉2007年将Bt菌株F14-1中分离到的Cry51Aa1蛋白及编码该蛋白的基因序列提交至NCBI GenBank,检录号为DQ836184,Cry51Aa1蛋白是一类由苏云金芽孢杆菌产生的伴胞晶体之一,该类蛋白在生物防治领域具有重要的应用前景。
技术实现要素:
本发明所要解决的技术问题是如何提高植物的抗虫性,如提高植物对盲蝽蟓的抗性。
为解决上述技术问题,本发明首先提供了植物抗虫性相关蛋白质。
本发明所提供的植物抗虫性相关蛋白质,名称为MRP001蛋白,是人工合成基因表达的下述A1)或A2)的蛋白质:
A1)氨基酸序列如SEQ ID No.6所示的蛋白质;
A2)在A1)的蛋白质的氨基酸序列中经过取代和/或缺失和/或添加一个或几个氨基酸残基得到的具有抗虫性的由A1)衍生的蛋白质。
其中,SEQ ID No.6由306个氨基酸残基组成。
上述A2)中的MRP001蛋白可先合成其编码基因,再进行生物表达得到。上述A2)中的MRP001蛋白的编码基因可通过将SEQ ID No.1的第896-1816位核苷酸所示的DNA序列中缺失一个或几个氨基酸残基的密码子,和/或进行一个或几个碱基对的错义突变得到。
为解决上述技术问题,本发明还提供了与所述MRP001蛋白相关的生物材料。
本发明所提供的与所述MRP001蛋白相关的生物材料,为下述B1)至B7)中至少一种:
B1)编码所述MRP001蛋白的核酸分子;
B2)含有B1)所述核酸分子的表达盒;
B3)含有B1)所述核酸分子的重组载体、或含有B2)所述表达盒的重组载体;
B4)含有B1)所述核酸分子的重组微生物、或含有B2)所述表达盒的重组微生物、或含有B3)所述重组载体的重组微生物;
B5)含有B1)所述核酸分子的转基因植物细胞系、或含有B2)所述表达盒的转基 因植物细胞系、或含有B3)所述重组载体的转基因植物细胞系;
B6)含有B1)所述核酸分子的转基因植物组织、或含有B2)所述表达盒的转基因植物组织、或含有B3)所述重组载体的转基因植物组织;
B7)含有B1)所述核酸分子的转基因植物器官、或含有B2)所述表达盒的转基因植物器官、或含有B3)所述重组载体的转基因植物器官。
上述与所述MRP001蛋白相关的生物材料中,B1)所述核酸分子为如下B1a)或B1b)或B1c)或B1d)所示的核酸分子:
B1a)其编码序列是SEQ ID No.1的第896-1816位的DNA分子或cDNA分子;
B1b)与B1a)限定的核苷酸序列具有75%或75%以上同一性,且编码所述MRP001蛋白的cDNA分子或基因组DNA分子;
B1c)在严格条件下与B1a)限定的核苷酸序列杂交,且编码所述MRP001蛋白的cDNA分子或基因组DNA分子;
B1d)与B1a)或B1b)或B1c)所述DNA分子反向互补的DNA分子。
上述用于编码所述MRP001蛋白的核酸分子,本领域普通技术人员可以很容易地采用已知的方法,例如定向进化和点突变的方法,对本发明的编码所述MRP001蛋白的核酸分子的核苷酸序列进行突变。那些经过人工修饰的,与本发明分离得到的编码所述MRP001蛋白的核酸分子的核苷酸序列具有75%或者更高同一性且编码所述MRP001蛋白,均是衍生于本发明的核苷酸序列并且等同于本发明的序列。
这里使用的术语“同一性”指与天然核酸序列的序列相似性。“同一性”包括与本发明的SEQ ID No.1的第896-1816位核苷酸所示的DNA分子或cDNA分子具有75%或更高,或85%或更高,或90%或更高,或95%或更高同一性的核苷酸序列。同一性可以用肉眼或计算机软件进行评价。使用计算机软件,两个或多个序列之间的同一性可以用百分比(%)表示,其可以用来评价相关序列之间的同一性。
所述严格条件是在2×SSC,0.1%SDS的溶液中,在68℃下杂交并洗膜2次,每次5min,又于0.5×SSC,0.1%SDS的溶液中,在68℃下杂交并洗膜2次,每次15min。
上述75%或75%以上同一性,可为80%、85%、90%或95%以上的同一性。
其中,SEQ ID No.1由2093个核苷酸组成,其编码序列是第896-1816位,编码SEQ ID No.6所示的蛋白质。
上述与所述MRP001蛋白相关的生物材料中,所述表达盒是指能够在宿主细胞中表达相应蛋白质的DNA,该DNA不但可包括启动相关基因转录的启动子,还可包括终止相关基因转录的终止子,如B2)所述的含有编码MRP001蛋白的核酸分子的表达盒,是指能够在宿主细胞中表达MRP001蛋白的DNA。进一步,所述表达盒还可包括增强子序列。可用于本发明的启动子包括但不限于:组成型启动子,组织、器官和发育特异 的启动子,和诱导型启动子。启动子的例子包括但不限于:组成型启动子T7lac、花椰菜花叶病毒的组成型启动子CaMV35S、番茄核酮糖-1,5-二磷酸羧化酶小亚基(Small subunit of ribulose-1,5-bisphospate carboxylase,rbcs)基因启动子;来自西红柿的创伤诱导型启动子,亮氨酸氨基肽酶("LAP",Chao等人(1999)Plant Physiol.120:979-992);来自烟草的化学诱导型启动子,发病机理相关1(PR1)(由水杨酸和BTH(苯并噻二唑-7-硫代羟酸S-甲酯)诱导);西红柿蛋白酶抑制剂II启动子(PIN2)或LAP启动子(均可用茉莉酮酸曱酯诱导);热休克启动子(美国专利5,187,267);四环素诱导型启动子(美国专利5,057,422);种子特异性启动子,如谷子种子特异性启动子pF128(CN101063139B(中国专利200710099169.7)),种子贮存蛋白质特异的启动子(例如,菜豆球蛋白、napin,oleosin和大豆beta conglycin的启动子(Beachy等人(1985)EMBO J.4:3047-3053))。此处引用的所有参考文献均全文引用。合适的转录终止子包括但不限于:T7终止子、根癌农杆菌胭脂碱合成酶终止子(NOS终止子)、花椰菜花叶病毒CaMV35S终止子、tml终止子、豌豆rbcS E9终止子和胭脂氨酸和章鱼氨酸合酶终止子(参见,例如:Odell等(1985),Nature,313:810;Rosenberg等(1987),Gene,56:125;Guerineau等(1991),Mol.Gen.Genet,262:141;Proudfoot(1991),Cell,64:671;Sanfacon等,Genes Dev.,5:141;Mogen等(1990),Plant Cell,2:1261;Munroe等(1990),Gene,91:151;Ballad等(1989),Nucleic Acids Res.17:7891;Joshi等(1987),Nucleic Acid Res.,15:9627)。在本发明的实施例中,大肠杆菌BL21(DE3)受体细胞中所述MRP001基因表达盒中启动所述MRP001基因转录的启动子可为组成型启动子T7lac,终止所述MRP001基因转录的终止子可为T7终止子;受体植物棉花中所述MRP001基因表达盒中启动所述MRP001基因转录的启动子为花椰菜花叶病毒的组成型启动子CaMV35S,序列具体可为SEQ ID No.1的第1-860位的所示的DNA序列;终止所述MRP001基因转录的终止子为NOS终止子,序列具体可为SEQ ID No.1的第1830-2093位的所示的DNA序列。
上述与所述MRP001蛋白相关的生物材料中,可用现有的原核载体构建含有所述MRP001基因表达盒的重组载体。上述与所述MRP001蛋白相关的生物材料中,所述载体可为质粒、黏粒、噬菌体或病毒载体。上述与所述MRP001蛋白相关的生物材料中,B3)所述重组载体可含有序列SEQ ID No.1的第896-1816位的所示的用于编码MRP001蛋白的DNA序列;进一步B3)所述重组载体具体可为pET28a-MRP001;所述pET28a-MRP001为将pET28a载体的NedI和XhoI识别位点(识别序列)间的DNA序列替换为SEQ ID No.1的第896-1816位所示的用于编码MRP001蛋白的DNA序列,保持其它DNA序列不变,得到表达SEQ ID No.6所示的MRP001蛋白的重组载体。
可用现有的植物表达载体构建含有所述MRP001基因表达盒的重组载体,如 pCAMBIA2301、pET-28a、pSP72、pROKII、pBin438、pCAMBIA1302、pCAMBIA1301、pCAMBIA1300、pBI121、pCAMBIA1391-Xa或pCAMBIA1391-Xb(CAMBIA公司)等。MRP001基因载体还可包含外源基因的3’端非翻译区域,即包含聚腺苷酸信号和任何其它参与mRNA加工或基因表达的DNA片段。所述聚腺苷酸信号可引导聚腺苷酸加入到mRNA前体的3’端,如农杆菌冠瘿瘤诱导(Ti)质粒基因(如胭脂合成酶Nos基因)、植物基因(如大豆贮存蛋白基因)3’端转录的非翻译区均具有类似功能。使用本发明的基因构建植物表达载体时,还可使用增强子,包括翻译增强子或转录增强子,这些增强子区域可以是ATG起始密码子或邻接区域起始密码子等,但必需与编码序列的阅读框相同,以保证整个序列的正确翻译。所述翻译控制信号和起始密码子的来源是广泛的,可以是天然的,也可以是合成的。翻译起始区域可以来自转录起始区域或结构基因。为了便于对转基因植物细胞或植物进行鉴定及筛选,可对所用植物表达载体进行加工,如加入可在植物中表达的编码可产生颜色变化的酶或发光化合物的基因(GUS基因、萤光素酶基因等)、抗生素的标记基因(如赋予对卡那霉素和相关抗生素抗性的nptII基因,赋予对除草剂膦丝菌素抗性的bar基因,赋予对抗生素潮霉素抗性的hph基因,和赋予对methatrexate抗性的dhfr基因,赋予对草甘磷抗性的EPSPS基因)或是抗化学试剂标记基因等(如抗除莠剂基因)、提供代谢甘露糖能力的甘露糖-6-磷酸异构酶基因。B3)所述重组载体可含有SEQ ID No.1的第896-1816位所示的用于编码MRP001蛋白的DNA序列;进一步3)所述重组载体具体可为pCambia2301-35S-MRP001-NOS。所述pCambia2301-35S-MRP001-NOS为将pCambia2301载体的HindⅢ和EcoRI识别位点(识别序列)间的DNA序列替换为SEQ ID No.1所示的DNA序列,保持其它DNA序列不变,得到表达SEQ ID No.6所示的MRP001蛋白的重组载体。
上述与所述MRP001蛋白相关的生物材料中,B4)所述重组微生物具体可为细菌,酵母,藻和真菌。其中,细菌可来自埃希氏菌属(Escherichia),欧文氏菌(Erwinia),根癌农杆菌属(Agrobacterium)、黄杆菌属(Flavobacterium),产碱菌属(Alcaligenes),假单胞菌属(Pseudomonas),芽胞杆菌属(Bacillus)等,本发明的实施例中,所述微生物具体可为埃希氏菌属(Escherichia),进一步具体可为大肠杆菌BL21(DE3)。B5)所述的转基因细胞系,B6)所述的转基因植物组织和B7)所述的转基因植物器官不包括植物的繁殖材料。
为解决上述技术问题,本发明还提供了下述1)-3)中任一种应用:
1)所述MRP001蛋白、或所述MRP001蛋白相关的生物材料在调控植物抗虫性中的应用;
2)所述MRP001蛋白、或所述MRP001蛋白相关的生物材料在制备植物抗虫产品(如植物杀虫剂)中的应用;
3)所述MRP001蛋白、或所述MRP001蛋白相关的生物材料在培育抗虫植物中的应用。
上述应用中,所述抗虫植物可为转基因植物。
为解决上述技术问题,本发明还提供了植物杀虫剂。
本发明所提供的植物杀虫剂,含有所述MRP001蛋白。
上述植物杀虫剂中,所述植物杀虫剂可以以所述MRP001蛋白为活性成分,还可以将所述MRP001蛋白和其它杀虫物质进行组合得到的组合物作为活性成分。
为解决上述技术问题,本发明还提供了一种制备所述MRP001蛋白的方法。
本发明所提供的一种制备所述MRP001蛋白的方法,包括向受体细胞中导入所述MRP001蛋白的编码基因得到重组细胞,培养重组细胞,得到所述MRP001蛋白。
所述受体细胞为微生物细胞、非人动物细胞或植物细胞。
所述微生物细胞为细菌或真菌;所述细菌可为革兰氏阴性细菌;所述革兰氏阴性细菌可为埃希氏菌属细菌;进一步所述埃希氏菌属细菌可为大肠杆菌BL21(DE3)。
利用上述制备MRP001蛋白的方法制备的蛋白质可为粉剂、水剂。
为解决上述技术问题,本发明还提供了一种培育具有抗虫性的转基因植物的方法。
本发明所提供的一种培育具有抗虫性的转基因植物的方法,包括向受体植物中导入所述MRP001蛋白的编码基因得到具有抗虫性的转基因植物的步骤。
上文中,所述MRP001蛋白的编码基因为如下B1a)或B1b)或B1c)或B1d)所示的核酸分子:
B1a)其编码序列是SEQ ID No.1的第896-1816位的DNA分子或cDNA分子;
B1b)与B1a)限定的核苷酸序列具有75%或75%以上同一性,且编码所述MRP001蛋白的cDNA分子或基因组DNA分子;
B1c)在严格条件下与B1a)限定的核苷酸序列杂交,且编码所述MRP001蛋白的cDNA分子或基因组DNA分子;
B1d)与B1a)或B1b)或B1c)所述DNA分子反向互补的DNA分子。
其中,所述MRP001蛋白的编码基因可先进行如下修饰,再导入受体棉花中,以达到更好的表达效果:
1)根据实际需要进行修饰和优化,以使基因高效表达;例如,可根据受体植物所偏爱的密码子,在保持本发明所述MRP001蛋白编码基因的氨基酸序列的同时改变其密码子以符合植物偏爱性;优化过程中,最好能使优化后的编码序列中保持一定的GC含量,以最好地实现植物中导入基因的高水平表达,其中GC含量可为35%、多于45%、多于50%或多于约60%;
2)修饰邻近起始甲硫氨酸的基因序列,以使翻译有效起始;例如,利用在植物中 已知的有效的序列进行修饰;
3)与各种植物表达的启动子连接,以利于其在植物中的表达;所述启动子可包括组成型、诱导型、时序调节、发育调节、化学调节、组织优选和组织特异性启动子;启动子的选择将随着表达时间和空间需要而变化,而且也取决于靶物种;例如组织或器官的特异性表达启动子,根据需要受体在发育的什么时期而定;
4)与适合的转录终止子连接,也可以提高本发明基因的表达效率;例如来源于CaMV的tml,来源于rbcS的E9;任何已知在植物中起作用的可得到的终止子都可以与本发明基因进行连接;
5)引入增强子序列,如内含子序列(例如来源于Adhl和bronzel)和病毒前导序列(例如来源于TMV,MCMV和AMV)。
上述方法中,所述MRP001基因通过含有MRP001基因表达盒的重组表达载体(MRP001基因表达载体)导入所述受体植物中,所述MRP001基因表达盒中,启动MRP001基因转录的启动子是花椰菜花叶病毒35S启动子。
所述MRP001基因表达载体可通过使用Ti质粒,植物病毒载体,直接DNA转化,微注射,电穿孔、农杆菌介导等常规生物技术方法导入植物细胞或组织。
所述方法还包括从导入SEQ ID No.1第896-1816位所示的MRP001蛋白的编码基因的植株中筛选表达所述编码基因的植株,得到所述转基因棉花的步骤。
上文中,所述转基因植物理解为不仅包含将所述基因转化受体植物得到的第一代转基因植物,也包括其子代。对于转基因植物,可以在该物种中繁殖该基因,也可用常规育种技术将该基因转移进入相同物种的其它品种,特别包括商业品种中。所述转基因植物包括种子、愈伤组织、完整植株和细胞。
上述应用、上述植物杀虫剂或上述方法中,所述植物可为盲蝽蟓的寄主,所述盲蝽蟓的寄主可为双子叶植物或单子叶植物,所述双子叶植物可为棉花、苹果、茶、苜蓿等,所述单子叶植物可为水稻;所述盲蝽蟓的寄主具体可为棉花。
上文中,所述虫为盲蝽蟓。
实验证明,将本发明的MRP001基因导入大肠杆菌BL21(DE3)感受态细胞中构建的重组大肠杆菌BL21-MRP001,能够表达出MRP001蛋白,该蛋白质具有较好的杀盲蝽蟓效果,当使用浓度为25μg/mL时,盲蝽蟓的死亡率可达到96.7%,远高于空白对照组及相同浓度下其它四种蛋白质(MRP002蛋白、MRP003蛋白、MRP004蛋白和MRP005蛋白)的致盲蝽蟓死亡率。将本发明的MRP001基因转入棉花中获得的转基因棉花与对照组1和对照组2的棉花相比,对盲蝽蟓具有很高的抗性。其中,转MRP001基因的棉花的叶片危害指数为0.35,叶片危害指数减退率为84.75%,棉蕾被害率为2.89%,棉蕾被害减退率为88.89%。本发明可以用于制备 含有该蛋白质的生物抗虫剂,培育具有抗虫性的转基因棉花、果树、茶树、水稻、蔬菜等农作物,从而降低农药的使用量,以减少环境污染,具有重要的经济价值和广阔的应用前景。
附图说明
图1为重组载体pET28a-MRP001的酶切图谱:泳道1为酶切后的重组载体pET28a-MRP001的条带;泳道2为DNA Marker条带。
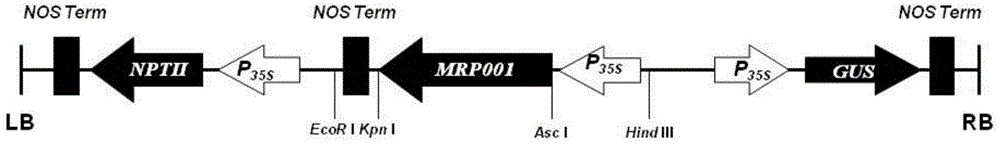
图2为植物表达载体pCambia2301-35S-MRP001-NOS结构示意图。
图3为植物表达载体pCambia2301-35S-MRP001-NOS的酶切图谱:泳道1为酶切后的植物表达载体pCambia2301-35S-MRP001-NOS的条带;泳道2为DNA Marker条带。
图4为采用PCR技术检测转基因棉花中的MRP001基因插入情况的电泳图谱:泳道1-5为转基因棉花的DNA样品,泳道n为水(阴性对照),泳道p为pCambia2301-35S-MRP001-NOS质粒(阳性对照),泳道m为DNA Marker。
图5为农杆菌介导法转化MRP001基因棉花的各个生长阶段:a为下胚轴切段,b为愈伤组织,c为胚性愈伤组织,d为胚状体,e为再生苗,f为转基因植株。
具体实施方式
下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。
下述实施例中的实验方法,如无特殊说明,均为常规方法。
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
下述实施例中的中棉所24(王新勇,刘伊宁.中棉所24在北疆的表现及栽培技术[J].中国棉花,1998,25(1):31-31.)公众可从中国农业科学院棉花研究所国家棉花种质中期库获得,该生物材料只为重复本发明的相关实验所用,不可作为其它用途使用。
下述实施例中的原核表达载体pET28a为novagen公司的产品,产品目录号为69864-3。
下述实施例中的BL21(DE3)感受态细胞为北京全式金生物技术有限公司的产品,产品目录号为CD601-01。
下述实施例中的表达载体pCambia2301为北京鼎国昌盛生物技术有限责任公司的产品,产品目录号为MCV037。
下述实施例中的农杆菌LBA4404为北京鼎国昌盛生物技术有限责任公司的产品,产品目录号为MCC026。
实施例1、抗盲蝽蟓蛋白MRP001的制备及其生物测定
基因MRP001、MRP002、MRP003、MRP004和MRP005的基因全长由上海生物工程 有限公司合成。
一、表达MRP001蛋白重组菌体细胞的制备
表达MRP001蛋白的重组菌体细胞的构建方法,包括向受体细胞中导入用于编码MRP001蛋白的DNA,得到表达MRP001蛋白的重组菌体细胞的步骤。其中,用于编码MRP001蛋白的DNA的核苷酸序列为序列表中SEQ ID No.1的第896-1816位的核苷酸序列。具体方法如下:
将表达载体pET-28a的NdeI和XhoI识别位点(识别序列)间的DNA序列替换为SEQ ID No.1的第896-1816位所示的用于编码MRP001的DNA序列,保持其它DNA序列不变,得到重组载体pET28a-MRP001。
酶切鉴定(图1)和DNA测序证明,pET28a-MRP001中的MRP001基因的核苷酸序列是SEQ ID No.1的第896-1816位所示的核苷酸序列。pET28a-MRP001可表达SEQ ID No.6所示的MRP001蛋白,SEQ ID No.1的第896-1816位为MRP001蛋白的编码序列。
将重组载体pET28a-MRP001的NdeI和XhoI酶切位点间的DNA序列替换为SEQ ID No.2所示的DNA序列,保持其它DNA序列不变,得到重组载体pET28a-MRP002,pET28a-MRP002表达MRP002蛋白;将重组载体pET28a-MRP001的NdeI和XhoI酶切位点间的DNA序列替换为SEQ ID No.3所示的DNA序列,保持其它DNA序列不变,得到重组载体pET28a-MRP003,pET28a-MRP003表达MRP003蛋白;将重组载体pET28a-MRP001的NdeI和XhoI酶切位点间的DNA序列替换为SEQ ID No.4所示的DNA序列,保持其它DNA序列不变,得到重组载体pET28a-MRP004,pET28a-MRP004表达MRP004蛋白;将重组载体pET28a-MRP001的NdeI和XhoI酶切位点间的DNA序列替换为SEQ ID No.5所示的DNA序列,保持其它DNA序列不变,得到重组载体pET28a-MRP005,pET28a-MRP005表达MRP005蛋白。
将pET28a-MRP001导入大肠杆菌BL21(DE3)感受态细胞中,得到含有SEQ ID No.1的第896-1816位所示的用于编码MRP001蛋白的重组菌株,将该菌株命名为重组大肠杆菌BL21-MRP001(下文中简称BL21-MRP001菌株);将pET28a-MRP002导入大肠杆菌BL21(DE3)感受态细胞中,得到含有SEQ ID No.2所示的用于编码MRP002蛋白的重组菌株,将该菌株命名为重组大肠杆菌BL21-MRP002(下文中简称BL21-MRP002菌株);将pET28a-MRP003导入大肠杆菌BL21(DE3)感受态细胞中,得到含有SEQ ID No.3所示的用于编码MRP003蛋白的重组菌株,将该菌株命名为重组大肠杆菌BL21-MRP003(下文中简称BL21-MRP003菌株);将pET28a-MRP004导入大肠杆菌BL21(DE3)感受态细胞中,得到含有SEQ ID No.4所示的用于编码MRP00蛋白4的重组菌株,将该菌株命名为重组大肠杆菌BL21-MRP004(下文中简称BL21-MRP004菌株);将pET28a-MRP005导入大肠杆菌BL21(DE3)感受态细胞中,得到含有SEQ ID No.5所示的用于编码MRP005蛋白的重组菌株,将该菌株命名为重组大肠杆菌BL21-MRP005(下文中简称BL21-MRP005菌株);将表 达载体pET28a导入大肠杆菌BL21(DE3)感受态细胞中,得到不含有插入片段的重组菌株,将该菌株命名为重组大肠杆菌BL21-CK(下文中简称BL21-CK菌株),该菌株是空载体对照菌株。
二、重组菌株MRP001蛋白表达及提取
1、不同处理的菌体细胞收集
将步骤一得到的BL21-MRP001菌株、BL21-MRP002菌株、BL21-MRP003菌株、BL21-MRP004菌株、BL21-MRP005菌株、BL21-CK菌株分别接种于含有5mL液体LB培养基的试管中(卡那霉素的浓度为50mg/mL),BL21菌株接种于不含卡那霉素的液体LB培养基中,37℃摇床培养过夜作为种子液,分别得到BL21-MRP001菌株、BL21-MRP002菌株、BL21-MRP003菌株、BL21-MRP004菌株、BL21-MRP005菌株、BL21-CK菌株和BL21菌株的种子液。将上述种子液分别以1%体积比的接种量接种于含有5mL液体LB培养基的试管中,37℃摇床培养至OD600达到0.4-1。分别向OD600达到0.4-1的菌体培养液中加入5mL1mM的IPTG溶液,37℃摇床培养继续培养4小时后,4000rpm离心10min收集菌体,分别得到经IPTG诱导后的BL21-MRP001菌株、BL21-MRP002菌株、BL21-MRP003菌株、BL21-MRP004菌株、BL21-MRP005菌株、BL21-CK菌株和BL21菌株的菌体。
2、重组菌株蛋白质的提取
分别向经IPTG诱导后的BL21-MRP001菌株、BL21-MRP002菌株、BL21-MRP003菌株、BL21-MRP004菌株、BL21-MRP005菌株、BL21-CK菌株和BL21菌株的菌体中加入36mL裂解缓冲液(其中Tris-HCl的浓度为2mM,CaCl2的浓度为0.2mM,pH值为8.0),重新悬浮菌体,分别向重悬菌液中加入4mL质量浓度为10mg/mL的溶菌酶,获得含有溶菌酶的重悬菌液,含有溶菌酶的重悬菌液中溶解酶的质量浓度为1mg/mL,然后置于冰上放置30min。冰浴结束后,利用超声波进行菌体破碎(破碎参数:超声功率为400w,共超声20min,每次超声1s,间隔2s),超声破碎结束后在4000rpm离心10min,收集上清液,分别得到BL21-MRP001菌株的上清液、BL21-MRP002菌株的上清液、BL21-MRP003菌株的上清液、BL21-MRP004菌株的上清液、BL21-MRP005菌株的上清液、BL21-CK菌株的上清液和BL21菌株的上清液。
3、蛋白质定量
将BL21-MRP001菌株表达的蛋白质命名为MRP001蛋白,将BL21-MRP002菌株表达的蛋白质命名为MRP002蛋白,将BL21-MRP003菌株表达的蛋白质命名为MRP003蛋白,将BL21-MRP004菌株表达的蛋白质命名为MRP004蛋白,将BL21-MRP005菌株表达的蛋白质命名为MRP005蛋白,将BL21-CK菌株表达的蛋白质命名为BL21-CK蛋白,将BL21菌株表达的蛋白质命名为BL21蛋白。
使用上海生物工程有限公司的SK3071非干扰型蛋白浓度测定试剂盒分别对 BL21-MRP001菌株、BL21-MRP002菌株、BL21-MRP003菌株、BL21-MRP004菌株、BL21-MRP005菌株、BL21-CK菌株和BL21菌株的上清液中的蛋白质进行定量,结果如下:BL21-MRP001菌株上清液中的MRP001蛋白的质量浓度为0.37mg/mL,BL21-MRP002菌株上清液中的MRP002蛋白的质量浓度为0.58mg/mL,BL21-MRP003菌株上清液中的MRP003蛋白的质量浓度为0.1mg/mL,BL21-MRP004菌株上清液中的MRP004蛋白的质量浓度为1.33mg/mL,BL21-MRP005菌株上清液中的MRP005蛋白的质量浓度为1.47mg/mL,BL21-CK菌株上清液中的BL21-CK蛋白的质量浓度为1.16mg/mL,BL21菌株上清液中的BL21蛋白的质量浓度为0.3mg/mL。分别将BL21-MRP001菌株上清液中的MRP001蛋白、BL21-MRP002菌株上清液中的MRP002蛋白、BL21-MRP003菌株上清液中的MRP003蛋白、BL21-MRP004菌株上清液中的MRP004蛋白、BL21-MRP005菌株上清液中的MRP005蛋白、BL21-CK菌株上清液中的BL21-CK蛋白和BL21菌株上清液中的BL21蛋白在冻干条件下制备成粉状,分别得到MRP001蛋白粉、MRP002蛋白粉、MRP003蛋白粉、MRP004蛋白粉、MRP005蛋白粉、BL21-CK蛋白粉和BL21蛋白粉,在-80℃条件下保存备用。
三、MRP001蛋白的生物测定
常规饲料液体配方如下:蔗糖2.8g、啤酒酵母粉0.25g、50%蜂蜜水2.5g、鸡蛋22.5g、小麦胚10g、利马豆粉30g、大豆粉2.5g、卵黄30g、大豆卵磷脂1.5g、复合维生素1.2g、水164g。
将步骤二得到的MRP001蛋白粉加入到常规饲料液体中,分别得到名称为12.5μg/mL MRP001蛋白饲料液体(MRP001蛋白在该饲料液体中的质量浓度为12.5μg/mL)、25μg/mL MRP001蛋白饲料液体(MRP001蛋白在该饲料液体中的质量浓度为25μg/mL)、50μg/mL MRP001蛋白饲料液体(MRP001蛋白在该饲料液体中的质量浓度为50μg/mL)、100μg/mL MRP001蛋白饲料液体(MRP001蛋白在该饲料液体中的质量浓度为100μg/mL)和200μg/mL MRP001蛋白饲料液体(MRP001蛋白在该饲料液体中的质量浓度为200μg/mL);将步骤二得到的MRP002蛋白粉加入到常规饲料液体中分别得到名称为12.5μg/mL MRP002蛋白饲料液体(MRP002蛋白在该饲料液体中的质量浓度为12.5μg/mL)、25μg/mL MRP002蛋白饲料液体(MRP002蛋白在该饲料液体中的质量浓度为25μg/mL)、50μg/mL MRP002蛋白饲料液体(MRP002蛋白在该饲料液体中的质量浓度为50μg/mL)、100μg/mL MRP002蛋白饲料液体(MRP002蛋白在该饲料液体中的质量浓度为100μg/mL)和200μg/mL MRP002蛋白饲料液体(MRP002蛋白在该饲料液体中的质量浓度为200μg/mL);将步骤二得到的MRP003蛋白粉加入到常规饲料液体中分别得到名称为12.5μg/mL MRP003蛋白饲料液体(MRP003蛋白在该饲料液体中的质量浓度为12.5μg/mL)、25μg/mL MRP003蛋白饲料液体(MRP003蛋白在该饲料液体中的质量浓度为25μg/mL)、50μg/mL MRP003蛋白饲料液体(MRP003蛋白在该饲料液体中的质量浓度 为50μg/mL)、100μg/mL MRP003蛋白饲料液体(MRP003蛋白在该饲料液体中的质量浓度为100μg/mL)和200μg/mL MRP003蛋白饲料液体(MRP003蛋白在该饲料液体中的质量浓度为200μg/mL);将步骤二得到的MRP004蛋白粉加入到常规饲料液体中分别得到名称为12.5μg/mL MRP004蛋白饲料液体(MRP004蛋白在该饲料液体中的质量浓度为12.5μg/mL)、25μg/mL MRP004蛋白饲料液体(MRP004蛋白在该饲料液体中的质量浓度为25μg/mL)、50μg/mL MRP004蛋白饲料液体(MRP004蛋白在该饲料液体中的质量浓度为50μg/mL)、100μg/mL MRP004蛋白饲料液体(MRP004蛋白在该饲料液体中的质量浓度为100μg/mL)和200μg/mL MRP004蛋白饲料液体(MRP004蛋白在该饲料液体中的质量浓度为200μg/mL);将步骤二得到的MRP005蛋白粉加入到常规饲料液体中分别得到名称为12.5μg/mL MRP005蛋白饲料液体(MRP005蛋白在该饲料液体中的质量浓度为12.5μg/mL)、25μg/mL MRP005蛋白饲料液体(MRP005蛋白在该饲料液体中的质量浓度为25μg/mL)、50μg/mL MRP005蛋白饲料液体(MRP005蛋白在该饲料液体中的质量浓度为50μg/mL)、100μg/mL MRP005蛋白饲料液体(MRP005蛋白在该饲料液体中的质量浓度为100μg/mL)和200μg/mL MRP005蛋白饲料液体(MRP005蛋白在该饲料液体中的质量浓度为200μg/mL);对照组1为常规饲料液体;对照组2为将步骤二得到的BL21-CK蛋白粉加入到常规饲料液体中得到名称为200μg/mL BL21-CK蛋白饲料液体(BL21-CK蛋白在该饲料液体中的质量浓度为200μg/mL);对照组3为将步骤二得到的BL21蛋白粉加入到常规饲料液体中得到名称为200μg/mL BL21蛋白饲料液体(BL21蛋白在该饲料液体中的质量浓度为200μg/mL)。将封口膜剪成2cm×2cm大小的方块,将500μL上述各浓度的蛋白饲料液体置于抻开的封口膜上包好,稍用力挤成圆球状,便于绿盲蝽刺吸。
在每个试管中放入一个封口膜包好的圆球状的上述任一浓度的蛋白饲料液体,每个试管中任一浓度的蛋白饲料液体的质量相同,然后接入20头初孵未进食绿盲蝽。放入温度为26-28℃,相对湿度为70%的环境中进行培养。接虫后的第3、6、9天统计死亡率,实验重复3次,每次重复试验每组饲料进行3管试管试验。死亡率的计算公式为:死亡率=死亡的虫数/接虫总数×100%。
其中,将以12.5μg/mL MRP001蛋白饲料液体饲喂绿盲蝽的处理组命名为12.5μg/mL BL21-MRP001组,以25μg/mL MRP001蛋白饲料液体饲喂绿盲蝽的处理组命名为25μg/mL BL21-MRP001组,以50μg/mL MRP001蛋白饲料液体饲喂绿盲蝽的处理组命名为50μg/mL BL21-MRP001组,以100μg/mL MRP001蛋白饲料液体饲喂绿盲蝽的处理组命名为100μg/mL BL21-MRP001组,以200μg/mL MRP001蛋白饲料液体饲喂绿盲蝽的处理组命名为200μg/mL BL21-MRP001组;以12.5μg/mL MRP002蛋白饲料液体饲喂绿盲蝽的处理组命名为12.5μg/mL BL21-MRP002组,以25μg/mL MRP002蛋白饲料液体饲喂绿 盲蝽的处理组命名为25μg/mL BL21-MRP002组,以50μg/mL MRP002蛋白饲料液体饲喂绿盲蝽的处理组命名为50μg/mL BL21-MRP002组,以100μg/mL MRP002蛋白饲料液体饲喂绿盲蝽的处理组命名为100μg/mL BL21-MRP002组,以200μg/mL MRP002蛋白饲料液体饲喂绿盲蝽的处理组命名为200μg/mL BL21-MRP002组;以12.5μg/mL MRP003蛋白饲料液体饲喂绿盲蝽的处理组命名为12.5μg/mL BL21-MRP003组,以25μg/mL MRP003蛋白饲料液体饲喂绿盲蝽的处理组命名为25μg/mL BL21-MRP003组,以50μg/mL MRP003蛋白饲料液体饲喂绿盲蝽的处理组命名为50μg/mL BL21-MRP003组,以100μg/mL MRP003蛋白饲料液体饲喂绿盲蝽的处理组命名为100μg/mL BL21-MRP003组,以200μg/mL MRP003蛋白饲料液体饲喂绿盲蝽的处理组命名为200μg/mL BL21-MRP003组;以12.5μg/mL MRP004蛋白饲料液体饲喂绿盲蝽的处理组命名为12.5μg/mL BL21-MRP004组,以25μg/mL MRP004蛋白饲料液体饲喂绿盲蝽的处理组命名为25μg/mL BL21-MRP004组,以50μg/mL MRP004蛋白饲料液体饲喂绿盲蝽的处理组命名为50μg/mL BL21-MRP004组,以100μg/mL MRP004蛋白饲料液体饲喂绿盲蝽的处理组命名为100μg/mL BL21-MRP004组,以200μg/mL MRP004蛋白饲料液体饲喂绿盲蝽的处理组命名为200μg/mL BL21-MRP004组;以12.5μg/mL MRP005蛋白饲料液体饲喂绿盲蝽的处理组命名为12.5μg/mL BL21-MRP005组,以25μg/mL MRP005蛋白饲料液体饲喂绿盲蝽的处理组命名为25μg/mL BL21-MRP005组,以50μg/mL MRP005蛋白饲料液体饲喂绿盲蝽的处理组命名为50μg/mL BL21-MRP005组,以100μg/mL MRP005蛋白饲料液体饲喂绿盲蝽的处理组命名为100μg/mL BL21-MRP005组,以200μg/mL MRP005蛋白饲料液体饲喂绿盲蝽的处理组命名为200μg/mL BL21-MRP005组;以常规饲料液体饲喂绿盲蝽的处理组命名为对照组1,以200μg/mL BL21-CK蛋白饲料液体饲喂绿盲蝽的处理组命名为对照组2,以200μg/mL BL21蛋白饲料液体饲喂绿盲蝽的处理组命名为对照组3。
结果如表1所示,人工改造合成的MRP001蛋白具有较好的杀绿盲蝽效果,当使用浓度为25μg/mL时,绿盲蝽的死亡率达到96.7%,远高于对照组及相同浓度下其它四种蛋白质的致绿盲蝽死亡率。
表1、不同蛋白的绿盲蝽生物测定结果
实施例2、培育抗盲蝽蟓转基因棉花
一、植物表达载体的构建
将表达载体pCambia2301的HindⅢ和EcoRI识别位点(识别序列)间的DNA序列替换为SEQ ID No.1所示的DNA序列,保持其它DNA序列不变,得到重组载体pCambia2301-35S-MRP001-NOS(部分结构示意图如图2所示)。SEQ ID No.1由2093个核苷酸组成,其中第1-860位为CaMV35S启动子的DNA序列,第896-1816位为MRP001蛋白的DNA编码序列,第1830-2093位为NOS终止子的DNA序列。
酶切鉴定(图3)和DNA测序证明,pCambia2301-35S-MRP001-NOS中的MRP001基因 的核苷酸序列是SEQ ID No.1的第896-1816位所示的核苷酸序列。pCambia2301-35S-MRP001-NOS可表达SEQ ID No.6所示的MRP001蛋白,SEQ ID No.1的第896-1816位为MRP001蛋白的编码序列。
二、培育抗盲蝽蟓转基因棉花
将pCambia2301-35S-MRP001-NOS转化根癌农杆菌LBA4404,得到含有pCambia2301-35S-MRP001-NOS的重组农杆菌,命名为LBA4404/MRP001。根据文献(Firoozabady E,DeBoer D L,Merlo D J,et al.Transformation of cotton(Gossypium hirsutum L.)by Agrobacterium tumefaciens and regeneration of transgenic plants[J].Plant Molecular Biology,1987,10(2):105-116.)的方法采用农杆菌介导的遗传转化方法,用LBA4404/MRP001进行中棉所24棉花下胚轴的转化,将MRP001基因转入棉花基因组中,经过卡那霉素筛选、再生后进行转基因棉花的嫁接。转化植株长出7-8叶时,取叶片提取DNA,以该DNA为模板,以C004-11-f(5’-CAGGGTGGTGATTTTGGTTA-3’)和C004-11-r(5’-CGGAGCCATTTCAGTGACATT-3’)为引物,进行PCR扩增,初步检测外源基因的插入情况,得到约920bp的PCR产物(图4)。经过测序,该PCR产物为921bp,其核苷酸序列为是SEQ ID No.1的第896-1816位所示的核苷酸序列,该核苷酸序列所示的DNA分子为MRP001蛋白的编码序列,该DNA分子编码的蛋白质命名为MRP001蛋白,MRP001蛋白的氨基酸序列为SEQ ID No.6。将得到921bp的PCR产物的转化植株称为转MRP001基因棉花。
采用同样的方法将空载体pCambia2301转入中棉所24的棉花基因组中,获得含有空载体的转基因棉花,命名为转空载体棉花。
三、转基因棉花的抗盲蝽蟓效果
供试材料:以非转基因中棉所24作为对照1,以步骤二得到的T0代的转空载体棉花作为对照2,以步骤二得到的T0代的转MRP001基因棉花作为受检材料。
实验重复三次,每次重复的实验方法如下:试验在长20米、宽2.5米、高1.8米的网室内进行,在网室外面覆上80目的尼龙网网罩,以阻止害虫及天敌的侵入。在网室内种植非转基因中棉所24的(对照组1)、步骤二得到的T0代的转MRP001基因棉花(对照组2)和步骤二得到的T0代的转空载体棉花各10株网室内棉花栽培行距为0.80m、株距为0.25m,苗期可防治1-2次苗蚜。
在棉花生长的盛蕾期释放绿盲蝽成虫,每平方米释放2头,所释放的绿盲蝽为采自田间自然种群,经室内用四季豆人工饲养的成虫,释放时选择活动力强的成虫释放。接虫后第6天开始调查绿盲蝽对照组材料和受试材料的叶片和棉蕾的危害情况,试验方法参照中国专利(一种抗盲蝽蟓棉花的鉴定方法,申请号:201010284395.4),记录叶片和棉蕾危害级别,叶片受害症状为叶片呈现不均匀的孔洞、出现褐色或黑色斑;棉 蕾受害症状为棉蕾苞叶呈现黑色刺点、严重的棉蕾变黑色;叶片危害级别判定标准:0级为叶片无危害状;1级为叶片轻微受害,受害面积≤5%;2级为叶片中等危害,受害面积>5%,≤20%;3级为叶片严重受害,受害面积>20%,≤50%;4级为叶片危害同对照品种,受害面积>50%。
计算叶片危害指数、叶片危害指数减退率、棉蕾被害率和棉蕾被害减退率,叶片危害指数为每株棉花上部5片叶片的危害级别的平均值;叶片危害指数减退率根据公式I计算:
公式Ⅰ
棉蕾被害率根据公式II计算:
公式Ⅱ
棉蕾被害减退率根据公式III计算:
公式Ⅲ
试验结果如表2所示:转MRP001基因的棉花的叶片危害指数为0.35,叶片危害指数减退率为84.75%,棉蕾被害率为2.89%,棉蕾被害减退率为88.89%,与对照组1和对照组2的棉花相比,转MRP001基因的棉花对绿盲蝽具有很高的抗性。
表2、抗盲蝽蟓棉花的试验结果
采用含有上述相同MRP001蛋白浓度的饲料在相同实验条件下饲喂棉铃虫的实验证明,饲喂200μg/mL MRP001蛋白饲料液体的棉铃虫均没有死亡,说MRP001蛋白不具有抗棉铃虫活性,转MRP001基因的棉花对棉铃虫也无抗性,说明MRP001蛋白只具有抗盲蝽蟓活性而没有抗棉铃虫活性。
本发明的发明人为了创造新的抗棉铃虫资源,利用Cry51Aa1基因进行人工突变,旨在增强其抗虫性,作为棉铃虫抗性基因的储备。为此,人工合成了编码该蛋白的基 因及根据该基因序列设计不同突变位点的基因,并利用原核表达系统在大肠杆菌中表达了上述蛋白质。通过蛋白喷施叶片的方法,寻找在大田环境中对棉铃虫抗性提高的突变基因,但是效果较差,没有发现对棉铃虫杀伤力提高的蛋白。同样的蛋白,进行盲蝽蟓饲喂试验,发现来自其中一个突变基因的蛋白对盲蝽蟓具有良好的灭杀效果。
- 还没有人留言评论。精彩留言会获得点赞!