一种多肽提取纯化方法和试剂盒与流程
本发明涉及多肽的提取和纯化技术领域,尤其涉及一种多肽提取纯化方法和试剂盒。
背景技术:
随着功能多肽和多肽组学的研究和应用快速发展,如何快速高效地从分析样本中提取并纯化符合检测要求的多肽成分显得越来越重要,成为多肽科学研究、多肽药物开发和多肽临床检测等方向非常重要的一个环节。
多肽的广义定位为两个氨基酸以上组成的肽类物质,但更多指的是狭义上的低分子量短肽,在10~100个氨基酸长度范围内,而且这些短肽是来自于生物体内源性酶切产生的多肽,而非人为酶切或化学合成的,是生物体内自然表现形式的一系列短肽。这些多肽广泛存在于各种体液以及组织细胞中,有些具有高度特异性,有些甚至具有重要未知功能,含有丰富但并未被很好地认识和开发的活性成分、免疫因子和效应分子等,包括多肽生物标志物。这些低分子量范围的多肽分子可以作为肿瘤特异性诊断的丰富资源,因为它们记录了肿瘤组织微环境中胞内胞外发生的一系列酶催化反应事件,反映相关分子机制,因此具有非常重要的研究意义和应用前景,高效研究多肽的工具和方法同时也显得尤为重要,亟待开发。而多肽的分子量通常介于小分子化合物代谢物和大分子蛋白质之间,因此需要有效的提取和纯化方法将其与小分子代谢物以及大分子蛋白质分离,以更好地提供后续检测和分析研究。
多肽提取和纯化方法原理上主要有酸提取法、有机溶液提取法、匀浆或研磨提取法、超声法、沉淀法、超滤法、磁珠法、固相萃取法、免疫亲和法、色谱分离法和纳米孔材料法中一种或多种方法的组合。但是,目前还缺乏对这些方法进行有效结合和优化的方案,有待形成一套适用性广、提取纯化效率高的整合方法以及相应试剂盒产品。
目前,国内还没有出现适用于大规模样本高通量多肽组研究和功能多肽研究、多肽药物开发的高效多肽提取纯化方法和相应试剂盒。DNA、RNA、蛋白质的提取纯化已有较多技术专利和试剂盒产品,但是多肽方面还存在空白。国外仅有一个多肽提取试剂盒产品“StabilizorTM Peptide Extraction Kit”,但这个试剂盒只适用于组织样本类型的多肽提取,而且需要与Stabilizor system配套使用, 具有很大的使用局限性。另外其提取效果也存在较多与后续质谱检测鉴定不兼容的地方,只有提取,没有纯化,还需要再进一步进行还原烷基化处理和纯化等步骤。
技术实现要素:
本发明提供一种适用性广、操作简便、高效稳定且成本较低的多肽提取纯化方法和试剂盒。
根据本发明的第一方面,本发明提供一种多肽提取纯化方法,该方法包括以下步骤:
多肽提取:将待提取样本与含有蛋白质多肽变性剂和蛋白酶抑制剂的缓冲液混合,反应后分离上清液;
还原烷基化处理:取上述上清液与还原剂混合进行还原反应,然后加入烷基化试剂进行烷基化反应;
多肽富集纯化:
a)使上述还原烷基化处理后的样品通过能够结合多肽的萃取器,该萃取器预先用洗脱缓冲液清洗并活化然后用清洗液清洗并平衡;任选地,重复该步骤至少一次;
b)使清洗液通过上述萃取器以去除不结合的非多肽物质;任选地,重复该步骤至少一次;
c)依次使洗脱缓冲液和清洗液通过上述萃取器并收集穿透液;任选地,重复该步骤至少一次,并混合上述穿透液;
任选地,将上述穿透液离心抽干得到纯化后的多肽。
作为本发明的进一步改进的方案,上述方法还包括:
多肽进一步纯化:
d)用超滤器超滤上述穿透液或上述纯化后的多肽溶解后得到的溶液,上述超滤器预先用清洗液清洗并平衡、能够截留分子量大于待纯化多肽的蛋白成分;
e)用洗脱液洗脱上述超滤器并收集滤过液;任选地,重复该步骤至少一次,并混合上述滤过液;
任选地,将上述滤过液离心抽干得到进一步纯化后的多肽。
本发明中,上述待提取样本可以选自组织类样本、体液类样本或细胞类样本中的一种或多种的混合。
作为本发明的进一步改进的方案,上述组织类样本是提前匀浆或液氮研磨 的,上述组织类样本与上述缓冲液按质量体积比(g/ml)或体积比(ml/ml)为1:1~1:10混合,混合后涡旋震荡或冰浴超声处理,然后离心取上清液。
作为本发明的进一步改进的方案,上述体液类样本包括血清、血浆、脑脊液、精浆、唾液或尿液,上述体液类样本与上述缓冲液按体积比(ml/ml)为1:1~1:10混合,优选混合稀释至样品蛋白浓度为1~10mg/ml,混合后涡旋震荡,然后离心取上清液。
作为本发明的进一步改进的方案,上述细胞类样本与上述缓冲液按体积比(ml/ml)为1:3~1:10混合,优选混合稀释至样品蛋白浓度为1~10mg/ml,混合后涡旋震荡或冰浴超声处理,然后离心取上清液。
本发明中,上述蛋白质多肽变性剂可以选自尿素、盐酸胍或硫脲中的一种或多种的混合。
作为本发明的进一步改进的方案,上述蛋白质多肽变性剂在上述缓冲液中的浓度为6~10mol/L,上述蛋白酶抑制剂在上述缓冲液中的浓度为0.2~1mg/ml,上述缓冲液的pH缓冲范围为7~10。
本发明中,上述还原剂可以选自二硫苏糖醇、三(2-羧乙基)膦或β-巯基乙醇中的一种或多种的混合。
作为本发明的进一步改进的方案,上述还原剂的母液浓度为0.1~1.5mol/L,工作浓度为5~50mmol/L,上述还原反应的温度为50~65℃,时间为30~70min。
本发明中,上述烷基化试剂可以是碘代乙酰胺。
作为本发明的进一步改进的方案,上述烷基化试剂的母液浓度为0.1~1mol/L,工作浓度为20~100mmol/L,上述烷基化反应的温度为15~30℃,时间为30~60min。
作为本发明的进一步改进的方案,上述萃取器为萃取柱,优选为C18固相萃取柱。
作为本发明的进一步改进的方案,采用配置的推气筒推动上述样品、洗脱缓冲液和清洗液通过上述萃取器。
作为本发明的进一步改进的方案,上述清洗液为可挥发性酸性水溶液,更优选为甲酸水溶液、乙酸水溶液或三氟乙酸水溶液;进一步优选地,上述可挥发性酸性水溶液中酸的含量为0.05~1wt%,pH值范围为2~4。
作为本发明的进一步改进的方案,上述洗脱缓冲液选自可挥发可溶于水的有机溶液,更优选为80~100体积%的乙腈水溶液或80~100体积%的甲醇水溶液。
作为本发明的进一步改进的方案,上述超滤器为超滤管。
作为本发明的进一步改进的方案,上述洗脱液为可挥发可溶于水的有机溶剂水溶液,更优选为甲醇水溶液或乙腈水溶液;进一步优选地,上述甲醇水溶液或乙腈水溶液的浓度为5~20%(体积)。
本发明的多肽提取纯化方法的一个较优选的技术方案,包括以下步骤:
多肽提取:将选自组织类样本、体液类样本或细胞类样本的待提取样本与含有蛋白质多肽变性剂和蛋白酶抑制剂的缓冲液按体积比(ml/ml)为1:1~1:10混合,混合后涡旋震荡或冰浴超声处理,然后离心取上清液;
还原烷基化处理:取上述上清液与选自二硫苏糖醇、三(2-羧乙基)膦或β-巯基乙醇的还原剂混合进行还原反应,然后加入碘代乙酰胺进行烷基化反应;
多肽富集纯化:
a)使上述还原烷基化处理后的样品通过能够结合多肽的萃取柱,该萃取柱预先用洗脱缓冲液清洗并活化然后用清洗液清洗并平衡,上述清洗液为甲酸水溶液、乙酸水溶液或三氟乙酸水溶液;任选地,重复该步骤至少一次;
b)使清洗液通过上述萃取柱以去除不结合的非多肽物质;任选地,重复该步骤至少一次;
c)依次使洗脱缓冲液和清洗液通过上述萃取柱并收集穿透液;任选地,重复该步骤至少一次,并混合上述穿透液;
d)将上述穿透液离心抽干得到纯化后的多肽;
多肽进一步纯化:
e)用超滤管超滤上述纯化后的多肽溶解后得到的溶液,上述超滤管预先用清洗液清洗并平衡、能够截留分子量大于待纯化多肽的蛋白成分;
f)用洗脱液洗脱上述超滤器并收集滤过液,所述洗脱液为甲醇水溶液或乙腈水溶液;任选地,重复该步骤至少一次,并混合上述滤过液;
g)将上述滤过液离心抽干得到进一步纯化后的多肽。
根据本发明的第二方面,本发明提供一种多肽提取纯化试剂盒,上述试剂盒包括以下组成部分:
多肽提取缓冲液:含有蛋白质多肽变性剂和蛋白酶抑制剂,用于从待提取样本中提取多肽,以得到分离的上清液;
还原烷基化试剂:包含还原剂和烷基化试剂,上述还原剂用于与上述上清液进行还原反应,上述烷基化试剂用于与上述还原反应之后的样品进行烷基化 反应;
萃取器:能够结合待纯化的多肽,用于富集纯化上述还原烷基化处理后的样品中的多肽,该萃取器使用前预先用洗脱缓冲液清洗并活化然后用清洗液清洗并平衡,使用时使上述还原烷基化处理后的样品通过该萃取器,然后使清洗液通过该萃取器以去除不结合的非多肽物质,再依次使洗脱缓冲液和清洗液通过该萃取器并收集穿透液。
作为本发明的进一步改进的方案,上述试剂盒还包括以下组成部分:
超滤器:能够截留分子量大于待纯化多肽的蛋白成分,用于对上述萃取器富集纯化后的样品进行超滤,该超滤器使用前预先用清洗液清洗并平衡,使用时使上述萃取器富集纯化后的样品通过该超滤器,然后用洗脱液洗脱该超滤器并收集滤过液。
本发明中,上述蛋白质多肽变性剂可以选自尿素、盐酸胍或硫脲,浓度优选为6~10mol/L;上述蛋白酶抑制剂在上述缓冲液中的浓度优选为0.2~1mg/ml,上述缓冲液的pH缓冲范围优选为7~10。
本发明中,上述还原剂可以选自二硫苏糖醇、三(2-羧乙基)膦或β-巯基乙醇,浓度优选为0.1~1.5mol/L。
本发明中,上述烷基化试剂可以为碘代乙酰胺,浓度优选为0.1~1mol/L。
本发明中,上述萃取器优选为萃取柱,更优选为C18固相萃取柱;上述超滤器优选为超滤管。
作为本发明的进一步改进的方案,上述试剂盒还包括:洗脱缓冲液、清洗液和洗脱液;进一步优选地,上述清洗液为可挥发性酸性水溶液,更优选为甲酸水溶液、乙酸水溶液或三氟乙酸水溶液,更进一步优选地,上述可挥发性酸性水溶液中酸的含量为0.05~1wt%,pH值范围为2~4;进一步优选地,上述洗脱缓冲液选自可挥发可溶于水的有机溶液,更优选为80~100体积%的乙腈水溶液或80~100体积%的甲醇水溶液;进一步优选地,上述洗脱液为可挥发可溶于水的有机溶剂水溶液,更优选为甲醇水溶液或乙腈水溶液,更进一步优选地,上述甲醇水溶液或乙腈水溶液的浓度为5~20%(体积)。
本发明的多肽提取纯化方法和试剂盒适用于包括组织类样本、体液类样本或细胞类样本在内的所有类型样本的多肽提取和纯化,尤其适用于后续基于质谱的多肽组定性和定量研究分析。本发明的方法和试剂盒操作简便快速,适用于常规生物实验室,其多肽提取效率、富集纯化效率以及回收率高,且与后续 实验步骤兼容性高,实验操作周期短,重复性好,实验成本低,有利于实现大规模样本的高通量处理和检测,可应用于各种多肽定性和定量研究、多肽药物开发以及其它多肽产品开发,具有很好的应用前景。
附图说明
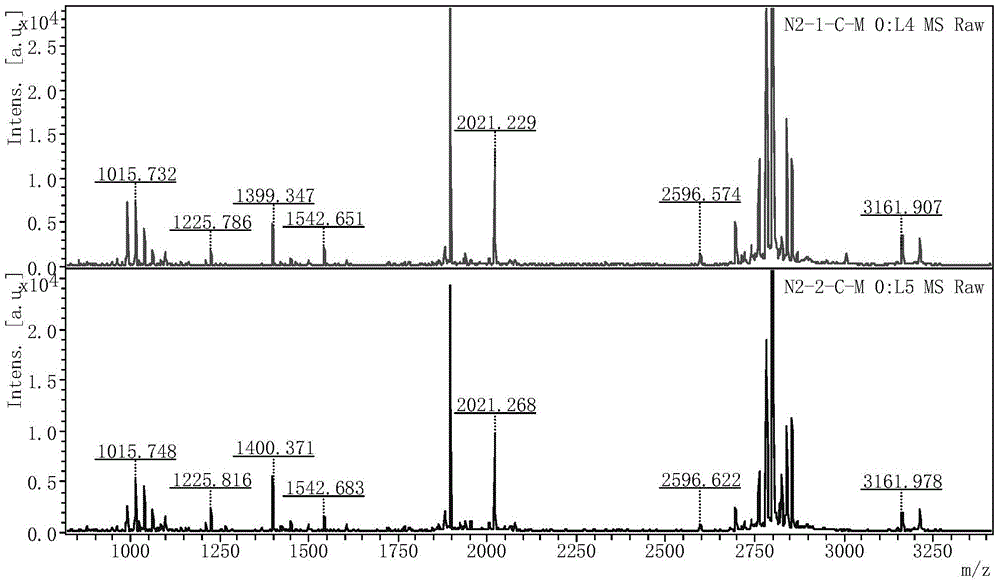
图1为本发明实施例1的两个重复实验小鼠脑组织样本富集后的多肽MALDI-TOF质谱检测图;
图2为本发明实施例2的两个重复实验血浆样本多肽富集纯化后的多肽MALDI-TOF质谱检测图;
图3为本发明实施例2的两个重复实验血浆样本多肽富集纯化后的多肽LC-MS/MS质谱定量检测结果图;
图4为本发明实施例3的两个重复实验细胞样本多肽富集后的多肽MALDI-TOF质谱检测图。
具体实施方式
下面通过具体实施方式结合实施例和附图对本发明作进一步详细说明。除非特别说明,下面实施例中所使用的技术均为本领域内的技术人员已知的常规技术;所使用的仪器设备和试剂等,均为本领域内的技术人员可以通过公共途径如商购等获得的。
本发明的关键构思之一在于,对多肽提取和纯化方法进行优化和整合,通过蛋白质多肽变性、还原烷基化处理以及使用萃取器并配合洗脱缓冲液和清洗液的使用,以及对操作过程和溶液使用顺序的优化,使得洗脱效率最大化,实现增加多肽的回收率,进而实现适用性广、操作简便、高效稳定且成本较低的多肽提取纯化。
本发明的进一步构思在于,在萃取器富集纯化多肽以后,使用超滤器进行超滤处理,实现了进一步截留分子量偏大的蛋白成分,并且具有高回收率和高重复性的效果。
本发明的多肽提取纯化方法基本上包括以下步骤:
多肽提取:将待提取样本与含有蛋白质多肽变性剂和蛋白酶抑制剂的缓冲液混合,反应后分离上清液;
还原烷基化处理:取上述上清液与还原剂混合进行还原反应,然后加入烷基化试剂进行烷基化反应;
多肽富集纯化:
a)使上述还原烷基化处理后的样品通过能够结合多肽的萃取器,该萃取器预先用洗脱缓冲液清洗并活化然后用清洗液清洗并平衡;任选地,重复该步骤至少一次;
b)使清洗液通过上述萃取器以去除不结合的非多肽物质;任选地,重复该步骤至少一次;
c)依次使洗脱缓冲液和清洗液通过上述萃取器并收集穿透液;任选地,重复该步骤至少一次,并混合上述穿透液;
任选地,将上述穿透液离心抽干得到纯化后的多肽。
针对上述方案作以下说明:
“任选地”是指可以有该特征,也可以没有该特征。权利要求书和说明书其它部分出现的“任选地”,如果没有其它特别说明,也是该含义。
本发明的方法适用于组织类样本、体液类样本或细胞类样本类型的待提取样本,相比现有的只适用于组织样本类型的多肽提取,具有明显的适用性广的优势。其中,组织类样本比如脑组织、肾脏组织、神经组织、结缔组织、肌肉组织或上皮组织等;体液类样本比如血清、血浆、脑脊液、精浆、唾液或尿液等;细胞类样本比如人成纤维细胞、心肌细胞或神经元等,可以是从生物体内分离的细胞,也可以是体外培养的细胞。
蛋白质多肽变性剂是指使得蛋白质和多肽以及多肽性物质发生变性的物质。这样的变性剂比如可以是尿素、盐酸胍或硫脲等,其浓度可以根据本领域技术人员的知识和经验确定。但是发明人经研究发现:蛋白质多肽变性剂在上述缓冲液中的浓度在6~10mol/L范围内(例如6mol/L、7mol/L、8mol/L、9mol/L或10mol/L)能取得优异效果,尤其是7mol/L的尿素;蛋白酶抑制剂的作用在于抑制蛋白质受蛋白酶的作用而降解生成多肽,防止最终提取到的多肽物质中混有蛋白质体外降解的成分,不能真实反映生物体内的多肽存在状况。这样的抑制剂比如ROCHE的蛋白酶抑制剂Cocktail(Protease Inhibitor Cocktail)或者SIGMA的蛋白酶抑制剂Cocktail,蛋白酶抑制剂在上述缓冲液中的浓度在0.2~1mg/ml范围内能取得优异效果。上述缓冲液的pH缓冲范围在7~10范围内(例如7、7.5、8、8.5、9、9.5或10)能取得优异效果,尤其是pH为9效果更加优异。本发明的缓冲液中的变性剂有利于增加多肽的溶解性,增加提取效率,且有利于后续还原烷基化效率,相比目前常报道的多肽提取方法——酸提取或有机溶剂提取,具有明显优势;蛋白酶抑制剂有效防止蛋白质在体外进一步降 解,大大减小内源性多肽的假阳性率。
针对组织类样本、体液类样本和细胞类样本三类样本,可以采用基本相同但有略有差异的操作方法实现多肽提取。例如本发明一个实施方案的多肽提取及缓冲液(称为Buffer A)如下。
多肽提取及缓冲液(Buffer A):
该缓冲液中含有蛋白质多肽变性剂(例如6M-10M、优选7M的尿素、盐酸胍或硫脲)和蛋白酶抑制剂(浓度0.2-1mg/ml)混合物,pH缓冲范围7-10(优选9)。
操作方法:
(1)组织类样本提前匀浆或液氮研磨,得到匀浆液或粉末后按样品:Buffer A=1g:1ml至1g:10ml(质量体积比),或样品:Buffer A=1ml:1ml至1ml:10ml(体积比)与Buffer A混合,室温(15-30℃)涡旋震荡5-10min,或冰浴超声处理1-3min;10000g离心5min,取上清。
(2)血清、血浆、脑脊液、精浆、唾液或尿液等体积较小、蛋白浓度较高的体液直接按照样品:Buffer A=1:1至1:10(体积比)与Buffer A混合,优选混合稀释至样品蛋白浓度为1-10mg/ml,室温(15-30℃)涡旋震荡1-5min;10000g离心5min,取上清。如果尿液等体积较大,蛋白浓度较低的体液,提前抽干浓缩或先富集浓缩成较小体积液体后再按照上述步骤(2)操作。
(3)细胞类样本直接按照样品:Buffer A=1:3至1:10(体积比)与Buffer A混合,优选混合稀释至样品蛋白浓度为1-10mg/ml,室温(15-30℃)涡旋震荡5-10min,或冰浴超声处理1-3min;10000g离心5min,取上清。
还原烷基化处理的目的在于通过还原剂还原多肽中的二硫键,通过烷基化试剂使二硫键还原生成的半胱氨酸发生烷基化,从而利于后续的多肽富集纯化操作,并且纯化出来的多肽不需要再进一步进行还原烷基化处理和其它纯化操作就可以进行后续应用,如质谱检测等。
还原剂可以选用二硫苏糖醇、三(2-羧乙基)膦或β-巯基乙醇等,一般还原剂配成0.1~1.5mol/L(例如0.1mol/L、0.3mol/L、0.5mol/L、0.7mol/L、0.9mol/L、1mol/L、1.3mol/L或1.5mol/L)的母液浓度,发明人发现工作浓度在5~50mmol/L范围内(例如5mmol/L、10mmol/L、20mmol/L、30mmol/L、40mmol/L或50mmol/L)能起到较好的还原效果,还原反应的温度在50~65℃范围内(例如50℃、51℃、52℃、53℃、54℃、55℃、56℃、57℃、58℃、59℃、60℃、61℃、62℃、63℃、 64℃或65℃)较好,一般还原时间在30~70min(例如30min、40min、50min、60min或70min)。
典型的烷基化试剂可以选用碘代乙酰胺,从烷基化的目的考虑,任何具有烷基化作用的试剂均可用于本发明中。一般烷基化试剂配置成0.1~1mol/L(例如0.1mol/L、0.15mol/L、0.25mol/L、0.35mol/L、0.45mol/L、0.55mol/L、0.65mol/L、0.75mol/L、0.85mol/L、0.9mol/L或1mol/L)的母液浓度,发明人发现工作浓度在20~100mmol/L范围内(20mmol/L、30mmol/L、40mmol/L、50mmol/L、60mmol/L、70mmol/L、80mmol/L、90mmol/L或100mmol/L)能起到较好的烷基化效果,烷基化反应的温度在15~30℃范围内(例如15℃、17℃、19℃、21℃、22℃、24℃、26℃、28℃或29℃)较好,一般烷基化时间在30~60min(例如30min、40min、50min或60min)。
本发明一个实施方案的还原烷基化及试剂如下:
还原烷基化及试剂:试剂A(Reagent A)和试剂B(Reagent B)。
Reagent A含有还原剂(例如0.1M-1.5M、优选0.5M的二硫苏糖醇、三(2-羧乙基)膦(TCEP)或β-巯基乙醇),Reagent B含有烷基化试剂(例如0.1-1M、优选0.85M的碘代乙酰胺)。
操作方法:
(1)样品与Buffer A混合变性后,加入Reagent A使还原剂(如二硫苏糖醇)终浓度为5-50mM(优选20mM),50-65℃(优选60℃)水浴反应30-70min(优选50min)。
(2)待水浴反应完,取出放置冷却至室温后加入Reagent B使烷基化试剂(如碘代乙酰胺)终浓度为20-100mM(优选80mM),室温(15-30℃)暗室放置30-60min(优选45min)。
多肽富集纯化过程中使用的萃取器,用于富集纯化多肽,可以是萃取柱或萃取塔等,优选萃取柱,更优选C18固相萃取柱,例如Phenomenex公司的Strata-X C18萃取柱。本发明中的萃取器可以称作PepExtracter,其可以通过推气筒例如手动推气筒(可以称作ManuPusher)来推动液体样品及缓冲液经过PepExtracter,可采用普通10ml注射器推筒。本发明的多肽富集所用的PepExtracter操作简便,富集效率高,重复性好。
多肽富集纯化过程中使用的清洗液(称作Buffer B)的作用是清洗去除不与PepExtracter结合的非多肽物质,同时也作为后续使用的超滤器(SpinFilter)的 清洗液;洗脱缓冲液(称作Buffer C)的作用一是活化PepExtracter,作用二是洗脱与PepExtracter结合的多肽物质。
Buffer B含有可挥发性酸性水溶液(例如0.05-1wt%、0.05wt%、0.1wt%、0.15wt%或1.0wt%、优选0.15wt%的甲酸水溶液、乙酸水溶液、三氟乙酸水溶液,pH值范围一般为2~4),Buffer C含有可挥发可溶于水的有机溶液(例如80~100体积%的乙腈水溶液或80~100体积%的甲醇水溶液)。
上述多肽富集纯化过程的步骤a)的作用是将样品中多肽物质与PepExtracter结合,非多肽物质不结合而流出,回收穿透液再重复一次的目的是增加多肽与PepExtracter的结合机会,增加回收率,其效果更佳。
上述多肽富集纯化过程的步骤b)的作用是去除不与PepExtracter结合的非多肽物质,起到净化作用,重复操作1-2次净化作用更加充分。
上述多肽富集纯化过程的步骤c)的作用是洗脱与PepExtracter结合的多肽物质,发明人深入研究发现,洗脱缓冲液和清洗液的交替使用能够使洗脱效率大大提高;如果步骤c)重复1-2次,那么多次洗脱缓冲液和清洗液的切换使用能够使洗脱效率最大化,这一点已经经过测试确证。步骤c)得到的穿透液在一些情况下可以直接用于后续分析或进一步纯化,在其它情况下可以将穿透液离心抽干得到纯化后的多肽,再用于后续分析或进一步纯化。
为了进一步提升纯化效果,还可以采用超滤器对上述萃取器纯化过的多肽进一步纯化,即上述方法还包括:
d)用超滤器超滤上述混合后的穿透液或上述纯化后的多肽溶解后得到的溶液,上述超滤器预先用清洗液清洗并平衡、能够截留分子量大于待纯化多肽的蛋白成分;
e)用洗脱液洗脱上述超滤器并收集滤过液;任选地,重复该步骤至少一次,并混合上述滤过液;
任选地,将上述滤过液离心抽干得到进一步纯化后的多肽。
对上述进一步纯化过程说明如下:
上述超滤器(可称为SpinFilter)可以是超滤管或超滤膜,优选超滤管,如Sartorius公司的Vivacon500 10KD超滤管。
步骤d)中的清洗液可以与上述步骤a)至c)中的清洗液相同。
步骤e)中的洗脱液(可称为Buffer D)选用可挥发可溶于水的有机溶剂水溶液,发明人发现甲醇水溶液或乙腈水溶液效果较好,更优选浓度为5~20%(体 积)的甲醇水溶液或乙腈水溶液的,洗脱液的作用是洗脱与SpinFilter结合残留的多肽物质,增加多肽回收率。
通过超滤能够截留分子量偏大的蛋白成分,纯化分子量偏小的多肽成分。要强调的是,在超滤器超滤完之后,再使用洗脱液(Buffer D)洗脱SpinFilter中吸附残留的多肽成分,可以很大程度地提高纯化回收率;另外,超滤与步骤c)的操作顺序也是关键,即PepExtracter和SpinFilter的先后使用顺序,本发明的操作顺序可以很好地解决高蛋白浓度样品在分子量截留超滤时常出现的堵塞所导致的回收率低和实验时间长等问题,可以达到高回收率和高重复性效果。
本发明的多肽进一步纯化所用的SpinFilter以及Buffer D提升了多肽纯化效果并大大增加了多肽回收率,目前Buffer D的使用尚未见报道。另外,优化的多肽富集纯化操作顺序解决了高蛋白浓度样品离心难的问题,提高实验操作简易度,同时提高了整体多肽富集纯化效果。
本发明一个实施方案的多肽富集纯化及装置、进一步纯化及装置说明如下:
多肽富集纯化及装置:PepExtracter采用Phenomenex公司的Strata-X C18萃取柱;ManuPusher采用普通10ml注射器推筒;SpinFilter采用Sartorius公司的Vivacon500 10KD超滤管。这些装置配合后续的优化实验操作步骤可达到良好的富集纯化效果。
操作方法:
(1)移取1ml Buffer C至PepExtracter中,用ManuPusher将Buffer C以3滴/秒的速度推出PepExtracter。
(2)移取1ml Buffer B至PepExtracter中,用ManuPusher将Buffer B以3滴/秒的速度推出PepExtracter。
(3)移取步骤(2)还原烷基化之后的样品至PepExtracter中,用ManuPusher将样品以1滴/秒的速度推出PepExtracter;如样品体积大于PepExtracter容积可分多次进行。样品从PepExtracter推出后的穿透液可放回PepExtracter中再重复一次操作效果更佳。
(4)移取1ml Buffer B至PepExtracter中,用ManuPusher将Buffer B以3滴/秒的速度推出PepExtracter;重复操作该步骤1-2次。
(5)移取0.2ml Buffer C至PepExtracter中,用ManuPusher将Buffer C以0.5滴/秒的速度推出PepExtracter,收集穿透液;移取0.1ml Buffer B至PepExtracter中,用ManuPusher将Buffer B以0.5滴/秒的速度推出PepExtracter, 收集穿透液。
(6)重复步骤(5)两次,然后将所有收集到的穿透液混合,离心抽干,则得到富集后的多肽,该多肽一般可直接用于后续质谱等检测分析,若要求更进一步的纯化,则往下按步骤7操作。
(7)移取0.4ml Buffer B至SpinFilter中,然后14000g离心10-15min至全部Buffer B甩出,弃甩出液;将富集并抽干后的样品用0.2-0.4ml Buffer B溶解,然后移取至Buffer B清洗后的SpinFilter中,更换新的收集套管,14000g离心10-15min至全部样品甩出,收集甩出液;移取0.3ml Buffer D至SpinFilter中,14000g离心10-15min至全部Buffer D甩出,收集甩出液;再移取0.3ml Buffer D至SpinFilter中,14000g离心10-15min至全部Buffer D甩出,收集甩出液;将所有收集的甩出液混合,离心抽干,即得进一步纯化后的多肽。
下面通过实施例更具体地说明本发明的特征、效果和优势,应当理解实施例仅是示例性的,并不构成对本发明保护范围的限制。
实施例1
一、组织样本多肽提取及还原烷基化
取小鼠脑组织样本分成两份,每份0.1g,液氮研磨,得到粉末后按样品:Buffer A=1g:5ml(质量体积比)加入0.5ml Buffer A(含7M尿素和0.5mg/ml蛋白酶抑制剂(ROCHE的Protease Inhibitor Cocktail)混合物,pH值9),室温涡旋震荡5min,然后冰浴超声处理1min,10000g离心5min,取上清。
往上清液加入Reagent A(含0.5M二硫苏糖醇)使二硫苏糖醇终浓度为20mM,涡旋震荡混匀,60℃水浴反应50分钟,待水浴反应完,取出放置冷却至室温后加入Reagent B(含0.85M碘代乙酰胺)使碘代乙酰胺终浓度为80mM,室温暗室放置45min。
二、组织样本多肽富集
1、移取1ml Buffer C(乙腈溶液)至PepExtracter(Phenomenex公司的Strata-X C18萃取柱)中,用ManuPusher(普通10ml注射器推筒)将Buffer C以3滴/秒的速度推出PepExtracter。
2、移取1ml Buffer B(0.15wt%甲酸水溶液)至PepExtracter中,用ManuPusher将Buffer B以3滴/秒的速度推出PepExtracter。
3、移取提取并还原烷基化之后的样品至PepExtracter中,用ManuPusher将样品以1滴/秒的速度推出PepExtracter。样品从PepExtracter推出后的穿透液 放回PepExtracter中再重复一次操作。
4、移取1ml Buffer B至PepExtracter中,用ManuPusher将Buffer B以3滴/秒的速度推出PepExtracter。重复操作该步骤2次。
5、移取0.2ml Buffer C至PepExtracter中,用ManuPusher将Buffer C以0.5滴/秒的速度推出PepExtracter,收集穿透液;移取0.1ml Buffer B至PepExtracter中,用ManuPusher将Buffer B以0.5滴/秒的速度推出PepExtracter,收集穿透液。
6、重复上述步骤5两次,然后将所有收集到的穿透液混合,离心抽干,则得到富集后的多肽。
三、组织样本富集多肽的MALDI-TOF质谱检测
使用MALDI-TOF质谱仪(Bruker公司)选择一级质谱检测方法,分子量检测范围为700-3500道尔顿,样品板上点样1μl富集后的组织样本多肽,烘干后点加0.3μl基质(饱和CHCA),旁边另外一个点点加0.2μl标准品,烘干后将样品靶放入质谱仪进行检测。
两个重复实验小鼠脑组织样本富集后的多肽MALDI-TOF质谱检测图如图1所示,示出了粒子流的强度(Intens)与质荷比(m/z)的关系,具有很高的富集效率和重复性。
实施例2
一、血浆样本的多肽提取及还原烷基化
取0.1ml人血浆样本,直接按照样品:Buffer A=1:5(体积比)与BufferA(含6M尿素和1mg/ml蛋白酶抑制剂(ROCHE的Protease Inhibitor Cocktail)混合物,pH值9)混合,室温涡旋震荡1min,10000g离心5min,取上清。
往上清液加入Reagent A(含1Mβ-巯基乙醇)使β-巯基乙醇终浓度为20mM,涡旋震荡混匀,60℃水浴反应1小时,待水浴反应完,取出放置冷却至室温后加入Reagent B(含1M碘代乙酰胺)使碘代乙酰胺终浓度为80mM,室温暗室放置45min。
二、血浆样本的多肽富集纯化
1、移取1ml Buffer C(乙腈溶液)至PepExtracter(Phenomenex公司的Strata-X C18萃取柱)中,用ManuPusher(普通10ml注射器推筒)将Buffer C以3滴/秒的速度推出PepExtracter。
2、移取1ml Buffer B(1wt%甲酸水溶液)至PepExtracter中,用ManuPusher将Buffer B以3滴/秒的速度推出PepExtracter。
3、移取提取并还原烷基化之后的样品至PepExtracter中,用ManuPusher将样品以1滴/秒的速度推出PepExtracter。样品从PepExtracter推出后的穿透液放回PepExtracter中再重复一次操作。
4、移取1ml Buffer B至PepExtracter中,用ManuPusher将Buffer B以3滴/秒的速度推出PepExtracter。重复操作该步骤2次。
5、移取0.2ml Buffer C至PepExtracter中,用ManuPusher将Buffer C以0.5滴/秒的速度推出PepExtracter,收集穿透液;移取0.1ml Buffer B至PepExtracter中,用ManuPusher将Buffer B以0.5滴/秒的速度推出PepExtracter,收集穿透液。
6、重复上述步骤5两次,然后将所有收集到的穿透液混合,离心抽干,则得到富集后的多肽。
7、移取0.4ml Buffer B至SpinFilter(Sartorius公司的Vivacon500 10KD超滤管)中,然后14000g离心10min至全部Buffer B甩出,弃甩出液。将富集并抽干后的样品用0.3ml Buffer B溶解,然后移取至Buffer B清洗后的SpinFilter中,更换新的收集套管,14000g离心15min至全部样品甩出,收集甩出液。移取0.3ml Buffer D至SpinFilter中,14000g离心15min至全部Buffer D甩出,收集甩出液。再移取0.3ml Buffer D(10%乙腈水溶液)至SpinFilter中,14000g离心15min至全部Buffer D甩出,收集甩出液。将所有收集的甩出液混合,离心抽干,即得进一步纯化后的多肽。
三、血浆样本富集纯化多肽的MALDI-TOF质谱检测
使用MALDI-TOF质谱仪(Bruker公司)选择一级质谱检测方法,分子量检测范围为700-3500道尔顿,样品板上点样1μl富集后的血浆样本多肽,烘干后点加0.3μl基质(饱和CHCA),旁边另外一个点点加0.2μl标准品,烘干后将样品靶放入质谱仪进行检测。
四、血浆样本富集纯化多肽的LC-MS/MS质谱检测
液质联用仪采用的是岛津的nano HPLC色谱仪系统和Thermo Scientific公司的Q-Exactive质谱仪系统。每个预分离好的多肽组分分别经过12cm长、75μm内径、填充了粒径3μm孔径120A的Welch Materials品牌XB-C18柱料的Ultimate毛细管分析柱分离,流速为300nl/min。检测进样体积为25μl,洗脱梯度为B液 浓度从5%均匀上升到45%经过40min。质谱采集模式为DDA模式(数据依赖性采集),可在一级和二级间切换,一级质谱全扫描分子量范围为350-1800m/z,轨道阱的分辨率达70000。二级质谱的采集,离子强度排在前20的离子相继分离后进行高能碰撞碎裂(HCD),选择母离子价态在2电荷到5电荷的范围,碎片离子通过高分辨率17500的轨道阱质量器记录,其中动态排除的设定是:重复次数为2,动态排除时间为8s。
两个重复实验血浆样本多肽富集纯化后的多肽MALDI-TOF质谱检测图如图2所示,液质联用串联质谱(LC-MS/MS)定量检测结果如图3所示,结果显示具有很高的富集纯化效率和重复性。
实施例3
一、细胞样本的多肽提取及还原烷基化
取人成纤维细胞样本108细胞数(300μl体积)直接按照样品:Buffer A=1:5(体积比)与Buffer A(含7M盐酸胍和0.5mg/ml蛋白酶抑制剂(ROCHE的Protease Inhibitor Cocktail)混合物,pH值9)混合,室温(15-30℃)涡旋震荡5min,冰浴超声处理1min;10000g离心5min,取上清。
往上清液加入Reagent A(含1M三(2-羧乙基)膦)使三(2-羧乙基)膦终浓度为10mM,涡旋震荡混匀,60℃水浴反应50分钟,待水浴反应完,取出放置冷却至室温后加入Reagent B(含0.1M碘代乙酰胺)使碘代乙酰胺终浓度为80mM,室温暗室放置45min。
二、细胞样本的多肽富集纯化及MALDI-TOF质谱检测
富集纯化及质谱检测方法同实施例2。两个重复实验细胞样本多肽富集后的多肽MALDI-TOF质谱检测图如图4所示,结果显示很高的纯化效率和重复性。
以上内容是结合具体的实施方式对本发明所作的进一步详细说明,不能认定本发明的具体实施只局限于这些说明。对于本发明所属技术领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干简单推演或替换。
- 还没有人留言评论。精彩留言会获得点赞!