Pyrviniumpamoate诱导的肌肉萎缩模型及其应用的制作方法
本发明涉及生物
技术领域:
,具体涉及Pyrviniumpamoate诱导的肌肉萎缩模型及其应用。
背景技术:
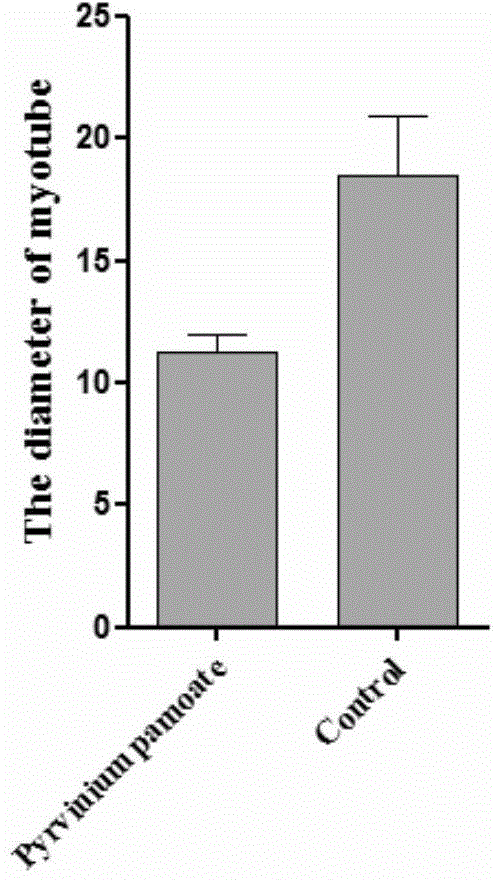
:目前的肌肉萎縮细胞模型主要通过血清饥饿制备,其模拟的是在营养不良情况下的肌肉萎缩,但是在现代社会由于营养不良造成的肌肉萎缩只占肌肉萎缩症患者中很小的比例,包括衰老相关肌肉萎缩在内的绝大多数肌肉萎缩都不是由营养不良造成的。要制备衰老相关肌肉萎缩的细胞模拟,目前只能从衰老小鼠肌肉中直接分离终末分化的肌纤维。这一方法耗时很长,需将小鼠至少饲养一年。一致性较差,由于小鼠存在个体差异,同样年龄的小鼠,其肌肉萎缩的程度存在比较大的差异。自体内直接分离的肌纤维只能在体外培养3-5天,再次使用必须另取新的小鼠进行分离。而由于小鼠间的个体差异,很难保证从不同个体中分离到的肌纤维的萎缩程度的一致性,因而妨碍采用此系统的实验的一致性。目前常用的肌肉萎缩动物模型主要通过限制进食获得,其模拟的是在营养不良情况下的肌肉萎缩。如上文所述,营养不良造成的肌肉萎缩在现代社会发生率很低,无法模拟衰老相关肌肉萎缩。另一获得衰老相关肌肉萎缩动物模型的方法是经长期饲养等动物衰老后作为模型使用。这一方法耗时很长,如上文所述,由于个体差异造成一致性很差,从而降低药物筛选实验的重复性。现有技术中,已知:小分子Pyrviniumpamoate,分子量1151.39,分子式C75H70N6O6,CAS号3546-41-6。但是未发现,小分子Pyrviniumpamoate与肌肉萎缩之间的关系。技术实现要素:为了克服现有技术中的缺陷,本发明提供了一种Pyrviniumpamoate的新用途,并将Pyrviniumpamoate用于诱导肌肉发生萎缩,成功构建了肌肉萎缩细胞模型。本发明的肌肉萎缩细胞模型具有肌肉萎缩的典型特征,可极好地模拟体内肌肉萎缩的发生发展,是肌肉萎缩基础和临床应用研究的理想细胞模型,可良好地应用于筛选治疗肌肉萎缩的药物。本发明是通过以下技术方案实现的:本发明的第一方面,提供了Pyrviniumpamoate在制备诱导肌肉细胞发生萎缩的药物或制剂中的用途。优选的,所述肌肉细胞为终末分化的肌肉细胞。优选的,所述药物或制剂还用于减小肌肉细胞中肌管的直径或横切面积。优选的,所述药物或制剂还用于上调肌肉细胞中Atroign-1和Murf-1等肌肉萎缩相关基因的表达水平。本发明的第二方面,提供了Pyrviniumpamoate在构建肌肉萎缩细胞模型或肌肉萎缩动物模型中的用途。本发明的第三方面,提供了一种构建肌肉萎缩细胞模型的方法,所述方法包括以下步骤:向肌肉细胞施用有效剂量的Pyrviniumpamoate;获得肌肉萎缩细胞模型。优选的,所述肌肉细胞为终末分化的肌肉细胞。优选的,所述终末分化的肌肉细胞选自以下任一:(1)由肌肉前体细胞、原代肌肉祖细胞或干细胞分化而成;(2)由体内肌肉分离得到终末分化的肌管细胞。在本发明的优选实例中,所述终末分化的肌肉细胞由肌肉前体细胞分化而成。所述肌肉前体细胞选自肌肉前体细胞系,如C2C12细胞。更优选的,所述终末分化的肌肉细胞是将肌肉前体细胞采用分化培养基培养2~4天,诱导分化而成。最优培养时间为3天。优选的,所述施用有效剂量的Pyrviniumpamoate的方法为:采用新鲜的含有效剂量的Pyrviniumpamoate的分化培养基,培养终末分化的肌肉细胞。在本发明的优选实例中,所述有效剂量的Pyrviniumpamoate是指Pyrviniumpamoate在分化培养基中的终浓度为2~15μM;培养时间为24~48小时。更优选的,Pyrviniumpamoate在分化培养基中的终浓度为5μM;培养时间为24小时。本发明的第四方面,提供了由前述方法构建的肌肉萎缩细胞模型在筛选药物中的用途。本发明的第五方面,提供了一种筛选治疗肌肉萎缩的候选药物的方法,所述方法包括以下步骤:将测试候选药物施用于由前述方法构建获得的肌肉萎缩细胞模型,并与未施用测试候选药物的肌肉萎缩细胞模型进行比较,其中施用后导致肌肉萎缩症状改善或治愈的测试化合物就是治疗肌肉萎缩的候选药物。上述筛选出的候选药物可构成一个筛选库,可对这些物质进行进一步的细胞实验、动物实验、和/或临床试验,以进一步确证所述潜在物质的治疗肌肉萎缩作用。由于本发明采用Pyrviniumpamoate进行诱导,所构建的模型更类似于人类的发病过程,一致性高,因而在药物的筛选上比以往的模型更为精准,效率更高。本发明的有益效果在于:(1)本发明首次揭示了Pyrviniumpamoate能够诱导肌肉细胞发生萎缩,更类似于人类的发病过程,模型的一致性高。(2)本发明的肌肉萎缩细胞模型具有肌肉萎缩的典型特征,可极好地模拟体内肌肉萎缩的发生发展,是肌肉萎缩基础和临床应用研究的理想细胞模型,从而可良好地应用于筛选治疗肌肉萎缩的药物。附图说明图1:Pyrviniumpamoate诱导终末分化的肌肉细胞发生萎缩。与对照组相比,处理1天及两天后,实验组myotube直径明显变小。Scalebar:100μm。图2:直径统计显示,Pyrviniumpamoate处理后,myotube直径较对照组明显减小。图3:Pyrviniumpamoate造成肌肉萎缩。RT-qPCR结果显示,与对照组相比,实验组肌肉萎缩相关基因Atrogin-1和Murf-1表达量上调。图4:Pyviniumpamoate诱导的肌肉萎缩能够被Wnt3缓解,但是Wnt3无法缓解由血清饥饿造成的肌肉萎缩。具体实施方式本发明经过广泛而深入的研究,对多种小分子化合物及其使用方法进行测试,发现小分子Pyrviniumpamoate能够用于成功建立肌肉萎缩细胞模型。所述肌肉萎缩细胞模型具有肌肉萎缩的典型特征,可作为模型,良好地模拟肌肉萎缩的发生发展。同时,所述细胞模型还可应用于筛选治疗肌肉萎缩的候选药物。在此基础上完成了本发明。所述的肌肉萎缩是一种哺乳动物的疾病,其主要表现为以下的部分或全部特征:Myotube(肌管)直径或横切面积明显变小,肌肉萎缩特异标记基因Atroign-1和Murf-1的mRNA表达水平上调。具体而言,本发明人使用小分子Pyrviniumpamoate建立肌肉萎缩细胞模型,对细胞模型进行相关生物学测试,最终筛选到一种Myotube直径明显变小,Atroign-1和Murf-1的mRNA表达水平上调的肌肉萎缩细胞模型。所述肌肉萎缩细胞模型表型稳定,并且在光镜、电镜下的形态特征与肌肉萎缩组织一致。光镜下显示,具有Myotube直径明显变小的特征。RT-qPCR分析显示,Atroign-1和Murf-1的mRNA高表达。Pyrviniumpamoate小分子Pyrviniumpamoate,分子量1151.39,分子式C75H70N6O6,CAS号3546-41-6。Pyrviniumpamoate的新用途本发明提供了Pyrviniumpamoate在制备诱导肌肉细胞发生萎缩的药物或制剂中的用途。所述肌肉细胞为终末分化的肌肉细胞。此外,所述药物或制剂还用于减小肌肉细胞中肌管的直径或横切面积。此外,所述药物或制剂还用于上调肌肉细胞中Atroign-1和Murf-1的表达水平。肌肉萎缩细胞模型的构建及其用途。本发明还提供了Pyrviniumpamoate在构建肌肉萎缩细胞模型或肌肉萎缩动物模型中的用途。肌肉萎缩细胞模型的构建及其用途:本发明的肌肉萎缩细胞模型构建方法,包括以下步骤:向肌肉细胞施用有效剂量的Pyrviniumpamoate;获得肌肉萎缩细胞模型。所述肌肉细胞为终末分化的肌肉细胞。所述终末分化的肌肉细胞选自以下任一:(1)由肌肉前体细胞、原代肌肉祖细胞或干细胞分化而成;(2)由体内肌肉分离得到终末分化的肌管细胞。在本发明的优选实例中,所述终末分化的肌肉细胞由肌肉前体细胞分化而成,所述肌肉前体细胞选自肌肉前体细胞系,如C2C12细胞。更优选的,所述终末分化的肌肉细胞是将肌肉前体细胞采用分化培养基培养2~4天,诱导分化而成。最优培养时间为3天。优选的,所述施用有效剂量Pyrviniumpamoate的方法为:采用新鲜的含有效剂量的Pyrviniumpamoate的分化培养基,培养终末分化的肌肉细胞。在本发明的优选实例中,所述有效剂量的Pyrviniumpamoate是指Pyrviniumpamoate在分化培养基中的终浓度为2~15μM;培养时间为24~48小时。更优选的,Pyrviniumpamoate在分化培养基中的终浓度为5μM;培养时间为24小时。在利用Pyrviniumpamoate诱导后,本发明人利用肌肉萎缩疾病相关的指标来验证建立模型成功与否。验证发现,采用Pyrviniumpamoate诱导后,Myotube肌管直径明显变小,Atroign-1和Murf-1的mRNA表达水平上调。综合这些指标可知,本发明人利用Pyrviniumpamoate诱导成功构建了肌肉萎缩细胞模型。本发明利用Pyrviniumpamoate诱导成功构建了肌肉萎缩细胞模型,所述模型具有多方面的应用。例如,可以用于研究和阐述肌肉萎缩的细胞乃至分子水平上的发病机制。还可应用于治疗肌肉萎缩的药物的筛选。筛选新药因此,本发明提供了一种筛选治疗肌肉萎缩的候选药物的方法,所述方法包括以下步骤:将测试候选药物施用于上述肌肉萎缩细胞模型,并与未施用测试候选药物的肌肉萎缩细胞模型进行比较,其中施用后导致肌肉萎缩症状改善或治愈的测试化合物就是治疗肌肉萎缩的候选药物。上述筛选出的候选药物可构成一个筛选库,可对这些物质进行进一步的细胞实验、动物实验、和/或临床试验,以进一步确证所述潜在物质的治疗肌肉萎缩作用。由于本发明采用Pyrviniumpamoate进行诱导,所构建的模型更类似于人类的发病过程,一致性高,因而在药物的筛选上比以往的模型更为精准,效率更高。本发明的有益效果在于:(1)本发明首次揭示了Pyrviniumpamoate能够诱导肌肉细胞发生萎缩,更类似于人类的发病过程,模型一致性高。(2)本发明的肌肉萎缩细胞模型具有肌肉萎缩的典型特征,可极好地模拟体内肌肉萎缩的发生发展,是肌肉萎缩基础和临床应用研究的理想细胞模型,从而可良好地应用于筛选治疗肌肉萎缩的药物。以下通过特定的具体实例说明本发明的实施方式,本领域技术人员可由本说明书所揭露的内容轻易地了解本发明的其它优点与功效。本发明还可以通过另外不同的具体实施方式加以实施或应用,本说明书中的各项细节也可以基于不同观点与应用,在没有背离本发明的精神下进行各种修饰或改变。在进一步描述本发明具体实施方式之前,应理解,本发明的保护范围不局限于下述特定的具体实施方案;还应当理解,本发明实施例中使用的术语是为了描述特定的具体实施方案,而不是为了限制本发明的保护范围;在本发明说明书和权利要求书中,除非文中另外明确指出,单数形式“一个”、“一”和“这个”包括复数形式。当实施例给出数值范围时,应理解,除非本发明另有说明,每个数值范围的两个端点以及两个端点之间任何一个数值均可选用。除非另外定义,本发明中使用的所有技术和科学术语与本
技术领域:
技术人员通常理解的意义相同。除实施例中使用的具体方法、设备、材料外,根据本
技术领域:
的技术人员对现有技术的掌握及本发明的记载,还可以使用与本发明实施例中所述的方法、设备、材料相似或等同的现有技术的任何方法、设备和材料来实现本发明。除非另外说明,本发明中所公开的实验方法、检测方法、制备方法均采用本
技术领域:
常规的分子生物学、生物化学、染色质结构和分析、分析化学、细胞培养、重组DNA技术及相关领域的常规技术。这些技术在现有文献中已有完善说明,具体可参见Sambrook等MOLECULARCLONING:ALABORATORYMANUAL,Secondedition,ColdSpringHarborLaboratoryPress,1989andThirdedition,2001;Ausubel等,CURRENTPROTOCOLSINMOLECULARBIOLOGY,JohnWiley&Sons,NewYork,1987andperiodicupdates;theseriesMETHODSINENZYMOLOGY,AcademicPress,SanDiego;Wolffe,CHROMATINSTRUCTUREANDFUNCTION,Thirdedition,AcademicPress,SanDiego,1998;METHODSINENZYMOLOGY,Vol.304,Chromatin(P.M.WassarmanandA.P.Wolffe,eds.),AcademicPress,SanDiego,1999;和METHODSINMOLECULARBIOLOGY,Vol.119,ChromatinProtocols(P.B.Becker,ed.)HumanaPress,Totowa,1999等。实施例1Pyrviniumpamoate诱导的肌肉萎缩细胞模型的建立本实施例的主要内容为对肌肉前体细胞系C2C12进行培养、分化并构建肌肉萎缩细胞模型:(1)配置生长培养基:DMEM高糖培养基加入10%胎牛血清后混匀备用。(2)配置分化培养基:DMEM高糖培养基中加入2%马血清后混匀备用。(3)溶解小分子化合物:用DMSO溶解Pyrviniumpamoate,配成浓度为10mM的储存浓度。(4)配置诱导肌肉萎缩的条件培养基:临用前向分化培养基中加入小分子Pyrviniumpamoate,使其在分化培养基中的终浓度为5μM;(5)细胞系培养:C2C12细胞从液氮中取出后迅速置于37℃水浴锅中,融化后加入到9ml生长培养基中,1500rpm/min室温离心5分钟后,弃掉上清,加入1ml生长培养基重悬后转入10cm培养皿中,补加9ml生长培养基,在37℃,5%二氧化碳条件下培养。C2C12细胞系分化为myotube:待C2C12细胞长至完全铺满整个培养皿之后,用PBS洗3次,加入10ml分化培养基,在37℃,5%二氧化碳条件下诱导分化3天。(6)小分子诱导由C2C12分化而来的myotube发生肌肉萎缩:更换新鲜10ml分化培养基,在对照组中加入5μlDMSO,在实验组中加入终浓度为5μM的Pyrviniumpamoate,37℃,5%二氧化碳条件下培养24小时。结果如图1所示,通过显微镜观察拍照,与对照组相比,加入Pyrviniumpamoate后myotube的直径显著减小;且通过统计学分析显示,加入Pyrviniumpamoate后myotube的直径显著减小至约为对照组的三分之一。(7)取实验组和对照组各一盘细胞,加入1mlTrizol后提取总RNA,各取1μg总RNA加入1μl(200units)NEB公司MuLV反转录酶及其1x反应缓冲液,0.5mMdNTP混合物,4μMOligodT,1μlRNaseinhibitor42℃孵育1小时,反转录为cDNA。将cDNA在90℃灭活10分钟,作为PCR模板。使用上面列出的正向和反向引物,进行实时荧光定量PCR检测目的基因的表达量。PCR条件为95℃10分钟,95℃30秒,60℃60秒,第二和第三步反复循环40次。采用GAPDH作为内参,所用引物序列为:GAPDHforward:ACCCAGAAGACTGTGGATGG(SEQIDNO.1)GAPDHreverse:ACACATTGGGGGTAGGAACA(SEQIDNO.2)同时检测肌肉中肌肉萎缩特异性基因Atrogin-1(NM_026346.3)和Murf-1(NM_001039048.2)的表达作为肌肉萎缩的标记。所用引物序列为:Atrogin-1forward:AGAGAGGCAGATTCGCAAGCGT(SEQIDNO.3)Atrogin-1reverse:TGCAAAGCTGCAGGGTGACCC(SEQIDNO.4)Murf-1forward:acctgctggtggaaaacatc(SEQIDNO.5)Murf-1reverse:cttcgtgttccttgcacatc(SEQIDNO.6)采用NEB的MuLv反转录酶反转录为cDNA,通过实时荧光定量PCR检测肌肉萎缩标记物Atroign-1和Murf-1的mRNA表达水平。结果如图2所示,小分子Pyrviniumpamoate作用于终末分化的肌肉细胞后能上调Atrogin1、Murf1的表达水平,造成肌肉萎缩。此外,还进行了如下优化考察实验:(a)固定分化诱导的天数为3天,作用时间24小时,对Pyrviniumpamoate的有效剂量进行了考察,亦即,上述步骤(4)中,加入不同浓度的小分子Pyrviniumpamoate,使其在分化培养基中的终浓度分别为1、2、5、10、15μM,观察终末分化肌肉细胞直径的变化情况,结果如表1所示:表1.不同剂量Pyrviniumpamoate对于终末分化肌肉细胞直径的影响Pyrviniumpamoate(μM)平均终末分化肌肉细胞直径(μm)018.2±1.4117.9±1.8215.4±1.3511.7±1.51010.5±1.21510.9±1.3由上述结果可知,当Pyrviniumpamoate在分化培养基中终浓度为2~15uM时,均可使得终末分化肌肉细胞直径明显减小。下述实验优选采用Pyrviniumpamoate在分化培养基中终浓度为5uM。(b)固定分化培养基中的Pyrviniumpamoate终浓度为5uM,作用时间24小时,对诱导分化天数进行了考察,亦即,上述步骤(5)中,诱导分化2~4天,观察终末分化肌肉细胞直径的变化情况,结果如表2所示:表2.不同分化时间的C2C12细胞分化效率分化时间(天)分化效率(%)0013220390490由上述结果可知,当Pyrviniumpamoate诱导分化的时间为2~4天时,均可使得终末分化肌肉细胞直径明显减小,但是当诱导分化3天时,已经能够达到较好的效果。因此,优选采用Pyrviniumpamoate的诱导分化时间为3天。(C)固定分化培养基中的Pyrviniumpamoate终浓度为5uM,诱导分化时间3天,对作用时间进行了考察,亦即,上述步骤(6)中,培养12~72小时,观察终末分化肌肉细胞直径的变化情况,结果如表3所示:表3.不同Pyrviniumpamoate作用时间对于终末分化肌肉细胞直径的影响作用时间(小时)平均肌肉细胞直径(μm)细胞死亡率(%)018.2±1.40818.5±1.521216.6±1.4172411.2±1.7184810.9±1.4807210.6±1.890由上述结果可知,当Pyrviniumpamoate诱导分化的时间为24~48小时,均可使得终末分化肌肉细胞直径明显减小,但是当诱导分化24小时,已经能够达到较好的效果,并且细胞死亡率较低。因此,优选采用作用时间为24小时。实施例3营养不良诱导的肌肉萎缩模型与Pyrviniumpamoate诱导的肌肉萎缩模型比较肌肉前体细胞系C2C12的培养、分化及构建肌肉细胞萎缩模型:配置生长培养基:DMEM高糖培养基加入10%胎牛血清后混匀备用。配置分化培养基:DMEM高糖培养基中加入2%马血清后混匀备用。溶解小分子化合物:用DMSO溶解Pyrviniumpamoate,配成浓度为10mM的储存浓度。配置诱导肌肉萎缩的条件培养基:临用前向分化培养基中加入小分子Pyrviniumpamoate,致终浓度为5μM。细胞系培养:C2C12细胞从液氮中取出后迅速置于37℃水浴锅中溶解,加入到9ml生长培养基中,1500rpm/min室温离心5分钟后,弃掉上清,加入1ml生长培养基重悬后转入10cm培养皿中,补加9ml生长培养基,在37℃,5%二氧化碳条件下培养。C2C12细胞系分化为myotube:待C2C12细胞长至完全铺满整个培养皿之后,用PBS洗3次,加入10ml分化培养基,在37℃,5%二氧化碳条件下诱导分化3天。饥饿诱导肌肉萎缩:将终末分化的myotube置于Hanks’缓冲液(0.137MNaCl,5.4mMKCl,0.25mMNa2HPO4,0.44mMKH2PO4,1.3mMCaCl2,1.0mMMgSO4,4.2mMNaHCO3)中培养24小时以保持渗透压平衡,但是不提供任何血清等营养物质。在显微镜下拍照,测量myotube的直径。小分子Pyrviniumpamoate诱导由C2C12分化而来的myotube发生肌肉萎缩:更换新鲜10ml分化培养基,在对照组中加入5μlDMSO,在实验组中加入终浓度为5μM的Pyrviniumpamoate,37℃,5%二氧化碳条件下培养24小时。显微镜下观察拍照,并测量myotube的直径。向饥饿诱导的肌肉萎缩和Pyrviniumpamoate诱导的肌肉萎缩myotube中分别加入Wnt信号通路激动剂10ng/μlWnt3a,37℃,5%二氧化碳条件下培养24小时。显微镜下拍照,并测量myotube直径。结果显示,加入Wnt信号通路激动剂能够逆转Pyrviniumpamoate造成的肌肉萎缩,但是无法逆转营养不良造成的肌肉萎缩。综上所述,Pyrviniumpamoate所诱导引起的肌肉萎缩与饥饿引起的肌肉萎缩不同:加入Wnt信号通路激动剂能够逆转由Pyrviniumpamoate诱导的肌肉萎缩(如图4所示)。但是由饥饿造成的肌肉萎缩不受Wnt信号通路激动剂的影响(如图4所示),提示Pyrviniumpamoate诱导的肌肉萎缩与传统的营养不良导致的肌肉萎缩模型不同。当今世界由于营养不良造成的肌肉萎缩越来越少见,而由衰老、肥胖所导致的肌肉萎缩患者日益增多。目前还没有快速、稳定地制备模拟衰老、肥胖所导致的肌肉萎缩模型的方法,因而难以为进一步肌肉萎缩防治药物的筛选提供稳定的良好平台,并研究相关的分子机制。而本发明的Pyrviniumpamoate诱导的肌肉萎缩模型,为进一步肌肉萎缩防治药物的筛选或研究相关的分子机制提供稳定而良好的平台。实施例4药物筛选以实施例1制备的肌肉萎缩细胞模型为受试对象,检测候选药物施用前后,Myotube直径变化,从而判断候选药物是否对于治疗肌肉萎缩是有效的。测试组:给予候选药物的模型;对照组:不给予候选药物的模型。如果与对照组相比,测试组中的Myotube直径变大,Atroign-1和Murf-1的mRNA表达水平下降,则说明该候选药物可治疗肌肉萎缩。可利用患肌肉萎缩动物,对上述经筛选能够治疗肌肉萎缩的候选药物,进行进一步的动物试验,进一步验证治疗效果。以上的实施例是为了说明本发明公开的实施方案,并不能理解为对本发明的限制。此外,本文所列出的各种修改以及发明中方法、组合物的变化,在不脱离本发明的范围和精神的前提下对本领域内的技术人员来说是显而易见的。虽然已结合本发明的多种具体优选实施例对本发明进行了具体的描述,但应当理解,本发明不应仅限于这些具体实施例。事实上,各种如上所述的对本领域内的技术人员来说显而易见的修改来获取发明都应包括在本发明的范围内。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1