一种人甲状旁腺激素PTH(1-34)融合蛋白及其应用的制作方法
本发明涉及医药生物工程
技术领域:
,具体涉及一种人甲状旁腺激素PTH(1-34)融合蛋白及其在制备药物组合物中的应用。
背景技术:
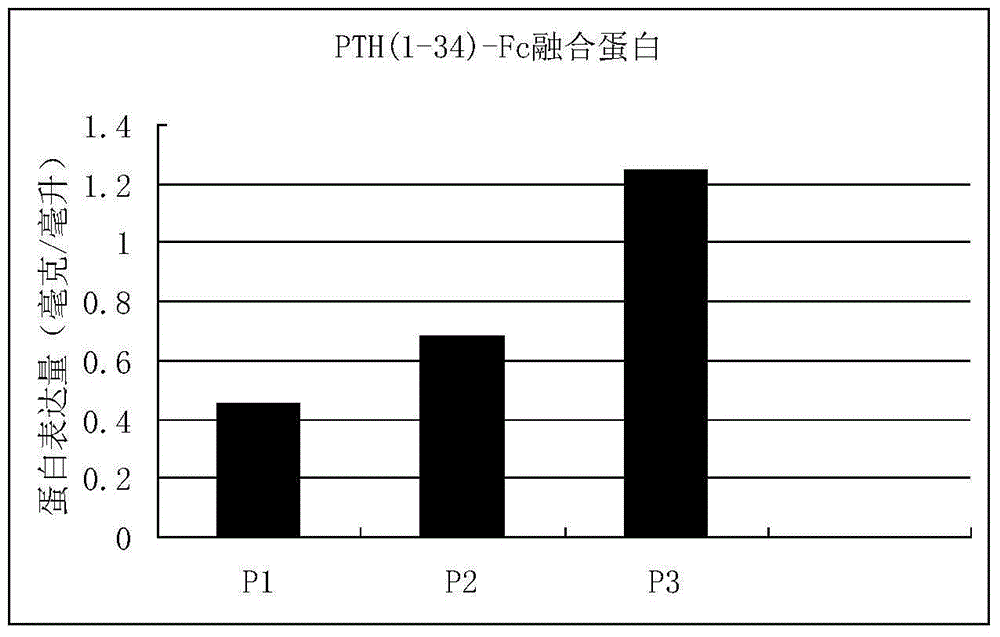
:骨质疏松症是一种以低骨量和骨组织退化为特征的最常见的代谢性骨病。市场上多数治疗骨质疏松症的药物,如雌激素、双磷酸盐类和降血钙素均属骨吸收抑制剂。而其他一些药物,如氟化物、甲状旁腺激素(PTH)则属于骨形成促进剂。PTH(1-34)(teriparatide)的商品名为Forteo,由礼来公司研制开发,2002年12月在美国首次上市,随后相继在奥地利、丹麦、芬兰、德国、希腊、冰岛、爱尔兰、荷兰、挪威、葡萄牙、瑞士、英国、澳大利亚等国上市。该品于2011年进口到我国市场,适用于患骨质疏松症、有高度骨折危险的绝经期妇女,亦适用于有高度骨折危险的原发性或性腺功能减退性骨质疏松症男性患者,包括有骨质疏松性骨折史、有骨折多种危险因素或经评价对先前疗法无效或不耐受的骨质疏松症患者。该品原研产品为重组人甲状旁腺激素(rhPTH)1-34,与内源性PTH类似,可与特异性高亲和性细胞表面受体结合发挥生物学作用。动物实验表明,该品以1次/天给药对成骨细胞的刺激作用高于其对破骨细胞的作用,可引起小梁骨和皮质骨表面的新骨生成。此外,可改善小梁骨微结构,并通过刺激松质骨和皮质骨中的新骨生成,增加骨量,提高骨强度。临床研究提示,该品的促合成效应表现为增加骨量、骨形成和再吸收,从而提高骨强度。与安慰剂组病例相比,使用PTH(1-34)治疗1~2年可使脊骨骨折危险性下降65%,非外伤性非脊骨骨折危险性下降53%。现有的PTH(1-34)药物不具有缓释性,每天静脉或皮下注射一次,病人治疗时痛苦较大,依从性较低。PTH(1-34)的消除半衰期约为1小 时,安全性及患者对PTH(1-34)的耐受性良好,这使得开发长效作用的衍生物以减少每天一次注射带来的不便成为可能。为了解决以上问题,科研人员对PTH(1-34)剂型进行研究,开发出了PTH(1-34)缓释微球制剂(例如CN103157096A),但是,药物在缓释微球中包埋的工艺难度较大,特别是在大规模生产中,这个问题更加难以解决。技术实现要素:本发明针对现有技术中存在的上述缺陷,一方面提供了一种PTH(1-34)-Fc融合蛋白,该融合蛋白中的PTH(1-34)部分来自人甲状旁腺激素(rhPTH)1-34和柄区的部分序列,免疫球蛋白Fc部分包括其铰链区、CH2区和CH3区,PTH(1-34)序列和Fc序列之间直接融合或经连接序列而融合。在本发明优选的实施方案中,免疫球蛋白Fc片段选自人或动物的免疫球蛋白Fc,为Fc全长或部分序列。在本发明进一步优选的实施方案中,Fc选自IgG,包括其各种亚型,例如IgG1,IgG2,IgG3,IgG4,特别优选IgG1。在本发明特别优选的实施方案中,本发明的融合蛋白由人甲状旁腺激素(rhPTH)1-34的第1至34氨基酸序列与免疫球蛋白IgG1Fc融合而成,该融合蛋白的序列如序列1所示。本发明另一方面提供了一种特异性扩增上述特别优选的融合蛋白的引物,其具有序列7和序列8所示的核苷酸序列。在本发明另一特别优选的实施方案中,本发明的融合蛋白由人甲状旁腺激素(rhPTH)1-34的第1至42氨基酸序列与免疫球蛋白IgG1Fc融合而成,其序列如序列2所示。本发明另一方面提供了一种特异性扩增上述特别优选的融合蛋白的引物,其具有序列9和序列10所示的核苷酸序列。在本发明最优选的实施方案中,本发明的融合蛋白由人甲状旁腺激素(rhPTH)1-34的第1至34氨基酸序列,连接序列6G1y,免疫球蛋白IgG1Fc融合而成,其序列如序列3所示。本发明另一方面提供了一种特异性扩增上述最优选的融合蛋白的引物,其具有序列11和序列12所示的核苷酸序列。本发明再一方面还提供了编码本发明所述融合蛋白的DNA分子。在本 发明优选的实施方案中,该DNA分子具有序列4-6所示的核苷酸序列。本发明再一方面还提供了含有上述DNA分子的重组表达载体,其中优选质粒pET-32a。本发明再一方面还提供了含有上述重组表达载体的宿主细胞,其可以选自哺乳动物细胞、细菌、酵母和昆虫细胞,优选CHO细胞。本发明再一方面还提供了包含本发明所述融合蛋白的药物组合物,其包含药物可接受载体,该药物组合物优选为注射剂,包括水剂和冷冻干燥注射剂。本发明再一方面还提供了一种生产PTH(1-34)-Fc融合蛋白的方法,包括如下步骤:1、用上述重组表达载体转化宿主细胞,获得重组菌株;2、培养上述重组菌株,诱导所述融合蛋白的表达;3、回收并纯化所表达的融合蛋白。本发明再一方面还提供了另外一种生产PTH(1-34)-Fc融合蛋白的方法,包括如下步骤:1、在适合表达融合蛋白的条件下,培养上述的宿主细胞,诱导所述融合蛋白的表达;2、回收并纯化所表达的融合蛋白。本发明再一方面还提供了本发明所述的融合蛋白、本发明所述的引物、本发明所述的DNA分子、本发明所述的重组表达载体以及本发明所述的宿主细胞在制备药物组合物中的应用。本发明最后还提供了一种生产药物组合物的方法,包括如下步骤:1、采用本发明所述的方法生产PTH(1-34)-Fc融合蛋白;2、将上述融合蛋白与药物可接受载体混合;3、按照制剂技术制备成所需要的剂型。由上述描述可知,与现有技术相比,本发明将人IgG衍生的Fc区域连接于PTH(1-34)的C末端,从而有效延长了PTH(1-34)的循环半衰期和/或增加了其生物活性。因此,本发明的融合蛋白有效克服了现有PTH(1-34)降解的问题,具备长效生物学活性,其蛋白表达量高,可用于工业化大规模生产。附图说明图1为本发明三种PTH(1-34)-Fc融合蛋白结构示意图。图2为本发明三种PTH(1-34)-Fc融合蛋白在CHO细胞中蛋白表达量的比较图。图3为纯化的P1、P2、P3融合蛋白聚丙烯酰胺凝胶电泳分析图。具体实施方式下面通过实施例对本发明作进一步的详细说明,旨在用于说明本发明而非限定本发明。应当指出,对于本领域技术人员而言,在不脱离本发明原理的前提下,还可以对本发明进行若干改进和修饰,这些改进和修饰也同样落入本发明的保护范围之内。本发明所使用的英文缩写的含义列于表1中。表1本发明使用的引文缩写的中文含义表英文缩写中文含义PTH甲状旁腺激素DNA脱氧核糖核酸PCR聚合酶链式反应IgG免疫球蛋白G实施例1:融合蛋白及其质粒的构建首先委托RNA合成公司合成RNA,然后用逆转录酶从RNA合成cDNA。再用不同的引物利用聚合酶链式反应(PCR)扩增获得所需要的PTH(1-34)片段。免疫球蛋白的Fc片段从已克隆的IgGlFc质粒经PCR扩增获得。最后用PCR将PTH(1-34)片段断和Fc序列相融合,从而构建成PTH(1-34)-Fc融合蛋白的DNA序列。聚合酶链式反应包括:变性95℃,30秒;退火56℃,45秒;延伸72℃,2分钟,30个循环。用TAcloning试剂盒,把PTH(1-34)和Fc的PCR产物分别克隆入pET-32a质粒,转染,E.coliBL21(DE3),选取白色菌落,加入LB培养基,培养过夜。再用Qiangen质粒提取试剂盒提取质粒,经酶切和测序鉴定PTH(1-34)和Fc序列。最后,采用拼接PCR方法把PTH (1-34)和IgGFc的cDNA连接在一起。将PTH(1-34)-Fc片段插入表达质粒中。将重组质粒转染E.coli,选取阳性菌落,提取质粒后经酶切和测序鉴定目的序列。将质粒转染CHO细胞以获得融合蛋白的表达。P1蛋白:PTH(1-34)1-34氨基酸+Fc。其氨基酸和DNA序列见序列表序列1和4。P2蛋白:PTH(1-34)1-42氨基酸+Fc。见序列表序列2和5。P3蛋白:PTH(1-34)1-34氨基酸+连接序列6Gly+Fc。见序列表序列3和6。AVSEIQFMHNLGKHLSSMERVEWLRKKLQDVHNFP1融合蛋白引物序列:正向引物:AGCCGTGTGGACC反向引物:GAGCTTGTTCP2融合蛋白引物序列:正向引物:AGCCGTGTGGA反向引物:GAGCTCTGGTP3融合蛋白引物序列:正向引物:AGCCGTGTGG反向引物:ACCTCCACCTCCA实施例2:PTH(1-34)-Fc融合蛋白在细胞中的表达本实施例以哺乳动物细胞为例提供了表达PTH(1-34)-Fc融合蛋白的实例。将P1,P2,P3三种融合蛋白克隆到pET-32a质粒(Invitrogen)中。融合蛋白的5’末端添加人F1t-1信号肽序列。用质粒DNA提纯试剂盒(MoBio公司)提取上述三种PTH(1-34)-Fc高纯度质粒DNA。然后利用FUGEN6转染试剂盒(ROCHE公司)将质粒DNA分别导入CHO细胞中。我们用瞬时转染(Transienttransfection)的方法,对这四种PTH(1-34)-Fc融合蛋白的表达水平进行了比较。用含10%胎牛血清的DMEM完全培养基将CHO细胞在细胞培养皿内培养。当细胞生长至一定时,将质粒DNA与FUGEN6试剂(Roche)的复合物加入到细胞培养液中,培养三天后收集上清液。这些细胞上清液中含有表达的融合蛋白。融合蛋白的浓度用ELISA法定量确定。蛋白的浓度结果参见说明书附图2,其中融合蛋白的 表达量以P3最高,P2其次,P1最低。因此,从蛋白的表达量来说,P3融合蛋白是最佳的分子组合。实施例3:高效表达细胞系的建立在确定P3融合蛋白是最佳的分子组合后,采用稳定转染和基因扩增的方法建立了CHO稳定高效表达细胞株。将含有P3融合蛋白的基因克隆到含DHFR基因的质粒中。用MoBio公司的DNA提纯试剂盒提取高纯度质粒DNA,再采用电钻孔法转染CHO细胞。转染后的细胞在选择培养中进行克隆培养,获得抗性克隆。用氨甲碟呤(MTX)加压进行基因扩增,得到高效表达的细胞株。最后将细胞扩大培养,在生物反应器中大规模生产该融合蛋白。融合蛋白的浓度用ELISA法定量确定。用该方法,成功地大规模生产了P3融合蛋白。产量可达100mg/L。实施例4:PTH(1-34)-Fc融合蛋白的纯化用1NNaOH将含有融合蛋白的条件培养基滴定到pH7-8,然后用0.45微米硝酸纤维滤膜过滤。将滤液加到磷酸盐缓冲盐(PBS)平衡的ProsepA柱上。待融合蛋白结合于ProsepA后,弃去流出的部分。用PBS洗涤该柱,直到280nm处的OD值低于0.01。然后用0.1MpH为3.75的柠檬酸缓冲液洗脱结合的融合蛋白。用0.4体积的1MK2HPO4中和,合并含有目标产物的组分,并用PBS透析。然后用0.22微米硝酸纤维滤膜过滤,并储存在4℃。实施例5:融合蛋白的电泳鉴定本实施例采用实验证明优化的融合蛋白在表达过程中不发生降解。将P1、P2、P3融合蛋白高效表达细胞株在培养瓶中培养,等细胞生长至高密度后,收集细胞培养液上清,用A蛋白亲和层析提纯融合蛋白。将纯化的融合蛋白与聚丙烯酰胺凝胶样品缓冲液混合,置于沸水浴中3分钟。将蛋白在聚丙烯酰胺凝胶加样后电泳。电泳后的凝胶用考马斯亮蓝染色,甲醇脱色后观察蛋白条带。实验结果显示P1、P2、P3蛋白呈单一条带,参见说明书附图3,电泳结果显示,从CHO高效表达细胞系生产的P1、P2、P3融合蛋白呈单一条带,其分子量约为420kD,与预期的融合蛋白的分子量相吻合。重要的是,没有观测到分子量小于420kD的蛋白条带。这一结果 说明本发明的融合蛋白序列有效地防止了蛋白在表达过程中被切割和降解,可以用于工业化大规模生产。实施例6:PTH(1-34)-GlyGlyGlyGlyGlyGly-Fc融合蛋白在体外成骨细胞和破骨细胞共培养体系中的活性检测/破骨细胞形成实验(TRACP染色法)首先,在无菌条件下,去除3-6周小鼠股骨,并冲洗骨髓腔,离心收集洗下的骨髓细胞。培养基重悬骨髓细胞,用直径为10cm的培养皿在37℃,5%二氧化碳条件下培养2d。收集培养皿中的骨髓细胞培养液上清,合并上清液并离心收集细胞。用一定体积的培养基对细胞进行重悬,血球计数板进行细胞计数。之后按16*104/孔铺板,用培养基补至培养基体积为1mL,加药后于37℃,5%二氧化碳条件下培养。实验设对照组、PTH(1-34)阳性组、IgG组、融合蛋白P3组。每组设3个平行复孔。给药浓度为10-7mol/L。分别在给药后第1、3、5、7天对贴壁细胞进行TRACP(耐酒石酸酸性磷酸酶)染色(TRACP/ALP染色试剂盒购自Takara),具体步骤如下:往待测24孔板的孔中添加250μLFixationsolution固定细胞,室温放置5min。每孔添加2mL无菌水清洗一次,移去液体。配制好含10%酒石酸的ACP(酸性磷酸酶)底物溶液,每孔添加250μL,盖上盖板于37℃孵育15-45min。移去上清液,用无菌水洗涤3次以终止显色。显微镜下计算每孔中被染成紫红色的细胞数(参见表2)。表2小鼠股骨骨髓培养体系的TRACP染色统计表(贴壁细胞计数/个)从实验结果可以看到,本发明所优化构建的融合蛋白P3克服了PTH (1-34)降解的问题,具备长效生物学活性,其蛋白表达量高,可以用于工业化大规模生产。实施例7:PTH(1-34)-Fc融合蛋白在体外成骨细胞和破骨细胞共培养体系中的活性检测/破骨细胞形成实验(TRACP染色法)首先,在无菌条件下,去除3-6周小鼠股骨,并冲洗骨髓腔,离心收集洗下的骨髓细胞。培养基重悬骨髓细胞,用直径为10cm的培养皿在37℃,5%二氧化碳条件下培养2d。收集培养皿中的骨髓细胞培养液上清,合并上清液并离心收集细胞。用一定体积的培养基对细胞进行重悬,血球计数板进行细胞计数。之后按16*104/孔铺板,用培养基补至培养基体积为1mL,加药后于37℃,5%二氧化碳条件下培养。实验设对照组、PTH(1-34)阳性组、IgG组、融合蛋白P1组。每组设3个平行复孔。给药浓度为10-7mol/L。分别在给药后第1、3、5、7天对贴壁细胞进行TRACP(耐酒石酸酸性磷酸酶)染色(TRACP/ALP染色试剂盒购自Takara),具体步骤如下:往待测24孔板的孔中添加250μLFixationsolution固定细胞,室温放置5min。每孔添加2mL无菌水清洗一次,移去液体。配制好含10%酒石酸的ACP(酸性磷酸酶)底物溶液,每孔添加250μL,盖上盖板于37℃孵育15-45min。移去上清液,用无菌水洗涤3次以终止显色。显微镜下计算每孔中被染成紫红色的细胞数(参见表3)。表3小鼠股骨骨髓培养体系的TRACP染色统计表(贴壁细胞计数/个)从实验结果可以看到,本发明所优化构建的融合蛋白P1克服了PTH(1-34)降解的问题,具备长效生物学活性,其蛋白表达量高,可以用于 工业化大规模生产。实施例8:PTH(1-42)-Fc融合蛋白在体外成骨细胞和破骨细胞共培养体系中的活性检测/破骨细胞形成实验(TRACP染色法)首先,在无菌条件下,去除3-6周小鼠股骨,并冲洗骨髓腔,离心收集洗下的骨髓细胞。培养基重悬骨髓细胞,用直径为10cm的培养皿在37℃,5%二氧化碳条件下培养2d。收集培养皿中的骨髓细胞培养液上清,合并上清液并离心收集细胞。用一定体积的培养基对细胞进行重悬,血球计数板进行细胞计数。之后按16*104/孔铺板,用培养基补至培养基体积为1mL,加药后于37℃,5%二氧化碳条件下培养。实验设对照组、PTH(1-34)阳性组、IgG组、融合蛋白P2组。每组设3个平行复孔。给药浓度为10-7mol/L。分别在给药后第1、3、5、7天对贴壁细胞进行TRACP(耐酒石酸酸性磷酸酶)染色(TRACP/ALP染色试剂盒购自Takara),具体步骤如下:往待测24孔板的孔中添加250μLFixationsolution固定细胞,室温放置5min。每孔添加2mL无菌水清洗一次,移去液体。配制好含10%酒石酸的ACP(酸性磷酸酶)底物溶液,每孔添加250μL,盖上盖板于37℃孵育15-45min。移去上清液,用无菌水洗涤3次以终止显色。显微镜下计算每孔中被染成紫红色的细胞数(参见表4)。表4小鼠股骨骨髓培养体系的TRACP染色统计表(贴壁细胞计数/个)从实验结果可以看到,本发明所优化构建的融合蛋白P2克服了PTH(1-34)降解的问题,具备长效生物学活性,其蛋白表达量高,可以用于工业化大规模生产。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1