睫状神经营养因子突变体及其修饰型突变体和应用的制作方法
本发明属于生物医药领域,具体而言,涉及一种修饰型睫状神经营养因子突变体、DNA、重组表达载体、遗传工程宿主细胞、修饰型睫状神经营养因子突变体、所述睫状神经营养因子突变体以及修饰型睫状神经营养因子突变体的应用、药物组合物。
背景技术:
睫状神经营养因子(Ciliary neurotrophic factor,简称CNTF)因为最初是从鸡的睫状体中提取出来,并可维持鸡副交感神经节的存活而得名。CNTF全长由200个氨基酸组成,第17位有Cys,无分子内二硫键,无糖基化位点。CNTF全长分子量在23KD左右。在体内以两个二聚体形式进行储存,经过酶解成单体后发生生物学作用。CNTF可以促进包括:运动神经元、感觉神经元、交感神经元、海马神经元等多种神经细胞和神经胶质细胞的生长和分化。90年代,在将CNTF用于治疗肌肉萎缩性脊髓侧索硬化症(ALS)的实验研究中发现,对一组ALS患者进行临床研究发现病人的体重大大降低,使用药物组体重比安慰剂组明显降低。而且这一结果持续整个研究过程。针对这一结果在肥胖症领域进行实验,结果表明CNTF在体内可与下丘脑的特异性受体结合,激活抑制食欲的关键信号通路,抑制进食欲望且使机体不会产生饥饿感,从而使体重减轻。研究发现,CNTF具有多种功能,能促使多种神经细胞的存活、营养肌肉、促进糖、脂代谢和调节能量平衡以及摄食行为。在神经系统,肌肉系统,肥胖症极其相关疾病的治疗中具有重要意义和广阔的临床前景。
CNTF是本领域技术人员所熟知的,通常使用CNTF突变体解决CNTF的生物活性不高以及表达量低的问题。因此,目前现有技术中已开发出了多种CNTF的突变体(或称变异体),多种重组人睫状神 经营养因子是市售的。CNTF突变体或变异体的制备方法在现有技术中也是已知的,例如中国专利CN1687413A公开了一种CNTF突变体(hCNTF),第17位的半胱氨酸突变为丙氨酸;第63位的谷氨酰胺突变为精氨酸;第64位的组氨酸突变为丙氨酸;并去除了C末端1-30个氨基酸。CN1760205A公开了一种CNTF突变体(hCNTF),第17位半胱氨酸突变为丝氨酸,并去除了C端的16个氨基酸;而且第53位的丙氨酸突变为缬氨酸,第35位的苏氨酸突变为蛋氨酸,第178位的苯丙氨酸突变为缬氨酸。CN1844392也公开了睫状神经营养因子的突变体。
但上述CNTF的突变体或变异体仍存在体内的作用时间短,要求反复多次给药;免疫原性强副反应严重,给病人带来巨大的经济压力和精神压力的缺点。因此,目前选择使用PEG修饰后的蛋白,其有以下优势:分子量增大、半衰期延长、免疫原性降低。PEG拥有独特的亲-疏水平衡:当偶联到药物分子表面时,将其优良性质赋予修饰后的药物,改变它们在水溶液中的生物分配行为和溶解性,在其修饰的药物周围产生空间屏障,减少药物的酶解。覆盖蛋白表面的抗原决定簇,降低蛋白的免疫原性。这样,可以增加蛋白的分子量和体积,减少肾小球的滤过作用,使蛋白在体内作用时间更长。聚乙二醇(PEG)于1940年首次商业生产化。PEG的使用通过了美国FDA认证,符合美国药典(USP)、国家处方集(NF)、食品化学法典(FCC)标准,被广泛应用于食品、饲料、个人护理品、化学、医药化工等生产生活领域。
利用PEG类修饰剂修饰CNTF或CNTF突变体的最大的问题在于,修饰位点不稳定,如在20种构成CNTF的常见氨基酸中,具有极性的氨基酸残基的侧链基团都能够进行化学修饰,包括赖氨酸、半胱氨酸、组氨酸、精氨酸、天冬氨酸、谷氨酸、丝氨酸、苏氨酸、酪氨酸等;而且以上几种极性氨基酸的N-端氨基和C-端羧基也可以进行修饰,这样会使得很难获得稳定的修饰位点和修饰方式,导致修饰的专一性降低与修饰的稳定性下降。而且修饰位点往往处于蛋白质的活性中心部位,因此修饰后蛋白活性损失较大。
另外,根据2015版药典的质量要求,治疗性蛋白的PEG修饰需是专一位点的修饰。然而,无论是天然的全长CNTF还是上述专利申请开发的CNTF突变体,均无法提供唯一的修饰位点。
技术实现要素:
为解决上述现有技术中存在的问题,本发明提供了一种修饰型睫状神经营养因子突变体、DNA、重组表达载体、遗传工程宿主细胞、修饰型睫状神经营养因子突变体、所述睫状神经营养因子突变体以及修饰型睫状神经营养因子突变体的应用、药物组合物。
具体而言,本发明提供了:
(1)一种睫状神经营养因子突变体,其中,所述睫状神经营养因子突变体是在天然睫状神经营养因子的氨基酸序列的基础上发生突变得到的,所述突变包括:第40位的赖氨酸突变为半胱氨酸,以及第17位的半胱氨酸突变为丙氨酸。
(2)根据(1)所述的睫状神经营养因子突变体,其中,所述突变还包括:第63位谷氨酰胺突变为精氨酸、以及去除天然睫状神经营养因子C末端的15个氨基酸。
(3)根据(1)所述的睫状神经营养因子突变体,其中,所述的睫状神经营养因子突变体具有SEQ ID NO:4所示的氨基酸序列。
(4)一种DNA,其中,所述DNA的核苷酸序列为编码根据(1)至(3)中任一项所述的睫状神经营养因子突变体的核苷酸序列。
(5)根据(4)所述的DNA,其中,所述DNA的核苷酸序列为SEQ ID NO:3所示的核苷酸序列。
(6)一种重组表达载体,其中,所述重组表达载体含有(4)或(5)所述的核苷酸序列。
(7)根据(6)所述的重组表达载体,其中,所述重组表达载体为PET24a+/CNTFnew/CC40表达载体。
(8)一种遗传工程宿主细胞,其中,所述宿主细胞含有(6)或(7)所述的重组表达载体。
(9)根据(8)所述的遗传工程宿主细胞,其中,所述宿主细 胞为CNTFnew/CC40工程菌。
(10)一种修饰型睫状神经营养因子突变体,其中,所述的修饰型睫状神经营养因子是通过对根据(1)至(3)中任一项所述的睫状神经营养因子突变体的第40位半胱氨酸进行定点修饰而得到的,所述定点修饰是通过在所述的第40位半胱氨酸上结合化学修饰剂而实现的。
(11)根据(10)所述的修饰型睫状神经营养因子突变体,其中,所述化学修饰剂为聚乙二醇或聚乙二醇类聚合物。
(12)根据(10)所述的修饰型睫状神经营养因子突变体,其中,所述的化学修饰剂选自:聚乙二醇、甲氧基聚乙二醇、甲氧基聚乙二醇-琥珀酰亚胺琥珀酸酯、甲氧基聚乙二醇-琥珀酰亚胺碳酸酯、甲氧基聚乙二醇三氟乙基磺酸酯、甲氧基聚乙二醇-丙醛、甲氧基聚乙二醇-琥珀酰亚胺丙酸酯、甲氧基聚乙二醇-琥珀酰亚胺α甲基丁酸酯、甲氧基聚乙二醇-N-羟基琥珀酰亚胺、甲氧基聚乙二醇-马来酰亚胺或甲氧基聚乙二醇-乙醛。
(13)根据(10)所述的修饰型睫状神经营养因子突变体,其中,所述化学修饰剂为甲氧基聚乙二醇-马来酰亚胺。
(14)根据(1)至(3)中任一项所述的睫状神经营养因子突变体在制备用于治疗和/或预防肥胖症或与肥胖症相关的疾病的药物中的应用。
(15)根据(10)至(13)中任意一项所述的修饰型睫状神经营养因子突变体在制备用于治疗和/或预防肥胖症或与肥胖症相关的疾病的药物中的应用。
(16)一种用于治疗和/或预防肥胖症及肥胖相关疾病的药物组合物,其中,所述的药物组合物包含根据(1)至(3)中任一项所述的睫状神经营养因子突变体和/或根据(10)至(13)中任意一项所述的修饰型睫状神经营养因子突变体。
本发明与现有技术相比具有以下优点和积极效果:
1.本发明惊奇地发现将CNTF第40位赖氨酸突变为半胱氨酸, 并将化学修饰剂定点修饰在该第40位半胱氨酸上,同时将第17位的半胱氨酸突变为丙氨酸,可以在保持蛋白质原有结构和生物学活性的同时,获得修饰专一性高的修饰型睫状神经营养因子,从而克服随机修饰带来的如修饰结果不稳定等一系列问题。
2.本发明的重组基因工程CNTF与原始CNTF蛋白序列与结构最为接近,使重组CNTF突变体蛋白稳定性、可溶性和生物学活性高于天然蛋白。
3.本发明获得的CNTF突变体结构稳定,与天然蛋白相比具有更高的生物学活性和可溶性,并且修饰型CNTF与未修饰型CNTF相比具有长效作用,从而能达到治疗或预防肥胖症及其相关疾病的显著效果。
附图说明
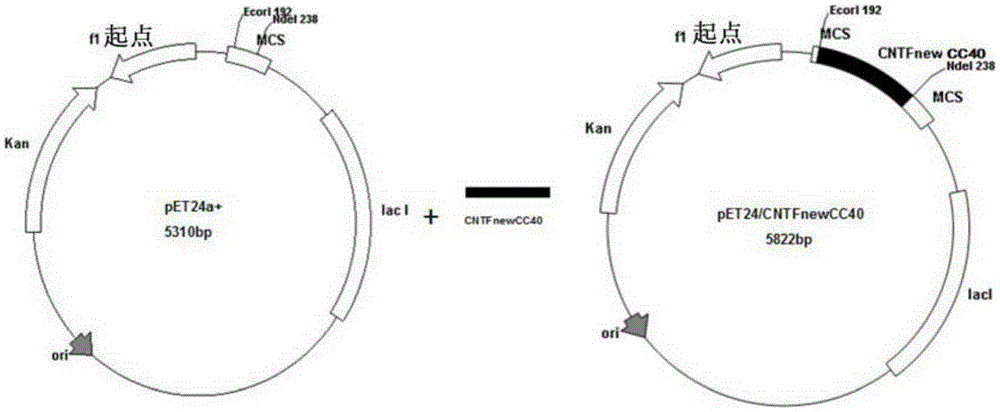
图1为CNTF突变体表达载体PET24a+/CNTFnew/CC40的构建图。
图2为CNTF突变体CNTFnew/CC40的编码序列PCR鉴定图;其中,M:marker;1:阴性对照;2-8:随机挑选的7个CNTFnew/CC40工程菌的菌落。
图3为NedI和EcorI双酶切鉴定的结果图;其中,M:marker;1-7:随机挑选的7个CNTFnew/CC40工程菌菌落,泳道8为阴性对照。
图4为CNTF突变体CNTFnew/CC40的全基因序列测定结果图。
图5为目的蛋白CNTFnew/CC40的表达结果图;其中,M:marker;1:阴性对照;2-8:随机挑选的7个CNTFnew/CC40工程菌菌落。
图6为CNTFnew/CC40蛋白SDS-PAGE电泳图;其中泳道M为Marker,泳道2为CNTFnew/CC40蛋白。
图7为CNTFnew/CC40蛋白的N端15个氨基酸序列的序列比对图。
图8为CNTFnew/CC40蛋白免疫印迹电泳图;其中泳道M为Marker,泳道2为CNTFnew/CC40。
图9为CNTFnew/CC40蛋白与MAL-mPEG分子结合的示意图。
图10为用支链MAL-mPEG修饰CNTFnew/CC40的结果的电泳图;其中泳道M为Marker,泳道2为修饰前的CNTFnew/CC40蛋白,泳道3为修饰反应混合液。
图11为纯化后的支链MAL-mPEG修饰CNTFnew/CC40蛋白电泳图。其中泳道M为Marker,泳道2为纯化的mPEG-MAL-CNTFnew/CC40
图12为mPEG-MAL-CNTFnew/CC40蛋白免疫印迹电泳图,其中泳道M为Marker,泳道2为mPEG-MAL-CNTFnew/CC40蛋白。
具体实施方式
以下通过具体实施方式的描述并参照附图对本发明作进一步说明,但这并非是对本发明的限制,本领域技术人员根据本发明的基本思想,可以做出各种修改或改进,但是只要不脱离本发明的基本思想,均在本发明的范围之内。
本发明的目的在于提供一种睫状神经营养因子突变体与一种修饰型睫状神经营养因子,以在提高睫状神经营养因子的治疗效果的前提下,获得的修饰后性状均一的修饰型的睫状神经营养因子。
通过对CNTF氨基酸序列(SEQ ID NO:2)进行系统的理论分析和设计并且进行大量的试验,本发明的发明人惊奇地发现在使用PEG或PEG类聚合物对CNTF或CNTF突变体进行修饰时,将CNTF第40位赖氨酸突变为半胱氨酸,并将化学修饰剂定点修饰在该第40位半胱氨酸上,同时将第17位的半胱氨酸突变为丙氨酸,可以在保持蛋白质原有结构和生物学活性的同时,获得修饰专一性高的修饰型睫状神经营养因子,从而克服随机修饰带来的如修饰结果不稳定等一系列问题。
基于以上发现,本发明一个方面提供了一种睫状神经营养因子突变体,其中,所述睫状神经营养因子突变体是在天然睫状神经营养因子的氨基酸序列的基础上发生突变得到的,所述突变包括:第40位的赖氨酸突变为半胱氨酸,以及第17位的半胱氨酸突变为丙氨酸。
本发明人通过实验进一步发现,在上述重组基因工程CNTF的基础上,使用常规突变CNTF的方法,例如将第63位谷氨酰胺突变成精氨酸、去除C末端的15个氨基酸等,也不会影响CNTF突变体在化学修饰中的稳定性,可以形成修饰均一的修饰型CNTF突变体,并获得与天然蛋白相比更高的生物学活性和长效作用,从而能达到治疗或预防肥胖症及其相关疾病的显著效果。
因此,在本发明的睫状神经营养因子突变体中,所述突变还可以包括:第63位谷氨酰胺突变为精氨酸、以及去除天然睫状神经营养因子C末端的15个氨基酸。
优选地,所述的睫状神经营养因子突变体具有SEQ ID NO:4所示的氨基酸序列。
本发明所述的CNTF突变体与原始CNTF蛋白序列和结构最为接近,使CNTF突变体蛋白稳定性、可溶性和生物学活性高于天然蛋白。
可以使用本领域已知的常规方法获得CNTF突变体。这些方法在(例如)专利申请CN1687413A中有所介绍。也可以采用全基因序列合成的方法获得本发明的CNTF突变体。
本发明第二方面提供了一种DNA,其中,所述DNA的核苷酸序列为编码本发明所述的睫状神经营养因子突变体的核苷酸序列。
优选的是,所述DNA的核苷酸序列为SEQ ID NO:3所示的核苷酸序列。
本发明第三方面提供了一种重组表达载体,其中,所述重组表达载体含有本发明所述DNA的核苷酸序列。
优选的是,所述重组表达载体为如图1所示的PET24a+/CNTFnew/CC40表达载体。
本发明第四方面提供了一种遗传工程宿主细胞,其中,所述宿主细胞含有本发明所述的重组表达载体。
优选的是,所述宿主细胞为CNTFnew/CC40工程菌。
本发明第五方面提供了一种修饰型睫状神经营养因子突变体,其中,所述的修饰型睫状神经营养因子是通过对本发明所述的睫状神经营养因子突变体的第40位半胱氨酸进行定点修饰而得到的,所述定 点修饰是通过在所述的第40位半胱氨酸上结合化学修饰剂而实现的。
定点修饰的方法可采用本领域已知的方法,例如张霖琳等,聚乙二醇单修饰重组人粒细胞集落刺激因子的研究,生物工程学报,2005,21(6)中公开的方法,其在4℃条件下将待修饰蛋白置于不同pH值的缓冲液中,以保证其生物学活性。Lowry法测定蛋白浓度,将蛋白稀释到实验所需的各个浓度,按摩尔配比(修饰剂:蛋白质)加入修饰剂,混合均匀,按正交试验设计的温度进行反应,反应时间为2-16小时。
所述的化学修饰剂可以使用在蛋白质工程领域中常用的化学修饰剂(包括高分子、聚合物修饰剂等),只要能够与半胱氨酸的巯基相结合,获得均一的修饰后产物即可。在本文中,“均一”是指没有同分异构体,纯度在95%以上。
优选的是,所述化学修饰剂为聚乙二醇(PEG)或聚乙二醇类聚合物。
在本文中,所述的“聚乙二醇类聚合物”指的是聚乙二醇衍生物,在聚乙二醇的应用中,端基起着决定性的作用,不同端基的聚乙二醇具有不同的用途。在实际应用中,聚乙二醇高分子链端不仅仅局限于链端羟基,其它反应性更强的功能化基团,如对甲苯磺酸酯基、氨基、羧基、醛基等亦可被引入到聚乙二醇链的两端。这些功能化基团的引入扩大了聚乙二醇的应用范围,使它在有机合成、多肽合成、高分子合成及药物的缓释控释、靶向施药等多方面均具有广阔的应用前景。
更优选的是,本发明的用于修饰的聚乙二醇或聚乙二醇类聚合物的分子量为20kD~40kD。
优选的是,所述的化学修饰剂选自:聚乙二醇、甲氧基聚乙二醇、甲氧基聚乙二醇-琥珀酰亚胺琥珀酸酯、甲氧基聚乙二醇-琥珀酰亚胺碳酸酯、甲氧基聚乙二醇三氟乙基磺酸酯、甲氧基聚乙二醇-丙醛、甲氧基聚乙二醇-琥珀酰亚胺丙酸酯、甲氧基聚乙二醇-琥珀酰亚胺α甲基丁酸酯、甲氧基聚乙二醇-N-羟基琥珀酰亚胺、甲氧基聚乙二醇-马来酰亚胺或甲氧基聚乙二醇-乙醛。
更优选地,所述化学修饰剂为甲氧基聚乙二醇-马来酰亚胺。
本发明第六方面提供了所述的睫状神经营养因子突变体在制备用于治疗和/或预防肥胖症或与肥胖症相关的疾病(如Ⅱ型糖尿病和脂肪肝)的药物中的应用。
本发明第七方面提供了所述的修饰型睫状神经营养因子突变体在制备用于治疗和/或预防肥胖症或与肥胖症相关的疾病(如Ⅱ型糖尿病和脂肪肝)的药物中的应用。
本发明第八方面提供了一种用于治疗和/或预防肥胖症及肥胖相关疾病的药物组合物,其中,所述的药物组合物包含本发明所述的睫状神经营养因子突变体和/或本发明所述的修饰型睫状神经营养因子突变体。
所述肥胖相关疾病包括II型糖尿病和脂肪肝。
优选的是,所述的药物组合物还包含药用辅料。用于本发明的药用辅料可以为本领域常规使用的那些。
以下通过实施例的方式进一步解释或说明本发明内容,但这些实施例不应被理解为对本发明保护范围的限制。
实施例1.CNTF突变体的全基因序列合成
根据天然睫状神经营养因子(CNTF)DNA序列(SEQ ID NO:1)与天然睫状神经营养因子(CNTF)氨基酸序列(SEQ ID NO:2),全基因序列合成重组睫状神经营养因子(CNTF突变体)的DNA序列SEQ ID NO:3(由上海捷瑞生物科技有限公司完成),其编码的氨基酸序列为SEQ ID NO:4。
其中,CNTF突变体为将天然睫状神经营养因子的第40位的赖氨酸突变为半胱氨酸、第17位半胱氨酸突变成丙氨酸、第63位谷氨酰胺突变成精氨酸,并且去除C末端的15个氨基酸而形成的CNTF突变体——CNTFnew/CC40突变体。
实施例2.CNTF突变体CNTFnew/CC40表达载体的构建与工程菌的鉴定
(1)CNTF突变体CNTFnew/CC40表达载体的构建
全基因序列合成后,取合成片段5μL,加入限制性内切酶NedI1μL和EcorI 1μL(限制性内切酶购于TAKARA公司)。加入限制性内切酶缓冲液2μL,加双蒸水11μL,成为20μL体系。37℃水浴,酶切1小时。同时,取pET24a+质粒(购于Novagen公司)5μL,加入相同的限制性内切酶NedI 1μL和EcorI 1μL(限制性内切酶购于TAKARA公司),加双蒸水11μL,成为20μL体系。37℃水浴,酶切1小时,酶切载体pET24a+。
酶切完成后,进行1%的琼脂糖凝胶电泳。切割下带有目的条带的胶,利用琼脂糖凝胶回收试剂盒(购于天根生化科技有限公司)对酶切后的目的片段和载体片段进行回收。
取酶切后的合成目的片段5μL、酶切后的载体pET24a+5μL,加入1μL T4DNA连接酶(购于TAKARA公司),加入10×连接酶缓冲液2μL,加入双蒸水7μL,成为20μL的连接反应体系。16℃连接过夜。连接成表达载体,命名为PET24a+/CNTFnew/CC40,具体的载体构建过程可以参看图1。
(2)将表达载体PET24a+/CNTFnew/CC40转化到感受态细胞BL21(DE3)(购于天根生化科技有限公司)中,制备出CNTFnew/CC40工程菌。
具体步骤:取连接后的表达载体PET24a+/CNTFnew/CC40共2μL,加入到一支感受态细胞BL21(DE3)中,轻敲后放置于冰上30分钟,42℃水浴热激60秒后,迅速至于冰上2分钟。加入不含抗生素的LB液体培养基300μL,至于摇床中,37℃、200转/分钟培养1小时。经过培养后的菌液涂于含50μg/ml卡那霉素的LB固体培养基平板上,于37℃培养箱中过夜培养,得到带有PET24a+/CNTFnew/CC40质粒的单个菌落。
随机挑取单个菌落,接种到5ml LB液体培养基中,37℃、200转/分钟过夜培养。得到工程菌,命名为CNTFnew/CC40工程菌。
(3)经过PCR鉴定、双酶切鉴定、全基因序列测定三种方法确定CNTFnew/CC40工程菌中包含有目的蛋白CNTFnew/CC40的编码序列。
3.1)PCR鉴定过程:取过夜培养的CNTFnew/CC40工程菌的菌液1μL,加入引物1(序列为:ATG GCT TTC ACA GAG CAT TC)1μL、引物2(序列为:GTC ATG GAT GGA CCT TAC TG)1μL、DNA Polymerase(购自Takara公司)1μL、2×PCR缓冲液10μL、双蒸水6μL,成为20μL的PCR反应体系。
放入PCR仪中,温度循环为:第一步:94℃5分钟。第二步:94℃30秒、55℃30秒、72℃1分钟,共30个循环。第三步:72℃10分钟。第四步:4℃恒温后取出。
PCR结束后对样品进行1%的琼脂糖凝胶电泳,观察结果。
PCR鉴定的结果参见图2,其中,M:marker;1:阴性对照;2-8:随机挑选的7个CNTFnew/CC40工程菌菌落的结果。
PCR鉴定结果为:随机挑取的7个工程菌菌落均为阳性菌落。
3.2)双酶切鉴定过程:
取过夜培养的CNTFnew/CC40工程菌的菌液5ml,利用质粒小量提取试剂盒(购于Axeygen公司)提取质粒。提取的质粒取5μL,限制性内切酶NedI和EcorI各1μL,限制性内切酶缓冲液2μL,双蒸水11μL,成为20μL的双酶切体系,于37℃水浴,酶切1小时,之后进行1%的琼脂糖凝胶电泳,观察结果。
双酶切鉴定的结果参见附图3,其中,M:marker;1-7:随机挑选的7个CNTFnew/CC40工程菌菌落的结果,8为阴性对照。
双酶切鉴定结果为:随机挑取的7个工程菌菌落均为阳性菌落。
3.3)CNTFnew/CC40的全基因序列测定由北京诺赛基因组研究中心完成。具体结果见图4。
实施例3.目的蛋白CNTFnew/CC40的表达。
1)制备LB琼脂平板:胰蛋白胨10g、酵母提取物5g、NaCl 5g,琼脂10g、加水定容至1L(pH为7.2±0.1),高温高压灭菌,当温度降到50℃左右时加入卡那霉素,至终浓度为50μg/ml,取20ml倒培养皿,凝固后即成LB琼脂平板。
2)培养CNTFnew/CC40工程菌:将CNTFnew/CC40工程菌划 线接种于LB琼脂平板,37℃培养过夜。从培养基过夜的LB平板上挑选生长状态良好的单个菌落,接种于含LB的试管中,37℃培养10小时。然后转种至含有200ml LB液体培养液(胰蛋白胨10g、酵母提取物5g、NaCl 5g,加水定容至1L(pH为7.2±0.1),高压灭菌,分装三角瓶,每瓶200ml)的三角瓶中,37℃培养过夜制得种子液。将种子液按1%比例接种于含30L 2YT培养液的50L发酵罐中,发酵培养基为2YT(胰蛋白胨480g、酵母提取物300g、NaCl 50g,加入蒸馏水溶解,5N NaOH调节pH至7.2±0.1,定容到30L,0.12Mpa、121℃、30分钟,高压灭菌)。控制发酵温度37℃、转速250-450r/分钟、通气量30-50L/分钟、pH7.2±0.1,培养至A600=1.2左右后,加入异丙基硫代-β-D-半乳糖苷(IPTG)至终浓度为1.0mM进行诱导。继续培养4.5小时,终止发酵,收集菌体,储存于-30℃冰箱中备用。取表达目的蛋白后的菌体,进行SDS-PAGE电泳,观察目的蛋白CNTFnew/CC40的表达结果见图5,其中,M:marker;1:阴性对照;2-8:随机挑选的7个CNTFnew/CC40工程菌菌落的结果。
实施例4.目的蛋白CNTFnew/CC40的复性与纯化。
从-20℃冰箱中取出发酵菌体,按1%比例用0.02mol、pH7.2的磷酸盐溶液重新悬浮菌体,通过高压匀浆破碎菌体,5000r/分钟离心15分钟,收集包涵体沉淀,再经变性〔每克包涵体使用400ml变性液(8M盐酸胍、50mMTris-Hcl、pH8.0)处理4小时〕、复性(通过透析法复性,透析液为50mM Tris-Hcl、pH8.0,透析时间为24小时)、Q-Sepharose HP(购自GE公司)层析步骤进行纯化而获得CNTFnew/CC40。所述层析步骤简述如下:A液50mM Tris-Hcl,pH8.0;B液50mM Tris-Hcl,1M NaCl,pH8.0;层析柱以A液平衡后,样品以1.2mg/ml上样,A液清洗后,用9%B洗脱,用第一个收集目的蛋白峰做SDS-PAGE,并用AlphaDigiDoc凝胶成像分析仪进行照相,并用AlphaDigiDoc凝胶成像分析软件对CNTFnew/CC40泳道进行扫描纯度分析,纯度可达95%以上。纯化结果见图6,其中泳道M为Marker,泳道2为纯化的CNTFnew/CC40蛋白。
实施例5.CNTFnew/CC40蛋白的N端15个氨基酸序列测定。
序列比对为将CNTFnew/CC40蛋白的N端15个氨基酸序列与天然CNTF的N端测序结果进行比对,测定结果见图7。结果说明CNTFnew/CC40蛋白的N端15个氨基酸序列的测序结果与预先设计完全相同。
实施例6.CNTFnew/CC40体外活性鉴定。
TF-1CN5a1细胞是一个依赖于GM-CSF的细胞系,其细胞表面具有rhCNTF高亲和力受体,所以CNTF能促进TF-1CN5a1细胞的增殖。将不同浓度的CNTFnew/CC40加入TF-1CN5a1细胞培养物中,观察细胞的生长情况,以测定CNTFnew/CC40体外活性,具体方法如下:
将TF-1CN5a1细胞(购自美国ATCC,货号为CRL-2512TM),常规培养于GM-CSF条件(100ml RPMI1640中含有500ng的GM-CSF)的培养液中,实验时收集对数生长期的细胞,用无血清的RPMI 1640(购自invitrogen公司)洗液洗涤3遍,然后用10%小牛血清RPMI 1640培养液调整细胞数为1.0×106,每孔加50μl细胞悬液,使用实施例4中获得的CNTFnew/CC40蛋白从初始浓度200ng/ml按4倍系列稀释后,每孔加入50μl。以50μl无血清RPMI 1640培养基作为阴性对照,以CNTF标准品(购自英国国家生物制品检定所NIBSC,货号:94/684)为阳性对照,初始浓度为200ng/ml,进行4倍系列稀释后,每孔加入50μl。培养板在37℃、5%CO2条件下培养48小时后,每孔加入50mg/ml的WST-8(购自碧云天生物技术研究所,货号:C0038)溶液20μl,继续培养8小时后,加入酸性异丙醇(异丙醇-HCL,pH4.0)溶液,混匀后在酶标仪上比色,测定波长为570nm,参比波长为630nm。每个实验取3次实验的平均结果。结果为CNTFnew/CC40蛋白的体外活性:8.7×106IU/mg。实验同时设置了未突变的睫状神经营养因子对照组(购自sigma,C3710-10UG),在相同的方法和条件下测定,实验结果证实未突变的睫状神经营养因 子的体外活性约为8.32×104IU/mg,经过定点突变的睫状神经营养因子突变体的生物学活性高于未突变的天然分子。
实施例7.CNTFnew/CC40在小鼠体内活性的测定。
实验用小鼠使用雄性昆明鼠(得自北京维通利华实验动物技术有限公司),体重18g-22g。分为阳性对照组,阴性对照组和实验组,每组6只。用生理盐水溶解CNTF标准品(购自英国国家生物制品检定所NIBSC,货号:NIBSC94/684)作为阳性对照,样品为CNTFnew/CC40(实施例4所得蛋白),同样以生理盐水溶解并稀释为100μg/ml。以每只小鼠125μg/kg/天的量进行皮下注射。阴性对照即生理盐水。注射前分别称量每组每只小鼠的体重。连续五天给药,称量小鼠的体重,观察小鼠的体重变化。
(1)流程:
表1CNTF对小鼠减重作用测定流程
注:实验时间以给药前一天为-1天,首次给药当天为0天。
△:根据前一操作完成情况,可提前或推后,但尽量保持每天在同一时间。
(2)测量指标:
体重变化率=(某组给药后体重-某组给药前体重)/给药前体重×100%
体重增长抑制率(%)=(对照组某日体重-对照组d0体重)-(受试组某日体重-该组d0体重)/(对照组某日体重-对照组d0体重)×100%
小鼠体重变化结果见表2:
表2.小鼠体重变化
由表2可知:三组皮下注射后的小鼠,体重均有所增长,但是样品组的小鼠体重增长低于阴性对照组(p<0.05),同时低于阳性对照(CNTF标准品)组(p<0.05)。
小鼠体重增长抑制率见下表3:
表3.小鼠体重增长抑制率
由表3可知,CNTFnew/CC40体重增长抑制率高于阳性对照(CNTF标准品)的体重增长抑制率。
实施例8.CNTFnew/CC40的免疫反应性
以CNTF的单克隆抗体作为特异性抗体进行蛋白质免疫印迹实验,研究免疫反应性。
用CNTF的单克隆抗体(购自Abcam公司)作为一抗,以辣根过氧化物酶标记的羊抗鼠IgG作为酶标二抗。首先将CNTFnew/CC40做SDS-PAGE电泳,分离胶浓度为12%,浓缩胶浓度为4%,上样量为15μl,恒压110V,电泳1.5小时,终止电泳,将凝胶转到NC膜上,分别与一抗和二抗孵育后显色。结果如图8所示,泳道M为Marker,泳道2为CNTFnew/CC40。结果显示CNTFnew/CC40能够与CNTF的单克隆抗体特异性结合,说明其仍具有与天然CNTF相似的免疫反应性。位点突变后没有改变蛋白与特异抗体结合的能力。
实施例9.CNTFnew/CC40蛋白的修饰以及纯化:
本实施例中利用支链的mPEG-MAL对上面步骤获得的CNTFnew/CC40蛋白进行修饰。
支链40KD的mPEG-MAL购于北京凯正科技有限公司,商品代号:Y-MAL-40K。分子式见下:
CNTFnew/CC40蛋白与MAL-mPEG分子结合的示意图见图9。
将纯化的CNTFnew/CC40蛋白与分子量40KD的MAL-mPEG按摩尔比1:2的比例混合,反应在100mmol/L的磷酸钠缓冲液(pH6.8,含1mmol/L的EDTA)中进行,置4℃反应16小时。修饰反应结果见图10。泳道M为Marker,泳道2为修饰前的CNTFnew/CC40蛋白,泳道3为修饰反应混合液。由结果可见,大部分的CNTFnew/CC40蛋白被MAL-mPEG修饰。采用阴离子交换介质Q FF(购自美国GE公司,型号:Hiprep16/10Q FF)对修饰反应混合液进行修饰剂、未修饰蛋白及修饰产物的分离。所采用的平衡缓冲液为50mM Tris-HCl,pH8.0,5个柱体积内用缓冲液B(50mM Tris-HCl,pH8.0,1M NaCl)进行梯度洗脱,收集目的蛋白洗脱峰,进行SDS-PAGE分析,结果见图11。泳道M为Marker,泳道2为纯化的mPEG-MAL-CNTFnew/CC40。
实施例10.修饰后mPEG-MAL-CNTFnew/CC40蛋白体外活性的测定。
TF-1CN5a1细胞是一个依赖于GM-CSF的细胞系,其细胞表面具有rhCNTF高亲和力受体,所以CNTF能促进TF-1CN5a1细胞的增殖。将不同浓度的mPEG-MAL-CNTFnew/CC40加入TF-1CN5a1细胞培养物中,观察细胞的生长情况,以测定mPEG-MAL-CNTFnew/CC40体外活性,具体方法如下:
将TF-1CN5a1细胞(购自美国ATCC,货号为CRL-2512TM),常规培养于GM-CSF条件(100ml RPMI 1640中含有500ng的GM-CSF)的培养液中,实验时收集对数生长期的细胞,用无血清的RPMI1640(购自invitrogen公司)洗液洗涤3遍,然后用10%小牛血清RPMI 1640培养液调整细胞数为1.0×106,每孔加50μl细胞悬液,使用实施例9获得的mPEG-MAL-CNTFnew/CC40蛋白,从起始浓度200ng/ml起按4倍系列稀释后,每孔加入50μl。以50μl无血清RPM1640培养基作为阴性对照,以CNTF标准品(购自英国国家生物制品检定所NIBSC,货号:94/684)为阳性对照,初始浓度为200ng/ml,进行4倍系列稀释后,每孔加入50μl。培养板在37℃、5%CO2条件下培养48小时后,每孔加入50mg/ml的WST-8(购自碧云天生物技术研究所。货号:C0038)溶液20μl,继续培养8小时后,加入酸性异丙醇(异丙醇-HCL,pH4.0)溶液,混匀后在酶标仪上比色,测定波长为570nm,参比波长为630nm。每个实验取3次实验的平均结果。测定方法同实施例6的未修饰的CNTF蛋白,结果为:
支链40K的MAL-mPEG修饰的CNTFnew/CC40蛋白的体外活性为:3.6×106IU/mg(为平均结果)。上述结果说明经40K的PEG修饰后,经过定点突变的睫状神经营养因子突变体的体外生物学活性有 所降低,修饰产物活性保留率为41%,但体外活性均远高于阳性对照组8×105IU/mg(p<0.05)。
实施例11mPEG-MAL-CNTFnew/CC40在小鼠体内活性的测定
实验用小鼠使用雄性昆明鼠(得自北京维通利华实验动物技术有限公司),体重18-22g。分为阳性对照组、阴性对照组和实验组,每组8只。用生理盐水溶解CNTF标准品(购自英国国家生物制品检定所.货号:NIBSC94/684),实验组样品为mPEG-MAL-CNTFnew/CC40(实施例9获得),以生理盐水溶解并稀释为0.5mg/ml。以每只小鼠100μg/kg/天的量进行皮下注射。阴性对照即生理盐水。注射前分别称量每组每只小鼠的体重。连续五天给药,称量小鼠的体重,观察小鼠的体重变化,另同时设置每周注射组,分为修饰样品组,未修饰样品组,阳性对照组及阴性对照组,以每只小鼠200μg/kg/天的量进行皮下注射。阴性对照即生理盐水。注射前分别称量每组每只小鼠的体重。为了证明mPEG-MAL-CNTFnew/CC40具有长效性,给药方式分两种,一种是每天给药,连续给药五天,另一种是每周给药一次,并分别称量小鼠的体重,观察小鼠的体重变化。
(1)流程如下表4:
表4.CNTF对小鼠减重作用测定流程(每天给药)
注:实验时间以给药前一天为-1天,首次给药当天为0天。
△:根据前一操作完成情况,可提前或推后,但尽量保持每天在同一时间。
表5.CNTF对小鼠减重作用测定流程(每周给药一次)
注:实验时间以给药前一天为-1天,首次给药当天为0天。
△:根据前一操作完成情况,可提前或推后,但尽量保持每天在同一时间。
(2)测量指标:体重变化率
体重变化率=(某组给药后体重-某组给药前体重)/给药前体重×100%;
体重增长抑制率(%)=(对照组某日体重-对照组d0体重)-(受试组某日体重-该组d0体重)/(对照组某日体重-对照组d0体重)×100%
小鼠体重变化结果见表6和表7:
表6小鼠体重变化表(连续5天给药)
由表6可知:样品mPEG-MAL-CNTFnew/CC40,CNTFnew/CC40两组注射后的小鼠,体重均有所增长,但是小鼠体重增长均小于阴性对照组(p<0.05),同时小于阳性对照(CNTF标准品)组(p<0.05)。
表7小鼠体重变化表(每周给药1次)
由表7可知:对于每周1次给药组,三组注射后的小鼠,体重均有所增长,但是修饰样品组的小鼠体重增长小于阴性对照组 (p<0.05),同时小于阳性对照(CNTF标准品)组(p<0.05)。
研究证实PEG修饰药物与未修饰药物相比较具有长效作用。
(2)小鼠体重增长抑制率见下表8:
表8小鼠体重增长抑制率(连续5天给药)
由表8可知mPEG-MAL-CNTFnew/CC40对小鼠的体重增长抑制率高于阳性对照(CNTF标准品)的体重增长抑制率(p<0.05)。
表9小鼠体重增长抑制率(每周给药1次)
由表9可知在每周给药一次的情况下, mPEG-MAL-CNTFnew/CC40对小鼠的体重增长抑制率与对照组比较有显著差异(p<0.01),特别是mPEG-MAL-CNTFnew/CC40样品每周一次给药即可达到CNTFnew/CC40每天给药效果,而CNTFnew/CC40每周给药一次不能有效抑制小鼠体重的增长。说明mPEG-MAL-CNTFnew/CC40有长效的抑制小鼠体重的效果。
实施例12.mPEG-MAL-CNTFnew/CC40的免疫反应性
以CNTF的单克隆抗体作为特异性抗体进行蛋白质免疫印迹实验,研究mPEG-MAL-CNTFnew/CC40的免疫反应性。
用CNTF的单克隆抗体(购自Abcam公司)作为一抗,以辣根过氧化物酶标记的羊抗鼠IgG作为酶标二抗。首先将mPEG-MAL-CNTFnew/CC40做SDS-PAGE电泳,分离胶浓度为12%,浓缩胶浓度为4%,上样量为15μl,恒压110V,电泳1.5小时,终止电泳,将凝胶转到NC膜上,分别与一抗和二抗孵育后显色。具体结果见图12,泳道M为Marker,泳道2为mPEG-MAL-CNTFnew/CC40蛋白。结果显示mPEG-MAL-CNTFnew/CC40能够与CNTF的单克隆抗体特异性结合,说明其仍具有与天然CNTF相似的免疫反应性,位点突变以及PEG修饰没有改变蛋白与特异性抗体结合的能力。
以上所述仅为本发明的较佳实施例,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!