一种干扰乙肝病毒复制的siRNA、其构建方法及应用与流程
本发明涉及生物领域。具体地,涉及一种干扰乙肝病毒复制的siRNA、其构建方法及应用。
背景技术:
乙型肝炎病毒(HBV)简称乙肝病毒,是一种DNA病毒,属于嗜肝DNA病毒科(hepadnavividae)。根据目前所知,HBV只对人和猩猩有易感性,引发乙型病毒性肝炎疾病。完整的乙肝病毒成颗粒状,也会被称为丹娜颗粒(Dane)。1965年由丹娜发现。直径为42纳米。颗粒分为外壳和核心两部分。
人体感染乙型肝炎病毒后,可引起细胞免疫及体液免疫应答,并激发自身免疫反应及免疫调节功能紊乱,致使病变的肝细胞产生或释放大量正常或异常的蛋白质,进一步促使免疫损害加重,使病情不断发展。
据估算,全国约有9300万人携带乙肝病毒,其中乙肝患者大约有3000万。
乙肝病毒慢性感染过程中机体需要反复清除乙肝病毒,如此可持续数年至数十年。由于免疫功能低,病毒无法清除,肝组织反复受损,反复修复,肝脏产生不同程度的纤维化。B超检查和组织学检查,则可清楚见到肝脏有明显的纤维化改变。如果治疗不及时,不能有效治疗纤维化,则转化为再生结节,形成假小叶,约20%左右的人出现肝硬化。
慢性乙肝在初期尽管对肝脏有损害但可以没有明显症状,因而导致很多人没有发现自己患有慢性乙肝疾病。由于肝脏代偿能力逐渐变差,一旦出现肝炎活动,就极易出现黄疸、腹水、出血、昏迷、尿少等严重后果。乙肝病毒携带者中,50%~75%的人有活动性病毒复制的慢性乙肝,估计5年中从慢性乙肝进展为肝硬化的发生率为2%~20%;从代偿性肝硬化到肝脏失代偿为20%~23%;从代偿性肝硬化到肝癌为6%~15%。
目前乙肝治疗的方法主要为抗病毒治疗,治疗使用的主要药物为干扰素,治疗方法为定期持续注射。然而,干扰素用于治疗慢性乙肝有诸多弊端。例如,对于注射干扰素后的乙肝患者,有些会在2-5小时内出现发热、恶心、浑身乏力、头晕、 头痛等类似于发烧症状,体温可高达38℃~40℃;干扰素还可影响乙肝患者的消化道功能,使得乙肝患者恶心、呕吐、厌油腻、无食欲、腹胀腹痛等现象;长期打干扰素治疗还可抑制乙肝患者的骨髓组织,使得血液中血小板以及白细胞含量降低,引发造血异常病症.一般在干扰素治疗3个月后,乙肝患者会出现不同程度的脱发,更为严重的患者可出现轻度皮疹等现在。并且,干扰素相对价格较为昂贵,反复需要注射,操作复杂。
因此,本领域迫切需要开发一种副作用小、费用低、获得和使用方便的乙肝病毒抑制剂。
技术实现要素:
本发明的目的是提供一种副作用小、费用低、获得和使用方便的乙肝病毒抑制剂。
本发明第一方面提供了一种功能siRNA,其5’至3’端具有式I所示的结构:
Z0-Z1-Z2 (式I)
其中,
Z0=A或无;
Z1是如SEQ ID NO.:2所示的核酸序列;和
Z2=A或无。
在另一优选例中,所述式I所示的siRNA序列选自下组:SEQ ID NO.:1、2、3、或其组合。
在另一优选例中,所述式I结构具有以下特征:
(i)Z0=A或无;
(ii)Z1是如SEQ ID NO.:7所示的核酸序列;和
(iii)Z2=G或无。
在另一优选例中,所述式I所示的siRNA序列选自下组:SEQ ID NO.:5、6、7、或其组合。
本发明第二方面提供了一种产生本发明第一方面所述siRNA的前体序列,其5’至3’端具有式II所示的结构:
式中,
B1为所需要的第一核糖核酸序列,其中所述的第一核糖核酸序列包括siRNA序列形式;
B2为与B1基本互补或完全互补的序列,且B2与C不互补;
C为茎环结构。
在另一优选例中,其5’至3’端具有式II所示的结构:
式中,
B1为siRNA;
B2为与B1基本互补或完全互补的序列,且B2与C不互补;
C为茎环结构。
在另一优选例中,所述前体序列如SEQ ID NO.:4所示。
在另一优选例中,所述B1选自下组:SEQ ID NO.:1、2、3、或其组合。
在另一优选例中,所述B1选自下组:SEQ ID NO.:5、6、7、或其组合。
在另一优选例中,所述前体序列如SEQ ID NO.:8所示。
本发明第三方面提供了一种多核苷酸,所述的多核苷酸能被宿主转录形成本发明第二方面中所述的前体序列。
本发明第四方面提供了一种表达载体,所述的表达载体含有本发明第二方面所述的前体序列或本发明第三方面所述的多核苷酸。
本发明第五方面提供了一种用于改善或治疗动物的靶基因相关疾病的组合物,其中所述靶基因相关疾病包括siRNA靶基因相关疾病,所述的组合物包括;
(1)药学上可接受的载体、保健品上可接受的载体或食品学上可接受的载体;和
(2)(a)植物或其可食用部分,并且所述植物或其可食用部分表达并携带用于改善或治疗本发明第一方面所述的功能siRNA和/或本发明第二方面所述siRNA的前体; 或(b)所述植物的提取物,所述提取物含有本发明第一方面所述的功能siRNA和/或本发明第二方面所述siRNA的前体。
在另一优选例中,所述食品学上可接受的载体包括饮料。
在另一优选例中,所述siRNA靶基因相关疾病选自下组:肝炎。
在另一优选例中,所述siRNA靶基因相关疾病选自下组:乙肝。
在另一优选例中,所述的动物包括哺乳动物,如人。
在另一优选例中,本发明的组合物为口服剂型。
在另一优选例中,所述的植物包括:禾本科、香蒲科、蕨科、菊科、唇形科、百合科、石蒜科、紫草科、天南星科、伞形科、十字花科、报春花科、蓼科、藜科、石竹科、柳叶菜科、荨麻科、车前草科、杨梅科、桑科、大麻科、虎耳草科、蔷薇科、豆科、蕨科、堇菜科、银齿莴苣科、苋科、壳斗科、小球藻科、茶科、茜草科、梧桐科、松科、葫芦科、大风子科、罗汉松科、桦木科、胡桃科、胡椒科、木兰科、齿菌科、木耳科、口蘑科、伞菌科、红菇科、杜鹃花科、蔷薇科、猕猴桃科、番杏科、葡萄科、番荔枝科、秋海棠科、凤梨科、白花菜科、银杏科、八角茴香科、姜科、石榴科、毛茛科、竹桃科、小檗科、芸香科、茄科、罂粟科、马鞭草科、鹿蹄草科、鸭跖草科、瑞香科、桑寄生科、萝藦科、三白草科、景天科、林橡科、马齿苋科、泽泻科、锦葵科、玄参科、紫葳科、防已科、海金沙科、爵床科、旋花科、多孔菌科、无患子科、柏科、苦木科、大戟科、楝科、使君子科、忍冬科、柽柳科、列当科、灯心草科、金缕梅科、龙胆科、椴树科、菖蒲科、冬青科、车前科、漆树科、五味子科、五加科、木棉科、马兜铃科、木犀科、棕榈科、睡莲科、檀香科植物、或其组合。
在另一优选例中,所述植物为生菜、水稻、小麦、玉米、花生、高粱、大豆、马铃薯、荞麦、藜、蓟、胡椒、八角、茴香、桃、杏、梨、苹果、香蕉、猴头、木耳、山药、山楂、人参、当归、番茄、辣椒、茄子、胡萝卜、甘蓝、花椰菜、大白菜、小白菜、油菜、菠菜、芥菜、豌豆、南瓜、黄瓜、西瓜、甜瓜、石刁柏、洋葱、或其组合。
在另一优选例中,所述的可食用部分包括:根、茎、叶、花、果、芽、种子、或其组合。
在另一优选例中,所述的植物提取物为以下部分的提取物:根、茎、叶、花、果、芽、种子、或其组合。
本发明第六方面提供了一种本发明第一方面所述功能siRNA或本发明第二方面所述前体序列的用途,用于制备(i)治疗肝炎的组合物;(ii)抑制/干扰肝炎病毒的复制。
在另一优选例中,所述肝炎选自下组:乙肝。
本发明第七方面提供了一种调控动物中靶基因表达的方法,所述的靶基因受功能siRNA的调控,将植物植株或其可食用部分或其提取物口服施用于需要的对象,其中,所述的植物或其可食用部分表达并携带有本发明第一方面所述的功能siRNA和/或本发明第二方面所述的siRNA前体,并且所述的提取物含有本发明第一方面所述的功能siRNA和/或本发明第二方面所述的siRNA前体。
在另一优选例中,所述方法还用于治疗siRNA靶基因相关的疾病。
在另一优选例中,所述siRNA靶基因相关疾病选自下组:肝炎。
在另一优选例中,所述siRNA靶基因相关疾病选自下组:乙肝。
本发明第八方面提供了一种抑制乙肝病毒复制的方法,包括步骤:将本发明第一方面所述功能siRNA或本发明第二方面所述前体序列导入植物中。
应理解,在本发明范围内中,本发明的上述各技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。限于篇幅,在此不再一一累述。
附图说明
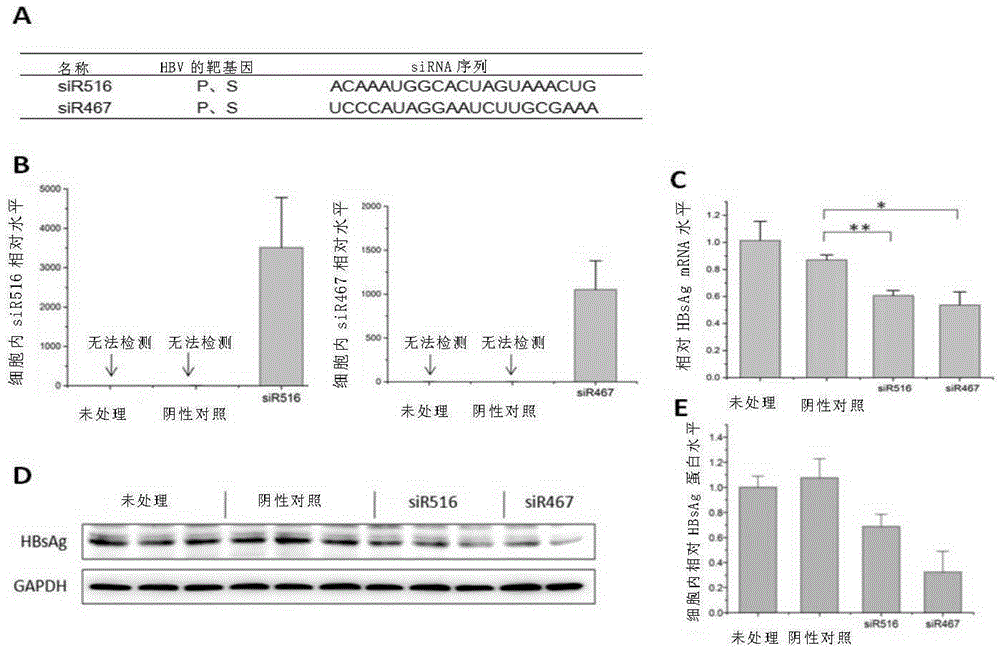
图1A显示了本发明一个实施例中siRNA的设计序列。
图1B显示了转染进HepG2细胞内的siR516和siR467的相对含量。
图1C显示了转染siR516和siR467后,HepG2细胞内HBsAg mRNA的表达水平。
图1D显示了转染siR516和siR467后,HepG2细胞内HBsAg蛋白的表达水平(Western blot)。
图1E显示了细胞内相对HBsAg蛋白的表达水平。
图2A显示了转基因生菜中siR516(amiR516)和siR467(amiR467)的绝对表达量。
图2B和图2C显示了转基因生菜中siR516(amiR516)和siR467(amiR467)的表达水平(Northern blot)。
图3A显示了细胞内相对siR516/amiR516的表达水平。
图3B显示了细胞内相对siR467/ami467的表达水平。
图3C显示了用合成的siRNA516与生菜表达的siRNA516(amiR516)分别处理HepG2细胞系后,细胞内HBsAg mRNA的表达水平。
图3D显示了用合成的siRNA467与生菜表达的siRNA467(amiR467)分别处理HepG2细胞系后,细胞内HBsAg mRNA表达水平。
图4A显示了用野生型生菜与表达siRNA516(amiR516)的生菜分别喂食HBBV转基因小鼠后,小鼠肝脏内HBsAg mRNA的表达水平。
图4B显示了对HBV转基因小鼠分别喂食野生型生菜、表达siRNA516(amiR516)的生菜、以及amiR516和抑制剂(联合使用)后,小鼠肝脏内HBsAg蛋白的表达水平。
图4C显示了HBV转基因小鼠肝脏内HBsAg蛋白的表达水平。
图4D显示了用野生型生菜与表达siRNA467(amiR467)的生菜分别喂食HBV转基因小鼠后,小鼠肝脏内HBsAg mRNA的表达水平。
图4E显示了用野生型生菜与表达siRNA467(amiR467)的生菜分别喂食HBV转基因小鼠后,小鼠肝脏内HBsAg蛋白的表达水平。
图4F显示了HBV转基因小鼠肝脏内HBsAg蛋白的表达水平。
图4G显示了对HBV转基因小鼠分别喂食野生型生菜、表达siRNA516(amiR516)的生菜、以及amiR516和抑制剂(联合使用)后,小鼠肝脏内HBsAg mRNA的表达水平。
图4H显示了对HBV转基因小鼠分别喂食野生型生菜、表达siRNA516(amiR516)的生菜、以及amiR516和抑制剂(联合使用)后,小鼠肝脏内HBsAg蛋白的表达水平。
图4I显示了HBV转基因小鼠肝脏内HBsAg蛋白的表达水平。
图5显示了与野生型小鼠相比,喂食HBV转基因小鼠siR516(amiR516)转基因生菜后,小鼠肝脏病理切片的观察结果。
其中,在上述各图中,未处理代表未做处理的阴性对照组;阴性对照代表合成的随机siRNA序列处理的阴性对照组;siR516代表合成的siR516处理的阳性对照组;野生型代表野生型生菜microRNA处理的阴性对照组;amiR516代表表达HBV siR516生菜microRNA处理的实验组;amiR516+抑制剂代表表达HBV siR516生菜microRNA和siR516的抑制剂同时处理的实验组;siR467代表合成的siR467处理的阳性对照组;amiR467代表表达HBV siR467生菜microRNA处理的实验组;amiR467+抑制剂代表表达HBV siR467生菜microRNA和siR467的抑制剂同时处理的实验组;GAPDH代表内参。
具体实施方式
发明人经过广泛而深入的研究,筛选了大量核酸序列,首次发现某些特定siRNA 对于乙肝病毒有非常高的抑制能力。因此,导入本发明的这些特异性乙肝病毒的siRNA,可以有效地抑制乙肝病毒的表达和活性,进而预防和/或治疗乙肝。在此基础上,发明人完成了本发明。
实验表明,植物表达的功能siRNA,不仅可耐受消化道的不利环境,可稳定存在于动物体,且更易在被动物体(如动物的循环系统、组织和器官)吸收或富集,从而调控(甚至沉默)靶基因,进而有助于调节人体生理状态或治疗siRNA靶基因相关疾病(如乙肝)。
如本文所用,术语“siRNA靶基因”均指在动物体内中,表达受到所述siRNA干扰(尤其是下调)的基因,所述siRNA靶基因可以是动物体内内源的基因,也可以是感染动物病原体表达的基因,本发明所述的siRNA靶基因是特异性针对HBV病毒的。
siRNA及其前体
本发明提供了一类涉及治疗乙肝的siRNA。
如本文所用,所述“本发明的功能siRNA”、“本发明的siRNA”,可互换使用,均指具有以下特征的siRNA:
所述siRNA的5’至3’端具有式I所示的结构:
Z0-Z1-Z2 (式I)
其中,
Z0=A或无;
Z1是如SEQ ID NO.:2所示的核酸序列;和
Z2=A或无。
在一优选实施方式中,所述式I所示的siRNA序列选自下组:SEQ ID NO.:1、2、3、或其组合。
如本文所用,所述的“siRNA”是指一类RNA分子,从可形成siRNA前体的转录物加工而来。成熟的siRNA通常具有18-26个核苷酸(nt)(更特别的约19-22nt),也不排除具有其它数目核苷酸的siRNA分子。siRNA通常可被Northern印迹检测到。
如本文所用,“分离的”是指物质从其原始环境中分离出来(如果是天然的物质,原始环境即是天然环境)。如活体细胞内的天然状态下的多聚核苷酸和多肽是没有分离纯化的,但同样的多聚核苷酸或多肽如从天然状态中同存在的其他物质中分开,则为分离纯化的。
值得说明的是,siRNA一般通过模拟miRNA产生机制来产生的,这样的siRNA就可从前体RNA(Precursor RNA,Pre-RNA)加工而来。所述的前体RNA可折叠成一种稳定的茎环(发夹)结构,所述的茎环结构长度一般在50-100bp之间。所述的前体RNA可折叠成稳定的茎环结构,茎环结构的茎部两侧包含基本上互补的两条序列。所述的前体RNA可以是天然的或是人工合成的。
前体RNA可被剪切生成siRNA,所述的siRNA可与编码基因的mRNA的至少一部分序列基本上互补。如本文所用,“基本上互补”是指核苷酸的序列是足够互补的,可以以一种可预见的方式发生相互作用,如形成二级结构(如茎环结构)。通常,两条“基本上互补”的核苷酸序列互相之间至少有70%的核苷酸是互补的;优选的,至少有80%的核苷酸是互补的;更优选的,至少有90%的核苷酸是互补的;进一步优选的,至少有95%的核苷酸是互补的;如98%、99%或100%。一般地,两条足够互补的分子之间可以具有最多40个不匹配的核苷酸;优选的,具有最多30个不匹配的核苷酸;更优选的,具有最多20个不匹配的核苷酸;进一步优选的,具有最多10个不匹配的核苷酸,如具有1、2、3、4、5、8、11个不匹配的核苷酸。
如本文所用,“茎环”结构也被称作“发夹”结构,是指一种核苷酸分子,其可形成一种包括双链区域(茎部)的二级结构,所述的双链区域由该核苷酸分子的两个区域(位于同一分子上)形成,两个区域分列双链部分的两侧;其还包括至少一个“环”结构,包括非互补的核苷酸分子,即单链区域。即使该核苷酸分子的两个区域不是完全互补的,核苷酸的双链部分也可保持双链状态。例如,插入、缺失、取代等可导致一个小区域的不互补或该小区域自身形成茎环结构或其它形式的二级结构,然而,该两个区域仍可基本上互补,并在可预见的方式中发生相互作用,形成茎环结构的双链区域。茎环结构是本领域技术人员所熟知的,通常在获得了一条具有一级结构的核苷酸序列的核酸后,本领域技术人员能够确定该核酸是否能形成茎环结构。
本发明所述的siRNA是指:抑制乙肝病毒的siRNA家族的微小RNA,所述抑制乙肝病毒的siRNA家族的微小RNA包括:抑制乙肝病毒的siRNA或经修饰的抑制乙肝病毒的siRNA衍生物。
在本发明的一个优选例中,抑制乙肝病毒的siRNA的核苷酸序列如SEQ ID NO.:1-8所示。特别优选的是SEQ ID NO.:1-4中任一序列或其组合。
本发明还包括siRNA变体和衍生物。此外,广义上的siRNA衍生物也可包括siRNA变体。本领域的普通技术人员可以使用通用的方法对抑制酪氨酸激酶的siRNA进行 修饰,修饰方式包括(但不限于):甲基化修饰、烃基修饰、糖基化修饰(如2-甲氧基-糖基修饰、烃基-糖基修饰、糖环修饰等)、核酸化修饰、肽段修饰、脂类修饰、卤素修饰、核酸修饰(如“TT”修饰)等。
多核苷酸构建物
根据本发明所提供的siRNA序列,可设计出在被导入后可被加工成可影响相应的mRNA表达的siRNA的多核苷酸构建物,也即所述多核苷酸构建物能够在体内上调相应的siRNA的量。因此,本发明提供了一种分离的多核苷酸(构建物),所述的多核苷酸(构建物)可被人细胞转录成前体RNA,所述的前体RNA可被人细胞剪切且表达成所述的siRNA。
作为本发明的一种优选方式,所述的多核苷酸构建物含有一个或多个式II所示的结构单元:
Seq正向-X-Seq反向
式II
式II中,
Seq正向为可在细胞中表达成所述的抑制乙肝病毒的siRNA的核苷酸序列,Seq反向为与Seq正向基本上互补的核苷酸序列;或者,Seq反向为可在细胞中表达成所述的siRNA的核苷酸序列,Seq正向为与Seq正向基本上互补的核苷酸序列;X为位于Seq正向和Seq反向之间的间隔序列,并且所述间隔序列与Seq正向和Seq反向不互补;
其中,各结构单元可表达相同或不同的siRNA;
式II所示的结构在转入细胞后,形成式III所示的二级结构:
式III中,Seq正向、Seq反向和X的定义如上述;
||表示在Seq正向和Seq反向之间形成的碱基互补配对关系。
通常,所述的多核苷酸构建物位于表达载体上。因此,本发明还包括一种载体,它含有所述的siRNA,或所述的多核苷酸构建物。所述的表达载体通常还含有启动子、复制起点和/或标记基因等。本领域的技术人员熟知的方法能用于构建本发明所需的表达载体。这些方法包括体外重组DNA技术、DNA合成技术、体内重组技术等。所述的表达载体优选地包含一个或多个选择性标记基因,以提供用于选择转化的宿主细胞的表型性状,如卡拉霉素、庆大霉素、潮霉素、氨苄青霉素抗性。
改善或治疗动物的靶基因相关疾病的组合物
本发明提供了一种用于改善或治疗动物的靶基因相关疾病的组合物,所述的组合物可包括:药物组合物、食品组合物或保健品。
现以药物组合物为例对组合物作进一步说明,所述药物组合物包括:
(1)药学上可接受的载体;和
(2)(a)植物或其可食用部分,并且所述植物或其可食用部分表达并携带用于改善或治疗本发明第一方面所述功能siRNA靶基因相关疾病的功能siRNA和/或本发明第二方面所述siRNA的前体;或(b)所述植物的提取物,所述提取物含有本发明第一方面所述的功能siRNA和/或本发明第二方面所述siRNA的前体。
如本文所用,所述靶基因相关疾病包括siRNA靶基因相关疾病,如肝炎或肝炎引起的肝硬化,具体地,所述siRNA靶基因相关疾病为乙肝。
如本文所用,术语“药学上可接受的”的成分是适用于人和/或哺乳动物而无过度不良副反应(如毒性、刺激和变态反应)的,即具有合理的效益/风险比的物质。术语“药学上可接受的载体”指用于治疗剂给药的载体,包括各种赋形剂和稀释剂。
本发明的药物组合物含有安全有效量的本发明的活性成分以及药学上可接受的载体。这类载体包括(但并不限于):盐水、缓冲液、葡萄糖、水、甘油、乙醇、及其组合。通常药物制剂应与给药方式相匹配,本发明的药物组合物的剂型为注射剂、口服制剂(片剂、胶囊、口服液)、透皮剂、缓释剂。例如用生理盐水或含有葡萄糖和其他辅剂的水溶液通过常规方法进行制备。所述的药物组合物宜在无菌条件下制造。
本发明所述的活性成分的有效量可随给药的模式和待治疗的疾病的严重程度等而变化。优选的有效量的选择可以由本领域普通技术人员根据各种因素来确定(例如通过临床试验)。所述的因素包括但不限于:所述的活性成分的药代动力学参数例如生物利用率、代谢、半衰期等;患者所要治疗的疾病的严重程度、患者的体重、患者的免疫状况、给药的途径等。通常,当本发明的活性成分每天以约0.00001mg-50mg/kg动物体重(较佳的0.0001mg-10mg/kg动物体重)的剂量给予,能得到令人满意的效果。例如,由治疗状况的迫切要求,可每天给予若干次分开的剂量,或将剂量按比例地减少。
本发明所述的药学上可接受的载体包括(但不限于):水、盐水、脂质体、脂质、微粒子(micro particle)、微泡(micro vesicle)、外泌体(exosomes)、脱落囊泡(shedding vesicle)、纳米胶囊(Nanocapsules/Nanoparticles)、β环糊精胶囊(β-cyclodextriniclusion compound)蛋白、蛋白-抗体缀合物、肽类物质、纤维素、纳米凝胶、或其组合。载体的选择应与给药方式相匹配,这些都是本领域的普通技 术人员所熟知的。
在本发明中,可将所述的表达载体直接施用于对象,也可将所述的表达载体与药学上可接受的载体制备成药物组合后进行施用。所述的施用包括静脉注射。
药物组合物的施用方式没有特别限制,代表性的施用方式包括(但并不限于):口服。
抑制动物中HBV相关靶基因表达的方法
本发明提供了一种抑制动物中HBV相关靶基因表达的方法,所述方法包括步骤:
将植物植株或其可食用部分或其提取物口服施用于需要的对象,其中,所述的植物或其可食用部分表达并携带有本发明第一方面所述的功能siRNA和/或本发明第二方面所述的siRNA前体,并且所述的提取物含有有本发明第一方面所述的功能siRNA和/或本发明第二方面所述的siRNA前体。
一种优选的方法是非治疗性非诊断性的抑制动物中HBV相关靶基因表达的方法。
本发明的主要优点包括:
1.首次开发了针对乙肝病毒特异性设计的siRNA序列,并将该序列构建如表达载体,通过大肠杆菌筛选后导入农杆菌侵染植物,得到可以表达抑制乙肝病毒siRNA序列的转化植株。
2.该siRNA序列针对乙肝病毒的S蛋白基因和P蛋白基因的重叠区域,可以有效、特异性地抑制乙肝病毒复制,可以制成抑制乙肝病毒的植物提取物,并且可以通过口服途径发挥作用,避免了注射带来的痛苦和不便。
3.通过转化植株可以快速、简单地获取包含siRNA的抑制乙肝病毒的植物提取物,降低了人工和使用成本。
下面结合具体实施,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件,例如Sambrook等人,分子克隆:实验室手册(New York:Cold Spring Harbor Laboratory Press,1989)中所述的条件,或按照制造厂商所建议的条件。除非另外说明,否则百分比和份数按重量计算。本发明实施例中所用原料或仪器,若非特别说明,均市售可得。
实施例1乙型肝炎病毒siRNA设计及其干扰效率验证
使用BLOCK-iTTM RNAi Designer系统,发明人针对下述靶序列设计了siRNA,具 体的靶序列见下表:
针对上述10条序列合成相应的HBV siRNA,转染进HepG2细胞,通过细胞内相对含量验证siRNA的转化效率。
如图1F所示,结果表明,siR467和siR516的转化效率远高于其他8条siRNA。
如图1A所示,图1A为针对起始位置为467、516而设计的siRNA序列。
经过筛选,选用siR467、siR516以及表达siR467和siR516的前体序列,所述siR467的前体序列如SEQ ID No.:4所示,所述siR516的前体序列如SEQ ID No.:8所示。
在本实施例中,siR467对应的siRNA序列分别如下所示:
(1)5’-UCCCAUAGGAAUCUUGCGAAA-3’(SEQ ID NO.:1)
(3)5’-UCCCAUAGGAAUCUUGCGAA-3’(SEQ ID NO.:2)
(3)5’-AUCCCAUAGGAAUCUUGCGAA-3’(SEQ ID NO.:3)
siR467的前体序列如下所示:
(4)5’-AGTTGCGCAAGATTCATATGGGCTCACAGGTCGTGATATGATTCAATTAGCTTCCGACTCA TTCATCCAAATACCGAGTCGCCAAAATTCAAACTAGACTCGTTAAATGAATGAATGATGCGGTAGACAAATTGGATCATTGATTCTCTTTGATCCCATAGGAATCTTGCGAAACT-3’(SEQ ID NO.:4)
siR516对应的siRNA序列分别如下所示:
(5)5’-AACAAAUGGCACUAGUAAACU-3’(SEQ ID NO.:5)
(6)5’-ACAAAUGGCACUAGUAAACUG-3’(SEQ ID NO.:6)
(7)5’-ACAAAUGGCACUAGUAAACU-3’(SEQ ID NO.:7)
siR516的前体序列如下所示:
(8)5’-AGCAATTTACTAGTGACATTTGCTCACAGGTCGTGATATGATTCAATTAGCTTCCGACTCA TTCATCCAAATACCGAGTCGCCAAAATTCAAACTAGACTCGTTAAATGAATGAATGATGCGGTAGACAAATTGGATCATTGATTCTCTTTGAACAAATGGCACTAGTAAACTGCT-3’(SEQ ID NO.:8)
siRNA设计完成后,在细胞水平,通过合成的HBV siRNA,验证siRNA的干扰效率。
实验方法:
Real-time PCR
(1)总RNA的提取:使用Trizol试剂(购自Invitrogen公司)提取处理后细胞内总RNA。
(2)制备cDNA样品:通过提出到的RNA进行逆转录反应制备cDNA样品。逆转录的反应体系包括2μL 5×AMV buffer、1μL 10mM each dNTP mixture(购自Takara公司)、0.5μL AMV(Takara公司),2μL RNA(1μg/μL)以及0.5μL microRNA特异性反向引物混和物.总体积为10μL,反应步骤为16℃孵育30分钟,42℃反应30分钟,85℃孵育5分钟。
(3)RT-qPCR:采用的是探针法PCR。首先取1μL cDNA,加入0.3μL Taq酶(Takara公司),0.33μL microRNA或基因特异性探针引物,1.2μL 25mM MgCl2,0.4μL 2.5mM each dNTP mixture(Takara公司),2μL 10×PCR buffer,14.77μL H2O,共20μL体系进行PCR。仪器使用的是ABI Prism 7300荧光定量PCR仪,反应条件为95℃、5分钟进行1个循环→95℃、15秒,60℃、1分钟进行40个循环。每个样品进行三副重复孔。siR516和siR467分别利用了siR516引物探针,siR467引物探针。
Western Blot
(1)总蛋白的提取与处理:使用RIPA细胞裂解液提取处理后细胞内总蛋白,然后进行Bradfold比色法测定蛋白浓度。根据浓度加入5×SDS-PAGE蛋白上样缓冲液,100℃浴热5分钟使蛋白变性。
(2)上样,SDS-PAGE胶电泳,转膜和封膜:把80μg的蛋白样,即HBsAg(蛋白分子量约44kDa)已经被适当分离后,停止电泳,然后取出SDS-PAGE胶,在300mA,把胶上的蛋白转到PVDF膜上,转膜时间为1.5小时。转膜后把膜取出,标记正面,放在丽春红中染色观察蛋白是否转上,然品上样到10%SDS-PAGE胶加样孔中,在80V恒压下电泳。当目的蛋白,也后把目的范围条带剪下,用1×TBST把丽春红洗脱,再用5%无脂牛奶-TBST液室温摇动1小时封膜。
(3)一抗孵育:目的蛋白:HBsAg抗体以1:500比例用5%无脂牛奶-TBST液稀释后,4℃过夜孵育封闭后的膜。之后用TBST在侧摆摇床上洗涤15分钟4次。内参:GAPDH(甘油醛-3-磷酸脱氢酶)抗体(SantaCruz公司)以1:3000比例用5%无脂牛奶 -TBST液稀释后,4℃过夜孵育封闭后的膜。之后用TBST在侧摆摇床上洗涤15分钟4次。
(4)二抗孵育:目的蛋白:羊抗兔抗体以1:3000比例用5%无脂牛奶-TBST液稀释后,室温摇床孵育膜一小时。内参:羊抗鼠抗体以1:5000比例用5%无脂牛奶-TBST液稀释后,室温摇床孵育膜一小时。
(5)蛋白检测:使用荧光检测试剂曝光检测蛋白。
实验结果:
siR516和siR467的表达水平如图1B所示。
从图1B可以看出,与对照组相比,转染进HepG2细胞后siR516和siR467含量显著增加,结果表明,siR516和siR467能够成功转化入细胞内。
siR516和siR467对HBsAg的抑制效果如图1C、1D、1E所示。
从图1C、1D、1E可以看出,与对照组相比,细胞内HBsAg的表达水平显著降低。结果表明,siR516、siR467均对靶基因有显著抑制作用。
综上,上述研究表明,本实施例所设计的siRNA具有较强的干扰效率,可用于在后续生菜表达的构建实验。
实施例2、转基因生菜中HBV siRNA的表达
本实施例选择人工小RNA(amiRNA:artificial miRNA)的表达方式来表达外源HBV siRNA,即选用植物内源miRNA前体骨架表达外源siRNA。通过此种构建方法,并分别利用半定量RT-PCR和Northren Blot印迹方法成功构建并检测出了HBV两种siRNAs的表达(图2A,B)。
2.1 HBV amiRNA表达载体的构建
对于siR516对应的siRNA序列:
(5)5’-AACAAAUGGCACUAGUAAACU-3’(SEQ ID NO.:5)
(6)5’-ACAAAUGGCACUAGUAAACUG-3’(SEQ ID NO.:6)
(7)5’-ACAAAUGGCACUAGUAAACU-3’(SEQ ID NO.:7)
以siR516-P1、siR516-P2、siR516-P3、siR516-P4、Primer A、Primer B三对为引物。
引物序列如下:
amiR516-P1:GAACAAATGGCACTAGTAAACTGTCTCTCTTTTGTATTCC(SEQ ID No.:19)
amiR516-P2:GACAGTTTACTAGTGCCATTTGTTCAAAGAGAATCAATGA(SEQ ID No.:20)
amiR516-P3:GACAATTTACTAGTGACATTTGCTCACAGGTCGTGATATG(SEQ ID No.:21)
amiR516-P4:GAGCAAATGTCACTAGTAAATTGTCTACATATATATTCCT(SEQ ID No.:22)
Primer A:CTGCAAGGCGATTAAGTTGGGTAAC(SEQ ID No.:23)
Primer B:GCGGATAACAATTTCACACAGGAAACAG(SEQ ID No.:24)
对于siR467对应的siRNA序列:
(1)5’-UCCCAUAGGAAUCUUGCGAAA-3’(SEQ ID NO.:1)
(3)5’-UCCCAUAGGAAUCUUGCGAA-3’(SEQ ID NO.:2)
(3)5’-AUCCCAUAGGAAUCUUGCGAA-3’(SEQ ID NO.:3)
引物序列如下:
amiR467-P1:GATCCCATAGGAATCTTGCGAAATCTCTCTTTTGTATTCC(SEQ ID No.:25)
amiR467-P2:GATTTCGCAAGATTCCTATGGGATCAAAGAGAATCAATGA(SEQ ID No.:26)
amiR467-P3:GATTGCGCAAGATTCATATGGGCTCACAGGTCGTGATATG(SEQ ID No.:27)
amiR467-P4:GAGCCCATATGAATCTTGCGCAATCTACATATATATTCCT(SEQ ID No.:28)
Primer A:CTGCAAGGCGATTAAGTTGGGTAAC(SEQ ID No.:29)
Primer B:GCGGATAACAATTTCACACAGGAAACAG(SEQ ID No.:30)
实验方法:
(a)以siR467-P1、siR467-P2、siR467-P3、siR467-P4、Primer A、Primer这三对引物,以骨架载体为模板(含有KpnI,BamHI克隆位点),用primeSTAR高保真DNA聚合酶(Takara),经过PCR得到三个片段,大小分别为320bp、170bp、200bp左右,经过琼脂1.5%糖凝胶电泳分离并割胶回收。
PCR反应体系(25μL):2×GC缓冲液12.5μL、dNTP(10mM)、引物(正义+反义)0.5+0.5μL、模板1.0μL、primeSTAR DNA聚合酶0.5μL、dH2O 9.0μL。
PCR反应条件:98℃5min;98℃10s,55℃5s,72℃30s,35个循环;72℃7min。
(b)回收的三个片段为模板,primer A和primer B为引物,用primeSTAR高保真DNA聚合酶(Takara),经过重叠PCR后,得到大约600bp的针对siR516(或siR467)表达所需的全长片段,经过Kpn I和BamHI双酶切后克隆到双元表达载体中,并测序验证是否引入突变。
重叠PCR反应体系(25μL)及条件如下:2×GC缓冲液12.5μL、dNTP(10mM)0.5μL、引物(正义+反义)0.5+0.5μL、模板0.5+0.5+0.5μL、primeSTAR DNA聚合酶0.5μL、dH2O 8.5μL。
重叠PCR反应条件:98℃5min;98℃10s,60℃5s,72℃40s,35个循环;72℃7min。
表达载体连接反应体系为:表达载体3.0μL,酶切位点为BamHI、KpnI;T4连接酶(Takara)2.0μL,T4连接酶缓冲液2.0μL,H2O 3.0μL。
连接反应条件:16℃,连接过夜。
(c)大肠杆菌的转化:采用常规的热激法转化大肠杆菌。正确的质粒用于转化 农杆菌株。
农杆菌质粒的提取:所用的试剂为国产Karroten质粒DNA提取试剂盒。测序确认后的单克隆摇菌,并按照试剂盒的操作说明提取质粒。
农杆菌的转化:采用常规的电击方法。经过鉴定成功转化的农杆菌,最后保存菌种,并用于植株的转化。
通过上述方法,完成了通过amiRNA稳定表达siR516和siR467的载体质粒的构建。
2.2 HBV amiRNA转化植株构建
amiRNA转化植株的实验包括无菌苗培养、农杆菌侵染、植物愈伤诱芽培养、幼苗诱根培养,具体包括以下步骤:
amiRNA转化植株的实验采用的是农杆菌介导的转化方法——叶盘法。将植物种子表面用消毒用10%NaClO振荡消毒10min左右;用无菌水冲洗4-5次;晾干后接种于培养基上,25℃培养5d。将新鲜的叶芽剪下,以备下步的质粒转化。
可选植物包括但不限于生菜、大豆、番茄、玉米、棉花、油菜、白菜、马铃薯、西葫芦、黄瓜、木瓜、胡萝卜等,本实施例中采用生菜作为实验植株,使用其它植物可以代替。
将载有amiRNA表达质粒的农杆菌于28℃摇床培养至OD600>1.0,离心收集细菌,重悬于5%蔗糖溶液中,使其OD600=1.0,此混合液即为侵染液。
将新鲜剪下的生菜叶芽置于上述侵染叶中悬浮培养10min,然后置于无菌滤纸吸干多余液体,并将子叶接种于预先铺有一层无菌滤纸的1/2MS培养基上。培养2d后用含4mg/ml羧苄青霉素的无菌水冲洗叶芽4-5次,然后接种于诱芽培养基上。诱芽培养基的成分包括:MS培养基、2%蔗糖、0.8%琼脂、0.01mg/L NAA、0.1mg/L 6-BA、200mg/L羧苄青霉素和50mg/L卡那霉素。
诱芽长出后将其从外植体上剪下,并转移到诱根培养基中,大约7-10d即可见幼根的生成,幼根培养基成分如下:1/2MS培养基、0.01mg/L NAA、30mg/L卡那霉素、50mg/L羧苄青霉素、0.8%琼脂。等幼苗生根后转移到土壤中进行培养,并检验pre-amiRNA及siRNA在植株中的表达。
所用的试剂除MS盐混合物购自Duchefa Biochemie公司外,其余试剂均为上海生工产品。
在完成构建后,通过实施例2.3确认转化植株构建是否成功。
2.3转化植株中HBV siRNA的检测实验
2.3.1 RNA及cDNA的准备。
使用Trizol试剂(Invitrogen公司)提取转化后植株的总RNA。通过提取到的RNA进行逆转录反应制备cDNA样品.逆转录的反应体系包括2μL 5×AMV缓冲液、1μL dNTP混合物(每个成分的浓度为10mM,Takara公司)、0.5μL AMV(Takara公司),2μL RNA(1μg/μL)以及0.5μL siRNA特异性反向引物混和物。
总体积为10μL,反应步骤为16℃孵育30分钟,42℃反应30分钟,85℃孵育5分钟。
2.3.2 siRNA表达的检测。
检测采用两种方法,Real-time PCR方法和Northern Blot方法。
(i)Real-time PCR方法如实施例1所述。
如图2A所示,图2A是qRT-PCR检测转基因生菜中siR516和siR467的绝对表达量柱形图,其中野生型代表野生型植株;amiR516代表转化siR516的转基因生菜;amiR467代表转化siR467的转基因生菜。检测结果表明,转化植株中成功检测到siR516和siR467的表达,siR516、siR467可以在植物体内成功表达。
(ii)Northern Blot方法
1)15%尿素变性聚丙烯酰胺胶液的配置
将以上混合物混合,42℃加热至融化均匀;
10%APS 75ul
TEMED 15ul
混合均匀后灌胶,37℃凝固至少30min;每块胶约15ml,灌好后在室温凝固30-60min;
2)预电泳:0.5X TBE作为电泳液,250V 120min;
3)样品处理:等体积的RNA样品与1X RNA loading buffer(formamide loading buffer)混合,95℃5min变性后,迅速放入冰浴中;95℃5min变性后,迅速放入冰浴中;
4)电泳:0.5X TBE作为电泳液,250V 40min,至溴酚蓝距胶底2cm处;
5)转膜:用0.5X TBE把半干式转膜仪擦拭干净,并把剪好的尼龙膜(Hyhord-N+nylon membrance),滤纸在0.5X TBE中浸润,将“三明治”结构按如下顺序放好,250mA转膜1h;
6)紫外交联:转膜结束后,将膜取出。要保持膜的湿润性,然后放在紫外交联仪中,12000mj交联1min,有RNA一面朝上;
7)烘干:把膜放在滤纸上,在烘箱中80℃烘30min至干。室温至少可保存一个月。
8)杂交反应:浸润转移后的尼龙膜;用2X SSPE浸润准备好的尼龙膜;预杂 交:将浸润过的膜放于杂交瓶中,有RNA的一面向中心卷起,加入15ml预杂交液(即church buffer)进行预杂交,37℃,最低转速,预杂交1h;准备杂交液:杂交反应液中primer有两种,一种是RNA Marker的primer,另一种是所要检测small RNA的primer;杂交液组成:20ul体系:10X reaction buffer,2.0ul;dH2O,6.5ul;Primers,1.5+1.5ul;32P-ATP,7.0ul;T4PNK(T4多核苷酸激酶),1.5ul。上述杂交液加好后,放于37℃水浴30min;
上述反应结束后,进行杂交液的纯化(过柱的方法:GE Healthcare illustric Microspin G-50columns,货号:27-5330-01)
9)洗膜:杂交结束后,将杂交瓶中的杂交液倒入32P废液回收瓶中,然后加入30ml的2×SSPE洗膜buffer,剧烈震荡清洗,然后同样倒入32P废液回收瓶中;向杂交瓶中再次加入30ml2×SSPE洗膜buffer,在杂交仪中以最大转速洗膜2min;然后重复此步骤再次洗膜一遍。用保鲜膜将洗好的膜包裹,正面向上放于曝光盒中以待曝光;
10)曝光:直接加底片于准备好的膜上,贴上荧光标签,并将暗盒放于-80℃曝光至少一天(24-48h)。
siR516和siR467的表达水平如图2B和2C所示。其中,野生型代表野生型植株;516-1、516-2、516-5、516-7、516-10、516-10、516-12、516-13代表T1代不同的转基因植株;21nt代表所表达siR516和siR467的长度;rRNAs作为内参照;Marker代表microRNA分子量标记;图2C中分别表示所提取的转基因生菜中的总RNA的上样量及合成的阳性对照siRNA的上样量。
从图2B和2C中可以看出,生菜表达siRNA的体系比较完善,转化效率很高,同时转基因生菜中siRNA的表达量也很高,siR467表达量可达0.1pmol/20ug total RNA。
结果表明,siR467的转化效率比siR516高3倍。
实施例3、转基因生菜表达的HBV siRNA能有效抑制细胞中HBsAg基因的表达
为研究生菜中表达的目的siRNA功能,本发明首先在细胞水平进行实验。
实验方法:
提取生菜小RNA;经转染进入HepG2细胞后,检测细胞内siRNA的含量(图3A,B);然后研究检测生菜表达的目的siRNA进入细胞内后,对HBsAg基因的表达的影响。
使用HBsAg表达质粒转染HepG2细胞,用合成的siRNA、生菜表达的siRNA处理的细胞系,利用Real-time PCR方法检测细胞内siRNA的含量、HBsAg mRNA的含量。具体操作如实施例1所述。
实验结果:
细胞内siR516/amiR516表达的结果如图3A所示。
结果显示,转染后用合成的siR516和生菜表达的siR516(amiR516)处理的细胞系,细胞内siR516的含量明显升高;加入siR516抑制剂后,细胞内siR516的含量明显恢复到对照组水平。
结果表明,无论是合成的还是生菜表达的siRNA都能够有效转染进细胞内,形成抑制靶基因的干扰RNA。
细胞内siR467/amiR467表达的结果如图3B所示。
结果显示,转染后用合成的siR467和生菜表达的siR467(amiR467)处理的细胞系,细胞内siR467的含量明显升高;加入siR467抑制剂后,细胞内siR467的含量明显恢复到对照组水平。
结果表明,无论是合成的还是生菜表达的siRNA都能够有效转染进细胞内,形成抑制靶基因的干扰RNA。
对HBsAg的抑制效果如图3C、3D所示。
结果显示,生菜表达的siR516(amiR516)能有效抑制HBsAg基因的表达,并且加入siR516抑制剂后,能够恢复HBsAg基因的表达。
结果表明,靶基因表达的下降是由HBV siRNA引起的。
结果显示,生菜表达的siR467对HBsAg基因表达能有效抑制,进一步加入siR467抑制剂后能够恢复HBsAg基因的表达。
结果表明,靶基因表达的下降确实是由所设计表达的HBV siRNA引起的。
实施例4、转基因生菜表达的HBV siRNA能有效抑制小鼠肝脏中HBsAg基因的表达
为进一步验证生菜表达的HBV siRNA的功能,本发明进行了HBV转基因小鼠体内实验。
4.1乙型肝炎病毒(HBV)转基因小鼠模型的制备与鉴定
制备显微注射的基因片段:
利用分子克隆方法,将HBV全基因组克隆至骨架载体pBR322质粒(购自Promega公司),并扩增纯化;
显微注射和移植受精卵:
低倍镜下用注射针吸入适量的DNA注射液,并将小鼠受精卵移于M2培养液液滴中。高倍镜下,用注射针尖瞄准受精卵雄原核,迅速刺入其中。缓慢注射DNA液约1pl,可见雄原核膨胀,迅速抽出注射针。依次注射每个卵细胞。立即将注射后的受精卵移入M16培养液中,CO2孵育箱中培养30分钟。再将受精卵从M16培养液中移于M2培养液中,吸入移卵管,在解剖镜下找到输卵伞开口,将移卵管插入伞部后将 卵吹入。手术完毕后缝合切口。
转基因小鼠的整合检测:
小鼠出生后10~15d,剪下约1cm的鼠尾,提取DNA。用HBV基因组特异性引物进行扩增,并将扩增产物用低熔点琼脂糖凝胶电泳回收,然后用基因分析仪进行DNA测序分析,以便确认HBV基因是否成功转入小鼠体内,选取HBV基因整合入基因组的小鼠。
转基因小鼠血清乙肝病毒DNA(HBV-DNA)的检测:
取1月龄仔鼠,切开尾部动脉取血,处理并收集血清,血清以2000×离心10分钟,PEG沉淀过夜,再用裂解液(含蛋白酶K 100~g/m1)重新悬浮,并50℃孵育3小时,最后酚、氯仿抽提,乙醇沉淀得血清HBV DNA。利用Real-time PCR方法检测血清HBV DNA水平。
转基因小鼠血清乙型肝炎表面抗原(HBsAg)的检测:
取2月龄仔鼠,切开尾部动脉取血,按照操作(4)收集血清。利用常规的时间分辨荧光免疫分析法检测小鼠血清中乙型肝炎表面抗原(HBsAg)水平。
在构建的转基因小鼠血清中,检测到HBV-DNA,且HBV在小鼠血清中分泌HBsAg,说明HBV转基因小鼠模型建成。选取出建模成功的HBV转基因小鼠,用于后续实验。
4.2喂食转基因小鼠,检测小鼠肝脏中HBsAg基因的表达
按照1000g新鲜生菜煮至500ml汁的比例,将新鲜生菜煮汤,制备好的生菜汁暂存于4℃备用;
amiR516实验分为4组,分别为未处理组,野生生菜处理组,amiR516(表达HBV siR516的生菜处理组)和amiR516+抑制剂(表达HBV siR516生菜和siR516的抑制剂同时处理的实验组)。未处理组不做任何处理;野生型,amiR516和siR516+抑制剂三组则用上述制备的相应的生菜汁替换HBV转基因小鼠的日常饮用水,连续喂食生菜汁一周,每天每只小鼠饮食4-5ml生菜汁。
amiR467实验分组同amiR516实验。
利用Real-time PCR检测喂食小鼠转基因生菜后及siR516抑制剂后,小鼠肝脏中HBsAg mRNA表达水平。具体操作步骤如实施例1所述。
利用Western Blot检测喂食小鼠转基因生菜后及siR516抑制剂后,小鼠肝脏中HBsAg蛋白表达水平。具体操作步骤如实施例1所述。
实验结果:
对HBsAg的抑制效果如图4A、图4B、图4C、图4D、图4E、图4F、图4G、图4H和图4I所示。
结果显示,未处理组和喂食野生生菜处理组相比,喂食amiR516生菜和amiR467 生菜后,小鼠肝脏中HBsAg基因的表达均有一定程度的下降。由此说明,生菜表达的amiR516和amiR467均能有效抑制HBsAg基因的表达。
综上,结果表明,生菜表达的HBV siR516和siR467均能有效抑制HBV转基因小鼠中HBsAg的表达。
实施例5、转基因生菜表达的HBV siRNA能有效缓解由HBV引起的小鼠肝脏病变
本实施例通过一个月长期喂食实验,证明生菜表达的siR516(amiR516)或siR467(amiR467)能有效缓解由HBsAg基因引起的小鼠肝脏病变。
实验方法:
按照1000g新鲜生菜煮至500ml汁的比例新鲜生菜煮汤,制备好的生菜汁暂存于-20℃以备用;
amiR516实验分为4组,分别为未处理组,野生生菜处理组、amiR516(表达HBV siR516的生菜处理组)和amiR467(表达HBV siR467的生菜处理组)。未处理组不做任何处理,野生生菜处理组、amiR516和amiR467三组则用上述制备的相应的生菜汁替换HBV转基因小鼠的日常饮用水,每天每只小鼠大约饮食4-5ml生菜汁,连续喂食生菜汁一个月。
连续喂食小鼠一个月后,去小鼠肝脏,进行HE染色,制作石蜡切片观察小鼠肝脏组织及细胞的病理状态。
实验结果:
结果如图5所示。结果显示,与野生型小鼠相比,HBV转基因小鼠肝脏细胞具有明显的脂肪病变,细胞内可见明显的小脂肪颗粒,且细胞形态明显发生变形。喂食野生型生菜的HBV转基因小鼠与转基因小鼠形态类似,呈现明显的脂肪化细胞变形,但是喂食HBV siRNA转基因生菜的实验组肝脏及细胞形态呈现明显的好转,未见脂肪化细胞变形,且细胞形态较好,呈放射状索围中央静脉。
结果表明,转基因生菜表达的HBV siRNA(siR516或siR467)均能有效缓解由HBV引起的小鼠肝脏病变。
在本发明提及的所有文献都在本申请中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
- 还没有人留言评论。精彩留言会获得点赞!