微流控培养装置及应用其培养细胞或微生物的方法与流程
本发明涉及微流控和生物细胞培养领域,具体来说,涉及微流控培养装置及应用其培养细胞或微生物的方法。
背景技术:
在自然界中,存在许多气液界面交替分布的微环境,如土壤间隙、湖泊和海洋,人类的支气管等。一些微生物和细胞如丝状真菌、放线菌、藻类、支气管上皮细胞等在气液界面表现出与环境相适应的特殊的分化形态。天蓝色链霉菌(Streptomyces coelicolor)是存在于土壤中的丝状细菌,有着复杂的生命周期,成为研究多细胞分化的模式原核生物(K.et al.Streptomyces morphogenetics:dissecting differentiation in a filamentous bacterium.Nature Rev.Microbiol.2009.7(1):p.36-49),全基因组测序已经完成。链霉菌能够产生一系列复杂的次级代谢产物,如抗生素、抗肿瘤制剂、免疫抑制剂等(S.D.Bentley,et al.Complete genome sequence of the model actinomycete Streptomyces coelicolor A3(2).Nature.2002.417(6885):p.141-7.),次级代谢产物分泌的起始往往与菌丝的分化相一致。因此,研究链霉菌的生长分化对次级代谢产物的产生、应用具有重要的指导意义。
传统实验室所用的丝状真菌及放线菌的培养观察方法主要是平板插片法,其主要缺陷在于无法实时动态地观察生物体生长发育的过程,且操作较为复杂,无法对其生长条件进行精确的控制。
微流控学(Microfluidics)是利用微米尺度的通道网络来操纵皮纳升体积流体的科学与技术。微流控芯片可以对极微量样品和试剂进行处理和分析,实现高分辨率、高灵敏度的分离和检测,成本低,缩短分析时间(G.M.Whitesides,et al.The origins and the future of microfluidics.Nature.2006.442(7101):p.368-373)。在微流控芯片上进行功能单元集成的芯片实验室(Lab-On-a-Chip)技术应用于生物学研究可以使复杂的实验流程简单化, 大幅度减少样品体积,减少试剂的消耗,从珍贵的样品中获取尽可能多的信息,规模化的处理和检测大批样品,对细胞微环境的时空变化提供更大的控制性和预见性(E.K.Sackmann,et al.The present and future role of microfluidics in biomedical research.Nature.2014.507(7491):p.181-189)。
利用微流控芯片进行微米尺度气液界面的控制需要对气液界面张力和微结构进行精确的设计和控制。难点在于对于液面的定位控制。对于放线菌等具有气液界面分化的细胞生物学研究,曾有报道利用皮升体积的液滴高通量的培养和筛选来自土壤的放线菌(E.Zang,et al.Real-time image processing for label-free enrichment of Actinobacteria cultivated in picolitre droplets.Lab Chip.2013.13(18):p.3707)。目前还未见用于实现气液界面分化生长和孢子收集的微流控装置的报道。
技术实现要素:
本发明提供了一种微流控培养装置及应用其培养细胞或微生物的方法,可用于培养细胞或微生物在气液界面分化生长并可观察其生长情况。
本发明的一个方面,提供一种微流控培养装置,包括基片和盖片,所述盖片一面开设有凹槽,所述盖片设有凹槽的一面盖设在所述基片之上;
所述基片的上表面与所述盖片的凹槽之间形成液体输送通道、气体输送通道及气体腔室,所述气体腔室环绕所述液体输送通道设置,所述液体输送通道与所述气体输送通道通过所述气体腔室相连通,所述液体输送通道与所述气体腔室之间设有用于限制液体流出所述液体输送通道的围堰;
所述气体输送通道开设有与外界相连通的通气孔及排气孔;所述液体输送通道开设有与外界相连通的输液孔及排液孔;
所述液体输送通道开设有培养微室。
以上所述的微流控培养装置,所述围堰结构环绕所述培养微室以及所述液体输送通道设置,所述围堰的顶部距离所述基片上表面0.5μm至5μm。
以上所述的微流控培养装置,所述气体腔室的高度为0.5μm-1mm。
以上所述的微流控培养装置,所述培养微室在所述液体输送通道的两侧或一侧阵列分布。
以上所述的微流控培养装置,所述培养微室与所述液体输送通道连通 的一侧的口径逐渐缩小。
以上所述的微流控培养装置,所述培养微室内可容纳的溶液体积为0.01nL~100μL。
以上所述的微流控培养装置,所述液体输送通道的长度为5mm~200mm,通道的宽度为50μm-10mm,深度为10μm-1mm。
以上所述的微流控培养装置,所述气体输送通道的宽度为50-10mm,深度为10μm~2mm。
以上所述的微流控装置,设有可用于观察所述培养微室与所述气体腔室连接部分的结构。
以上所述的微流控装置,所述盖片与所述基片为可拆卸连接。
本发明的另一个方面,提供一种可观察细胞或微生物在气液界面生长分化的培养方法,包括如下步骤:
a)细胞或微生物悬液接种于液体输送通道或培养微室:将细胞或微生物悬液从以上任一所述的装置的输液孔注入所述液体输送通道及所述培养微室中,细胞或微生物在培养微室内芯片上贴壁或者悬浮生长;
b)通入培养基:将细胞或微生物培养所需的液体培养基通过所述输液孔注入所述液体输送通道;
c)通入气体:将细胞或微生物培养所需的气体通过通气孔注入气体输送通道和气体腔室;对于依靠空气即可生长的细胞或微生物不做通气处理;
d)细胞或微生物生长发育过程实时的观察与记录:引入所述培养微室的细胞或微生物在所述培养微室中生长,长到一定阶段后在所述培养微室与所述气体腔室的气液界面进行分化,细胞或微生物的气生部分会长入所述气体腔室中,观察记录生长情况。
本发明提供的微流控装置可以容纳细胞或微生物在装置的液体输送通道以及培养微室中,通过液体输送通道持续供应液体培养基,使细胞或微生物可在充足的营养供应下,持续生长和发育分化。在液体输送通道和培养微室周围的气体腔室中充满空气或培养所需的特殊配比气体,细胞可通过培养微室边缘的围堰与基片间的空隙穿过气液界面,在气体腔室中生长,完成其完整的气生发育分化过程。微流控装置可采用透明的玻璃、有机玻璃、聚碳酸酯等材质,方便利用光学显微镜进行成像,实现细胞或微生物 完整生命周期的观察;可以通过对培养基进行精确的调节和控制,通过改变不同碳源、氮源、pH值或测试用的液体以及不同气体的条件,研究液体及气体对细胞或微生物生长分化的影响。
本发明的装置在细胞或微生物培养成熟后还可以通过液体输入通道通入戊二醛等固定液,对细胞进形态固定,打开盖片,利用电子显微镜对细胞或微生物进行高分辨率形态学分析与纳米级表面结构分析。
附图说明
图1为本发明实施例1提供的微流控培养装置结构示意图;
图2是本发明的微流控培养装置沿图1的A-A方向的纵剖图;
图3是本发明图2所示的微流控培养装置中细胞或微生物生长情况示意图;
图4是本发明实施例1的实验流程示意图;
图5为本发明实施例1的微流控培养装置实物的微室及液体输送通道中充满色素溶液的显微放大照片;
图6A为本发明实施例1的微流控培养装置的微室中天蓝色链霉菌0小时生长的明场显微成像观察;
图6B为本发明实施例1的微流控培养装置的微室中天蓝色链霉菌培养20小时生长的明场显微成像观察;
图6C为本发明实施例1的微流控培养装置的微室中天蓝色链霉菌培养45小时生长的明场显微成像观察;
图7是本发明实施例2的微流控培养装置的结构示意图;
图8为本发明实施例2的微流控培养装置的局部放大图;
图9为本发明实施例2的微流控培养装置的实物图。
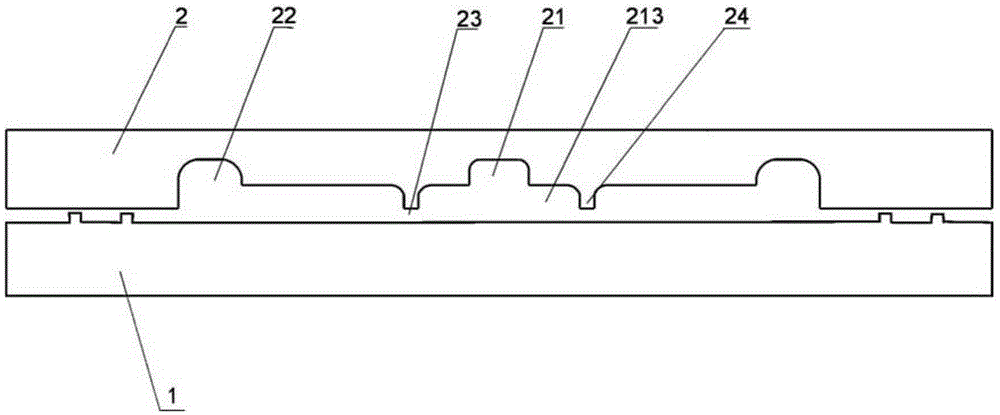
以上附图中,1为基片,2为盖片;
21为液体输送通道,211为输液孔,212为排液孔,213为培养微室;
22为气体输送通道,221为通气孔,222为排气孔;
23为气体腔室;
24为围堰;
25为第二液体输送通道。
具体实施方式
以下结合附图和实施例,对本发明的具体实施方式进行更加详细的说明,以便能够更好地理解本发明的方案以及其各个方面的优点。
下述实施例中所使用的实验方法如无特殊说明,均为常规方法。
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
实施例1
图1所示,本发明实施例1的微流控装置的结构示意图,包括基片1和盖片2,盖片2一面开设有凹槽,盖片2设有凹槽的一面盖设在基片1之上。
基片1的上表面与盖片2的凹槽之间形成液体输送通道21、气体输送通道22及气体腔室23,气体输送通道22环绕液体输送通道21设置,液体输送通道21与气体输送通道22通过气体腔室23相连通。液体输送通道宽度为500μm,长度为20mm,深度为40μm。
本实施例中基片1与盖片2之间设有微柱组成的阵列,是许多个长宽为50μm,高为1.5μm的微柱,可以起到支撑盖片2的作用,在基片1与盖片2之间形成一个1.5μm的狭缝,即形成了气体腔室23。
气体输送通道22开设有与外界相连通的通气孔221及排气孔222;液体输送通道21开设有与外界相连通的输液孔211及排液孔212,输液孔211的直径为0.8mm。溶液接口直径为0.6mm左右,能够直接与连接外径0.8mm的特氟龙泵管的注射器通过泵管连接。
液体输送通道21开设有培养微室213,培养微室213的长度为150μm,宽度为100μm,最大高度为15μm,培养微室213与液体输送通道21相连接的一侧口径逐渐缩小。
微流控装置的基片1和盖片2均为玻璃(全氟硅烷化)材质,整体透明,便于观察记录。
本实施例中的基片1和盖片2表面均做了硅烷化处理,表面疏水,溶液表面张力较大,表面疏水化处理及培养微室213缩小的口径保证溶液能被保留在培养微室内的围堰区域之内,不存在泄漏。培养微室213的规格没有固定要求,可根据要培养的细胞进行调节。培养微室213缩小的口径 还可以保证细胞在微室中生长时不受输送通道中液体流动所产生的剪切力的影响。
本发明的微流控装置使用的简要步骤如图4所示,主要包括:
细胞或微生物悬液接种于微室:选取天蓝色链霉菌A3(2)作为模式菌株。天蓝色链霉菌具有复杂的生命周期,包括机基内菌丝、气生菌丝及孢子丝阶段,是研究多细胞分化的模式生物。将A3(2)从固体平板中刮下,置于MM(Minimal Medium)培养基中,用棉花过滤掉气生菌丝,只剩下孢子,测量OD=0.1左右,制成孢子悬液;用10μL移液器吸取孢子悬液从输液孔211注入到液体输送通道21及培养微室213中,随后从排液孔212将通道中的溶液吸出,培养微室213由于具有收口构型,液体输送通道内的液流对微室内的冲激作用微弱,可保留引入的链霉菌孢子。
通入培养基:将液体培养基装载到1mL的注射器中,并将注射器固定到可编程控制的注射泵上,以100nL/min的速度将液体培养基注入液体输送通道21中,持续72小时。
通入气体:本实施例中的气体为空气,由于空气的扩散速度很快,只需保持空气通入通道的入口敞开,即可保证气体微室内气生菌丝的生长。
天蓝色链霉菌生长发育过程实时观察与记录:将微流控装置放置于显微镜恒温培养罩内,通过倒置荧光显微镜观察链霉菌的生长情况,并连续拍照记录。图6A为0小时:在培养微室成功接种单个天蓝色链霉菌的孢子(白色箭头所指)。图6B为20小时:孢子经过20小时的生长,长出了基内菌丝(白色箭头所指);图6C为45小时:溶液菌丝透过围堰结构,向空气微室中生长出气生菌丝和孢子丝(白色箭头所指)。利用本微流控芯片,可以清楚地观察到天蓝色链霉菌在不同阶段的完整的生长发育情况。
需要说明的是,当细胞或微生物生长成熟时,可通过溶液输入通道21打入戊二醛,对菌丝进行固定,再将微流控装置的盖片打开,利用电子显微镜观察细胞和微生物的高分辨率结构或表面细微结构。
为了进一步说明以上微流控装置的操作,图5展示了本发明实施例1的微流控装置的实物图。通道内通入红色素溶液。
需要说明的是,可以根据需要向液体输送通道中注入不同成分的培养基,研究不同的碳源、氮源、无机盐离子及pH对原核或真核细胞生长分化 的影响。
也可以根据需要向气体输送通道注入不同成分的气体,研究氧气、二氧化碳等气体对细胞或微生物生长分化的影响。
实施例2
本发明也可以实现多次气液交替界面的控制,以实现对自然环境中的土壤等复杂相界面中微生物和细胞生长状态的模拟。图7是本发明的实施例2的结构示意图。
装置的通道结构与实施例1类似,从中间较宽的液体输送通道21入口处通入放线菌孢子悬液,并持续流入培养基,在第二液体输送通道25中可以通入培养基或含有其他不同组分的溶液,需要说明的是,第二液体输送通道25可以根据需要设有多个,各液体输送通道周围设置有与实施例1结构相同的围堰,以避免通道内的液体漏出,第二液体输送通道25外侧还设置了气体输送通道22,各液体输送通道之间形成气体腔室23,并通过气体腔室23分隔开,形成多个气液界面的交替分布。孢子在培养微室213中生长发育,长出基内菌丝,接触到空气后分化为气生菌丝,再次遇到培养基后可以长入其中,并发生可逆分化。通道的宽度范围是200μm-1000μm。周围的液体通道宽度为100μm,培养微室213长度为350μm,宽度为200μm,最大高度为15μm。
利用第二液体输送通道25,可以在气生菌丝发育分化到一定阶段后,通入培养基、水、重金属溶液、有机油性液体或其它试剂溶液,观察放线菌的气生菌丝在遇到不同液体时的生长分化行为。本方法的优势在于,可以连续创造多个气液界面,并可对溶液成分进行精确控制,实时观察放线菌的生长行为。
图9是本发明的实施例2的微流控装置的实物图,为了演示功能,其中液体输送通道21以及培养微室213通入红色色素溶液、第二液体输送通道25通入了绿色色素溶液。在各液体输送通道之间,为气体腔室。
最后应说明的是:显然,上述实施例仅仅是为清楚地说明本发明所作的举例,而并非对实施方式的限定。对于所属领域的普通技术人员来说,在上述说明的基础上还可以做出其它不同形式的变化或变动。这里无需也 无法对所有的实施方式予以穷举。而由此所引申出的显而易见的变化或变动仍处于本发明的保护范围之中。
- 还没有人留言评论。精彩留言会获得点赞!