一种黑曲霉批发酵生产葡萄糖酸钠的方法与流程
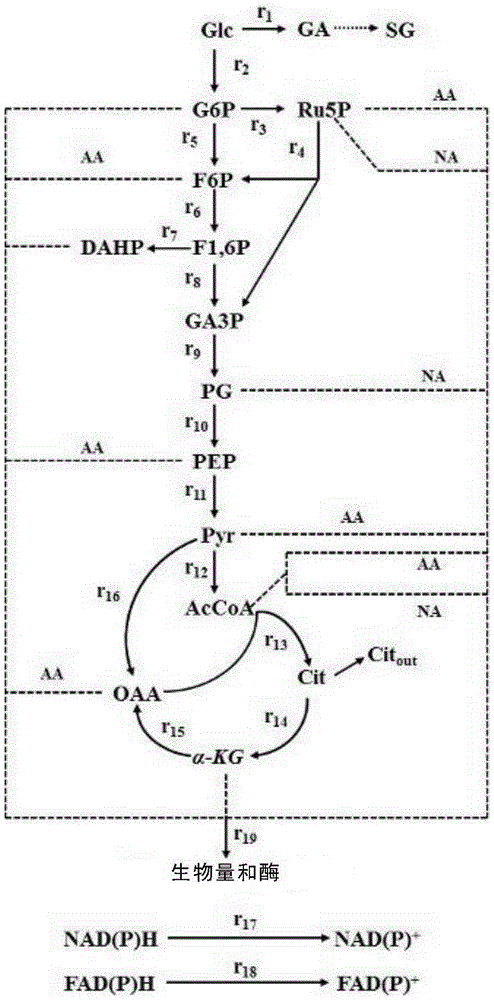
本发明属于生物工程领域,更具体地,本发明涉及一种黑曲霉批发酵生产葡萄糖酸钠的方法。
背景技术:
:葡萄糖酸钠又称为D-葡萄糖酸钠,分子式C6H11NaO7。其外观为白色结晶颗粒或粉末,极易溶于水,略溶于酒精,不能够溶于乙醚。作为多功能的生物材料,葡萄糖酸钠被广泛应用于食品、药品、以及建筑行业中。其可以在建筑、纺织印染和金属表面处理以及水处理等行业作高效螯合剂,钢铁表面清洗剂,玻璃瓶清洗剂,电镀工业铝氧着色,在混凝土行业用作高效缓凝剂、高效减水剂等。其还能够调节人体内酸碱平衡,以恢复神经正常作用,亦可基于同样目的用于食品添加剂。鉴于葡萄糖酸钠广泛的应用领域,需要大量地、高效地生产葡萄糖酸钠,以满足应用所需。工业上一般以含有葡萄糖的物质(例如谷物)为原料,采用发酵法先由葡萄糖制得葡萄糖酸,然后再由氢氧化钠进行中和,即可得葡萄糖酸钠,也可采用电解法和氧化合成,例如,可以采用化学氧化法-次溴氧化法生产合成。如果采用发酵方法,目前工业中较多地以黑曲霉为菌株,采用深层发酵法生产葡萄糖酸钠。但是,发酵法目前还存在葡萄糖酸钠产量不高,发酵时间长的问题,需要加以改良以提高发酵的效力。并且,目前现有技术中,关于葡萄糖酸钠的研究很多,但是没有任何研究是关于利用在线参数实时监控发酵过程。技术实现要素:本发明的目的在于提供一种黑曲霉批发酵生产葡萄糖酸钠的方法。在本发明的第一方面,提供一种提高黑曲霉菌生产葡萄糖酸钠产率的方 法,所述方法包括:在发酵培养黑曲霉菌生产葡萄糖酸钠的过程中,由起始发酵起逐渐提高供氧水平;并且,对黑曲霉菌增加有机氮源供给以缩短发酵延滞期,并降低磷元素供给以限制菌株过量生长。在一个优选例中,所述的对黑曲霉菌增加有机氮源供给和降低磷元素供给包括:在培养基中增加玉米浆,使得玉米浆浓度在0.1-0.3g/L;和在培养基中以KH2PO4和(NH4)2HPO4作为磷源,使得KH2PO4浓度0.1-0.3g/L,(NH4)2HPO4浓度0.1-0.3g/L。在另一优选例中,所述的培养基包括:在另一优选例中,所述的由起始发酵起逐渐提高供氧水平是:由转速300-350rpm起始逐渐提高供氧水平;较佳地,包括:起始发酵时控制转速300-350rpm;之后每隔1-2小时增加50-100rpm的转速;转速达到550-600rpm后,保持该转速至发酵结束。在另一优选例中,所述的由转速300-350rpm起始逐渐提高供氧水平包括:(1)起始发酵时控制转速为350rpm,维持2小时;(2)调整转速至450rpm,维持2小时;(3)调整转速至500rpm,维持2小时;(4)调整转速至550rpm,直至发酵结束。在另一优选例中,采用氧气的消耗速率(OUR)作为调控供氧的依据;采用二氧化碳的释放速率(CER)作为限制菌株过量生长的依据。在另一优选例中,利用呼吸商(RQ)来判断发酵过程的得率。在另一优选例中,黑曲霉菌生产葡萄糖酸钠的生产速率(rp)根据式(3)获得:式(3)中,OUR为氧气总消耗速率(包括菌体呼吸以及葡萄糖酸钠合成);OUR2为葡萄糖酸钠合成的体积氧消耗速率;CER为二氧化碳的释放速率;葡萄糖酸钠发酵的得率(Yp)根据公式(6)获得:式6中,RQ为发酵过程中菌体的呼吸商。在本发明的另一方面,提供一种用于黑曲霉菌发酵生产葡萄糖酸钠的培养基,所述培养基包括:在一个优选例中,所述的培养基中,包括:在另一优选例中,所述的培养基中还包括有效量的消泡剂;较佳地,消泡剂为0.15-0.25mL/L;更佳地为0.18-0.22mL/L。本发明的其它方面由于本文的公开内容,对本领域的技术人员而言是显 而易见的。附图说明图1、黑曲霉中葡萄糖至葡萄糖酸钠的生物转化。图2、黑曲霉合成葡萄糖酸钠的代谢网络。图中,各代号表示如下:AcCoA乙酰辅酶A;Glc葡萄糖;DHAP二羟丙酮磷酸;F6P6-磷酸果糖;FADH黄素腺嘌呤二核苷酸;GA3P3-磷酸甘油醛;G6P6-磷酸葡萄糖;GA葡萄糖酸;NA核酸;α-KGα-酮戊二酸;NADH烟酰胺腺嘌呤二核苷酸;NADPH还原型烟酰胺腺嘌呤二核苷酸磷酸;AA氨基酸;OAA草酰乙酸;PEP磷酸烯醇丙酮酸盐;PG3-磷酸甘油酸;Pyr丙酮酸;Cit柠檬酸;Citout胞外柠檬酸;Ru5P5-磷酸核酮糖;SG葡萄糖酸钠。图3、初始发酵F1中在线参数以及离线参数随着发酵时间变化图。图4、三种发酵在线参数随着发酵时间变化图:CER(A),OUR(B),DO(C),OUR2(D)和RQ(E)。图5、三种发酵离线参数随发酵时间变化图:DCW(A);P浓度(B);残糖浓度(C);葡萄糖酸钠浓度(D);柠檬酸浓度(E)。图6、三种发酵稳定期代谢通量比较:(A)发酵F1(22-24h);(B)发酵F2(22-24h);(C)发酵F3(8-10h)。图7、三种发酵(F1、F2和F3)稳定期根据在线参数和测量值计算的平均葡萄糖酸钠生产速率(A)和平均得率(B)。图8、三种发酵的kLa随时间变化(A)以及初始发酵(B)和最终发酵(C)时粘度随剪切率变化情况。具体实施方式本发明人经过深入的研究,找到了工业发酵生产葡萄糖酸钠的限制性因素,通过对供氧条件和培养基条件加以改良,成功地解决了这些限制性因素。同时,本发明人建立了实时监控黑曲霉批发酵生产葡萄糖酸钠的方法。本发明的方法极大地提高了葡萄糖酸钠的产率和得率,降低了发酵的总成本。本发明人由葡萄糖酸钠的工业发酵生产(山东福洋生物科技有限公司)开始,运用发酵罐尾气测定分析技术,准确地测定了发酵过程中的OUR、CER和RQ,发现了发酵过程中的限制性因素。所述的限制性因素主要体现在供氧条件以及培养基两个方面。基于上述发现,本发明提供了一种提高黑曲霉菌生产葡萄糖酸钠的产率方法,包括:在发酵培养黑曲霉菌生产葡萄糖酸钠的过程中,逐渐提高供氧水平;并且,对黑曲霉菌增加有机氮源供给和降低磷元素供给以限制菌株过量生长。作为本发明的优选方式,所述的对黑曲霉菌增加有机氮源供给和降低磷 元素供给包括:在培养基中增加玉米浆,使得玉米浆浓度在0.1-0.3g/L;和在培养基中以KH2PO4和(NH4)2HPO4作为磷源,使得KH2PO4浓度0.1-0.3g/L,(NH4)2HPO4浓度0.1-0.3g/L。用于黑曲霉菌发酵的培养基可以采用本领域技术人员已知的用于黑曲霉菌培养的培养基,只要在其中调整有机氮源及磷源至本发明所建议的水平即可。作为本发明的优选方式,还提供了一种用于利用黑曲霉菌发酵生产葡萄糖酸钠的发酵培养基,所述发酵培养基包括:葡萄糖、KH2PO4、(NH4)2HPO4、MgSO4和玉米浆。较佳地,所述的发酵培养基的用量如表1。表1用量较佳量葡萄糖300-350g/L310-340g/LKH2PO40.1-0.3g/L0.15-0.2g/L(NH4)2HPO40.1-0.3g/L0.12-0.2g/LMgSO40.15-0.25g/L0.18-0.22g/L玉米浆0.1-0.3g/L0.15-0.25g/L上述更佳含量的发酵培养基中,各组分在基本培养基中的含量还可以在±10%的范围内,更佳地±5%的范围内浮动。应理解,可以预期在一定范围内配方的调整仍然可实现所需的技术效果。上述列出的各组分均是本领域技术人员已知的组分,可以通过商业途径购买获得。作为本发明的优选方式,所述的发酵培养基中,还可以添加有效量的消泡剂,以有效地去除发酵过程中所产生的泡沫。本领域技术人员可以根据发酵罐内形成的泡沫的情况来添加消泡剂。当然,也可以采取在发酵过程中流加消泡剂的策略。作为本发明的优选方式,所述的消泡剂是聚醚型消泡剂。更优选地,消泡剂加入量为0.15-0.25mL/L;更佳地为0.18-0.22mL/L。作为较为优选的方式,所述的逐渐提高供氧水平包括:由转速300-350rpm起始逐渐提高供氧水平;更优选地包括:起始发酵时控制转速300-350rpm;之后每隔1-2小时增加50-100rpm的转速;转速达到550-600rpm后,保持该转速至发酵结束。更为优选地,所述的由转速300-350rpm起始逐渐提高供氧水平包括:(1)起始发酵时控制转速为350rpm,维持2小时;(2)调整转速至450rpm,维持2小时;(3)调整转速至500rpm,维持2小时;(4)调整转速至550rpm,直至发酵结束。除非另外说明,所述的转速是指发酵罐的搅拌转速。通过以上方式,本发明人对葡萄糖酸钠发酵过程中的供氧以及培养基进行了调整,显著地缩短了发酵周期,并且获得了较高的得率,很大程度地降低了葡萄糖酸钠发酵的成本。本发明的方法基于模仿工业发酵生产葡萄糖酸钠过程,因此,该方法适用于工业规模生产,例如20-10000L规模的发酵罐发酵;发酵罐也可以是30L、50L、60L、80L、100L、200L、500L、1000L或2000L等。基于本发明人的发现,本发明人还以发酵过程中的氧气的消耗速率(OUR)和二氧化碳的释放速率(CER)两个参数作为调控的关键因素,并据此建立了利用在线生理参数来实时计算发酵过程关键参数的公式。本发明人发现了原葡萄糖酸钠发酵过程(发酵F1)中的限制性因素(供氧问题以及培养基问题)。并且,根据黑曲霉工业发酵生产葡萄糖酸钠的特点,建立了利用在线生理参数来实时计算发酵过程关键参数的公式。在公式的基础上,建立了以关键生理参数实时监控葡萄糖酸钠发酵的新方法。在本发明的具体实施例中,为了消除发酵过程的限制性因素,在发酵F2和F3中,本发明人分别改进了发酵过程搅拌转速的控制方式和发酵的培养基组分。与初始发酵F1相比,发酵F3中葡萄糖酸钠的生产速率(16.58±0.91gL-1h-1)提高了104.2%。同时,由于更短的发酵周期(从34.0h降低至18.7h)、更低的菌浓(从5.25gL-1降低至1.47gL-1)以及更少的副产物(柠檬酸),发酵F3的总得率(0.943±0.012molmol-1)比初始发酵F1提高了近16.00%。在发酵F3中,更高的搅拌转速提高了发酵的氧传递速率(OTR),从而提高了葡萄糖酸钠 的合成速率。改进的发酵培养基移除了原发酵中的延滞期(0-6h),进一步缩短了发酵周期。此外,本发明人还发现,发酵F3中较低的菌浓有效地降低了原发酵F1中发酵液的粘度,从而使发酵液有利于氧传递,对葡萄糖酸钠发酵也有很好的促进作用。目前,本文中建立的新方法以及实验结果已经成功地应用到葡萄糖酸钠的工业生产中,极大地提高了葡萄糖酸钠的产率,降低了发酵的总成本。下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件如J.萨姆布鲁克等编著,分子克隆实验指南,第三版,科学出版社,2002中所述的条件,或按照制造厂商所建议的条件。I.材料和方法发酵设备本发明中所使用的种子发酵罐(15L)和发酵罐(50L)由国强生化装备有限公司制造。该发酵罐配备了多种电极以检测整个发酵过程。温度和pH分别由Pt100温度电极(Omega,USA)和玻璃pH电极(MettlerToledo)进行检测。溶氧(DO)由低漂移(MettlerToledo)极谱电极进行检测。发酵尾气组分是利用质谱仪(MS;MAX300-LGMassSpectrometer;Extrel,USA)进行实时的检测来计算OUR、CER和RQ。所有的数据都会被采集进实时的数据采集与计算软件(Biostar;国强生化装备有限公司)进行实时的监控与分析。菌株与培养基本发明所使用的黑曲霉菌株(CICC40350)由山东福洋生物科技有限公司提供。过程中总共使用了四种培养基。种子活化培养基:种子培养基:工业生产发酵培养基:改进的发酵培养基(用于发酵F3):以上所有培养基的初始pH均用NaOH调至7.0,然后在115℃灭菌20 分钟。以上培养基中,所用的消泡剂是:聚醚型消泡剂。分析方法葡萄糖用试剂盒进行测定。葡萄糖酸钠用高效液相色谱检测。菌体经滤纸过滤烘干后测定干重(DCW)。磷元素用钼酸铵比色法进行测定。发酵液粘度用转子粘度计(LVDV-ⅠPrime;Brookfield,USA)进行测定。在线生理参数的计算方法有关在线生理参数(OUR、CER以及RQ)的计算方法见文章:K.K.Ping,Z.J.Wang,F.Lu,etal(2015)Effectofoxygensupplyontheintracellularfluxdistributionandatwo‐stageOURcontrolstrategyforenhancingtheyieldofsodiumgluconateproductionbyAspergillusniger.JournalofChemicalTechnology&Biotechnology.Doi:10.1002/jctb.4741;和F.Lu,K.K.Ping,JChuetal(2015)EnhancinggluconicacidproductionbycontrollingthemorphologyofAspergillusnigerinsubmergedfermentation.ProcessBiochem.DOi:10.1016/j.procbio.2015.04.010。体积氧传递系数(kLa)用动态法进行计算,也参见上段所列举的文章。代谢流计算在本发明中,本发明人计算了三批批发酵在稳定期的代谢流。主要的代谢网络见图2。代谢流的计算方法见F.Lu,K.K.Ping,JChuetal(2015)EnhancinggluconicacidproductionbycontrollingthemorphologyofAspergillusnigerinsubmergedfermentation.ProcessBiochem.DOi:10.1016/j.procbio.2015.04.010。II.具体实施例实施例1、利用50-L发酵罐初模拟工业生产的初始发酵(发酵F1)种子培养:经活化培养基活化的孢子被接种至含有9L种子培养基的15L发酵罐中培养。通气比、温度和罐压分别控制在0.8vvm,38℃,和0.1MPa。pH用NaOH控制在5.5。发酵培养:种子培养18h后,取4.5L种子液转移至含有30L发酵培养基的50L发酵罐中进行培养。pH、温度和罐压控制与种子罐一致,通气比为1.2vvm。发酵F1的转速控制策略如表2所示,该发酵工艺模拟山东福洋生物科技有限公司的工业生产过程,采用工业生产发酵培养基。残糖浓度低于3gL-1时发酵结束。表2、发酵F1批发酵搅拌转速控制策略初始模拟工业生产的批发酵过程(发酵F1)的在线和离线数据如图3所示。过程中存在着近6h的延滞期(0-6h),在发酵前期(0-12h),氧气消耗速率(OUR)随着菌体生长(以二氧化碳的释放速率(CER)来表征)而提高,这说明在这段时间菌浓,也就是关键酶的酶活是发酵的限制性因素。12h以后,菌体继续生长,但是OUR不随之升高,说明限制性因素已转化为供氧,此时菌体的过量生长对发酵没有帮助。在16h提高转速,OUR有大幅度升高,同时耗糖速率与产葡萄糖酸钠速率均有显著提升。上述现象说明,发酵过程中存在着氧限制情况以及菌体过量生长情况,需要进一步优化来加以改善。实施例2、葡萄糖酸钠发酵过程限速因素的确定及公式建立如图1所示,黑曲霉代谢产生葡萄糖酸钠是由两种关键酶催化(葡萄糖氧化酶和过氧化氢酶)的酶反应过程。这两种酶被黑曲霉高效合成并被运输固定 至菌体细胞壁上,所以该酶反应是一个胞外反应。葡萄糖先被葡萄糖氧化酶催化形成葡萄糖酸内酯,副产物过氧化氢被过氧化氢酶催化形成氧气和水。葡萄糖酸内酯自发或者由内酯酶催化形成葡萄糖酸,葡萄糖酸在NaOH的作用下形成葡萄糖酸钠。从总反应式可以看出,每生成1mol葡萄糖酸钠,需0.5mol的氧气。根据前面实施例1的结果可见,氧限制是导致产葡萄糖酸钠速率不高的关键性因素,并且菌体过量生长也是不利因素。因此本发明人以促进氧气利用和菌体合理生长作为优化的关键,也即将发酵过程中的氧气的消耗速率(OUR)和二氧化碳的释放速率(CER)两个参数作为调控的关键因素。因此,本发明人首先根据黑曲霉发酵生产葡萄糖酸钠的特点,建立利用在线生理参数来实时计算发酵过程关键参数的公式。在发酵过程中,氧气的利用可以用如下反应式表示出来:细胞呼吸:C6H12O6+6O2→6CO2+6H2O(a)葡萄糖酸钠合成的酶反应:C6H12O6+1/2O2+NaOH→C6H11O7Na+H2O(b)根据反应式(a)和(b),氧气的利用分为细胞呼吸和葡萄糖酸钠合成两部分。发酵过程的OUR可以用公式(1)表示:OUR=OUR1+OUR2(1)其中,OUR1和OUR2(mmolL-1h-1)分别代表细胞呼吸和葡萄糖酸钠合成的体积氧消耗速率。菌体利用葡萄糖作为碳源进行维持时,OUR与CER(mmol/L/h)相等,所以公式(1)可以表示成:OUR=CER+OUR2(2)根据反应式(b),葡萄糖酸钠的生产速率(rp,g/L/h)可以表示成公式(3):葡萄糖酸钠发酵的得率(Yp)可以表示为公式(4):而呼吸商(RQ)可以表示为公式(5):所以公式(4)可以表示如公式(6):根据公式(3)以及公式(6),葡萄糖酸钠发酵中的关键参数生产速率(rp)和得率(Yp)可以用实时的在线参数(OUR、CER和RQ)进行表示。因此,在准确测量OUR、CER和RQ的基础上,葡萄糖酸钠发酵可以用这些生理参数进行实时地监控。简单的说,三个监控原则可以适用于葡萄糖酸钠发酵:发酵过程中CER可以用来表示菌体的生长以及活力,因为葡萄糖酸钠合成的酶反应不释放二氧化碳;更高的OUR2意味着更快的葡萄糖酸钠的生产速率;更低的RQ值意味着更高的得率。实施例3、改进的葡萄糖酸钠批发酵结果(发酵F2和F3)本实施例中,利用实施例2中建立的以关键生理参数实时监控葡萄糖酸钠发酵的新方法,进行改进的葡萄糖酸钠批发酵的发酵过程参数计算。鉴于实施例1中的发现,本发明人改进了发酵中转速的调控模式以根据发酵的需求来供氧(发酵F2)(表3)。发酵F2改善了发酵过程的供氧条件,其它条件同发酵F1,采用工业生产发酵培养基。以残糖浓度低于3gL-1时发酵结束。表3进一步地,为了缩短延滞期并防止菌体的过量生长,本发明人在调控供氧条件的基础上,还改变了发酵中的培养基的组分(发酵F3),采用“改进的发酵培养基”。与初始发酵F1相比,发酵F2改善了发酵过程搅拌转速的调控方式,而发酵F3进一步改变了发酵培养基。三种发酵的在线与离线数据对比如图4和图5所示。发酵最终结果对比如表4所示。发酵F1和发酵F2拥有相似的CER趋势以及DCW(图4A和图5A),最大值分别为6.85mmolL-1h-1和5.32gL-1,说明不同的转速对菌体生长影响不大。然而提高供氧后,发酵F2的发酵周期缩短至26.5h,同时相比发酵F1,发酵过程的OUR以及葡萄糖酸钠的合成速率更高(图4B和图5D),从而证明了之前关于发酵过程处于氧限制状态的假设。在初始发酵F1中,造成长延滞期的原因可能是原有发酵培养基缺少有机氮源,菌体不得不在延滞期内合成必须的氨基酸以及蛋白。为了缩短延滞期并且防止菌体的过量的生长,在改进的培养基中加入了少许的玉米浆,并且降低了p元素的浓度(图5B)。改进培养基后,有效地移除了延滞期,使发酵周期缩短至18.7h。OUR最高值可以达到55.85mmolL-1h-1,较初始发酵F1中OUR最高值提高了58.89%。能够表征葡萄糖酸钠生产速率的OUR2值随着菌体的生长而增值直到溶氧成为限制性因素(公式3、图4C和4D)。发酵F3拥有最大的OUR2值,同时耗糖速率以及产葡萄糖酸钠速率也是三种发酵中最高,说明在发酵F3中低菌浓(1.47gL-1)并不是限制性因素(图4D、图5C和5D)。低菌浓发酵在葡萄糖酸钠发酵中是可行的。除了更高的OUR和葡萄糖酸钠合成速率,发酵F3中的RQ也是最低的(图4E)。根据公式6,发酵F3拥有最高的得率。如表4所示,发酵F3中葡萄糖酸钠的浓度为316.8±4.8gL-1,比发酵F1和F2分别高了13.2%和8.2%。发酵F3的总得率高达0.943±0.012molmol-1,比初始发酵F1提高了16.00%。为了解释发酵F3得率高的原因,本发明人计算了发酵F1(22-24h),F2(22-24h)和F3(8-10h)稳定期时的代谢流,结果如图6所示。在高菌浓的发酵F1和F2中,糖酵解以及三羧酸途径的通量都较大,说明有更多的糖被用来进 行细胞生长和呼吸。除此之外,发酵F3中副产物柠檬酸的代谢通量最小,与图5E的结果一致。更高的OUR水平以及更低的菌浓降低了柠檬酸的产生。所以发酵F3拥有更高得率的原因可以概括为:更少的糖用于菌体生长以及呼吸;更短的周期,使用于细胞维持的糖更少;副产物更少。表4、三种发酵结果参数为了确定公式3和公式6的准确性,本发明人分别用在线参数和离线检测值计算了平均葡萄糖酸钠和得率。对比结果如图7所示,由于较高的菌浓以及柠檬酸含量,发酵F1和F2的计算值略高于测量值。而对于低菌浓发酵的发酵F3,计算值与测量值有很好的对应关系。所以,本发明中建立的公式3和公式6能够用来表征发酵过程中的产率和得率,特别是对于低菌浓发酵。实施例4、菌浓对发酵液粘度的影响虽然发酵F2和F3拥有相同的搅拌转速的控制策略,但是两种发酵的OUR和DO的变化趋势却相差很大(图4b和4c)。在发酵F2中,随着菌体的过量生长,OUR在达到最大值后有一个快速下降的过程,但是DO并没有升高,说明这段时间的供氧速率(OTR)有显著地下降。体积氧传递系数(kLa)能够用来表征OTR的大小。本发明人用动态法计算了三个发酵过程的kLa值,结果见图8a。拥有更高搅拌转速发酵F2和F3的kLa值大于发酵F1,而高菌浓发酵的发酵F1和F2在kLa达到最大值都有一个 快速下降的过程。下降的原因可能是由于菌体过量生长导致发酵液粘度的增加,从而不利于传氧。为此,本发明人测定了三种发酵初始和最终放罐时的粘度,结果如图8b和8c所示。三种发酵的初始粘度都是很低的(图8b),但是在发酵结束时,高菌浓的发酵F1和F2的粘度明显大于较低菌浓的发酵F3。由于高菌浓导致的高粘度降低了发酵液的传氧能力,从而使OUR以及产葡萄糖酸钠速率都有明显下降。因此,如发酵F3的低菌浓发酵是有优势的。结论在发明中,本发明人根据黑曲霉发酵生产葡萄糖酸钠的代谢特点,建立了以在线生理参数实时监控发酵过程的新方法。根据该方法,本发明人发现了工业发酵生产葡萄糖酸钠的限制性因素,并成功地解决了这些限制性因素,使葡萄糖酸钠的发酵周期由约34.0h缩短至约18.7h。且葡萄糖酸钠的产率提高了近一倍,得率也有大幅度的提高。并根据该方法,对整个发酵过程有了更好的认识,为进一步研究发酵过程提供了方法以及基础。预期该方法可成功应用到工业生产中,并由此产生很大的经济效率。在本发明提及的所有文献都在本申请中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1