一种多肽及其应用的制作方法
本发明涉及生物技术领域,具体涉及一种多肽,一种多肽疫苗及其应用。
背景技术:
糖尿病(diabetes mellitus)是由体内胰岛素相对或绝对不足,或靶细胞对胰岛素敏感性降低,或胰岛素本身存在结构上的缺陷而引起的体内碳水化合物、脂肪和蛋白质代谢紊乱的一种慢性疾病。据世界卫生组织最新公布数据显示,糖尿病已成为继心脑血管疾病、恶性肿瘤之后的第三大疾病。全球糖尿病患者目前已有3.66亿人,预计至2030年,这个数字将达到5.52亿,其中,二型糖尿病(T2DM)占患者总数的90%以上。我国已成为世界第一糖尿病大国,患病率为9.7%,患病人数达9200万,高于世界平均水平的6.4%。2010年,我国用于糖尿病的治疗费用高达250亿美元,相当于全国医疗总支出的13%。据估计全世界每分钟就有6人死于该病,T2DM已成为一个严峻的健康问题。
T2DM的特征是胰岛素抵抗和胰岛β细胞功能丧失甚至凋亡。肥胖伴随着慢性低水平的炎症状态,是引起T2DM的主要风险因素。研究表明,肥胖者通过激活NLRP3炎症小体,促进炎症因子IL-1β等的释放,阻断代谢级联反应及胰岛素信号转导,从而导致胰岛素水平相对失衡和活性相对丧失,即胰岛素抵抗。目前认为,高血糖,高水平游离脂肪酸,氧化应激,内质网应激,以及淀粉样蛋白沉积是诱发胰岛素抵抗和β细胞功能丧失从而导致T2DM的主要机理,而这些机理都与组织炎症密切相关。
炎症是机体应对损伤和微生物感染所产生的组织修复能力,是机体的一种自适应反应。IL-1β是调节机体炎症反应的关键炎症因子,在1、2型糖尿病、 类风湿性关节炎等许多自身免疫和代谢紊乱疾病的病理过程中都发挥着重要作用。IL-1β主要通过巨噬细胞产生,胰岛β细胞也能够产生和分泌IL-1β。在T2DM中,高血糖水平增强了胰岛β细胞的代谢活性,诱导胰岛β细胞产生大量的活性氧自由基(ROS),导致NLRP3炎症小体的异常激活,进而促进了IL-1β的大量合成和释放,IL-1β的自我刺激功能进一步扩大了炎症状态,形成了一种恶性循环。过量的IL-1β抑制胰岛素的信号转导,导致胰岛素抵抗;β细胞功能丧失和凋亡进一步导致脂肪组织、肝脏、骨骼肌和循环系统的功能紊乱。因而,阻断IL-1β将能够减少胰岛β细胞的炎症和机体系统炎症发生发展,增进胰岛素的分泌,提高胰岛素敏感性,降低高血糖,改善胰岛功能,是治疗T2DM的理想策略。
目前已经有4种基于阻断IL-1β治疗T2DM的免疫制剂进入临床研究,包括3种IL-1β单克隆抗体和一种以全长的IL-1β化学交联至噬菌体Qβ病毒样颗粒(Qβ-VLP)的表面制成的疫苗,它们是Xoma生产的Gevokizumab(XOMA 052)、Novartis生产的Canakinumab(ACZ885)、Lilly生产的LY2189102这3种IL-1β单抗和Cytos Biotech生产的IL-1β疫苗。这些制剂在临床试验阶段都表现出了较好的治疗作用,能够明显降低病人的血糖水平和增强胰岛素敏感性,保护胰岛功能,并且有效改善糖尿病及其并发症的发生发展。其作用机制在于阻断IL-1β并打断了其自身的恶性循环,纠正了过度激活的免疫系统。T2DM是一种能够导致全身多个器官发生慢性炎症的代谢疾病,这些基于阻断IL-1β治疗T2DM的免疫制剂不仅能够有效改善胰岛素抗性,同时能够改善多器官间的代谢循环,降低机体系统炎症,治疗并发症。但是,由于阻断了IL-1β的自循环,免疫制剂的剂量优化和疗程设计是需要首要考虑的问题。基于IL-1β的表位多肽制备的T2DM疫苗在最大程度上避免或降低了全长的IL-1β蛋白可能导致的急性毒性, 副作用较小,在T2DM等炎症相关的疾病治疗方面将具有广泛的应用前景。然而,该类疫苗尚未见报道。
技术实现要素:
本发明的目的在于提供一种多肽及其应用,特别是基于IL-1β的表位多肽制备的治疗T2DM的疫苗,其在最大程度上避免或降低了全长的IL-1β蛋白可能导致的急性毒性,副作用较小,在T2DM等炎症相关的疾病治疗方面将具有广泛的应用前景。
为达到此发明目的,本发明采用以下技术方案:
第一方面,本发明提供了一种多肽,所述多肽的氨基酸序列为SEQ ID NO.1所示的氨基酸序列。
氨基酸序列如下:
SEQ ID NO.1:VQGEESNDKESVDPKNYPKKKMEKRFVFNKIEINNKLEF。
本发明中,所述多肽由2部分合并组成,包括IL-1β前体蛋白的163-171位氨基酸构成的肽段VQGEESNDK,和199-228位氨基酸构成的肽段ESVDPKNYPKKKMEKRFVFNKIEINNKLEF。其中163-171位氨基酸组成的多肽模拟了全长IL-1β蛋白的免疫刺激活性,又不具有致炎性和毒性作用,199-228位氨基酸组成的多肽为主要抗原表位,不具有致热原性。
所述氨基酸为含有39个氨基酸的表位多肽,既保持了全长的IL-1β蛋白的免疫原性,又在最大程度上避免或降低了全长的IL-1β蛋白可能导致的急性毒性,又因为所述氨基酸可以能够明显降低IL-1β表达水平,降低血糖,改善血糖控制,增强胰岛素的分泌和胰岛素敏感性,改善胰岛功能,从而起到治疗二型糖尿病的作用。
第二方面,本发明提供一种DNA片段,其包含编码第一方面所述多肽的核苷酸序列。
第三方面,本发明提供一种重组载体,所述表达载体含有至少一个拷贝的如第二方面所述的DNA片段。
第四方面,本发明提供一种重组细胞,所述重组细胞含有第三方面所述的表达载体。
第五方面,本发明提供一种疫苗,所述疫苗包括第一方面所述的多肽和佐剂。
优选地,所述佐剂为铝佐剂和/或聚乳酸纳微球佐剂。
优选地,所述多肽与佐剂的体积比为(1-5):1,例如可以是1:1、2:1、3:1、4:1或5:1,优选为(2-4):1,进一步优选为3:1。
第六方面,本发明提供一种如第一方面所述的多肽,如第二方面所述的核苷酸序列,如第三方面所述的重组载体,如第四方面所述的重组细胞或如第五方面所述的疫苗在抑制IL-1β水平方面的应用。
第七方面,本发明提供一种组合物,所述组合物包括如第一方面所述的多肽,如第二方面所述的核苷酸序列,如第三方面所述的重组载体,如第四方面所述的重组细胞或如第五方面所述的疫苗。
优选地,所述组合物在制备检测、诊断和/或治疗二型糖尿病的药物中的应用。
本发明中,所述组合物能够控制血糖,增进胰岛素分泌,增强胰岛素敏感性,提高胰岛β细胞数量,促进β细胞增殖,减少β细胞凋亡,改善胰岛功能。
与现有技术相比,本发明具有以下有益效果:
(1)本发明多肽及疫苗能够明显降低IL-1β水平,降低血糖,改善血糖控制,增强胰岛素的分泌和胰岛素敏感性,改善胰岛功能;
(2)本发明多肽及疫苗既保持了全长的IL-1β蛋白的免疫原性,又在最大程度上避免或降低了全长的IL-1β蛋白可能导致的急性毒性,副作用较小,在二型糖尿病等炎症相关的疾病治疗方面具有广泛的应用前景。
附图说明
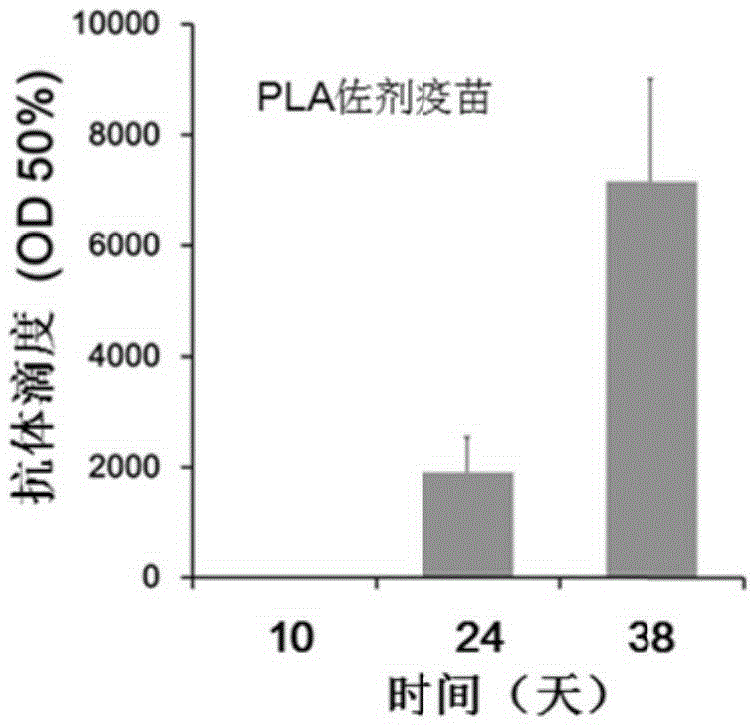
图1为本发明IL-1β表位疫苗诱导小鼠产生较高的抗体滴度,其中,图1(A)铝佐剂疫苗,图1(B)PLA微球佐剂疫苗;
图2为本发IL-1β表位疫苗降低KK-Ay小鼠血糖水平,其中,图2(A)铝佐剂疫苗,图2(B)PLA微球佐剂疫苗;
图3为IL-1β表位疫苗改善KK-Ay小鼠的糖耐量,其中,图3(A)铝佐剂疫苗的糖耐量实验的血糖值,图3(B)铝佐剂疫苗的糖耐量实验的曲线下面积,图3(C)PLA微球佐剂疫苗的糖耐量实验血糖值,图3(D)PLA微球佐剂疫苗的糖耐量实验曲线下面积;
图4为IL-1β表位疫苗增进KK-Ay小鼠的胰岛素分泌,其中,图4(A)铝佐剂疫苗的胰岛素水平,图4(B)铝佐剂疫苗的胰岛素刺激指数;图4(C)PLA微球佐剂疫苗的胰岛素水平,图4(D)PLA微球佐剂疫苗的胰岛素刺激指数;
图5为IL-1β表位疫苗增强KK-Ay小鼠对胰岛素的敏感性,其中,图5(A)铝佐剂疫苗的胰岛素抵抗指数,图5(B)铝佐剂疫苗的胰岛素耐量实验血糖水平,图5(C)铝佐剂疫苗的胰岛素耐量实验曲线下面积,图5(D)PLA微球佐剂疫苗的胰岛素抵抗指数,图5(E)PLA微球佐剂疫苗的胰岛素耐量实验血糖水平,图5(F)PLA微球佐剂疫苗的胰岛素耐量实验曲线下面积;
图6为IL-1β表位疫苗提高KK-Ay小鼠胰岛β细胞数量,其中,图6(A)小鼠胰脏组织切片的胰岛素染色,图6(B)胰岛β细胞比例的统计分析;
图7为IL-1β表位疫苗促进KK-Ay小鼠胰岛β细胞增殖,其中,图7(A)小鼠胰脏组织切片的胰岛素和Ki67染色,图7(B)胰岛β细胞增殖比例的统计分析;
图8为IL-1β表位疫苗降低KK-Ay小鼠胰岛β细胞凋亡,其中,图8(A)小鼠胰脏组织切片的胰岛素和TUNEL染色,图8(B)胰岛β细胞凋亡比例的统计分析;
图9为IL-1β表位疫苗降低KK-Ay小鼠IL-1β的表达水平,其中,图9(A)铝佐剂疫苗IL-1β的表达水平;图9(B)PLA微球佐剂疫苗IL-1β的表达水平。
具体实施方式
下面通过具体实施方式来进一步说明本发明的技术方案。本领域技术人员应该明了,所述实施例仅仅是帮助理解本发明,不应视为对本发明的具体限制。
下述实施例中所使用的实验方法如无特殊说明,均为常规方法。
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
下述实施例中的表位多肽由上海吉尔生化有限公司合成和纯化。
下述实施例中的小鼠由华阜康生物公司提供,所有小鼠为4周龄大的雄性KK-Ay小鼠,随机分为疫苗组(A1佐剂)、疫苗组(PLA微球佐剂)、佐剂对照组,每组8只,同时以8只年龄相同的雄性C57BL/6J小鼠作为对照组。
实施例1本发明表位多肽及其疫苗的制备
通过对IL-1β蛋白进行表位序列分析得到了本发明表位多肽,所述多肽的氨基酸序列为:SEQ ID NO.1: VQGEESNDKESVDPKNYPKKKMEKRFVFNKIEINNKLEF,通过全合成并纯化所述多肽。
疫苗(Al佐剂)组:表位多肽用PBS溶解后,与注射用铝佐剂以3:1的体积比吹打混匀。疫苗(PLA微球佐剂)组:用5mg/mL PLA与表位多肽混合,4℃混悬过夜。佐剂对照组:PBS溶液与佐剂以3:1的体积比吹打混匀。得到所述疫苗。
实验例2 IL-1β表位疫苗对小鼠抗体滴度的影响
以两周一次的间隔分别在第0、14、28天对小鼠进行皮下注射。疫苗组每只小鼠注射含50μg表位多肽的疫苗。佐剂对照组和C57对照组注射等体积的不含表位多肽的佐剂溶液。
抗体滴度测定:分别在首次免疫后的第10、24和38天尾静脉取血,将取出的血液于37℃静置2小时后,4000r/min离心5min,取上层血清,分装待用。
将100μL表位多肽包被96孔酶联免疫微孔板0.5μg/孔,BSA为阴性对照,置37℃2小时,以5%BSA 37℃封闭2小时,340μL/孔。以PBS洗板3次,加入以5%BSA梯度稀释的小鼠血清100μL,室温孵育1小时后用含有0.1%Tween-20的PBS洗涤6次。每孔加入HRP标记的山羊抗小鼠IgG 1:3000,室温孵育1小时后,用含有0.1%Tween-20的PBS洗涤6次。每孔加入底物溶液TMB100μL,放置37℃20min,然后每孔加入100μL 1mM硫酸终止反应,于酶标仪上测定OD450值。在相同的条件下重复三次,结果见图1。
实验结果如图1所示,佐剂对照组在首次免疫后的第10、24和38天的抗体滴度都为0;疫苗组(Al)在首次免疫后的第10、24和38天的抗体滴度分别是0、1960、9500;疫苗组(PLA)在首次免疫后的第10、24和38天的抗体滴度分别是0、1913、7167;表明IL-1β表位疫苗能诱导小鼠产生较高的抗体滴度。
实验例3 IL-1β表位疫苗对KK-Ay小鼠血糖水平的影响
血糖测量:以两周一次的间隔分别在首次免疫后第0、14、28、42天采小鼠尾尖血用罗氏血糖仪/活力型测量小鼠的空腹血糖值。
各组小鼠血糖值如图2(A)和2(B)所示,C57对照组在第0、14、28、42天的平均空腹血糖分别为4.0、4.4、4.6、4.7;佐剂对照组在第0、14、28、42天的平均空腹血糖分别为4.3、11.0、12.3、13.0;疫苗组(Al)在第0、14、28、42天的平均空腹血糖分别为4.3、9.7、8.7、8.5;疫苗组(PLA)在第0、14、28、42天的平均空腹血糖分别为4.3、8.1、8.8、9.1;实验结果表明,KK-Ay小鼠的血糖水平随着年龄的增长迅速升高,给予IL-1β表位疫苗能够明显降低KK-Ay小鼠的血糖水平。
实验例4 IL-1β表位疫苗对KK-Ay小鼠糖耐量的影响
糖耐量实验:首次免疫后的第42天,小鼠过夜禁食12小时后,腹腔注射40%浓度的葡萄糖溶液,剂量为2g/kg体重。分别在0、30、60、90、120和150分钟采尾尖血测量血糖值,并计算曲线下面积(AUC)。
实验结果如图3(A)和3(C)所示,在给予葡萄糖后,佐剂对照组小鼠的血糖水平迅速升高,而Al佐剂疫苗组和PLA微球佐剂疫苗组小鼠的血糖水平明显低于佐剂对照组小鼠,图3(B)和3(D)显示疫苗组的糖耐量曲线下面积也显著降低,表示IL-1β表位疫苗能够显著改善KK-Ay小鼠的血糖控制。
实验例5 IL-1β表位疫苗对KK-Ay小鼠胰岛素分泌的影响
在糖耐量实验的0和30分钟取血,分离血清,使用小鼠超敏感胰岛素ELISA试剂盒测定血清中胰岛素含量,计算胰岛素刺激指数。
胰岛素刺激指数=30分钟血清胰岛素水平(ng/mL)/0min血清胰岛素水平 (ng/mL)。实验结果如图4(A)和4(C)所示,30分钟时Al佐剂疫苗组和PLA微球佐剂疫苗组小鼠的胰岛素水平明显升高,而佐剂对照组小鼠的胰岛素水平没有明显变化。图4(B)和4(D)显示佐剂对照组的胰岛素刺激指数为1.2;疫苗组(Al)的胰岛素刺激指数为3.3;疫苗组(PLA)的胰岛素刺激指数为3.0;表明疫苗组小鼠的胰岛素刺激指数明显高于佐剂对照组。说明IL-1β表位疫苗能够增进KK-Ay小鼠的胰岛素分泌。
实验例6 IL-1β表位疫苗对KK-Ay小鼠胰岛素敏感性的影响
(1)胰岛素耐量试验:首次免疫后的第49天,小鼠禁食5小时后,腹腔注射人工合成胰岛素,剂量0.75U/kg体重,分别在0、30、60、90、120分钟采尾尖血测量血糖值,并计算曲线下面积(AUC)。
(2)根据小鼠空腹血糖值和胰岛素含量,计算胰岛素抵抗指数(HOMA-IR):
HOMA-IR=空腹胰岛素水平(ng/mL)×空腹血糖水平(mmol/L)
实验结果如图5(A)和5(D)所示,Al佐剂疫苗组和PLA微球佐剂疫苗组的HOMA-IR都明显低于佐剂对照组。在胰岛素耐量实验中,图5(B)和5(E)显示Al佐剂疫苗组和PLA微球佐剂疫苗组的血糖值也显著低于佐剂对照组,并且图5(C)和5(F)显示疫苗组的胰岛素耐量曲线下面积也显著降低,以上结果说明IL-1β表位疫苗能够增强KK-Ay小鼠对胰岛素的敏感性。
实验例7 IL-1β表位疫苗对KK-Ay小鼠胰岛β细胞的影响
(1)腹腔注射三溴乙醇300mg/kg麻醉小鼠,立即打开小鼠胸腔,以50mL预冷的PBS(PH7.4,含肝素10U/mL)进行心脏灌流,取胰脏组织,4℃多聚甲醛固定24h,石蜡包埋。石蜡切片厚度5μm,每10个切片取一个进行染色观察。
(2)将上述石蜡切片脱蜡,并于10mM pH 6.0枸橼酸钠缓冲液中沸水浴15 分钟后自然冷却至室温,然后应用10%的羊血清对切片进行封闭。
β细胞量检测:1:200稀释的胰岛素一抗37℃作用1小时,Alexa Fluor 488偶联的山羊抗豚鼠二抗室温避光作用1小时。
β细胞增殖检测:加入1:100稀释的Ki-67一抗和Alexa Fluor 594偶联的山羊抗兔二抗,按前述方法对胰岛素复染,最后加入DAPI染色,室温作用5min。
β细胞凋亡检测:应用试剂盒In Situ Cell Death Detection Kit,TMR red检测β细胞凋亡,按前述方法对胰岛素复染,最后加入DAPI染色,室温作用5min。
(3)应用荧光显微镜采集图像,应用软件ImageJ进行图像统计分析。
实验结果如图6(A)-(B)、图7(A)-(B)和图8(A)-(B)所示:
图6(A)-(B)可以看出,佐剂对照组KK-Ay小鼠胰脏中β细胞比例为0.78%;疫苗(Al佐剂)组KK-Ay小鼠胰脏中β细胞比例为1.81%;疫苗(PLA微球佐剂)组KK-Ay小鼠胰脏中β细胞比例为1.13%;
图7(A)-(B)可以看出,佐剂对照组KK-Ay小鼠胰脏中β细胞增殖比例为0.22%;疫苗(Al佐剂)组KK-Ay小鼠胰脏中β细胞增殖比例为0.42%;疫苗(PLA微球佐剂)组KK-Ay小鼠胰脏中β细胞增殖比例为0.38%;
图8(A)-(B)可以看出,佐剂对照组KK-Ay小鼠胰脏中β细胞凋亡比例为1.44%;疫苗(Al佐剂)组KK-Ay小鼠胰脏中β细胞凋亡比例为0.38%;疫苗(PLA微球佐剂)组KK-Ay小鼠胰脏中β细胞凋亡比例为0.60%。
以上结果表明,IL-1β表位疫苗能够明显提高KK-Ay小鼠的β细胞数量,促进β细胞增殖,并降低β细胞凋亡。
实验例8 IL-1β表位疫苗对KK-Ay小鼠IL-1β的表达水平的影响
取小鼠胰脏约50mg,应用RNeasy脂质组织试剂盒提取胰脏总RNA。应用 PrimeScrip RT-PCR试剂盒将所提总RNA逆转录为cDNA。使用SYBR Select Master Mix荧光探针试剂以及7500快速实时定量PCR仪检测IL-1β基因表达。GAPDH作为内参。
引物序列为:
IL-1β:5’-CAACCAACAAGTGATATTCTCCATG-3’和5’-GATCCACACTCTCCAGCTGCA-3’;
GAPDH:5’-TCCATGACAACTTTGGCATTG-3’和5’-CAGTCTTCTGGGTGGCAGTGA-3’。
结果如图9(A)-(B)所示,Al佐剂IL-1β表位疫苗和PLA微球佐剂IL-1β表位疫苗能够明显抑制KK-Ay小鼠胰脏组织中的IL-1β的表达。
综上所述,本发明的表位多肽能够明显抑制小鼠体内的IL-1β表达水平,降低血糖,改善血糖控制,增强胰岛素的分泌和胰岛素敏感性,改善胰岛功能,在二型糖尿病等炎症相关的疾病治疗方面有广阔的应用前景。
申请人声明,本发明通过上述实施例来说明本发明的工艺方法,但本发明并不局限于上述工艺步骤,即不意味着本发明必须依赖上述工艺步骤才能实施。所属技术领域的技术人员应该明了,对本发明的任何改进,对本发明所选用原料的等效替换及辅助成分的添加、具体方式的选择等,均落在本发明的保护范围和公开范围之内。
- 还没有人留言评论。精彩留言会获得点赞!