一种纯化氧化含二硫键多肽的方法与流程
本发明涉及一种多肽药物的纯化方法。
背景技术:
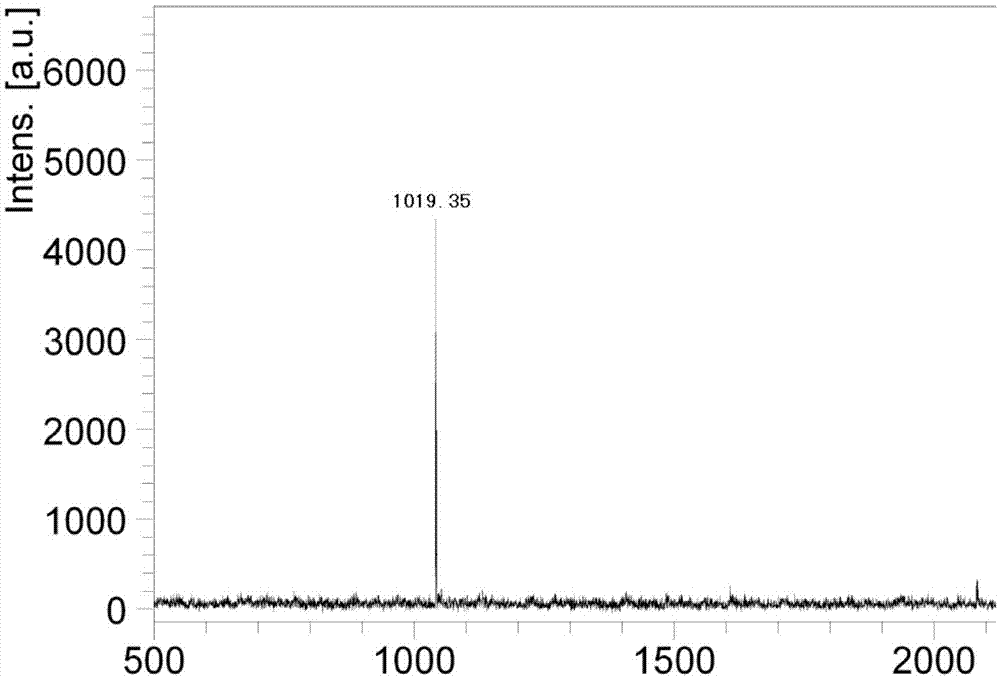
:一对或多对半胱氨酸残基之间所形成的二硫键对维持多肽空间构象以及某些生物学活性起着重要的作用。现有的许多药物都需要二硫键的存在才具有活性,例如如:奥曲肽、奈西立肽、爱啡肽、阿托西班和特利加压素等等,因此二硫键的氧化方法一直是多肽行业研究的重点。目前多肽二硫键氧化的常规方法是先采用空气、双氧水、碘等氧化剂进行氧化,再利用反相液相色谱进行纯化,得到最终产物。此方法虽然在15min-30min即可完成氧化,氧化速度较快,但停止氧化反应后还需要经过反相液相色谱纯化,才能得到所需的产物。而不同的氧化方法,在进行下一步反相色谱纯化前的处理过程也不相同。例如爱啡肽按照常规方法用双氧水氧化后,溶液体积较大,需多重过滤后方可进行纯化;奈西利肽先用氧气氧化,再经过旋蒸、过滤后,方可进行纯化,等等。这些方法的步骤都过于繁琐,需控制的参数也多,不利于对多肽质量的控制。多肽的稳定性本身较差,特别对于一些性质极不稳定的多肽而言,在终止氧化反应后,进行后续步骤之前,强氧化剂就有可能已经破坏了多肽本身的结构,引起多肽变性。所以减少氧化操作步骤,缩短处理时间对提高氧化收率,控制产品质量显得尤为重要。本发明为解决这些问题,提供了一种在纯化的同时完成多肽氧化的方法。不仅简化了操作过程,缩短了整个工艺的处理时间,更加避免了多肽与强氧化剂长时间接触引起的结构不稳定,所导致的收率降低。对于多肽的二硫键氧化主要有以下几种方式,一是多肽固相或液相合成过程中进行氧化,经过裂解后,得到的就是氧化产物,然后进行纯化,如:cn102827249a;二是固相合成线性粗肽,裂解后将线性粗肽溶解后进行液相氧化,然后再进行纯化如:cn103304655a、cn104710509a;或是将线性粗肽纯化提高纯度后再进行二硫键氧化,以提高氧化产物纯度或反应效率,但是每种二硫键氧化方法都有其优缺点,固相氧化对某些短肽或某些只需成一对二硫键的多肽更为合适;液相氧化费时费力,但氧化后的纯度相对较高,对于后续纯化提供了便利。为了提高药物的安全性,现有多肽药物要求纯度越高越好,大多要求纯度大于99%,并需对单杂进行控制,要求单杂小于0.15%,固相氧化杂质较多,不利于质量控制;如果采用液相氧化后进行纯化,虽然液相氧化完全,纯度较高,但氧化处理工序 较繁琐,费时费力。本发明提供了一种新液相二硫键氧化方法,区别于传统氧化思路,可以弥补固相氧化收率、纯度低,传统液相氧化方法费时费力的缺点,操作简便的同时大大提高氧化纯度及收率,并且易于放大生产。技术实现要素:本发明涉及一种新的液相氧化方法,将多肽药物线性粗肽直接在制备色谱柱上实现二硫键氧化。主要是以含有氧化剂的溶液为a1相,以有机溶剂为b相,在色谱柱上梯度洗脱多肽药物的同时,对多肽药物线性肽进行氧化,收集到的样品即为氧化后的多肽原料药。本发明涉及一种纯化氧化含二硫键多肽的方法,将待纯化氧化的粗肽在色谱柱上进行分离,同时进行氧化;其是将粗肽以包含氧化剂的流动相进行洗脱同时氧化;优选地,包括以下步骤:将粗肽以流动相a相和b相进行冲洗,其中,a相为无机盐水溶液,a相中还包含氧化二硫键的氧化剂;进一步地,a相中所述氧化剂选自双氧水、dmso、碘以及金属离子氧化剂(fe3+、cu2+、ag+)的一种或者几种;优选地,金属离子氧化剂选自fe2o3。进一步地,a相中的氧化剂为双氧水或dmso,且a相的ph为7.5-9.0。进一步地,a相中的氧化剂为碘,且其ph为2.5-9.0,优选为2.5、3.0、3.5、4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5、9.0。进一步地,所述氧化剂摩尔数为粗肽摩尔数的2-10倍,优选3、4、5、6、7、8、9倍。进一步地,a相中包含水和无机盐,b相中包含有机溶剂,优选地,b相中包含乙腈、甲醇、异丙醇、乙醇、四氢呋喃中的一种或多种,无机盐选自磷酸二氢钾、磷酸二氢钠、磷酸氢二钠、磷酸氢二钾、氯化钠中的一种或多种。进一步地,所述色谱柱固定相选自硅胶基质、聚合物高分子、氧化锆。进一步地,含二硫键多肽选自奥曲肽、爱啡肽、奈西立肽、阿托西班、特利加压素、齐考诺肽、利那洛肽、去氨加压素等。本发明所用洗脱程序和洗脱剂可以采用任何能够将多肽进行分离的程序和洗脱剂。进一步地,洗脱程序为,将无机盐溶液作为流动相a相,在a相中加入氧化剂,混合均匀;以色谱纯甲醇为b相。以60-80ml/min的流速,检测波230nm。b相洗脱梯度:b%:15%—35%,50-70min。进一步地,洗脱程序为,将无机盐溶液作为流动相a,并添加入氧化剂,混合均匀;色谱纯甲醇作为b相。流速:200ml/min。检测波长:230nm。b相洗脱 梯度:b%:8%—20%,50-70min。进一步地,洗脱程序为,将无机盐溶液作为流动相a,并添加入氧化剂,混合均匀;乙腈作为b相。流速:200ml/min。检测波长:230nm。b相乙腈洗脱梯度:b%:18%—28%,50-70min。进一步地,洗脱程序为,将无机盐溶液作为流动相a,并添加入氧化剂,混合均匀;乙醇作为b相。流速:200ml/min。检测波长:220nm。b相乙醇洗脱梯度:b%:25%—45%,50-70min。本发明通过将氧化和纯化合二为一,一步完成,省时省力,氧化的同时实现粗肽中的异构体杂质和其他难分离杂质的有效分离,然后利用反相hplc方法转成醋酸盐或者其它成盐形式,最终提高了产品的收率和纯度。同时解决了固相氧化收率、纯度低,液相氧化费时费力的缺点。本方法操作简便,有利于实现规模化的制备,提供了一种液相氧化的新方法。本法明所述色谱柱为硅胶基质、聚合物高分子、氧化锆类型的反相色谱柱,包括c1、c4、c8、c18等类型色谱柱。均可用于该液相二硫键氧化方法的固定相。所有可以溶解二硫键氧化剂的溶液均可以作为本发明的洗脱流动a相,包括水、各种无机盐等。b相可以为各种有机相,如乙腈、甲醇、异丙醇等等。本发明所述ph限定范围,依据二硫键氧化方式不同而不同,对于双氧水、空气、dmso需在碱性环境中进行的氧化方式,ph限定范围7.5-9.0;采用碘氧化时,ph限定范围为2.5-9.0;金属离子做二硫键氧化剂适合所有ph,优选ph范围为1.5-11.5.本发明所涉及的二硫键氧化剂较多,不限于dmso、双氧水、碘以及金属离子氧化剂的一种或者几种,只要溶于洗脱流动相中的氧化剂均可作为本发明的氧化剂。本发明所述氧化剂浓度主要是根据待纯化物质摩尔数的2-10倍。附图说明图1为线性粗肽质谱。图2为精肽质谱。图3为实施例1分离纯化后hplc谱图。图4为实施例2分离纯化后hplc谱图。图5为实施例3分离纯化后hplc谱图。图6为实施例4分离纯化后hplc谱图。图7为实施例5分离纯化后hplc谱图。具体实施方式可使用的不同色谱柱规格包括:5cm×25cm(柱子直径×长度)、10cm×25cm、15cm×25cm。实施例1:奥曲肽粗肽纯化将奥曲肽线性粗肽2.0g溶解过滤,收集滤液备用。色谱柱:十八烷基键合硅胶色谱柱,色谱柱规格为5cm×25cm。制备过程:将100mmol/l的磷酸二氢钾溶液用氨水调ph至8.5作为流动相a相,在a相中加入10g双氧水,混合均匀;以色谱纯甲醇为b相。以60-80ml/min的流速,检测波230nm。b相洗脱梯度:以b%:15%—35%,50-70min的梯度变化对样品进行梯度洗脱。纯化完成,同时完成氧化。将上步骤得到的氧化纯化多肽形成稳定的盐类,冷冻干燥后即可得到纯度大于99.0%的符合标准奥曲肽。冻干后得白色粉末状固体精肽0.75g。纯度99.28%,单个杂质均小于0.15%。纯化收率68%(以粗品中奥曲肽含量计算),总收率37.5%,纯化一批总共需要1.6h.实施例2:奥曲肽粗肽纯化将奥曲肽粗肽15g溶解过滤,收集滤液备用。1色谱柱:十八烷基键合硅胶色谱柱,色谱柱规格为10cm×25cm。将100mmol/l的磷酸二氢钠溶液用氨水调ph至8.0作为流动相a,,并添加150g双氧水;色谱纯甲醇作为b相。流速:200ml/min。检测波长:230nm。b相洗脱梯度:以b%:8%—20%,50-70min的梯度变化对样品进行梯度洗脱。纯化完成,同时完成氧化。将上步骤得到的氧化纯化多肽形成稳定的盐类,冷冻干燥后即可得到纯度大于99.0%的符合标准奥曲肽。冻干后得白色粉末状固体精肽6.1g。纯度99.30%,单个杂质均小于0.15%。纯化收率73.9%(以粗品中奥曲肽含量计算),总收率40.6%,纯化一批总共需要1.6h。实施例3:奥曲肽粗肽纯化将奥曲肽粗肽25g溶解过滤,收集滤液备用。色谱柱:十八烷基键合硅胶色谱柱,色谱柱规格为15cm×25cm。将100mmol/l的磷酸二氢钠溶液用氨水调ph至7.5,并添加150g双氧水作为a相;色谱纯甲醇作为b相。流速:200ml/min。检测波长:230nm。b相洗脱梯度:以b%:8%—20%,50-70min的梯度变化对样品进行梯度洗脱。纯化完成,同时完成氧化。将上步骤得到的氧化纯化多肽形成稳定的盐类,冷冻干燥后即可得到纯度大于99.0%的符合标准奥曲肽。冻干后得白色粉末状固体精肽8.9g。纯度99.30%,单个杂质均小于0.15%。纯化收率64%(以粗品中奥曲肽含量计算),总收率35.6%,纯化一批总共需要 1.6h。实施例4:爱啡肽纯化将爱啡肽粗肽250g溶解,然后将溶液过0.45μm滤膜,耗时约1小时,收集滤液备用。色谱柱:十八烷基键合硅胶色谱柱,色谱柱规格为15cm×25cm。将50mmol/l的磷酸二氢钠溶液用氨水调ph至8.0,并添加140g双氧水,作为a相;色谱纯乙腈作为b相。流速:200ml/min。检测波长:230nm。b相乙腈洗脱梯度:以b%:18%—28%,50-70min的梯度变化对样品进行梯度洗脱。纯化完成,同时完成氧化将上步骤得到的氧化纯化多肽形成稳定的盐类,冷冻干燥后即可得到纯度大于99.0%的符合标准爱啡肽。冻干后得白色粉末状固体精肽85g。纯度99.40%,单个杂质均小于0.15%。纯化收率58%(以粗品中爱啡肽含量计算),总收率34%。耗时如下:过滤时间1小时纯化时间30小时总时间31小时实施例5:齐考诺肽纯化将齐考诺肽线性粗肽15g溶解过滤,收集滤液备用。色谱柱:十八烷基键合硅胶色谱柱,色谱柱规格为10cm×25cm。将61.5克氢氧化钠,溶于10l水中,用盐酸调节ph7.0,并添加三氧化二铁8g,作为流动相a;色谱纯乙醇作为b相。流速:200ml/min。检测波长:220nm。b相乙醇洗脱梯度:b%:25%—45%,50-70min的梯度变化对样品进行梯度洗脱。纯化完成,同时完成氧化。将上步骤得到的氧化纯化多肽形成稳定的盐类,冷冻干燥后即可得到纯度大于99.0%的符合标准醋酸齐考诺肽。冻干后得白色粉末状固体精肽3.2g。纯度99.32%,单个杂质均小于0.15%。纯化收率61%(以粗品中齐考诺肽线性肽含量计算),总收率32%。对比例1:爱啡肽放大粗肽纯化将爱啡肽粗肽250g溶解过滤,进行液相氧化,溶解浓度1mg/ml,1小时后氧化完成,然后过滤,因氧化后杂质变化,溶液极其难过滤,需经过两步过滤,一步粗过滤,一步精细过滤,粗过滤去掉大部分不溶物后再过滤0.45μm滤膜,耗时约10小时,然后进行反相纯化。色谱柱:十八烷基键合硅胶色谱柱,色谱柱规格为15cm×25cm。将50mmol/l的磷酸二氢钠溶液用氨水调ph至8.0,作为a相色谱纯乙腈作为b相。流速:200ml/min。检测波长:230nm。以b%:18%—28%,50-70min 的梯度变化对样品进行梯度洗脱。将上步骤得到的氧化纯化多肽形成稳定的盐类,冷冻干燥后即可得到纯度大于99.0%的符合标准的爱啡肽。冻干后得白色粉末状固体精肽58g。纯度99.31%,单个杂质均小于0.15%。纯化收率40%(以粗品中爱啡肽含量计算),总收率23%。耗时如下:过滤时间10小时纯化时间30小时氧化时间1小时总共耗时41小时纯化一批250g爱啡肽粗肽耗时41h,氧化完成后氧化后的粗肽需放置20h,在这个过程中产品稳定性难以把控。本发明的氧化纯化方法能够将收率从之前的23%提高至34%,提高了50%同时产能增加(41-31)/31=32%,同时加上收率提高50%,可见方法的优势。现有技术中的方法因为氧化后放置时间过长,氧化产物有所变化,难以去除,进而影响纯化效果,如遇不稳定的产品,质量更将难以保证,本发明的方法创造性地将氧化步骤在色谱柱中进行,而氧化剂加入的方法又保证了氧化后粗肽质量一样,本发明的方法能够将产能提高30%,收率同时提高50%。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1