CRM197和相关蛋白的表达和纯化的制作方法
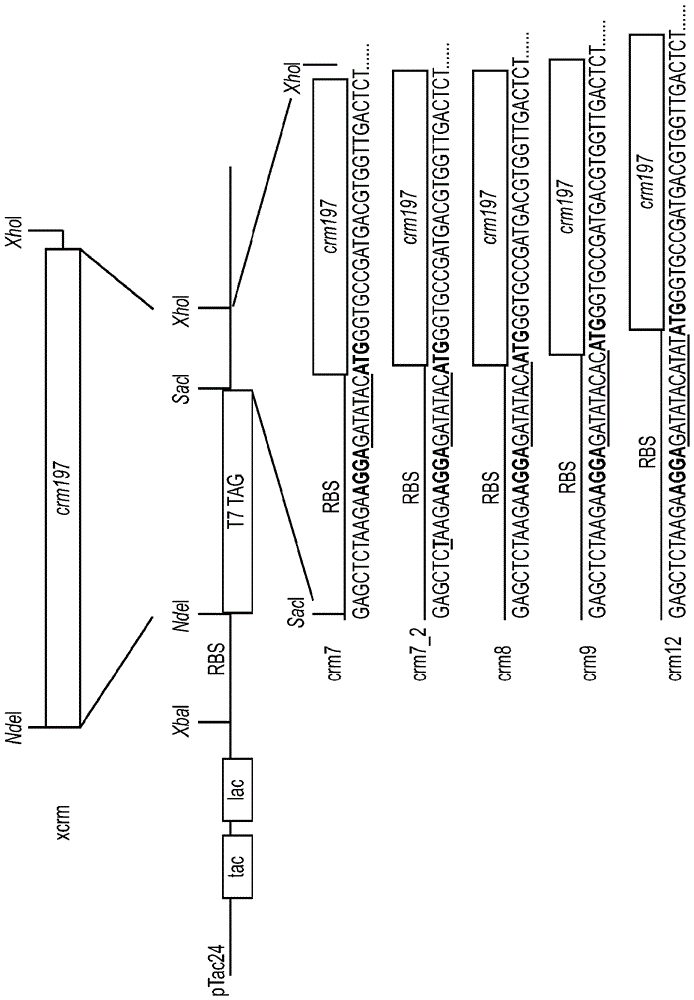
本申请要求2014年1月31日提交的相同标题的美国临时申请号61/934,377的优先权,其整体通过引用特别结合到本文中。发明背景1.发明领域本发明涉及在细菌宿主中生产重组蛋白的领域。具体而言,本发明涉及用于从大肠杆菌获得高水平的可溶性重组CRM197蛋白的生产方法。本发明还涉及CRM197的纯化和表征方法以及通过所述方法生产的CRM197的用途。2.背景描述白喉毒素(DT)是一种由白喉棒状杆菌(Corynebacteriumdiphtheriae)的致病菌株合成和分泌的蛋白质性外毒素。这些致病菌株包含携带毒素基因的噬菌体溶素原。白喉毒素是一种ADP-核糖基化的酶,其作为535个残基的酶原分泌和由胰蛋白酶-样蛋白酶加工,并释放两个片段(A和B)。片段A使用NAD作为底物,催化在烟酰胺环和N-核糖之间的N-糖苷键的裂解和介导ADP-核糖共价转移(ADPRT活性)至延伸因子EF-2的修饰的组氨酸715(白喉酰胺)。该翻译后白喉酰胺修饰使EF-2失活,停止蛋白合成和导致细胞死亡。DT的A片段(亦称为C结构域)带有催化活性位点,并且是中毒的最后一步所需的唯一毒素片段。B片段上携带的R结构域介导与宿主细胞表面上的受体的结合,并且也在B片段上携带的T结构域促进片段A的pH-依赖性转移至细胞质。富含精氨酸的二硫键连接的环连接片段A与片段B(或者结构域C与结构域TR)。在该链在位置186上蛋白水解裂解后,该链间二硫键是在这两个片段之间唯一的共价连接。各种无毒性和部分毒性的免疫学交叉反应形式的白喉毒素(CRM或交叉反应材料)的分离导致发现CRM197(Uchida等JournalofBiologicalChemistry248,3845-3850,1973;亦参见Giannini等NucleicAcidsRes.1984年5月25日;12(10):4063-9)。优选地,CRM可具有包含整个DT或其一部分的任何大小和组成。CRM197是一种主要酶失活和无毒性形式的白喉毒素,其包含单个氨基酸置换G52E。该突变导致NAD-结合位点之前的活性位点环的内在柔韧性,和降低CRM197结合NAD的能力并消除DT的有毒性质(Malito等ProcNatlAcadSciUSA109(14):5229-342012)。如同DT一样,CRM197具有两个二硫键。一个二硫键连接Cys186与Cys201,其连接片段A与片段B。第二个二硫键在片段B内连接Cys461与Cys471。DT和CRM197两者均具有片段A-相关的核酸酶活性(Bruce等Proc.Natl.Acad.Sci.USA87、2995-8、1990)。许多抗原具有差的免疫原性,尤其是在婴儿中,除非与蛋白化学连接(“缀合”),从而形成缀合物或缀合物疫苗。这些缀合物疫苗的蛋白组分也称为“载体蛋白”。CRM197通常用作蛋白-糖和半抗原-蛋白缀合物的载体蛋白。作为载体蛋白,CRM197相对于白喉类毒素以及其它类毒素蛋白具有许多优点,其中许多已被证明(ShinefieldVaccine,28:4335,2010;Broker等Biologicals,39:1952011)。例如,因为CRM197是遗传上去毒性的,它保留较大的赖氨酸(其用于缀合但被化学类毒素化封闭)补体。已经证明CRM197是肺炎链球菌荚膜多糖的有效的载体蛋白,如通过PREVNAR™(Pfizer)(一种由与CRM197化学连接的至多13种荚膜多糖组成的疫苗)的成功所证明的。还有证据表明,与破伤风类毒素相比,存在较少的载体诱导的免疫反应抑制,尤其是当存在许多单独多糖与相同的载体蛋白连接时。CRM197和天然DT对白喉毒素受体(DTR)具有类似的亲和力,所述受体与HB-EGF前体pro-HB-EGF具有相同的氨基酸序列(Mitamura等J.Biol.Chem.272(43):27084-90、1997)。CRM197结合可溶形式的HB-EGF,以及膜形式pro-HB-EGF,和通过阻止其与EGF受体结合而抑制HB-EGF有丝分裂作用。因此CRM197也可能在癌症疗法中具有有前景的作用(Miyamoto等AnticancerRes.Nov-Dec27(6A):3713-21,2007)。CRM197已经在原始宿主棒状杆菌中生产,但收率低,通常<50mg/L,并且另外地,与例如大肠杆菌相比,棒状杆菌生长相对缓慢。存在专有的棒状杆菌菌株,其已被工程改造以较高水平生产CRM197(美国专利号5,614,382)。CRM197还已经在专有的荧光假单胞菌(Psuedomonasfluorescens)菌株中表达和以高水平表达。在大肠杆菌中生产CRM197将是有利的,因为大肠杆菌是BL1水平的生物,其在培养和繁殖方面廉价。在大肠杆菌中生产CRM197主要产生不溶性包涵体(通常不溶),其然后需要困难的再折叠过程,导致收率低(EP20100742260)或具有额外的肽序列(标签)(JBiotechnol.2010Dec20;156(4):245-52,OverexpressionandpurificationoftherecombinantdiphtheriatoxinvariantCRM197inEscherichiacoli.StefanA,ContiM,RubboliD,RavagliL,PrestaE,HochkoepplerA)。尚未报道适合于大量蛋白生产的用于在大肠杆菌中过量表达可溶性无标签CRM197的方法。因此,对以高效和成本有效方式生产CRM197的更好方法存在需要。发明概述本发明克服了与当前策略和设计有关的问题和缺点,提供了用于生产CRM的新的组合物和方法。本发明的一个实施方案涉及生产整个CRM蛋白或其一部分的方法,包括:提供包含表达载体的重组细胞,所述表达载体包含与多顺反子基因序列功能连接的诱导型启动子,其中至少一个顺反子编码CRM蛋白;诱导表达载体生产CRM蛋白;和分离表达的CRM蛋白。优选地,重组细胞的一种或多种二硫化物还原酶的活性降低,和还优选地,各个顺反子包含核糖体结合位点和起始密码子。优选地,多顺反子基因序列在一个或多个核糖体结合位点和一个或多个起始密码子之间包含至少一个间隔基。优选地,由细胞表达的CRM蛋白是可溶性的,和还优选地,表达的CRM蛋白是细胞内的、周质的或分泌的。优选地,重组细胞在约15°C至约32°C的温度下增殖,和还优选地,CRM蛋白通过色谱法从细胞分离。优选的色谱介质包括例如硫酸葡聚糖树脂、凝胶树脂、活性硫酸化树脂、磷酸盐树脂、肝素树脂或肝素-样树脂。本发明的另一实施方案包括通过本发明的方法分离的CRM蛋白。本发明的另一实施方案涉及生产整个CRM蛋白或其一部分(例如优选地CRM197)的方法,包括:提供包含表达载体的重组细胞,其中与未修饰的重组细胞相比,重组细胞已被修饰以改变细胞质的氧化还原状态至更加氧化的状态,和表达载体包含与CRM编码序列化学连接的诱导型启动子、在核糖体结合位点和ATG密码子之间的间隔基序列、CRM编码序列上游的表达增强子区;诱导表达载体生产CRM蛋白;和分离表达的CRM蛋白。重组细胞可以是真核细胞或原核细胞。优选地,重组细胞是原核细胞,例如大肠杆菌细胞或大肠杆菌的衍生菌或菌株。优选地,重组细胞修饰包括一种或多种二硫化物还原酶的活性降低,所述二硫化物还原酶例如氧化还原酶、二氢叶酸还原酶、硫氧还蛋白和硫氧还蛋白还原酶、蛋白还原酶或谷胱甘肽还原酶的一种或多种。优选地,与非-重组细胞相比,一种或多种二硫化物还原酶的活性降低改变重组细胞的细胞质的氧化还原状态至氧化状态。优选地,CRM编码序列编码一个或多个CRM表位、CRM肽序列、CRM结构域或其组合。优选地,间隔基包含多于9个核苷酸或少于9个核苷酸,例如5-20个核苷酸。优选地,表达增强子包含CRM编码序列上游的核糖体结合位点和ATG密码子。优选地,由细胞表达的CRM蛋白是可溶性的,和是细胞内的、周质的或分泌的。优选地,重组细胞在约15°C至约32°C的温度下增殖。优选地,CRM蛋白通过色谱法从细胞分离,所述色谱法包括硫酸葡聚糖树脂、活性硫酸盐树脂、磷酸盐树脂、肝素树脂或肝素-样树脂作为优选的色谱介质。本发明的另一实施方案涉及通过本发明的方法分离的CRM蛋白。优选地,分离的CRM蛋白是缀合的,和缀合的CRM蛋白作为疫苗配制。本发明的另一实施方案涉及生产整个CRM蛋白或其一部分(例如从CRM编码序列生产的蛋白或肽,所述编码序列编码一个或多个CRM表位、CRM肽序列、CRM结构域或其组合,和优选地CRM197)的方法,包括提供包含表达载体的重组细胞,其中所述表达载体包含与EES编码序列(其前面有核糖体结合位点)功能连接的启动子;从CRM编码序列(其前面有核糖体结合位点)表达CRM蛋白;和分离表达的CRM蛋白。优选地,重组细胞是原核或真核细胞,和优选地,原核细胞是大肠杆菌细胞或大肠杆菌的衍生菌或菌株。优选地,启动子是组成型或诱导型的。优选地,与未修饰的重组细胞相比,重组细胞被修饰以改变细胞质的氧化还原状态至更加氧化的状态。优选地,修饰的重组细胞的一种或多种硫醇-二硫化物氧化还原酶和/或参与硫氧还蛋白和谷氧还蛋白系统的酶(例如,硫氧还蛋白、硫氧还蛋白还原酶、谷胱甘肽还原酶)的活性降低。优选地,表达载体包含受核糖体结合位点控制的表达增强子序列(例如SEQID15)或例如包括CRM编码序列上游的核糖体结合位点上游的T7标签序列。本发明的另一实施方案涉及分离和/或纯化CRM蛋白的方法,包括用加样缓冲液加载CRM蛋白至包含树脂的色谱柱上,其中树脂优选地是硫酸葡聚糖树脂、活性硫酸盐树脂、磷酸盐树脂、肝素树脂或肝素-样树脂;用一种或多种洗涤缓冲液洗涤树脂;和用洗脱缓冲液从树脂洗脱CRM蛋白。优选地,加样缓冲液和洗涤缓冲液是或包含相同的组分,并且其量相同或类似。优选地,加样缓冲液和一种或多种洗涤缓冲液是低电导率缓冲液,例如Tris-HCl、HEPES、磷酸钠缓冲液,电导率为约10mS/cm或更小(例如1mS/cm、2mS/cm、3mS/cm、4mS/cm、5mS/cm、6mS/cm、7mS/cm、8mS/cm、9mS/cm)。优选地,洗脱缓冲液是高电导率缓冲液,例如含有添加的盐例如NaCl或KCl的缓冲液,电导率为约10mS/cm或更大(例如12mS/cm、14mS/cm、15mS/cm、20mS/cm、25mS/cm、30mS/cm、40mS/cm、50mS/cm、60mS/cm、70mS/cm、80mS/cm、90mS/cm、100mS/cm或更大)。本发明的另一实施方案涉及表征白喉毒素或CRM蛋白的折叠的方法,包括:使白喉毒素或CRM蛋白接触HB-EGF;测定白喉毒素或CRM蛋白与HB-EGF结合的量;和通过测定的结合的量,测定白喉毒素或CRM蛋白的折叠,其中结合表示正确折叠。优选地,白喉毒素或CRM包含受体结合结构域。优选地,CRM蛋白包含CRM197。还优选地,白喉毒素或CRM蛋白和/或HB-EGF的至少一种结合到固体载体。优选地,白喉毒素或CRM蛋白与HB-EGF结合的量通过ELISA测定,和结合HB-EGF的CRM蛋白在PBS中是可溶性的。本发明的另一实施方案包含表达载体,其包含启动子和两个或更多个顺反子(至少一个编码蛋白),其中至少一个顺反子编码CRM蛋白和各个顺反子具有核糖体结合位点和起始密码子。优选地,表达载体在核糖体结合位点和起始密码子之间进一步包含间隔基,和还优选地,间隔基包含5-20个核苷酸。优选地,间隔基不包含9个核苷酸。本发明的其它实施方案和优点在之后的详述中部分地描述,和部分地,可从该详述中显而易见,或者可从本发明的实施中获知。附图简述图1:载体构建体crm7(SEQIDNO10)、crm7_2(SEQIDNO11)、crm8(SEQIDNO12)、crm9(SEQIDNO13)和crm12(SEQIDNO14)的示意图,其中核糖体结合位点(RBS)和起始密码子(ATG)两者均用粗体表示,间隔基序列用下划线表示。图2:在用2µg/ml的pn6B包被的immunotech板上小鼠抗-pn6B血清的滴定结果。图3:在pn14包被的板上抗-pn14血清的滴定结果。发明详述可溶性的完整重组CRM最初在蛋白酶-缺陷的大肠杆菌中生产(Bishai等1987)。然而,蛋白生产量非常低。随后,CRM197在大肠杆菌细胞中作为包涵体(StefanA等JBiotechnol.Dec20;156(4):245-52,2010;国际申请公开号WO2011/126811,中国专利申请号200610042194)或作为通过信号肽引导到周质的可溶性蛋白(国际申请公开号WO2011/042516)生产。大肠杆菌的周质是一种氧化环境,其允许形成二硫键。CRM197具有两个二硫键,其对于正确折叠和功能以及对于蛋白可溶性而言可能是重要的。已经令人惊讶地发现,可溶性重组CRM蛋白的单一未裂解链可从微生物在细胞内和以商业化的量快速生产,其后大量分离和/或纯化,并保持可溶。CRM在磷酸盐缓冲盐水(PBS,pH7.5)和其它类似的缓冲液中是可溶性的,并且在该缓冲液和其它缓冲液中可浓缩至大于5mg/ml,同时保持可溶。尽管在Cornybacter中表达的CRM可在这些缓冲液中浓缩,但在假单胞菌中产生和在周质中表达的CRM不能容易地在这些相同的缓冲液中浓缩(PfenexInc.,SanDiego,CA)。与周质表达相比,细胞内表达的其它优点是实现更高表达水平,这是因为与细胞内空间相比,周质空间有限。优选生产的CRM蛋白是全长或部分区域,例如肽、单一或多个结构域或表位和从天然CRM编码序列表达的任何特定区域,其包括已被一个或多个缺失、取代和/或添加(例如保守或非保守的)修饰的CRM序列,和已被促进在宿主生物中的表达的另外序列(例如一个或多个启动子、起始密码子和翻译因子、核糖体或聚合酶结合位点)修饰的CRM序列。优选的CRM蛋白是CRM197。可溶性的和不作为细胞的不溶性包涵体另外结合的CRM蛋白的表达是优选的。用于表达和生产CRM蛋白的优选的表达系统包括具有细胞内氧化状态的微生物。优选的表达系统可以是重组或天然的真核或原核细胞,其中重组细胞包括包含非天然CRM编码序列的细胞。优选的原核细胞是大肠杆菌的菌株或包含一个或多个遗传改变(例如一个或多个缺失或突变)的另一细菌菌株。优选地,与野生型相比,一个或多个遗传改变将细胞的细胞质的氧化还原状态改变为更加氧化的状态,例如公开于美国专利号7,410,788(通过引用结合到本文中)。改变优选地降低一种或多种二硫化物还原酶基因和/或其它基因的活性,所述其它基因降低细胞质的氧化状态。优选地,活性降低归因于一种、两种或多种二硫化物还原酶或其它基因的无表达或表达降低,或降低一种或多种表达的二硫化物还原酶蛋白或其它蛋白的活性的一种或多种突变。优选的微生物细胞(例如,重组、改造或天然的真核或原核细胞)菌株生产仍为功能蛋白的包含二硫键的天然折叠蛋白的能力增加。本发明的方法生产一定量的包含完全、截短或修饰的CRM氨基酸序列的CRM蛋白。根据本发明生产的CRM蛋白的量是令人惊讶的,例如600mg或更多的CRM蛋白/升细菌细胞培养物。本发明的一个实施方案涉及生产大量CRM蛋白和优选地CRM197的方法。生产量通常按mg/L的细菌细胞培养物量化。根据本发明方法的CRM蛋白生产是200mg/L或更多、300mg/L或更多、400mg/L或更多、500mg/L或更多、600mg/L或更多、700mg/L或更多、800mg/L或更多、900mg/L或更多、1,000mg/L或更多、1,500mg/L或更多、或2,000mg/L或更多。本发明优选量的CRM197包括包含全长和截短的CRM蛋白以及修饰的CRM蛋白氨基酸序列的相关蛋白。修饰包括一个或多个保守氨基酸缺失、取代和/或添加。保守修饰是保持分子的功能活性和/或免疫原性的修饰,但可增加或降低活性和/或免疫原性。CRM的保守修饰的实例包括但不限于氨基酸修饰(例如,单个、两个和另外的短氨基酸添加、缺失和/或取代)、可容易用于缀合形成疫苗的39个赖氨酸残基的α-氨基(赖氨酸的伯胺基)之外的修饰、由于DT的血清型变化导致的修饰、增加免疫原性或增加缀合效率的修饰、基本上不改变与肝素的结合的修饰、保留正确折叠或三维结构的修饰、和/或不显著改变提供对DT的保护性免疫的蛋白或蛋白部分的免疫原性的修饰。用于本发明方法的重组细胞优选地是大肠杆菌细菌,和优选地,经遗传改造以改变细胞质的氧化还原状态至更加氧化的状态的大肠杆菌(例如通过一种或多种二硫化物还原酶基因的突变,例如氧化还原酶、二氢叶酸还原酶、硫氧还蛋白还原酶、谷氨酸半胱氨酸裂解酶、二硫化物还原酶、蛋白还原酶和/或谷胱甘肽还原酶)。优选地,一种或多种二硫化物还原酶基因被突变,和赋予无功能性或少量功能性,使得与野生型相比,细胞的细胞质的氧化还原状态被改变至更加氧化的状态。氧化的蛋白折叠涉及二硫桥的形成和异构化,并在许多蛋白包括CRM197的稳定性和溶解性方面起关键作用。二硫桥的形成和断裂通常通过硫醇-二硫化物氧化还原酶催化。这些酶的特征为一个或多个Trx折叠,其由通过三个α-螺旋围绕的四链β−片组成,具有CXXC氧化还原活性位点基序。各种Trx组件的装配已经用于构建在原核和真核生物中存在的不同的硫醇氧化还原酶。在细菌周质中,通过DsbB-DsbA和DsbD-DsbC/DsbE/DsbG对的组合作用,蛋白保持在合适的氧化状态(Inaba2009,Gruber等2006)。许多蛋白表达系统是本领域众所周知的,和市售可得的。特别优选的微生物包括大肠杆菌表达菌株,例如化学感受态的大肠杆菌K12细胞,其经工程改造以在细胞质中形成二硫键键合的蛋白(例如,ORIGAMI™(EMDMillipore)和SHUFFLE™(NewEnglandBiolabs))。也可使用氧化型氧化还原状态提高的其它菌株和细胞类型和其它大肠杆菌菌株。例如,ORIGAMI™2宿主菌株是在硫氧还蛋白还原酶(trxB)和谷胱甘肽还原酶(gor)两个基因中具有突变的K-12衍生菌,其极大提高在大肠杆菌细胞质中的二硫键形成。这些菌株是卡那霉素敏感性的;像原始的Origami菌株一样,仍通过四环素选择gor突变。为了减少在分子之间形成二硫键的可能性,建议包含trxB和gor突变的菌株仅用于表达为了正确折叠而需要二硫键形成的蛋白。SHUFFLE™细胞是化学感受态大肠杆菌K12细胞,其经工程改造以在细胞质中形成包含二硫键的蛋白。优选地,这些细胞包含trxB和gor突变和细胞质蛋白伴侣二硫键异构酶DsbC(fhuA2[lon]ompTahpCgalλatt::pNEB3-r1-cDsbC(SpecR,lacIq)ΔtrxBsulA11R(mcr-73::miniTn10--TetS)2[dcm]R(zgb-210::Tn10--TetS)endA1Δgor∆(mcrC-mrr)114::IS10)。还优选地,细胞适合于T7启动子驱动的蛋白表达和具有基因型F´lac,pro,lacIQ/Δ(ara-leu)7697araD139fhuA2lacZ::T7gene1Δ(phoA)PvuIIphoRahpC*galE(orU)galKλatt::pNEB3-r1-cDsbC(SpecR、lacIq)ΔtrxBrpsL150(StrR)ΔgorΔ(malF)3。SHUFFLE™菌株组成型表达二硫键异构酶DsbC的染色体拷贝。DsbC促进校正错误氧化的蛋白为它们的正确形式。细胞质DsbC还是可有助于不需要二硫键的蛋白折叠的蛋白伴侣。细菌培养物优选地在使得与较高的温度(例如37°C)下的溶解性相比表达的蛋白的溶解性增加的温度下培养(例如CRM或CRM197)。优选的培养温度是30°C或更低、优选地25°C或更低、优选地20°C或更低、优选地18°C或更低和优选地在15°C和32°C之间。本发明的另一实施方案涉及用于生产CRM的载体和生产整个CRM蛋白或其一部分(例如优选地CRM197)的方法,所述CRM蛋白在细胞和优选地原核细胞的细胞质中可溶。以前在大肠杆菌中在细胞内表达CRM的尝试基于仅编码CRM序列的单顺反子mRNA,和导致包涵体形成。在细胞的细胞质中生产可溶性CRM的方法使用提供在多顺反子mRNA中的CRM的转录的表达载体开发。多顺反子mRNA是指编码两种或更多种多肽的信使RNA。在原核细胞中,参与相同生物化学或生理学途径的基因往往归类为操纵子,其控制基因转录为单一的多顺反子mRNA。操纵子中的基因(顺反子)受核糖体结合位点序列的控制,和可通过多个核苷酸或甚至重叠序列分开。例如,第一个基因的终止密码子在第二个基因的起始密码子的下游,如在半乳糖操纵子中。已经表明在操纵子中的基因位置通过翻译和mRNA稳定性作用也强烈影响基因表达水平(Smolke,C.D.和Keasling,J.D.(2002)Effectofgenelocation,mRNAsecondarystructures,andRNasesitesonexpressionoftwogenesinanengineeredoperon.Biotechnol.Bioeng.80,762−76)。发现下游基因表达水平经过翻译偶联,通过上游基因表达而提高(Schümperli,D.,McKenney,K.,Sobieski,D.a和Rosenberg,M.(1982)TranslationalcouplingatanintercistronicboundaryoftheEscherichiacoligalactoseoperon.Cell30,865−71)。本发明的一个优选的实施方案是包含原核启动子和两个编码多肽(其中之一是CRM)的顺反子的载体。各个顺反子包含核糖体结合位点和起始密码子,例如ATG。本发明还包括诱导表达载体生产CRM蛋白和分离表达的CRM蛋白。在一个优选的实施方案中,CRM序列之前的第一个顺反子包含与CRM顺反子重叠的T7标签序列,使得第一个顺反子的终止密码子在CRM的起始密码子的下游(例如SEQIDNO15)。表达增强子按SEQIDNO16或SEQIDNO17进一步修饰。CRM编码序列之前的第一个顺反子被称为“表达增强子序列”(EES)。表达载体包含(1)启动子,接着是核糖体结合位点和表达增强子序列,和(2)核糖体结合位点和ATG密码子和CRM编码序列。重组细胞可以是原核或真核细胞。优选地,重组细胞是原核细胞,例如大肠杆菌细胞或大肠杆菌的衍生菌或菌株。优选地,重组细胞修饰包含降低活性的一种或多种二硫化物还原酶,例如氧化还原酶、二氢叶酸还原酶、硫氧还蛋白和硫氧还蛋白还原酶、蛋白还原酶或谷胱甘肽还原酶的一种或多种。优选地,与非-重组细胞相比,降低活性的一种或多种二硫化物还原酶改变重组细胞的细胞质的氧化还原状态至氧化状态。优选地,CRM编码序列编码一个或多个CRM表位、CRM肽序列、CRM结构域或其组合。优选地,由细胞表达的CRM蛋白是可溶性的,和是细胞内的、周质的或分泌的。优选地,重组细胞在约15°C至约32°C的温度下增殖。本发明的另一实施方案包括包含可表达的CRM序列和优选地CRM197的序列的重组细胞,例如细菌、哺乳动物或昆虫细胞。优选的宿主细胞包括但不限于经遗传改造以改变细胞质的氧化还原状态至更加氧化的状态的细胞。优选的细胞包括原核或真核细胞,例如大肠杆菌细胞表达系统,杆状病毒表达系统和其它细菌和/或真核细胞表达系统。优选地,细胞包含用于表达外源或非天然序列例如CRM肽的蛋白表达系统。还优选的,待表达的序列由表达载体构成,其包含一个或多个诱导型启动子(例如,自动诱导型,优选地用特定培养基)、起始密码子(例如ATG)、核糖体结合位点、非特定的多肽序列和转录为多顺反子mRNA的CRM编码序列。还优选地,表达载体在核糖体结合位点和ATG起始密码子之间或在起始密码子和待表达的序列之间包含修饰的序列。优选的修饰序列或间隔基序列包括例如,多于9个或少于9个的多个核苷酸(例如7-12个核苷酸),和优选地不是9个核苷酸。可用于表达系统的间隔基核苷酸的具体实例包括但不限于GATATAC(SEQIDNO3)、GATATACCA(SEQIDNO4)和GATATACCATAT(SEQIDNO5)。因此,本发明的另一实施方案包含CRM的表达构建体、核苷酸和氨基酸序列,含或不含定义的间隔基序列并且含和不含宿主细胞。本发明的另一实施方案涉及重组CRM197蛋白以及重组CRM在大肠杆菌或另一宿主细胞中使用具有诱导型启动子和/或在核糖体结合位点和ATG起始密码子之间的修饰序列的表达载体的表达。优选地,表达载体包括乳糖/IPTG诱导型启动子,优选地tac启动子和在核糖体结合位点和ATG起始密码子之间的序列。优选地,表达系统在起始密码子和表达序列之间包含间隔基,其由多于9个或少于9个的多个核苷酸构成(例如7-12个核苷酸),和优选地不是9个核苷酸。可用于表达系统的间隔基核苷酸的具体实例包括但不限于本文鉴定的那些。令人惊讶的发现,与9个核苷酸的间隔基相比,使用长度为7或12的间隔基导致显著增加CRM197表达水平。本发明的另一实施方案包括CRM的表达构建体、核苷酸和氨基酸序列,含或不含本文所公开的定义的间隔基序列和含或不含增强子区。增强子区通过增强CRM的正确折叠的翻译偶联促进下游CRM序列的表达,导致蛋白可溶性。增强子区还通过添加促进核酸识别以增加表达的一个或多个序列,促进蛋白表达(例如,起始密码子、酶结合位点、翻译或转录因子结合位点)。优选地,本发明的增强子包含核糖体结合位点与编码序列上游的起始密码子和编码序列,所述编码序列不同于CRM蛋白的编码序列。本发明的另一实施方案涉及根据本发明的方法纯化的重组CRM,和具体而言CRM197。纯化优选地包括肝素或肝素-样亲和色谱法。令人惊讶的发现,CRM197包含典型的肝素结合位点XBBXBX(SEQIDNO6)的基于序列的基序,其中B是赖氨酸或精氨酸和X是亲水残基(CardinAD,WeintraubHJ.,1989:Molecularmodelingofprotein-glycosaminoglycaninteractions.Arteriosclerosis9:21–32)。该基序位于CRM197受体-结合结构域中并包含以下氨基酸:GRKIRMRCR(SEQIDNO7),其中G(甘氨酸)、I(异亮氨酸)、M(甲硫氨酸)和C(半胱氨酸)是亲水残基。肝素结合位点的存在允许在纯化中使用肝素或肝素-样树脂。肝素-样树脂包括包含硫酸官能团的树脂,例如硫酸葡聚糖,例如硫酸葡聚糖(Sterogene)、CaptoDevirs(GE)或硫酸酯,例如CellufineSulfate(AsahiKaseiBioprocess)。在第一步中,粗大肠杆菌提取物可例如优选地通过离心或深过滤澄清。任选澄清的裂解物可优选地通过加入对蛋白溶解度有影响的盐和盐析CRM197进一步分级。在第二步中,澄清的裂解物或包含CRM197的再溶解的盐析部分可在当CRM197流动通过的条件下施加至例如阴离子交换树脂。在第三步中,包含CRM197的流动通过部分可施加至柱。优选的柱树脂包括但不限于硫酸葡聚糖树脂、CELLUFINE™树脂(ChissoCorporation;色谱凝胶)、活性硫酸化树脂、磷酸盐树脂或肝素或肝素-样树脂。优选地,CRM与树脂结合在低盐缓冲液中进行和在较高盐缓冲液中洗脱,得到高度纯化的CRM197。优选的结合缓冲液包含例如一种或多种离液剂、NaCl、KCl、甘油、异丙醇、乙醇、精氨酸、乙酸盐、胍、尿素、ATP、一种或多种一-、二-、三-和/或多-磷酸盐、硫酸盐或焦磷酸盐,和其组合。优选的洗脱缓冲液包含例如,较高浓度的一种或多种结合缓冲液组分。其它优选的纯化方法包括阴离子交换色谱法、疏水相互作用色谱法和/或Cibacron-Blue树脂(CN101265288A、美国专利号8,383,783)的任何一种或组合。本发明的纯化方法以如本文所述的高收率和大于80%、优选地大于85%、优选地大于90%、优选地大于95%、优选地大于99%纯度水平和优选地甚至更高的纯度生产重组CRM蛋白(例如CRM197)。本发明的另一实施方案涉及表征包含受体结合结构域(见SEQIDNO2)的重组DT和CRM蛋白(例如结合活性),和具体而言CRM197的方法。这些方法包括测定包含DT受体结合结构域的天然或修饰序列的蛋白的结合活性。这样的修饰优选地保留CRM结合HB-EGF(肝素结合表位生长因子)的能力。所述方法可适用于粗制和纯化的CRM197两者。结合活性代表了可溶形式的白喉毒素受体HB-EGF(DTR)的结合。这些方法优选地包括测定CRM197与DTR的结合和用对正确折叠的结构、复合物、结合和/或结合位点有特异性的分子(例如抗体、抗体片段、抗原)和优选地以ELISA形式检测。测定和定量结合的测定法允许快速检测CRM197是正确折叠的,因为仅正确折叠的CRM197结合受体。因此,所述方法监测在开发、生产和纯化过程中制备的CRM197和相关蛋白的正确折叠。此外,该表征方法可用于在与另一分子缀合后鉴定和跟踪CRM蛋白,例如在疫苗生产中。使用本发明的检测方法,在开发用于治疗和/或预防患者的疾病和病症的疫苗过程中可监测正确折叠和构造的缀合的CRM蛋白。本发明的另一实施方案包括用于缀合CRM蛋白的方法,用于疫苗生产,例如通过与多糖缀合。还包括蛋白、肽、寡糖和半抗原的缀合。本发明的另一实施方案包括包含本发明的CRM蛋白的疫苗。本发明的另一实施方案涉及与另一分子例如另一蛋白或多糖经基因或化学融合的本发明的CRM蛋白。融合优选地通过在分子之间的一个或多个共价键进行。以下实施例举例说明了本发明的实施方案,但不应视为限制本发明的范围。实施例实施例1.自在RBS和起始ATG密码子之间包含7、8、9或12个核苷酸序列的表达载体检测的CRM197表达将编码成熟CRM197的DNA以多顺反子形式克隆至表达载体,产生以下DNA调节和编码片段的序列:tac启动子-核糖体结合位点-ATG密码子-T7标签-核糖体结合位点-ATG密码子-CRM编码序列-终止密码子。不同的大肠杆菌菌株,包括ORIGAMI2、C41,作为表达菌株进行测试(图1)。实施例2.CRM197在允许在细胞质中形成二硫键的Origami2大肠杆菌表达菌株中可溶性表达CRM197在37°C不溶性表达。当表达温度下降至低于37℃时,在ORIGAMI™2细胞和SHUFFLE™细胞中而非在其它测试的大肠杆菌菌株中表达的蛋白的溶解度增加。当在ORIGAMI™2细胞中在18°C下表达时,CRM197大部分是可溶的。实施例3.在CRM197表达中的表达增强子序列(EES)EES在包含CRM的载体中促进CRM序列的转录和产生多顺反子mRNA,其翻译成两种蛋白,短的EES肽和CRM肽。对于潜在的3D结构形成,分析天然CRM基因的编码序列,和发现包含多个潜在的发夹结构,其可抑制翻译。创建CRM序列,其将可能产生没有发夹结构但仍翻译相同的CRM氨基酸序列的mRNA。该基因序列称为最佳CRM序列和包含SEQIDNO8。最佳CRM序列在大肠杆菌(例如BL21)和经改造包含氧化细胞质的大肠杆菌(例如Shuffle)中均良好表达。自多顺反子mRNA翻译的CRM肽产生全长蛋白,和认为其比天然CRM编码序列更稳定。不像天然CRM序列,最佳CRM序列作为全长和作为可溶性蛋白在Shuffle细胞中表达。此外,与天然CRM相比,以较低的细胞密度和以与色谱树脂的结合增加观察到最佳CRM序列的更高表达,使CRM蛋白的生产水平更高。实施例4.硫酸铵沉淀来自细胞裂解物的CRM197表达CRM197的SHUFFLE™细胞使用微流化仪打开,向细胞裂解物中加入1M的氯化钠。向其中加入足够的硫酸铵至等于1M,接着以20,000xg离心30分钟,这除去错误折叠的CRM197和大部分的细菌蛋白。在澄清后,硫酸铵浓度进一步增加至2.2M。收集主要是CRM197的沉淀物和再溶于低电导率缓冲液。实施例5.在肝素柱上CRM197的纯化将硫酸铵沉淀的CRM197再溶于20mMTris-HClpH8.0,达到电导率5mS/cm和上样到包含肝素琼脂糖CL-6B树脂(GE)的柱上。在以下条件下进行纯化:流速5ml/min,洗涤缓冲液A:20mMTris-HClpH8。用缓冲液B0-100%梯度,缓冲液B:缓冲液A+1MNaCl以20个CV进行洗脱。洗脱的CRM197通过SDS-PAGE在还原和非还原条件下分析。洗脱的CRM197的纯度大于95%。用DTT还原的蛋白作为单一多肽显示,证实了完整形式的CRM197在大肠杆菌中表达。实施例6.在CaptoDevirs柱上的CRM197的纯化表达CRM197的SHUFFLETM细胞使用微流化仪在1xPBSpH7.4、1%焦磷酸钠中打开。裂解物使用深过滤澄清。将澄清的裂解物上样到包含QSepharoseXL(GE)的柱上,和收集流动通过的部分(flowthroughfraction)。为减少体积和电导率,将流动通过部分使用10K盒(cassette)(Sartorius)进行切向流过滤。CaptoDevirs树脂用25mM焦磷酸钠缓冲液pH8.0平衡。CRM197在以下条件下与柱结合:电导率低于10mS/cm,在包含离液剂(例如在该情况下为尿素)的结合缓冲液中,洗涤缓冲液为25mM焦磷酸钠pH8.0。用NaCl进行洗脱。洗脱的CRM197通过SDS-PAGE在还原和非还原条件下分析。洗脱的CRM197的纯度大于95%。用DTT还原的蛋白作为单一多肽显示,证实了CRM197在纯化过程期间保持完整。实施例7.用于CRM197表征的结合测定将重组可溶性白喉毒素受体HB-EGF(DTR)(Sigma)结合至ELISA板。5%脱脂奶粉的封闭液用于防止高背景。将在1xPBSpH7.4、0.1%Twin20中稀释的重组CRM197在37°C在板上孵育1小时。与HB-EGF结合的CRM197通过兔多克隆抗-CRM197抗体和与大豆过氧化物酶缀合的山羊抗兔抗体(FinaBioSolutions;Rockville,MD)检测。变性的重组CRM197不与受体结合。实施例8.在大肠杆菌中生产的CRM197结合DTR,其类似于来自棒状杆菌和假单胞菌的CRMELISA板用可溶性HB-EGF(肝素-结合EGF-样生长因子)包被,和用5%脱脂奶粉封闭。CRM197与受体结合,和用兔抗-CRM197多克隆抗体和与SBP缀合的山羊抗-兔多克隆抗体检测。在大肠杆菌中表达的CRM197显示对HB-EGF的亲和力与在棒状杆菌和假单胞菌中生产的CRM相同。实施例9CRM197是载体蛋白CRM197按照本发明的方法表达和纯化(实施例1)和使用CDAP化学,化学连接(缀合)至肺炎球菌荚膜多糖血清型14和6B(Lees,A.Producingimmunogenicconstructsusingsolublecarbohydratesactivatedviaorganiccyanylatingreagents.见美国专利号5,651,971;5,693,326和5,849,301)。缀合物自未缀合的蛋白和多糖纯化。根据表1的时间表用缀合物皮下免疫BALB/c雌性小鼠。在完全弗氏佐剂中免疫小鼠和在不完全弗氏佐剂中加强两次,并在第57天采血。表1血清型在CFA中初次*加强IFA**加强IFA**D576B20ug10ug,第28天10ug,第48天采血1420ug5ug,第21天5ug,第48天采血*60%完全弗氏佐剂;**60%不完全弗氏佐剂通过ELISA在用2µg/ml的Pn6B或Pn14(来自ATCC)包被的Brandtech免疫级板上使用γ-特异性检测,测试血清的反应性。图2的结果表明与Pn6B的强反应性。小鼠5086用于杂交瘤生产,并且得到的杂交瘤中的三个用于制备高特异性小鼠抗-6B单克隆抗体。针对Pn14包被板的血清滴定的结果显示在图3中。小鼠1397随后用于生产与P14多糖有反应的四种高特异性小鼠单克隆抗体。未缀合的多糖不产生显著的ELISA吸光度。考虑本文公开的本发明的说明书和实践,本发明的其它实施方案和用途对本领域技术人员而言将是显然的。本文引用的所有参考文献,包括所有出版物、美国和其它国家的专利和专利申请,明确和完整地通过引用结合到本文中。术语“包含”,在任何时候使用时,意图包括术语“由……组成”和“基本上由……组成”。此外,术语“包含”、“包括”、“含有”等不意图限制。预期说明书和实施例仅认为是示例性的,本发明的真实范围和精神由随附权利要求书表明。序列SEQIDNO1 CRM197GADDVVDSSKSFVMENFSSYHGTKPGYVDSIQKGIQKPKSGTQGNYDDDWKEFYSTDNKYDAAGYSVDNENPLSGKAGGVVKVTYPGLTKVLALKVDNAETIKKELGLSLTEPLMEQVGTEEFIKRFGDGASRVVLSLPFAEGSSSVEYINNWEQAKALSVELEINFETRGKRGQDAMYEYMAQACAGNRVRRSVGSSLSCINLDWDVIRDKTKTKIESLKEHGPIKNKMSESPNKTVSEEKAKQYLEEFHQTALEHPELSELKTVTGTNPVFAGANYAAWAVNVAQVIDSETADNLEKTTAALSILPGIGSVMGIADGAVHHNTEEIVAQSIALSSLMVAQAIPLVGELVDIGFAAYNFVESIINLFQVVHNSYNRPAYSPGHKTQPFLHDGYAVSWNTVEDSIIRTGFQGESGHDIKITAENTPLPIAGVLLPTIPGKLDVNKSKTHISVNGRKIRMRCRAIDGDVTFCRPKSPVYVGNGVHANLHVAFHRSSSEKIHSNEISSDSIGVLGYQKTVDHTKVNSKLSLFFEIKSSEQIDNO2 CRM197的结构域SPGHKTQPFLHDGYAVSWNTVEDSIIRTGFQGESGHDIKITAENTPLPIAGVLLPTIPGKLDVNKSKTHISVNGRKIRMRCRAIDGDVTFCRPKSPVYVGNGVHANLHVAFHRSSSEKIHSNEISSDSIGVLGYQKTVDHTKVNSKLSLFFEIKSSEQIDNO3 GATATAC 间隔基SEQIDNO4 GATATACCA 间隔基SEQIDNO5 GATATACCATAT 间隔基SEQIDNO6 XBBXBX 推定的肝素结合位点SEQIDNO7 GRKIRMRCR 肝素结合位点SEQIDNO8 最佳CRM序列ATGGGTGCTGATGATGTTGTTGATTCCTCTAAGTCTTTCGTGATGGAAAATTTCTCGTCCTATCACGGTACCAAGCCTGGCTATGTGGATAGCATTCAAAAGGGTATTCAAAAACCGAAGTCTGGTACCCAGGGCAACTACGATGACGATTGGAAAGAGTTTTACAGCACCGACAACAAATATGACGCGGCAGGCTACAGCGTTGATAATGAAAATCCGCTGAGCGGTAAGGCTGGCGGCGTCGTTAAGGTTACCTATCCGGGTCTGACGAAAGTGCTGGCCCTGAAAGTTGACAATGCTGAAACCATCAAAAAAGAACTGGGTCTGAGCTTGACCGAGCCGCTGATGGAACAGGTTGGTACTGAAGAATTCATTAAACGTTTTGGTGACGGCGCGAGCCGTGTTGTGCTGTCCCTGCCGTTTGCCGAGGGTTCTAGCTCCGTGGAGTATATCAACAATTGGGAACAGGCGAAAGCGTTGAGCGTCGAGCTGGAAATCAATTTCGAGACTCGTGGTAAGCGTGGCCAAGATGCGATGTACGAGTACATGGCCCAGGCATGTGCGGGTAACCGCGTCCGTCGCAGCGTCGGCAGCTCCCTGAGCTGCATTAACCTGGACTGGGACGTGATCCGCGACAAGACTAAGACCAAGATTGAGAGCCTGAAAGAGCACGGTCCGATTAAGAACAAAATGTCCGAGTCTCCGAACAAAACGGTGAGCGAAGAAAAAGCCAAACAGTATCTGGAAGAATTCCATCAGACCGCCCTGGAGCACCCAGAGCTGAGCGAGCTGAAAACCGTCACCGGCACGAATCCGGTTTTTGCGGGTGCGAACTACGCGGCATGGGCAGTCAATGTTGCGCAAGTCATCGACAGCGAAACGGCTGATAACTTGGAGAAAACCACCGCGGCACTGAGCATTCTGCCGGGCATCGGTAGCGTTATGGGCATTGCGGACGGTGCCGTGCATCACAATACCGAAGAAATTGTCGCGCAGAGCATCGCATTGTCTAGCCTGATGGTTGCACAGGCCATTCCGCTGGTAGGCGAATTGGTGGATATCGGTTTCGCGGCTTACAATTTCGTTGAGTCGATCATTAACCTGTTTCAAGTCGTTCACAATAGCTATAACCGTCCGGCATACAGCCCGGGTCATAAGACGCAACCGTTTCTGCATGATGGCTATGCCGTGAGCTGGAACACGGTCGAGGATTCGATTATCCGTACCGGTTTTCAGGGTGAGAGCGGTCACGACATCAAAATCACCGCGGAGAACACGCCGCTGCCTATTGCGGGCGTCCTGCTGCCGACGATCCCGGGCAAACTGGACGTTAACAAGAGCAAGACCCATATCAGCGTCAACGGTCGTAAGATTCGCATGCGTTGTCGTGCAATCGACGGTGACGTGACGTTCTGCCGCCCAAAAAGCCCGGTGTACGTGGGTAACGGCGTGCACGCGAATCTGCATGTCGCGTTCCACCGCTCCTCAAGCGAGAAAATCCACAGCAATGAAATTAGCAGCGACAGCATTGGTGTGTTGGGCTACCAAAAGACCGTGGATCACACCAAGGTTAATAGCAAGCTGAGCCTGTTCTTTGAGATCAAAAGCSEQIDNO9 非最佳CRM序列ATGGGTGCCGATGACGTGGTTGACTCTTCCAAAAGCTTCGTCATGGAAAACTTCAGCTCCTATCACGGCACTAAACCGGGTTATGTCGACAGCATCCAGAAAGGCATCCAGAAACCGAAATCTGGCACTCAGGGTAACTATGACGACGACTGGAAAGAGTTCTACTCTACCGACAACAAATACGACGCGGCTGGTTATTCTGTGGACAACGAAAACCCGCTGTCTGGTAAAGCTGGTGGTGTTGTTAAAGTGACCTACCCGGGTCTGACCAAAGTTCTGGCTCTGAAAGTGGACAACGCCGAAACCATCAAAAAAGAACTGGGTCTGTCTCTGACCGAACCGCTGATGGAACAGGTAGGTACCGAGGAATTCATCAAACGTTTTGGTGATGGTGCGTCCCGTGTTGTACTGTCTCTGCCATTTGCCGAAGGTTCTAGCTCTGTCGAGTACATCAACAACTGGGAGCAGGCCAAAGCTCTGTCTGTGGAACTGGAAATCAACTTCGAGACCCGTGGTAAACGTGGTCAGGACGCAATGTATGAATACATGGCACAGGCTTGCGCGGGTAACCGTGTACGTCGTTCTGTAGGTTCTTCCCTGTCTTGCATCAACCTGGACTGGGATGTCATCCGTGACAAAACCAAAACCAAAATCGAGTCCCTGAAAGAGCACGGTCCGATCAAAAACAAAATGAGCGAATCTCCGAACAAAACGGTCTCTGAGGAAAAAGCGAAACAGTACCTGGAAGAATTCCATCAGACCGCCCTGGAACACCCGGAACTGTCTGAACTGAAAACCGTTACCGGTACTAACCCGGTTTTCGCAGGTGCTAACTACGCAGCGTGGGCGGTTAACGTAGCCCAGGTAATCGATTCCGAAACCGCAGACAACCTGGAAAAAACGACTGCGGCTCTGTCTATTCTGCCGGGTATTGGTAGCGTGATGGGTATTGCAGATGGTGCAGTTCACCACAACACGGAAGAAATCGTTGCGCAGTCTATCGCTCTGTCTTCTCTGATGGTAGCACAGGCGATCCCGCTGGTTGGTGAACTGGTTGACATTGGCTTCGCGGCCTACAACTTCGTTGAATCCATCATCAACCTGTTCCAGGTTGTGCACAACTCTTACAACCGTCCAGCTTACTCTCCGGGTCACAAAACCCAGCCGTTCCTGCACGACGGTTATGCGGTTTCTTGGAACACCGTTGAAGACAGCATCATCCGTACTGGTTTCCAGGGTGAATCTGGCCACGACATCAAAATCACTGCTGAAAACACCCCGCTGCCGATCGCAGGTGTTCTCCTGCCAACTATTCCGGGTAAACTGGACGTGAACAAATCCAAAACGCACATCTCCGTGAACGGTCGTAAAATCCGCATGCGTTGTCGTGCGATTGATGGTGACGTTACTTTCTGTCGTCCGAAATCTCCGGTCTACGTAGGTAACGGTGTACATGCTAACCTCCATGTAGCGTTCCACCGTTCTTCTTCCGAGAAAATCCACTCCAACGAGATCTCTAGCGACTCTATCGGTGTTCTGGGTTACCAGAAAACCGTTGACCACACCAAAGTGAACTCCAAACTCAGCCTGTTCTTCGAAATCAAATCTSEQIDNO10 crm7GAGCTCTAAGAAGGAGATATACATGGGTGCCGATGACGTGGTTGACTCTSEQIDNO11 crm7_2GAGCTCTTAAGAAGGAGATATACATGGGTGCCGATGACGTGGTTGACTCTSEQIDNO12 crm8GAGCTCTAAGAAGGAGATATACAATGGGTGCCGATGACGTGGTTGACTCTSEQIDNO13 crm9GAGCTCTAAGAAGGAGATATACACATGGGTGCCGATGACGTGGTTGACTCTSEQIDNO14 crm12GAGCTCTAAGAAGGAGATATACCATATATGGGTGCCGATGACGTGGTTGACTCTSEQIDNO15TCTAGAAATAATTTTGTTTAACTTTAAGAAGGAGATATACATATGGCTAGCATGACTGGTGGACAGCAAATGGGTCGGGATCCGAATTCGAGCTCTAAGAAGGAGATATACCSEQIDNO16TCTAGAAATAATTTTGTTTAACTTTAAGAAGGAGATATACATATGGCTAGCATGACTGGTAAGGAGATATACCSEQIDNO17TCTAGAAATAATTTTGTTTAACTTTAAGAAGGAGATATACATATGGCTAGCATGACTGGTGCGMAYCCATTCAGTGAAGAAGRAGSTTYATTT当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1