凝乳天冬氨酸蛋白酶组合物的制作方法
本发明涉及液体或干燥的粒状凝乳天冬氨酸蛋白酶组合物,该组合物包含添加的多肽/蛋白。
背景技术:
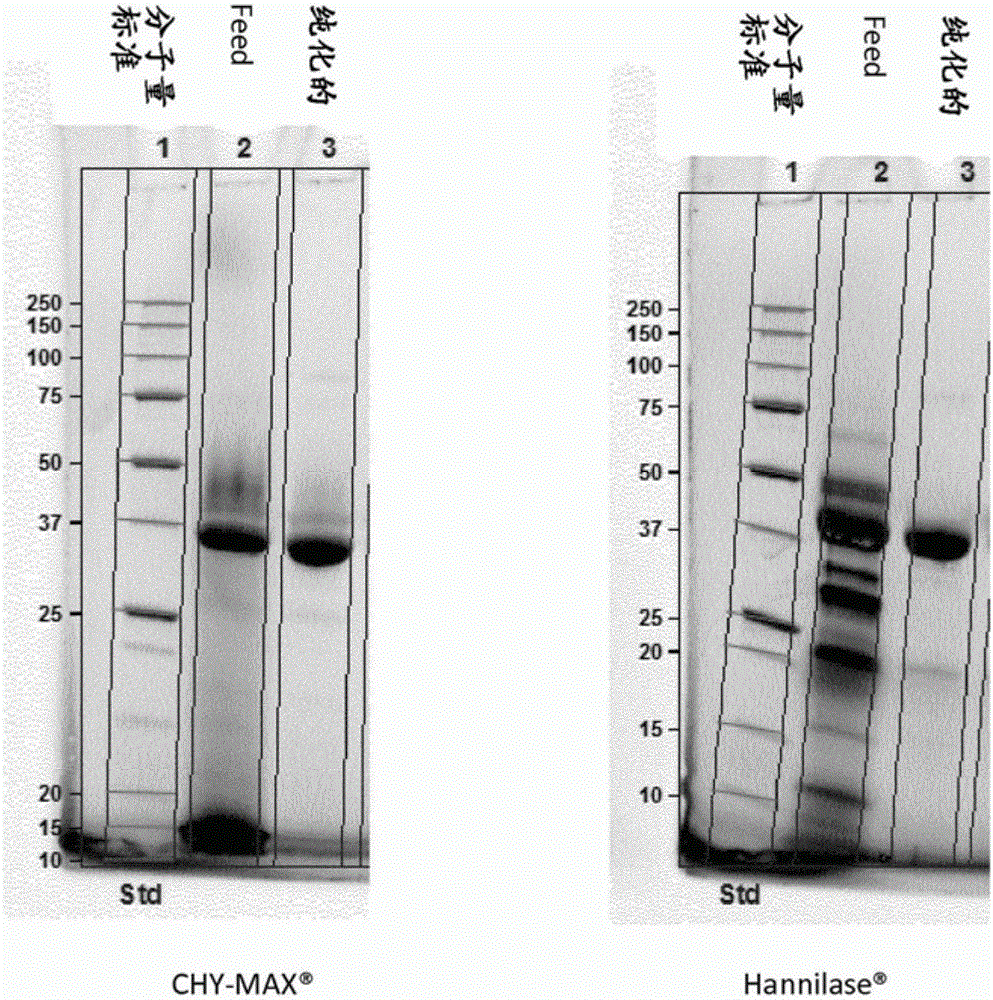
:通过凝乳性酶诸如凝乳酶和胃蛋白酶进行的乳的酶法凝固是奶酪生产中最重要的过程之一。乳的酶法凝固是两个阶段的过程:第一阶段中蛋白水解酶(凝乳酶或胃蛋白酶)攻击κ-酪蛋白,导致酪蛋白胶束结构的亚稳态,第二阶段中乳随后凝固并形成凝结物。凝乳酶(EC3.4.23.4)和胃蛋白酶(EC3.4.23.1),哺乳动物胃中的凝乳性酶,是属于一个广义类的肽酶的天冬氨酸蛋白酶。毛霉凝乳酶(Mucorpepsin)(EC3.4.23.23)是一种来自真菌米赫根毛霉(Rhizomucormiehei)的凝乳性酶。商业相关的凝乳性酶产品常常是液体组合物,在本领域中描述了多种不同的方式以试图稳定产品中的凝乳性酶——例如以改善酶的存储稳定性或比活性。例如,EP2333056A1(DSM,申请日12.04.2007)描述了甲酸盐、乙酸盐、乳酸盐、丙酸盐、苹果酸盐、延胡索酸盐或丙二醇可增高液体组合物/产品中天冬氨酸蛋白酶的稳定性。WO2012/127005A1(DSM)描述了一种包含浓度为2-100g/kg无机盐以及防腐剂的稳定的液体凝乳酶组合物,所述防腐剂诸如甲酸盐、乙酸盐、乳酸盐、丙酸盐、苹果酸盐、苯甲酸盐、山梨酸盐或延胡索酸盐、乙二醇、丙二醇、甘油、赤藓糖醇、木糖醇、甘露醇、山梨醇、肌醇或半乳糖醇。所述凝乳酶组合物的最高强度为1500IMCU/ml(参见例如第6页第1-3行)。聚乙二醇(PEG)是环氧乙烷的聚合物–其也可称为聚氧乙烯(POE)。分子量在宽范围诸如从300g/mol至10000000g/mol内的PEG是可商购的。DE1492060A1(Nordmark-WerkeGmbH,1969年公开)公开了一种通过添加浓度为1-20wt%(对应于10000-200000ppm)的具有400-6000分子量的聚乙二醇(PEG)来制备胃蛋白酶组合物的方法。发明概述本发明待解决的一个问题是提供一种新型的凝乳天冬氨酸蛋白酶(例如,凝乳酶)组合物,其中天冬氨酸蛋白酶具有增高的物理稳定性和/或比活性。解决方案是基于本发明的发明人已鉴定出,通过向不同的天冬氨酸蛋白酶(例如,凝乳酶)中添加合适的多肽/蛋白制剂,显著改善所述酶组合物的物理稳定性和比活性。工业酶的液体制剂在例如运输过程中经受物理作用力(诸如摇动),酶组合物的物理稳定性可通过反复摇动(例如,通过颠倒)具有高的顶部空间与样品体积比的测试试管中的样品来检测。如本文工作实施例中所讨论的,向例如骆驼凝乳酶(M,Chr.HansenA/S)中添加多种不同的多肽/蛋白制剂,这些多肽/蛋白制剂中的一些显著增高了骆驼凝乳酶的物理稳定性。如本文工作实施例中所讨论的,向牛凝乳酶(Chr.HansenA/S)、骆驼凝乳酶(M,Chr.HansenA/S)和毛霉凝乳酶(Chr.HansenA/S)中添加多种不同的多肽/蛋白制剂,这些多肽/蛋白制剂中的一些显著增高了酶组合物的比活性。对于牛凝乳酶和骆驼凝乳酶比活性的增高是最显著的。如本领域技术人员在本发明上下文中所理解的,凝乳天冬氨酸蛋白酶组合物的比活性涉及活性/每组合物中的凝乳天冬氨酸蛋白酶蛋白的总量IMCU。如本文工作实施例中所描述的,向纯化的凝乳酶样品中添加例如乳清蛋白制剂产生具有显著更高的IMCU/ml强度的酶组合物——即具有更高比活性的组合物。例如,添加0,5%(w/w)乳清蛋白浓缩物制剂WPC80使骆驼凝乳酶组合物本身的强度增高约10%。不受理论的限制,对本发明人而言感到意外是通过简单地添加合适量的例如乳清蛋白就可能增高例如凝乳酶组合物/产品的强度。本文相关的是注意到,酪蛋白水解物未显著增高物理稳定性和/或比活性。如本领域技术人员所知的——在酪蛋白水解物中已经进行了酪蛋白的水解。不受理论的限制——据信在这种酪蛋白水解物制剂中,大量的多肽是少于10个氨基酸的。换句话说并且不受理论的限制——据信当使用长于10个氨基酸的多肽时获得本文有关的增高的物理稳定性和比活性效果。如本领域所知的——术语肽可以在大小的基础上区别于术语蛋白,肽(以任意基准)可以理解为大约50个或更少的氨基酸。换句话说,长于50个氨基酸的多肽在本领域通常被理解为是蛋白。因此,长于50个氨基酸的多肽在本文中或者可以被称为蛋白。如本文工作实施例中所讨论的,本发明有关的增高的/改善的物理稳定性和/或比活性效果与向凝乳酶中添加的多肽/蛋白组合物的量有关——其中如果添加小于0.01%(w/w),未获得显著的积极效果。不受理论的限制——据信添加多肽/蛋白为凝乳酶提供了增高的构象稳定性,并且这可以解释在本文工作实施例中观察到的增高的物理稳定性和增高的比活性。不受理论的限制——据信现有技术中没有描述或暗示添加多肽/蛋白可增高天冬氨酸蛋白酶凝乳性酶诸如,例如,凝乳酶的稳定性——具体而言,现有技术中没有描述可增高构象稳定性。酶的构象稳定性示于本文的图3。如本领域所知的——构象的丧失等同于酶活性的丧失——即酶的比活性更小。不受理论的限制——构象丧失可增高酶的变性/沉淀并因此产生更小的如本文所讨论的物理稳定性。如本领域所知的——多种凝乳天冬氨酸蛋白酶可看作结构上相对地类似。如本领域所知的——从不同的哺乳动物或真菌物种(诸如例如,牛、骆驼、绵羊、猪或毛霉菌)获得的不同的天然野生型凝乳天冬氨酸蛋白酶多肽序列具有相对高的三级结构相似性。本文图4中提供了与本文相关的来自不同哺乳动物物种(奶牛、水牛、山羊、绵羊、骆驼和猪)的不同凝乳性凝乳酶序列的比对——如图4中可看出,它们具有密切的序列关系并且已知具有非常高的三级结构相似性。本文图5中提供了与本文相关的商购的来自不同哺乳动物或真菌物种的不同凝乳性凝乳酶序列(骆驼凝乳酶、牛凝乳酶、牛胃蛋白酶、真菌的毛霉凝乳酶和真菌的内座壳凝乳酶(Endothiapepsin))的比对。可以说图5的这5个不同的序列不是高度一致的——但是如本领域技术人员所知的,已知这5个不同的凝乳天冬氨酸蛋白酶都具有高三级序列相似性。如上文所述并且如本文工作实施例中所显示的,对于牛凝乳酶、骆驼凝乳酶和毛霉凝乳酶已经证明了与本文相关的改善的/增高的稳定性/活性效果。不受理论的限制——据信,没有明显的技术方面的理由认为与本文相关的改善/增高的稳定性效果一般与凝乳天冬氨酸蛋白酶不相关——如上文所述,已知这些酶具有高度的三级结构相似性,并且如本领域技术人员在本发明上下文中所理解的,这种三级结构的相似性使得以下论述看起来是合理的:即,本文描述的聚合物-酶相互作用以获得改善的稳定性是与本文相关的结构相似的凝乳天冬氨酸蛋白酶的一般类作用。因此,本发明第一方面涉及一种用于制备液体凝乳天冬氨酸蛋白酶组合物的方法,其中该方法包括以下步骤:(a):获得纯化的液体凝乳天冬氨酸蛋白酶样品,该样品包括:(i):25IMCU/g样品-30000IMCU/g样品的强度;和(ii):其中,所述纯化的样品中通过SDS-PAGE测定的具有大于10kDa大小的蛋白的总量的至少70%是凝乳天冬氨酸蛋白酶;以及(b):向步骤(a)的样品中添加合适量的多肽制剂,以获得液体凝乳天冬氨酸蛋白酶组合物,所述多肽制剂包含长于10个氨基酸的多肽,其中所述多肽不是凝乳天冬氨酸蛋白酶也不是降解天冬氨酸蛋白酶的酶,其中所述组合物包含:(I):强度为26IMCU/g所述组合物-30100IMCU/g所述组合物的凝乳天冬氨酸蛋白酶;和(II):浓度是所述组合物的0.01%-10%(w/w)的步骤(b)添加的不是凝乳天冬氨酸蛋白酶且长于10个氨基酸的多肽;并且其中,在5℃存储一周之后检测,(I)中的强度(IMCU/g所述组合物)至少比(i)中的强度(IMCU/g样品)高1%。检测(i)和(II)中的凝乳天冬氨酸蛋白酶强度并从而确定(II)中更高的强度的要求是否得到满足是常规的工作。在本发明上下文中,对于本领域技术人员而言很明显的是,用于检测存储一周后(i)中的强度的对照样品是步骤(a)中的样品(即,没有步骤(b)中添加的多肽制剂)。如本文讨论的,本发明人测试了多种多肽/蛋白制剂(参见本文的工作实施例),其中一些显著增高了酶组合物的比活性。因此,基于本文的教导和本领域技术人员的一般常识——本领域技术人员无需过多的负担可以确定在步骤(b)中添加的合适量的合适的优选蛋白制剂以获得第一方面的所述方法的所需的增高的/更高的强度。本发明上下文中,很明显,第一方面的方法的步骤(b)中,优选不添加降解天冬氨酸蛋白酶的酶,步骤(b)中的术语“不是降解天冬氨酸蛋白酶的酶”应据此理解。第(II)项中的浓度是关于组合物本身的。例如,如果组合物本身的重量是1kg,第(II)项的步骤(b)中添加的多肽的浓度是1%(w/w),则步骤(b)中添加了10g长于10个氨基酸的多肽。对本领域技术人员而言,在步骤(b)中添加合适量的多肽制剂以获得根据第一方面第(II)项的添加的多肽的所需浓度是常规工作。本文图1中显示了牛凝乳酶(Chr.HansenA/S)和毛霉凝乳酶(Chr.HansenA/S)的不同样品的SDS-PAGE数据。和都是泳道2(命名为“Feed”),基本上取自发酵液的未纯化样品,泳道3是纯化的样品。可以看出——纯化的样品在第一方面的第(ii)项的范围内——即,它们是其中具有大于10kDa大小的蛋白的总量的至少70%是凝乳天冬氨酸蛋白酶的样品。未纯化的样品不在第一方面的第(ii)项的范围内。SDS-PAGE是本领域技术人员公知的技术——即,对本领域技术人员而言,确定目的纯化的凝乳天冬氨酸蛋白酶样品是否是第一方面的第(ii)项范围内的样品是常规工作。从本文图1中可看出,对于例如在泳道3的纯化样品中的在34-38kDa的迁移范围内有两个条带。不受理论的限制——据信这两个条带代表的两种不同的糖基化形式。如本领域技术人员在本发明上下文中所理解的——这两种不同的糖基化形式都是凝乳天冬氨酸蛋白酶,因为它们都有凝乳性酶活性。如本领域技术人员在本发明上下文中所理解的——第(i)项中的术语“IMCU/g所述样品”涉及每克样品本身的IMCU酶活性。类似的——第(I)项中的术语“IMCU/g所述组合物”涉及每克组合物本身的IMCU酶活性。可优选的是第一方面的液体组合物具有10g-10000kg的总重量。如本领域技术人员在本发明上下文中所理解的——重量为1kg的本文相关的第一方面的液体组合物大约具有1升的体积。本发明第二方面涉及一种液体凝乳天冬氨酸蛋白酶组合物,其可通过所述第一方面的方法或者其任何与本文相关的实施方式来获得。本文第一方面和第二方面涉及液体组合物——然而,凝乳天冬氨酸蛋白酶(例如,凝乳酶)也可作为干燥的粒状组合物/产品进行商业化。因此,本发明第三方面涉及一种用于制备干燥的凝乳天冬氨酸蛋白酶组合物的方法,其中所述方法包括以下步骤:(1):首先根据所述第一方面的方法或者其任何与本文相关的实施方式制备液体凝乳天冬氨酸蛋白酶组合物;(2):使步骤(1)的液体组合物干燥并粒化以获得干燥的粒状凝乳天冬氨酸蛋白酶组合物。在本发明上下文中干燥步骤(2)可以看作对本领域技术人员来说常规的步骤——因此本文无需对该步骤本身进行详细描述。本发明第四方面涉及干燥的粒状凝乳天冬氨酸蛋白酶组合物,其可通过所述第三方面的方法或者其任何与本文相关的实施方式来获得。本发明第五方面涉及液体凝乳天冬氨酸蛋白酶组合物,其包含:(I):强度为25IMCU/g所述组合物-30000IMCU/g所述组合物的凝乳天冬氨酸蛋白酶;(II):浓度为所述组合物的0.01%-10%(w/w)的长于10个氨基酸且不是凝乳天冬氨酸蛋白酶的多肽;以及(III):浓度为1-350g/kg的盐,并且其中所述组合物的pH为2-8;以及(x):其中第(II)项中所述长于10个氨基酸的多肽是选自由如下组成的多肽组的至少一种多肽:乳清蛋白、α乳白蛋白、β-乳球蛋白、转铁蛋白、乳过氧化物酶、酪蛋白、α-s1-酪蛋白、α-s2-酪蛋白、β-酪蛋白、κ-酪蛋白、卵清蛋白、明胶、牛血清白蛋白、大豆蛋白、豌豆蛋白、玉米蛋白、马铃薯蛋白、大麻蛋白、稻蛋白、螺旋藻蛋白、小麦蛋白、花生蛋白、向日葵蛋白、油菜籽蛋白、血蛋白和藻类蛋白。在本发明上下文中——本领域技术人员将知道或者可常规地确定(例如,基于具体相关的氨基酸序列)第(x)项中所述长于10个氨基酸的多肽的来源。如本领域技术人员在本发明上下文中所理解的——与第(III)项相关的术语“g/kg”涉及每kg所述组合物本身的盐的克数。本发明第六方面涉及干燥的粒状凝乳天冬氨酸蛋白酶组合物,其包含:(I):强度为25IMCU/g所述组合物-30000IMCU/g所述组合物的凝乳天冬氨酸蛋白酶;(II):浓度为所述组合物的0.01%-10%(w/w)的长于10个氨基酸且不是凝乳天冬氨酸蛋白酶的多肽;以及(III):盐,并且其中悬浮于水中的所述组合物的pH为2-8;以及(x):其中第(II)项中所述长于10个氨基酸的多肽是选自由如下组成的多肽组的至少一种多肽:乳清蛋白、α乳白蛋白、β-乳球蛋白、转铁蛋白、乳过氧化物酶、酪蛋白、α-s1-酪蛋白、α-s2-酪蛋白、β-酪蛋白、κ-酪蛋白、卵清蛋白、明胶、牛血清白蛋白、大豆蛋白、豌豆蛋白、玉米蛋白、马铃薯蛋白、大麻蛋白、稻蛋白、螺旋藻蛋白、小麦蛋白、花生蛋白、向日葵蛋白、油菜籽蛋白、血蛋白和藻类蛋白。本发明第七方面涉及液体凝乳天冬氨酸蛋白酶组合物,其包括强度为1600IMCU/g所述组合物-30000IMCU/g所述组合物的凝乳天冬氨酸蛋白酶以及浓度为1-350g/kg的盐,且其中所述组合物的pH为2-8。本发明第八方面涉及干燥的粒状凝乳天冬氨酸蛋白酶组合物,其包括强度为1600IMCU/g所述组合物-30000IMCU/g所述组合物的凝乳天冬氨酸蛋白酶以及盐,且其中悬浮于水中的所述组合物的pH为2-8。本文所述的凝乳天冬氨酸蛋白酶组合物可根据本领域用于——例如,制备目的食品或饲料产品(诸如例如,基于乳的目的产品,例如可以是奶酪产品)。因此,本发明第九方面涉及一种用于制备食品或饲料产品的方法,包括向食品或饲料成分中添加有效量的第五至第八方面的任一或其与本文相关的实施方式的任一的凝乳天冬氨酸蛋白酶组合物,并进行进一步的制备步骤以获得食品或饲料产品。定义本文相关的术语的所有定义均与本领域技术人员相对于本文相关的技术上下文所理解的一致。术语“凝乳性酶”指具有凝乳性酶活性的酶,即活性的凝乳性酶。凝乳活性可以用国际凝乳单位(IMCU)/ml或IMCU/g表示。本领域技术人员知道如何确定本文相关的凝乳性酶活性。本文的工作实施例1中提供了确定凝乳性酶活性和凝乳性酶比活性的标准方法的实例。如本领域所知的——通过凝结活性(IMCU/ml)除以总蛋白含量(mg总蛋白/ml)来确定凝结比活性(IMCU/mg总蛋白)。术语“序列一致性”涉及两个氨基酸序列之间的相关性。为了本发明的目的,根据本领域确定两个氨基酸序列之间的序列一致性程度,并且优选使用Needleman-Wunsch算法(Needleman和Wunsch,1970,J.Mol.Biol.48:443-453),如在EMBOSS软件包(EMBOSS:TheEuropeanMolecularBiologyOpenSoftwareSuite,Rice等人,2000,TrendsGenet.16:276-277)的Needle程序(优选3.0.0或更高版本)中实施的。所使用的任选参数是空位开放罚分为10,空位延伸罚分为0.5和EBLOSUM62(BLOSUM62的EMBOSS版本)置换矩阵。标签为“最长一致性”(使用-nobrief选项获得)的Needle输出作为百分比一致性,并按如下计算:(相同残基×100)/(比对长度-比对中的空位总数)。术语“变体”指具有凝乳性酶活性的肽,其包含在一个或多个(几个)位置上的改变,即取代、插入和/或缺失。取代是指用不同的氨基酸取代占据某位置的氨基酸;缺失是指去除占据某位置的氨基酸;插入是指添加与占据某位置的氨基酸相邻的1-3个氨基酸。氨基酸可以是天然或非天然氨基酸——例如,用例如D-丙氨酸的特别的D-异构体(或D-形式)的取代在理论上是可能的。本发明的实施方式描述于下文,仅作为示例的方式。附图说明图1:本文图1中显示了牛凝乳酶(Chr.HansenA/S)和毛霉凝乳酶(Chr.HansenA/S)的不同样品的SDS-PAGE数据。和都是泳道2(名为“Feed”),基本上取自发酵液的未纯化样品,泳道3是纯化的样品。图2:显示了用于确定与本文相关的物理稳定性的如本文讨论的颠倒实验的一些结果。更多细节参见本文的工作实施例。图3:说明了酶的构象稳定性。图4:来自不同哺乳动物物种(牛、水牛、山羊、绵羊、骆驼和猪)的与本文相关的不同凝乳性凝乳酶序列的比对。图4的所有序列都是公众可获得的。图5:与本文相关的可通过商业途径获得的来自不同的哺乳动物或真菌物种的不同凝乳天冬氨酸蛋白酶序列(骆驼凝乳酶、牛凝乳酶、牛胃蛋白酶、真菌的毛霉凝乳酶和真菌的内座壳凝乳酶)的比对。图5的所有序列都是公众可获得的。发明详述凝乳天冬氨酸蛋白酶下文对与本文相关的凝乳天冬氨酸蛋白酶的具体实施方式/实施例的讨论与对本文讨论的发明的所有方面都是相关的。在一优选实施方式中,凝乳天冬氨酸蛋白酶是选自由如下组成的组的凝乳性酶:凝乳酶(EC3.4.23.4)、胃蛋白酶(EC3.4.23.1)和毛霉凝乳酶(EC3.4.23.23)。如本文工作实施例中所讨论的,对于牛凝乳酶组合物和骆驼凝乳酶组合物,与本文相关的比活性和强度的增高最显著。因此,在一优选实施方式中,凝乳天冬氨酸蛋白酶是凝乳酶(EC3.4.23.4)。优选的凝乳天冬氨酸蛋白酶是例如WO02/36752A2(Chr.Hansen)中所述的单峰骆驼(Cameliusdromedarius)凝乳酶。本文或可称为骆驼凝乳酶,公众所知的成熟多肽氨基酸序列示于本文图5中。如本领域所知的——对本领域技术人员而言,制备目的酶的变体(即,氨基酸修饰)且不显著改变酶的特性是常规工作。因此,在一优选实施方式中,凝乳天冬氨酸蛋白酶是包含本文图5所示的多肽氨基酸序列(称为“Camel_chymosin”)的单峰骆驼凝乳酶或单峰骆驼凝乳酶的变体,其中所述变体包含与本文图5所示的骆驼凝乳酶多肽氨基酸序列具有至少90%(优选至少95%,更优选至少99%)序列一致性的多肽序列。优选的凝乳天冬氨酸蛋白酶是牛凝乳酶。本文或称为奶牛凝乳酶,公众所知的成熟多肽氨基酸序列示于本文图5中。因此,在一优选实施方式中,凝乳天冬氨酸蛋白酶是包含本文图5所示的多肽氨基酸序列(称为“Cow_chymosin”)的牛凝乳酶或牛凝乳酶的变体,其中所述变体包含与本文图5所示的牛凝乳酶多肽氨基酸序列具有至少90%(优选至少95%,更优选至少99%)序列一致性的多肽序列。优选的凝乳天冬氨酸蛋白酶是牛胃蛋白酶.本文或称为奶牛胃蛋白酶,公众所知的成熟多肽氨基酸序列示于本文图5中。因此,在一优选实施方式中,凝乳天冬氨酸蛋白酶是包含本文图5所示的多肽氨基酸序列的牛胃蛋白酶(称为“Cow_pepsin”)或牛胃蛋白酶的变体,其中所述变体包含与本文图5所示的牛胃蛋白酶多肽氨基酸序列具有至少90%(优选至少95%,更优选至少99%)序列一致性的多肽序列。优选的凝乳天冬氨酸蛋白酶是毛霉凝乳酶(参见例如,EP0805866B1(Harboeetal,Chr.HansenA/S,Denmark))。公众所知的成熟多肽氨基酸序列示于本文图5中。因此,在一优选实施方式中,凝乳天冬氨酸蛋白酶是包含本文图5所示的多肽氨基酸序列(称为“Mucor”)的毛霉凝乳酶或毛霉凝乳酶的变体,其中所述变体包含与本文图5所示的毛霉凝乳酶多肽氨基酸序列具有至少90%(优选至少95%,更优选至少99%)序列一致性的多肽序列。优选的凝乳天冬氨酸蛋白酶是内座壳凝乳酶。公众所知的成熟多肽氨基酸序列示于本文图5中。因此,在一优选实施方式中,凝乳天冬氨酸蛋白酶是包含本文图5所示的多肽氨基酸序列(称为“Endothia”)的内座壳凝乳酶或内座壳凝乳酶的变体,其中所述变体包含与本文图5所示的内座壳凝乳酶多肽氨基酸序列具有至少90%(优选至少95%,更优选至少99%)序列一致性的多肽序列。添加的多肽/蛋白如上文所述——第一方面的方法中的步骤(b)为:步骤(b):向步骤(a)的样品中添加合适量的多肽制剂,以获得液体凝乳天冬氨酸蛋白酶组合物,所述多肽制剂包含长于10个氨基酸的多肽,其中所述多肽不是凝乳天冬氨酸蛋白酶也不是降解天冬氨酸蛋白酶的酶,如上所述——第五方面的液体凝乳天冬氨酸蛋白酶组合物的第(II)项和第六方面的干燥的粒状凝乳天冬氨酸蛋白酶组合物的第(II)项为:(II):浓度为所述组合物的0.01%-10%(w/w)的长于10个氨基酸且不是凝乳天冬氨酸蛋白酶的多肽;下文对与本文相关的“长于10个氨基酸的多肽”的具体实施方式/实施例的讨论与对本文讨论的发明的所有方面都是相关的。本发明上下文中,很明显,第一方面的方法的步骤(b)中,优选不添加降解天冬氨酸蛋白酶的酶,步骤(b)中的术语“不是降解天冬氨酸蛋白酶的酶”应据此理解。优选地,所述长于10个氨基酸的多肽是选自由如下所组成的多肽组的至少一种多肽:乳清蛋白、α乳白蛋白、β-乳球蛋白、转铁蛋白、乳过氧化物酶、酪蛋白、α-s1-酪蛋白、α-s2-酪蛋白、β-酪蛋白、κ-酪蛋白、卵清蛋白、明胶、牛血清白蛋白、大豆蛋白、豌豆蛋白、玉米蛋白、马铃薯蛋白、大麻蛋白、稻蛋白、螺旋藻蛋白、小麦蛋白、花生蛋白、向日葵蛋白、油菜籽蛋白、血蛋白和藻类蛋白。更优选地,所述长于10个氨基酸的多肽是选自由如下所组成的多肽组的至少一种多肽:乳清蛋白、α乳白蛋白、β-乳球蛋白、转铁蛋白、乳过氧化物酶、酪蛋白、α-s1-酪蛋白、α-s2-酪蛋白、β-酪蛋白、κ-酪蛋白、卵清蛋白、明胶和牛血清白蛋白。在上一段提及的组中,优选所述长于10个氨基酸的多肽是选自由如下组成的多肽组的至少一种多肽:乳清蛋白、α乳白蛋白、β-乳球蛋白、酪蛋白、α-s1-酪蛋白、α-s2-酪蛋白、β-酪蛋白、κ-酪蛋白、卵清蛋白、明胶和牛血清白蛋白。在一优选实施方式中——长于10个氨基酸的多肽是长于25个氨基酸的多肽,更优选地是长于40个氨基酸的多肽。如本文工作实施例中所讨论的——通过添加例如乳清蛋白、卵清蛋白和BSA(本文中全部可以称为相对大的蛋白)获得与本文相关的积极的结果。如本领域所知的——术语肽可以在大小的基础上区别于术语蛋白,肽(以任意基准)可以理解为大约50个或更少的氨基酸。换句话说,长于50个氨基酸的多肽在本领域通常被理解为是蛋白。因此,长于50个氨基酸的多肽在本文中或者可以被称为蛋白。在一优选实施方式中,——长于10个氨基酸的多肽是长于50个氨基酸的蛋白,更优选地是长于75个氨基酸的蛋白,甚至更优选地长于150个氨基酸。甚至更优选的长于10个氨基酸的多肽是长于300个氨基酸的蛋白。第一方面-一种用于制备液体凝乳天冬氨酸蛋白酶组合物的方法如上文所述–本发明第一方面涉及一种用于制备液体凝乳天冬氨酸蛋白酶组合物的方法,其中该方法包括以下步骤:(a):获得纯化的液体凝乳天冬氨酸蛋白酶样品,该样品包括:(i):25IMCU/g所述样品-30000IMCU/g所述样品的强度;和(ii):其中,在所述纯化的样品中,通过SDS-PAGE测定的具有大于10kDa大小的蛋白的总量的至少70%是凝乳天冬氨酸蛋白酶;以及(b):向步骤(a)的样品中添加合适量的多肽制剂,以获得液体凝乳天冬氨酸蛋白酶组合物,所述多肽制剂包含长于10个氨基酸的多肽,其中所述多肽不是凝乳天冬氨酸蛋白酶也不是降解天冬氨酸蛋白酶的酶,其中所述组合物包含:(I):强度为26IMCU/g所述组合物-30100IMCU/g所述组合物的凝乳天冬氨酸蛋白酶;和(II):浓度是所述组合物的0.01%-10%(w/w)的步骤(b)添加的不是凝乳天冬氨酸蛋白酶且长于10个氨基酸的多肽;并且其中,在5℃存储一周之后检测,(I)中的强度(IMCU/g所述组合物)比(i)中的强度(IMCU/g样品)高至少1%。在优选的实施方式中,在5℃存储一周之后检测,(I)中的强度(IMCU/g所述组合物)比(i)中的强度(IMCU/g样品)高至少3%;更优选地,在5℃存储一周之后检测,(I)中的强度(IMCU/g所述组合物)比(i)中的强度(IMCU/g样品)高至少7%;甚至更优选地,在5℃存储一周之后检测,(I)中的强度(IMCU/g所述组合物)比(i)中的强度(IMCU/g样品)高至少10%;最优选地,在5℃存储一周之后检测,(I)中的强度(IMCU/g所述组合物)比(i)中的强度(IMCU/g所述组合物)高至少15%。凝乳天冬氨酸蛋白酶的优选实施例/实施方式如上文所述。“长于10个氨基酸的多肽”的优选实施例/实施方式如上文所述。优选第(i)项的酶强度是100MCU/g所述样品-10000IMCU/g所述样品的强度,更优选地是500IMCU/g所述样品-6000IMCU/g所述样品的强度。优选第(I)项的酶强度是100IMCU/g所述组合物-10000IMCU/g所述组合物的强度,更优选地是500IMCU/g所述组合物-6000IMCU/g所述组合物的强度。优选地,步骤(a)(ii)的纯化的样品是这样一种样品,其中所述纯化样品中通过SDS-PAGE测定的具有大于10kDa大小的蛋白的总量的至少80%是凝乳天冬氨酸蛋白酶;更优选地,其中所述纯化样品中通过SDS-PAGE测定的具有大于10kDa大小的蛋白的总量的至少90%是凝乳天冬氨酸蛋白酶;甚至更优选地,其中所述纯化样品中通过SDS-PAGE测定的具有大于10kDa大小的蛋白的总量的至少95%是凝乳天冬氨酸蛋白酶。可优选的是所述纯化样品中通过SDS-PAGE测定的具有大于10kDa大小的蛋白的总量的至少99%是凝乳天冬氨酸蛋白酶。如本领域技术人员所知的——在本发明上下文中,本领域技术人员获得本文所讨论的纯化的液体凝乳天冬氨酸蛋白酶样品是常规工作——例如通过使用合适的层析(例如,柱层析)分离程序。由于本领域技术人员熟知这样的层析,因此没有必要在此详细描述层析过程。例如,WO02/36752A2(Chr.Hansen)描述了使用曲霉(Aspergillus)细胞(优选黑曲霉(Aspergillusniger))作为生产宿主细胞产生单峰骆驼凝乳酶(骆驼凝乳酶)的重组方法。还已知使用其它细胞作为生产宿主细胞–诸如例如,酵母细胞,其中一个例子是例如克鲁维酵母(Kluyveromyces)细胞(例如乳酸克鲁维酵母(Kluyveromyceslactis))。因此,可优选的是步骤(a)(ii)的纯化样品是从真菌或酵母生产宿主细胞例如曲霉细胞或克鲁维酵母细胞中的凝乳天冬氨酸蛋白酶的重组生产获得的样品。如本领域所知的——来自米赫根毛霉的毛霉凝乳酶可优选地通过使用米赫根毛霉作为生产宿主细胞来产生。关于第(II)项——优选步骤(b)中添加的不是凝乳天冬氨酸蛋白酶且长于10个氨基酸的多肽的浓度是组合物的0.05%-8%(w/w);更优选地,步骤(b)中添加的不是凝乳天冬氨酸蛋白酶且长于10个氨基酸的多肽的浓度是组合物的0.1%-7%(w/w);甚至更优选地,步骤(b)中添加的不是凝乳天冬氨酸蛋白酶且长于10个氨基酸的多肽的浓度是组合物的0.25%-5%(w/w),最优选地,步骤(b)中添加的不是凝乳天冬氨酸蛋白酶且长于10个氨基酸的多肽的浓度是组合物的0.5%-4%(w/w)(诸如例如,浓度是组合物的1%-3%(w/w))。第五和/或第六方面-液体和/或干燥的凝乳天冬氨酸蛋白酶组合物如上文所述–本发明第五方面涉及一种液体凝乳天冬氨酸蛋白酶组合物,其包含:(I):强度为25IMCU/g所述组合物-30000IMCU/g所述组合物的凝乳天冬氨酸蛋白酶;(II):浓度为所述组合物的0.01%-10%(w/w)的长于10个氨基酸且不是凝乳天冬氨酸蛋白酶的多肽;以及(III):浓度为1-350g/kg的盐,并且其中所述组合物的pH为2-8;以及(x):其中第(II)项中所述长于10个氨基酸的多肽是选自由如下组成的多肽组的至少一种多肽:乳清蛋白、α乳白蛋白、β-乳球蛋白、转铁蛋白、乳过氧化物酶、酪蛋白、α-s1-酪蛋白、α-s2-酪蛋白、β-酪蛋白、κ-酪蛋白、卵清蛋白、明胶、牛血清白蛋白、大豆蛋白、豌豆蛋白、玉米蛋白、马铃薯蛋白、大麻蛋白、稻蛋白、螺旋藻蛋白、小麦蛋白、花生蛋白、向日葵蛋白、油菜籽蛋白、血蛋白和藻类蛋白。如上文所述–本发明第六方面涉及干燥的粒状凝乳天冬氨酸蛋白酶组合物,其包含:(I):强度为25IMCU/g所述组合物-30000IMCU/g所述组合物的凝乳天冬氨酸蛋白酶,其;(II):浓度为所述组合物的0.01%-10%(w/w)的长于10个氨基酸且不是凝乳天冬氨酸蛋白酶的多肽;以及(III):盐,并且其中悬浮于水中的所述组合物的pH为2-8;以及(x):其中第(II)项中所述长于10个氨基酸的多肽是选自由如下组成的多肽组的至少一种多肽:乳清蛋白、α乳白蛋白、β-乳球蛋白、转铁蛋白、乳过氧化物酶、酪蛋白、α-s1-酪蛋白、α-s2-酪蛋白、β-酪蛋白、κ-酪蛋白、卵清蛋白、明胶、牛血清白蛋白、大豆蛋白、豌豆蛋白、玉米蛋白、马铃薯蛋白、大麻蛋白、稻蛋白、螺旋藻蛋白、小麦蛋白、花生蛋白、向日葵蛋白、油菜籽蛋白、血蛋白和藻类蛋白。对于液体的和干燥的组合物而言-凝乳天冬氨酸蛋白酶的优选实施例/实施方式如上文所述。对于液体的和干燥的组合物而言-“长于10个氨基酸的多肽”的优选实施例/实施方式如上文所述。对于液体的和干燥的组合物而言–优选第(I)项中的酶强度是100IMCU/g所述组合物–10000IMCU/g所述组合物的强度,更优选地是500IMCU/g所述组合物-6000IMCU/g所述组合物的强度。对于液体的和干燥的组合物而言–关于第(II)项,优选不是凝乳天冬氨酸蛋白酶且长于10个氨基酸的多肽的浓度是组合物的0.05%-8%(w/w);更优选地,不是凝乳天冬氨酸蛋白酶且长于10个氨基酸的多肽的浓度是组合物的0.1%-7%(w/w);甚至更优选地,不是凝乳天冬氨酸蛋白酶且长于10个氨基酸的多肽的浓度是组合物的0.25%-5%(w/w),最优选地,不是凝乳天冬氨酸蛋白酶且长于10个氨基酸的多肽的浓度是组合物的0.5%-4%(w/w)(诸如例如,不是凝乳天冬氨酸蛋白酶且长于10个氨基酸的多肽的浓度是组合物的1%-3%(w/w))。对于液体组合物–第(iii)项中的盐的浓度优选为10-300g/kg,更优选地第(iii)项中的盐的浓度为25-250g/kg。如本领域技术人员所知的-对于干燥的组合物,第(iii)项中的盐浓度可相对较高——诸如例如,50%(w/w)-99.9%(w/w)或诸如例如,80%(w/w)-99%(w/w)。对于液体的和干燥的组合物而言–优选所述盐是无机盐–优选地其中所述无机盐选自如下的组:NaCl、KCl、Na2SO4、(NH4)2SO4、K2HPO4、KH2PO4、Na2HPO4或NaH2PO4或它们的组合。最优选地,所述盐是NaCl。所述液体或干燥的组合物均可包含其他添加剂/化合物诸如例如,防腐剂。如本领域技术人员所知的-防腐剂通常可以足以在产品的保质期期间防止微生物生长的浓度添加。防腐剂的实例可以是例如,弱有机酸如甲酸盐、乙酸盐、乳酸盐、丙酸盐、苹果酸盐、苯甲酸盐、山梨酸盐或延胡索酸盐。对羟基苯甲酸酯(对羟基苯甲酸的烷基酯)也可以用作防腐剂。甘油或丙二醇也已被描述为防腐剂。液体的和干燥的组合物–优选pH为3-7,更优选地pH为4-6.5,甚至更优选地pH为5–6。优选地,所述液体组合物是含水组合物,例如水溶液。如本文所用的含水组合物或含水溶液涵盖包含水例如至少20wt%水、例如至少40wt%水的任何组合物或溶液。可优选的是本文所述的液体组合物具有10g-10000kg诸如例如100g-3000kg的总重量。可优选的是本文所述的干燥的粒状组合物具有0.25g-200kg诸如例如0.5g-50kg的总重量。优选所述组合物是如本文所述的液体凝乳天冬氨酸蛋白酶组合物。对于液体和干燥的组合物而言–优选的实施方式是:(y):其中通过SDS-PAGE测定的第(I)项的天冬氨酸蛋白酶和第(II)项的长于10个氨基酸的多肽的含量的总和高于组合物中长于10个氨基酸的蛋白和/或多肽的总量的50%(w/w);更优选地(y):其中通过SDS-PAGE测定的第(I)项的天冬氨酸蛋白酶和第(II)项的长于10个氨基酸的多肽的含量的总和高于组合物中长于10个氨基酸的蛋白和/或多肽的总量的70%(w/w);甚至更优选地(y):其中通过SDS-PAGE测定的第(I)项的天冬氨酸蛋白酶和第(II)项的长于10个氨基酸的多肽的含量的总和高于组合物中长于10个氨基酸的蛋白和/或多肽的总量的80%(w/w);以及最优选地(y):其中通过SDS-PAGE测定的第(I)项的天冬氨酸蛋白酶和第(II)项的长于10个氨基酸的多肽的含量的总和高于组合物中长于10个氨基酸的蛋白和/或多肽的总量的90%(w/w)。在本发明上下文中–本领域技术人员将知道或者可常规地确定(例如,基于具体相关的氨基酸序列)第(x)项中所述长于10个氨基酸的多肽的来源。因此,本领域技术人员可因此常规地确定(例如,通过SDS-PAGE)在本文相关的目的组合物中第(y)项是否得到满足。第七方面和第八方面如上文所述-本发明第七方面涉及液体凝乳天冬氨酸蛋白酶组合物,其包括强度为1600IMCU/g所述组合物-30000IMCU/g所述组合物的凝乳天冬氨酸蛋白酶以及浓度为1-350g/kg的盐,且其中所述组合物的pH为2-8。本发明第八方面涉及干燥的粒状凝乳天冬氨酸蛋白酶组合物,其包括强度为1600IMCU/g所述组合物-30000IMCU/g所述组合物的凝乳天冬氨酸蛋白酶以及盐,且其中悬浮于水中的所述组合物的pH为2-8。对于液体和干燥的组合物而言–优选地,所述强度是2000IMCU/g所述组合物-15000IMCU/g所述组合物的强度,诸如3000IMCU/g所述组合物-10000IMCU/g所述组合物,或诸如4000IMCU/g所述组合物-8000IMCU/g所述组合物。第九方面-用于制备食品或饲料产品的方法根据本领域如上文所述-本文所述的凝乳天冬氨酸蛋白酶组合物可用于——例如,制备基于乳的目的产品(诸如例如,奶酪产品)。如上文所述–本发明第九方面涉及一种用于制备食品或饲料产品的方法,包括向食品或饲料组分中添加有效量的根据第五至第八方面的任一或其与本文相关的实施方式的任一的凝乳天冬氨酸蛋白酶组合物,并进行进一步的制备步骤以获得食品或饲料产品。优选地,所述食品或饲料产品是基于乳的产品,且其中所述方法包括向乳中添加有效量的本文所述的分离的凝乳酶多肽变体并进行进一步的制备步骤以获得基于乳的产品。乳可以例如是绵羊奶、山羊奶、水牛奶、牦牛奶、羊驼(lama)奶、骆驼奶或牛奶。基于乳的产品可以例如是发酵乳产品、奶渣(quark)或奶酪。可优选的是用于制备第四方面或其与本文相关的实施方式的食品或饲料产品的方法是这样的方法,其中首先根据第三方面的用于存储凝乳天冬氨酸蛋白酶的方法存储凝乳天冬氨酸蛋白酶组合物,然后根据用于制备第四方面的食品或饲料产品的方法添加到食品或饲料组分中。实施例实施例1:凝乳比活性的测定4.1凝结活性的测定使用REMCAT方法测定凝乳活性,REMCAT方法是由国际乳业联合会开发的标准方法(IDF方法)。凝乳活性由从低热、低脂奶粉和0,5g/升(pH≈6,5)的氯化钙溶液制备的标准乳底物的可见絮凝所需的时间来确定。将凝乳酶样品的凝结时间与具有已知的凝乳活性且根据IDF标准110B具有与样品相同的酶组分的参照标准品的凝结时间进行比较。在相同的化学和物理条件下测量样品和参考标准品。使用84mM乙酸pH5.5缓冲液将多种样品调节至约3IMCU/ml。此后,将200μl酶添加到置于水浴中的玻璃试管中的10ml预热的牛奶(32℃)中,牛奶在恒定搅拌下能够保持32℃±1℃的恒温。根据下式,相对于具有与样品相同的酶组成的标准品,计算凝乳性酶的总凝乳活性(强度),以国际乳凝结单位(IMCU)/ml表示:S标准:国际参照标准品凝乳酶(rennet)的凝乳活性T标准:对于标准品稀释液获得的凝结时间(秒)D样品:样品的稀释因子D标准:标准品的稀释因子T样品:从添加酶至絮凝的时间对于稀释的凝乳酶样品获得的凝结时间(秒)4.2总蛋白含量测定使用来自ThermoScientific的PierceBCA蛋白测定试剂盒,根据提供商的说明书测定总蛋白含量。4.3凝结比活性的计算通过凝结活性(IMCU/ml)除以总蛋白含量(mg总蛋白/ml)来确定凝结比活性(IMCU/mg总蛋白)实施例2:酶制剂在黑曲霉(大致如WO02/36752A2所述)中重组表达牛凝乳酶(Chr.HansenA/S)或骆驼凝乳酶(M,Chr.HansenA/S)。通过层析技术纯化酶。使用米赫根毛霉作为生产宿主细胞产生来自米赫根毛霉的毛霉凝乳酶(Chr.HansenA/S),并通过层析技术纯化。对于所有纯化的酶样品-在纯化的样品中通过SDS-PAGE测定的具有大于10kDa大小的蛋白的总量的至少90%是相关的凝乳天冬氨酸蛋白酶。所有的酶样品均通过以下方式制备:将精确体积的酶储液与添加剂的溶液混合并添加缓冲液至最终体积。以这种方式,对于所有制备的样品,酶蛋白的浓度保持恒定。缓冲液组成为:0.25M乙酸钠、20mM磷酸钠、2.0M氯化钠pH5.7、5mM甲硫氨酸和35mM苯甲酸钠。强度为200-1200IMCU/ml。向组合物中添加不同的多肽,例如Hammersten酪蛋白,WPC80,LacprodanAlpha10,LacprodanAlpha20等。WPC80是具有80%蛋白的干乳清蛋白浓缩物的商业制剂。LacprodanAlpha10和LacprodanAlpha20是乳清蛋白分离物的商业制剂,分别含有43%总蛋白含量和60%总蛋白含量的α乳白蛋白。实施例3:骆驼凝乳酶的物理稳定性工业酶的液体制剂经受来自单元操作的物理力,诸如泵送、搅拌和膜上过滤。在部分填充的容器的运输期间,液体制剂的晃动也可能有助于此。剪切应力和酶暴露于水-空气界面的增加可引起变性和伴随的酶活性损失。酶或蛋白样品的物理稳定性可以通过反复摇动在具有高的顶部空间与样品体积比的试管中的酶样品来测试。通过在旋转装置中颠倒填充在10ml试管中的2ml样品1小时来研究不同的天冬氨酸蛋白酶针对震荡的稳定性(参见本文图2)。对于每种溶液,在垂直颠倒1小时(室温)后测量相对凝乳活性,并与具有完全相同组成的未颠倒对照进行比较。结果表示为“保留的活性”,其通过颠倒样品的活性除以未颠倒对照样品的活性而获得。结果:骆驼凝乳酶样品垂直颠倒1小时导致超过30%的活性损失,参见表1(无添加)。发现添加浓度为0.015%PEG8000保护骆驼凝乳酶,并且使得垂直颠倒后没有活性损失。当骆驼凝乳酶样品含有浓度为0.5%w/v或1.0%w/v的Hammersten酪蛋白、Alpha10、Alpha20或WPC80时,可见在垂直颠倒后几乎没有损失。发现当Alpha20和WPC80的浓度降低到低于0.1%时,它们的保护作用逐渐降低。具有酸性酪蛋白水解物或无蛋白乳清的骆驼凝乳酶制剂未增高酶的稳定性,因为垂直颠倒后活性的损失与未处理的对照样品相同(表3)。结论:结果表明,添加到骆驼凝乳酶制剂中的某些蛋白可以增高酶的物理稳定性。表1:垂直颠倒1小时的骆驼凝乳酶样品的保留活性(内部参考号:EXP-13-AD2681)。化合物保留的活性无添加67%(3%)PEG(0.015%)99%(0%)甘油(6%)67%(4%)0.5%Hammersten酪蛋白97%(0%)1%Hammersten酪蛋白97%(1%)0.5%酪蛋白水解物(Merck)67%(4%)1%酪蛋白水解物(Merck)74%(5%)0.5%Alpha10(样品1)98%(0%)1%Alpha10(样品1)98%(0%)0.5%Alpha20(样品2)98%(0%)1%Alpha2098%(0%)0.5%无蛋白乳清64%(17%)1%无蛋白乳清69%(1%)0.1%WPC80100%(0%)1%WPC8099%(0%)实施例4:骆驼凝乳酶的比活性结果:设计颠倒实验,使得在每个实验中添加完全相同量的酶蛋白并且将所有制剂制成相同的体积。如果制剂的组成不影响酶活性,则预期会发现所有对照样品即未颠倒的样品具有相同的酶活性。然而,情况并非如此。含有PEG8000的样品的活性高4-5%,良好地符合最近提交的专利申请IN5103DK00。即使应用相同量的酶蛋白,含有Hammerstein酪蛋白、Alpha20或WPC80的样品与不含添加剂的样品(无添加)相比活性高13-18%(表2)。这表明,骆驼凝乳酶制剂中存在的乳蛋白提高了酶的比活性。从表3中得出相同的结论,表3显示了含有5种不同浓度的Alpha20和WPC80的组合物的活性。表5显示了组合物的活性,“无添加”的活性指数=100%,以及垂直颠倒1小时的样品的保留活性。向骆驼凝乳酶的组合物中添加多肽对酶有两种作用:比活性增高和酶的物理稳定性增高。如表3所示,两种性能与多肽的剂量良好相关。在表3中,发现当Alpha20的浓度从0.5%降低至0.01%时,酶活性从指数115降至指数102(为与未处理的对照几乎相同的水平)。Alpha20的浓度为0.01%时,酶的物理稳定性(保留的活性)与对照实验(未添加)相同。表2:添加了不同多肽的M的活性。相对于未处理对照(“无添加”)的活性指数以百分比显示(内部参考号:EXP-13-AD2681)。表3:添加了不同多肽的M的活性。相对于未处理对照(“无添加”)的活性指数以百分比显示。右栏显示垂直颠倒1小时的骆驼凝乳酶样品的保留的活性(内部参考号:EXP-13-AD2681)。结论:向骆驼凝乳酶组合物中添加多肽对酶具有两种作用:比活性增高和酶的物理稳定性增高。两种性能均与多肽的剂量良好相关。实施例5:骆驼凝乳酶、牛凝乳酶、毛霉凝乳酶L和毛霉凝乳酶XL的比活性表4:添加了不同多肽的凝乳性酶的活性(内部参考号:EXP-13-AD2690)。绝对值的标准偏差在括号中。结论:表2-4的结果显示,向天冬氨酸蛋白酶制剂中添加多肽增高了比活性。实施例6:下表显示了类似于上述实施例3进行的测试的结果——但使用不同的蛋白制剂。添加表中所示的所有蛋白至最终含量为1%w/w,麦醇溶蛋白作为唯一的例外产生澄清溶液。根据实施例3测试物理稳定性。样品在5℃和37℃分别存储1年,并在存储期间测试稳定性。“存储结束”这一栏显示1年后的保留的活性-通过对所有数据点拟合单个指数函数来计算数值。如本领域所知的–术语“蛋白胨”是指通过蛋白质水解消化的蛋白。如本领域所知的–术语“胰蛋白胨”是指由胰蛋白酶这种蛋白酶消化的蛋白。表5:添加1%w/w不同多肽的CHY-MAXM的活性。相对于未处理对照(“无添加”)的活性指数以百分比显示。“保留的活性”这一栏显示垂直颠倒1小时的骆驼凝乳酶样品的保留的活性。“存储结束”这一栏显示在5℃和37℃存储后的保留的活性。标准偏差示于括号中。(内部参考号:EXP-14-AE8307)实施例7:通过将2g样品悬浮于40ml盐水中制备植物蛋白提取物,所述盐水由溶于水中的12%NaCl、20g/L无水NaAc、2.5g/L无水NaH2PO4和10g/L苯甲酸钠组成,pH5.4-5.8。在旋转装置上混合2小时后,将悬浮液离心,将上清液的pH调节至5.4-5.8,并通过0.45μm的针筒式过滤器过滤。通过与精确测量的等体积的酶储液混合,提取物用于制备CHY-MAXM制剂,产生具有相同浓度的酶蛋白的样品。在该实施例中,在三组中测试27种不同植物蛋白的提取物,每组在不同的天制备。在样品制备后一天测量活性;标题为“活性”的一栏示出了相对于未处理对照(无添加)的活性(IMCU/ml)。根据实施例3测试物理稳定性,唯一的区别在于,在本实施例中,使用不同的旋转装置用于样品的垂直颠倒(来自Biosan的MultiRS-60,32rpm,1小时)。旋转装置的改变可能导致样品的物理应力增加,因为与前述实施例中70%活性相比未处理样品的保留的活性仅为10%。样品在5℃和37℃下分别储存1年,并在储存期间测试稳定性。“存储结束”一栏显示1年后的保留的活性-通过对所有数据点拟合单个指数函数来计算数值。表6:添加不同多肽的M的活性。相对于未处理对照(“无添加”)的活性指数以百分比显示。“保留的活性”这一栏显示垂直颠倒1小时的骆驼凝乳酶样品的保留活性。“存储结束”这一栏显示在5℃和37℃存储后的保留的活性。标准偏差示于括号中。内部参考号:组1/EXP-14-AF3604。表7:添加了不同多肽的M活性。相对于未处理对照(“无添加”)的活性指数以百分比显示。“保留活性”这一栏显示垂直颠倒1小时的骆驼凝乳酶样品的保留活性。“存储结束”这一栏显示在5℃和37℃存储后的保留活性。标准偏差示于括号中。内部参考号:组2/EXP-14-AF3604。表8:添加不同多肽的M的活性。相对于未处理对照(“无添加”)的活性指数以百分比显示。“保留的活性”这一栏显示垂直颠倒1小时的骆驼凝乳酶样品的保留的活性。“存储结束”这一栏显示在5℃和37℃存储后的保留的活性。标准偏差示于括号中。内部参考号:组3/EXP-14-AF3604。参考文献1:EP2333056A1(DSM,申请日2007.12.04)2:WO2012/127005A1(DSM)3:DE1492060A1(Nordmark-WerkeGmbH,1969年公开)当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1