用于快速并且灵敏地检测热点突变的方法与流程
本发明涉及遗传和生物化学分析的领域。确切地说,其涉及赘生性样品和其组分的分析。
背景技术:
恶性神经胶质瘤是成人中最常见的原发性中枢神经系统(CNS)恶性肿瘤,在美国在2012年导致>14,000的死亡2。世界卫生组织(World Health Organization,WHO)已确立用于将神经胶质瘤分类成多种亚型并且将其从I定级到IV(指示其恶性程度)的许多组织学和临床准则。弥漫性神经胶质瘤(WHO II-IV级),其包括星形细胞瘤、少突神经胶质瘤、少突星形细胞瘤以及成胶质细胞瘤(GBM)3,由于占所有原发性恶性脑肿瘤的80%而具有特定临床重要性。这些肿瘤是弥漫性浸润性的,其使得治愈性手术切除变得不可能。此外,II-III级弥漫性神经胶质瘤也具有进展到更高WHO IV级GBM的能力。GBM在成人中是最常见的恶性脑肿瘤并且具有最差的存活率(中位总存活期12-15个月)4。此外,即使在具有一致组织结构的实体中,患者结果可以大致上变化。这通过原发性GBM显现地最好,原发性GBM相较于从更低级发展的继发性GBM重新发生。两种肿瘤在组织学上不可区分,但在基因和临床上这些疾病相异,因为患有继发性GBM的患者的存活率几乎是原发性GBM的两倍5。
归因于异质性、侵袭性、反应性薄壁组织以及形态学特征中的不明确性,弥漫性神经胶质瘤的精确诊断尤其具挑战性。这些诊断难题通过见于这些准则的临床用途中的高程度观察者间变化性来反映。在独立地由四名神经病理学家综述的244神经胶质瘤的研究中,一致性低到52%6。弥漫性神经胶质瘤的精确诊断对于针对患者的临床决策极其重要。这种诊断确定治疗方案,并且已知特定亚型展示增加的针对特定化学疗法(例如,用于少突神经胶质瘤治疗的丙卡巴肼(procarbazine)、CCNU以及长春新碱(vincristine)的治疗反应。此外,组织亚型指定患者预后。对于对神经胶质瘤患者的更精确诊断、预后以及个人化护理的递送,明确需要客观的肿瘤特异性标记。
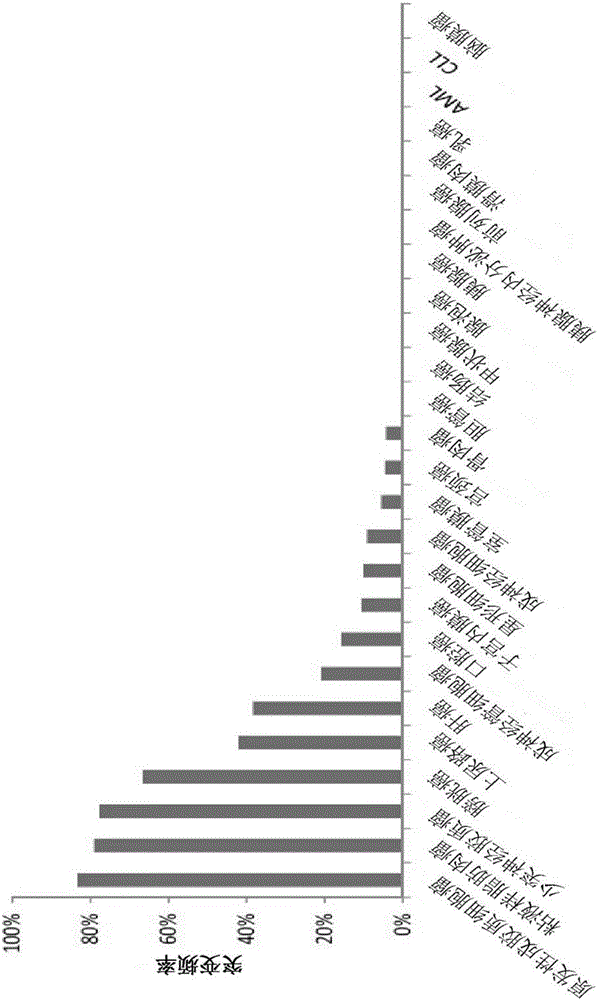
为解决这些需求,大规模测序研究已描绘弥漫性神经胶质瘤中所发现的基因改变。许多改变经过标注,尤其如以下各者中的频繁突变:异柠檬酸脱氢酶1和2(IDH1/2)1、端粒酶逆转录酶(TERT)7的启动子、α地中海贫血智力低下综合症X连锁(ATRX)8,9、capicua果蝇(Drosophila capicua,CIC)的同系物、远上游元件结合蛋白1(FUBP1)10。这些发现已有助于确立神经胶质瘤的明确目标分子亚型。就诊断的相关性来说,TERT启动子和IDH1/2中的改变是最有前景的,这在很大程度上归因于其在特异性基因组基因座(“热点”)处作为单核苷酸取代的频率和出现。在弥漫性神经胶质瘤中,我们发现这些突变共出现或排他性地出现的程度定义神经胶质瘤亚型:例如IDH1/2突变出现在>50%继发性GBM中但在原发性GBM中不常发生(<5%)(图1),而TERT启动子突变发现于>80%原发性GBM中以及>70%少突神经胶质瘤中(图2)。此外,我们发现通过TERT/IDH状态确立的神经胶质瘤的基因亚型有效地将神经胶质瘤患者分成具有相异预后的亚型,比单独通过组织结构更有效,向医生提供目标测试以指导更适当的治疗(图3)。举例来说,具有含有TERT启动子突变的神经胶质瘤的患者的中位总存活期(OS)是11.5个月,而具有TERT启动子和IDH1/2突变的那些患者展现125个月的中位OS。此外,我们的研究已揭露“混合组织结构”少突星形细胞瘤,其最有可能反映组织学分类的不明确性,基因地分成星形胶质细胞(TERTWTIDHMUT)或少突神经胶质(TERTMUTIDHMUT)标志(图3)。我们已将我们这些突变的研究扩展到许多其它肿瘤类型并且发现TERT启动子突变也频繁地在其它癌症中,最显著的是肝癌44.2%)、膀胱癌(66%)、粘液样脂肪肉瘤(79.1%)以及成神经管细胞瘤(21%),其中早期诊断、复发以及治疗反应监测是关键的7,11(图2)。类似地,IDH1和IDH2突变同样以高频率发现于其它类型的癌症中,包括软骨肉瘤(56%)12、内生软骨瘤(87%)、梭形细胞血管瘤(70%)13,14、急性骨髓性白血病(15%)15,以及肝内来源的胆管癌(22-28%)16。
这些神经胶质瘤亚型特异性和高度复发性的突变需要能够快速、灵敏并且特异性地检测IDH1/2和TERT启动子中的这些突变的诊断分析。这类工具将在这些具挑战性诊断中辅助神经病理学家,向患者提供更精确的预后信息,并且允许医生调适针对患者肿瘤的独特分子标志的疗法。此外,对于在这些基因座处具有IDH1/2和TERT启动子中的频繁突变的许多其它上述癌症类型,这类诊断工具也将有助于快速并且灵敏地检测这些突变。
针对突变检测的当前诊断工作基于桑格(Sanger)测序,其耗时、成本高,并且最重要的是因较差的灵敏性(检测极限~20%突变等位基因)而受到限制17。归因于有限的灵敏性,低肿瘤百分比(<40%肿瘤,对于杂合突变暗示<20%突变等位基因)的样品可以误诊为缺乏突变(图4、5)。在弥漫性神经胶质瘤和其它恶性肿瘤的情境下,低肿瘤百分比的这类情况极真实。除弥漫性神经胶质瘤的固有异质性和侵袭性性质以外,肿瘤活检可以含有最小肿瘤组织,产生较差的抽样。坏死是许多癌症常见的特征,也可以限制可使用的组织。这些限制具有显著的诊断和预后推断并且可以产生被误导的疗法,使得其不适用于临床用途。
在所述领域中持续需要使得临床分析更快、更灵敏并且更具特异性。
技术实现要素:
根据本发明的一个方面,提供一种用于测试具有肿瘤的人类的身体样品的方法。人类的身体样品的肿瘤DNA用一个扩增引物组扩增。每一扩增引物包含选自SEQ ID NO:1-14的序列。从而产生包含TERT启动子以及IDH1和IDH2序列的扩增产物。此后,检测扩增产物。
根据本发明的另一方面,提供一种TERT/IDH1的杂合校准质粒。所述质粒包含(a)TERT C228T片段和TERT C250T片段,以及(b)IDH1 R132H片段和IDH1野生型片段,其中TERT片段中的每一个以相等的量和大小存在,并且其中IDH1片段中的每一个以相等的量和大小存在。质粒在每一片段之间具有限制位点,其使得能够选择性地线性化并且添加所关注的其它基因座,如(但不限于)其它IDH1和IDH2突变,以及所关注的其它遗传基因座。
本发明的一个方面包含一种用于检测个体中IDH1/2和/或TERT启动子中的突变的方法,其包含以下各者、由以下各者组成或主要由以下各者组成:(a)从个体获得身体样品,所述样品包含至少一个肿瘤DNA;(b)向所述样品提供至少一个核酸引物;(c)提供用于使用至少一个引物扩增至少一个DNA模板的酶和试剂;(d)在适合于扩增至少一个DNA模板的条件下培育所述样品、酶、试剂、至少一个引物;(e)检测经过扩增的核苷酸;以及(f)鉴别IDH1/2和/或TERT启动子中的突变。
在一些实施例中,至少一个引物选自由以下各者组成的群组:表1A、表1B以及表2和其组合中所发现的那些引物。
在其它实施例中,酶和试剂包含表4中所发现的那些酶和试剂。
在又另一实施例中,样品在根据表3的条件下培育。
在一些实施例中,个体是哺乳动物。在其它实施例中,个体是人类。
在其它实施例中,生物样品选自由以下各者组成的群组:脑脊髓液(CSF)、组织、细胞、活检、血液、淋巴、血清、血浆、尿液、唾液、粘液以及泪液。在一些实施例中,样品包含组织活检。在一些实施例中,生物样品包含CSF。在一些实施例中,生物样品包含尿液。在一些实施例中,生物样品包含血浆。
所属领域的技术人员在阅读本说明书时将显而易见的这些和其它实施例向所属领域提供具稳固性、快速性以及可再现性的分析。
附图说明
图1.跨越不同肿瘤类型的IDH1和IDH2中的突变。IDH1和IDH2突变频繁出现在弥漫性神经胶质瘤(WHO II-III级)和继发性GBM(WHO IV级)中。1
图2.跨越多种肿瘤亚型的TERT启动子突变的频率。7
图3.针对弥漫性神经胶质瘤的基于TERT/IDH的遗传分类。突出的遗传标志包括:主要由组织学少突神经胶质瘤组成的TERTMUTIDHMUT;由渐进性星形细胞瘤组成的TERTWTIDHMUT;由原发性GBM组成的TERTMUTIDHWT;以及由GBM组成的TERTWTIDHWT。红色指示在C228T或C250T处的TERT启动子突变;绿色指示在IDH1的R132或IDH2的R172处的突变。
图4.来自癌症患者的抽样组织的潜在问题。假阴性可以起因于正常组织背景中低百分比的肿瘤细胞或起因于其它癌细胞背景中亚克隆肿瘤细胞群体。
图5.关于具有指定突变的基因组DNA的稀释液的桑格测序色谱图。在<20%突变等位基因分数下,突变等位基因的峰与背景不可区分,限制这种方法用于临床样品,尤其用于为异质和侵袭性的弥漫性神经胶质瘤。
图6是展示使用LNA引物的等位基因特异性qPCR的概述的示意图。
图7是展示基于PGL3-enh载体的TERT启动子C228/C250T和IDH1 R132H杂合校准质粒的示意图。TERT C228T、C250T以及IDH1 R132H以50%的比率存在于每一质粒中,其中每一靶标的300bp克隆于pGL3-enh质粒中。基因座彼此距离3kb以限制引物的交叉反应性。所关注的额外遗传基因座可以与这些片段一起添加以产生突变的可再现性突变等位基因分数。
图8.在pgl3-enh载体中克隆于彼此相距~3kb的位点中的TERT启动子C228T/C250T和IDH1 R132H杂合校准质粒的详细示意图
图9.靶突变到不同突变等位基因分数(10%、1%、0.1%)的稀释。跨越这些范围,等位基因特异性分析展示极佳的线性(R2>0.994)。
图10.TERT/IDH等位基因特异性LNA qPCR测试检测0.1%突变等位基因分数(~15突变拷贝)。
图11.虽然仅使用50ng的预扩增的gDNA作为模板,但呈嵌套型式的TERT/IDH等位基因特异性LNA qPCR保持高辨别力。
具体实施方式
诸位发明人已开发可以快速、特异性并且灵敏性地检测TERT启动子、IDH1/2热点突变的基于高度灵敏的定量PCR(qPCR)的分析。这种基于qPCR的诊断分析可以检测正常DNA的高背景中的突变DNA,如当突变DNA低到0.1%突变等位基因时。这比基于桑格测序的传统方法高200倍的灵敏性。这类检测极限类似于其它昂贵、费时并且复杂的技术,如BEAMing,然而qPCR分析可以在几个小时里进行,需要单一PCR步骤。归因于这种分析的灵敏性,其准许检测循环肿瘤DNA(ctDNA)中的突变。ctDNA常常以极有限的量发现于癌症患者的血液、尿液以及CSF中,但有希望用作“液体活检”,经由其患者可以在无手术干预的情况下被诊断。肿瘤复发或耐药性开发可以通过检验这些体液来监测。分析不限于使用体液,但是,并且可以类似地用于更传统的组织和活检样品。
可以应用这种技术来检测DNA中IDH1、IDH2、TERT启动子突变中的热点突变,所述DNA从肿瘤组织以及“液体活检”样品提取,包括从CSF、血浆、血清、尿液以及其它体液提取的DNA。此外,对这些突变的鉴别不仅与脑肿瘤相关,而且与这些突变频繁的许多其它肿瘤类型相关,所述其它肿瘤类型包括肝癌和膀胱癌、皮肤癌(黑色素瘤、鳞状和基底细胞癌)、急性骨髓性白血病、胆管癌、软组织肿瘤(软骨瘤、软骨肉瘤、梭形细胞血管瘤、粘液样脂肪肉瘤、非典型性纤维黄瘤、粘液样脂肪肉瘤)以及甲状腺癌。
身体样品可以是含有肿瘤DNA的身体的任何适宜并且可消耗部分。这可以是肿瘤组织、边缘组织、活检样品、转移性样品、淋巴、脑脊髓液、血液(包括血清或血浆)、尿液唾液、粘液以及泪液。还可以抽样并且测试从含有肿瘤的特定器官排出的其它流体。可以在身体样品中测试DNA,或其可以使用所属领域中已知的技术来提取。DNA可以在扩增之前预扩增以对TERT启动子、IDH1以及IDH2中的突变进行测试。可以将DNA去除外来序列以使得靶序列成为分析物的更大部分。经测试的DNA可以是基因组DNA,包括(但不限于)线粒体DNA、扩增的DNA以及cDNA。
作为分析的一部分,扩增循环可以在PCR惯用的更高温度下进行,以引入更高水平的严格性和特异性。更高温度可以是例如至少66℃、至少67℃、至少68℃、至少69℃、至少70℃、至少71℃、至少72℃、至少73℃、至少74℃或至少75℃。类似地,可能需要在这类高温下进行预扩增步骤(如果使用)。在初始更高温度循环后,可以使用低温扩增循环。低温循环可以在例如60度下、在小于60℃下、在小于59℃下、在小于58℃下、在小于57℃下、在小于56℃下、在小于55℃下、在小于54℃下、在小于53℃下、在小于52℃下或在小于51℃下进行。
如果在特定设置中适宜,那么多重反应可以用于分析。在多重设置中,在相同反应混合物中同时使用多于一个组的引物对。在一些情况下,优选地可以分隔扩增,使得反应具有较小的复杂性,使用更少的引物对,或甚至使用单引物对。如下文所描述,分析的单反应可以使用三引物组,例如具有野生型和突变特异性引物以及常见引物。这可以视为单反应,而非针对多个不同基因组片段的多重反应。
在分析中LNA修饰的核苷酸典型地在引物的3'端处使用以增强特异性。引物也可以具有不与靶基因组片段互补的额外序列。针对分析的便利性,可以使用额外序列或标签。举例来说并且如下文所论述,M13序列添加到引物的5'端中以促进使用引物形成的扩增子的测序。Tag序列可以用作用于鉴别和/或量化的杂交标签。Tag序列可以用于任何额外功能性或不用于功能性。在对灵敏性具有最小影响的情况下,与靶标互补的额外核苷酸也可以添加到引物的5'端中。
高保真度聚合酶可以用以促成扩增反应的精确性。许多这类聚合酶在所属领域中已知并且可以由所属领域的技术人员选择。示范性DNA聚合酶包括FideliTaqTMDNA聚合酶、Easy-ATM高保真度PCR克隆酶、II融合DNA聚合酶、增强DNA聚合酶、PfuUltraTM高保真度DNA聚合酶、ACCUZYMETMDNA聚合酶、VELOCITYTMDNA聚合酶、VentTM(外)DNA聚合酶、KAPA HiFiHotStartTMDNA聚合酶以及Pfx50TMDNA聚合酶。
虽然为分析的靶标的突变称作TERT C228T和C250T,但这些标识的互补序列也可以在相同位置处分析以分析互补核苷酸。类似地,对于IDH1/IDH2,尽管通篇提及R132和R172,但可以对互补链进行分析以检测有义链上的已命名突变的互补核苷酸。
以上公开内容通常描述本发明。本文公开的所有文献以引用的方式明确地并入。参考以下具体实例可以获得更为彻底的理解,仅出于说明的目的在本文提供实例,并且并不意图限制本发明的范围。
实例
TERT启动子和IDH1/2热点突变AS LNA q-PCR分析:
A.背景:
等位基因特异性PCR是用于选择性扩增含有所关注变异的模板的DNA模板扩增的一种形式,并且因此是一种用于SNP基因分型的方法18。大多数方法依赖于辨别与具有所关注基因型的靶序列具有更高互补性的引物。这最通常通过迫使引物的3'处于突变位置并且仅与靶变异或野生型核苷酸互补来进行。以这种方式,当引物结合到非靶标等位基因、传递选择性扩增时,PCR效率降低(图6)。
这个区域中的主要前移已经是使用称为锁核酸(LNA)的这些等位基因特异性引物的3'端处的候补核酸。LNA是在核酸的2'-O与4'-C之间具有亚甲基桥的核酸类似物,其产生将核糖部分锁为C3'端构象的双环结构。当LNA碱基与其互补序列杂交时,这种构象增加Tm,大大增加了引物对于其靶突变或单核苷酸多态性的特异性(相较于DNA,大多数来源测量至少9循环更大差异LNA)19。在其它应用中,在鉴别细菌物种20,囊肿性纤维化基因改变19、BRAF突变21、HBV耐药性突变22、线粒体突变(在MELAS和NARP中)23的情形下,这一平台已用于等位基因辨别。
尽管其它方法作为桑格测序的替代方式已用于检测TERT启动子和IDH1/2中的突变,包括TaqMan LNA探针24、高分辨率熔解曲线分析(传统25和基于FRET26的)、SNaPshot27,28、焦磷酸测序29、冷PCR HRM30,以及SafeSeq31,但这些技术是资源密集的或缺乏灵敏性并且因此作为真实临床诊断不实用。
B.TERT启动子和IDH1/2热点突变AS LNA q-PCR分析:
引物设计
我们已设计并且测试许多等位基因特异性引物,其用作用于检测TERT启动子和IDH1/2两者中的最频繁突变的诊断;以及为扩增所需的其非等位基因特异性反向引物(表1A)。值得注意的是,为确立这些高性能的等位基因特异性(AS)引物,我们已设计超过10个不同候选AS引物,其具有不同长度,所引入的强制错配(3-1和-2位置),以及试图提高这些引物的辨别的LNA的经改变位置。为测试这种辨别能力,在低到15个拷贝或0.1%的正常DNA的背景中,我们使用肿瘤DNA的标准稀释液,并且评估虽然仍然产生特异性产物、但在qPCR上具有最大ΔCt的引物。另外,我们已再次测试超过20个不同候选反向引物以产生无背景的PCR产物,其特异性扩增TERT启动子的这个区域,并且产生能够扩增片断式DNA来源(即,甲醛固定的石蜡包埋的(FFPE),ctDNA)的足够小的扩增子(<160bp)。其它反向引物也与候选AS引物一起工作,然而我们已选择最小扩增子以促进qPCR(表1、2)。最后,针对极其罕见的IDH1 R132突变R132C、G、S、L)以及IDH2R172突变(R172M、W、G),我们也已开发类似等位基因特异性引物,然而尽管可以使用这些者来应用于神经胶质瘤,但IDH1 R132H引物组是最常用的。
表1A:用于检测并且定量最常见TERT启动子(C228T、C250T)、IDH1(R132H)以及IDH2(R172K)热点突变的高性能等位基因特异性引物(*注释:+指示)。M13标签(TGTAAAACGACGGCCAGT;SEQ ID NO:28)和CAG GAA ACA GCT ATG ACC;SEQ ID NO:29)添加到常见引物的5'端中以促进测序。
表1B:用于检测罕见IDH1和IDH2突变的高性能等位基因特异性引物(注释这些引物组使用与1A中相同的反向常见引物).
表2:用于基因分型TERT启动子和IDH1/2的等位基因特异性qPCR分析的引物组
TERT:C228和C250
IDH1:R132
IDH2:R172
*注释:归因于所添加的M13序列标签,所扩增的靶标区域针对AS扩增子短18bp,针对非AS扩增子短36bp
C.高性能PCR程序和试剂
以等位基因特异性和非AS方式并且在两种不同情形:(1)基因组DNA的PCR和(2)预扩增基因组DNA的嵌套PCR下,PCR程序和试剂有效地扩增TERT启动子和IDH1/2外显子4两者。对于快速地需要突变状态并且存在足够样品以用复制本进行PCR的应用,推荐第一程序。对于存在有限的DNA或DNA具有较差质量的应用,推荐第二程序。
a.TERT/IDH状态的基因组DNA的1步AS-LNA qPCR
产生PCR程序来允许有效的等位基因特异性PCR是具挑战性的,尤其由于对引物位置的限制。归因于TERT启动子的高GC含量(贯穿所关注区域>80%,并且从C228到C250的延伸中88%)和重复序列(在所关注区域中4G的10回合),其非常难以扩增。针对野生型等位基因与突变等位基因之间的最大化辩别,我们使用的扩增程序使用在高退火温度(≥66℃)下的初始扩增阶段,随后使用在更低退火温度(≤60℃)下的第二扩增阶段。排除熔解曲线,具有匀变速率5℃/sec的我们热循环仪上的这个程序消耗<1小时(表3)。这可以在更短变性下在更高温度(例如,在98℃下1分钟)和更短退火时间下调节,以促进甚至更快速的检测,其可以应用于手术中诊断的情境中。我们也已使用传统的单一退火温度程序,其在更高退火温度(≥66℃)下工作地最好,但其灵敏性较小。在下文我们已列举针对所有引物组工作地最好的用于最大化辩别的程序。等位基因特异性(AS)引物作为已经历双重HPLC纯化的定制寡核苷酸购自Exiqon(美国马萨诸塞州沃本市(Woburn,MA,USA))。非AS引物作为具有标准纯化的定制寡核苷酸购自IDT(美国爱荷华州科勒尔维尔市(Coralville,Iowa))。
表3.用于基于AS-qPCR的基因分型的PCR程序1
对于这一PCR的反应条件展示于表4中。许多富GC的试剂盒和其它聚合酶被使用并且具有尤其针对TERT启动子的困难。针对我们的分析的读出是SYBR绿色信号,使用KAPA SYBR Fast 2×主混合物(MasterMix)(KK4600,美国马萨诸塞州波士顿市(Boston)。引物浓度已经改变并且跨越大范围的浓度而工件。此外,可以使用输入>50ng,但开始抑制反应。
表4.用于TERT/IDH突变检测的使用SYBR的1步qPCR的PCR试剂
b.TERT/IDH状态的预扩增DNA的嵌套AS LNA qPCR
用于突变检测的第二方法是对于以下工作地非常好的嵌套qPCR方法:低质量样品(即,ctDNA、FFPE gDNA),和对于所需复制本不足的低分析物数量的样品(即,细针活检)。这种嵌套qPCR分析也具有高度可信赖的定量,因为在嵌套PCR情形下,PCR抑制和引物效率的差异不太显著。为使用这种方法,用非偏压(NB)引物组在TERT启动子、IDH1或IDH2或所有三种中以多重方式,使用用于有限循环次数(<20个循环)的高保真度酶在高退火温度(≥66℃)(表5、6)下,来扩增所关注基因座。随后,将所得PCR产物纯化(使用基于柱或基于珠粒的方法)并且稀释(通常1:1000)并且充当用于下一轮扩增的模板,所述下一轮扩增使用上文所描述的等位基因特异性LNA修饰的引物。在≥66℃的退火温度下进行嵌套PCR,因为这提供最高辩别(表7、8)。这种嵌套方法的益处是存在大得多的模板供应,均由1-50ng gDNA产生,其可以经筛选用于比将以另外的方式可能的突变更多的突变。在下文我们描述用于嵌套qPCR的高性能PCR程序。将预扩增反应分成多个反应(例如,50μl分成5×10μl)是有益的,随后可以将其汇集。这个步骤后,可以使用基于柱或珠粒的方法纯化PCR产物。
表5.用于高保真度预扩增的PCR程序
表6.用于TERT/IDH基因座的高保真度预扩增的PCR试剂
表7.用于非偏压PCR产物的嵌套等位基因特异性qPCR的PCR程序
表8.用于使用LNA修饰的引物的等位基因特异性qPCR的PCR试剂
如果使用探针用于嵌套qPCR中的检测,那么方案应使用表8中提及的两种探针混合物中的任一种和取决于TERT或IDH检测的这些探针中的任一种:TERT探针:/56FAM/CGGGTCCCC/ZEN/GGCCCAGC/3IaBkFQ/(SEQ ID NO:22-23);IDH1探针:/56-FAM/ATGACTTAC/ZEN/TTGATCCCCATAAGCATGA/3IABkFQ/(SEQ ID NO:24-25)。TERT探针在C228T与C250T之间的共有区域中设计,然而IDH1探针在等位基因特异性引物与常见引物之间的区域中设计,并且因此可以用于所有等位基因特异性IDH反应(R132S、C、L、G以及H)。
D.标准物、拷贝数以及突变%定量
与AS TERT和IDH1/2引物组一起,我们使用以非等位基因特异性方式扩增两种突变(C228T和C250T)周围的TERT启动子区、R132H突变周围的IDH1外显子4的引物,以及经设计以扩增高度重复人类系-1元件(hline1Fwd:5'TCACTCAAAGCCGCTCAACTAC-3'(SEQ ID NO:26);hline1Rev:5'-TCTGCCTTCATTTCGTTATGTACC-3')(SEQ ID NO:27)的引物。这一信息可以用以标准化来自扩增WT或MUT等位基因的等位基因特异性PCR的Ct值,并且提供突变等位基因分数的定量读出,使得能够交叉比较样品。如第E节中所提及,如果样品的浓度均一致,那么这不必要。除此以外,出于验证的目的,许多标准化样品与测试样品一起运行,包括如50%突变样品(阳性对照)、1%突变样品(低突变阳性对照)、0%野生型样品(阴性对照)以及无模板对照的样品。这些标准物通过从具有已知TERT/IDH状态的细胞系分离基因组DNA(gDNA)来产生。举例来说,我们使用来自以下细胞系的gDNA:DAOY(C228T)、A375(C250T)、HCT116(野生型)以及HCT116IDH1 R132H敲入#2(IDH1 R132H)。在靶标基因座处具有gDNA野生型的这些样品的稀释液产生1%和小于1%的所需标准物。标准物的另一来源是具有靶突变的质粒DNA,对于其我们已使用TOPO克隆(K4810-01,Life technologies)产生为“100%标准物”。我们使用通过PCR扩增来自具有所关注突变的肿瘤样品的TERT启动子/IDH1/2的一部分来产生的插入物。此外,为充当更真实的定量对照,我们已产生具有所关注的TERT和IDH1突变两者的完美杂合子质粒(参见下文细节,图7),其可以通过将这些基因座克隆于相同质粒中或以类似方式克隆于独立质粒中扩展到其它靶突变。
每个引物组一式三份地运行于样品。用于检测TERT和IDH1的突变等位基因(即,最常见的神经胶质瘤相关突变)的一示例性运行是使用表9中的以下引物组。野生型AS引物组也可以用作非偏压(NB)扩增子的替代物以用于更精确定量。用于非偏压扩增子的引物展示对特定等位基因(突变或野生型)无特异性,并且应同样扩增两种类型的等位基因。
我们设计异合子校准体以充当50%突变/50%WT样品,因为稀释液仅可以近似于突变和野生型等位基因分数的相对比率。这种标准物作为用于先前提及的嵌套PCR方法的标准物工作地最好。针对单突变,如BRAF V600E突变32,已先前产生杂合校准质粒,然而在这里我们制备用于多个突变:IDH1 R132H和TERT C228T/C250T的单一校准体,大大促进了定量和工作流(图7)。两个靶标区域由>3100bp分隔开并且对应突变彼此大致等距以确保有限的引物干扰。这些标准物通过第一设计基因来产生以由GENEWIZ合成,其中pUC-57-ampR质粒中TERT启动子的部分(228和250基因座+/-~150bp)和IDH1外显子4的部分(R132或c.395G基因座+/-~150bp),连同分隔每一基因片段的合成限制酶位点(在希望的情况下),将基因座彼此分隔(一些作者将这列举为改良其作为标准物的性能)。这些物克隆于载体pGL3-enh(Promega)中,仅使用载体pGL3-enh,因为其具有彼此大约等距的克隆位点,确保构成“异合子”的两个TERT-IDH段被最大限度地分隔。另外,我们产生所有基因座作为阴性对照是野生型的等效质粒,其中每一基因基因座具有两个拷贝。这个系统可以扩展到所关注的其它突变,例如更罕见的IDH1突变和IDH2突变。我们已在每一基因座周围引入限制酶位点以促进其它基因座下的扩展并且使得能够选择性地线性化。
E.数据分析
存在用于数据分析的若干选择。最直接的一个方法是确保所有样品具有相等浓度,并且使用由将标准细胞系DNA稀释到多个突变百分比而产生的趋势线,以反向计算突变等位基因分数(图9)。如下文所示,趋势线具有极佳线性(R2>0.994)。
为使用具有不同DNA输入量的样品,我们已采用以下方法:将Ct值标准化成样品拷贝数的度量(使用非偏压/常见扩增子的Ct值或hline1的Ct值),并且使用阳性对照样品作为突变等位基因百分比标准物。Ct(循环阈值)被定义为使荧光信号穿过阈值(即超出背景水平)所需的循环数。这种类型的标准化计算另外需要估计引物效率。基于基因组DNA的稀释液,我们已估计每个引物组合的引物效率(表10)。
成一式三份的Ct值是每个引物组的平均值并且通过引物效率值标准化。对于每一样品,AS突变引物的平均Ct值随后通过对应常见(NB)引物组的平均Ct值标准化。使用下文等式(Pfaffl等人),其中EAS是指AS突变引物组合的效率,对照是指已知突变百分比(在这种情况下是50%)的阳性对照的平均Ct值,并且样品是指所评估样品的平均Ct值。相同信息在分母中,但均参照用于标准化的适当NB引物组(例如,常见TERT、常见IDH1、line1)。对于更精确的值,为比较我们建议使用AS突变相较于AS野生型来调节等式,这产生突变:野生型等位基因分数的比率,其可以经过调节以单独产生突变等位基因分数。
这些方法用于gDNA的等位基因特异性qPCR和预扩增的经纯化PCR产物的嵌套qPCR两者。在嵌套qPCR的情形下,我们建议使用预扩增的杂合校准质粒作为具有每一靶突变的50%的高度精确标准物,并且作为参考标准化成这者,但也可以使用已知突变百分比的预扩增的基因组DNA。
F.性能
使用上文引物组和条件,我们已测试这些引物在高水平背景中的检测限,并且发现其在15,000野生型拷贝的背景中可以可靠地检测低到15个突变基因组DNA拷贝(0.1%),并且将这与0%(野生型)样品区分(图10)。使用嵌套qPCR,也可以在等位基因特异性PCR下实现高辩别(图11)。
G.qPCR诊断的应用
为在临床上相关的情形下测试我们的分析,我们已从43个神经胶质瘤样品中获取DNA,所述神经胶质瘤样品先前已使用桑格测序进行基因分型,并且使用这种方法鉴别为TERT启动子WT和IDH1 R132 WT。我们使用我们的qPCR分析并且鉴别具有TERT启动子C228T突变的9个样品和具有IDH1 R132H突变的3个样品,总计12个样品或全部的28%,均具有先前通过传统方法不可检测的百分比<10%(表11)。另外,这种分析在~1小时内在定量结果的情况下完成,然而桑格测序涉及PCR后的额外测序步骤。
文献
所引用的每一文献的公开内容明确地并入本文中。
1.Yan,H.等人 神经胶质瘤中的IDH1和IDH2突变(IDH1 and IDH2 mutations in gliomas).《新英格兰医学杂志(N Engl J Med)》360,765-73(2009).
2.Jansen,M.,Yip,S.&Louis,D.N.成人神经胶质瘤中的分子病变:诊断、预后以及预测标记。(Molecular pathology in adult gliomas:diagnostic,prognostic,and predictive markers.)《柳叶刀神经病学(Lancet Neurol)》9,717-26(2010).
3.Louis,D.N.,国际癌症研究机构(International Agency for Research on Cancer).,世界卫生组织(World Health Organization).&德国海德堡的癌症研究中心(Deutsches Krebsforschungszentrum Heidelberg).中枢神经系统的肿瘤的WHO分类(WHO classification of tumours of the central nervous system),第309页(国际癌症研究机构:由瑞士里昂日内瓦市(Lyon Geneva,Switzerland)世界卫生组织的《WHO简报(WHO Press)》分发,,2007).
4.Ostrom,Q.T.等人 CBTRUS统计报告:在美国在2007-2011年诊断的原发性脑和中枢神经系统肿瘤(CBTRUS statistical report:primary brain and central nervous system tumors diagnosed in the United States in 2007-2011).《神经肿瘤学(Neuro Oncol)》16增刊4,iv1-63(2014).
5.Ohgaki,H.&Kleihues,P.原发性和继发性成胶质细胞瘤的定义(The definition of primary and secondary glioblastoma).《临床癌症研究(Clin Cancer Res)》19,764-72(2013).
6.Coons,S.W.,Johnson,P.C.,Scheithauer,B.W.,Yates,A.J.&Pearl,D.K.在原发性神经胶质瘤的分类和定级中提高诊断精确性和观察者间一致性(Improving diagnostic accuracy and interobserver concordance in the classification and grading of primary gliomas).《癌症(Cancer)》79,1381-93(1997).
7.Killela,P.J.等人 TERT启动子突变频繁出现在神经胶质瘤和来源于具有低速率自身再生的细胞的肿瘤子集中(TERT promoter mutations occur frequently in gliomas and a subset of tumors derived from cells with low rates of self-renewal).《美国国家科学院院刊(Proc Natl Acad Sci U S A)》110,6021-6(2013).
8.Jiao,Y.等人 频繁的ATRX、CIC、FUBP1以及IDH1突变细化恶性神经胶质瘤的分类(Frequent ATRX,CIC,FUBP1and IDH1 mutations refine the classification of malignant gliomas).《肿瘤靶标(Oncotarget)》3,709-22(2012).
9.Heaphy,C.M.等人 具有ATRX和DAXX突变的肿瘤中的经改变端粒(Altered telomeres in tumors with ATRX and DAXX mutations).《科学(Science)》333,425(2011).
10.Bettegowda,C.等人 CIC和FUBP1中的突变促成人类少突神经胶质瘤(Mutations in CIC and FUBP1contribute to human oligodendroglioma).《科学》333,1453-5(2011).
11.Killela,P.J.等人 IDH1、IDH2以及TERT启动子中的突变定义成人恶性神经胶质瘤的临床上相异的亚群(Mutations in IDH1,IDH2,and in the TERT promoter define clinically distinct subgroups of adult malignant gliomas).《肿瘤靶标》(2014).
12.Amary,M.F.等人 IDH1和IDH2突变在中心性软骨肉瘤以及中心性和骨膜软骨瘤中而非在其它间叶细胞肿瘤中是频繁事件(IDH1and IDH2mutations are frequent events in central chondrosarcoma and central and periosteal chondromas but not in other mesenchymal tumours).《病理学杂志(J Pathol)》224,334-43(2011).
13.Pansuriya,T.C.等人 在奥利埃病和马富西综合征中体细胞镶嵌IDH1和IDH2突变与内生软骨瘤和梭形细胞血管瘤相关(Somatic mosaic IDH1and IDH2mutations are associated with enchondroma and spindle cell hemangioma in Ollier disease and Maffucci syndrome).《自然-遗传学(Nat Genet)》43,1256-61(2011).
14.Kipp,B.R.等人 胆管癌中的异柠檬酸脱氢酶1和2突变(Isocitrate dehydrogenase1and 2mutations in cholangiocarcinoma).《人类病理学(Hum Pathol)》43,1552-8(2012).
15.Mardis,E.R.等人 通过测序急性骨髓性白血病基因组而发现的复发突变(Recurring mutations found by sequencing an acute myeloid leukemia genome).《新英格兰医学杂志》361,1058-66(2009).
16.Borger,D.R.等人 经由广基肿瘤基因分型鉴别的胆管癌中的异柠檬酸脱氢酶(IDH)1和IDH2的频繁突变(Frequent mutation of isocitrate dehydrogenase(IDH)1and IDH2in cholangiocarcinoma identified through broad-based tumor genotyping).《肿瘤学家(Oncologist)》17,72-9(2012).
17.Davidson,C.J.等人 提高桑格测序的检测限:用于KRAS变异体检测的方法的比较(Improving the limit of detection for Sanger sequencing:A comparison of methodologies for KRAS variant detection).《生物技术(Biotechniques)》2012(2012).
18.Wu,D.Y.,Ugozzoli,L.,Pal,B.K.&Wallace,R.B.用于诊断镰状细胞贫血的β-球蛋白基因组DNA的等位基因特异性酶扩增(Allele-specific enzymatic amplification of beta-globin genomic DNA for diagnosis of sickle cell anemia).《美国国家科学院院刊》86,2757-60(1989).
19.Latorra,D.,Campbell,K.,Wolter,A.&Hurley,J.M.在SNP基因分型中的使用3'锁核酸(LNA)引物的经增强等位基因特异性PCR辩别(Enhanced allele-specific PCR discrimination in SNP genotyping using 3'locked nucleic acid(LNA)primers).《人类突变(Hum Mutat)》22,79-85(2003).
20.Rupp,J.,Solbach,W.&Gieffers,J.用于通过使用“锁”核酸来定量并且辩别肺炎衣原体基因型的单核苷酸多态性特异性PCR(Single-nucleotide-polymorphism-specific PCR for quantification and discrimination of Chlamydia pneumoniae genotypes by use of a"locked"nucleic acid).《应用与环境微生物学(Appl Environ Microbiol)》72,3785-7(2006).
21.Morandi,L.等人 等位基因特异性锁核酸定量PCR(ASLNAqPCR):判断并且定量KRAS和BRAF突变的精确并且有成本效益的分析(Allele specific locked nucleic acid quantitative PCR(ASLNAqPCR):an accurate and cost-effective assay to diagnose and quantify KRAS and BRAF mutation).《公共科学图书馆·综合(PLoS One)》7,e36084(2012).
22.Zeng,Y.等人 用于检测HBV YIDD(ATT)突变并且评估其应用的实时等位基因特异性锁核酸定量PCR的确立(Establishment of real time allele specific locked nucleic acid quantitative PCR for detection of HBV YIDD(ATT)mutation and evaluation of its application).《公共科学图书馆·综合》9,e90029(2014).
23.Strand,H.,Ingebretsen,O.C.&Nilssen,O.用含有锁核酸的寡核苷酸引物实时检测并且定量线粒体突变(Real-time detection and quantification of mitochondrial mutations with oligonucleotide primers containing locked nucleic acid).《临床化学学报(Clin Chim Acta)》390,126-33(2008).
24.Remke,M.等人 TERT启动子突变在SHH亚群成神经管细胞瘤中是高度复发性的(TERT promoter mutations are highly recurrent in SHH subgroup medulloblastoma).《神经病理学学报(Acta Neuropathol)》126,917-29(2013).
25.Patel,K.P.等人 用于急性骨髓性白血病中的IDH1和IDH2变异体的诊断测试,一种使用高分辨率熔解曲线分析的运算方法(Diagnostic testing for IDH1 and IDH2variants in acute myeloid leukemia an algorithmic approach using high-resolution melting curve analysis).《分子诊断学杂志(J Mol Diagn)》13,678-86(2011).
26.Horbinski,C.,Kelly,L.,Nikiforov,Y.E.,Durso,M.B.&Nikiforova,M.N.针对脑活检通过荧光熔解曲线分析作为诊断工具来检测IDH1和IDH2突变(Detection of IDH1and IDH2mutations by fluorescence melting curve analysis as a diagnostic tool for brain biopsies).《分子诊断学杂志》12,487-92(2010).
27.Hurst,C.D.,Platt,F.M.&Knowles,M.A.膀胱癌中的TERT启动子的综合突变分析和排泄尿液中突变的检测(Comprehensive mutation analysis of the TERT promoter in bladder cancer and detection of mutations in voided urine).《欧洲泌尿科学(Eur Urol)》65,367-9(2014).
28.Allory,Y.等人 膀胱癌中的端粒酶逆转录酶启动子突变:跨越阶段的高频率、尿液中的检测以及与结果相关联的缺乏(Telomerase reverse transcriptase promoter mutations in bladder cancer:high frequency across stages,detection in urine,and lack of association with outcome).《欧洲泌尿科学》65,360-6(2014).
29.Qu,Y.等人 胆囊癌和胃癌大群组中的低频率的TERT启动子突变(Low frequency of TERT promoter mutations in a large cohort of gallbladder and gastric cancers).《国际癌症杂志(Int J Cancer)》134,2993-4(2014).
30.Boisselier,B.等人 冷PCR HRM:一种用于IDH1突变的高度灵敏的检测方法(COLD PCR HRM:a highly sensitive detection method for IDH1mutations).《人类突变》31,1360-5(2010).
31.Kinde,I.等人 TERT启动子突变早期出现在尿道上皮瘤形成中并且是尿液中的早期疾病和疾病复发的生物标记(TERT promoter mutations occur early in urothelial neoplasia and are biomarkers of early disease and disease recurrence in urine).《癌症研究(Cancer Res)》73,7162-7(2013).
32.Szankasi,P.等人 针对定量使用单一杂合对照质粒的用于BRAF V600E突变的定量等位基因特异性PCR测试:在无标准曲线的情况下用于qPCR测试的模型(A quantitative allele-specific PCR test for the BRAF V600E mutation using a single heterozygous control plasmid for quantitation:a model for qPCR testing without standard curves).《分子诊断学杂志》15,248-54(2013).
序列表
<110> H•严
Y•何
R•杨
B•H•迪普拉斯
L•汉森
D•比格纳
<120> 用于快速并且灵敏地检测热点突变的方法
<130> 000250.00218
<150> 62/014197
<151> 2014-08-14
<160> 29
<170> FastSEQ for Windows Version 4.0
<210> 1
<211> 16
<212> DNA
<213> 人工序列
<220>
<223> 引物
<400> 1
ctgggagggc ccggag 16
<210> 2
<211> 16
<212> DNA
<213> 人工序列
<220>
<223> 引物
<400> 2
ctgggagggc ccggaa 16
<210> 3
<211> 19
<212> DNA
<213> 人工序列
<220>
<223> 引物
<400> 3
gtcctgcccc ttcaccttc 19
<210> 4
<211> 16
<212> DNA
<213> 人工序列
<220>
<223> 引物
<400> 4
cccgtcccga cccctc 16
<210> 5
<211> 16
<212> DNA
<213> 人工序列
<220>
<223> 引物
<400> 5
cccgtcccga cccctt 16
<210> 6
<211> 36
<212> DNA
<213> 人工序列
<220>
<223> 引物
<400> 6
caggaaacag ctatgaccca gcgctgcctg aaactc 36
<210> 7
<211> 25
<212> DNA
<213> 人工序列
<220>
<223> 引物
<400> 7
gggtaaaacc tatcatcata ggtcg 25
<210> 8
<211> 25
<212> DNA
<213> 人工序列
<220>
<223> 引物
<400> 8
gggtaaaacc tatcatcata ggtca 25
<210> 9
<211> 24
<212> DNA
<213> 人工序列
<220>
<223> 引物
<400> 9
aacatgcaaa atcacattat tgcc 24
<210> 10
<211> 36
<212> DNA
<213> 人工序列
<220>
<223> 引物
<400> 10
caggaaacag ctatgaccat cccccggctt gtgagt 36
<210> 11
<211> 20
<212> DNA
<213> 人工序列
<220>
<223> 引物
<400> 11
aagcccatca ccattggcag 20
<210> 12
<211> 20
<212> DNA
<213> 人工序列
<220>
<223> 引物
<400> 12
aagcccatca ccattggcaa 20
<210> 13
<211> 20
<212> DNA
<213> 人工序列
<220>
<223> 引物
<400> 13
aggtcagtgg atcccctctc 20
<210> 14
<211> 38
<212> DNA
<213> 人工序列
<220>
<223> 引物
<400> 14
caggaaacag ctatgaccgg accaagccca tcaccatt 38
<210> 15
<211> 24
<212> DNA
<213> 人工序列
<220>
<223> 引物
<400> 15
gggtaaaacc tatcatcata ggtt 24
<210> 16
<211> 24
<212> DNA
<213> 人工序列
<220>
<223> 引物
<400> 16
gggtaaaacc tatcatcata ggtg 24
<210> 17
<211> 24
<212> DNA
<213> 人工序列
<220>
<223> 引物
<400> 17
gggtaaaacc tatcatcata ggta 24
<210> 18
<211> 25
<212> DNA
<213> 人工序列
<220>
<223> 引物
<400> 18
gggtaaaacc tatcatcata ggtct 25
<210> 19
<211> 20
<212> DNA
<213> 人工序列
<220>
<223> 引物
<400> 19
aagcccatca ccattggcat 20
<210> 20
<211> 19
<212> DNA
<213> 人工序列
<220>
<223> 引物
<400> 20
aagcccatca ccattggcg 19
<210> 21
<211> 19
<212> DNA
<213> 人工序列
<220>
<223> 引物
<400> 21
aagcccatca ccattggct 19
<210> 22
<211> 9
<212> DNA
<213> 人工序列
<220>
<223> 引物
<400> 22
cgggtcccc 9
<210> 23
<211> 8
<212> DNA
<213> 人工序列
<220>
<223> 引物
<400> 23
ggcccagc 8
<210> 24
<211> 9
<212> DNA
<213> 人工序列
<220>
<223> 引物
<400> 24
atgacttac 9
<210> 25
<211> 19
<212> DNA
<213> 人工序列
<220>
<223> 引物
<400> 25
ttgatcccca taagcatga 19
<210> 26
<211> 22
<212> DNA
<213> 人工序列
<220>
<223> 引物
<400> 26
tcactcaaag ccgctcaact ac 22
<210> 27
<211> 24
<212> DNA
<213> 人工序列
<220>
<223> 引物
<400> 27
tctgccttca tttcgttatg tacc 24
<210> 28
<211> 18
<212> DNA
<213> M13
<400> 28
tgtaaaacga cggccagt 18
<210> 29
<211> 18
<212> DNA
<213> M13
<400> 29
caggaaacag ctatgacc 18
- 还没有人留言评论。精彩留言会获得点赞!