早期鉴定‘Hort16A’猕猴桃开放性授粉后代性别的方法与流程
本发明属于植物的遗传育种,涉及可早期鉴定植物后代性别的方法。
背景技术:
猕猴桃,藤本,多年生,大多为雌雄异株,为一类植物的总称。在猕猴桃属中,中华猕猴桃‘Hort 16A’果肉呈金黄色,富含不饱和脂肪酸和大量亚麻酸,果肉脆滑香甜,爽口多汁,单果的重量最高140g,每公斤果实中维生素C含量可达1200mg,是公认的优良品种,广泛栽培于亚热带地区,其性别表现有雌株、雄株、雌雄同株三种类型,有些雌株能产生有活力的花粉,有些雄株却不能正常传粉,甚至有能结果的雄株(McNeilage M A.Progress in breeding hermaphrodite kiwifruit cultivars and understanding the genetics of sex determination[J].Biologia Plantarum,1997,39(2):271-280)。对于种子和果实生产,‘Hort 16A’猕猴桃开放授粉后代的雌株具有更重要的存在意义,其开放授粉后代遗传了母本的大部分的优良品质,同时后代出现了明显的性别分化,雌株和雄株的数量相当。但是,处于生长期的‘Hort 16A’猕猴桃植株从外部形态上不能区分出植株的性别,性别区分发生在花器官发育的后期差异上。雄花的花柱和柱头停止发育,雌蕊败育不形成胚珠,雄蕊饱满,充满有活力的花粉;雌花的雄蕊败育,几乎被发达似羽扇的花柱和柱头掩盖。然而,从种子播种到开花区分出雌雄,一般需要3~5年的时间。这期间内,没有多少生产意义的雄株不但增加了大量的培育成本,而且延长了杂交育种、改良品种、获得果实、选育雌性植株等的年限。早期鉴定‘Hort 16A’猕猴桃开放授粉后代雌雄株性别成为研究者们探索的重要问题。
现有技术中,SCAR标记、AFLP标记等体系均可在核苷酸水平上比对筛查目标序列。SNP(Single Nucleotide Polymorphism)单核苷酸多态性,主要是指在基因组水平上由单个核苷酸的变异所引起的DNA序列多态性。
以上术语的中英文含义是:
SCAR(Sequence Characterized Amplified Regions,特征序列扩增区域)标记。
AFLP(Amplified Fragment Length Polymorphism,扩增片段长度多态性)标记。
技术实现要素:
本发明旨在提供一种可早期鉴定‘Hort 16A’猕猴桃开放授粉后代性别的方法,或者说,针对‘Hort 16A’猕猴桃的开放授粉后代,通过验证SCAR标记、筛选AFLP标记、筛查SNP标记,在DNA水平上发现该开放授粉后代植株的雌雄鉴别的早期鉴定方法。
本发明所要解决的技术问题通过以下途径实现:
可早期鉴定‘Hort 16A’猕猴桃开放性授粉后代性别的方法,包括以下步骤:
(1)取‘Hort 16A’猕猴桃开放性授粉后代植株,利用Ezup柱式法提取植物基因组DNA作为样本;
(2)SNP标记的筛选,包括:
针对性别相关基因片段,建立PCR反应体系,配置25μLPCR反应体系,其反应体系以下表的引物序列作为PCR扩增SNP差异的上下游引物,扩增样本,筛选雌雄株之间的SNP差异:
表1 SNP标记的引物序列
(3)将步骤(2)扩增的核苷酸序列作为雌雄株之间的SNP标记的对照序列,比对雌雄株之间的SNP位点,筛选区分‘Hort 16A’猕猴桃开放授粉后代性别 的SNP标记位点。
进一步,所述的方法是:所述的步骤(2)是针对性别相关基因片段,以引物2-1R:5’ttagcacgctagggtcac3’和2-1F:5’aaggttagggtcgcaagt3’作为PCR扩增SNP差异的上下游引物,使扩增出的序列具有雌雄之间的SNP差异。
进一步,所述的方法是:所述的步骤(3)是将步骤(2)扩增的295bp核苷酸序列的雄性6号样本(X6):
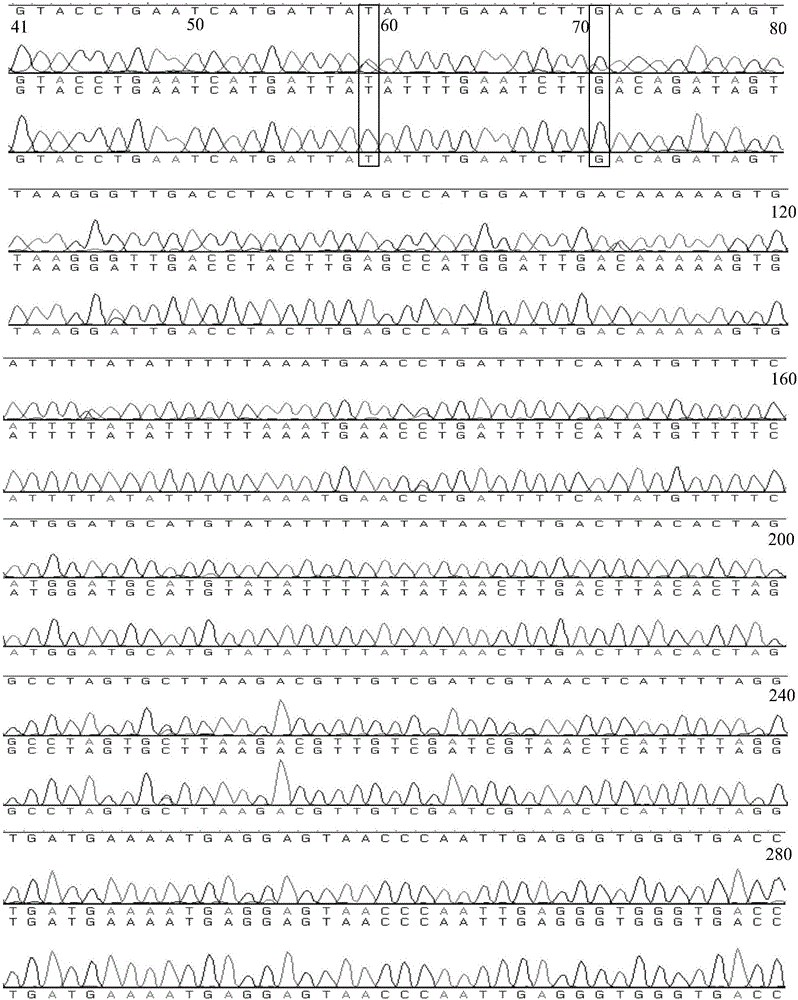
作为雌雄株之间的SNP标记的对照序列,比对雌雄株之间的SNP位点,以59bp和71bp处作为区分‘Hort 16A’猕猴桃开放授粉后代性别的SNP标记位点:
其中,59bp处碱基表现为t纯合的为雌性个体,表现为t/c杂合的为雄性个体,71bp处碱基表现为g纯合的为雌性个体,表现为g/a杂合的雄性个体。
本发明的有益效果是:
以‘Hort 16A’猕猴桃开放授粉后代为研究对象,通过验证SCAR标记、筛选AFLP标记以及筛查SNP标记之分子生物学方法,取得DNA水平的性别标记,提供了中华猕猴桃‘Hort 16A’开放授粉后代植株的雌雄鉴别的一种早期鉴定方法。具体是:
(1)SCAR标记的验证:
参考Gill的研究成果,验证SCAR标记引物在‘Hort 16A’猕猴桃开放授粉后代雌雄株之间的检测率。
(2)基于AFLP标记的分析:
建立AFLP遗传分析体系,比对条带,分析各项遗传参数,寻找与性别相关的AFLP标记。
(3)基于SNP标记的筛查:
通过SNP标记的筛查,找到一对可以在已知性别‘Hort 16A’猕猴桃开放授粉后代雌雄株之间稳定扩增的引物;通过PCR扩增和测序比对,找到在雌雄株之间的SNP标记。即引物2-1F和引物2-1R扩增出来约295bp的核苷酸序列中,以雄 性6号样本(X6)为对照序列,59bp和71bp处可作为区分‘Hort 16A’猕猴桃开放授粉后代性别的SNP标记。其中,59bp处碱基表现为t纯合的雌性个体,表现为t/c杂合的为雄性个体;71bp处碱基表现为g纯合的为雌性个体,表现为g/a杂合的雄性个体。
本发明属于国家林业局948项目(2012-4-62)云南省教育厅科学研究基金项目(2014Y332)和云南省高校林木遗传与繁育重点实验室研究生开放基金项目(YNGB201508)的资助项目。
附图说明
图1为已知性别‘Hort 16A’猕猴桃开放授粉后代聚类图。图中,C10、CB1、C14、C16、C18、C21、C8、C21、C8、C11、C19、C20、C14、C12、C101、CB2均为雌性个体;X1、X9、X7、X2、X6、X13、X22、X15、X5、X24均为雄性个体。
图2为雌雄株扩增序列比对结果。
图3为通过步骤(2)引物扩增的295bp核苷酸序列的雄性6号样本(X6)。
以下结合附图对本发明做进一步说明。
具体实施方式
1.以‘Hort 16A’猕猴桃开放授粉后代已知性别植株为实验材料,利用Ezup柱式法提取植物基因组DNA。
2.SCAR标记的验证
(1)PCR反应体系
根据Gill等(Gill G P,Harvey C F,Gardner R C,et al.Development of sex-linked PCR markers for gender identification in Actinidia[J].Theoretical&Applied Genetics,1998,97(97):439-445)的研究成果,分别验证3对SCAR标记引物:SMX、SMY、SMY1,具体序列见表1。配置25μLPCR反应体系,见表2。
表1SCAR引物序列及Tm值
Table 1The sequences and Tm value of SCAR primers
表2PCR反应体系25μL
Table 2The system of PCR reaction 25μL
(2)PCR扩增条件
将25μL反应体系配制好后,按照下面程序设置好PCR仪,放入样品进行扩增。
扩增完成后,取5μL样品,利用1.2%的琼脂糖凝胶电泳检测;结果拍照记录。统计其在24株已知性别后代样本中的检出率,SMX检出性别的比率为35%,SMY检出性别的比率为60%,SMY1检出性别的比率为80%,检出率都较低。
3.AFLP标记的分析
通过酶切、连接、预扩增、选择性扩增、变性聚丙烯酰胺凝胶电泳等一系列过程建立AFLP标记分析体系,其中为了优化实验过程,我们对酶切时间、预扩增产物稀释倍数进行了筛选,最后确定5对选择性扩增引物进行AFLP分析。
当酶切8小时,预扩增产物稀释到20倍时,选取5对聚丙烯酰胺凝胶电泳较清晰且条带较丰富的引物进行荧光标记,用于对已知性别后代DNA样本的选择性扩增,由GENEMARKER导出峰值数据后,统计0/1矩阵,结果见表3,这5 对引物的多态带百分率都较高,适合作为已知性别后代不同个体之间各项遗传参数的分析。利用POPGENE分析遗传参数,由表4中可知,雄性群体的各项遗传参数均大于雌性群体的各项遗传参数,但由于雌雄两组的样本数和多态位点数都存在差异,所以这并不能作为区分性别的标志。表5中可知,已知性别后代的遗传分化系数很低,基因流很高,说明其后代个体间的亲缘关系很近。
再利用NTSYS对24株已知性别后代个体间进行聚类,从聚类图(图2)上可以看到,在任何一个分支点上,都没有把雌雄个体间区分开来。所以AFLP标记并不是区分‘Hort 16A’猕猴桃性别高效且便捷的方法。
表3对荧光标记AFLP引物扩增结果
Table 3The amplification results of 5pairs AFLP primers labeled with fluorescent
表4已知性别后代遗传多样性分析
Table 4The genetic diversity analysis of known-gender offsprings
表5遗传分化和遗传结构分析
Table 5The analysis of genetic differentiation and genetic structure
4.SNP标记的筛查
(1)PCR扩增体系的建立
在网上下载红阳猕猴桃全基因组序列,通过Gill G P已经在中华猕猴桃中找到的SCAR标记片段为目标序列,在红阳猕猴桃全基因组中比对筛查与之同源性较高区域6个,以之分别设计上下游引物,具体序列见表6。
表6SNP标记的引物序列
Table 6The sequences of SNP marker
首先在已知性别的10株‘Hort 16A’猕猴桃开放授粉后代(5株为雄株,5株为雌株)中进行PCR扩增,扩增体系见表7。
表7PCR扩增体系25μL
Table 7The system of PCR amplification 25μL
(2)PCR扩增条件
将PCR反应体系配制好后,设置好退火温度,将体系放入PCR仪中按照下 面的程序进行扩增。
扩增结果通过1.2%的琼脂糖凝胶电泳检测,拍照记录。扩增产物委托生工测序。
(3)性别差异SNP标记的筛选及验证
在扩增结果较清晰,测序结果较好的情况下,分别比对已知性别‘Hort 16A’猕猴桃开放授粉后代雌雄株(5株雄株,5株雌株)之间的序列信息。测序结果在Contig中进行比对分析,逐一比对个体之间每个位点的碱基峰值,统计存在的SNP位点,比较分析性别差异,找到雌雄株之间可能存在的SNP位点。
经筛选,找到了雌雄株之间的特征差异SNP标记,确定了扩增出SNP差异的上下游引物。在引物2-1即2-1F:5’AAGGTTAGGGTCGCAAGT3’和2-1R:5’TTAGCACGCTAGGGTCAC3’扩增的核苷酸序列中,统计SNP标记位点,统计结果见表8。其中:
59bp和71bp处可作为区分性别的SNP标记。59bp处表现为t纯合的为雌性个体,表现为t/c杂合的雄性个体;71bp处表现为g纯合的为雌性个体,表现为g/a杂合的为雄性个体。
在125bp处,虽然在10株已知性别后代中也表现为雌雄之间的明显差异,但在随后的已知性别植株验证中发现,在125bp处并不能完全区分雌雄,而59bp和71bp处可以区分所有已知性别‘Hort 16A’猕猴桃开放授粉后代的性别。
由于SNP标记是DNA水平的分子标记,不会随时间、空间及生理的变化而发生变化,可作为选择标记对‘Hort 16A’猕猴桃开放授粉后代性别进行早期鉴定。
表8‘Hort 16A’猕猴桃开放授粉后代SNP标记位点
Table 8The SNP marker loci of open pollination offsprings of‘Hort 16A’
- 还没有人留言评论。精彩留言会获得点赞!