基于血清exosomalmicroRNAs的结直肠癌转移检测的引物和试剂盒的制作方法
本发明属于分子生物学检测技术领域,涉及一种检测结直肠癌转移相关血清exosomal microRNAs的专用引物、试剂盒,以及检测结直肠癌血清exosomal microRNAs表达量的方法。
背景技术:
结直肠癌是一种发病率和死亡率较高的恶性肿瘤,发生转移是直肠癌患者治疗失败和死亡的最主要原因。研究显示,超过半数的结直肠癌患者最终会发生转移,导致术后肿瘤的转移复发。从临床治疗效果来看,对转移或转移高危人群的准确预测,积极采取预防性治疗措施,是降低结直肠癌复发转移、改善预后的重要环节。目前临床上用于检査结直肠癌转移的方法较多,虽各具优势,但临床应用均受到一定的限制。肠镜可确定结直肠癌患者术后肿瘤有无复发及复发灶的浸润程度,但为有创操作,患者的耐受性较差。影像学检查方法,如B超、CT、MRI和PET/CT等,虽然技术在不断发展,敏感性仍较低,待发现时肿瘤多已具备一定体积。目前,国内外学者多倾向于采用检测肿瘤标志物的方法用于结直肠癌转移的预测。因此,寻找敏感性高、特异性强的生物标志物有效预测结直肠癌转移也一直是临床研究的热点。
microRNAs是一类具有调控功能的内源性非编码小分子RNA,控制着约1/3的人类基因的表达,其可以发挥类似于癌基因或抑癌基因的功能,在肿瘤的发生、发展和转移中发挥着重要作用。Nicoloso等在《Nature Reviews Cancer》(Nicoloso,MS.et al(2009)Nat Rev Cancer 9:293-302)中指出,microRNAs是一种新型肿瘤转移调控器,作为判断肿瘤转移的分子标志物是非常有潜力的。microRNAs可以通过促进肿瘤细胞的浸润、血管生成、EMT和逃避凋亡,参与结直肠癌的转移。
2014年美国《Popular Science》杂志提出,“以Exosomes(外泌体)为载体的诊断工具,有望使癌症诊断更加简单易行”。Exosomes是指由细胞分秘释放到细胞外的一种膜性囊泡,在肿瘤的侵袭、转移中扮演着重要角色。Huang等(Huang,X.et al(2013)BMC genomics 14:319)利用深度测序分析发现血浆exosomes中存在丰富的RNAs,并且exosomes的膜性囊泡结构可以对这些RNAs产生保护作用,因此与血清/血浆总体RNA相比,血清/血浆exosomal RNA更加稳定,并且更加能代表恶性肿瘤的生物学功能的变化。近年来,有关exosomal RNA对于肿瘤疾病诊断作用的研究日益增多,为肿瘤的检测分析提供了一个可视窗口(Taylor,DD.et al(2013)Frontiers in genetics 4:142),但到目前为止,与结直肠癌转移相关的exosomal microRNAs未见报道。加之不同肿瘤间的异质性很大,与其它肿瘤转移相关的exosomal microRNAs对结直肠癌转移检测的参考性不大。因此,有必要对结直肠癌转移相关的exosomal microRNAs进行筛选验证,寻找可用于结直肠癌转移检测的exosomal microRNAs。
技术实现要素:
针对上述现有技术,本发明提供了一种准确、可靠的检测结直肠癌转移相关血清exosomal microRNAs的逆转录引物和检测引物、检测试剂盒,以及检测结直肠癌血清exosomal microRNAs表达量的方法。
本发明是通过以下技术方案实现的:
检测miR-483-5p与miR-451a组合的试剂在制备基于血清exosomal microRNAs检测结直肠癌转移试剂中的应用,其中miR-483-5p、miR-451a的碱基序列分别为5’-AAGACGGGAGGAAAGAAGGGAG-3’(SEQ ID:1)、5’-AAACCGUUACCAUUACUGAGUU-3’(SEQ ID:2)。
一种基于血清exosomal microRNAs检测结直肠癌转移的引物,包括miR-483-5p的逆转录引物和检测引物,miR-451a的逆转录引物和检测引物,
miR-483-5p的逆转录引物和检测引物如下:
miR-483-5p-RT:
5’-CTCAACTGGTGTCGTGGAGTCGGCAATTCAGTTGAGCTCCCTTC-3’(SEQ ID:3);
miR-483-5p-F:5’-ACACTCCAGCTGGGAAGACGGGAGGAAAGA-3’(SEQ ID:4);
miR-483-5p-R:5’-TGGTGTCGTGGAGTCG-3’(SEQ ID:5);
miR-451a的逆转录引物和检测引物如下:
miR-451a-RT:
5’-CTCAACTGGTGTCGTGGAGTCGGCAATTCAGTTGAGAACTCAGT-3’(SEQ ID:6);
miR-451a-F:5’-ACACTCCAGCTGGGAAACCGTTACCATTAC-3’(SEQ ID:7);
miR-451a-R:5’-TGGTGTCGTGGAGTCG-3’(SEQ ID:8)。
一种基于血清exosomal microRNAs检测结直肠癌转移的试剂盒,包括上述miR-483-5p的逆转录引物和检测引物,miR-451a的逆转录引物和检测引物,还包括内参基因miR-191-5p逆转录引物、内参基因miR-191-5p上游引物、内参基因miR-191-5p下游引物、内参基因U6逆转录引物、内参基因U6上游引物、内参基因U6下游引物和PCR反应液。
miR-191-5p的逆转录引物和检测引物如下:
miR-191-5p-RT:
5’-CTCAACTGGTGTCGTGGAGTCGGCAATTCAGTTGAGCAGCTGCT-3’(SEQ ID:9);
miR-191-5p-F:5’-ACACTCCAGCTGGG CAACGGAATCCCAAAAG-3’(SEQ ID:10);
miR-191-5p-R:5’-TGGTGTCGTGGAGTCG-3’(SEQ ID:11);
U6的逆转录引物和检测引物如下:
U6-RT:5’-AACGCTTCACGAATTTGCGT-3’(SEQ ID:12);
U6-F:5’-CTCGCTTCGGCAGCACA-3’(SEQ ID:13);
U6-R:5’-AACGCTTCACGAATTTGCGT-3’(SEQ ID:14)。
优选:PCR反应液由Syber GreenⅠ荧光染料、DNA聚合酶、dNTPs、三羟甲基氨基甲烷盐酸盐、氯化钾、氯化镁和水组成。
优选:所述试剂盒中各物质的浓度如下:miR-483-5p的逆转录引物:10nM;miR-483-5p的上游引物:10nM;miR-483-5p的下游引物:10nM;miR-451a的逆转录引物:10nM;miR-451a的上游引物:10nM;miR-451a的下游引物:10nM;Syber GreenⅠ荧光染料:1×Syber Green Ⅰ荧光染料;内参基因miR-191-5p逆转录引物:10nM;内参基因miR-191-5p上游引物:10nM;内参基因miR-191-5p下游引物:10nM;内参基因U6逆转录引物:10nM;内参基因U6上游引物:10nM;内参基因U6下游引物:10nM;DNA聚合酶:100U/mL;dNTPs:0.2mM;氯化镁:6mM;三羟甲基氨基甲烷盐酸盐:16.5mM;氯化钾:89.3mM。
上述基于血清exosomal microRNAs检测结直肠癌转移的引物,基于血清exosomal microRNAs检测结直肠癌转移的试剂盒在定性或定量检测血清exosomal microRNAs表达量中的应用。
一种检测结直肠癌转移相关exosomal microRNAs表达量的方法,步骤如下:
(1)提取血清样本中的exosomes:取250μl血清加入63μl ExoQuickTMExosomePrecipitation Solution试剂,震荡混匀,于室温下孵育30min。4℃,1500g,离心30min,于管底可见淡黄色沉淀,弃上清,用25μl PBS重悬沉淀,若沉淀不溶解,可适当继续加入PBS直至完全溶解。
(2)分离exosomes中的总RNA:
(3)RT-qPCR扩增:将上述分离的RNA进行反转录成cDNA,取cDNA为模板,加入引物和PCR反应液,进行PCR反应,检测样本阈值Cq;同时提取人结直肠癌细胞株SW480(购自中国医学科学院基础医学研究所基础医学细胞中心)RNAs,逆转录成cDNA作为校对样本,在每个PCR反应板中进行检测,记录Cq值;内参基因miR-191-5p、U6的RT-qPCR扩增,除引物采用相对应的逆转录引物和检测引物外,方法相同;
(4)制作标准曲线:上述检测完成后,拷贝数以10为底取对数作为横坐标,Cq值为纵坐标作图,绘制标准曲线,计算斜率Slope,然后根据公式E=10(-1/Slope)-1,计算扩增效率E;
(5)计算:选中样本和校对样本检测孔,应用实时荧光定量PCR仪的随机软件得出样本阈值Cq(T)和校对样本阈值Cq(C),根据公式Q=(E+1)-△Cq,△Cq=[Cq(T)-Cq(C)],得出基因的校正起始拷贝数Q;将miR-483-5p、miR-451a的Q值与内参基因(miR-191-5p、U6)的Q值的几何平均数相比,得到miR-483-5p、miR-451a的相对表达量。
上述方法的目的是研究恶性肿瘤生物学功能的变化中的应用,并不是以疾病的诊断与治疗为目的。
有益效果:
本发明建立的exosomal microRNAs检测方法,为结直肠癌转移的有效判断以及治疗方案的选择提供了重要的参考依据。
本发明使用了miR-191-5p、U6组合作为内参照对标本中的miR-483-5p、miR-451a进行相对定量分析,经NormFinder、geNorm软件评价,稳定性优于单一内参基因miR-191-5p或U6的使用,提高了结果的准确性,见表1。
表1NormFinder和geNorm软件对内参基因的评价
注:评分越低,稳定性越好。
本发明根据公式E=10(-1/Slope)-1,计算扩增效率(E),根据公式Q=(E+1)-△Cq计算miR-483-5p、miR-451a基因相对miR-191-5p、U6的表达量,避免了传统2-△△Cq法必须要求PCR扩增效率为100%的限制,使结果分析更加可靠。
附图说明
图1为淋巴结转移结直肠癌患者和未发生淋巴结转移结直肠癌患者血清exosomal microRNAs差异表达谱;
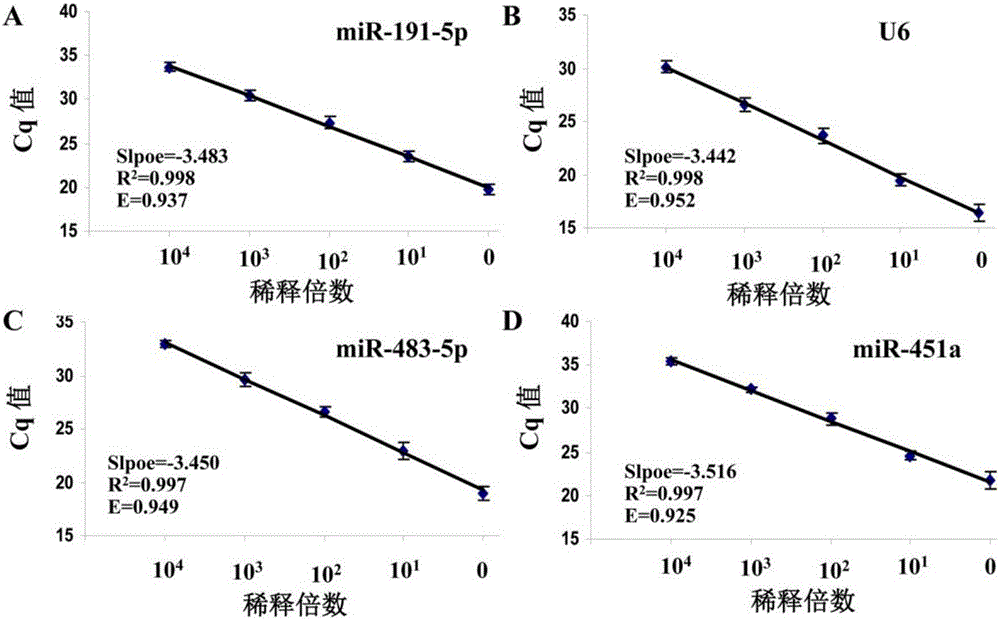
图2为miR-191-5p、U6、miR-483-5p和miR-451a的标准曲线;
图3为试剂盒检测miR-483-5p、miR-451a的特异性评价;
图4为exosomal miR-483-5p、miR-451a在47例未发生淋巴结转移结直肠癌(NLNM)和69例淋巴结转移结直肠癌(LNM)中的相对表达水平;
图5为exosomal miR-483-5p、miR-451a检测对判断结直肠癌转移的ROC曲线。
具体实施方式
下面结合实施例对本发明作进一步的说明。
下述实施例中所使用的实验方法如无特殊说明,均为常规方法。
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
实施例1
(1)结直肠癌转移相关exosomal microRNAs的筛选:
采用“microRNAs cDNA文库+文库预扩增+二代测序”的研究策略,首先建立了基于血清exosomes中差异表达microRNAs的技术路径,对40例淋巴结转移结直肠癌患者(每20例划为1组)和40例未发生淋巴结转移结直肠癌患者(每20例划为1组)血清exosomal microRNAs表达谱进行了分析和比对,发现13个上调exosomal microRNAs,其中miR-483-5p上调表达最明显,以及106个下调exosomal microRNAs,其中miR-451a下调表达最明显,见图1。
(2)试剂盒的组成及配制:
所述引物的序列是根据microRNA数据库(http://www.mirbase.org/)上报的核苷酸序列miR-483-5p(MIMAT0004761)、miR-451a(MIMAT0001631)为模板自主设计的,其引物序列、Tm值见表1。
表2引物序列、Tm值
所述专用试剂盒还包括内参基因miR-191-5p逆转录引物、内参基因miR-191-5p上游引物、内参基因miR-191-5p下游引物、内参基因U6逆转录引物、内参基因U6上游引物、内参基因U6下游引物和PCR反应液,PCR反应液由Syber GreenⅠ荧光染料、DNA聚合酶、dNTPs、三羟甲基氨基甲烷盐酸盐、氯化钾、氯化镁和水组成。
所述miR-483-5p逆转录引物:10nM。
所述miR-483-5p上游引物:10nM。
所述miR-483-5p下游引物:10nM。
所述miR-451a逆转录引物:10nM。
所述miR-451a上游引物:10nM。
所述miR-451a下游引物:10nM。
所述内参基因miR-191-5p逆转录引物:10nM。
所述内参基因miR-191-5p上游引物:10nM。
所述内参基因miR-191-5p下游引物:10nM。
所述内参基因U6逆转录引物:10nM。
所述内参基因U6上游引物:10nM。
所述内参基因U6下游引物:10nM。
所述Syber GreenⅠ荧光染料:1×Syber GreenⅠ荧光染料。
所述DNA聚合酶在qPCR反应液中的终浓度为100U/ml。
所述dNTPs在qPCR反应液中的终浓度为0.2mM。
所述氯化镁在PCR反应液中的终浓度为6mM。
所述三羟甲基氨基甲烷盐酸盐在PCR反应液中的终浓度为16.5mM。
所述氯化钾在PCR反应液中的终浓度为89.3mM。
(3)病例资料:
2009年1月至2010年1月在山东大学齐鲁医院进行结直肠癌根治术的结直肠癌患者116例,其中淋巴结转移组患者69例,男39例,女30例,年龄23~75岁,中位年龄52岁;未发生淋巴结转移组患者47例,男25例、女22例,年龄25~76岁,中位年龄54岁,所有患者均经组织病理学确诊,且为初次诊断,之前未接受任何治疗。两组间性别、年龄比较差异无统计学意义(P>0.05),具有可比性。
(4)血清标本采集:血清收集于促凝管内,4℃1 600×g离心10min,然后进一步4℃16000×g离心10min,收集血清,置-80℃冻存待测。
(5)血清中exosomes的分离:取250μl血清加入63μlExoQuickTMExosomePrecipitation Solution试剂,震荡混匀,于室温下孵育30min。4℃,1500g,离心30min,于管底可见淡黄色沉淀,弃上清,用25μl PBS重悬沉淀,若沉淀不溶解,可适当继续加入PBS直至完全溶解。
(6)exosomes中RNA提取:
1)向已提取好的exosome样本中加入700μl QIAzolLysis Reagent,震荡混匀1min,室温静止孵育5min。
2)加入140μl三氯甲烷,盖好盖子,剧烈震荡混匀。
3)室温静止2-3min后,将离心管置于低温离心机,4℃,12000g,离心15min。
4)离心结束后缓慢取出离心管,将上层水相(约350μl)转移入新离心管中,注意不要吸到中间相,加入525μl无水乙醇,用加样枪充分混匀。
5)吸取700μl样品加入到Rnease Mini column中盖好盖子,将柱子放入2ml离心管中,4℃,10000g,离心15s,丢弃离心出的液体。
6)向柱子中加入700μl Buffer RWT,盖好盖子,4℃,10000g,离心15s,丢弃离心出的液体。
7)向柱子中加入500μl Buffer RPE盖好盖子,4℃,10000g,离心15s,丢弃离心出的液体。
8)向柱子中加入500μl Buffer RPE盖好盖子,4℃,10000g,离心15s,丢弃离心出的液体。
9)将柱子取出置于新的离心管中,17000g,离心1min,尽量去除柱子中的液体。
10)将柱子置于新的离心管中,想柱子中加入30-50μl DEPC水(直接滴加到膜上),10000g,离心1min,洗提RNA。RNA存在于管底液相中。
(7)RT-qPCR:采用Takara公司的One StepmiRNA cDNA Synthesis Kit逆转录试剂盒对上述总RNA进行反转录成cDNA,取5μl cDNA为模板,进行qPCR反应。
qPCR反应体系:
模板DNA:5ul
PCR反应液:12.5μl
上游引物(10μM):1μl
下游引物(10μM):1μl
无菌水:5.5μl
反应条件为:37℃→20分钟,95℃→10分钟;(95℃15秒,60℃1分钟)→40个循环。
内参基因miR-191-5p、U6的RT-qPCR扩增,除引物采用相对应的逆转录引物和检测引物外,方法同上。
(8)标准曲线制作:将从人结直肠癌SW480细胞中提取的RNA,逆转录成cDNA,然后10倍梯度稀释成5个浓度,作为标准品,同待测样本一同进行RT-qPCR扩增,制作标准曲线。
(9)结果判断:
1)拷贝数以10为底取对数作为横坐标,Cq值为纵坐标作图,绘制标准曲线,计算斜率Slope,然后根据公式E=10(-1/Slope)-1,计算扩增效率E;
2)选中样本和校对样本检测孔,应用实时荧光定量PCR仪的随机软件得出样本阈值Cq(T)和校对样本阈值Cq(C),根据公式Q=(E+1)-△Cq,△Cq=[Cq(T)-Cq(C)],得出基因的校正起始拷贝数Q;将miR-483-5p、miR-451a的Q值与内参基因miR-191-5p、U6的Q值的几何平均数相比,得到miR-483-5p、miR-451a的相对表达量。
(10)检测结果:
1)试剂盒敏感性评价
将从人结直肠癌SW480细胞中提取的RNA浓度调整为1000ng/μl,用去RNA酶无菌水进行10倍梯度稀释,得到100ng/μl(101倍稀释)、10ng/μl(102倍稀释)、1ng/μl(103倍稀释)、0.1ng/μl(104倍稀释)、0.01ng/μl(105倍稀释)不同浓度样品,分别检测内参基因miR-191-5p、U6和靶基因miR-483-5p、miR-451a。结果由图2可见,从1000ng/μl(0倍稀释)样品到0.1ng/μl(104倍稀释)样品,miR-191-5p、U6、miR-483-5p、miR-451a检测到的Cq值呈现良好的线性关系,相关系数R2均大于0.99;而0.01ng/μl(105倍稀释)样品未检测到相应的Cq值,表明本试剂盒敏感度最低可检测到浓度为0.1ng/μl的RNA样品。
2)试剂盒特异性评价
选择人结直肠癌SW480细胞、下调表达miR-483-5p的SW480细胞(miR-483下调细胞)以及下调表达miR-451a的SW480细胞(miR-451a下调细胞),提取的RNA,同时以水为模板替代RNA样品作为空白对照。采用本试剂盒对上述四种样品检测,结果发现下调表达miR-483-5p的SW480细胞以及下调表达miR-451a的SW480细胞检测到的miR-483-5p、miR-451a水平明显低于SW480细胞,同时空白对照未检测到miR-483-5p、miR-451a的表达,见图3表明本试剂盒具有很好的特异性。
3)试剂盒扩增效率
拷贝数以10为底取对数作为横坐标,miR-191-5p、U6、miR-483-5p、miR-451a的Cq值作为纵坐标,制作标准曲线见图2,计算miR-191-5p、U6、miR-483-5p、miR-451a得到扩增效率(E)分别为0.937、0.952、0.949、0.925,均大于0.9,表明本试剂盒扩增效率较好。
4)69例淋巴结转移结直肠癌患者和47例未发生淋巴结转移结直肠癌患者血清exosomal miR-483-5p、miR-451a检测结果见图4。淋巴结转移组血清exosomal miR-483-5p中位水平分别为0.851(0.551~1.120),明显高于未发生淋巴结转移组的0.339(0.134~0.521),差异具有统计学意义(P<0.001)。淋巴结转移组血清exosomal miR-451a中位水平分别为0.201(0.127~0.284),明显低于未发生淋巴结转移组的0.408(0.309~0.609),差异具有统计学意义(P<0.001)。
5)、血清exosomal miR-483-5p、miR-451a对结直肠癌淋巴结转移的鉴别诊断价值分析
以69例淋巴结转移结直肠癌患者作为阳性组,47例未发生淋巴结转移结直肠癌患者作为阴性组,MedCalc 9.3.9.0统计软件的受试者工作特征曲线(receiver operating characteristic curve,ROC)分析,血清exosomal miR-483-5p对结直肠癌淋巴结转移的鉴别诊断效能为0.821(95%CI 0.739~0.886,Z=8.414,P<0.001);血清exosomal miR-451a对结直肠癌淋巴结转移的鉴别诊断效能为0.803(95%CI 0.719~0.871,Z=6.953,P<0.001),见图5。
上述虽然结合附图对本发明的具体实施方式进行了描述,但并非对本发明保护范围的限制,所属领域技术人员应该明白,在本发明的技术方案的基础上,本领域技术人员不需要付出创造性劳动即可做出的各种修改或变形仍在本发明的保护范围以内。
- 还没有人留言评论。精彩留言会获得点赞!