一种结合荧光强度和荧光偏振检测DNA的纳米探针的制作方法
本发明属于核酸检测技术领域,具体涉及一种结合荧光强度和荧光偏振检测DNA的纳米探针。
背景技术:
基因是遗传变异的物质基础,支配着生命的基本构造和性能。现有的基因分析针对群体细胞,其结果只是细胞群体信号的平均值或其中占优势数量的细胞信息。但是细胞存在异质性,即使来源相同的单个细胞,由于随机的生物过程和环境扰动等原因,彼此也存在许多方面差异。与现有基因测序技术相比,单细胞测序技术不仅有助于认识细胞异质性,而且还能检测到微量的基因表达子或者罕见非编码RNA,也可用于寻找新的细胞类型、进行细胞亚型鉴定等。而在单细胞层面进行核酸的准确高通量检测是单细胞测序技术的基础工作。
2005年,美国约翰霍普金斯大学的Zhang等开发了一种基于量子点荧光染料和Cy5染料的夹心式发光探针,能够用来测定DNA的含量,遗憾的是,该检测需要复杂的细胞核提取等预处理过程,且对于荧光光子检测仪器的要求较高。(Zhang C.Y.,Yeh H.C.,Kuroki M.T.,et al.,Single-quantum-dot-based DNA nanosensor,Nature materials,2005,4(11):826-831.)2010年,韩国科学技术院的Taejoon等人利用目标DNA单链将纳米金颗粒和金纳米线连接起来,并观察到表面拉曼增强效应(SERS),实现了对多种病原体核酸的并行检测,但该方法的材料合成过程繁琐,对纳米线的操作困难,且拉曼光谱检测设备较为昂贵。(Kang T,Yoo S M,Yoon I,et al.Patterned multiplex pathogen DNA detection by Au particle-on-wire SERS sensor[J].Nano letters,2010,10(4):1189-1193.)2014年,德国的Michaelis等人利用核酸分子杂交前后荧光分子的连接位置的改变,实现荧光共振转移效率的变化,从而检测目标DNA的含量,然而该检测方法的灵敏度较低,检测限有待进一步提高。(Michaelis J,van der Heden van Noort G J,Seitz O.DNA-triggered dye transfer on a quantum dot[J].Bioconjugate chemistry,2013,25(1):18-23.)
核酸可以通过碱基配对特异性连接互补探针,进而可根据系统的质量改变、谐振频率偏移、表面拉曼增强等效应对目标核酸进行检测,但是其灵敏度较低,偶联物复杂,过程繁琐,难以取得实用。另外,现有的纳米探针,例如分子信标技术,用于DNA检测时存在假阳性干扰,稳定性不足,对细胞毒性较大,且灵敏度、速度、通量等方面有待进一步提高。(Yeh H.Y.,Yates M.V.,Mulchandani A.,et al.,Molecular beacon–quantum dot–Au nanoparticle hybrid nanoprobes for visualizing virus replication in living cells,Chemical Communications,2010,46(22):3914-3916.)
除了传统的荧光强度检测指标,荧光偏振是荧光分子本征性的检测参数,目前尚未有结合荧光强度和荧光偏振的检测方法的报道。
技术实现要素:
本发明的目的在于提供一种结合荧光强度和荧光偏振检测DNA的纳米探针,采取的技术方案如下:
一种结合荧光强度和荧光偏振检测DNA的纳米探针,所述的纳米探针包括荧光蛋白1、捕捉探针2、报告探针3和纳米金颗粒4;其中,荧光蛋白1作为供体与捕捉探针2相连,纳米金颗粒4作为受体与报告探针3相连;捕捉探针2与报告探针3通过部分碱基互补配对形成能量转移供受体对;所述的捕捉探针2与目标DNA完全互补配对。
所述的荧光蛋白1表面用链霉亲和素修饰。
所述的纳米金颗粒4的直径为2nm-15nm。
所述捕捉探针2的结构为biotin-5’-(A,T,C,G)m-3’;其中,biotin为用于偶联荧光蛋白1的生物素,5’-(A,T,C,G)m-3提供捕获目标DNA的配对区域,15≤m≤40,具体的碱基序列根据目标DNA的序列决定。
所述报告探针3的结构为5’-(A,T,C,G)n-3’-SH;其中,-SH为用于偶联纳米金颗粒4的巯基,5’-(A,T,C,G)n-3’提供与捕捉探针3配对的区域,m-15≤n≤m-3。
报告探针3中C、G碱基的数目较少,因此报告探针3与捕捉探针2形成的dsDNA具有较低的退火温度(35-40℃),在室温下(25℃)反应时竞争性偶联的效率较高。
报告探针3的碱基数目少于捕捉探针2,碱基数差基本上决定了供受体间距。碱基数差过大,供受体之间的能量转移效率将变低;而碱基数差过小,报告探针3与捕捉探针2形成的配对区域不容易与目标DNA接触,产生空间位阻效应,竞争性偶联效率较低。所述纳米探针的碱基数目适中,荧光蛋白1和纳米金颗粒4的间距合适,保证了较高的竞争性偶联效率和能量转移效率。
本发明的有益效果为:所述纳米探针结合了高灵敏度的荧光强度参数和荧光偏振参数,实现了非扩增式的DNA高灵敏度检测;同时利用共振荧光能量转移形成和消失过程中,荧光强度和荧光偏振相反的变化趋势,引入荧光强度/荧光偏振的比值,放大了DNA的检测信号。
附图说明
图1为所述纳米探针的结构示意图;其中,1-荧光蛋白、2-捕捉探针、3-报告探针和4-纳米金颗粒。
图2为所述纳米探针的能量转移示意图。
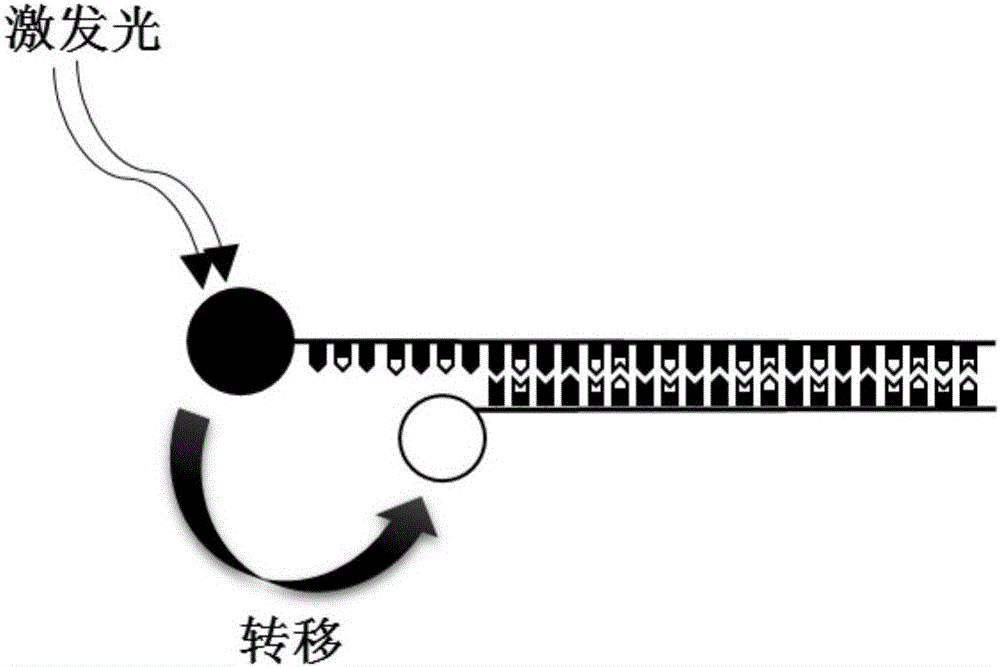
图3为目标DNA竞争性取代报告探针的示意图。
具体实施方式
本发明可用于DNA含量的高灵敏度检测。下面结合附图和实施例对本发明做进一步描述,但本发明的保护范围不限于此。
survivin具有肿瘤特异性,且与肿瘤细胞的分化增殖及浸润转移密切相关,survivin基因在常见的肿瘤细胞中均有表达。设计出本发明中的相应探针,即可对肿瘤细胞中的survivin基因进行检测。
实施例1
(1)原料的准备
在荧光蛋白Alexa Fluor 488(激发波长488nm,发射波长为519nm)外围修饰1个链霉亲和素;
纳米金颗粒的数量为链霉亲和素数量总结合位点个数的5-10倍;一个链霉亲和素的可用结合位点为3个,所以纳米金颗粒的数量为链霉亲和素的15-30倍,试验中取纳米金颗粒160pmol,纳米金颗粒直径为2nm。
设计合成报告探针和捕捉探针,合成的针对survivin基因的探针序列如表1所示。其中,报告探针中带下划线的部分代表报告探针末端的非配对碱基,在报告探针末端设置2-3个非配对碱基可以增强竞争性偶联的效率;待测基因序列中带下划线的部分为靶向序列区。
表1:针对survivin基因的探针序列
(2)纳米金颗粒-报告探针的合成
首先将纳米金颗粒和3’端修饰有巯基-SH的报告探针通过Au-S键偶联结合;为保证每个纳米金颗粒和报告探针都连接上,报告探针需过量,一般取报告探针的分子数为纳米金颗粒的2-10倍。
将300pmol的报告探针与150pmol纳米金颗粒混合,加入PBS缓冲液,最终反应体积为300ul;然后在4℃环境下反应24小时,无需搅拌;反应结束后,将反应液转移到容量为500ul、截留分子量为10K的超滤离心管中,调节离心机的转速为6000r/min,离心20min,重复两次,去除未与纳米金颗粒结合的报告探针,得到约20ul的“纳米金颗粒-报告探针”溶液;反应中采用的纳米金颗粒的分子量约为15K,报告探针的分子量约为7K,所以用截留分子量为10K的超滤离心管能将未参与反应的报告探针去除。
(3)纳米金颗粒-dsDNA的合成
将5’端修饰有biotin的捕捉探针与纳米金颗粒-报告探针以1:1.2的摩尔比混合,室温下反应8h,使捕捉探针与报告探针不完全配对结合成dsDNA,得到40ul“纳米金颗粒-dsDNA”溶液;其中,捕捉探针能与survivin基因的DNA完全互补配对。
(4)特异性检测survivin基因含量的纳米探针的合成
将50pmol修饰有链霉亲和素的荧光蛋白溶液(1ul)加入到纳米金颗粒-dsDNA溶液中,然后加入PBS缓冲液,形成100ul最终反应液,室温反应45分钟,让纳米金颗粒-dsDNA一端的biotin与荧光蛋白外围的链霉亲和素充分反应,形成能特异性检测survivin基因含量的纳米探针,其结构如图1所示。
(5)细胞中survivin基因含量的检测
当纳米探针没有接触到目标DNA,用光源激发荧光蛋白1时,荧光蛋白1吸收的光能不以光子的形式发射出去,不具有发光特性,如图2所示;同时荧光蛋白1偶联纳米金颗粒后质量增大,荧光偏振增大;另外荧光淬灭相当于荧光蛋白1的有效浓度降低,同样使得荧光偏振增大。用多功能酶标仪检测纳米探针的荧光强度和荧光偏振,然后与相同浓度的纯荧光蛋白对比,由于形成表面能量转移后,纳米探针的荧光强度降低80%以上,荧光偏振可增加2-4倍,此时荧光强度/荧光偏振的比值极低,如图3所示。
当纳米探针与目标DNA接触后,目标DNA与捕捉探针2的亲和性更强,通过竞争性关系取代报告探针3偶联于捕捉探针2,使荧光蛋白1和纳米金颗粒4之间的距离增大,超出产生能量转移的有效距离,此时用光源激发荧光蛋白1,荧光蛋白1恢复发光的特性;同时目标DNA的分子量比纳米金颗粒略小,使得荧光蛋白1的分子质量降低,荧光偏振减小;另外荧光蛋白1恢复发光特性,相当于荧光蛋白1的有效浓度增大,同样使得荧光偏振减小,此时荧光强度/荧光偏振的比值大幅增加,如图3所示。
在384孔板中每孔加入所述纳米探针1pmol,然后在每孔中分别加入不同含量的survivin基因序列,室温下反应2h。在有温控设备的情况下,提高反应温度至30-35℃,可将竞争性偶联反应时间缩短至0.5h以内。
竞争性偶联反应完毕后,使用多功能酶标仪检测纳米探针的荧光信号变化,记录荧光强度和荧光偏振参数,根据荧光强度/荧光偏振的比值变化反映出survivin含量的变化,荧光强度/荧光偏振的比值越大说明survivin的含量越多。
- 还没有人留言评论。精彩留言会获得点赞!