检测NOP10基因第2号外显子突变位点R34W(C100T)序列突变的方法和引物与流程
本发明属生命科学和生物技术领域,特别涉及检测NOP10基因第2号外显子突变位点R34W(C100T)序列的引物、方法和试剂盒。
背景技术:
先天性角化不良症(dskeratosis eongenita,DC)是一种具有遗传异质性的骨髓衰竭综合征,发病率约为1/100万。典型的DC患者约80%~90%具有皮肤黏膜异常三联征,表现为皮肤网状色素沉着、指(趾)甲萎缩、口腔黏膜白斑。目前文献报道可引起DC的突变基因主要有CTC1,DKC1,TERC,TERT,TINF2,NHP2,NOP10及WRAP53。文献报道,这些基因有3种遗传方式,分别为X-连锁隐性遗传、常染色体隐性遗传、常染色体显性遗传。但目前仍约50%患者遗传特征不明确。X-连锁隐性遗传包括DKC1,常染色体显性遗传包括TERC及TINF2,常染色体隐性遗传包括CTC1,WRAP53,NHP2,NOP10,既可以作为常染色体显性遗传又可以作为隐性遗传的有TERT。NOP10位于15q14-q15位点负责编码端粒酶相关蛋白复合体组分蛋白的基因。NOP10蛋白是端粒酶相关蛋白复合体的核心蛋白之一,与dyskerin、NHP2、GAR1蛋白共同参与了真核生物核糖体的合成,前体mRNA剪接和端粒的维持。Walne等在先天性角化不良症患者中发现NOP10存在突变,该突变缩短了端粒酶的长度,并降低了TERC的表达量水平。
近年来,通过全基因组测序,发现NOP10基因突变在先天性角化不良症患者中非常常见。文献报道NOP10基因突变存在p.R34W(C100T)突变热点,该突变位点位于NOP10基因的第2外显子,并且能引起该基因第34密码子精氨酸到色氨酸的改变。该位点的变异能引起端粒酶RNA水平减低及端粒长度明显缩短,并降低了TERC的表达量水平。目前国内文献报道的DC病例绝大多数为30岁左右皮肤受累的临床病例,病例数较少,且较少进行基因检测。因此有必要进行相关基因的突变检测,有必要先对患者进行R34W突变进行筛选,有助于对先天性角化不良症的早期诊断,减少误诊、漏诊,并进行治疗。
本发明采用Touch-down PCR扩增和Sanger测序法检测NOP10基因第2号外显子突变位点R34W(C100T)序列的突变,并且设计的引物可以扩展整个第2号外显子全外显子序列,包括待检测的所有突变位点。Touch-down PCR扩增可确保正、反向扩增引物与样本DNA模板的结合发生在最互补的序列之间,当退火温度降低到非特异性扩增发生的水平时,特异性扩增产物在此时已经有一个几何数的起始优势,丰度较高,在剩余的扩增反应中,特异性扩增产物与非特异扩增产物产生竞争,但是因非特异性扩增产物丰度较低,特异性扩增产物始终优先扩增,从而产生单一的占主导地位的特异性扩增产物。而Sanger测序法是检测基因突变的金标准,检测结果准确性高,并且很大程度上地节省了检测成本。
技术实现要素:
本发明的目的在于提供检测NOP10基因第2号外显子突变位点R34W(C100T)序列的引物,其特征在于,包括:扩增NOP10基因第2号外显子突变位点R34W(C100T)序列的正、反向引物;其碱基序列为:
NOP10-F:TGTAAAACGACGGCCAGTTTGACCATTGCATCTTCTATTTTC
NOP10-R:AACAGCTATGACCATGTCCCTTTATGGGTGATGCCAC。
进一步地,所述引物还包括一对测序引物,其碱基序列为
M13-F:TGTAAAACGACGGCCAGT
M13-R:AACAGCTATGACCATG。
进一步地,所述正、反向引物的使用浓度比为:NOP10-F:NOP10-R=1:1。
进一步地,所述一对测序引物的使用浓度比为:M13-F:M13-R=1:1。
进一步地,所述正、反向扩增引物的扩增反应条件为:第一阶段,95℃预变性10min;第二阶段,变性温度94℃30sec,退火温度64℃90sec,延伸温度72℃30sec,循环16次,每循环一次,所述退火温度降低0.5℃;第三阶段,变性温度94℃30sec,退火温度58℃30sec,延伸温度72℃30sec,循环24次;第四阶段,72℃10min;第五阶段,扩增反应结束,扩增产物在4℃下保存。
本发明的目的还在于提供一种检测NOP10基因第2号外显子突变位点R34W(C100T)序列的方法,其包括如下步骤:
(1)提取样本DNA;
(2)利用一对扩增引物NOP10-F和NOP10-R对(1)中的DNA进行扩增,获得扩增产物;
(3)利用一对测序引物M13-F和M13-R对(2)中的扩增产物进行测序,获得所述扩增产物的基因序列;
(4)将(3)中的基因序列与NOP10基因野生型参考序列NOP10-ref进行比较,确定突变位点是否存在,其特征在于,
NOP10-F:TGTAAAACGACGGCCAGTTTGACCATTGCATCTTCTATTTTC
NOP10-R:AACAGCTATGACCATGTCCCTTTATGGGTGATGCCAC
M13-F:TGTAAAACGACGGCCAGT
M13-R:AACAGCTATGACCATG。
进一步地,步骤(2)中的扩增反应条件为:第一阶段,95℃预变性10min;第二阶段,变性温度94℃30sec,退火温度64℃90sec,延伸温度72℃30sec,循环16次,每循环一次,所述退火温度降低0.5℃;第三阶段,变性温度94℃30sec,退火温度58℃30sec,延伸温度72℃30sec,循环24次;第四阶段,72℃10min;第五阶段,扩增反应结束,扩增产物在4℃下保存。
本发明的目的还在于提供一种检测NOP10基因第2号外显子突变位点
R34W(C100T)序列的试剂盒,其特征在于,所述试剂盒包括样本DNA抽提试剂;无水乙醇;检测体系PCR反应液、测序体系反应液、阳性对照品、阴性对照品和空白对照品,其中检测体系PCR反应液包括一对扩增产物NOP10-F和NOP10-R,测序体系反应液包括一对测序引物NOP10-F和NOP10-R,其特征在于:
NOP10-F:TGTAAAACGACGGCCAGTTTGACCATTGCATCTTCTATTTTC
NOP10-R:AACAGCTATGACCATGTCCCTTTATGGGTGATGCCAC
M13-F:TGTAAAACGACGGCCAGT
M13-R:AACAGCTATGACCATG。
进一步地,所述试剂盒包括NOP10基因野生型参考序列NOP10-ref。
进一步地,所述测序纯化液包括由虾碱性磷酸酶和核酸外切酶I组成的测序纯化液。
本发明的有益效果:本发明设计了扩增NOP10基因第2号外显子突变位点R34W(C100T)序列的正,反向引物,构建了稳定的Touch-down PCR扩增体系,对整个第2号外显子全外显子序列进行扩增,包含待检测的所有突变位点,同时在扩增时,富集正、反向引物与模板正确配对的特异性扩增产物,提高扩增特异性。此外,通过调整正、反向扩增引物的浓度、退火温度等反应条件,可使扩增效率达到最佳,并采用Sanger测序法,对PCR扩增产物进行测序反应扩增、纯化后变性、直接测序检测NOP10基因第2号外显子突变位点R34W(C100T)序列中各突变位点的突变情况,具有灵敏度高、操作简单和成本低等优点。
附图说明
图1 NOP10基因PCR扩增电泳结果图。M为TAKARA DL2000。
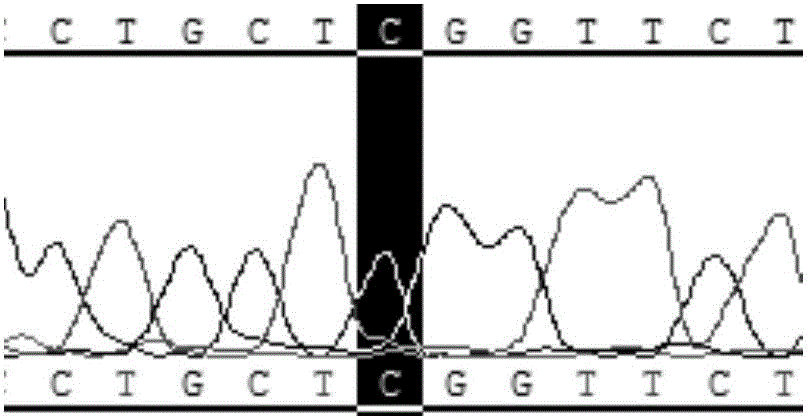
图2样本1NOP10基因R34W检测结果图。
图3样本2NOP10基因R34W检测结果图。
图4样本3NOP10基因R34W检测结果图。
图5样本4NOP10基因R34W检测结果图。
具体实施方式
下面结合具体实施例和附图,进一步阐述本发明。应当注意的是,实施例中未说明的常规条件和方法,通常按照所属领域实验人员常规采用方法:譬如,奥斯柏和金斯顿主编的《精编分子生物学实验指南》第四版,或者按照制造厂商所建议的步骤和条件。
实施例1
检测NOP10基因第2号外显子全外显子序列的引物,包括:扩增NOP10基因第2号外显子全外显子序列的正、反向引物;其碱基序列为:
NOP10-F:TGTAAAACGACGGCCAGTTTGACCATTGCATCTTCTATTTTC
NOP10-R:AACAGCTATGACCATGTCCCTTTATGGGTGATGCCAC。
优选地,所述引物还包括一对测序引物,其碱基序列为
M13-F:TGTAAAACGACGGCCAGT
M13-R:AACAGCTATGACCATG。
在检测中,先利用上述正、反向引物对NOP10基因第2号外显子全外显子序列进行扩增,获得扩增产物,然后利用上述一对测序引物对扩增产物进行测序,获得扩增产物的基因序列。
检测NOP10基因第2号外显子全外显子序列的试剂盒,包括:样本DNA抽提试剂(例如使用天根生物的试剂盒来抽提样本DNA);无水乙醇;检测体系PCR反应液、测序体系反应液、阳性对照品、阴性对照品和空白对照品,其中
检测体系PCR反应液包括:2×PCR Buffer;2mM dNTPs;KOD FX DNA Polymerase(1U/μl);扩增NOP10基因第2号外显子全外显子序列的正、反向引物NOP10-F(10μm)、NOP10-R(10μm)。
测序体系反应液包括:测序纯化液、EDTA(125mmol)、无水乙醇、75%乙醇、HIDI(高度去离子甲酰胺)、测序引物:NOP10-F(3.2μm)、NOP10-R(3.2μm),以及Bigdye Terminator V3.1(购买自美国Applied Biosystems公司),其中测序纯化液包括虾碱性磷酸酶(SAP)0.6U和核酸外切酶I(EXONI)1.2U。
检测体系PCR反应液试剂配制如下:
其中,NOP10-F和NOP10-R的碱基序列为:
阳性对照品:含有NOP10序列的溶液。
阴性对照品:无NOP10序列的溶液。
空白对照品:2μl生理盐水或不加任何物质。
优选地,该试剂盒还包括NOP10基因野生型参考序列NOP10-ref,其碱基序列如下所示:
TTGACCATTGCATCTTCTATTTTCATGTTTGCCCTTTTTCGCGCTGGCCCCACCCCATTTCATCACTCCTGTACTGACATACATTCTGTGTTCCTGGAGCAGAAATTTGACCCGATGGGACAACAGACCTGCTCAGCCCATCCTGCTCGGTTCTCCCCAGATGACAAATACTCTCGACACCGAATCACCATCAAGAAACGCTTCAAGGTGCTCATGACCCAGCAACCGCGCCCTGTCCTCTGAGGGTCCCTTAAACTGATGTCTTTTCTGCCACCTGTTACCCCTCGGAGACTCCGTAACCAAACTCTTCGGACTGTGAGCCCTGATGCCTTTTTGCCAGCCATACTCTTTGGCATCCAGTCTCTCGTGGCGATTGATTATGCTTGTGTGAGGCAATCATGGTGGCATCACCCATAAAGGGA。
实施例2
检测流程:
(1)利用血液DNA抽提试剂盒(天根生物)提取血液样本中的基因组DNA:
1)抽取500uL血液加入1000uL红细胞裂解液,颠倒混匀,室温放置5分钟,期间再颠倒混匀几次。3000rpm离心5min,吸去上清,留下白细胞沉淀,加200uL缓冲液GA,振荡至彻底混匀。
2)加入20μl蛋白酶K溶液,混匀。
3)加入200μl缓冲液GB,充分颠倒混匀,70℃放置10分钟,溶液应变清亮,简短离心以去除管盖内壁的水珠。
4)加入200μl无水乙醇,充分振荡混匀15秒,此时可能会出现絮状沉淀,简短离心以去除管盖内壁的水珠。
5)将上一步所得溶液和絮状沉淀都加入一个吸附柱CB3中(吸附柱放入收集管中),12,000rpm(13,400×g)离心30秒,倒掉废液,将吸附柱CB3放回收集管中。
6)向吸附柱CB3中加入500μl缓冲液GD(使用前请先检查是否已加入无水乙醇),12,000rpm(13,400×g)离心30秒,倒掉废液,将吸附柱CB3放入收集管中。
7)向吸附柱CB3中加入700μl漂洗液PW(使用前请先检查是否已加入无水乙醇),12,000rpm(13,400×g)离心30秒,倒掉废液,将吸附柱CB3放入收集管中。
8)向吸附柱CB3中加入500μl漂洗液PW,12,000rpm(13,400×g)离心30秒,倒掉废液。
9)将吸附柱CB3放回收集管中,12,000rpm(13,400×g)离心2分钟,倒掉废液。将吸附柱CB3置于室温放置数分钟,以彻底晾干吸附材料中残余的漂洗液。
10)将吸附柱CB3转入一个干净的离心管中,向吸附膜的中间部位悬空滴加100μl洗脱缓冲液TE,室温放置2-5分钟,12,000rpm(13,400×g)离心2分钟,将溶液收集到离心管中,获得血液基因组DNA溶液。
(2)试剂配置:按检测人份数配置检测体系PCR反应液各Xμl,每人份18μl分装:X=18μl反应液×(n份样本+1份阳性对照+1份阴性对照+1份空白对照)n为检测样本数。
(3)加样:将2ul步骤(1)中获得的血液基因组DNA溶液加入到检测体系PCR反应液中;对阳性对照实验而言,直接加2ul阳性对照品;对阴性对照实验而言,直接加2ul阴性对照品;对空白对照实验而言,加2ul生理盐水或不加任何物质。
(4)Touch-down PCR扩增:检测在常规PCR仪上进行,获得PCR扩增产物,可用仪器包括ABI veriti(美国Applied Biosystems公司)等。反应条件如下:
(5)Sanger测序:
取9μl PCR扩增产物与2μl测序纯化液。按照以下程序进行纯化,从而获得纯化产物:
将1μl纯化产物分别与测序引物M13-F(3.2μm)和M13-R(3.2μm)按照如下体系进行混合:
测序反应程序:
沉淀环节:
向完成测序反应的产物中加入2μl 125mmol的EDTA,静置5min;加入15ml无水乙醇,漩涡混匀;3700rpm离心30min;倒置离心15sec,加入50ml 70%乙醇,漩涡混匀;3700rpm离心15min;倒置离心15sec,置于95℃金属浴上;加入10μl HIDI后进行变性试验。变性程序:
变性程序结束后,上测序仪(ABI3730)测序,获得PCR扩增产物的基因序列。
(6)结果判断:将(5)中获得的基因序列与NOP10基因野生型参考序列NOP10-ref进行比对,根据实际突变情况对结果进行报告。
实施例3
采用本发明核酸检测试剂盒检测临床样本。
取送检先天性角化不良患者抗凝血样本20例,按实施例2所述检测流程提取样本中的基因组DNA,配制试剂并检测。
将2ul按照实施例2中所述检测流程提取出的每份样本基因组DNA溶液加入检测体系PCR反应液中。同时做阳性、阴性和空白对照。用普通PCR仪检测,时间为160分钟。
电泳结果如图1所示,表明本发明所述引物NOP10-F、NOP10-R对血液样本能有效扩增,且条带单一。
样品1的NOP10基因R34W正向测序结果如图2所示,为野生型,未检测出R34W突变。
样品2的NOP10基因R34W正向测序结果如图3所示,为野生型,未检测出R34W突变。
样品3的NOP10基因R34W正向测序结果如图4所示,为野生型,未检测出R34W突变。
样品4的NOP10基因R34W正向测序结果如图5所示,为野生型,未检测出R34W突变。
检测结果如表1:
表1
从检测结果可以看出,本发明所述引物已经把NOP10基因第2号外显子全外显子序列序列包括在内了,并且测序结果完全准确。对阳性标本的检测表明本发明所述引物和方法及试剂盒能够检测出NOP10基因突变。
- 还没有人留言评论。精彩留言会获得点赞!