高纯度荨麻新苷及荨麻木脂素的制备方法与流程
本发明涉及的是一种生物医药领域的技术,具体是一种纯度达到95%以上的荨麻新苷Ⅰ、荨麻新苷Ⅱ,以及纯度达60%以上的荨麻木脂素的制备方法。
背景技术:
荨麻Urtica fissa E.Pritz.始载于《图经本草》,药用历史悠久。其根及根茎入药称荨麻根,为一常用民族药,具有祛风、活血、止痛之功效,主治风湿疼痛、荨麻疹、湿疹等症,在汉、藏、彝、苗、羌、土家、布依、维吾尔、瑶、傈僳、纳西族等多个民族中广泛应用。近年来,发现荨麻具有明显的抑制前列腺增生、抗类风湿作用,但其活性成分尚不清楚。
目前国内学者从荨麻根中分离鉴定了多个木脂素、三萜、甾体、多糖等成分。
然而,荨麻根化学成分复杂,除含有木脂素类成分外,还含有大量黄酮、核苷、脂肪酸、生物碱类成分。荨麻新苷Ⅰ、荨麻新苷Ⅱ、荨麻木脂素在荨麻根中含量低,加上大量杂质干扰,因此分离难度大,目前尚未见有制备荨麻新苷Ⅰ、荨麻新苷Ⅱ、荨麻木脂素的方法。
技术实现要素:
本发明针对现有技术存在的上述不足,提出一种高纯度荨麻新苷及荨麻木脂素的制备方法,制备得到的荨麻新苷能够用于荨麻药材的准确快速鉴定、质量评价;荨麻木脂素用于类风湿药物的制备。该方法具有简便、快速、纯度高、生产成本低等优点。
本发明是通过以下技术方案实现的:
本发明涉及一类单萜类化合物,具体为荨麻新苷Ⅰ(Urticaside Ⅰ)和荨麻新苷Ⅱ(Urticaside Ⅱ),均具有显著的抑制5‐α还原酶作用,是荨麻根抑制前列腺增生的活性成分;结构新颖,也是荨麻的特征性成分,其结构式如下所示:
本发明还涉及一种荨麻木脂素,具有显著的抗类风湿作用,是荨麻抗类风湿的有效药物。其主要成分及含量为:荨麻醇8%、荨麻内酯A 12%、荨麻内酯B 24%、荨麻醇‐7‐O‐β‐D‐葡萄糖苷10%、开环异落叶松脂素5%、臭矢菜素A 4%,主要成分的结构式如下所示:
所述的单萜类化合物、荨麻木脂素通过从荨麻(Urtica fissa E.Pritz.)中提取得到。
本发明涉及上述单萜类化合物的应用,将其用于荨麻药材的真伪鉴定及优劣评价,以及制备抑制前列腺增生的药物,具体为抑制5‐α还原酶。所涉及荨麻木脂素的应用,将其用于制备类风湿关节炎药物。
本发明涉及上述单萜类化合物的提取方法,通过将荨麻(Urtica fissa E.Pritz.)乙醇提取、脱色脱脂、萃取木脂素后,得到含荨麻新苷的水溶液依次经大孔树脂柱层析以及硅胶柱层析,得到荨麻新苷粗品,最后经HPLC制备分离并分别收集两个主峰,分别得到荨麻新苷Ⅰ(Urticaside Ⅰ)和荨麻新苷Ⅱ(Urticaside Ⅱ)。
所述的荨麻,具体采用荨麻干燥根及根茎,经干燥后粉碎。
所述的萃取木脂素,优选对荨麻根先进行乙醇回流提取,得到醇浸膏。醇浸膏先经石油醚脱色脱脂后,采用但不限于乙酸乙酯进行萃取。
所述的制备单萜类成分过程中涉及的大孔树脂层析以及硅胶柱层析,均通过TLC检测并合并主斑点相同(Rf0.4‐0.5)的流份。
所述方法具体包括:
步骤1)荨麻根粉碎,乙醇回流提取,回收乙醇(可再次使用)得醇浸膏。醇浸膏悬浮于水,石油醚脱脂、脱色素后,采用乙酸乙酯萃取,回收乙酸乙酯(可再次用于萃取)得乙酸乙酯浸膏;水层水浴上浓缩至无酸乙酯味,得含荨麻新苷的水溶液。
所述的荨麻为荨麻科荨麻属植物荨麻Urtica fissa E.Pritz.的干燥根及根茎。
所述的乙醇提取,乙醇浓度为70~95%,乙醇和荨麻干粉的料液比为1∶10~1∶14(g/ml),时间为1~3h,提取次数为2~3次。
所述的石油醚、乙酸乙酯萃取,石油醚‐水、乙酸乙酯‐水的比例均为1:1(v/v),萃取次数为2~3次。
步骤2)含荨麻新苷的水溶液经D101大孔树脂柱层析,经乙醇洗脱后进行TLC检测,合并主斑点相同(Rf0.4‐0.5)的流份,回收乙醇(可再次使用)得荨麻苷提取物。
所述的大孔树脂柱层析树脂用量为药材重量的2~3倍,每个梯度洗脱3~5个柱体积(BV),流速为0.6BV/h,0.3BV/流份。
所述的乙醇洗脱,具体为:先以30%乙醇洗脱,然后用55%、80%的乙醇洗脱,最后收集55%、80%乙醇洗脱液。
所述的TLC法检测为:将样品溶于甲醇,硅胶板上点样,以二氯甲烷‐甲醇3:1(v/v)为展开剂,展开后吹干展开剂,以10%硫酸乙醇溶液为显色剂,加热显色进行检测。
步骤3)荨麻苷提取物进行硅胶柱层析,二氯甲烷‐甲醇梯度洗脱,收集洗脱液后进行TLC检测,合并主斑点相同(Rf0.4‐0.5)的流份,减压回收溶剂,得荨麻新苷粗品。
所述的硅胶柱层析粒径为200~300目,样量比为1∶40~1∶60(样品比硅胶,w/w)。所述的梯度洗脱为二氯甲烷‐甲醇比例为90:10、85:15、80:20、75:25(v/v),每个梯度洗脱4~6个BV,流速0.6BV/h,0.3BV/流份。
步骤4)将荨麻新苷粗品进行HPLC制备分离,分别收集两个主峰并回收溶剂,即得荨麻新苷Ⅰ、荨麻新苷Ⅱ精制品。
所述的HPLC制备分离,检测波长为210nm,流动相甲醇‐水(1:1),所用色谱柱为C18柱。
本发明涉及一种基于上述方法的荨麻木脂素提取方法,通过将步骤1)中的浸膏进行甲醇处理,离心,弃去不溶物;甲醇溶液回收溶剂后进行硅胶柱层析,先以二氯甲烷洗脱,回收二氯甲烷,弃去提取物;然后用二氯甲烷‐甲醇4:1洗脱,收集洗脱液,回收溶剂,减压干燥得荨麻木脂素。
所述的硅胶柱层析粒径为200~300目,样量比为1∶20~1∶30(样品比硅胶,w/w)。每个梯度洗脱3~5个BV,流速0.6BV/h。
本发明涉及上述方法提取得到的荨麻木脂素的应用,可将其用于类风湿关节炎药物的制备。
技术效果
与现有技术相比,本发明可以同时制备两种新化合物荨麻新苷Ⅰ、Ⅱ两种精制品以及荨麻木脂素,所得产品纯度高。采用乙醇提取药材,既提高了目标产物的收率,同时又去除了荨麻中水溶性大分子成分(如多糖、蛋白质)的干扰,简化了制备工艺。采用石油醚萃取,去除了大部分色素及脂肪酸的干扰。采用乙酸乙酯萃取,既排除了水溶性成分的干扰,富集了木脂素类成分;同时,也避免了萃取过程中荨麻新苷类成分的损失,提高了荨麻新苷的收率。
本发明根据荨麻木脂素的理化特性,乙酸乙酯浸膏先甲醇处理,去除了浸膏中大量胡萝卜苷以及脂肪酸的干扰;硅胶柱层时,先用二氯甲烷洗脱,进一步去除了脂肪酸、甾醇及脂溶性色素,能简便快速制备荨麻木脂素。所得荨麻木脂素经UV法检测(对荨麻内酯A为对照品,测定波长282nm),纯度超过65%。采用HPLC进行测定,6种主要木脂素的质量百分含量约为:荨麻醇8%:荨麻内酯A 12%:荨麻内酯B 24%:荨麻醇‐7‐O‐β‐D‐葡萄糖苷10%:开环异落叶松脂素5%:臭矢菜素A 4%,总含量超过60%。
整个制备过程使用的有机溶剂,以及分离中用到的填料均可反复使用;另一方面,同时制备荨麻新苷及荨麻木脂素类成分,充分利用了药材及化学试剂,大幅降低了生产成本。
附图说明
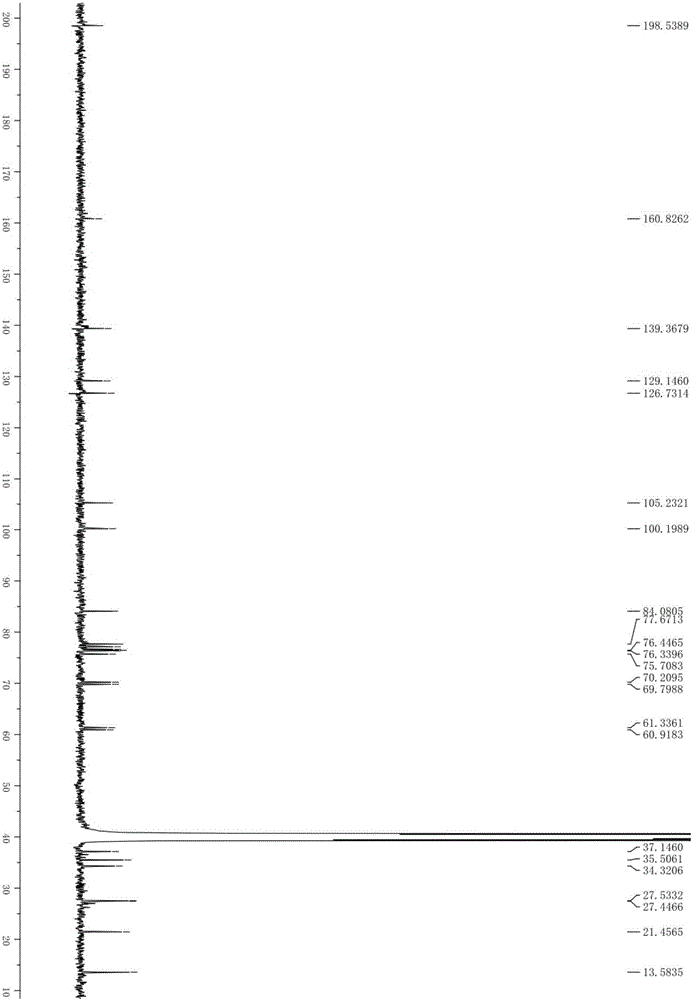
图1为荨麻新苷Ⅰ的13C‐NMR图(DMSO‐d6,150MHz);
图2为荨麻新苷Ⅱ的13C‐NMR图(DMSO‐d6,150MHz);
图3为荨麻木脂素HPLC图;
图中:1为荨麻醇‐7‐O‐β‐D‐葡萄糖苷、2为荨麻内酯B、3为荨麻内酯A、4为荨麻醇、5为臭矢菜素A、6为开环异落叶松脂素。
具体实施方式
实施例1
本实施例是在以下实施条件和技术要求条件检测下实施的:
1.荨麻根200g,加入2000mL 70%乙醇回流2次,每次1h,提取液离心,回收乙醇得醇浸膏(23.3g)。醇浸膏悬浮于250mL水中,加入250mL石油醚萃取2次,然后用乙酸乙酯萃取2次(每次250mL),回收乙酸乙酯,得乙酸乙酯浸膏(9.0g);下层水溶液水浴上挥至无乙酸乙酯味,得水溶液。
2.水溶液上D101大孔树脂柱(400g树脂),先以30%乙醇洗脱3个柱体积,然后55%、80%的乙醇洗脱3个柱体积(流速均为0.6BV/h)。收集55%、80%乙醇洗脱液(0.3BV/流份),TLC检测,合并主斑点相同(Rf0.4‐0.5)的流份,回收乙醇得荨麻苷提取物(2.5g)。
3.取上述荨麻苷提取物进行第一次硅胶柱层析(100g硅胶),用二氯甲烷‐甲醇梯度洗脱(每个梯度洗脱6个BV),收集洗脱液。TLC法检测,合并主斑点Rf值0.4‐0.5的流份,回收溶剂得荨麻新苷粗品(146mg)。
4.将荨麻新苷粗品进行HPLC分离,分别收集两个主要色谱峰,即得荨麻新苷I精制品26mg(纯度95.7%,HPLC法)、荨麻新苷Ⅱ精制品17mg(纯度95.4%,HPLC法)。
5.所得乙酸乙酯浸膏用50mL甲醇超声处理,离心,弃去不溶物。甲醇溶液回收溶剂后进行第二次硅胶柱层析(180g硅胶),先以二氯甲烷洗脱3个BV,回收二氯甲烷,弃去提取物;然后用二氯甲烷‐甲醇4:1洗脱3个BV,收集洗脱液,回收溶剂,减压干燥得荨麻木脂素4.7g。
经UV检测,木脂素含量达68.4%;如图3所示,经HPLC分析,6种主要木脂素总含量为62.4%,HPLC检测波长:282nm;流动相:0→18min,10%乙腈→100%乙腈;流速:1.0mL/min;柱温:30℃。
如图1所示,为荨麻新苷Ⅰ的13C‐NMR图。
如图2所示,为荨麻新苷Ⅱ的13C‐NMR图。
实施例2
本实施例是在以下实施条件和技术要求条件下实施的:
1.荨麻根200g,加入2.4L乙醇回流3次,每次2h,提取液离心,回收乙醇得醇浸膏(29.8g)。醇浸膏悬浮于300mL水中,加入300mL石油醚萃取2次,然后用乙酸乙酯萃取2次(每次300mL),减压回收乙酸乙酯,得乙酸乙酯浸膏(11.4g)。水层置水浴锅上挥尽乙酸乙酯,得水溶液。
2.水溶液上D101大孔树脂柱(500g树脂,流速为0.6BV/h),先以30%乙醇洗脱4个柱体积,然后55%、80%的乙醇洗脱4个柱体积。收集55%、80%乙醇洗脱液(0.3BV/流份),TLC检测,合并主斑点相同(Rf0.4‐0.5)的流份,回收乙醇(可再次使用)得荨麻苷提取物(3.3g)。
3.取上述荨麻苷提取物进行第一次硅胶柱层析(165g硅胶),用二氯甲烷‐甲醇梯度洗脱(每个梯度洗脱5个BV),收集洗脱液。TLC法检测,合并主斑点Rf值0.4‐0.5的流份,回收溶剂即得荨麻新苷粗品(184mg)。
4.将荨麻新苷粗品进行HPLC分离,分别收集两个主要色谱峰,即得荨麻新苷I精制品31mg(纯度95.3%,HPLC法)、荨麻新苷Ⅱ精制品23mg(纯度96.4%,HPLC法)。
5.所得乙酸乙酯浸膏用60mL甲醇超声处理,离心,弃去不溶物。甲醇溶液回收溶剂后进行第二次硅胶柱层析(280g硅胶),先以二氯甲烷洗脱4个BV,回收二氯甲烷,弃去提取物;然后用二氯甲烷‐甲醇4:1洗脱4个BV,收集洗脱液,回收溶剂,减压干燥得荨麻木脂素5.9g(经UV检测,木脂素含量达70.7%;经HPLC分析,6种主要木脂素总含量为63.0%)。
实施例3
本实施例是在以下实施条件和技术要求条件下实施的:
1.荨麻根200g,加入2.8L乙醇回流3次,每次3h,提取液离心,回收乙醇得醇浸膏(32.4g)。醇浸膏悬浮于300mL水中,加入300mL石油醚萃取3次,然后用乙酸乙酯萃取3次(每次300mL),减压回收乙酸乙酯得乙酸乙酯浸膏(12.5g)。水层水浴锅上挥尽乙酸乙酯,得水溶液。
2.水溶液上D101大孔树脂柱(600g树脂,流速为0.6BV/h),先以30%乙醇洗脱5个柱体积,然后55%、80%的乙醇洗脱5个柱体积。收集55%、80%乙醇洗脱液(0.3BV/流份),TLC检测,合并主斑点相同(Rf0.4‐0.5)的流份,回收乙醇得荨麻苷提取物(3.5g)。
3.取上述荨麻苷提取物进行硅胶柱层析(210g硅胶),用二氯甲烷‐甲醇梯度洗脱(每个梯度洗脱4个BV),收集洗脱液。TLC法检测,合并主斑点Rf值0.4‐0.5的流份,回收溶剂即得荨麻新苷粗品(201mg)。
4.将荨麻粗品进行HPLC分离,分别收集两个主要色谱峰,即得荨麻新苷I精制品33mg(纯度95.2%,HPLC法)、荨麻新苷Ⅱ精制品21mg(纯度96.0%,HPLC法)。
5.所得乙酸乙酯浸膏用60mL甲醇超声处理,离心,弃去不溶物。甲醇溶液回收甲醇后经硅胶柱层析(375g硅胶),先以二氯甲烷洗脱5个BV,回收二氯甲烷,弃去提取物;然后用二氯甲烷‐甲醇4:1洗脱5个BV,收集洗脱液,回收溶剂,减压干燥得荨麻木脂素6.1g(经UV检测,木脂素含量达71.2%;经HPLC分析,6种主要木脂素总含量为63.4%)。
通过上述实施例制备得到的荨麻新苷具有显著的抑制5‐α还原酶作用,其活性优于非那雄胺。实验方法:将5α‐还原酶液、睾酮溶液、辅酶(NADPH‐Na4)、样品(荨麻新苷及非那雄胺)以及Tris缓冲液加入反应体系,组成2ml酶促反应体系,反应液于37℃水浴反应60min。0min及60min反应液中各加入甲醇1.0ml并振荡混匀以终止反应,10000rpm 4℃离心20min,上清液经0.22μm微孔滤膜滤过,取20μL注入HPLC液相色谱仪分析(保护柱:Alltech Brava BDS‐C18guard column,5μm,7.5×4.6mm;分析柱:Agilent Zorbax Elipse XDB‐C18Column,5μm,4.6×250mm;流动相:甲醇:水=7:3;流速:0.7ml/min;柱温:35℃;检测器:UV;检测波长:242nm)。比较0min和60min反应液中睾酮峰面积变化,计算酶促反应体系中荨麻新苷、非那雄胺对5α‐还原酶活性抑制的程度。实验结果见表1。
表1荨麻新苷对5‐α还原酶的抑制作用(n=3)
通过上述方法所得荨麻木脂素具有显著抗类风湿关节炎(AA)作用。实验方法:SD大鼠40只,随机分为4组,每组10只。测定大鼠造模前的后足足跖厚度后,将每鼠右后足跖皮内注射Freund’s完全佐剂0.05ml塑造AA模型。致炎后第18天开始给药,连续给药7天,隔日测定后足足跖厚度。末次测量完毕后测量关节炎指数(AI)(根据未注射的3只肢体的病变程度累计积分,计算AI:无红肿,0分;小趾关节红肿,1分;趾关节和足趾肿胀,2分;踝关节以下的足爪肿胀,3分;包括踝关节在内的全部足爪肿胀,4分。把各个关节的积分累计起来,即为每只大鼠的AI)。实验结果:荨麻木脂素高、低剂量组均对AA模型大鼠的关节肿胀有明显抑制作用(结果见表2),还能显著抑制AA模型大鼠全身继发性病变(结果见表3)。
表2荨麻木脂素对类风湿关节炎模型大鼠关节肿胀度的影响(n=10)
与空白组比较,*P<0.05;**P<0.01。
表3荨麻木脂素对类风湿关节炎模型大鼠关节炎指数的影响(n=10)
*与生理盐水组比较,p<0.05;**p<0.01。
上述具体实施可由本领域技术人员在不背离本发明原理和宗旨的前提下以不同的方式对其进行局部调整,本发明的保护范围以权利要求书为准且不由上述具体实施所限,在其范围内的各个实现方案均受本发明之约束。
- 还没有人留言评论。精彩留言会获得点赞!