果蝇S2细胞瞬时转染的方法与流程
本发明涉及生物工程领域,尤其是涉及一种果蝇s2细胞瞬时转染的方法。
背景技术:
昆虫细胞表达系统已被广泛用于包括组织因子和抗体等在内的众多人类重组蛋白的表达(kosr等,1997)。目前,昆虫表达系统主要用于表达亚单位疫苗,包括兽用疫苗以及部分人类疫苗及重组病毒(maranga等,2002;ryan和walsh等,2012;yang等,2013;miller等,2012)。果蝇s2(drosophilaschneider2)细胞是一种常用于异源基因表达的双翅目果蝇科果蝇属的昆虫细胞,可通过构建稳定细胞池的方法进行重组蛋白表达,近年来已成功用于表达一些具有生物活性的受体蛋白、离子通道蛋白、细胞骨架蛋白、转录因子、激素和凝血因子等(millar等,1995;millar等,1994;tota等,1995;towers和sattelle等,2002;mennella等,2005;winslow等,1989;change等,2005;zmora等,2007;vatandoost等,2012)。
但稳定细胞池的生产过程耗时长达几个月并且产量很低,每升的产量只能达到几毫克。瞬时转染在哺乳动物中用于重组蛋白的快速表达的工艺已非常完善,近年来也逐渐应用到昆虫表达系统中(geisse等,2009;hopkins等,2012;loomis等,2005;shen等,2013)。但由于表达量低和没有找到高效低成本的的转染试剂等原因,果蝇s2细胞的瞬时转染目前只用于构建稳定细胞株之前对表达载体的检验(vatandoost等,2012)。果蝇s2细胞的瞬时转染常用的转染试剂为磷酸钙或脂质体,操作繁琐、价格昂贵,不利于工艺放大,使其应用受到了限制(cherbas等,2007)。目前还没有低成本的阳离子聚合物转染试剂在果蝇s2细胞转染中的应用(hacker等,2013)。
技术实现要素:
基于此,有必要提供一种成本低且转染效率高的果蝇s2细胞瞬时转染的方法。
一种果蝇s2细胞瞬时转染的方法,包括如下步骤:
配置转染试剂溶液:将几丁聚糖溶于ph3-10无菌水中,配置成浓度为0.1-10g/ml的转染试剂溶液;
配置转染复合物:按照几丁聚糖与待转染的含目的dna的质粒的质量比为1-20:1的比例将所述转染试剂溶液与待转染的含目的dna的质粒溶液加入无菌水中,震荡混匀,形成转染复合物;
瞬时转染:将所述转染复合物加入已传代培养的果蝇s2细胞悬液中,摇晃培养,得到已转染含目的dna的质粒的果蝇s2细胞。
在其中一个实施例中,所述几丁聚糖的分子量范围为50-300kd。
在其中一个实施例中,所述几丁聚糖的分子量范围为50-190kd。
在其中一个实施例中,在所述配置转染试剂溶液过程中,所述无菌水的ph为5.0-7.0。
在其中一个实施例中,在所述配置转染试剂溶液过程中,配置的转染试剂溶液中几丁聚糖的浓度为0.1-1g/ml。
在其中一个实施例中,在所述配置转染复合物过程中,是按照几丁聚糖与待转染的含目的dna的质粒的质量比为5:1的比例配置。
在其中一个实施例中,在所述瞬时转染过程中,将所述转染复合物加入已传代培养的果蝇s2细胞悬液中是按照每106个细胞转染0.1-3μg含目的dna的质粒的比例添加。
在其中一个实施例中,在所述瞬时转染过程中,是于4-37℃、120-300rpm摇晃培养。
在其中一个实施例中,在果蝇s2细胞传代培养时,传代细胞的密度为0.1-2×106个细胞/ml。
在其中一个实施例中,在所述瞬时转染过程中,当传代培养的细胞密度达到2-50×106个细胞/ml时,进行瞬时转染。
上述果蝇s2细胞瞬时转染的方法使用几丁聚糖(chitosan,又名甲壳素、甲壳质)作为转染试剂,转染效率较之多聚赖氨酸(polysine)、脂质体或磷酸钙等转染试剂有明显提高,蛋白产品也显著提高。在分析含目的dna的质粒与转染试剂形成的转染复合物的大小后发现,几丁聚糖与含目的dna的质粒形成的转染复合物最小。几丁聚糖作为转染试剂具有价格低廉、操作简单且转染后蛋白产量较高的优点,可适用于果蝇s2细胞的大规模瞬时转染,可在较低成本短时间内(如5天)获得大量重组蛋白。
附图说明
图1一实施方式的果蝇s2细胞瞬时转染的流程示意图;
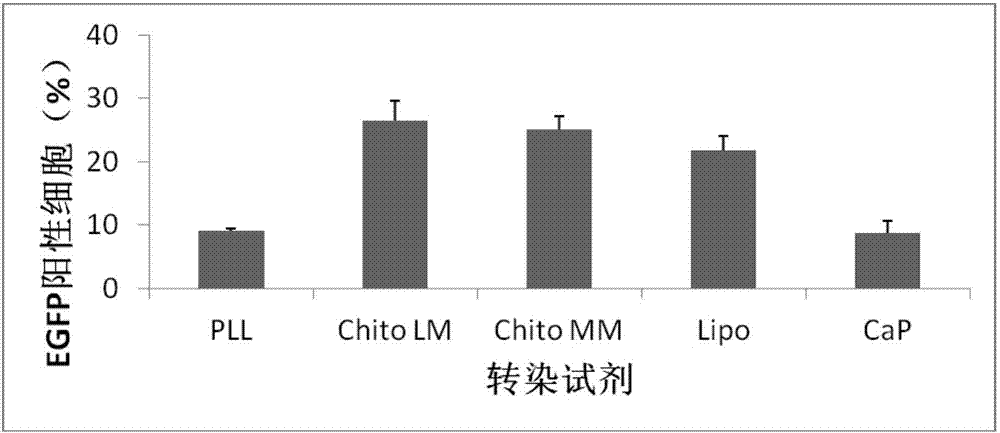
图2为使用不同转染试剂转染后的egfp阳性细胞克隆比例;
图3为使用不同转染试剂转染后的相对荧光强度;
图4为使用不同转染试剂转染后的tnfr-fc单位产量;
图5为使用不同转染试剂得到的转染复合物的大小。
具体实施方式
为了便于理解本发明,下面将参照相关附图对本发明进行更全面的描述。附图中给出了本发明的较佳实施例。但是,本发明可以以许多不同的形式来实现,并不限于本文所描述的实施例。相反地,提供这些实施例的目的是使对本发明的公开内容的理解更加透彻全面。
如图1所示,一实施方式的果蝇s2细胞瞬时转染的方法,包括如下步骤:
配置转染试剂溶液:将几丁聚糖溶于ph3-10的无菌水中,配置成浓度为0.1-10g/ml的转染试剂溶液;
配置转染复合物:按照几丁聚糖与待转染的含目的dna的质粒的质量比为1-20:1的比例将转染试剂溶液与待转染的含目的dna的质粒溶液加入无菌水中,震旦混匀,形成转染复合物;
瞬时转染:将转染复合物加入已传代培养的果蝇s2细胞悬液中,摇晃培养,得到已转染含目的dna的质粒的果蝇s2细胞。
在本实施例中,几丁聚糖的分子量范围为50-300kd,优选50-190kd小分子量范围的几丁聚糖。
在配置转染试剂溶液过程中,无菌水优选ph为5.0-7.0的无菌水,更优选为ph6.1的无菌水。配置的转染试剂溶液中几丁聚糖的浓度优选为0.1-1g/ml,更优选为0.2g/ml。
在配置转染复合物过程中,优选是按照几丁聚糖与待转染的含目的dna的质粒的质量比为1-20:1的比例配置。优选,按照5:1的比例配置。
在瞬时转染过程中,当传代培养的细胞密度达到2-50×106个细胞/ml时,进行瞬时转染,优选的是达到5×106个细胞/ml时进行瞬时转染。并且在瞬时转染过程中,将转染复合物加入已传代培养的果蝇s2细胞悬液中是按照每106个细胞转染质量为0.1-3μg含目的dna的质粒的比例添加,并于4-37℃、120-300rpm摇晃培养。优选的,将转染复合物加入已传代培养的果蝇s2细胞悬液中是按照每106个细胞转染质量为0.6μg含目的dna的质粒的比例添加,并于28℃、180rpm摇晃培养。
在果蝇s2细胞传代培养时,传代细胞的密度为0.1-2×106个细胞/ml,优选1×106个细胞/ml。
上述果蝇s2细胞瞬时转染的方法使用几丁聚糖(chitosan,又名甲壳素、甲壳质)作为转染试剂,转染效率较之多聚赖氨酸(polysine)、脂质体或磷酸钙等转染试剂有明显提高,蛋白产品也显著提高。在分析含目的dna的质粒与转染试剂形成的转染复合物的大小后发现,几丁聚糖与含目的dna的质粒形成的转染复合物最小。几丁聚糖作为转染试剂具有价格低廉、操作简单且转染后蛋白产量较高的优点,可适用于果蝇s2细胞的大规模瞬时转染,可在较低成本短时间内(如5天)获得大量重组蛋白。
以下结合具体实施例对果蝇s2细胞瞬时转染的方法作进一步详细的说明。
果蝇s2细胞来源及传代
果蝇s2细胞从tcmetrix公司(epalinges,瑞士)获得,来自果蝇的drosophilaschneider2细胞系,并在sf900iisfm培养基中(lifetechnologies公司,巴塞尔,瑞士)进行悬浮培养。细胞在tubespin生物反应器50(ts50)或在tubespin生物反应器600(ts600)(tpp,trasadingen,瑞士)中培养,其各自培养基的量分别为5~10ml或300ml。细胞每周传代2次,传代细胞密度为1×106个细胞/ml。所有培养物在isf1-x振荡培养器(kühnerag,birsfelden,瑞士)中保持在28℃温度下,摇晃速度为180rpm,摇动直径5cm。细胞密度和活性通过台盼蓝排除法使用血细胞计数器测定。
转染
几丁聚糖溶液的配置:称取相应质量的几丁聚糖干粉溶解于ph3-10的无菌水中,配置成浓度为0.1-10g/ml的转染试剂溶液。
在转染两天前将细胞离心后按照1×106个细胞/ml的密度传代,当细胞密度达到5×106个细胞/ml时转染;按照每106个细胞转染质量为0.1-3μg含目的dna的质粒比例准备质粒,将几丁聚糖与含目的dna的质粒按照质量比为1-20:1的比例加入无菌水中震荡混匀,以形成转染复合物。
对于小规模转染,将细胞离心并重悬于含培养基的ts50管中,将转染复合物加入培养基中。对于300ml的转染,将细胞离心并重悬于含培养基的ts600管中,将转染复合物加入培养基中。
将果蝇s2细胞置于4-37℃培养箱中,120-300rpm摇晃培养。5天后可收集上清进行检测或下游纯化。
蛋白质定量
含目的dna的质粒包括导入有egfp(绿色荧光蛋白)基因的质粒和导入有tnfr-fc基因的质粒,从而表达出egfp以及tnfr-fc蛋白。
piex-xegfp和piex-tnfr-fc分别携带egfp基因和人tnfr-fc的基因,并且受autographacalifornicamulticapsidnucleopolyhedrovirus(acmnpv)同源区5(hr5)增强子以及立早1(ie1)启动子的控制,质粒的构建参考申请号为cn201510708368.8的中国专利申请。egfp阳性细胞的百分比通过guavaeasycyte流式细胞仪(guavatechnologies,hayward,美国)测定。激发光和发射光分别为488nm和532nm。
egfp的荧光定量通过tecansaphireii荧光光度计(tecan,maennedorf,瑞士)测定,激发光和发射光分别为485nm和515nm。
tnfr-fc的浓度通过elisa方法确定。使用羊抗人fcγ抗体进行包被,并通过碱性磷酸酶共聚羊抗人iggγ链来检测tnf-fc。加入底物后,在405nm和490nm下用读板器检测吸收值。
使用streamlinerproteina(ge,uppsala,瑞典)纯化重组tnfr-fc,并使用dc蛋白检测(biorad,reinach,瑞士)方法进行检测。
转染复合物大小的测定:
转染试剂和含目的dna的质粒的转染复合物大小可用nanozszen3600电位分析仪进行测定。
实验结果
如图2和图3所示,在果蝇s2细胞的瞬时转染中,与使用阳离子聚合物转染试剂polylysine(pll)、中分子量(190-300kd)几丁聚糖(chitomm),脂质体转染试剂lipofectamine2000(lipo)和磷酸钙法(cap)相比,使用阳离子聚合物低分子量(50-190kd)几丁聚糖(chitolw)转染后的egfp阳性细胞比例最高,相对荧光强度也最高。
如图4所示,在瞬时表达中,使用阳离子聚合物低分子量几丁聚糖(chitolw)转染的果蝇s2细胞tnfr-fc产量更高。
如图5所示,比较几种阳离子聚合物转染试剂,含目的dna的质粒与转染试剂形成的转染复合物大小,阳离子聚合物低分子量几丁聚糖(chitolw)形成的转染复合物最小,中分子量几丁聚糖(chitomm)形成的转染复合物次之。
以上所述实施例的各技术特征可以进行任意的组合,为使描述简洁,未对上述实施例中的各个技术特征所有可能的组合都进行描述,然而,只要这些技术特征的组合不存在矛盾,都应当认为是本说明书记载的范围。
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
- 还没有人留言评论。精彩留言会获得点赞!