通用型CAR-T细胞及其制备方法和用途与流程
本发明涉及免疫学和分子生物学领域,具体地涉及肿瘤免疫疗法,尤其是一种通用型CAR-T细胞及其制备方法和用途。·
背景技术:
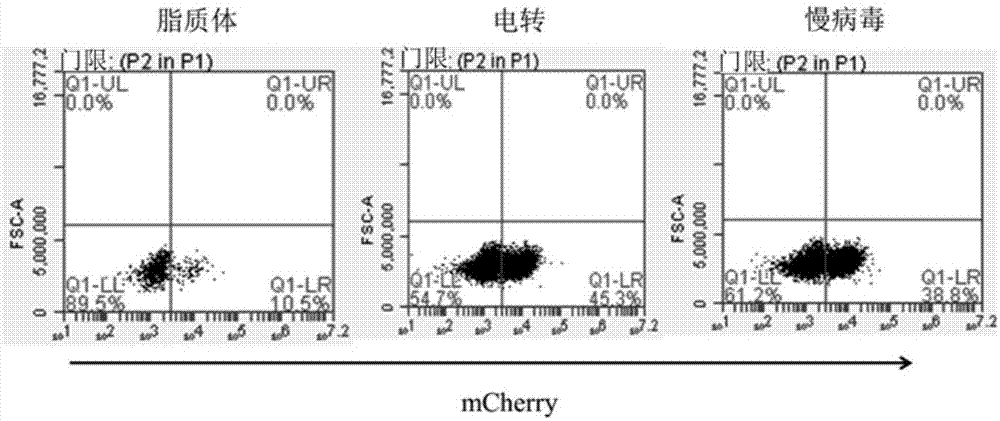
:肿瘤免疫疗法近年来得到广泛的关注和应用,尤其是CAR-T(chimericantigenreceptor-engineeredTcells)技术的出现,使人类对肿瘤的控制得到了里程碑式的发展。该技术在肿瘤治疗中的应用始于1989年。它的临床应用结果让人看到治愈癌症的曙光:不仅仅在急性或者慢性淋巴细胞血液病中可以创造奇迹,在其它一些实体瘤比如淋巴瘤、成神经细胞瘤中也有着令人兴奋的治疗效果。目前CAR-T技术中所应用的T细胞主要来源于患者自身,从患者自身外周血来源的T细胞经过激活、CAR导入并扩增,然后回输到患者体内。但是很多情况下,由于病人的病情危险或者患者自身的条件不允许再从其体内抽出外周血进行CAR-T细胞的治疗;甚至是即使病人可以提供外周血,但是从血中分选出来的T细胞活性不足以进行CAR改造,这就从一定范围上限制了CAR-T技术的应用范围。为了解决这个问题,异体CAR-T逐渐成为一个良好的选择。同时,异体CAR-T技术解决了T细胞的来源问题也将为CAR-T的商业化推广奠定基础。在机体内,T细胞捕获并消灭异源抗原是一个复杂的过程,需要主要组织相容性复合物(MHC)和T细胞受体(TCR)的共同参与,其中TCR在识别MHC结合的抗原过程中起着关键作用。主要组织相容性复合物(MHC)有两种类型,通常称为MHCI类和MHCII类,除了具有抗原递呈作用,还与器官移植过程中的排斥反应相关。杀伤性T细胞则是通过其表面具有的类似抗体的分子即T细胞受体(TCR)识别并清除经MHCI类分子递呈的抗原。在同种异体环境中,CAR-T上的TCR信号传导作用可能对临床应答产生潜在的影响,而TCR和CAR之间的相互作用尚未有深入的研究。同时,回输异体CAR-T细胞有可能出现移植物抗宿主病(GVHD)的风险。因此,需要有降低受体的供体细胞排斥反应和避免出现GVHD的改善CAR-T疗效的方法。·技术实现要素:本发明针对上述缺陷,利用CRISPR/Cas9技术对来自健康志愿者(donor)的T细胞进行修饰,选择性敲除内源性T细胞受体(TCR)的a链和/或β链恒定编码区(TRAC和/或TRBC)基因,同时将嵌合抗原受体(CAR)稳定表达在T细胞中,从而获得了表达特异性CAR同时不表达TCR的CAR-T细胞。本发明的第一方面提供了一种通用型CAR-T细胞,其表达特异性CAR并且不表达TCR。本发明的第二方面提供了一种制备通用型CAR-T细胞的方法,所述方法包括如下步骤:1)在T细胞中引入sgRNA分子和Cas9分子;2)在所述T细胞中引入CAR分子;其中,步骤2)可在步骤1)之前、之后或同时进行,并且所述sgRNA分子包含与来自TCR的a链或β链恒定编码区(即TRAC或TRBC)基因的靶区域互补的靶向结构域。本发明的第三方面提供了包含本发明第一方面的通用型CAR-T细胞的组合物。本发明的第四方面提供了本发明第一方面的通用型CAR-T细胞用于制备治疗肿瘤的药物的用途。本发明的通用型CAR-T细胞避免了输注到患者体内的T细胞出现GVHD以及潜在的TCR受体信号干扰。本申请将会为通用型CAR-T细胞的使用铺平道路,具有重大的临床意义。·附图说明根据以下参照附图进行的详细描述,本发明的上述和其他方面、特征和优点会变得更加清楚。图1示出了sgRNA表达质粒及Cas9表达质粒在不同转染(脂质体转染、电转和慢病毒转染)条件下的转染效率的比较结果。图2a和图2b示出了不同sgRNA造成基因组突变的效率的比较结果。图3示出了对经TCR敲除的TRAC和TRBC区域进行测序的结果。图4示出了对预测的TRAC-sg3潜在的人基因组上的脱靶位点进行测序的结果。图5示出了对TCR阴性、CD4和CD8阳性的T细胞的筛选结果。图6示出了T细胞、WTCAR-T和TCR-CAR-T细胞对靶细胞的杀伤效果的比较结果。图7示出了T细胞、WTCAR-T和TCR-CAR-T细胞抑制以及杀死肿瘤细胞的效果的比较结果。图8示出了注射小鼠T细胞、人WTCAR-T和人TCR-CAR-T细胞后,小鼠平均体重的变化的比较结果。·具体实施方式如上所述,本发明的第一方面提供了一种通用型CAR-T细胞,其表达特异性CAR并且不表达TCR。在一个实施方案中,所述细胞来源于健康志愿者(或供者)。在一个实施方案中,本发明的通用型CAR-T细胞的TCR基因被敲除。在一个具体的实施方案中,所述TCR的a链和/或β链恒定编码区(即TRAC和/或TRBC)基因被敲除。TRAC和TRBC基因可以被全部敲除,也可以被部分敲除;可以二者均被敲除,也可以敲除二者之一;只要敲除后细胞不能表达有活性的TCR即可。在一个具体的实施方案中,所述TCR的a链恒定编码区(即TRAC)基因被敲除。例如,在具体实施方案中,本发明TCR的a链恒定编码区基因被引入所述细胞的TRAC-sg1-7分子之一(见表1)以及Cas9分子部分或全部敲除;优选,所述TCR的a链恒定编码区基因被引入细胞的TRAC-sg3分子以及Cas9分子敲除。在另一个具体的实施方案中,所述TCR的β链恒定编码区(即TRBC)基因被敲除。例如,在具体实施方案中,本发明TCR的β链恒定编码区基因被引入所述细胞的TRBC-sg1-7分子之一(见表1)以及Cas9分子部分或全部敲除;优选,所述TCR的β链恒定编码区基因被引入细胞的TRBC-sg1分子以及Cas9分子敲除。在一个实施方案中,本发明的通用型CAR-T细胞所表达的CAR可以是本领域已知的任何CAR,只要其能够使T细胞以人白细胞抗原-非依赖性的方式识别细胞表面抗原,发挥杀伤作用即可。例如,可以使用中国发明专利申请201510324558.X中公开的CAR,本发明的具体实施方案中使用的CAR可参考该发明专利申请公开文本。具体而言,本发明的CAR-T细胞中表达的CAR包含顺序连接的信号肽、胞外结合区、任选的铰链区、跨膜区和胞内信号区。本文使用的术语“信号肽”是指引导新合成的蛋白质向分泌通路转移的短(长度5-30个氨基酸)肽链。在本发明中,可以使用人体内的各种蛋白质的信号肽,例如体内分泌的细胞因子蛋白、白细胞分化抗原(CD分子)的信号肽。在一个具体的实施方案中,所述信号肽为GMCSF信号肽,其核苷酸序列如发明专利申请201510324558.X的序列表中的SEQIDNo:1所示。在一个具体的实施方案中,所述信号肽为CD8信号肽,其核苷酸序列如发明专利申请201510324558.X的序列表中的SEQIDNo:2所示。在本发明中,所述铰链区可以使用各种不同抗体或抗原受体的铰链区,特别是CD分子的铰链区。在一个具体的实施方案中,所述铰链区可以选自CD8或CD28等蛋白的铰链区。所述CD8或CD28是T细胞表面的天然标记物。在一个具体的实施方案中,所述铰链区为CD8铰链区(CD8-hinge),其核苷酸序列如发明专利申请201510324558.X的序列表中的SEQIDNo:6所示。在一个具体的实施方案中,所述铰链区为CD28铰链区(CD28-hinge),其核苷酸序列如发明专利申请201510324558.X的序列表中的SEQIDNo:7所示。在本发明中,可以使用各种人体内蛋白的跨膜区,特别是各种不同抗原受体的跨膜区。优选使用的跨膜区是CD分子的跨膜区。在一个实施方案中,所述跨膜区可以选自CD8或CD28等蛋白的跨膜区。在一个具体的实施方案中,所述跨膜区为CD8跨膜区(CD8-TM),其核苷酸序列如发明专利申请201510324558.X的序列表中的SEQIDNo:8所示。在一个具体的实施方案中,所述跨膜区为CD28跨膜区(CD28-TM),其核苷酸序列如发明专利申请201510324558.X的序列表中的SEQIDNo:9所示。所述“胞外结合区”包含特异性识别肿瘤细胞表面抗原的scFv。本文使用的术语“scFv”是指这样的抗体片段——其是包含通过接头(linker)连接的重链可变区(variableregionofheavychain,VH)和轻链可变区(variableregionoflightchain,VL)的重组蛋白,接头使得这两个结构域相关联,以最终形成抗原结合位点。scFv的大小一般是一个完整抗体的1/6。scFv优选是由一条核苷酸链编码的氨基酸序列。本发明使用的scFv可通过单独或联合使用本领域已知的常规技术,例如氨基酸缺失、插入、取代、增加、和/或重组以及/或其他修饰方法作进一步修饰。根据一种抗体的氨基酸序列在其DNA序列中引入这种修饰的方法对本领域技术人员来说是公知的(参见例如,Sambrook分子克隆:实验手册,ColdSpringHarborLaboratory(1989)N.Y.)。所述修饰优选在核酸水平上进行。上述scFv还可以包括其衍生物。本文使用的术语“特异性识别”意指本发明的抗原识别区不与或基本上不与目标抗原以外的任意多肽交叉反应。其特异性的程度可以通过免疫学技术来判断,包括但不限于免疫印迹,免疫亲和层析,流式细胞分析等。在一个实施方案中,所述胞外结合区包含特异性识别CD19、CEA、EGFR、GD2或CD138等的scFv。在一个具体的实施方案中,所述胞外结合区包含特异性识别CD19的scFv(anti-CD19scFv)。在一个具体的实施方案中,所述胞外结合区包含经人源化改造的特异性识别CD19的scFv。在一个优选的实施方案中,所述胞外结合区为经人源化改造的特异性识别CD19的scFv-S1(其核酸序列如发明专利申请201510324558.X的序列表中的SEQIDNo:4所示)或scFv-S2(其核酸序列如发明专利申请201510324558.X的序列表中的SEQIDNo:5所示)。在本发明中,可以使用各种人体内蛋白的胞内信号区,特别是各种不同抗原受体的胞内信号区。优选使用的胞内信号区是CD分子的胞内信号区。在一个实施方案中,所述胞内信号区可以选自CD3ζ、FcεRIγ、CD28、CD137、CD134蛋白的胞内信号区,及其组合。CD3分子由五个亚单位组成,其中CD3ζ亚单位(又称CD3zeta,简称Z)含有3个ITAM基序,该基序是TCR-CD3复合体中重要的信号转化区。CD3δZ是突变的不具有ITAM基序的CD3ζ序列,在本发明的实施例中一般作为阴性对照的构建组分。FcεRIγ主要分布在肥大细胞和嗜碱性粒细胞表面,其含有一个ITAM基序,在结构、分布及功能上与CD3ζ类似。此外如前所述,CD28、CD137、CD134是共刺激信号分子,在与各自配体结合后其胞内信号区段产生的共刺激作用引起T细胞的持续增殖,并能够提高T细胞分泌IL-2和IFN-γ等细胞因子的水平,同时提高CAR-T细胞在体内的存活周期和抗肿瘤效果。本发明具体使用的胞内信号区有多种组合,其包括选自如下的信号区或其组合:CD28信号区(CD28-signal),其核苷酸序列如发明专利申请201510324558.X的序列表中的SEQIDNo:10所示;CD137信号区(CD137-signal),其核苷酸序列如发明专利申请201510324558.X的序列表中的SEQIDNo:11所示;和CD3ζ信号区(CD3ζ-signal),其核苷酸序列如发明专利申请201510324558.X的序列表中的SEQIDNo:12所示。在一个具体的实施方案中,本发明的通用型CAR-T细胞所表达的CAR选自如下的包含顺序连接的信号肽、胞外结合区、任选的铰链区、跨膜区和胞内信号区的嵌合抗原受体蛋白:GMCSF–scFv-S1–CD8-hinge–CD8-TM–CD137-signal–CD3ζ-signal(CAR1,其核酸序列如发明专利申请201510324558.X的序列表中的SEQIDNo:13所示);GMCSF–scFv-S2–CD8-hinge–CD8-TM–CD137-signal–CD3ζ-signal(CAR2,其核酸序列如发明专利申请201510324558.X的序列表中的SEQIDNo:14所示);GMCSF–scFv-S1–CD28-TM–CD28-signal–CD3ζ-signal(CAR3,其核酸序列如发明专利申请201510324558.X的序列表中的SEQIDNo:15所示);GMCSF–scFv-S2–CD28-TM–CD28-signal–CD3ζ-signal(CAR4,其核酸序列如发明专利申请201510324558.X的序列表中的SEQIDNo:16所示);GMCSF–scFv-S1–CD8-hinge–CD8-TM–CD28-signal–CD137-signal–CD3ζ-signal(CAR5,其核酸序列如发明专利申请201510324558.X的序列表中的如SEQIDNo:17所示);GMCSF–scFv-S2–CD8-hinge–CD8-TM–CD28-signal–CD137-signal–CD3ζ-signal(CAR6,其核酸序列如发明专利申请201510324558.X的序列表中的SEQIDNo:18所示)。如上所述,本发明的第二方面提供了一种制备通用型CAR-T细胞的方法,所述方法包括如下步骤:1)在T细胞中引入sgRNA分子和Cas9分子;2)在所述T细胞中引入CAR分子;其中,步骤2)可在步骤1)之前、之后或同时进行,并且所述sgRNA分子包含与来自TCR的a链和/或β链恒定编码区(即TRAC和/或TRBC)基因的靶区域互补的靶向结构域。在本发明的方法中,所述sgRNA分子是指一段包含与待敲除的基因的靶区域互补的靶向结构域的核酸序列,其能识别靶标DNA序列并引导Cas9分子切割靶位点。在本发明的方法中,所述Cas9分子是指一种双链DNA核酸酶,其能够在sgRNA的引导下对靶位点进行切割。在一个实施方案中,所述sgRNA分子包含与来自TCR的a链恒定编码区(即TRAC)基因靶区域互补的靶向结构域。在一个具体的实施方案中,所述sgRNA分子所包含的靶向结构域的序列如SEQIDNOs:1-7中之一所示。在一个优选的实施方案中,所述靶向结构域的序列如SEQIDNO:3所示。在一个实施方案中,所述sgRNA分子包含与来自TCR的β链恒定编码区(即TRBC)基因靶区域互补的靶向结构域。在一个具体的实施方案中,所述sgRNA分子所包含的靶向结构域的序列如SEQIDNOs:8-14中之一所示。在一个优选的实施方案中,所述靶向结构域的序列如SEQIDNO:8所示。在一个实施方案中,通过构建载体将所述sgRNA分子和Cas9分子经脂质体转染、电转或慢病毒转染技术引入所述T细胞中。在一个优选的实施方案中,通过构建载体将所述sgRNA分子和Cas9分子经电转技术引入所述T细胞中。在一个更优选的实施方案中,通过电转技术将所述sgRNA分子和编码Cas9分子的mRNA引入所述T细胞中。在一个实施方案中,通过慢病毒转染技术将所述CAR分子引入所述T细胞中。在一个具体的实施方案中,本发明的方法在步骤1)之前还包括分离和/或激活来自健康志愿者(或供者)的T细胞的步骤;优选地,所述方法在步骤2)之后还包括对通用型CAR-T细胞进行分选的步骤;更优选地,分选之后再对所得的通用型CAR-T细胞进行有效性验证。如上所述,本发明的第三方面提供了包含本发明第一方面的通用型CAR-T细胞的组合物。在一个实施方案中,所述组合物还包含可药用的稀释剂、赋形剂或载体等。如上所述,本发明的第四方面提供了本发明第一方面的通用型CAR-T细胞用于制备治疗肿瘤的药物的用途。以下通过具体实施例来说明本发明的内容。应理解,所述具体实施例仅为说明目的,并不意味着本发明的内容仅限于具体实施例。实施例1:通用型CAR-T细胞的制备1.健康供者T细胞的分离与激活。1)健康供者外周血的采集:采集的外周血4℃冰箱暂存,24h内,经由配备有恒温设备的转运车运至GMP实验室进行分离和培养。2)外周血单个核细胞(PBMC)的制备:用移液管吸取DPBS(Dulbecco'sPhosphateBufferedSaline)或者生理盐水加入到步骤(1)采集的外周血中(1:1),稀释,将血细胞稀释液,缓慢加入装有淋巴细胞分离液(Ficoll或者Histopaque-1077)的离心管中,以800g离心20min后,吸取淋巴细胞分离液上方的白膜层细胞,转入一个新的离心管中,加入Lonzax-vivo15培养基(货号:04-418Q)离心后弃上清,保留离心管底部的细胞沉淀,即得到外周血单个核细胞。3)T细胞的分离和激活:将得到的外周血单个核细胞进行计数,按照1:1的比例加入偶联CD3/CD28抗体的beads,轻轻震荡20min,利用磁力架的吸附作用,得到CD3阳性的T细胞,此时的T细胞处于激活状态,加入完全培养基(Lonzax-vivo15+IL-2),对T细胞进行培养扩增。2.利用CRISPR/Cas9系统敲除经步骤1获得的T细胞中的TCR基因,具体操作步骤如下所示:1)针对TCR的a链和β链恒定编码区(TRAC、TRBC)基因的sgRNA设计和质粒构建。针对TRAC以及TRBC基因编码区的前三个外显子序列中选择5’-GN19-22NGG-3’的序列,并用Cas-OFFinder确保其3’端的8-12个碱基不会错配到基因组其他位置(http://www.rgenome.net/cas-offinder/)。所选取的序列见表1。表1:sgRNA序列合成引物,正义链为5’-ACCGN19-22-3’,反义链为5’-AAACN19-22-3’(正义反义链中N19-22序列部分反向互补)。将合成的序列片断各取22.5μL,与5μL10×TransTaqHiFiBufferII(全式金Transgene,北京)混合,于95℃加热3min后缓慢冷却到室温。所得产物用T4PNK(T4PolynucleotideKinase/T4多聚核苷酸激酶)进行磷酸化处理,37℃温育30min。将磷酸化后的产物(InsertsgRNA)分别通过GoldenGate反应连接到psgRNA载体(AddgenePlasmid#53121)中。反应体系如下:10XBufferTango1μLDTT(50mM)0.2μLATP(10mM)1μLEsp3I0.75μLT4DNAligase0.25μLpsgRNAvector(20ng/μL)2μLInsertsgRNA0.2μLddH2O4.6μL连接产物使用感受态stbl3转化后,挑选克隆使用通用引物U6进行测序(LifeTechnology,上海),将正确插入sgRNA序列的克隆摇菌提取质粒。2)sgRNA表达质粒及Cas9表达质粒转入T细胞系以及原代T细胞的效率检测如下所示比较了sgRNA表达质粒及Cas9表达质粒在不同转染(脂质体转染、电转和慢病毒转染)条件下的转染效率。脂质体转染:在六孔板的孔中铺1×106Jurkat细胞,在200μL的OPTI-MEM中加入1μgpCas9(AddgenePlasmid#53118),1μgTRAC-sg3表达质粒混合均匀,再加入4μLX-tremeGENEHPDNA转染试剂或者6μL100nM聚乙烯亚胺(Polyethylenimine,PEI),或者6μLlipo2000试剂,混合均匀后室温静置15min,滴入孔中。6-8h后将细胞换回新鲜培养基培养。换液72h后通过流式细胞分选(FACS)分析mCherry阳性细胞比例。电转:取1×106Jurkat细胞,在100μL的电转Buffer中加入1μgpCas9,1μgTRAC-sg3表达质粒,混合均匀,用LONZA电转仪电转。转完的细胞继续培养。换液72h后通过流式细胞分选(FACS)分析mCherry阳性细胞比例。慢病毒感染:取1×106Jurkat细胞,按照MOI=4的比例加入包装有Cas9和TRAC-sg3的慢病毒,24h后换液,继续培养48h,通过流式细胞分选(FACS)分析mCherry阳性细胞比例。不同转染条件效率的比较结果见图1。比较结果显示,脂质体转染方法转染效率较低,电转方法细胞转染效率较高,两者细胞活率类似。3)sgRNA造成基因组突变的效率检测用1μgpCas9,1μgpTRAC-sgRNA和/或1μgpTRBC-sgRNA转染2×105HeLa细胞,72h后提取转染细胞的基因组为模板,用Primer-Blast设计引物,特异性地扩增包含sgRNA序列的一段300-1000bp大小的基因组片断。在50μL体系中取300-500ng的PCR产物与10×NEBBuffer2(NEB)混合,95℃加热3min后缓慢冷却到室温。所得产物加入0.5μLT7E1(NEB)在37℃温育15min,进行琼脂糖凝胶电泳,电泳图用ImageJ图像分析软件分析条带切割的效率,指示sgRNA产生InDel(insertion-deletion)的效率(如图2a和2b)。结果显示,TRAC-sg3及TRBC-sg1具有较高的对靶基因位点的编辑效率,后续选取表达TRAC-sg3及TRBC-sg1的质粒继续实验。4)敲除T细胞系(Jurkat、SupT1等)和primaryT细胞的TCR基因利用电转技术,将sgRNA和Cas9导入到T细胞系(Jurkat、SupT1等)和primaryT细胞中,通过流式分选技术或者免疫磁珠技术筛选出TCR阴性同时CD4或者CD8阳性的T细胞。将筛选出的TCR阴性同时CD4或者CD8阳性的T细胞提取基因组(血液/细胞/组织基因组DNA提取试剂盒),用特异性引物(TRAC:Forward:AGTCTGTCTGCCTATTCACCGA,Reverse:CCTGGTGCATTCATGTGCCG;TRBC:Forward:GGATAGATGATCAGACAAGCCT,Reverse:TGGTAGCTGGTCTCACCTAAT)分别PCR扩增TRAC及TRBC包含对应sgRNA的基因组区域,PCR产物进行TA克隆及测序以从分子水平上验证TCR的敲除,结果如图3所示,可以看出,可以成功对TCR的TRAC及TRBC基因进行编辑,包括插入突变和缺失突变,两者都造成了移码突变,从而从基因的水平抑制了TCR的表达。同时对于TRAC-sg3及TRBC-sg1潜在的人基因组上的脱靶位点进行预测,并对预测的可能影响其他基因表达的脱靶位点区域进行扩增和T7E1分析,目的是为了从分子水平确认TCR的敲除并没有引入off-target的非特异基因的敲除,结果如图4所示,可以看出TRAC和TRBC的基因并没有发生任何突变,说明该体系特异性满足需求。以上结果显示,转入TRAC-sg3及TRBC-sg1并进行筛选的T细胞中的TCR基因被完全敲除,同时,没有发现潜在脱靶位点处的基因突变。3.CAR的设计及载体构建参考中国发明专利申请201510324558.X公开文本,特别是其实施例1和2,设计包含顺序连接的信号肽、胞外结合区、任选的铰链区、跨膜区和胞内信号区的嵌合抗原受体(CAR),并进行载体构建。所述胞外结合区的核苷酸序列是在抗CD19的嵌合抗原受体的抗原结合区(在此命名为anti-CD19scFv-S0,简称为scFv-S0,其来源于小鼠,参见JImmunother.2009September;32(7):689–702.)的核苷酸序列(如发明专利申请201510324558.X的序列表中的SEQIDNo:3所示)的基础上进行人源化改造而获得的。应理解,抗体人源化改造的原则为在保证抗体亲和力的同时,最大限度地将骨架区(frameworkregion,FM)改变为人源序列,以降低抗体的免疫原性。在该实施例中,将上述SEQIDNo:3中的抗原识别区保持不变,对其余的序列进行相应的改变,进行了超过40种的人源化设计,再通过基因合成的方法合成得到这些序列,CAR分子的其他部分都是利用PCR技术,分别从人cDNA文库中克隆得到,然后进行搭桥连接,最终制备得到CAR分子的核苷酸序列。将这些CAR分子转入T细胞,将包含含有这些经人源化改造序列的CAR分子的T细胞与包含含有scFv-S0的CAR分子的T细胞对靶细胞的杀伤能力进行比较,最终筛选得到两种经人源化改造的胞外结合区序列,其分别称为anti-CD19scFv-S1(简称为scFv-S1,其核苷酸序列如发明专利申请201510324558.X的序列表中的SEQIDNo:4所示)和anti-CD19scFv-S2(简称为scFv-S2,其核苷酸序列如发明专利申请201510324558.X的序列表中的SEQIDNo:5所示)。下面以CAR5和CAR6为例,具体说明CAR分子的核苷酸序列的制备步骤。首先进行引物设计,本实施例中使用的引物序列如下:1-1:5’-atgcttctcctggtgacaag-3’1-2:5’-tgggatcaggaggaatgctg-3’2-1:5’-TACATCTGGGCGCCCTTGGCCGG-3’2-2:5’-GGAGCGATAGGCTGCGAAGTCGCG-3’3-1:5’-AGAGTGAAGTTCAGCAGGAGCG-3’3-2:5’-TTAGCGAGGGGGCAGGGCCT-3’4-1:5’-atgcttctcctggtgacaagcc-3’4-2:5’-TGAGGAGACGGTGACTGAGGTTCCTTGG-3’5-1:5’-gcggccgcaattgaagttatgta-3’5-2:5’-TTAGCGAGGGGGCAGGGCCTGC-3’6-1:5’-CTAGACTAGTatgcttctcctggtgacaagcc-3’6-2:5’-CGACGCGTTTAGCGAGGGGGCAGGGCCTGC-3’以人的cDNA文库为模板,分别以1-1和1-2、2-1和2-2、3-1和3-2为引物,通过PCR克隆出相应的CAR分子部分,分别为GMCSF、CD28-TM+CD28-signal(这两部分是相连的)和CD3ζ-signal。再通过搭桥引物4-1和4-2获得GMCSF+scFv片段,通过搭桥引物5-1和5-2获得CD28-TM+CD28-signal+CD3ζ-signal片段,随后通过搭桥引物6-1和6-2获得完整的CAR分子的核苷酸序列,酶切位点为SpeI和MluI。将如上制备的CAR分子的核苷酸序列经SpeI(Fermentas)和MluI(Fermentas)双酶切、经T4连接酶(Fermentas)连接插入慢病毒pLenti-CMV-eGFP载体的SpeI-MluI位点,转化到感受态E.coli(DH5α),经测序正确后,使用质粒纯化试剂盒提取(Qiagen)并纯化质粒,用于后续实验。4.通用型CAR-T细胞的构建和扩增如步骤1所述,利用偶联CD3/CD28抗体的beads将PBMC中的T细胞分选和激活后,用Lonzax-vivo15培养基将细胞密度调至2×106cell/mL。按照MOI=2-4的比例加入包装有CAR的慢病毒(慢病毒法,具体步骤可参见发明专利申请201510324558.X的实施例3部分),24h后换液,48h后观察细胞的状态,收集细胞悬液,以400g离心5min,弃上清,用x-vivo15培养基将细胞密度调至1×107cell/mL。使用mMessagemMachineT7Ultrakit(LifeTechnologies)试剂盒制备Cas9mRNA和TRAC-sg3mRNA,经过纯化和洗脱后待用。把细胞和mRNA混合,使其最终浓度达到每100μL中含1×106个细胞和500ngmRNA(Cas9mRNA和TRAC-sg3mRNA各250ng)。利用电转仪(NEPA21)将mRNA导入细胞中。每天观察细胞的生长状况,每隔一天进行换液。细胞培养11-12d后,对所得的T细胞进行质量检测。并在第12-14d对T细胞进行纯化,具体方法见步骤5,最后将终产品(即,通用型CAR-T细胞,在本文中简称为TCR-CAR-T细胞)进行分装和冻存。5.TCR阴性、CD4和CD8阳性的T细胞的筛选:利用流式分选技术或者免疫磁珠技术筛选出TCR阴性同时CD4或者CD8阳性的T细胞。1)第一步,首先利用偶联CD3抗体的免疫磁珠进行负分选,除掉T细胞中仍表达CD3(TCR)的细胞(通常进行2次负分选);2)第二步,取小量第一步的T细胞,进行流式检测,同时染色CD3、CD4和CD8,如果CD3阳性率<0.01%,同时CD4+CD8阳性率>90%,即可进行下一步工作。在本实施例中,CD3阳性率为0%,同时CD4+CD8阳性率为93.3%(图5)。实施例2:通用型CAR-T(TCR-CAR-T细胞)有效性验证观察实施例1得到的通用型CAR-T细胞(即,效应细胞)对B细胞型急性淋巴细胞白血病的治疗作用。细胞生物学验证:具体实验步骤如下:第一步:使用Calcein-AM标记靶细胞(即,来自B细胞型急性淋巴细胞白血病患者的细胞)1)将Calcein-AM(LifeTechnology,上海)用DMSO稀释成1mg/mL;2)将靶细胞用全培养基重悬成1×106个/mL的密度;3)加入15μM的Calcein-AM,37℃、5%CO2培养30min,每10min轻轻混匀;4)以1500rpm离心5分钟,去上清,用全培养基重悬,重复操作两遍;第二步:利用效应细胞对靶细胞进行杀伤1)将标记好的靶细胞按照5000-50000个/mL的密度重悬,取100μL加入到96孔板中;2)按照适当的ET(效靶比)比(5:1)加入100μL效应细胞,同时以T细胞和一般外周血CAR-T(即,WTCAR-T细胞)作为对照细胞,每组3个平行,检测上清的荧光强度(testrelease);设计单独的A组(6个平行),只有靶细胞,检测其自发凋亡裂解的荧光强度(spontaneousrelease);设计单独的B组(6个平行),只有靶细胞+2%TritonX-100,检测其最大裂解的荧光强度(maximumrelease);3)37℃、5%CO2培养4h后,离心,取75μL上清,转移到一个新的培养板上;4)样品利用spectramaxGeminidual-scanningmicroplatespectrofluorimeter检测(excitationfilter:485±9nm;band-passfilter:530±9nm);按以下公式计算细胞裂解的百分比:[(testrelease-spontaneousrelease)/(maximumrelease–spontaneousrelease)]*100。所得结果如图6所示,可以看出,通用型CAR-T杀伤能力与WTCAR-T杀伤能力基本一致。动物实验验证:一、淋巴瘤小鼠模型的构建:1.细胞系:人淋巴瘤细胞系Daudi;Daudi细胞是人淋巴瘤细胞系,可以通过皮下注射的方式构建小鼠的人淋巴瘤模型。其CD19表达为阳性,可以作为CAR-T细胞的靶细胞。2.Daudi细胞培养Daudi细胞系为悬浮细胞系,在含有20%FBS的1640培养基(Gibco)中可以快速生长。细胞密度为2-3×106/mL时需要传代。传代时取细胞悬液于离心管中,以500g离心5分钟,弃上清。将细胞密度调整到0.3-0.5×106/mL,继续培养。正常生长情况下,Daudi细胞系为隔天传代,细胞密度维持在0.3-3×106/mL之间即可。3.细胞系接种用生理盐水重悬Daudi细胞,调整其活细胞浓度为3×108个/mL,在冰上将其与Matrigel(BD,中国)按照2:1的体积比充分混匀。通过皮下注射的方式进行接种。以成功长出100mm3的肿瘤作为小鼠淋巴瘤模型构建成功的判定标准。其中肿瘤体积计算公式为:肿瘤体积(mm3)=肿瘤长径(mm)×肿瘤短径2(mm2)×0.5;4.小鼠淋巴瘤模型给药。记录给药当天为D0。通过尾静脉注射的方式进行细胞输注(PBS200μL、人T细胞200μL(总计1×106/只)、人WTCAR-T细胞200μL(总计1×106/只)、人TCR-CAR-T细胞200μL(总计1×106/只)),所有小鼠均单次给药。结果如图7所示,可以看出,本发明提供的TCR-CAR-T细胞具有很好的抑制以及杀死肿瘤细胞的效果。实施例3:通用型CAR-T(TCR-CAR-T细胞)安全性验证小鼠GVHD模型6-8周龄的C57雄性小鼠30只(24小时前给予2.4Gy全身照射),单次尾静脉注射小鼠T细胞、人WTCAR-T细胞和人TCR-CAR-T细胞各1×107个/mL(每组随机分配10只,阴性对照组注射同体积PBS),注射细胞4小时后开始详细临床观察(死亡率、临床症状、行为、体重变化),以后每天观察一次,连续观察60天,以评估GVHD的发生与否及其严重性。通过表2可以看出注射正常异种CAR-T细胞的组中的小鼠全部发生严重GVHD反应,并有70%小鼠死亡。而TCR敲除后的CAR-T细胞对机体几乎不发生GVHD,说明TCR敲除后CAR-T细胞安全性较高。图8示出了小鼠平均体重的变化,注射正常异种CAR-T细胞组中的小鼠体重明显下降,最多下降了30%,而未注射CAR-T细胞的组和注射TCR敲除CAR-T细胞的组中的小鼠体重没有明显下降,相反有些许上升现象。综合所有数据,表明TCR敲除后的CAR-T细胞的安全性高。表2:小鼠异常统计表当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1