体外感染PRRSV建立猪肺泡巨噬细胞氧化应激模型的方法与流程
本发明属于病毒处理诱导免疫细胞氧化应激模型技术领域,尤其涉及一种应用PRRSV建立猪肺泡巨噬细胞体外氧化应激模型的方法。
背景技术:
近年来,大量实验研究表明,病毒感染与氧化应激之间有密不可分的联系,如HSV-1、SV、HIV、HAV、流感病毒等,当病毒感染后,细胞处于氧化应激状态,细胞内还原型谷胱甘肽水平下降,活性氧增多。而在一个过度氧化的坏境中,病毒的感染也变得更加容易,因此,病毒会通过不同的途径和作用机制来改变宿主靶细胞的氧化还原状态,以利于自身的增殖。研究表明,在机体的抗氧化能力降低时,能增加病毒的感染几率或病毒的感染力增强,如在硒缺乏时,含硒的具有抗氧化作用的谷胱甘肽过氧化物酶和硫氧还蛋白还原酶活性降低,这时柯萨奇病毒感染力增强。当细胞处于氧化剂的作用下时能刺激HIV的复制和病毒蛋白的合成。随着大量研究的开展,越来越多的病毒感染被证实与宿主的氧化应激有关。猪繁殖与呼吸综合征病毒(PRRSV)是猪繁殖与呼吸综合征的主要病原,能诱发机体免疫抑制,造成免疫失败、继发感染其他疾病,给世界养猪业造成巨大经济损失。PRRSV体外与免疫细胞培养与细胞氧化应激之间的联系却尚未见报道。
技术实现要素:
:
本发明要解决的技术问题是提供一种一种PRRSV建立猪肺泡巨噬细胞(3D4/2)氧化应激体外模型的方法,为后续深入研究PRRSV的感染机制和开发应用于PRRSV感染的制剂提供技术平台和理论参考。
为解决上述技术问题,本发明采用以下技术方案:应用PRRSV建立猪肺泡巨噬细胞氧化应激体外模型的方法,采用PRRSV体外处理猪肺泡巨噬细胞,病毒浓度为TCID50是10-5.5/0.1mL的PRRSV病毒原液的100-10-3,处理时间为4-24h。
病毒浓度为TCID50是10-5.5/0.1mL的PRRSV病毒原液的10-1,处理时间为8h。
上述体外处理PRRSV建立猪肺泡巨噬细胞氧化应激模型的方法,包括以下步骤:
(1)设细胞对照组和病毒液组,细胞对照组加入无血清RPMI 1640培养液,病毒组加入等量用不含血清的RPMI 1640培养液稀释的病毒液,37℃,5%CO2培养箱中吸附2小时;弃去病毒液,PBS缓冲液清洗3次后加入含5%FBS的RPMI 1640培养液后继续培养;
(2)分别收集细胞上清液或细胞,用于测定表征氧化应激模型的相关指标。
猪肺泡巨噬细胞为3D4/2。
病毒液组中病毒浓度为TCID50是10-5.5/0.1mL的PRRSV病毒原液的100、10-1、10-2、10-3。
收集细胞上清液或细胞在培养后第4h、8h、12h、24h。
相关指标包括NO、ROS、GSH、GSSG、XOD、MPO和iNOS。
为研究PRRSV处理与宿主细胞氧化应激状态之间的联系,发明人以猪肺泡巨噬细胞(3D4/2)为研究对象,建立了一种体外应用PRRSV建立猪肺泡巨噬细胞氧化应激模型的方法,采用PRRSV体外处理猪肺泡巨噬细胞,病毒浓度为TCID50是10-5.5/0.1mL的PRRSV病毒原液的100-10-3,处理时间为4-24h。应用本发明,利用不同稀释度PRRSV作用不同时间,通过检测细胞存活率,NO释放,细胞内ROS水平,GSH和GSSG含量,XOD、MPO和iNOS活性,观察病毒处理后细胞内氧化还原状态的变化,可确定构建猪肺泡巨噬细胞(3D4/2)氧化应激模型的最佳条件,为后续研究PRRSV的感染机制和开发应用于PRRSV处理的制剂提供技术平台和理论参考。
附图说明
图1是PRRSV对3D4/2细胞存活率的影响图。
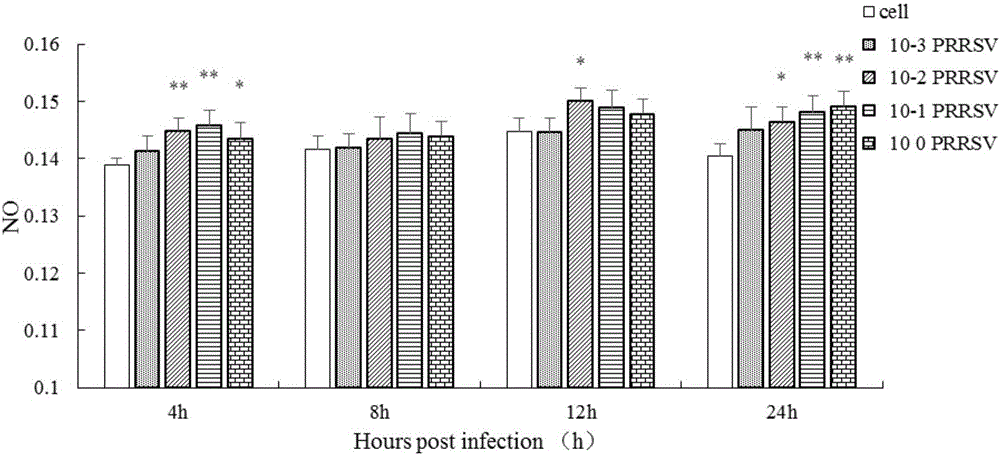
图2是PRRSV体外处理3D4/2细胞对NO分泌的影响图。
图3是PRRSV体外处理对3D4/2细胞内ROS水平的影响图。
图4是PRRSV体外处理对3D4/2细胞内GSH含量的影响图。
图5是PRRSV体外处理对3D4/2细胞内GSSG含量的影响图。
图6是PRRSV体外处理对3D4/2细胞内GSH/GSSG的影响图。
图7是PRRSV体外处理对3D4/2细胞内XOD活力的影响图。
图8是PRRSV体外处理对3D4/2细胞内MPO活力的影响图。
图9是PRRSV体外处理对3D4/2细胞内iNOS活力的影响图。
具体实施方式
一、研究思路
本发明通过PRRSV体外处理猪肺泡巨噬细胞(3D4/2),测定病毒处理后细胞分泌一氧化氮(NO)的水平、细胞内总活性氧(ROS)水平、还原型谷胱甘肽(GSH)含量、氧化型谷胱甘肽(GSSG)含量、黄嘌呤氧化酶(XOD)活性、髓过氧化物酶(MPO)活性、诱生型一氧化氮合酶(iNOS)活性,探讨PRRSV体外处理猪肺泡巨噬细胞与细胞氧化应激之间的关系,建立猪肺泡巨噬细胞氧化应激体外模型。
二、实验方法
(1)3D4/2细胞的实验分组与处理
分别设置细胞对照组和4个不同稀释度病毒液组(100、10-1、10-2、10-3),每组4个重复,用含5%FBS的RPMI 1640培养液调整细胞浓度为5×106/mL,按1000μL/孔加至24孔板内,培养过夜使细胞贴壁;第二天弃去原培养液,PBS缓冲液洗3次,细胞对照组加入无血清RPMI 1640培养液200μL,病毒组加入等量用不含血清的RPMI 1640培养液稀释的不同稀释度病毒液液,37℃,5%CO2培养箱中吸附2小时,期间每20分钟摇晃一次;弃去病毒液,PBS缓冲液清洗3次后每孔加入1mL含5%FBS的RPMI 1640培养液后继续培养,于第4h、8h、12h以及24h分别收集细胞上清液或细胞,用于NO、ROS、GSH、GSSG、XOD、MPO和iNOS等指标测定。其中,PRRSV病毒原液的TCID50为10-5.5/0.1mL。(2)MTT法检测细胞存活率
(a)取状态良好的细胞按4×105cell/mL接种于96孔板,每孔100μL,分组同前,培养过夜;
(b)弃去原培养液,细胞对照组加入不含血清的细胞培养液20μL,病毒组加入等量不同稀释度病毒液,置于37℃,5%CO2培养箱吸附2h;
(c)弃去各孔内液体,PBS清洗3次,每孔加入100μL含5%FBS的细胞维持液,37℃,5%CO2培养箱继续培养;
(d)44h后每孔弃去10μL上清液,加入10μL MTT(5mg/mL)溶液,37℃,5%CO2培养箱继续培养4h;
(e)弃去上清液,每孔加入100μL DMSO,摇匀使颗粒溶解后静置10min,用酶标仪测定490nm波长处吸光度值。
(3)Griess法测定细胞培养上清液中NO含量
取(1)中细胞培养上清液100μL至新的96孔细胞培养板,加入等量新鲜混合配制的Griess试剂,震荡混匀,室温避光反应10min,用酶标仪检测490nm处吸光度值,根据NaNO2标准曲线计算NO含量。
(4)荧光探针测定细胞内ROS水平
按(1)分组处理,弃去细胞培养液,PBS缓冲液洗2次,加入稀释好的DCFH-DA荧光探针(1∶1000无血清细胞培养液)200ul,37℃,5%CO2培养箱孵育30分钟;小心吸弃荧光探针,PBS缓冲液洗3次,每孔加入1000μL PBS缓冲液,收集细胞制成单细胞悬液,按每孔100μL吸至荧光酶标仪专用的黑色96孔板,用荧光酶标仪测定激发波长488nm,发射波长525nm处荧光值。
(5)荧光光度法测定细胞内GSH和GSSG含量
按(1)分组处理,弃去细胞培养液,PBS缓冲液洗2次,每孔加入1000μL PBS缓冲液,收集细胞至新的EP管中,4℃,12000个离心5分钟后收集细胞沉淀,每管加入400μL 5%三氯乙酸溶液,冰水浴超声破碎1分钟,4℃,12000g离心10min,吸取上清至新的EP管后,存于-80℃超低温冰箱,备用于GSH和GSSG检测。
GSH测定:取200μL上清加入3.6mL PBS-EDTA缓冲液(pH8.0)和200μL OPT溶液,充分混匀,室温孵育40分钟,用荧光酶标仪测定激发波长350nm,发射波长425nm处荧光值,并根据标准曲线计算含量。
GSSG测定:取100μL上清加入40μL NEM溶液(0.04mol/L)室温孵育30分钟,再加入1.9mL NaOH溶液(0.1mol/L)和100μL OPT溶液(1mg/ml),充分混匀,室温孵育15分钟,用荧光酶标仪测定激发波长337.8nm,发射波长421.6nm处荧光值,并根据标准曲线计算含量。
(6)分光光度法测定细胞内XOD、MPO和iNOS活性
按(1)分组处理,弃去细胞培养液,PBS缓冲液洗2次,每孔加入1000μL PBS缓冲液,收集细胞至新的EP管中,冰水浴超声破碎1分钟,4℃,12000g离心10min,吸取上清,分装保存于-80℃超低温冰箱,用于XOD、MPO和iNOS活力检测。使用紫外分光光度计严格按照XOD、MPO和iNOS测定试剂盒说明书进行操作,所有样品均在同一批测定中完成。
(7)数据统计分析
所测得数据用SPSS 21.0统计软件进行统计学处理。所有实验结果以均数±标准差表示,采用单因素方差分析进行统计学分析。以P<0.05表示为差异显著,P<0.01为差异极显著,P>0.05为差异不显著。
三、实验结果
1.PRRSV体外处理对3D4/2细胞存活率的影响
细胞存活率结果如图1所示,不同稀释度PRRSV体外处理3D4/2细胞,随着病毒浓度升高,细胞存活率逐渐下降,但均与细胞对照组差异不显著(P>0.05),均适用于造模的后续试验。
2.PRRSV体外处理3D4/2细胞对NO分泌的影响
NO分泌水平如图2所示,PRRSV体外处理3D4/2细胞能引起细胞NO分泌增加。与对照组相比,10-1稀释度病毒液体外处理3D4/2细胞4h、24h均能极显著升高细胞NO的分泌(P<0.01);10-2稀释度病毒液体外处理3D4/2细胞4h、12h和24h能极显著(P<0.01)或显著(P<0.05)升高细胞NO的分泌;病毒原液体外处理4h和24h分别能显著(P<0.05)和极显著(P<0.01)升高细胞NO的分泌。
3.PRRSV体外处理对3D4/2细胞内ROS水平的影响
细胞内活性氧水平如图3所示,PRRSV体外处理3D4/2细胞能升高细胞内ROS水平,一定范围内随着作用时间的延长ROS水平逐渐降低,随着病毒浓度升高ROS水平逐渐增加,且始终高于对照组。与对照组相比,10-1稀释度病毒液和病毒原液体外处理4h、8h、12h和24h均能极显著(P<0.01)升高细胞内ROS水平;10-2稀释度病毒液体外处理3D4/2细胞24h能极显著升高细胞内ROS水平(P<0.01)。
4.PRRSV体外处理对3D4/2细胞内GSH和GSSG含量的影响
细胞内还原型谷胱甘肽含量如图4所示,与对照组相比,不同稀释度PRRSV体外处理3D4/2细胞均能升高细胞内GSH含量。10-2稀释度病毒液、10-1稀释度病毒液和病毒原液处理均能显著(P<0.05)或极显著(P<0.01)升高细胞内GSH含量,其中10-3稀释度病毒液处理4h能显著(P<0.05)升高细胞内GSH含量。
细胞内氧化型谷胱甘肽含量如图5所示,PRRSV体外处理3D4/2细胞能升高细胞内GSSG含量。与对照组相比,10-1稀释度病毒液体外处理4h、8h、12h和24h均能显著(P<0.05)或极显著(P<0.01)升高细胞内GSSG含量;10-3稀释度病毒液体外处理12h和24h能极显著(P<0.01)和显著(P<0.05)升高细胞内GSSG含量;10-3稀释度病毒液体外处理8h和12h能显著(P<0.05)和极显著(P<0.01)升高细胞内GSSG含量;病毒原液体外处理4h和12h能显著(P<0.05)和极显著(P<0.01)升高细胞内GSSG含量。
细胞内氧化还原状态如图6所示,PRRSV体外处理3D4/2细胞能降低细胞内GSH/GSSG比值。与对照组相比,不同稀释度PRRSV体外处理3D4/2细胞4h均能显著(P<0.05)或极显著(P<0.01)降低细胞内GSH/GSSG比值;其中10-2稀释度病毒液处理12h能显著降低细胞内GSH/GSSG比值(P<0.05);10-1稀释度病毒液体外处理细胞24h能极显著降低细胞内GSH/GSSG比值(P<0.01);病毒原液体外处理8h能显著降低细胞内GSH/GSSG比值(P<0.05)。
5.PRRSV体外处理对3D4/2细胞内XOD、MPO和iNOS活力的影响
XOD活力如图7所示,PRRSV体外处理3D4/2细胞能升高细胞内黄嘌呤氧化酶活力。与对照组相比,10-1稀释度病毒液体外处理处理4h、8h和12h均能显著升高细胞内XOD活力(P<0.05);病毒原液在处理4h和24h能显著升高细胞内XOD活力(P<0.05)。
MPO活力如图8所示,PRRSV体外处理3D4/2细胞能升高细胞内髓过氧化物酶活力。与对照组相比,10-1稀释度病毒液处理所有时间段均能显著(P<0.05)或极显著(P<0.01)升高细胞内MPO活力;处理4h,10-3稀释度病毒液和病毒原液聚能显著升高细胞内MPO活力(P<0.05);处理12h,病毒原液能显著升高细胞内MPO活力(P<0.05)。
iNOS活力如图9所示,PRRSV体外处理3D4/2细胞能升高细胞内诱生型一氧化氮合酶活力。与对照组相比,10-1稀释度病毒液处理所有时间段均能显著(P<0.05)或极显著(P<0.01)升高细胞内iNOS活力;10-3稀释度病毒液处理4h显著(P<0.05)升高细胞内iNOS活力;10-2稀释度病毒液处理4h、8h和24h均能显著(P<0.05)或极显著(P<0.01)升高细胞内iNOS活力;病毒原液处理24h能极显著(P<0.01)升高细胞内iNOS活力。
四、研究结论
PRRSV体外处理猪3D4/2细胞能显著升高细胞内ROS水平。病毒处理4h时细胞内ROS水平达到峰值,后随着处理时间增加而逐渐降低,而且在一定范围内使用的病毒浓度越高细胞内ROS水平越高。其中10-1稀释度病毒液和病毒原液体外处理4h、8h、12h和24h均能极显著升高细胞内ROS水平;10-2稀释度病毒液体外处理3D4/2细胞24h能极显著升高细胞内ROS水平。结果提示PRRSV体外处理3D4/2细胞内诱导细胞内ROS水平增加,且呈一定的浓度依赖性,即细胞内ROS水平随处理的病毒浓度的升高而升高。
当病毒处理3D4/2细胞后,细胞内MPO和XOD活力升高,诱发机体产生氧化应激,但随着处理时间的增加,细胞内MPO和XOD水平逐渐降低,低浓度病毒处理的细胞内MPO和XOD活力趋向正常水平,可能是因为细胞在调动抗氧化系统来应对病毒处理引起的氧化应激。
PRRSV处理3D4/2细胞同样能显著增加细胞NO分泌水平和iNOS活性,且以10-1稀释度病毒处理的效果最显著。不同稀释度的PRRSV处理不同时间均能升高3D4/2细胞内GSH和GSSG含量,细胞通过增加GSH的表达来应对病毒的处理,但病毒的持续处理导致GSH不断被消耗,GSSG含量升高,使细胞内GSH/GSSG比值下降,导致细胞处于氧化应激状态。其中10-2稀释度病毒处理使细胞内GSH和GSSG含量升高最明显,GSH/GSSG比值显著低于细胞对照组。说明10-1稀释度病毒处理能显著改变3D4/2细胞内氧化还原状态,使细胞处于氧化应激状态。
因此,本发明成功建立了PRRSV体外处理3D4/2细胞氧化应激模型,并确立10-1稀释度PRRSV体外处理3D4/2细胞8h是建立模型的最佳条件。
- 还没有人留言评论。精彩留言会获得点赞!