一种柑橘轮斑病菌分子检测的引物及其检测方法与流程
本发明涉及农业生物技术领域,尤其涉及一种柑橘轮斑病菌分子检测的引物及其检测方法。
背景技术:
柑橘轮斑病(Citrus target spot)是2006年在我国柑桔产区的最北缘——陕西省城固县(107.3E,33.2N)新发现的一种毁灭性病害。该病仅在冬春季节发病,且温度越低病情越重,严重时,多个病斑联合成大斑,发病叶片易脱落直至整株死亡,甚至死树毁园。
柑橘轮斑病的病原菌为拟隐孢壳属的Cryptosporiopsis citricarpa sp.nov。主要为害柑橘的叶片和部分嫩枝。发病初期,叶面产生红褐色斑点,后随病斑逐渐扩大,变成近圆形红褐色病斑,病斑中部渐变为白色,叶片背面病斑边缘有黄色晕环。后期叶片背面病斑中央密生黑褐色茸毛状小点,呈轮纹状排列。严重时,多个病斑联合成大斑,发病叶片易脱落。
由于对柑橘轮斑病的认识水平所限,不能及早诊断,且长期以来防治效果不佳,造成了严重的经济损失。如果能够对该病害进行早期预测预报,在病害尚未表现出明显症状时,及时采取措施进行有效防治,防患于未然,对减少病害所造成的经济损失具有重要意义。
技术实现要素:
有鉴于此,本发明的目的之一是提供一种柑橘轮斑病菌分子检测的引物,从而解决柑橘轮斑病分子检测所使用的引物问题。
本发明通过以下技术手段解决上述技术问题:
一种柑橘轮斑病分子检测的引物,柑橘轮斑病分子检测的特异性上、下游引物为:
Cc-SP1-上游:CCTTTCACAATGAAGCAGGAATAG
Cc-SP1-下游:GTGGCTGTACCATCCTTAGAAA
和/或
Cc-SP2-上游:GCTGATTGAGTGCCCATAGA
Cc-SP2-下游:ACTCCAACCAACGAGATGATAG。
本发明的目的之二是提供一种柑橘轮斑病菌的检测方法,从而解决柑橘轮斑病不能在早期检测,且无快速准确检测方法的问题。
本发明通过以下技术手段解决上述技术问题:
柑橘轮斑病菌的检测方法,包括以下步骤:
S1:利用柑橘轮斑病菌中的2条特异基因组DNA序列在Primer Primier 6软件中设计并合成两对特异性上、下游引物Cc-SP1和Cc-SP2;
S2:将柑橘轮斑病菌的特异性引物Cc-SP1-上游、Cc-SP1-下游和与其相对应的1条基因组DNA加入PCR反应体系中,并在PCR反应条件下进行多个循环反应;
和/或将柑橘轮斑病菌的特异性引物Cc-SP2-上游、Cc-SP2-下游和与其相对应的1条基因组DNA加入PCR反应体系中,并在PCR反应条件下进行多个循环反应;
S3:PCR反应结束后,取5μL扩增产物在预先加入了Glodview的琼脂糖凝胶中,并在100V电压条件下电泳,在BIO-RAD凝胶成像系统上观察、拍照,若能够检测出224bp和/或389bp大小的片段,则可判断出所述的柑橘轮斑病菌。
进一步,在S2中,所述PCR反应体系总体积为20μL,其中10μL 2×Taq PCR Mix,终浓度0.2μmol/L的正向引物,终浓度0.2μmol/L的反向引物,100ng基因组DNA,超纯水补足20μL。
进一步,在S2中,所述PCR反应条件为94℃5分钟,94℃30秒,55℃30秒,72℃30秒,72℃10分钟,共35个循环。
进一步,在S3中,所述琼脂糖凝胶的浓度为1.0%,所述电泳时间为20min。
进一步,在S3中,所述224bp大小的片段的核苷酸序列为:
进一步,在S3中,所述389bp大小的片段的核苷酸序列为:
本发明的有益效果:首次建立了柑橘轮斑病菌的分子检测方法,本检测方法所需时间短、成本低且具有灵敏度高、特异性强、检测准确性高等特点;该检测系统可以用于柑橘轮斑病的病原菌接种和田间样品的特异分子检测以及早期快速诊断。
附图说明
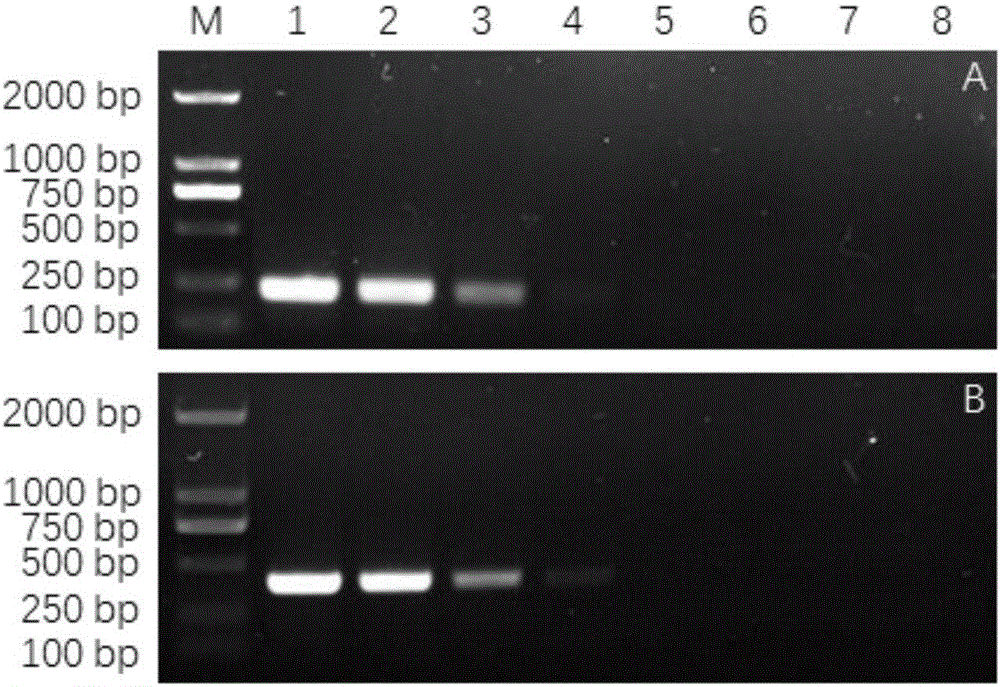
图1是引物Cc-SP1(A)与Cc-SP2(B)对供试菌株的PCR扩增电泳图,为柑橘轮斑病菌检测引物特异性验证结果图,其中,M:DL2 000 DNA marker;泳道1-9:C.citricarpa;Alternatia alternata;Colletotrichum gloeosporioides;Diaporthe citri;Alternaria tenuissima;Aspergillus japonicus;Phyllosticta capitalensis;Penicillium italicum;Penicillium digitatum。
图2是引物Cc-SP1(A)与Cc-SP2(B)对供试菌株的PCR扩增电泳图,为柑橘轮斑病菌特异引物灵敏度检测结果图,其中,M:DL2 000 DNA marker;泳道1-8:分别是在20μL的体系中含有100ng、10ng、1ng、100pg、10pg、1pg、100fg和10fg DNA的扩增结果。
具体实施方式
以下将结合附图对本发明进行详细说明:
实施例一:
利用RAPD技术筛选出柑橘轮斑病菌中的2条特异性的基因组DNA序列。通过NCBI数据库的Blast比对分析,未获得同源序列信息,表明所获得的基因组DNA序列特异性较高,并根据序列测定结果设计了特异上、下游引物:
Cc-SP1-上游:5’-CCTTTCACAATGAAGCAGGAATAG-3’
Cc-SP1-下游:5’-GTGGCTGTACCATCCTTAGAAA-3’
和
Cc-SP2-上游:5’-GCTGATTGAGTGCCCATAGA-3’
Cc-SP2-下游:5’-ACTCCAACCAACGAGATGATAG-3’。
实施例二:
利用SCAR-PCR技术建立了1对特异引物Cc-SP1的分子检测柑橘轮斑病菌的检测方法,包括以下步骤:
S1:利用柑橘轮斑病菌中的1条基因组DNA序列在Primer Primier 6软件中设计并合成特异性上、下游引物Cc-SP1-上游和Cc-SP1-下游,其中,
Cc-SP1-上游:5’-CCTTTCACAATGAAGCAGGAATAG-3’
Cc-SP1-下游:5’-GTGGCTGTACCATCCTTAGAAA-3’。
S2:将柑橘轮斑病菌的特异性引物Cc-SP1-上游、Cc-SP1-下游和与其相对应的1条基因组DNA加入PCR反应体系中,并在PCR反应条件下进行多个循环反应。所述PCR反应体系总体积为20μL,其中10μL 2×Taq PCR Mix,终浓度0.2μmol/L正向引物,终浓度0.2μmol/L反向引物,100ng基因组DNA,超纯水补足20μL。所述PCR反应条件为94℃5分钟,94℃30秒,55℃30秒,72℃30秒,72℃10分钟,共35个循环。
S3:PCR反应结束后,取5μL扩增产物在预先加入了Glodview的浓度为1.0%琼脂糖凝胶中,并在100V电压条件下电泳20min,在BIO-RAD凝胶成像系统上观察、拍照;若能够检测出224bp大小的片段,则可判断出所述的柑橘轮斑病菌。
所述224bp大小的片段的核苷酸序列为:
实施例三:
利用SCAR-PCR技术建立了1对特异引物Cc-SP2的分子检测柑橘轮斑病菌的检测方法,包括以下步骤:
S1:利用柑橘轮斑病菌中的1条基因组DNA序列在Primer Primier 6软件中设计并合成特异性上、下游引物Cc-SP2,其中,
Cc-SP2-上游:5’-GCTGATTGAGTGCCCATAGA-3’
Cc-SP2-下游:5’-ACTCCAACCAACGAGATGATAG-3’。
S2:将柑橘轮斑病菌的特异性引物Cc-SP2-上游、Cc-SP2-下游和与其相对应的1条基因组DNA加入PCR反应体系中,并在PCR反应条件下进行多个循环反应。所述PCR反应体系总体积为20μL,其中10μL 2×Taq PCR Mix,终浓度0.2μmol/L正向引物,终浓度0.2μmol/L反向引物,100ng基因组DNA,超纯水补足20μL。所述PCR反应条件为94℃5分钟,94℃30秒,55℃30秒,72℃30秒,72℃10分钟,共35个循环。
S3:PCR反应结束后,取5μL扩增产物在预先加入了Glodview的浓度为1.0%琼脂糖凝胶中,并在100V电压条件下电泳20min,在BIO-RAD凝胶成像系统上观察、拍照;若能够检测出389bp大小的片段,则可判断出所述的柑橘轮斑病菌。
所述389bp大小的片段的核苷酸序列为:
实施例四:
如图1-2所示,为验证柑橘轮斑病原菌的分子检测引物及其检测方法的使用效果,进行以下实验:
S1:采用常规植物病原鉴定技术,分别对能够引起柑橘病害的柑橘轮斑病菌(C.citricarpa)、柑橘褐斑病菌(Alternatia alternata)、柑橘炭疽病菌(Colletotrichum gloeosporioides)、柑橘黑点病菌(Diaporthe citri)、柑橘煤污病菌(Alternariatenuissima)、日本曲霉(Aspergillusjaponicus)、柑橘黑斑病菌(Phyllosticta capitalensis)、柑橘青霉菌(Penicillium italicum)和柑橘绿霉菌(Penicillium digitatum)进行分离培养,获得各病原菌纯化菌株。
S2:提取各病原菌纯化菌株的DNA备用。
收集约1g病原菌菌丝并采用液氮进行研磨,然后采用CTAB溶液(2%(w/v)CTAB,100mmol/L Tris-HCl(pH 8.0),20mmol/L EDTA,1.4mol/L NaCl,40mmol/Lβ-巯基乙醇)对液氮冷冻条件下充分研磨的菌丝在65℃条件下孵育60分钟,其间不时摇动。随后加入等体积氯仿轻缓颠倒混匀,室温条件下12000r/min离心10分钟。吸取上清液并加入等体积异丙醇,混匀后-20℃静置30分钟。室温条件下12000r/min离心10分钟,去上清液,沉淀用75%乙醇漂洗。待DNA风干后加入100uL的TE缓冲液(10mmol/L Tris-HCl,1mmol/L EDTA)溶解备用。
S3:检测引物特异性的验证,以S3步骤中的各病原菌纯化菌株的DNA为模板,在PCR反应条件下进行多个循环反应。所述PCR反应体系总体积为20μL,其中10μL 2×Taq PCR Mix,终浓度0.2μmol/L正向引物,终浓度0.2μmol/L反向引物,100ng基因组DNA,超纯水补足20μL。所述PCR反应条件为94℃5分钟,94℃30秒,55℃30秒,72℃30秒,72℃10分钟,共35个循环。
S4:检测体系的灵敏度验证,将柑橘轮斑病菌基因组DNA从100ng/μL开始依次10倍稀释至10fg/μL,各浓度取1μL为模板利用优化的体系进行扩增。
结果分析:
检测引物特异性的验证结果如图1所示,仅柑橘轮斑病菌C.citricarpa的泳道分别有224bp(Cc-SP1)和389bp(Cc-SP2)的目的条带扩增出来,表明所设计的引物是特异性引物,能够从众多柑橘病原菌中检测出柑橘轮斑病菌。
检测体系的灵敏度验证结果如图2所示,2对特异性引物Cc-SP1和Cc-SP2均能从质量浓度为100pg/μL及以上的模板中扩增出相应大小的特异性条带,而未能在稀释至100pg/μL以下的模板DNA及对照中扩增到特异性条带。
以上实施例仅用以说明本发明的技术方案而非限制,尽管参照较佳实施例对本发明进行了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的宗旨和范围,其均应涵盖在本发明的权利要求范围当中。
- 还没有人留言评论。精彩留言会获得点赞!