一种小麦花粉管转基因育种方法与流程
本发明属于遗传育种技术领域,具体涉及一种改进后的小麦花粉管转基因育种方法。
背景技术:
关于花粉管通道,王艳杰等人(花粉管通道法转基因技术的细胞胚胎学机理探讨,西北植物学报,2006,26(3):0628-0634)认为,花粉管通道是花粉管在相关组织中生长时,将周围组织的细胞挤压,从而使花粉管与相应组织的细胞之间形成的缝隙。花粉管通道法(pollen-tube pathway)就是将供体生物的DNA片段,在受体自花授粉后一定时期,使其沿着花粉管的通道进入胚囊转化受精卵或其前后的细胞(卵细胞和早期胚细胞)而自然发展成种子。
花粉管通道法自创立以来,在玉米、水稻、棉花等多种农作物育种上取得了显著成绩,因为该法是外源DNA或单基因导入植物简便有效的途径,其成本低廉,因而尤其适合我国广大育种工作者作为育种的新方法,在国内得到了较为快速的推广和发展。
关于花粉管通道法,现有研究一般认为,其主要优势有以下几点:
(1)可直接得到转化种子,不依赖植物组织培养或诱导再生植株等一整套人工培养过程,一般不会形成嵌合体,纯合速度快;
(2)由于花粉管通道是天然存在的普通现象,故利用花粉管通道法进行外源基因的遗传转化,可基本上应用于任何开花植物,进行任何物种之间包括人工合成基因的转移,从而极大的扩大了基因工程的目的基因的来源和受体植物的范围;
(3)操作简便、经济,易于常规育种者掌握,适合大规模的农作物遗传转化;由于直接获得转基因植株,在进行转基因目标性状和转基因分子鉴定的同时,即可针对转基因植株的农艺性状进行定向筛选,故能够与转基因育种直接结合,使形成转基因农作物新品种的效率得到提高,育种周期大幅缩短;
(4)转化频率高,效果好,变异广泛,为育种提供了大量有价值的种质资源;
(5)该方法利用了整体植株的卵细胞、受精卵或早期胚胎细胞进行转化,直接获得的产品即是转基因植株;因此,在转基因表达的目标性状鉴定上,完全可以直接针对目标性状的表现型进行,从而避免在植物组培的鉴定过程中,大量依赖抗生素进行筛选的弊端。
但是,花粉管通道法也有一些较为明显的缺陷,主要有如下几点:
(1)进行外源基因转化目标植物的工作时间受自然花期限制,同时必须充分了解每一种植物的开花受精的时间和过程;
(2)花粉管通道法操作的经验性较强,需要一定的技术摸索和技巧;
(3)对单籽粒的小花农作物操作难度较大,需要大量的、浓度高的质粒,工作量大,成本高,限制其在生产上的规模化应用。
由于上述缺陷,因而一定程度上严重的限制了花粉管通道法在转基因育种尤其是小花植物(例如小麦)育种中的大规模应用,本发明系统化了小麦花粉管转基因的方法,并对质粒提取方法进行改进,提取质粒浓度高且成本低,并成功把外源质粒导入小麦中。
技术实现要素:
本发明目的在于提供一种改进后的小麦花粉管转基因育种方法,从而为花粉管通道法在农作物分子育种中的应用提供借鉴和参考。
本发明所采取的详细技术方案如下所述。
一种小麦花粉管转基因育种方法,包括以下步骤:
(1)采用热击法将含目标基因的表达质粒转入大肠杆菌感受态细胞,进行热激转化,转化后加入培养液进行抗性筛选,获得重组后菌株;
(2)采用玻璃珠悬起菌落法快速提取质粒,具体过程为:
首先,将步骤(1)中筛选所得重组菌株接种于含有抗性抗生素的平板培养基上,进行培养;
其次,在平板上加入无菌水和灭菌的玻璃珠摇晃,利用玻璃珠悬起菌落,并将含有菌落的无菌水进行离心,保留沉淀细胞;
最后,将沉淀细胞进行裂解,利用氯仿-异戊醇混合液,离心提取质粒;
(3)利用花粉管通道法转化受体小麦,具体为:
在小麦开花前,按照常规杂交育种的方法进行整穗、去雄、套袋;在去雄2 ~ 3天后,人工授粉;
在小麦授粉1.5~2h后剪去约三分之一的柱头,然后在剪切后的柱头上滴加步骤(2)中所提取的质粒;每个柱头的上质粒的滴加量具体可设计为:100 μg/mL、10μL;
优选情况下,在柱头上初次滴加质粒后1h重复滴加一次;
滴加质粒后,套袋,做好标记,继续培育,自然结实后收获小麦种子,对所收获的小麦的种子进一步培育、筛选获得相应的转基因植株。
本发明所提供的小麦花粉管转基因方法,通过对质粒提取方法的优化,大大提高了获得大量质粒的效率,从而为花粉管通道法在小花农作物如小麦中的大规模应用奠定了基础。相较于现有的花粉管通道法在小麦转基因育种中的应用,本发明中质粒提取便捷、快速,成本低廉,且省工省时,能够较好提高工作效率,因而对于小麦新品种的培育具有较好地促进作用。
附图说明
图1为100mg/L的潮霉素涂抹筛选,上图中是表现潮霉素抗性,下图中是没有表现潮霉素抗性;
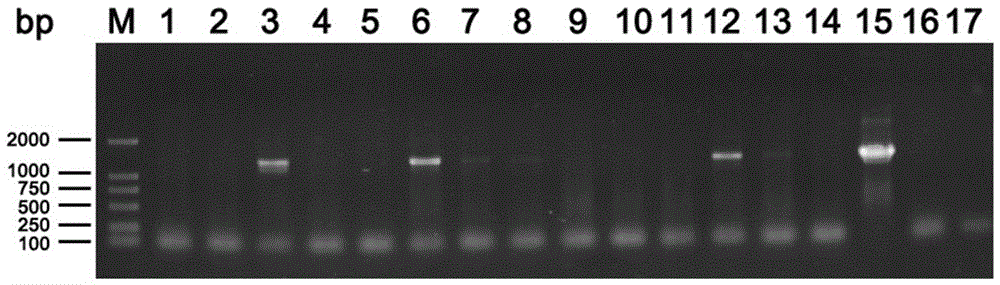
图2 为转化植株Tri101基因PCR鉴定;其中泳道 M : DNA Marker DL2000;泳道1-13: 样品;泳道14: pCAMBIA1301S空载体对照;泳道15: 阳性对照;泳道16: 阴性对照;泳道17: 空白对照(水);
图3为转化植株GUS染色鉴定,其中A为阳性植株,B为阴性植株。
具体实施方式
下面结合实施例对本发明做进一步的解释说明。介绍具体实施例前,对本发明中涉及的部分物料及试验设备情况简要介绍说明如下。
生物材料:
大肠杆菌JM109购于TaKaRa公司;
质粒pCAMBIA1301S,由华中农业大学作物遗传改良国家重点实验室涂金星教授赠予;该质粒载体含有35S启动子元件、潮霉素抗性元件和GUS基因表达元件,可用于对阳性植株的筛选和鉴定;
豫麦18、郑麦366,均为商品化小麦品种;
实验试剂:
溶液I,每升溶液中的组份为:1M Tris-HCL(pH=8.0)、50mL,0.5M EDTA、20mL,其余为ddH2O,pH=7.5,高温灭菌;
溶液II,0.4M 的NaOH的ddH2O溶液与质量浓度2%的SDS的ddH2O溶液的等体积混合液;0.4M 的NaOH的ddH2O溶液可由8g NaOH 溶于500mL的ddH2O中配制而成,质量浓度2%的SDS的ddH2O溶液可由10g SDS溶于500mL的ddH2O中配制而成;需要强调的是,溶液II需现配现用;
溶液III,每升溶液的制备方法为:在600mL的ddH2O中依次加入129.69g的KAc和100mL冰乙酸,溶解并混合均匀后,乙酸调节pH=4.8,然后用ddH2O定容至1L,pH=4.8;
LB培养液:10 g 胰蛋白胨,5 g酵母提取物,10 g NaCl,双蒸水定容至1000mL(LB平板培养基另外加入15g 琼脂),高压灭菌后4℃保存。
实施例
禾谷镰刀菌Tri101基因可以编码一种单端孢酶烯3-O-乙酰转移酶,这种酶可通过加乙酰基的形式来降解赤霉病毒素,从而降低小麦赤霉病的发病率。本实施例以重组有禾谷镰刀菌Tri101基因的植物表达载体(重组质粒pCAMBIA1301S-Tri101)的大量质粒提取和花粉管通道法转化小麦操作为例,对本申请所述小麦花粉管转基因育种方法进行了具体介绍。详细过程说明如下。
(一)首先,将欲转化基因(目的基因 Tri101基因)片段整合进入质粒基因组中,然后,采用热击法将含目标基因的表达质粒转入大肠杆菌感受态细胞,进行热激转化,转化后加入培养液进行抗性筛选,以获得重组菌株。具体过程为:
(1)首先,设计引物对,并利用PCR技术扩增获得Tri101基因;
根据Tri101基因序列设计如下引物对(引物由上海生工生物工程股份有限公司合成):
Z-Tri101-F:5′-TCTAGAATGGCTTTCAAGATACAGCT-3′
(5’端TCTAGA序列为引入的XbaI酶切位点),
Z-Tri101-R:5′-GGATCCCTAACCAACGTACTGCGCAT-3′(5’端GGATCC序列为引入的BamHI酶切位点);
25µL PCR扩增体系:
10×Buffer(Mg2+ free),2.5 μL;
MgCl2(25mM),2.5 μL;
dNTP(10mM),0.4 μL;
Z-Tri101-F(10µM),1 μL;
Z-Tri101-R(10µM),1 μL;
rTaq DNA聚合酶(0.5U/μL),0.2 μL
Tri101基因DNA(10ng/µL),6 μL;
ddH2O,11.4 μL;
扩增条件:94℃预变性3 min;94℃变性1 min,55℃退火1 min,72℃延伸1 min, 进行30个循环;72℃延伸10 min,10℃保持。
PCR产物用1%的琼脂糖凝胶电泳检测,利用DNA凝胶回收试剂盒回收目的DNA片段。
(2)酶切,连接,构建重组质粒,具体为:
用XbaI、BamHI双酶切回收后目的DNA片段,回收约1500 bp左右的片段,与经同样酶切的表达载体pCAMBIA1301S并回收的酶切产物进行连接,在T4连接酶的作用下于16℃过夜连接;
酶切体系设计如下:
10×Fast Digest buffer,6μL;
pCAMBIA1301S质粒(或PCR扩增产物),2μg、20μL;
XbaI,1U/L 、2μL;
BamHI,1U/L 、2μL;
ddH2O,30 μL;
连接体系设计如下:
10×T4 DNA 连接缓冲液,1μL;
Tri101基因片段,7μL;
pCAMBIA1301S载体,1μL;
T4 DNA 连接酶,1μL。
(3)热击转化:采用热击法将上述连接产物(含有目标基因的重组表达质粒)转化大肠杆菌JM109感受态细胞,具体转化过程为:
取2μL 含目标基因表达质粒加入100 μL感受态细胞中,轻轻混匀,冰上放置10 min;
42℃水浴锅中热击细胞50 s,迅速放置冰上90 s,然后室温放置10 min;
向管中加入100 μL预热至37℃的LB培养液,37℃培养1 h(140 r/min振荡培养),同时将LB平板置于37℃温育30 min,然后加入44 μL IPTG/X-gal(4 μL IPTG和40 μL X-gal)均匀涂布于LB平板表面放置片刻,使之吸附渗透;
将37℃培养1 h后的细胞/SOC培养液加到涂好IPTG/X-gal的LB平板表面放置片刻使之吸附;最后将平板置于37℃培养12~16 h。
培养结束后,提取质粒,送生工生物工程(上海)股份有限公司对重组后的质粒进行测序,测序正确的阳性克隆命名为pCAMBIA1301S-Tri101。
(二)采用玻璃珠悬起菌落法快速提取质粒
(1)制备细胞,具体为:
挑取上述鉴定正确的重组表达载体pCAMBIA1301-Tri101单菌落接种于含有抗性抗生素的液体培养基中,扩大培养(具体为,首先接种于2mL含有LB/Kan(Kan的浓度为0.1mg/mL)培养液中,37℃培养3~4h后,于50mL的离心管中扩大培养4~6h);
吸取扩大培养后的菌液涂布于含有抗性抗生素的固体培养基的平板上,培养过夜(具体为,吸取扩大培养后的菌液50μL或按4倍稀释成200μL涂布于新的LB/ Kan平板培养基上(平板直径15cm,Kan的浓度为0.1mg/mL),37℃过夜培养(12~16h));
在平板上加入无菌水和灭菌的玻璃珠摇晃,利用玻璃珠悬起菌落(具体为,在上述长满菌落(过夜培养后,平板培养基中菌落基本可长满至整个平板)的培养基中加入4mL灭菌水然后放入灭菌的玻璃珠摇晃);
待培养基中无菌落残留时,用移液枪将含有菌落的无菌水吸出,置于离心管中,离心弃上清,保留沉淀(具体为,分别置于4个2mL的离心管中,12000 g离心5 min,弃去上清,保留沉淀);
(2)裂解细胞,具体为:
在步骤(1)中离心后沉淀中加入600µL溶液I,在震荡器上剧烈震荡重悬菌体,静置5min;
然后加入600µL溶液II,轻轻颠倒数次,彻底混匀,至溶液变清亮为止,混匀过程中应确保离心管的整个内壁与溶液II 充分接触,混匀后冰上放置5 min;
最后加入600µL溶液III,轻轻颠倒数次,混匀过程中看到絮状物时轻弹离心管使之均匀,同时,混匀过程中注意使溶液III在粘稠的细胞裂解物中分散均匀,混合均匀后冰上放置5min;
(3)提取质粒,具体为:
将步骤(2)中冰上放置后溶液离心(具体为,4℃、12000 g离心10 min),弃沉淀,取上清液于新的2mL离心管中,加入等体积量的氯仿-异戊醇混合液,混合均匀,放置20min;所述氯仿-异戊醇混合液中,以体积比计,氯仿:异戊醇=24:1;
将放置后混合液离心(具体为,4℃、12000 g离心10 min),取上清液置于预先加有无水乙醇的新的2mL离心管中,离心(具体为,4℃、12000 g离心10 min),弃上清,对离心后沉淀物再用体积分数75%的乙醇漂洗两次后,即为所提取的质粒;
离心管中预先加入的无水乙醇的量为上清液2倍体积的量,所加入无水乙醇为-20℃预冷的无水乙醇;
所提取的质粒在干燥后,溶于1mL TE缓冲液中,测量浓度后稀释溶解为浓度100 μg/mL, -80℃保存备用。
(三)利用花粉管通道法转化受体小麦
具体为:
以河南地区为例,10月初,将豫麦18和郑麦366种植在试验田内(试验田位于原阳县),按照正常田间管理;
在小麦开花前,按照常规杂交育种的方法进行整穗、去雄、套袋;在去雄2 ~ 3天后,人工授粉;
在小麦授粉2h后剪去约三分之一的柱头,然后在剪切后的柱头上滴加步骤(二)中所提取的质粒;每个柱头的上质粒的滴加量为10μL、100 μg/mL;
在柱头上初次滴加质粒后1h重复滴加一次;
滴加质粒后,套袋,做好标记,继续培育,自然结实后收获小麦种子。
对所收获的小麦的种子进一步培育、筛选获得相应的转基因植株。
(四)小麦阳性单株的鉴定和筛选
对所收获的小麦种子进行阳性单株的鉴定和筛选,主要包括初步的潮霉素抗性筛选、后续的PCR鉴定以及GUS染色鉴定,鉴定过程中设置未进行花粉管转化的小麦种子豫麦18(CK)和郑麦366(CK)作为对照。
小麦种植过程中,培育条件为:
光周期为16 小时光照和8 小时黑暗,光照强度500μmol/m2/s,
苗期光照时温度为20℃、黑暗时温度为15℃;
孕穗及灌浆期光照时温度为30℃、黑暗时温度为20℃。
具体筛选过程和结果如下:
(1)潮霉素抗性初步筛选
对移栽温室3周的小麦幼苗,用100mg/L的潮霉素涂抹其第四片叶子,涂抹后继续正常培育。一周后,观察涂抹过潮霉素幼苗叶片的变化。
非转基因单株其涂抹过潮霉素叶片部分开始逐渐黄化,两周(14天)后黄化面积达到80%以上;转基因阳性单株涂抹过潮霉素叶片会一直保持绿色生长。
对所有叶片颜色保持绿色的小麦幼苗(初步认为其对潮霉素具有抗性)挂牌标记。
鉴定结果如图1所示,初步表明利用本方法可以将外源DNA转化受体小麦中。
(2)目标基因PCR鉴定
对步骤(1)中初步筛选得到的转基因小麦进行叶片DNA提取,然后进行目标基因Tri101 PCR扩增鉴定。
PCR扩增设置空载体(质粒pCAMBIA1301S)对照和空白对照(水)。
PCR扩增引物序列、扩增体系及PCR反应程序参考前述步骤(一)中Tri101基因的获得过程。
PCR扩增产物用1%的琼脂糖凝胶电泳检测。
相关结果如图2所示,含有Tri101基因的转基因植株可扩增出约1500bp的条带,而空载体对照、阴性对照和空白对照(水)均无目的条带。
(3)GUS染色鉴定
将PCR鉴定阳性的转基因小麦幼苗叶片浸泡在GUS染液中,37℃染色过夜;然后用70%乙醇脱色2~3次,直至阴性对照材料呈白色。
显微镜下观察,结果如图3所示,图中有显著蓝色着色的位置即为GUS表达位点。结果表明,GUS基因在小麦植株内表达。利用本发明改进后的花粉管介导的转基因方法可以使外源DNA片段Tri101成功转入受体植株中。
转化频率和转化效率统计
统计各小麦品种的转化效率,结果如下表所示。其中:转化效率=(获得T0 代PCR阳性植株/成活植株)×100%;
。
上表结果表明,利用花粉管介导的小麦转基因方法,在豫麦18和郑麦366为受体的小麦品种中均能得到阳性植株,其转化率分别为0.97%和1.15%。
就基因转化频率而言,利用现有常规基因枪转基因方法中,其转化频率因作为品种及基因形状差别,转化频率差别较大,但也普遍低于1.0%。例如,王海风等利用基因枪介导的转基因方法成功的把ZmalI基因导入小麦植株中,其用基因枪轰击了约3000个幼胚,获得再生植株59株,通过PCR检测鉴定16株为阳性苗,转化率为0.53%(基因枪法介导转ZmalI基因小麦植株的获得和鉴定.西北农林科技大学学报,2011 (8):90-94);周鹏等利用基因枪法轰击约1680个小偃22幼胚愈伤组织,成功得到转bar基因的阳性植株6株和转KN2基因的阳性植株4株,其转化率分别为0.36%和0.24%(基因枪法介导KN2基因小麦植株的获得和鉴定.西北农林科技大学学报,2014,42(1):83-88);权军利等利用高效蔗糖高渗基因枪转化受体系统将HAL1基因成功导入黄淮麦区3个优良品种(系)小偃一号、千斤早和9848,转化效率平均达到0.90%左右(普通小麦基因枪转化高效受体系统的建立. 西北农林科技大学学报,2007,35(7):117-122)。
从上述对比可以看出,本申请所提供的转基因操作方法,在不考虑基因本身及作物品种差别时,基因转化频率相对较高。同时,相较于现有基因枪操作方法的较高操作成本而言,本发明通过改进质粒提取操作方法,优化操作流程,在较好降低操作成本的同时,省工省时省力,较好提高了工作效率。加上花粉管介导的转基因操作方法在规模化农作物遗传育种中的天然优势,使得本申请在小麦新品种培育中具有较好地应用价值。
- 还没有人留言评论。精彩留言会获得点赞!