一种来源于马粪海胆生殖腺的水溶性多糖的制备方法及其应用与流程
本发明涉及一种马粪海胆生殖腺多糖的制备方法及其抗肿瘤应用,属于医药技术领域。
背景技术:
多糖是由单糖通过苷键聚合而成的一类高分子化合物,广泛分布于动植物及海洋生物体内,在治疗心血管疾病、抗肿瘤、抗肝炎和抗衰老等方面具有独特的生物活性,因此对糖类的研究一直十分活跃。
由于高盐、高压、低温、缺氧等特殊环境,海洋生物体内常代谢出结构独特和活性显著的物质,近年从海洋动物得到多种活性多糖类物质。海胆是棘皮动物门海胆纲生物,在我国沿海海域分布广泛,能食用的经济型海胆主要为紫海胆(Anthocidaris crassispina)、光棘球海胆(Strongylocentrotus nudus)和马粪海胆(Hemicentrotus pulcherrimus)等几个品种。海胆壳棘作为中药使用历史悠久,具有“软坚散结,化痰消肿,消瘰疬痰核,积痰不化,胸肋胀痛”之功效。黄色的海胆生殖腺在海胆繁殖期发育成熟,含有丰富的不饱和脂肪酸、氨基酸和微量元素等营养成分,是一种高级海洋食品资源。近年发现,海胆生殖腺含有的多糖类成分具有降血脂、抑制胃溃疡、增强机体免疫机能等多种生理活性,具有很高的药用价值。
多糖由单糖聚合而成,随着聚合程度增加,分子量增加,水溶性随之降低,升高水温可提高溶解度。目前海胆中发现的多糖的分子量多为百万级,分子聚合程度高,因此提取温度设置在80℃-100℃,以增加多糖溶解度。升高温度可提高多糖的提取效率,但提取液中的杂质增多,将影响多糖的纯化效果,也增加后期纯化工序,造成多糖的损耗。
另外,多糖是高分子化合物,同蛋白质一样存在高级结构,且与其活性密切相关,长时间加热可能会改变其高级结构,影响其生物学活性。
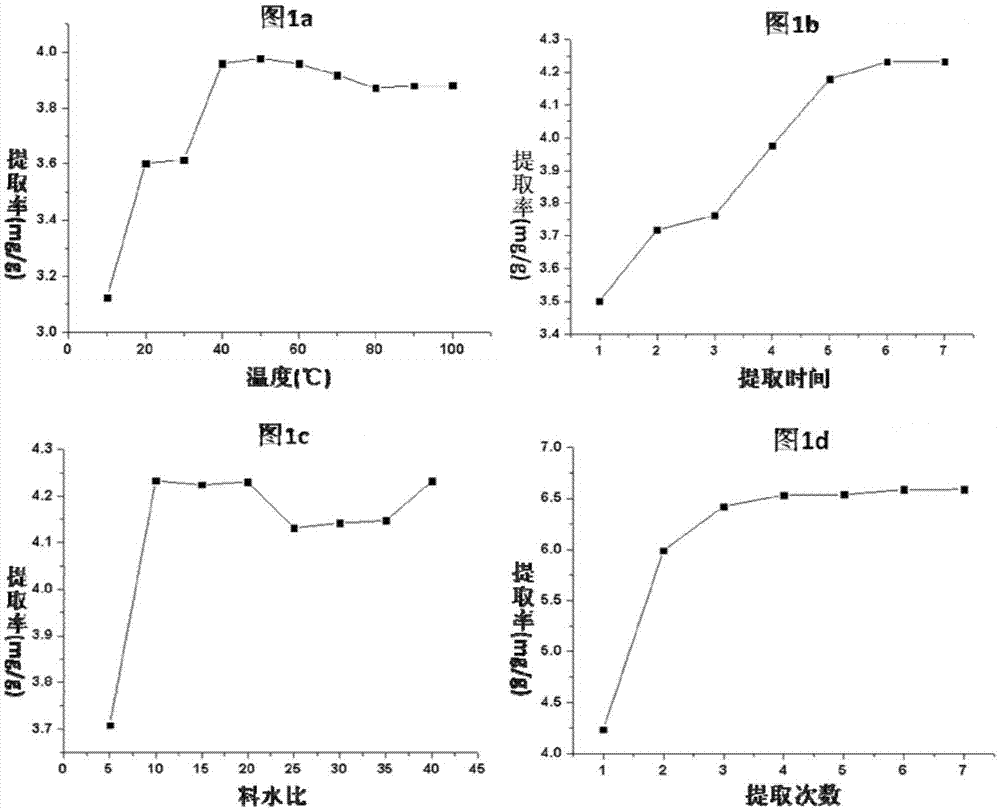
不同种系的海胆体内代谢产生的多糖结构不同,理化性质不同,本发明涉及的多糖是从马粪海胆生殖腺中提取和纯化得到。优化提取方法的实验结果表明,较低温度下(40-50℃)和10倍量水即达最佳提取效率(图1),这说明马粪海胆所含多糖易溶于水,低于常规温度可实现高效提取。
平行实验比较了50℃与90℃水提多糖的各项参数,低温提取具有以下优点:
(1)提取液透明度更高,所含杂质更少,不仅简化后期纯化工序,而且低温提取减少能耗,极大的降低生产成本。
(2)低温获取的多糖提取液稳定性更好,久置无沉淀析出。经同样纯化方法所得多糖为白色粉末,常温下易溶于水,利于进一步纯化和生物学活性筛选实验。
(3)多糖产品的水溶性好,水溶液稳定,不仅具有更好的生物利用度,也有利于后期药物不同剂型的设计与开发。
(4)低温获取的总多糖及其经柱色谱分离纯化得到的两个多糖对肿瘤细胞BEL-7402、Panc-28、U20S、HepG2、SGC7901和THP-1均有不同程度的抑制作用(图3-图8),而90℃提取得到的总多糖对上述细胞未表现出抑制活性。
在发现马粪海胆所含多糖常温下易溶于水的基础上,本发明系统性筛选并确定了一种海胆多糖的高效、低成本的提取和纯化方法,与高温水提多糖相比,本发明所得多糖具有更好的水溶性、稳定性及抗肿瘤活性。目前国内外鲜有探讨提取温度对多糖活性影响的研究。
技术实现要素:
本发明旨在提供一种从马粪海胆生殖腺中提取的水溶性多糖,并同时公开了所述水溶性多糖的提取制备方法,本发明的水溶性多糖常温下易溶于水,具有良好的水溶性、稳定性及抗肿瘤活性;本发明还同时提供了所述水溶性多糖在抗肿瘤药物中的应用。
为此,本发明所采用的技术方案是:
一种来源于马粪海胆生殖腺的水溶性多糖的制备方法,其特殊之处在于,将新鲜马粪海胆的黄色生殖腺粉碎后,依次经过丙酮脱脂、短时高温水灭活酶、低温水提,水提液合并后减压浓缩,而后经酶解、脱蛋白,再经透析、醇沉、干燥后得到总多糖(HPP);总多糖水溶后,经Sephacryl S-300凝胶柱色谱分离纯化得到两个多糖(HPP-1和HPP-2)。
以上提取过程按如下具体步骤进行:
a、取新鲜马粪海胆的海胆生殖腺,粉碎后用丙酮脱酯,获得海胆黄脱脂粉末;
b、脱脂粉末用2倍量体积的90-100℃热水处理10-30min;而后加入8倍量体积的20-60℃水中提取2-6小时,再用10-20倍量体积的20-60℃水提取2-3次,合并提取液浓缩至总体积的二分之一;
c、按脱脂粉末:蛋白酶=100:(4-8)的质量比,向步骤b获得的浓缩液中加入木瓜蛋白酶,酶解20-30h,加热灭活后再用Sevage法除蛋白10-15次,用旋转蒸发仪减压浓缩;
d、步骤c得到的多糖水溶液经流动蒸馏水透析,透析后的水液加入4倍量无水乙醇,离心得多糖沉淀,用无水乙醇洗涤、干燥得马粪海胆总多糖HPP;
e、将步骤d所得粪海胆总多糖配制成50mg/ml的水溶液,用Sephacryl S-300凝胶柱色谱分离,双蒸水为流动相洗脱,每10ml收集一管,苯酚-硫酸法测定每管多糖含量,根据洗脱曲线合并洗脱液,冷冻干燥得到两个马粪海胆多糖,分别命名为HPP-1和HPP-2。
更为具体的,本发明的提纯步骤为:
a、选取6-9月份新鲜采集的马粪海胆,剥开外壳,取其黄色的海胆生殖腺,用组织匀浆机充分粉碎,加入1-2倍量体积的无水丙酮,常温搅拌脱酯,重复脱脂7-10次,离心,充分干燥后,获得海胆黄脱脂粉末;
b、向脱脂粉末加入2倍量体积的水,加热至90-100℃维持10-30min;而后加入8倍量体积的水维持20-60℃提取2-6h,再用10-20倍量体积的水维持20-60℃提取2-3次,合并提取液浓缩至总体积的二分之一;
c、按脱脂粉末:蛋白酶=100:(4-8)的质量比,向步骤b获得的浓缩液中加入木瓜蛋白酶,于50-60℃酶解20-26h,再将体系加热升温至85-95℃灭活10-15min,离心收集上清液;上清液用其体积分数值1/5的Sevage试剂(氯仿:正丁醇=4:1)萃取10-15次,弃下层溶剂和变性蛋白,上层水溶液用旋转蒸发仪减压浓缩;
d、步骤c得到的多糖水溶液装入孔径为3500Da的透析袋,经流动蒸馏水透析24h,向透析后的多糖水溶液中加入4倍量体积的无水乙醇,静置12h,离收集沉淀,用无水乙醇洗涤3-5次,干燥后获得马粪海胆总多糖HPP;
e、将步骤d所得粪海胆总多糖配制成50mg/ml的水溶液,用Sephacryl S-300凝胶柱色谱分离,双蒸水为流动相洗脱,每10ml收集一管,苯酚-硫酸法测定每管多糖含量,根据洗脱曲线合并洗脱液,冷冻干燥得到两个马粪海胆多糖,分别命名为HPP-1和HPP-2。
上述方法制备的海胆总多糖纯度达90%,常温下水溶性好,水溶液透光率高。经Sephacryl S-300凝胶柱色谱分离纯化得到的两个多糖及总多糖均能抑制肿瘤细胞的增殖,均有较好的抗肿瘤作用,可开发成无毒副作用的抗肿瘤药物。本发明所用的提取温度低,不影响多糖结构和活性,提取液中杂质少,后处理方法简单,极大地降低了生产成本。
本发明在优选提取方法时,设定了10℃-100℃的不同提取温度,结果表明,随着温度提升,总多糖提取率增加,但水温太高提取率反而稍有降低,在50℃时达最佳提取效果(图1a)。优选料/水比、提取次数的实验结果也表明,该多糖的水溶性好(图1),最终根据正交实验确定了提取方法中的水温、提取次数、料/水比和提取时间的最佳参数(表1和表2)。
表1.多糖提取因素水平表
表2.正交实验直观分析表
由于提取温度低,为避免多糖被海胆体内的酶水解,先短时间高温加热使酶灭活,再降低温度进行提取。
与90℃的提取液相比,50℃水温下得到的提取液颜色较浅,离心后所得多糖水溶液体系稳定,久置无沉淀析出。因多糖水溶性好,提取用水的总体积小,仅需浓缩至原体积的二分之一,依次应用木瓜蛋白酶酶解和sevage法脱除结合蛋白和游离蛋白,再经充分透析除去小分子杂质,即可得到纯度较高的总多糖(HPP)。
总多糖用Sephacryl S-300凝胶柱色谱分离纯化,以水为流动相即可将所有多糖洗脱出柱,若用梯度浓度的盐水溶液可加快多糖的洗脱速度。结果表明,马粪海胆总多糖含有两种多糖,分别合并洗脱液,冷冻干燥得两个纯化多糖HPP-1和HPP-2。常温下,HPP、HPP-1和HPP-2易溶于水,对肿瘤细胞株BEL-7402、Panc-28、U20S、HepG2、SGC7901和THP-1均显示出抑制作用。
附图说明
图1:马粪海胆多糖水提取单因素优选实验(a:不同水温下的提取率;b:不同提取时间的提取率;c:不同料/水比的提取率;d:不同提取次数的提取率);
图2:Sephacryl S-300凝胶柱色谱洗脱曲线;
图3:海胆多糖对BEL-7402细胞株的抑制作用,与对照组相比,*P<0.05,**P<0.01;
图4:海胆多糖对panc-28细胞株的抑制作用,与对照组相比,*P<0.05,**P<0.01;
图5:海胆多糖对U20S细胞株的抑制作用,与对照组相比,*P<0.05,**P<0.01;
图6:海胆多糖对HepG2细胞株的抑制作用,与对照组相比,*P<0.05,**P<0.01;
图7:海胆多糖对SGC7901细胞株的抑制作用,与对照组相比,*P<0.05,**P<0.01;
图8:海胆多糖对THP-1细胞株的抑制作用,与对照组相比,*P<0.05,**P<0.01。
具体实施方式
下面给出本发明的几个具体实施方案,以对本发明的技术方案作详细说明。
实施例1
选用6-9月份新鲜采集的马粪海胆,剥开外壳,取其黄色的海胆生殖腺,用组织匀浆机充分粉碎,加入2倍量体积的无水丙酮,常温搅拌脱脂,重复脱脂7次,离心,充分干燥后得脱脂粉末。
脱脂粉末加2倍量体积的水,加热至90℃-95℃并维持10min,再加入8倍量水维持20℃-30℃提取2h,用10倍量水于20℃-30℃再提取2次,合并提取液浓缩至总体积的二分之一。
按脱脂粉末:蛋白酶=100:4(质量比)向浓缩液中加入木瓜蛋白酶,于55℃酶解24h,再将体系升温至90℃灭活15min,离心,收集上清液。
上清液用其体积分数1/5的sevage试剂(氯仿:正丁醇=4:1)萃取10次,弃下层溶剂和变性蛋白,上层水溶液减压浓缩,浓缩液装入孔径为3500Da的透析袋,用流动蒸馏水透析24h。
向透析后的多糖水溶液中加入4倍量无水乙醇,静置12h,离心收集沉淀,用无水乙醇洗涤3次,干燥得海胆总多糖。
将海胆总多糖配制成50mg/ml的水溶液,用预先平衡好的Sephacryl S-300凝胶柱色谱分离,用双蒸水作流动相。每10ml一管接收洗脱液,用苯酚-硫酸法测定每管洗脱液的多糖含量,以管数和吸光度绘制洗脱曲线。根据曲线合并洗脱液,冷冻干燥得到两个纯化海胆多糖。
实施例2
选用6-9月份新鲜采集的马粪海胆,剥开外壳,取其黄色的海胆生殖腺,用组织匀浆机充分粉碎,加入1倍量体积的无水丙酮,常温搅拌脱脂,重复脱脂10次,离心,充分干燥后得脱脂粉末。
脱脂粉末加2倍量体积的水,加热至95℃-100℃并维持30min,再加入8倍量水维持50℃-60℃提取6h,用20倍量水于50℃-60℃再提取3次,合并提取液浓缩至总体积的二分之一。
按脱脂粉末:蛋白酶=100:8(质量比)向浓缩液中加入木瓜蛋白酶,于55℃酶解24h,再将体系升温至90℃灭活15min,离心,收集上清液。
上清液用其体积分数1/5的sevage试剂(氯仿:正丁醇=4:1)萃取15次,弃下层溶剂和变性蛋白,上层水溶液减压浓缩,浓缩液装入孔径为3500Da的透析袋,用流动蒸馏水透析24h。
向透析后的多糖水溶液中加入4倍量无水乙醇,静置12h,离心收集沉淀,用无水乙醇洗涤5次,干燥得海胆总多糖。
将海胆总多糖配制成50mg/ml的水溶液,用预先平衡好的Sephacryl S-300凝胶柱色谱分离,用双蒸水作流动相。每10ml一管接收洗脱液,用苯酚-硫酸法测定每管洗脱液的多糖含量,以管数和吸光度绘制洗脱曲线。根据曲线合并洗脱液,冷冻干燥得到两个纯化海胆多糖。
实施例3
取7月份于山东威海采集的马粪海胆20Kg,剥除海胆壳,得黄色海胆生殖腺3.5Kg。取1.15kg,用组织粉碎机进行粉碎,每两分钟间歇一次,重复操作至海胆黄为匀浆。向海胆黄匀浆中加入两倍体积的丙酮(2400mL)常温搅拌8h,离心收集沉淀。沉淀再重复脱脂8次至丙酮层为无色,干燥称重得脱脂粉末220g。加入450ml水,加热至90℃维持10min,再加入1.8L水维持50℃提取4h。离心,沉淀再用2.2L水提取2次。提取液合并后,减压浓缩至3.3L,加入1.9g木瓜蛋白酶于55℃酶解24h,然后加热至90℃灭活15min,离心收集上清液。向上清液中加入其体积分数1/5的sevage试剂(氯仿︰正丁醇=4︰1)萃取,弃去下层液体和变性蛋白,再重复该操作10次。上层多糖水溶液减压浓缩至1.5L,装入孔径为3500Da的透析袋内,用流动蒸馏水透析24h。向透析后的多糖水溶液中加入6L无水乙醇,静置12h,离心,沉淀用无水乙醇洗涤3次,充分干燥得白色海胆总多糖粉末22g。苯酚-硫酸法测其多糖含量为89%。
实施例4
取8月份于山东威海采集的马粪海胆50Kg,剥除海胆壳,得黄色海胆生殖腺9.53Kg,用组织粉碎机进行粉碎得匀浆。用两倍体积的无水丙酮脱脂8次,得脱脂粉末1.7Kg。取脱脂粉末230g,加入500ml水于90℃加热30min,再加入3.0L水维持50℃提取6h,离心。沉淀再用3.5L水提取2次。合并提取液,减压浓缩至4.5L。向上清液中加入其体积分数1/5的sevage试剂(氯仿︰正丁醇=4︰1)萃取,弃去下层液体和变性蛋白,重复该操作11次。上层多糖水溶液减压浓缩至1.5L,装入孔径为3500Da的透析袋内,用流动蒸馏水透析24h。向透析后的多糖水溶液中加入6.0L无水乙醇,静置12h,离心,沉淀用无水乙醇洗涤5次,充分干燥得白色海胆总多糖粉末32.5g。苯酚-硫酸法测其多糖含量为91%。
取1g总多糖用20ml水溶解,加入预先平衡好的Sephacryl S-300凝胶柱,以双蒸水为流动相洗脱,每10ml接收1管,苯酚-硫酸法测定每管内多糖含量,分别合并第7管至第15管洗脱液,第16管至第24管洗脱液,冷冻干燥得HPP-1(630mg)和HPP-2(50mg)(图2)。
二、细胞增殖抑制实验
1.肿瘤细胞株的复苏、培养及冻存
(1)细胞复苏:将冷冻管从液氮罐内或-80℃冰箱中取出后,迅速放入37℃水浴中,当细胞呈现冰水混合物的状态时,从水浴中取出冻存管,用75%酒精灭菌消毒后,移入无菌超净台内。将冻存管内的细胞吸出后加入预先加有培养液的离心管中,混匀,1000rpm离心5min。弃去上清液,收集下层细胞,用培养液洗2次,加入装有适量培养液的培养瓶中,放入37℃、5%CO2的恒温培养箱中培养。每日观察细胞的生长状态,待细胞长至80%-90%后进行传代培养。(培养液的配制:适合类型的培养基加10%胎牛血清,1%的青霉素链霉素混合液)
(2)细胞的传代:将培养瓶从CO2培养箱中取出放入超净台中,贴壁细胞直接弃去培养液,加入PBS缓冲液冲洗两次后,用胰酶消化,用培养液终止消化,进行分瓶培养。37℃、5%CO2的恒温培养箱中培养。
2.MTT法检测多糖对肿瘤细胞增殖的影响
MTT法检测多糖对不同种类肿瘤细胞生长的抑制作用:
细胞传代后,以5×103个/孔加入96孔板内,每孔200l,再加入无菌的待检样品(0,32,64,128,256,512,1024-g/ml)于37℃、5%CO2培养箱培养24h,然后吸去上清。最后使用MTT法进行检测:每孔加入20l的MTT染色液(5mg/ml),反应4h后弃上清,加入DMSO 150l,避光震荡溶解10min后用酶标仪检测570nm处的吸光值,计算细胞存活率。
3.统计学处理
结果中的数据以平均值±SD的形式显示,应用软件SPSS 13.0进行数据处理,保证3次实验重复。采用单因素方差分析法比较多组数据,对照组与各实验组之间的差异通过t检验进行对比分析,当P<0.01时,对照组与实验组差异极其显著,当P<0.05时对照组与实验组有显著性差异。
- 还没有人留言评论。精彩留言会获得点赞!