来源于葡萄溃疡病菌的效应子蛋白及其编码基因和应用的制作方法
本发明属于分子生物学领域,涉及一种来源于葡萄溃疡病菌的效应子蛋白及其编码基因和应用。
背景技术:
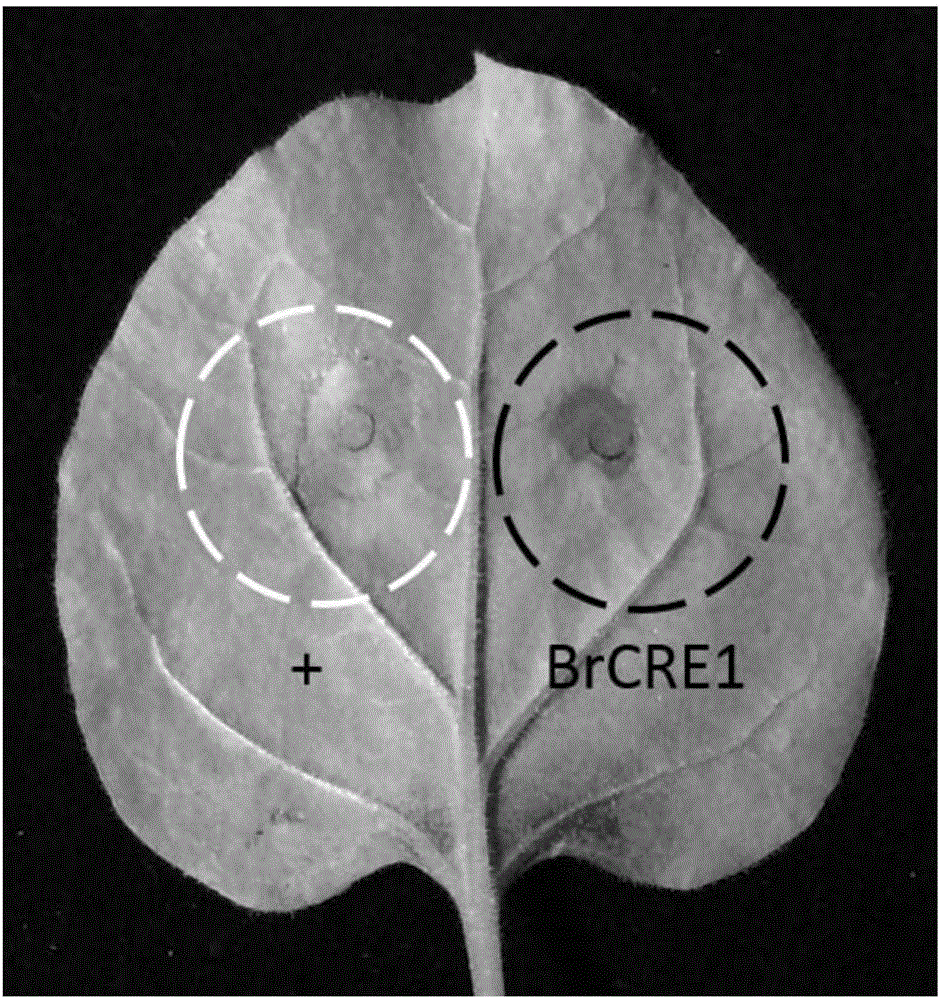
:葡萄(VitisviniferaL.)一直是全世界最重要的水果之一,其经济价值非常高,不仅可以直接鲜食还可加工制作成葡萄干、葡萄酒等。目前全世界葡萄种植面积非常大,栽培面积至少占据了所有水果种类的10%,截至2013年底,我国葡萄栽培面积已达到71.46万hm2,葡萄产量1155万吨。葡萄病害是影响葡萄产量和品质的最重要因素之一,葡萄病害的发生与管理方式、品种选择等人为因素和气候环境等因素有着密切的关系。我国葡萄大多数种植在温带及亚热带,其果实成熟期多是温度高湿度也高的季节,因此葡萄白粉病、霜霉病等病害时有发生。目前我国葡萄生产上被鉴定出的病害种类约有50多种,其中病害较严重的也有十多种,直接造成葡萄产业30%经济损失。由葡萄座腔病菌引起的葡萄溃疡病(Botryosphaeriadieback)是葡萄上存在的主要枝干病害之一,严重影响葡萄的产量和品质。病原菌通过自然孔口或修剪伤口进行侵染,引起果梗干枯、果实干缩或掉粒、枝干溃疡、树势减弱等症状,严重的会导致使植株整株枯死。至今,在我国已发现Botryosphaeriadothidea、Diplodiaseriata、Lasiodiplodiatheobromae、Neofusicoccumparvum、Lasiodiplodiapseudotheobromae和Neofusicoccummangiferae可引起葡萄溃疡病,其中优势种群是L.theobromae,B.dothidea,而致病力较强的是L.theobromae。在长期的协同进化过程中,植物形成了两层防卫机制来抵抗病原菌的侵害。第一层是病原相关分子模式(Pathogen-associatedmolecularpattern,PAMPs)触发的免疫PTI(PAMP-triggeredimmunity),即植物体细胞膜表面的受体激酶(PRRs)通过识别病原菌相关的分子模式(PAPMs)来激活植物体的基础防卫系统(PTI)。多数情况下,基础防卫反应可阻断病原菌对植物的侵害。有些病原菌可向植物细胞内分泌效应子蛋白来冲破PTI,这时,植物体通过抗病蛋白(R蛋白)识别这些效应蛋白从而激活第二层防卫反应机制,即效应子蛋白激发的防卫机制(ETI),激活防卫基因的表达,通常表现为过敏反应。效应子蛋白在病原菌与植物互作系统中扮演着十分重要的角色。一方面,效应蛋白是植物病原菌成功侵染寄主的关键武器;另一方面,效应蛋白也是植物免疫系统识别病原菌入侵的靶标。目前对于葡萄溃疡病的主要研究在于菌种分离鉴定和种群结构多样性分析,对葡萄溃疡病致病机理的研究特别是分子致病机理还知之甚少。并且长期以来,国内外主要采用喷洒农药来控制葡萄溃疡病的流行与危害,都未能达到理想的防治效果,不仅加重了农户的负担,还造成了环境污染。植物病原菌产生的效应子蛋白是一种能够引起植物防卫反应的分泌蛋白,该类蛋白通过与植物细胞表面或亚细胞表面的受体结合激活植物体内的级联信号系统以及诱导防卫基因的表达等防御机制在抗病信号途径中发挥作用,具有化学农药所不具备的优势和特点,可作为一种新型微生物蛋白农药来防御病虫害的侵害。因此开展与致病性相关的效应子蛋白基因的功能研究,不仅可以充实植物病原葡萄溃疡病菌与寄主互作的分子机制资料信息,而且对生产上制定有效的葡萄溃疡病的生态控制技术和措施具有重要意义。技术实现要素:本发明的目的是提供一种葡萄溃疡病菌的效应子蛋白(致病相关蛋白)及其编码基因与应用。本发明所提供的葡萄溃疡病菌的效应子蛋白(致病相关蛋白),来源于野生型葡萄溃疡病菌(L.theobromae)菌株CSS-01s,名称为BrCRE1,是如下1)或2)的蛋白质:1)由序列表中序列1所示的氨基酸序列组成的蛋白质;2)将序列表中序列1的氨基酸残基序列经过一个或几个氨基酸残基的取代和/或缺失和/或添加且与序列1所示蛋白具有相同活性的由1)衍生的蛋白质。序列表中的序列1由214个氨基酸残基组成。为了便于序列1编码的BrCRE1纯化,可在由序列表中序列1所示的氨基酸序列组成的蛋白质的氨基末端或羧基末端连接上如表1所示的标签。表1标签的序列标签残基序列Poly-Arg5-6(通常为5个)RRRRRPoly-His2-10(通常为6个)HHHHHHFLAG8DYKDDDDKStrep-tagII8WSHPQFEKc-myc10EQKLISEEDL上述BrCRE1可人工合成,也可先合成其编码基因,再进行生物表达得到。上述BrCRE1的编码基因可通过将序列表中序列2自5′末端第1-645位碱基所示的DNA序列中缺失一个或几个氨基酸残基的密码子,和/或进行一个或几个碱基对的错义突变,和/或在其5′端和/或3′端连上表1所示的标签的编码序列得到。所述葡萄溃疡病菌的效应子蛋白(BrCRE1)的编码基因也属于本发明的保护范围。所述葡萄溃疡病菌的效应子蛋白(BrCRE1)的cDNA为如下1)或2)或3)的DNA分子:1)序列表中序列2所示的DNA分子;2)在严格条件下与1)限定的DNA序列杂交且编码所述葡萄溃疡病菌的效应子蛋白的DNA分子;3)与序列表中序列2的核苷酸序列具有90%以上的同源性的且编码蛋白对葡萄具有致病性的功能的核苷酸序列。序列表中序列2全长为645个核苷酸,编码一个长度为214个氨基酸(序列表中序列1)、分子量约为23kD的蛋白,即为葡萄溃疡病菌的效应子蛋白(BrCRE1),也称葡萄溃疡病菌致病相关效应子蛋白。所述葡萄溃疡病菌的效应子蛋白(BrCRE1)的基因组基因的核苷酸序列如下1)、2)、或3)所示:1)序列表中SEQID№:3的核苷酸序列;2)在严格条件下可与1)所述的DNA序列杂交的核苷酸序列;3)与序列表中SEQID№:3的核苷酸序列具有90%以上的同源性的且编码蛋白具有葡萄溃疡病菌的效应子蛋白功能的核苷酸序列。序列表中序列3全长为868个核苷酸,自序列3的5’端第1-74位核苷酸是第一个外显子,第75-190位核苷酸是第一个内含子,第191-385位核苷酸是第二个外显子,第386-440位核苷酸是第二个内含子,第441-680位核苷酸是第三个外显子,第681-735位核苷酸是第三个内含子,第736-868位核苷酸是第四个外显子,编码序列表中序列1所示的蛋白质。上述严格条件可为在0.1×SSPE(或0.1×SSC),0.1%SDS的溶液中,在65℃下杂交并洗膜。含有所述葡萄溃疡病菌的效应子蛋白(BrCRE1)的编码基因的重组表达载体、表达盒、转基因细胞系或重组菌均属于本发明的保护范围。上述葡萄溃疡病菌的效应子蛋白(BrCRE1)及其编码基因在培育能对葡萄致病力增强或减弱的转基因工程菌中的应用也属于本发明的保护范围,其中,所述培育能对葡萄致病力增强或减弱的转基因工程菌菌株的方法是将上述的基因转入出发菌株中,筛选得到对葡萄致病力增强的转基因工程菌;或者将出发菌株中的所述基因突变或敲除,筛选得到对葡萄致病力减弱的转基因工程菌;所述出发菌株为葡萄溃疡病菌(L.theobromae)菌株。所述的蛋白及其编码基因在作为效应子蛋白激发植物防卫反应、过敏反应和/或激发植物抗病基因表达中的应用、和/或在作为蛋白农药来防御病虫害的侵害中的应用,也属于本发明的保护范围,所述植物优选为烟草。所述的蛋白质在预防和/或治疗葡萄溃疡病菌(L.theobromae)引起的病害中的应用也属于本发明的保护范围。该蛋白经转基因实验表明,过表达后可增强葡萄溃疡病菌的致病性,是研究抗病基因的重要靶标。该基因具有激发烟草中抗病基因过量表达的功能,可以引起烟草的过敏性坏死反应,因此,该蛋白是葡萄溃疡病菌致病相关的效应子蛋白。作为植物病原菌产生的效应子蛋白,它能够引起植物防卫反应,通过与植物细胞表面或亚细胞表面的受体结合激活植物体内的级联信号系统以及诱导防卫基因的表达等防御机制在抗病信号途径中发挥作用,具有化学农药所不具备的优势和特点,可作为一种新型微生物蛋白农药来防御病虫害的侵害。附图说明图1为实施例2中葡萄溃疡病菌接种后BrCRE1基因的相对表达量。图2为实施例3中BrCRE1蛋白在烟草叶片上的毒力测定。图3为实施例4中pET-BrCRE1载体的结构示意图。图4为实施例4中His-BrCRE1融合蛋白的SDS-PAGE蛋白胶图。图5为实施例5中His-BrCRE1融合蛋白在烟草叶片上HR反应。图6为实施例5中His-BrCRE1融合蛋白注射烟草后烟草抗性相关基因的相对表达量。图7为实施例6中超表达转化子中BrCRE1基因的相对表达量。图中,WT为野生型对照,OV1,OV2,OV3,OV4,OV5,OV6是六个超表达转化子。图8为实施例6中超表达转化子接种葡萄枝条的表型照片。图中,WT为野生型对照,OV1,OV2,OV3,OV4,OV5,OV6是六个超表达转化子。图9为实施例6中超表达转化子接种葡萄枝条的病斑长度统计。图中,WT为野生型对照,OV1,OV2,OV3,OV4,OV5,OV6是六个超表达转化子。具体实施方式以下的实施例便于更好地理解本发明,但并不限定本发明。下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的试验材料,如无特殊说明,均为自常规生化试剂商店购买得到的。以下实施例中的定量试验,均设置三次重复实验,结果取平均值。多糖多酚型植物总RNA提取试剂盒:奥莱博公司,货号ALBRE-003-100。DNaseⅠ、M-MLV、SYBRPremixExTaq(TliRNaseHPlus)、pMD18-T、限制性内切酶以及连接酶均购置TaKaRa公司。野生型葡萄溃疡病菌(L.theobromae)菌株CSS-01s,由本实验室保存(刘爱芬,张鑫,张玮,等.葡萄溃疡病菌转化子致病力快速评价体系的建立[J].植物保护,2013,2:021)。水稻谷枯病菌(Burkholderiaglumae)以及pEDV载体:中国农业大学,参考文献:ZhangY,ZhangK,FangA,etal.SpecificadaptationofUstilaginoideavirensinoccupyinghostfloretsrevealedbycomparativeandfunctionalgenomics[J].Naturecommunications,2014,5。pEDV载体出发质粒是pBBR1MCS-5。以质粒pBBR1MCS-5为出发质粒,将寡核苷酸P1(5’-GAAGCTTATCGATGAATTCCAGCT-3’)和P2(5’-GGAATTCATCGATAAGCTTCGTAC-3’)插入到pBBR1MCS-5命名质粒的KpnⅠ和SstⅠ位点间,得到的重组载体命名为mpBBR1MCS。以质粒pV316-1A为模板,用引物KS_96(5’-CCCAAGCTTTTTCCCCGAAGATTAGGAACTGTC-3’)和KS_107(5’-GGAATTCTTATGCGTAGTCTGGTACGTCGTACGGATAGGATCCGTCGACTCGTTTACCTCCACCCAATAGG-3’)进行扩增,得到的产物用HindⅢ和EcoRⅠ双酶切,回收的片段分别插入到mpBBR1MCS相同的酶切位点间,得到的重组载体命名为pEDV。pKN载体由实验室构建,构建过程如下:用BamHI和XbaI双酶切pUCATPH载体,得到的小片段插入到pBluescriptKS载体相同的酶切位点间,得到的重组载体命名为pKS1;用KpnI和ClaI双酶切pUCATPH载体,得到的小片段插入到pKS1载体相同的酶切位点间,得到的重组载体命名为pKS2;以pEGFP-C1为模板,用Neo-XF(5’-AGTCTAGACTGAGGCGGAAAGAACCAGC-3’)和Neo-XF(5’-CGTCTAGATCAGAAGAACTCGTCAAGAAG-3’)引物进行配对进行PCR扩增,用XbaI分别单酶切PCR产物和pKS2载体,回收后进行连接反应,得到的重组载体命名为pKN。新霉素(NEOMYCIN):Sigma公司,货号为N6386-5G。蜗牛酶(Snailase):Sigma公司,货号为SL103-5G。崩溃酶(Driselase):Sigma公司,货号为D9515-5G。实施例1、BrCRE1蛋白及其编码基因的克隆本文研究的BrCRE1基因是通过葡萄溃疡病菌CSS-01s菌株对‘夏黑’葡萄侵染的基因表达谱数据中筛选出的可能诱导植物产生寄主抗性的效应子蛋白基因。以葡萄溃疡病菌CSS-01s菌株提取的总RNA为模板,设计特异引物BrCRE1-F和BrCRE1-R,利用RT-PCR技术扩增获得BrCRE1基因的全长cDNA片段。引物序列如下:BrCRE1-F:5′-ATGAAGGCTTCCGGTCTC-3′(序列表中序列5);BrCRE1-R:5′-GAAGTACTGCAGCAACTG-3′(序列表中序列5)。在PDA培养基上生长7天的葡萄溃疡病菌CSS-01s,收集菌丝后提取总RNA并反转录得到cDNA。以cDNA为模板,用BrCRE1-F和BrCRE1-R组成的引物对进行PCR扩增(靶序列约642bp)。PCR扩增体系为:2.5μL的10×PCRbuffer(Mg2+free),1.8μLMgCl2(25mM),0.5μL的dNTPs(10mM),0.2μLTaq酶(5U/μL),1.0μL模板cDNA,正向引物和反向引物(10mM)各加0.5μL,加ddH2O补足25μL。反应程序如下:94℃预变性5min后,进入94℃30s,58℃30s,72℃30s,32个循环,最后在72℃下延伸10min。将PCR扩增产物回收连接pMD18-T载体(TaKaRa),转化大肠杆菌DH5α,质粒经酶切鉴定,正确的克隆送到北京博迈德基因技术有限公司进行测序,测序结果如序列表的序列2所示,编码序列表的序列1所示的蛋白质。将经测序表明外源插入片段为序列2的重组质粒命名为pMD18-T/BrCRE1。在PDA培养基上生长3天的葡萄溃疡病菌CSS-01s,收集菌丝后提取基因组DNA。以基因组DNA为模板,用BrCRE1-F和BrCRE1-R组成的引物对进行PCR扩增(靶序列约868bp)。PCR扩增体系为:2.5μL的10×PCRbuffer(Mg2+free),1.8μLMgCl2(25mM),0.5μL的dNTPs(10mM),0.2μLTaq酶(5U/μL),1.0μL模板基因组DNA,正向引物和反向引物(10mM)各加0.5μL,加ddH2O补足25μL。反应程序如下:94℃预变性5min后,进入94℃30s,58℃30s,72℃50s,32个循环,最后在72℃下延伸10min。将PCR扩增产物回收连接pMD18-T载体(TaKaRa),转化大肠杆菌DH5α,质粒经酶切鉴定,正确的克隆送到北京博迈德基因技术有限公司进行测序,测序结果如序列表的序列3所示,转录生成序列表的序列2所示的cDNA扩增片段。将序列表的序列1所示的蛋白质命名为BrCRE1蛋白。将编码BrCRE1蛋白的基因命名为BrCRE1基因,其开放阅读框如序列表的序列2所示。序列表中序列3全长为868个核苷酸,自序列3的5’端第1-74位核苷酸是第一个外显子,第75-190位核苷酸是第一个内含子,第191-385位核苷酸是第二个外显子,第386-440位核苷酸是第二个内含子,第441-680位核苷酸是第三个外显子,第681-735位核苷酸是第三个内含子,第736-868位核苷酸是第四个外显子,编码序列表中序列1所示的蛋白质。实施例2、BrCRE1基因在葡萄溃疡病菌侵染葡萄寄主过程中表达模式分析一、葡萄溃疡病菌接种葡萄枝条将在4℃冰箱保存的CSS-01s菌丝块置于PDA固体培养基上活化,28℃培养24-36h。选取一年生‘夏黑’葡萄半木质化绿枝条,70%乙醇表面消毒。用打孔器在枝条节间中部打孔,将CSS-01s菌丝块置于孔内,封口膜固定。将接种后的枝条置于培养室花盆中培养,湿度≥80%,温度在26-28℃,于接种0h、12h、24h、36h和48h取葡萄枝条表皮,液氮冻存后于-80℃冰箱中保存,用于RNA提取。二、接种样品RNA提取及表达验证采用多糖多酚型植物总RNA提取试剂盒(奥莱博)提取葡萄枝条RNA,经DNaseⅠ(Takara)37℃消化30min后,采用M-MLV(Takara)反转录合成cDNA,经10倍稀释后-20℃保存备用,用于荧光定量分析。采用BrCRE1-qF和BrCRE1-qR组成的引物对检测BrCRE1基因,采用BrActin基因作为内参基因(用BrActin-qF和BrActin-qR组成的引物对扩增BrActin)。采用SYBR荧光染料法,反应体系参照TaKaRa说明书,每个样品设置3个重复。反应体系为:0.5μL反转录产物,引物3.5μL(0.5μM),7μL2×SYBRPremixExTaqII,补水至总体积14μL。所用仪器为ABI7500。扩增程序为:94℃预变性2min,进入94℃变性15sec,60℃变性15sec,68℃延伸30sec共40个循环,最后65-95℃制备溶解曲线。所用引物序列如下:BrCRE1qF:5′-CAACAGTGGCAAGGACTA-3′;BrCRE1qR:5′-GATGGTGGTGGTCTTCTT-3′。BrActin-qF:5′-GAAGGACCTGTACGGCAACA-3′;BrActin-qR:5′-AGGGCGGTGATTTCCTTCTG-3′。结果见图1,从图中可以看出,BrCEP1基因表达水平在葡萄溃疡病菌侵染12h时达到最高,随后逐渐下降。实施例3、BrCRE1蛋白烟草毒力测定一、载体构建用引物BrCRE1-SIF和BrCRE1-BIR进行配对,以质粒pMD18-T/BrCRE1为模板,扩增得到的片段连接到T载体上,命名为pMD18-T/BrCRE1t;用BamHⅠ和SalⅠ双酶切pMD18-T/BrCRE1t,回收小片段插入到pEDV相同的酶切位点间,得到的重组载体命名为pEDV/BrCRE1。菌落PCR和酶切鉴定结果显示成功构建了表达载体pEDV/BrCRE1。所用引物序列如下:BrCRE1-SIF:5′-TGTCGACCGTTCCCATGCTTAAC-3′;BrCRE1-BIR:5′-TGGATCCGAAGTACTGCAGC-3′。二、重组质粒转化水稻谷枯病菌(Burkholderiaglumae)1、水稻谷枯病菌感受态的制备和转化将10μL水稻谷枯病菌转接到50mL液体培养基中,28℃180rpm振荡培养过夜,扩大培养至OD600=1.0,将菌液转入无菌离心管,4℃下800g离心5min收集菌体,弃上清;用40mL预冷的10%甘油溶液轻轻悬浮细胞,4℃下800g离心5min,弃上清;用40mL预冷的10%甘油溶液再次悬浮细胞,4℃下800g离心5min,弃上清;最后用用200μL预冷的10%甘油溶液轻轻悬浮,最后分装成50μL小份于1.5mL离心管中,液氮速冻后置于-80℃冰箱。通过电击转化将pEDV/BrCRE1重组质粒水稻谷枯病菌感受态中,取100μL菌液,涂于含25mg/L庆大霉素固体LB培养基平板上,28℃倒置暗培养,PCR阳性克隆pEDV/BrCRE1保存于-80℃冰箱。2、烟草瞬时转化将10μL含pEDV/BrCRE1重组质粒水稻谷枯病菌转接到3mLLB液体培养基中(25mg/L庆大霉素),28℃180rpm培养过夜。离心收集菌体用10mMMgCl2溶液将菌落密度调整为OD600=0.1。室温静置3h后,用1mL无针头注射器将菌液注射入生长期三周的烟草叶片下表皮。转化了pEDV空载体的水稻谷枯病菌用做对照。结果见图2,从图中可以看出,注射了重组pEDV/BrCRE1水稻谷草杆菌和对照菌液pEDV的烟草叶片在48h后叶片产生黄色斑,随后病斑逐渐加重至叶片坏死,但重组pEDV/BrCRE1水稻谷草杆菌引起的坏死斑比对照小。说明BrCRE1蛋白可抑制水稻谷枯病菌引起的过敏反应,因此,BrCRE1蛋白在侵染过程中起着毒性因子的作用,是致病相关的效应子蛋白。实施例4、BrCRE1基因的原核表达和纯化一、原核表达载体构建用引物BrCRE1-BIF和BrCRE1-BIR进行配对,以质粒pMD18-T/BrCRE1为模板,扩增得到的片段连接到T载体上,命名为pMD18-T/BrCRE1e;用BamHⅠ和SmaⅠ双酶切pMD18-T/BrCRE1e,回收小片段插入到pET-32a相同的酶切位点间,得到的重组载体命名为pET-BrCRE1,载体图见图3。菌落PCR和酶切鉴定结果显示成功构建了表达载体pET-BrCRE1。引物序列如下:BrCRE1-BIF:5′-AGGATCCATGAAGGCTTCCGGTCTC-3′;BrCRE1-SmR:5′-TCCCGGGGAAGTACTGCAGCAACTG-3′。二、BrCRE1基因的原核表达和蛋白纯化将原核表达载体pET-BrCRE1转化E.coliBL21(DE3)感受态细胞。挑选单菌落在LB(含100mg/LAmp)液体培养基中于37℃180rpm过夜培养,将1mL菌液转接至100mLLB(含100mg/LAmp)液体培养基中,37℃180rpm摇培2h至OD600=0.4-0.6;取1mL菌液作为诱导前样品;加入100μLIPTG至终浓度为0.1mM,16℃100rpm过夜摇培;取出1mL菌液作为诱导后样品,然后用50mL离心管4℃10000g离心5min收集菌液;加入10mLLysisBuffer溶液(50mMNaH2PO4,0.3MNaCl,10mM咪唑,pH=8.0)将菌体悬浮,超声波裂解细胞(功率250W,工作时间10s,间隔10s,工作10次);4℃12000g离心10min后,将上清移到新的50mL离心管,沉淀用10mLLysisBuffer悬浮。各取240μL诱导后上清及沉淀,加入60μL5×SDSloadingbuffer,煮沸样品,与诱导前后总蛋白样品一起进行SDS-PAGE电泳,分析蛋白诱导情况及诱导蛋白在上清还是包涵体中;向BioRad蛋白纯化柱中加入500μlNi-NTA悬浮液,先用三倍柱子体积的LysisBuffer冲洗柱子3-5次;加入超声波破碎的上清蛋白溶液,4℃混匀1h;加入4mLWashBuffer(50mMNaH2PO4,0.3MNaCl,20mM咪唑,pH=8.0),洗柱子3次,最后加入500μLElutionBuffer(50mMNaH2PO4,0.3MNaCl,250mM咪唑,pH=8.0)进行His-BrCRE1蛋白洗脱。结果见图4,经SDS-PAGE电泳,获得一个分子量约为43kD的His-BrCRE1融合表达蛋白,与预测的大小一致。并且His-BrCRE1融合蛋白富集在上清液里,纯化后的蛋白条带单一、无杂带。图4注:M:蛋白质Marker;B:诱导前的菌液;A:诱导后菌液;S:诱导后的上清液;P:诱导后的蛋白;His-BrCRE1:His-BrCRE1纯化蛋白。实施例5、His-BrCRE1融合蛋白在烟草上引起的防御反应一、His-BrCRE1融合蛋白在烟草上引起的HR反应用1mL无针头注射器,将约20μL30μg/mLHis-BrCRE1融合蛋白从叶子背面注射入生长期三周的烟草叶片表皮。以相同浓度的pET-32a空质粒表达蛋白作为对照,48h后观察叶片上的反应。结果如图5所示,His-BrCRE1融合蛋白能够引起烟草叶片产生HR反应,与实施例3引起的症状基本一致。二、His-BrCRE1融合蛋白提高烟草抗性相关基因的转录水平用1mL无针头注射器,将约20μL30μg/mLHis-BrCRE1融合蛋白从叶子背面注射入生长期三周的烟草叶片表皮,于注射0h、6h和12h取烟草叶片,液氮速冻。以注射了相同浓度的pET-32a空质粒表达蛋白的烟草作为对照。烟草叶片RNA提取,反转录反应及qPCR验证步骤参照实施例2。依次用NtPR1a-qF/NtPR1a-qR、NtPR2a-qF/NtPR2a-qR、NtPAD3-qF/NtPAD3-qR和NtLOX-qF/NtLOX-qR配对检测NtPR1a、NtPR2a、NtPAD3和NtLOX基因,采用NtEF1α基因作为内参基因。引物序列见表1。表1.本研究所用引物引物名称引物序列(5’-3’)NtPR1a-qFGTGCCCAAAATTCTCAACAAGNtPR1a-qRTTCTACACCTACATCTGCACGAGNtPR2a-qFTCCAGATACAAATGTCTTCAACGNtPR2a-qRTGGGACGTCGAGAATGATCTNtPAD3-qFAGGTTCTGTACCGACTGTGGTTNtPAD3-qRGTTCTAAAGATCTCTCGGGCAATNtLOX-qFAGAAATGGATGTCCACCTTGANtLOX-qRGGACTCATCCCAGTCAAATGTCNtEF1α-qFTGAGAAGGAGCCCAAGTTCTNtEF1α-qRTGGTGGGAATCATCTTAACCA结果如图6所示,His-BrCRE1融合蛋白处理烟草叶片6h后就能激活相关抗性相关基因的表达。实施例6、葡萄溃疡病菌BrCRE1基因超表达转化子的致病力测定一、载体构建用引物BrCRE1-HF和BrCRE1-EvR进行配对,以质粒pMD18-T/BrCRE1为模板,扩增得到的片段连接到T载体上,命名为pMD18-T/BrCRE1ov;用HindⅢ和EcoRⅤ双酶切pMD18-T/BrCRE1ov,回收小片段插入到pKN相同的酶切位点间,得到的重组载体命名为pKN/BrCRE1。菌落PCR和酶切鉴定结果显示成功构建了表达载体pKN/BrCRE1。引物序列如下:BrCRE1-HF:5′-CAAGCTTATGAAGGCTTCCGGTCTC-3′;BrCRE1-EvR:5′-TGATATCGAAGTACTGCAGCAACTG-3′。二、重组质粒转化葡萄溃疡病菌1、原生质体制备将4℃保存的葡萄溃疡病菌株CSS-01s转接到PDA固体培养基上,28℃培养36h后将菌丝涂断转入CM液体培养基(6g/LYeastextract,3g/LCaseinenzymatichydrolysate,3g/LCaseinacidhydrolysate,10g/LSucrose)中,28℃120rpm摇培24h;8000g离心5min收集菌丝,用0.7MNaCl溶液重悬,4000g离心15min收集菌丝;菌丝称重,按照1g:2mL:2mL(菌丝体:20mg/mL蜗牛酶:20mg/mL崩溃酶)比例加入酶解液,28℃120rpm摇培酶解4h,用血球计数板观察原生质体酶解是否彻底;三层擦镜纸过滤酶解液,加入预冷的0.7MNaCl溶液4000rpm离心15min洗涤原生质体,弃去上清液;加入5mLSTC溶液(1.2M山梨醇,10mMTris·HCl,50mMCaCl2)重悬,4000rpm离心15min,弃上清;最后加入1-3mL的STC溶液并将原生质体浓度调制至1x107个/mL。2、重组质粒的原生质体转化在50mL的离心管中分别加入150μL制备好的原生质体,线性化的pKN/BrCRE1质粒(NotI酶切),STC溶液补至300μL,冰上静置20min;逐滴加入2mLPTC溶液(180mMPEG3300,10mMTris·HCl,50mMCaCl2),冰上静置20min;加入25mL预冷的STC溶液,充分混匀,4000rpm离心15min,弃上清,加入3mLLR液体培养基(1g/LYeastextract,1g/LCaseinenzymatichydrolysate,1MSucrose),28℃培养12-18h;加入15mLSR固体培养基(1g/LYeastextract,1g/LCaseinenzymatichydrolysate,1MSucrose,1.5g/L琼脂粉,温度在50℃左右),充分混匀铺板,等SR培养基凝固后在其表面覆盖约10mL1.5%的水琼脂(1.5g/L琼脂粉,含有1100μg/mL新霉素);28℃培养箱中培养24h后挑取水琼脂表面长出的单菌落,在CM固体培养基(6g/LYeastextract,3g/LCaseinacidhydrolysate,3g/LCaseinenzymatichydrolysate,10g/LSucrose,1.5g/L琼脂粉,含有1100μg/mL的新霉素)再次筛选,得到pKN/BrCRE1重组质粒转化子,4℃保存。转化了pKN空载体的菌株作为对照。3、转化子RNA提取及BrCRE1基因表达分析将4℃保存的转化子转接到PDA固体培养基上,28℃培养36h后将菌丝涂断转入CM液体培养基(6g/LYeastextract,3g/LCaseinacidhydrolysate,3g/LCaseinenzymatichydrolysate,10g/LSucrose)中,28℃120rpm摇培24h,8000g离心5min收集菌丝;采用Trizol(Qiagen)提取转化子RNA,经DNaseⅠ(Takara)37℃消化30min后,采用M-MLV(Takara)反转录合成cDNA,经10倍稀释后-20℃保存备用,用于荧光定量分析。所用引物序列、反应体系、扩增程序同实施例2。4、转化子葡萄枝条接种实验将对照菌株、转化子菌株转接到PDA固体培养基上,28℃培养48h,待菌丝均长满培养皿后,用打孔器取菌饼(0.5cm),用同一直径的打孔器在修剪好的一年生‘夏黑’葡萄绿枝条上打孔,去掉外表皮,将菌饼置于绿枝条打孔处,用封口膜包裹封好,将枝条插入基质中28℃光暗交替培养,接种72h后观察并统计发病情况。结果如图所示,通过PEG介导的转化,获得阳性转化子6个(命名为OV1-OV6),BrCRE1基因在OV1-OV6中的表达量是对照菌株(WT)的1.5-4倍(图7)。并且,接种葡萄枝条枝条后,OV1-OV6转化子病斑长度较对照长,说明BrCRE1基因的超表达可增强葡萄溃疡病菌的致病力(图8、图9)。以上说明对本发明而言只是说明性的,而非限制性的,本领域普通技术人员理解,在不脱离所附权利要求所限定的精神和范围的情况下,可做出许多修改、变化或等效,但都将落入本发明的保护范围内。序列表<110>北京市农林科学院<120>来源于葡萄溃疡病菌的效应子蛋白及其编码基因和应用<130>WHOI160081<160>5<210>1<211>214<212>PRT<213>葡萄溃疡病菌(L.theobromae)<400>1MetLysAlaSerGlyLeuPheLeuAlaSerLeuValSerAlaValMet151015AlaSerProIleAlaAsnLeuAlaGlnGlnCysSerGlyGlnAlaVal202530AsnGlyAlaThrThrGlnProSerAspProSerAlaArgMetTrpLeu354045AlaLeuHisAsnAlaHisArgAlaAsnHisThrGlnThrCysSerVal505560AlaTrpAspGlnGlnLeuAlaAsnGluAlaMetAlaSerAlaGlnAla65707580CysGlnPheGlnHisThrAsnSerGlyLysAspTyrGlyGlnAsnMet859095GlyGluThrSerGlnGlySerAlaGluHisAlaValThrAlaMetPhe100105110TyrAsnGluIleSerGluPheGlyProTyrTrpHisGlnProAspVal115120125ProIleGlyAsnProMetIleLeuHisPheThrGlnAlaValTrpLys130135140LysThrThrThrIleGlyCysAlaThrTrpAsnCysGlyGlnTrpLeu145150155160LeuSerTyrCysAsnTyrArgGlyProGlyAsnTyrAlaGlyGluTyr165170175GlyAspAsnValAlaAspLeuIleProAsnProLeuProProIleCys180185190SerGluIleGlySerSerAlaGlnAspGlySerCysIleThrAspGln195200205GlnLeuLeuGlnTyrPhe210<210>2<211>645<212>DNA<213>葡萄溃疡病菌(L.theobromae)<400>2atgaaggcttccggtctcttcctcgcctcgctggtctccgccgtcatggcgtcgccaatt60gccaacctcgcacagcaatgctctggtcaggctgtcaacggtgccaccacccagcccagt120gatccctcggccaggatgtggcttgcactccacaacgcgcaccgcgccaaccacacccag180acctgctccgtcgcctgggaccagcagctcgcaaacgaagccatggcctccgcccaagca240tgccagttccagcacaccaacagtggcaaggactacggccaaaacatgggcgagaccagc300caaggctcggccgagcacgccgttaccgccatgttctacaacgaaatcagcgaattcggc360ccgtactggcaccagccggacgtcccgatcggcaacccgatgatcctccactttactcaa420gccgtctggaagaagaccaccaccatcggttgcgccacctggaactgtggtcaatggctg480ctgtcctactgcaactaccgcggacctggcaactatgccggcgagtacggtgacaacgtc540gctgatctgatccccaacccgctccccccgatttgctctgagatcggttcgagcgcacag600gacggaagctgcatcactgaccagcagttgctgcagtacttctaa645<210>3<211>868<212>DNA<213>葡萄溃疡病菌(L.theobromae)<400>3atgaaggcttccggtctcttcctcgcctcgctggtctccgccgtcatggcgtcgccaatt60gccaacctcgcacagttagtctccacccaccaaccaggaagatgcctttgactccactcg120agggccacaaagcacactgctcccgcctcctttatggcaattcttcaatcttactcacaa180ctgaaactaggcaatgctctggtcaggctgtcaacggtgccaccacccagcccagtgatc240cctcggccaggatgtggcttgcactccacaacgcgcaccgcgccaaccacacccagacct300gctccgtcgcctgggaccagcagctcgcaaacgaagccatggcctccgcccaagcatgcc360agttccagcacaccaacagtggcaagtacgttttgcctctccaccctttacctttttaaa420tctttaacacgccaatgcagggactacggccaaaacatgggcgagaccagccaaggctcg480gccgagcacgccgttaccgccatgttctacaacgaaatcagcgaattcggcccgtactgg540caccagccggacgtcccgatcggcaacccgatgatcctccactttactcaagccgtctgg600aagaagaccaccaccatcggttgcgccacctggaactgtggtcaatggctgctgtcctac660tgcaactaccgcggacctggtacgtgcaacccgtatgaagacaaattttgactatactga720ctttctgcgattaggcaactatgccggcgagtacggtgacaacgtcgctgatctgatccc780caacccgctccccccgatttgctctgagatcggttcgagcgcacaggacggaagctgcat840cactgaccagcagttgctgcagtacttc868<210>4<211>18<212>DNA<213>人工序列<400>4atgaaggcttccggtctc18<210>5<211>18<212>DNA<213>人工序列<400>5gaagtactgcagcaactg18当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1