通过加成沉积制造身体替代物的方法与流程
本发明涉及生物技术领域,更具体而言涉及身体组织替代物,尤其是皮肤组织的替代物。特别地,本发明涉及身体(如皮肤)替代物的制造,所述身体替代物旨在被植入体内或者进行药物或化妆品的活性成分的测试,以评价其毒性、效果或在身体组织中的渗透力。
背景技术:
在欧洲,不能再在实验动物身上对用于化妆品中的化学产品进行测试;因此,在下列方面作出不断的尝试:改进皮肤替代物、赋予皮肤替代物更接近天然皮肤特征的特征、降低皮肤替代物的生产和使用成本。在制造生物技术材料和基质的不同实验方法中,加成沉积法在过去几年中受到了相当多的关注。
在过去大约十年中在很多应用领域开发了加成制造方法,其中有一些被称为“立体平板印刷”或“3D打印”,其最初被设计用于制造由塑料制成的模型工业部件(快速原型制造,参见FR 2 567 668)。它们通常包括在初始基底上以可控的三维形式沉积粉末、糊剂或液(墨水)相,然后通过使该沉积相固化从而获得具有可控的三维形状的物体。所述沉积通常进行若干次,每次均使粉末、糊剂或液相以可控的三维形式沉积;这些沉积物通常是逐步(一层一层的)固化的。所述粉末、糊剂或液相可以为均质的(例如均匀的粉末或熔融的热塑性聚合物)或可以在液相中包含固体颗粒的分散体。其粘度可以为关键参数,因为其沉积之后得到的预成形体在等待其固化时必须不会塌陷(该等待时间可能为几分之一秒)。根据墨水的组成,可以通过非常不同的技术进行固化;也可以自发地发生固化,特别是在熔融状态下的挤出聚合物固化的情况下,或者在触变性糊剂的情况下,或者在聚合物的组成包含彼此反应的分子的情况下(如在US 6,942,830中描述的那样)。
例如,可以通过沉积能够由激光束的光(或由吸收产生的热量)而聚合的墨水来制造塑料部件,并且可以通过沉积含有金属颗粒或粉末的糊剂来制造金属部件,所述糊剂能够在激光束作用(被称为SLS(选择性激光烧结)的技术)下固结(通常通过中间体熔融);也可以直接沉积熔融金属。由此可以制造复杂形状的工业部件。在市场上有大量技术(和关于它们的缩写),如FDMTM(熔融沉积成型)、多嘴喷射成型和FTI(膜转印成像)。缩写SFF(实体自由成型制造)用于指定一组技术,其可用于使用加成技术直接地由CAD(计算机辅助设计)文件来制造三维结构。
加成制造技术的使用在生物技术领域的现有技术中是已知的;因此,已经打印了基于“生物学”材料的三维结构。更确切地说,在这种情况下,所使用的墨水为能够固化的生物相容性材料。这些材料可用作活细胞支架,活细胞在支架固化后引入。也可以将活细胞直接引入墨水中,然后其为含有活细胞的悬浮液;这些墨水有时被称为“生物墨水”。
这种固化可以通过光化学方法完成。例如,文献US 2014/0052285描述了使用几种类型的光致聚合水凝胶(即PEG-DA(=聚乙二醇二丙烯酸酯)、PEG-DA-PEA(聚酯酰胺)、GMA-壳聚糖和藻酸盐)来制造能够定殖活细胞的支架。US 2013/0304233描述了基于PPF(聚丙烯富马酸酯)的可再吸收的支架结构的制造。US 7 780 897和US 8 197 743描述了使用通过光化学反应固化的聚乙二醇水凝胶的立体平版印刷的其他实施方案。然而,通过光化学固化需要大量的光催化剂、光引发剂和/或染色剂(例如:2%的光引发剂);这些添加剂会产生毒理学问题。就光催化剂而言,即使其本身没有毒性,但自由基的产生总是有助于细胞死亡和具有干扰所得产品的风险。这就是为什么需要为生物技术应用找到光致聚合的替代品。
水凝胶过去也被用作可固化的糊状介质;US 7 051 654描述了水凝胶的很长的列表。US 2014/003932描述了基于甲基丙烯酸酯的光固化水凝胶。US 2014/0012407更具体地描述了热可逆的水凝胶。EP 2 670 669 A1描述了一种方法,其中使活细胞悬浮液沉积,其包含第一水凝胶前体和第二可交联的水凝胶前体,当温度降低至临界凝胶化温度以下时,第一水凝胶前体能够固化;通过冷却和添加固化剂而使所沉积的悬浮液固化。第二前体可以为藻酸盐、透明质酸、纤维素衍生物、壳聚糖、黄原胶、纤维蛋白、果胶凝胶或聚乙烯醇。通常,用于细胞培养支架的固化水凝胶以名称“网格(lattice)”为本领域技术人员所知。在US 2013/0164339和US 2014/00998709中描述了其他可固化的体系。
基于藻酸盐的墨水也是已知的,其利用溶液进行固化以制造用于细胞培养的支架;在US 8 639 484、US 8 691 974和US 8 691 274中描述了此类体系和方法。
US 2013/0017564描述了羟基磷灰石沉积物以制备三维结构,其上可沉积骨细胞、成骨细胞。
3D打印在生物技术中还用于将含有活细胞的墨水涂布到有助于细胞培养物发育的支架上。US 2009/0208466和WO 2014/039427描述了使用基于胶原(可包含藻酸盐)的含有人细胞的墨水的3D打印。US 2011/0250688描述了在生物支持物或合成支持物上通过3D打印来沉积悬浮在水凝胶中的平滑肌细胞。
US 2012/0089238描述了通过3D打印在多孔基底(支架)上沉积四种不同的细胞类型,每种细胞类型从专用打印头开始在悬浮液中沉积,从而生成模仿组织的复杂三维结构。WO 2013/040087描述了通过3D打印制造“网格”型生物相容性结构,其上固定有特定范围的组织的活组织:平滑肌细胞、真皮成纤维细胞、内皮细胞、肝星形细胞、肝细胞、单核细胞、巨噬细胞。由W.Lee等人在杂志生物材料“Biomaterials”30(2009),1587-1595页发表的题目为“Multi-layered culture of human skin fibroblasts and keratinocytes through three-dimensional freeform fabrication”的出版物描述了以相同的沉积方式,通过3D打印将细胞沉积在基于I型胶原的水凝胶网格上。特别地,该出版物描述了多层胶原结构的制造,其中一些层包含成纤维细胞或角质形成细胞;在细胞培养之后,其可以用作皮肤模型。
由W.Lee等人于2010年在杂志生物技术和生物工程“Biotechnology and Bioengineering”,vol.105(6),1178-1186页发表的题目为“On-Demand Three-Dimensional Freeform Fabrication of Multi-Layered Hydrogel Scaffold With Fluidic Channels”的出版物描述了从胶原基水凝胶和明胶溶液的交替层沉积生物材料的方法;在沉积期间明胶溶液通过冷却而固化的同时,利用碳酸氢钠对水凝胶进行交联。胶原水凝胶中含有待培养的细胞。在培养期间,明胶溶液变成液体并通过冲洗被除去;结果生成了一种这样的结构,其包括致密的胶原水凝胶层,该层与明胶除去之后留下的略微致密的层相交替。尽管这种生物材料可用于细胞培养,但其不是皮肤替代物。
由V.Lee等人在杂志组织工程学部分C“Tissue Engineering Part C”,20(6)(2014),473-484页发表的题目为“Design and Fabrication of Human Skin by Three-Dimensional Bioprinting”的出版物显示,通过手动组装和通过3D打印获得的多层体系在细胞培养条件下发展得非常不同:通过3D打印生成的体系旺盛生长并保持其形状,而手动组装的体系消亡。
目前,生物技术中的大多数3D打印产品得到了可用作科学研究模型的产品;以这种方式可以模拟各种各样的细胞和器官。模型系统可用于在与体内条件相似的条件下培养和维持的细胞培养物上表征药物活性成分。由Y.Zhao等人在杂志生物制造“Biofabrication”6(1914),doi:10.1088/1758-5082/6/3/035001发表的题目为“Three-dimensional printing of Hela cells for cervical tumor model in vitro”的出版物提供了一个实例。
另一方面,仍然在人类皮肤领域,治疗风险是巨大的,因为仍有许多需求未得到满足。因此,文献US 2014/0012225描述了一种设备,用于在人体表面的广泛区域上沉积含有表皮细胞的可固化水凝胶作为人造皮肤;该设备是为治疗严重烧伤而设计的。
本发明涉及身体替代物领域,特别是皮肤替代物,旨在植入体内或用于对药物或化妆品的活性成分进行测试。发明人已经观察到用于制造身体替代物,特别是皮肤替代物的传统方法在两个方面需要很长时间;首先,传统方法需要长的操作时间(以工时表示),因为身体替代物,特别是皮肤替代物的制造是一个复杂的过程;其次,制造皮肤替代物所必需的多孔基质(支架)不能就这样使用,而是必须首先使其陈化几个月(通常约六个月)之后才能在培养条件下使用。培养阶段本身需要至少六至七周。还应注意的是,制造期间的复杂操作意味着培养物的污染的风险。
由生物墨水制造皮肤替代物的技术可以很容易地自动化,其再现性良好,因而其可以用于获得标准化产品并且其更为快捷:在生产当天将生物材料与细胞混合以形成生物墨水,并且真皮在十至十五天内成熟。
然而,结果不是很好,因为我们没有获得可用于在其表面上培养分层的表皮的人造真皮,这样的人造真皮可以用作天然皮肤的仿真模型。由M.Riemann等人于2015年在实验室自动化杂志“J.of Laboratory Automation”,1-14页(doi:10.1177/2211068214567146)发表的题目为“Standardized 3D Bioprinting of Soft Tissue Models with Human Primary Cells”的出版物描述了通过加成沉积光致聚合生物墨水的连续层(单层厚度:0.05mm)来制备皮肤替代物;将基质层与包含成纤维细胞的层交替设置。该层立即光致聚合。生物墨水基于PEG。然而,由此获得的皮肤替代物不具有天然表皮的分层结构,并且其包含许多孔。
目前,对于使用加成技术制造具有足够的与天然皮肤的结构和功能相似性的皮肤替代物的问题,还没有解决方案。
技术实现要素:
本发明的目的
根据本发明,通过使用含有天然明胶、藻酸盐和纤维蛋白原的混合物的生物墨水的新组合物解决了所述问题,所述生物墨水通过三种不同的方式固化:在墨水的沉积期间,明胶通过冷却而固化,从而能够保持沉积的墨水的珠粒形状。沉积之后,用含有钙离子和凝血酶的溶液对沉积的物体进行处理,从而通过钙离子使藻酸盐固化并通过凝血酶作用使纤维蛋白原凝固。
因此,本发明的第一主题为制造用于加成沉积的生物墨水的方法,其中:
(a)提供第一溶液,其含有5质量%至40质量%之间的明胶(优选6质量%至30质量%之间)和0质量%至5质量%之间的NaCl;
(b)提供第二溶液,其含有1质量%至12质量%之间的藻酸盐(优选1质量%至8质量%之间)和0质量%至5质量%之间的NaCl;
(c)提供第三溶液,其含有1质量%至15质量%之间的纤维蛋白原(优选3质量%至15质量%之间)并任选地含有活细胞(如成纤维细胞)悬浮液;
(d)生成混合物,其包含:
约35体积%至65体积%的第一溶液;约15体积%至35体积%的第二溶液;约15体积%至35体积%的第三溶液;选择这些比例以使得合计为100%,
并且在所述方法中:
-步骤(a)、步骤(b)和步骤(c)的顺序是不重要的,
-选择NaCl含量以使得:在合并的所述第一溶液和所述第二溶液中,NaCl含量为0.2质量%至5质量%之间,优选0.2质量%至3质量%之间,甚至更优选0.4质量%至2质量%之间。
对于皮肤替代物的制备,所述活细胞可以来源于皮肤的不同结构:真皮、表皮、皮下组织、血液和淋巴管、毛囊、皮脂腺、汗腺、毛孔、立毛肌、肌肉,麦斯纳氏小体、帕西尼氏小体、鲁菲尼氏小体、结缔组织、基底膜。更具体地,这些细胞可以为角质形成细胞、黑素细胞(特别是根据Fitzpatrick量表的光类型I、II、III、IV和V)、成纤维细胞(包括乳头状和网状成纤维细胞)、梅克尔细胞、朗格汉斯细胞、皮脂腺细胞、真皮树突细胞、巨噬细胞、肥大细胞、毛囊上皮细胞、毛囊乳头成纤维细胞、前脂肪细胞、干细胞(特别是脂肪细胞组织的干细胞),敏感神经细胞、肌肉细胞。这些细胞可以为健康的或病理性的。
本发明的另一主题为可以使用该方法获得的生物墨水。其可以含有活细胞,特别是成纤维细胞。明胶赋予该生物墨水粘度,其转变点(凝胶点)通常为27℃至32℃之间,优选28℃至30℃之间:生物墨水在该温度以上为流体而在该温度以下形成凝胶。特别是当达到其凝胶点以上的温度T1的生物墨水降低到低于该凝胶点的温度T2时,会发生这种凝胶化作用:在这种情况下,其能够立即固化而不会完全铺展,可以保持挤出珠粒的形状。因此,所述生物墨水可以用于加成沉积法。
本发明的另一主题为制造身体组织替代物的方法,其中:
(i)提供根据本发明的生物墨水;
(ii)提供水性溶液(称为“聚合溶液”),其含有1质量%至5质量%之间的钙离子和2U/mL至40U/mL之间(并且优选5U/mL至40U/mL之间,甚至更优选10U/mL至30U/mL之间)的凝血酶;
(iii)使所述生物墨水达到其凝胶点以上的温度T1,并在所述生物墨水的凝胶点以下的温度T2下将所述生物墨水沉积在基底上,在温度T2下,所述生物墨水形成凝胶以形成被称为“未经处理的打印对象”的可控三维物体,
(iv)利用所述聚合溶液对所述未经处理的打印对象进行处理,以将所述未经处理的打印对象固结成身体组织替代物;
(v)任选地,在所述生物墨水含有活细胞的情况下,将所述身体替代物前体在细胞培养基中培养。在36℃至38℃之间的温度下,优选在含有5%的CO 2的潮湿气氛中有利地进行该培养。
该过程可以通过单一沉积或通过加成沉积来完成,单一沉积包括单层或单个墨水珠粒的沉积,而加成沉积可以用于生成具有给定的可控二维延伸的未经处理的打印对象,或甚至是具有可控三维形状的物体。特别地,该方法可以包括通过挤出(例如使用设置有活塞或螺旋的注射器)、通过喷墨(通常涉及在适当温度下将生物墨滴喷射到支架上,从而使生物墨水固化)或通过激光(例如涉及在由能够吸收来自激光的光的材料所形成的层上沉积生物墨水层,然后用激光对由能够吸收来自激光的光的材料所形成的层进行局部辐照,其在保持在合适的温度下的基底上产生墨滴的投射以使生物墨水固化)的沉积(单一或加成)。
有利地,T1为28℃至37℃之间(优选28℃至33℃之间),并且T2为0℃至20℃之间(并且优选4℃至18℃之间)。
最后通过使用聚合溶液处理来对打印对象进行固结:虽然利用钙使藻酸盐凝固可以通过钙的适当去除而至少部分地可逆,但利用凝血酶使纤维蛋白原凝固为不可逆的。在根据本发明的方法中,该固结在对象的整个厚度上为均匀的。
可以通过浸渍来利用所述聚合溶液对所述未经处理的打印对象进行处理,优选在高于T1的温度T3下,并且优选在35℃至38℃下进行。
根据本发明的一个具体实施方案,所述身体组织前体为皮肤替代物前体。在这种情况下,所述生物墨水为含有活成纤维细胞的悬浮液。在36℃至38℃之间的温度下,在含有5%的CO2的潮湿气氛中有利地进行所述培养。所述培养有利地包括持续一天至四十天之间的第一培养阶段和持续五天至四十天之间的第二培养阶段,已知角质形成细胞的水性悬浮液在第一阶段和第二阶段之间沉积在所述皮肤替代物的表面上。还可以通过根据本发明的生物墨水的沉积,特别是以薄层的方式将角质形成细胞沉积在所述皮肤替代物的表面上。
所述皮肤替代物前体可以为平坦的或者可以具有其他形式。在一个实施方案中,所述未经处理的打印对象包括大致平坦的上表面并且具有均匀分布的成纤维细胞,相当于每cm2的平坦的上表面具有0.2×105个至10×105个之间的(优选0.2×105个至2×105个之间的)成纤维细胞。
在另一个实施方案中,成纤维细胞的浓度为每cm3的生物墨水具有0.6×105个至12×105个之间的成纤维细胞,优选每cm3的生物墨水具有1×105个至7×105个之间的成纤维细胞,甚至更优选每cm3的生物墨水具有1×105个至5×105个之间的成纤维细胞;这是优选实施方案。
仍然以制备皮肤替代物为目的,沉积的角质形成细胞的量有利地为每cm2的平坦的上表面具有0.05×105个至50×105个之间的(并且优选0.2×105个至20×105个之间的)角质形成细胞;最优选的浓度为每cm2的平坦的上表面具有0.5×105个至10×105个之间的角质形成细胞。
本发明的再一目的为身体组织替代物,特别是皮肤替代物(或皮肤替代物的前体),其可以通过根据本发明的方法而获得。
根据本发明的方法可以用于制造各种身体替代物。特别地,其可以用于制造皮肤替代物,包括含有特别是成纤维细胞的真皮层、表皮层以及含有特别是角质形成细胞和黑素细胞的角质层。这种结构能够很好地分层和分化。根据本发明的皮肤替代物可以用于研究化妆品或护肤品活性成分的作用,或用于毒理学研究。其还可以用于修复、美容或整形手术。
例如,利用病理性细胞制成的身体替代物可以用于检测活性成分的一般效果或个体效果。
附图说明
图1至图17示出了本发明的一些方面,但不限制本发明的范围。
组织学和免疫组织学分析基于本领域技术人员已知的技术。光学显微照片基于这样的样品的断层成像切片(5μm):包埋在石蜡中并用福尔马林固定,在脱蜡和再水合之后进行染色。使用联配到NIS型软件(Nikon公司)的DS-Ri1型CCD相机以未压缩的16位格式生成图像(每个样品6个代表性观察结果)。使用适当的抗体在5μm冷冻切片上进行免疫荧光实验,并使用与LSM700共聚焦激光扫描系统(Zeiss)联配的Observer ZI光学显微镜观察样品,以未压缩的8位格式生成图像(每个样品6个代表性观察结果)。在4℃下使用含有2%的戊二醛的二甲胂酸钠(0.1M)缓冲液(pH 7.5)对透射电子显微镜样品进行固定,然后使用1%的OsO4溶液进行处理。将样品脱水,然后包埋在已在56℃下聚合3天的环氧树脂中。然后使用乙酸双氧铀(7%)和乙酸铅的溶液对切片进行处理。
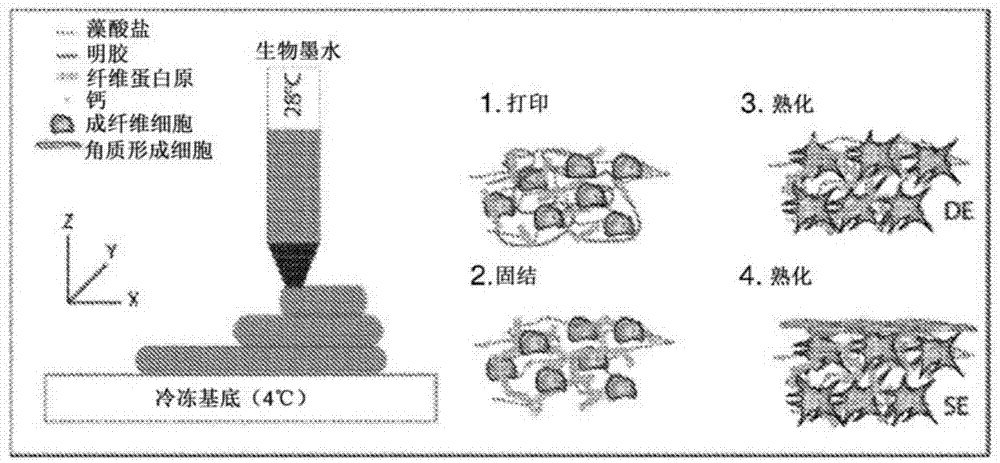
图1图示了根据本发明的方法。
图2涉及实施例2,并示出了根据本发明的皮肤替代物的截面的光学显微照片。右下角的黑色条为50μm长。
图3涉及实施例3,并示出了根据本发明的皮肤替代物的截面的光学显微照片,利用波形蛋白进行免疫组织化学标记。右下角的白色条表示50μm的长度。
图4涉及实施例4b(不包括在本发明中),并示出了使用不包括在本发明中的生物墨水制成的皮肤替代物的截面的光学显微照片。该生物墨水不含任何纤维蛋白原,但含有与GFP(绿色荧光蛋白)偶联的NIH3T3型成纤维细胞。该图示出了当生物墨水不含纤维蛋白原时,成纤维细胞不会三维铺展,不会粘附至固化的生物墨水,最终会死亡。
图5涉及实施例6。图5(a)示出了对于由三种各自含有不同浓度的活细胞的墨水制成的皮肤替代物前体,细胞存活率表示为用Alamar blueTM着色后的光学吸光度的比率(在570nm和600nm处测定吸光度,活细胞的数量取决于这两个吸光度值之间的比率)。
图5(b)示出了使用含有100000个成纤维细胞/mL的生物墨水制成的皮肤替代物在培养7天、10天和14天之后的细胞存活率(以相同方式确定);细胞数量的增加反映了细胞增殖。图5(c)和图5(d)示出了显微镜切片,其中用DAPI染色后产生代表活细胞的灰色遮盖物,用碘化丙啶染色后产生代表死细胞的白色斑点,已知图5(c)涉及培养14天后的身体替代物,而图5(d)涉及用杀死细胞的十二烷基硫酸钠(0.5%)处理后的相同身体替代物(对照实验)。
图6(a)图示了根据本发明的方法的一个实施方案中涉及的步骤。图6(b)和图6(c)图示了在培养的第一个7天期间,浸入多孔板的孔中的(左侧)和培养皿中的(图6(c))培养基中的样品的位置(图6(c)),以及在所述培养基的表面上的样品的位置(图6(b))。
图7至图11涉及实施例7并示出了:
-根据本发明的皮肤切片的光学显微镜切片(图7(a)使用HPS(苏木精-荧光桃红-藏红花)染料,图7(b)使用马松三色染料);
-特异性免疫组织学图像(图7(c)、图7(e)、图7(f)*、图7(g)*、图7(h)*、图7(i)、图7(j)、图7(k)*和图7(l)*、图10(a)、图10(b)、图10(c)、图10(d)*、图10(e)*、图10(f)*),如实施例中所解释的,已知标有星号的图涉及健康的人皮肤,而其他的图涉及根据本发明的皮肤替代物;
-根据本发明的皮肤替代物的透射电子显微镜图像(图8(a)、图8(b)、图8(c)、图8(d)、图11(a)、图11(b)、图11(c)、图11(d)、图11(e))。
图12、图13、图14和图15分别涉及实施例8、实施例9、实施例10和实施例11,并示出了培养根据本发明的身体替代物之后的细胞增殖曲线。
图16涉及实施例12并示出了根据本发明的两种不同的生物墨水的细胞存活率曲线(图16(a)、图16(b))和显微照片(图16(c)和图16(d)),以4种不同的浓度制备每种生物墨水。一种用脂肪组织干细胞制备(图16(a)),而另一种用前脂肪细胞制备(图16(b)),它们为两种类型的脂肪细胞前体。当用根据本发明的方法对这些皮下组织替代物进行生物打印,然后用分化因子(本领域技术人员已知的)进行分化时,获得了功能性皮下组织,因为细胞具有富含脂肪酸的脂质空泡,其为脂肪细胞的典型特征。图16(c)的显微照片示出了利用脂滴包被蛋白A的免疫标记,脂滴包被蛋白A为通常表达在脂质液滴表面上的蛋白。图16(d)的显微照片示出了细胞的脂质含量的着色,该着色为使用尼罗红(一种脂质特异性染料)获得的。
图17涉及实施例13,示出了在不同制造阶段的根据本发明制成的身体替代物前体的照片。
具体实施方式
本发明可用于通过加成沉积(如3D打印)的方式生成身体替代物,特别是等效皮肤。这种新的制造方法节省了时间并且提供了极其有利、简单且可再现的制造身体替代物(特别是皮肤替代物)的方法。制造和熟化时间大大缩短。特别地,该制造方法可以使用以下加成沉积技术:通过挤出的沉积(单一或加成)、喷墨沉积和激光沉积。
根据本发明的生物墨水由可以形成水凝胶的生物材料与细胞的混合物组成。所述生物墨水也可以在使用前由稳定的水性溶液制备。一旦已经制备了正确浓度的溶液,仅需要将其在挤出注射器中小心地与细胞悬浮液(如果目标物为皮肤替代物:通常为成纤维细胞)混合即可。然后将注射器安装在生物打印机上。有利地,设置注射器推动器从而控制流量;例如,可以通过螺杆和马达来控制注射器推动器,其对待挤出的液体或凝胶施加恒定压力。因此,打印了水凝胶对象;该对象通常为平坦的物体。一旦水凝胶已被打印,就必须将其浸入生物相容性聚合溶液中,这将使生物材料能够形成固体网络并保持所需的三维形状。然后在也称为“熟化步骤”的步骤中让细胞发育。在该细胞发育成三维网络期间,聚合的水凝胶中所含的打印的细胞(在皮肤替代物的情况下为成纤维细胞)分泌其细胞外基质。然后水凝胶被逐渐吸收,从而留出空间用于产生将表现出特定功能的新合成的组织,这与“支架”型方法相比是显著的优势,所述“支架”型方法中的生物材料有时为不可再吸收的。
如果目标物为皮肤替代物,则有利地通过沉积根据本发明的生物墨水或通过表面接种来添加角质形成细胞;该步骤之后进行适当的培养,由此可以产生分层且分化的皮肤替代物,其包括真皮、真皮-表皮界面、表皮和角质层。
为了实施根据本发明的方法,必须根据精确的且预定的顺序和比例来制备生物墨水。
在第一步骤中,提供藻酸盐和明胶粉末,将藻酸盐和明胶粉末灭菌并溶解以获得两种原液:第一种为通过在NaCl的溶液(优选浓度为0.2%m/v至5%m/v之间,更优选0.4%m/v至3%m/v之间,并且最优选0.5%m/v至1.4%m/v之间)中溶解明胶粉末(优选以5%m/v至40%m/v之间的浓度)而获得的明胶的水性溶液,第二种为通过在NaCl的溶液(优选浓度为0.2%m/v至5%m/v之间,更优选0.4%m/v至3%m/v之间,并且最优选0.5%m/v至1.4%m/v之间)中以1%m/v至10%m/v之间(优选2%m/v至7%m/v之间)的浓度溶解藻酸盐粉末(优选“极低粘度”品质)而获得的藻酸盐的水性溶液。这两种溶液为稳定的并且可以储存。
有利地,使用相同的NaCl溶液来制备这两种溶液。以下浓度范围特别有利:
·6%m/v至30%m/v的明胶溶液,1%m/v至8%m/v的藻酸盐溶液;NaCl溶液为0.2%m/v至3%m/v(优选0.4%m/v至2%m/v,并且更优选0.5%m/v至1.4%m/v)。
·10%m/v至30%m/v的明胶溶液,2%m/v至6%m/v的藻酸盐溶液;NaCl溶液为0.2%m/v至3%m/v(优选0.4%m/v至2%m/v,并且更优选0.5%m/v至1.4%m/v)。
·15%m/v至26%m/v的明胶溶液,2%m/v至6%m/v(并且优选3%m/v至5%m/v)的藻酸盐溶液;NaCl溶液为0.2%m/v至3%m/v(优选0.4%m/v至2%m/v,并且更优选0.5%m/v至1.4%m/v)。
·17%m/v至24%m/v的明胶溶液,2%m/v至6%m/v(优选3%m/v至5%m/v)的藻酸盐溶液;NaCl溶液为0.4%m/v至2%m/v(优选0.5%m/v至1.4%m/v,并且更优选0.6%m/v至1.3%m/v)。
NaCl在这些溶液中的作用为有利于生物墨水中对细胞发育有利的渗透性环境,并促进藻酸盐的溶解。
藻酸盐粉末为市售可得的粉末,并且优选“低粘度”品质,甚至更优选“极低粘度”品质。
如果生物墨水含有太多藻酸盐,其将变得难以使用加成沉积技术,如果生物墨水未含有足够的藻酸盐,其将不能通过钙离子充分聚合,并且所得的前体可能不够结实。
如果生物墨水含有太多纤维蛋白原,其将变得难以使用加成沉积技术,如果生物墨水未含有足够的纤维蛋白原,则细胞将不会粘附至生物墨水,细胞将不会铺展,并将最终死亡。这就是为什么生物墨水中需要浓度为0.2质量%,并且优选最低含量为0.3%的纤维蛋白原的原因。类似地,必须选择凝血酶的浓度以使得纤维蛋白原能够转化为纤维蛋白。
此外,制备第三溶液,其为纤维蛋白原的水性溶液,优选浓度为1%m/v至15%m/v之间(更优选3%m/v至12%m/v之间,甚至更优选5%m/v至10%m/v之间),其中添加适当浓度的细胞(通常为5万个细胞/mL至1百万个细胞/mL,优选每mL为10万个至60万个)。例如,对于皮肤替代物前体的沉积试验,我们可以制备2mL该溶液。所述细胞具体为成纤维细胞。
生物墨水中的细胞浓度对于根据本发明的制备身体替代物的方法的成功是至关重要的。如果细胞浓度太低,则细胞不能形成与目标天然组织足够相似的组织。例如,在成纤维细胞的情况下,形成的细胞外基质不足以取代生物墨水的成分。在诸如角质形成细胞之类的上皮细胞的情况下,据观察,细胞不是相接的并且最终死亡。
如果生物墨水中的细胞浓度太高,则结构降解而不是发育,并且令人惊讶地观察到其结构改变并且变得不可用(其实际上“消融”了)。
在第三步骤中,由这三种溶液制备生物墨水以获得混合物,其包含合计为100%的约35%至65%(优选约45%至55%,甚至更优选约50%)的第一溶液(明胶)、约15%至35%(优选20%至30%之间,甚至更优选约25%)的第二溶液(藻酸盐)和约15%至35%(优选约20%至30%,甚至更优选约25%)的第三溶液,这些百分比表示为体积百分比。
在第四步骤中,制备第四水性溶液,其为聚合溶液。其包含约1%m/v至5%m/v并且优选约3%m/v的钙溶液,其中添加有最终浓度为约10U/mL的凝血酶。必须以足够的量获得该聚合溶液,从而使得通过3D打印得到的对象能够浸渍以获得均匀的聚合凝胶。该第四步骤可以在前三个步骤之前或之后或期间进行,但是该第四溶液的储存时间是有限的;发明人已经观察到,当在即将使用之前制备第四溶液时,生物墨水的固化和聚合更均匀。
如果所述第四溶液未含有足够的钙,则藻酸盐的聚合不会发生或不充分。如果第四溶液含有太多的钙,则细胞的存活率将会降低,因为钙可能具有细胞毒性。
在第五步骤中进行打印,换句话说,使墨水沉积在支架上。在此之前,使墨水的温度T1充分升高以熔化明胶。该温度T1取决于墨水的确切组成,并且必须通过简单的试验来确定:对于上述最优选的组成范围,大约28℃至29℃的温度T1可以是合适的。该打印可以通过任何适当的方式进行,例如使用安装在托架上的注射器,注射器在托架上沿轴线移动,并且托架在垂直于所述轴线的方向上移动。将基底放置在桌子或平台上。对于承载注射器的托架,或者对于承载基底的桌子或平台,可以配置沿着高度轴的移动装置。
有利地,冷却基底以便使明胶立即固化;该基底温度T2取决于墨水的组成和温度T1及其沉积速率;可以通过简单的试验来确定温度T2。在另一个实施方案中,打印组件位于冷室中,换句话说,在温度T2下,任选地,可将注射器加热至温度T1。该实施方案的有利之处在于,可以制造更厚或更复杂形状的结构,对于此类结构而言,通过刚沉积的墨水层的热传导不能使当前沉积的墨水层冷却得足够快。
在第六步骤中,通过使用聚合溶液(第四溶液)对未经处理的打印对象进行处理,优选通过完全浸渍,从而使其固结;由此得到所谓的“固化对象”。未经处理的打印对象与聚合溶液之间的接触时间优选为至少十五分钟。在该步骤中,聚合溶液的温度T3优选高于明胶的熔融温度。这意味着明胶可变成水相,从而从固化对象中除去绝大部分的明胶。由此得到所谓的“身体组织前体”,其可以为“皮肤组织前体”。温度T3可以为约37℃。
步骤5和步骤6图示于图1。
在第六步骤中,培养身体组织前体(其可以为皮肤替代物前体)以获得身体组织替代物(例如皮肤替代物)。该培养分三个阶段进行。在第一培养阶段期间,优选在约37℃的温度下,将所述皮肤替代物前体浸入合适的成纤维细胞培养基中。该培养的持续时间可以为三天至二十天之间(使用角质形成细胞最多40天);持续时间优选八天至十五天之间;对于成纤维细胞,十二天的持续时间是最佳的。
在该第一培养阶段结束时,将角质形成细胞的水性悬浮液涂布到皮肤替代物前体的表面上。每cm2具有1×105个至5×105个之间的细胞的浓度为合适的。
然后,在第二培养阶段,将皮肤替代物前体浸入适当的培养溶液中,例如格林氏培养基;必须定期(优选每天)添加营养素。该第二培养阶段持续五天至十天之间,优选约七天。温度为37℃。
最后,在第三培养阶段期间,将皮肤替代物前体保持在分化培养基的表面上,并将其培养15天至30天之间,优选18天至25天之间,通常21天。温度为37℃。从而获得皮肤替代物。所述分化培养基通常包含DMEM和特定添加剂;在一个有利的实施方案中,这些添加剂为氢化可的松(0.4μg/mL)、胰岛素(5μg/mL)、牛血清白蛋白(8mg/mL)。
根据本发明的生物打印方法可用于获得尺寸为几厘米或甚至几分米的对象。打印机类似于传统的FDM(熔融沉积成型)3D打印机,但以注射器推动器取代了塑料挤出器。
根据本发明的生物墨水满足三个目标:
-在打印(挤出)过程中保持足够的水凝胶流变性,
-形成均匀聚合的对象,保持其所得的3D形状,
-使细胞能够在3D网格中发育。
这三种功能已通过使用以下生物材料得到验证。将明胶(一种相转变温度为29℃的胶原基聚合物)用作流变性组分,以确保生物墨水在打印后保留在冷却的基底上,明胶随后可在方法的后续步骤中除去。将藻酸盐(一种碳水合物聚合物,具有在钙存在下形成水凝胶的性质)用作结构元件,一旦明胶溶解,就赋予打印的生物墨水机械稳定性。纤维蛋白原(一种糖蛋白,具有在凝血酶作用下形成水凝胶的能力)由于其细胞结合成分(RGD模式)被用作构造元件和熟化元件。
图6(a)图示了所用方法的过程。根据本发明的方法包括沉积含有正常人真皮成纤维细胞(NHDF)的皮肤替代物前体。在37℃下在培养基中完全浸渍4天来进行培养以刺激细胞外基质的合成。下一步骤为种植正常人表皮角质形成细胞(NHEK)并且再培养另外的3天以刺激细胞增殖、迁移和粘附。在培养开始后第7天之后,在气-液界面处继续培养以获得细胞分化,直至合计21天。
可以在多孔板的孔中或在皮式培养皿中进行培养。图6(c)图示了浸没时的培养条件(用于第一个七天);在左侧的多孔板3中,和在右侧的培养皿中。在“多孔板”变体中,将生物打印的身体替代物前体1置于位于多孔板的孔3中的培养插入物2中。培养基4浸没了身体替代物前体1。在“培养皿”变体中,将生物打印的身体替代物前体1置于含有培养基4的皿体8中;皿盖5覆盖皿体8。
图6(b)图示了未浸没时的培养条件(从第8天开始使用);在左侧的多孔板3中,和在右侧的培养皿中。在“多孔板”变体中,将身体替代物1置于培养插入物2中,其下表面接触位于多孔板的孔3中的培养基4的上表面。在“培养皿”变体中,将身体替代物1放置在不锈钢格栅6上,不锈钢格栅6略微浸没在皿体8所含的培养基4中。格栅6的上表面覆盖有一张吸水纸;皿盖5覆盖皿体8。
本发明有许多应用。根据本发明的制造身体组织替代物的方法可用于制造性质不同的身体组织替代物。可以将所有类型的活细胞引入到根据本发明的生物墨水中。例如,可以将所有其他类型的皮肤细胞引入到生物墨水中(特别是ADSC(脂肪衍生的干细胞)、脂肪细胞和前脂肪细胞、内皮细胞、神经细胞、真皮树突细胞、朗格汉斯细胞、黑素细胞、梅克尔细胞、皮脂腺细胞、巨噬细胞;肥大细胞、毛囊上皮细胞、毛囊乳头成纤维细胞,诱导多能干细胞)。特别地,该方法可用于制造各种身体组织的替代物,特别是角膜、口腔黏膜、食道、软骨、血管、阴道黏膜的替代物。
通常,可以将所有类型的细胞(优选活细胞)引入到本发明的框架中。
细胞可以为胚胎干细胞(全能、多能和三能)或分化型(生殖细胞或体细胞)、从所有的人或动物的组织或器官中分离的原代细胞,例如生殖细胞(配子),体细胞和成体干细胞。细胞可以具体来源于结缔组织或支持组织(如骨骼、韧带、软骨、肌腱、脂肪组织)、肌肉组织(如血管壁的平滑肌细胞、心肌、骨骼肌)、神经组织和上皮细胞(如血管、下颌腺管、口腔黏膜、舌背、硬腭、食道、胰腺、肾上腺、前列腺、肝脏、甲状腺、胃、肠、小肠、直肠、肛门、胆囊、甲状腺滤泡、淋巴管、皮肤、汗腺、体腔间皮、卵巢、输卵管、子宫、子宫内膜、子宫颈(子宫颈内膜、外宫颈)、阴道、大阴唇、肾直小管、睾丸网、输出小管、附睾、输精管、射精管、尿道球腺、精囊、口咽、喉、声带、气管、细支气管、角膜、鼻、肾近曲小管、肾远端管、肾盂、输尿管、膀胱、前列腺尿道)。
细胞可以为中胚层、外胚层或内胚层来源的细胞。
人或动物细胞可以选自由下列组成的组:淋巴细胞(特别是B淋巴细胞、T淋巴细胞、细胞毒性T淋巴细胞、NKT淋巴细胞、调节性T淋巴细胞、辅助淋巴细胞)、骨髓细胞、粒细胞、嗜碱性粒细胞、嗜酸性粒细胞、中性粒细胞、多分叶核中性粒细胞、单核细胞、巨噬细胞、网织红细胞、血小板、肥大细胞、血小板、巨核细胞、树突细胞、甲状腺细胞、甲状腺上皮细胞、滤泡旁细胞、甲状旁腺细胞、甲状旁腺主细胞、嗜酸细胞、肾上腺细胞、嗜铬细胞、松果体细胞、神经胶质细胞、成神经胶质细胞(glioblasts)、星形胶质细胞、少突胶质细胞、小神经胶质细胞、大细胞神经分泌细胞、星状细胞、伯特歇尔细胞;垂体细胞、促性腺激素细胞、促肾上腺皮质激素细胞、促甲状腺激素细胞、生长激素细胞、催乳素细胞、肺细胞(I型肺泡壁细胞、II型肺泡壁细胞、克氏细胞);杯状细胞、肺泡巨噬细胞、心肌细胞、周皮细胞、胃细胞(胃主细胞、壁细胞、杯状细胞、帕内特细胞、G细胞、D细胞、ECL细胞、I细胞、K细胞、S细胞、肠内分泌细胞、肠嗜铬细胞、APUD细胞)、肝细胞(肝实质细胞、库普弗细胞)、骨骼细胞(成骨细胞、骨细胞、破骨细胞、成牙质细胞、成牙骨质细胞、成釉细胞)、软骨骼细胞(成软骨细胞、软骨细胞)、毛细胞(丝胞)、皮肤细胞(角质形成细胞、脂肪细胞、成纤维细胞、黑素细胞、痣细胞)、肌肉细胞(肌细胞、成肌细胞、肌管)、肌腱细胞、肾脏细胞(足细胞、肾小球旁细胞、肾小球内系膜细胞、肾小球外系膜细胞、致密斑细胞)、精子、支持细胞、睾丸间质细胞、卵母细胞。
细胞也可以分离自患病组织,例如癌组织。
例如,细胞可以分离或衍生自许多类型的癌:乳腺癌;胆道癌;膀胱癌;脑癌,包括成胶质细胞瘤和成神经管细胞瘤;宫颈癌;绒毛膜癌;结肠癌;子宫内膜癌;食道癌;胃癌;血液肿瘤,包括白血病;上皮内瘤样病变,包括博温氏病和佩吉特氏病;肝癌;肺癌;淋巴瘤,包括霍奇金氏病;成神经细胞瘤;口腔癌,包括表皮样癌;卵巢癌,包括上皮细胞、基质细胞、生殖细胞和间充质细胞的癌;胰腺癌;前列腺癌;直肠癌;肉瘤,包括平滑肌肉瘤、横纹肌肉瘤、脂肪肉瘤、纤维肉瘤和骨肉瘤;皮肤癌,包括黑色素瘤、梅克尔细胞癌、卡波西氏肉瘤、基底细胞癌和表皮样癌;睾丸癌,包括生殖细胞系肿瘤,如精原细胞瘤、非精原细胞瘤(畸胎瘤、绒毛膜癌)、间质瘤和生殖细胞肿瘤;甲状腺癌,包括甲状腺腺癌和髓样癌;肾癌,包括腺癌和肾母细胞瘤。
细胞可以为脐带血细胞、干细胞、胚胎干细胞、成体干细胞、癌症干细胞、祖细胞、自体细胞、同系异体移植细胞、同种异体细胞、异种移植细胞和遗传修饰细胞。细胞可以为诱导祖细胞。细胞可以为分离自受试者的细胞,例如供体受试者,其已经被干细胞相关的基因转染以诱导细胞的多能性。干细胞相关的基因可以选自由下列组成的组:Oct3、Oct4、Sox1、Sox2、Sox3、Sox15、Klf1、Klf2、Klf4、Klf5、Nanog、Lin28、C-Myc、L-Myc和N-Myc。细胞可以为已经从用干细胞相关基因转染以诱导多能性的受试者中分离并沿预定细胞系分化的细胞。
因此,根据本发明的身体组织替代物不仅可以用作皮肤替代物而用于化妆品、药物和化学产品的测试,而且还可以用于临床应用,例如用于修复和重建手术。例如,根据本发明的皮肤替代物可以用作烧伤受害者的皮肤。根据本发明的通过加成沉积制造身体组织替代物的方法还可以用于制造复杂对象,从而(例如)利用取自将使用耳朵或鼻子替代物的患者的细胞制造所述替代物。
通常,根据本发明的身体替代物可以被植入患者(人或动物)体内,可以用作研究感兴趣的物质(特别是药物或化妆品,或表征化学物质)的模型,或者可以用作教学的模型对象(特别是用于实际工作和用于手术预备试验)。有利地,根据本发明的身体替代物可用于以下外科手术应用:用于严重烧伤受害者的皮肤和软骨(耳朵、鼻子)、牙龈的植入、人造食道、人造尿道和输尿管、角膜。
此外,根据本发明的身体皮肤替代物可以用于表征各种化学物质在身体组织中的毒性、效果或渗透力。其也可以用于过敏原检测。
显然,本发明可以无差别地应用于人细胞和其他动物细胞,特别是其他哺乳动物细胞。
实施例
以下实施例举例说明了本发明的一些方面,但不限制本发明的范围。
实施例1:细胞的培养和收集
该实施例举例说明了用于扩增和收集细胞(成纤维细胞和角质形成细胞)的方法,然后所述细胞可用于制造根据本发明的皮肤替代物。
皮肤角质形成细胞和成纤维细胞分离自人包皮。
使用含有DMEM和Ham's F12(以3:1的比例)的被称为“格林氏培养基”的培养基,在使用本领域技术人员熟知的技术辐照的人成纤维细胞上培养角质形成细胞,向其中添加腺嘌呤(24.3μg/mL)以及人表皮生长因子(10ng/mL)、氢化可的松(0.4μg/mL)、胰岛素(5μg/mL)、2×10-9M的三碘-L-甲状腺原氨酸(5μg/mL)、10-10M的异丙肾上腺素、青霉素(100U/mL)、链霉素(100μg/mL)和10%的胎牛血清。使用在第2、3和4轮传代期间收集的角质形成细胞。
在37℃下含5%的CO2的气氛中,在含有DMEM、20%的新生小牛血清和抗生素的适当的培养基中培养成纤维细胞。使用第5、6、7和8轮传代期间收集的成纤维细胞。
实施例2:通过加成技术沉积(根据本发明的方法)
通过将明胶粉末以20%m/v溶解在0.9%m/v的NaCl溶液中来制备明胶的第一水性溶液。通过将藻酸盐粉末(极低粘度)以4%m/v溶解在0.9%m/v的NaCl溶液中来制备藻酸盐的第二水性溶液。制备8%m/v的纤维蛋白原的第三水性溶液,其中添加细胞浓度为2百万个细胞/mL的成纤维细胞悬浮液(实施例1中得到的)。
然后将这三种溶液混合以获得混合物(称为“生物墨水”),其包含50体积%的第一溶液(明胶)、25体积%的第二溶液(藻酸盐)和25体积%的第三溶液(在纤维蛋白原中恢复的成纤维细胞)。
制备含有3%m/v的钙和最终浓度为20U/mL的凝血酶的水性聚合溶液。
所述生物墨水在29℃下具有粘性转变。将其加热至约30℃的温度,并在该温度下使用,用于根据已知类型的沉积技术进行加成沉积,通过装配有注射器推动器的注射器以便能够控制流量。基底的温度为约4℃,因此沉积的墨水立即固化。从300μm直径的珠粒开始,在大约几平方厘米的区域上沉积总厚度为约10mm的若干层。由此得到平坦的对象,其具有均匀分布的成纤维细胞,密度为每cm2具有2.5×105个成纤维细胞。
然后将以这种方式沉积的各未经处理的打印对象浸在聚合溶液中,以使保持在37℃的纤维蛋白原交联并凝结,从而聚合藻酸盐并使纤维蛋白原凝结。在这种情况下,由此得到的平坦的对象被称为“皮肤替代物前体”。
实施例3:皮肤替代物前体的熟化(根据本发明的方法)
将皮肤替代物前体在含有1mM抗坏血酸2-磷酸盐的成纤维细胞培养基中培养12天;每天使皮肤替代物前体得到营养。十二天后,将角质形成细胞以每cm2 2.5×105个细胞的浓度涂布于皮肤替代物前体的表面上。
如上所述,将皮肤替代物前体浸入格林氏培养基中进行第一个七天培养期的培养,培养基具有浓度为1mM的抗坏血酸2-磷酸盐和抗生素;每天使皮肤替代物前体得到营养。
然后对皮肤替代物前体进行第二个21天培养期的培养,将其保持在分化培养基的液体表面处,分化培养基含有DMEM以及氢化可的松(0.4μg/mL)、胰岛素(5μg/mL)、抗坏血酸2-磷酸盐和抗生素;分化培养基含有8mg/mL的牛血清白蛋白。
由此得到皮肤替代物。其可用于进行化妆品或化学产品的测试。
图2示出了此类皮肤替代物的截面。可以看到表皮包括在其外围的真正的角质层,并且包含角质形成细胞。真皮-表皮界面轮廓分明。真皮含有成纤维细胞(在图2中仅可见细胞核,被黑线包围)。可以在真皮中看到孔;这些孔逐渐填充有成纤维细胞分泌的细胞外基质。
图3示出了皮肤替代物中成纤维细胞细胞骨架的中间纤维(用波形蛋白进行免疫组织化学标记)。可以看到细胞骨架的三维形式,其类似于健康的天然真皮中发现的形态。
实施例4:各种不令人满意的试验
该实施例包括试图使用根据现有技术的方法或不令人满意的新方法制造皮肤替代物。
实施例4a:基于PEG二丙烯酸酯的光致聚合墨水
使用基于光致聚合的PEG-DA(聚乙二醇二丙烯酸酯)的生物墨水,利用类似于本发明所述方法的方法来制备皮肤替代物前体。光引发剂为IrgacureTM 819(CIBA的双(2,4,6-三甲基苯甲酰基)-苯基氧化膦)。培养之后,2天后观察到细胞死亡率为100%。不希望受理论的束缚,发明人认为光引发剂本身不是细胞毒性的,但光引发剂促进了自由基的产生。
实施例4b:根据本发明但不含纤维蛋白原的墨水
制造不含纤维蛋白原的生物墨水,其所有其他成分与本发明一致,NIH3T3细胞系具有荧光小鼠成纤维细胞。使用根据本发明的方法中的步骤由该生物墨水制备皮肤替代物前体。在这种情况下,尽管凝胶保持良好,但由于凝胶内缺乏细胞粘附形式,细胞在培养期间发育得不令人满意。从图4中可以看出,细胞没有铺展并最终消亡。因此,该皮肤替代物不能用于化妆品、药物和化学产品的测试。
实施例4c:墨水过于流动
利用根据本发明的方法,使用不同类型的藻酸盐,具体通过其粘度来区分:以“低粘度”和“高粘度”来代替“极低粘度”。可以看出,使用“高粘度”墨水不能获得令人满意的挤出效果。可以改变该方法以使用“低粘度”墨水得到未经处理的打印对象,但是该实施方案使得挤出较不稳定,因此不是优选的。
例4d:其他失败的原因
在以下情况中观察到失败(形成形态和/或质量差的皮肤替代物前体):
-施用之后,生物墨水与聚合溶液之间的接触时间太短(小于约15分钟);
-生物墨水沉积物在聚合过程中的整体浸渍失败;
-聚合溶液的老化。
实施例5:制造具有3个皮肤层的全皮肤:皮下组织、真皮和表皮(根据本发明的方法)。
三个皮肤层可以使用相同的方法打印,但使用包含生物墨水和不同的细胞的三种不同的注射器:
第一种注射器包含稀释在生物墨水中的前脂肪细胞和/或成熟脂肪细胞。以多层的方式打印这种皮下组织。其首先被打印以形成皮肤的最深层。
如方法中所述,第二种注射器包含成纤维细胞的生物墨水。在先前打印的皮下组织的表面上以多层的方式打印这部分真皮。
第三种注射器包含稀释在略微不同的生物墨水中的角质形成细胞。在真皮层的表面上以单层或多层的方式打印这种表皮。可以在任意时间将比例为1/10至1/2的黑素细胞添加到角质形成细胞悬浮液中,从而得到着色的皮肤。
实施例6:具有不同细胞含量的根据本发明的生物墨水
制备了三种根据本发明的生物墨水,它们之间的唯一区别为它们的活细胞含量(人成纤维细胞):每mL生物墨水具有50,000个细胞、每mL生物墨水具有100,000个细胞、每mL生物墨水具有200,000个细胞。使用根据本发明的方法利用这些生物墨水制成皮肤替代物前体。将打印的皮肤替代物前体在37℃、5体积%的CO2下培养4天,并通过Alamar blueTM试验来确定活细胞的比例(在570nm和600nm处测定吸光度,活细胞的数量为这两个吸光度值之间的比率的结果)。据观察,生物墨水能够使皮肤替代物中的成纤维细胞存活,并且皮肤替代物前体中这些活细胞的浓度与生物墨水中的活细胞浓度成比例(参见图5a)。
对于给定的细胞密度(实际上为100,000),在以上给出的培养条件下培养7天、10天和14天后测定活细胞的数量。结果示于图5(b)。可以看出,随着时间的推移,这些细胞在皮肤替代物中增殖。
14天后,用DAPI(其染色活细胞的细胞核)和碘化丙啶(其染色死细胞的细胞核)对皮肤替代物进行染色。图5(c)示出了光学显微镜切片上的DAPI染色(灰色遮盖物)和一些由碘化丙啶染色的区域(白点)。图5(d)示出了对相同的样品进行的对照实验,其中细胞已经被十二烷基硫酸钠(0.5%)的处理杀死:可以看到白色的碘化丙啶染色。
实施例7:根据本发明的皮肤替代物的制备
制备根据本发明的皮肤替代物,更具体而言,使用图6所示的方法。图7(a)示出了使用根据本发明的方法获得的真皮基底的截面;该图是用HPS(苏木精-荧光桃红-藏红花)染色得到的。图7(b)示出了相同的皮肤替代物(厚度5μ)的截面;使用马松三色进行染色。在生物打印的皮肤中可以看到成纤维细胞的细胞核(N)和由成纤维细胞新合成的细胞外基质(ECM)。图7(c)、图7(d)和图7(e)示出了在根据本发明的生物打印的皮肤中(覆盖表皮和真皮的区域)对胶原I(图7(c)),胶原V(图7(d))和原纤维蛋白(图7(e))特异的免疫组织学标记,而图7(f)、图7(g)和图7(h)出于对照的目的,示出了在相同条件下在人皮肤上获得的相应图像(这六幅图上的一些线条已经用虚线重新绘制,以使其更容易被看到)。
还检测到波形蛋白和弹性蛋白(图中未显示)。
图7(i)和图7(j)示出了在根据本发明的生物打印的皮肤中(在覆盖表皮和真皮的另一区域)对层粘连蛋白332(图7(i))和胶原VII(图7(j))特异的免疫组织学标记,而图7(k)和图7(1)出于对照的目的,示出了在相同条件下获得的人皮肤的相应图像。
图8(a)和图8(b)示出了图7(c)中生物打印的皮肤区域的放大图,即成纤维细胞(图8(a))和新合成的胶原(图8(b))-符号N、Re和Rb分别表示细胞核、网状组织和核糖体。在图8(a)中,左侧的黑色条表示0.5μm的长度,而图8(b)的黑色条表示200nm的长度。
图8(c)和图8(d)示出了图8(b)的细节,即条纹状胶原(图8(c))和可溶性弹性蛋白的沉积物(图8(d))。
图9示出了根据本发明的生物打印的皮肤的图像。数字标记指明超微结构特征,即细胞角蛋白10的中间纤维、半桥粒11、透明板(lamina lucida)12、致密层13、锚定纤维14、胶原纤维15。右下方的垂直条表示0.2μm的长度。
图10(a)、图10(b)和图10(c)示出了在根据本发明的生物打印的皮肤中(在覆盖表皮和真皮的另一区域)对细胞角蛋白10(图10(a))、la丝聚蛋白(图10(b))和兜甲蛋白(图10(c)特异的免疫组织学标记,而图10(d)、图10(e)和图10(f)出于对照的目的,示出了在相同条件下在人皮肤上获得的相应图像。
图11(a)示出了根据本发明的皮肤替代物的另一超微结构图像;这个区域示出了角质层。图11(b)、图11(c)、图11(d)和图11(e)示出了细节,即角化桥粒(图11(b))、桥粒(图11(c))、透明角质颗粒(图11(d))、角质板层小体(图11(e))。
该实施例表明,使用根据本发明的方法获得的皮肤替代物不仅在形态上与健康人类皮肤相似,而且还表达了与表皮分化和增殖相关的所有生物标志物(如细胞角蛋白10、丝聚蛋白),能够作为功能性屏障(具体参见兜甲蛋白的表达),并且表达通常在细胞外基质中发现的蛋白(特别是胶原I、胶原V、原纤维蛋白、波形蛋白、弹性蛋白):这说明了根据本发明的皮肤替代物与人皮肤的紧密的形态学、组织学和功能相似性。
实施例8:具有人内皮细胞的根据本发明的身体替代物。
制备两种根据本发明的生物墨水,一种为每毫升含有200,000个人皮肤的内皮细胞,而另一种为每毫升含有400,000个人皮肤的内皮细胞。沉积成身体替代物前体,并在培养4天、8天和14天之后利用上述Alamar blueTM试验来测定细胞的存活率。图12示出了打印的内皮细胞的增殖作为初始细胞密度的函数。
实施例9:具有人角膜成纤维细胞的根据本发明的身体替代物。
根据本发明制备两种生物墨水,一种为每毫升含有150,000个人角膜成纤维细胞,而另一种为每毫升含有200,000个人角膜成纤维细胞。沉积身体替代物前体,并在培养4天和8天后用上述Alamar blueTM试验测定细胞的存活率。图13示出了打印的细胞的增殖作为初始细胞密度的函数。
实施例10:具有人口腔黏膜成纤维细胞的根据本发明的身体替代物。
根据本发明制备两种生物墨水,一种含有150,000个人口腔黏膜成纤维细胞,而另一种含有200,000个人口腔黏膜成纤维细胞。沉积身体替代物前体,并在培养4天和8天后用上述Alamar blueTM试验测定细胞的存活率。图14示出了打印的细胞的增殖作为初始细胞密度的函数。
实施例11:具有人毛囊真皮乳头成纤维细胞的根据本发明的身体替代物
根据本发明制备两种生物墨水,一种含有150,000个人毛囊真皮乳头成纤维细胞,而另一种含有200,000个人毛囊真皮乳头成纤维细胞。沉积身体替代物前体,并在培养4天和8天后用上述Alamar blueTM试验测定细胞的存活率。图15示出了打印的细胞的增殖作为初始细胞密度的函数。
实施例12:具有不同活细胞的生物墨水
以与实施例6中所述方式相似的方式,根据本发明制备四种生物墨水,在每毫升生物墨水中,一种含有100,000个脂肪干细胞,其他的含有200,000个、400,000个和600,000个脂肪干细胞,并且制备身体替代物前体。据观察,生物墨水能够使脂肪干细胞在身体替代物前体中存活,并且所述前体中的这些活细胞的浓度与生物墨水中的活细胞的浓度成比例(参见图16a)。
类似地,根据本发明制备四种生物墨水,在每毫升生物墨水中,一种含有100,000个前脂肪细胞,其他的含有200,000个、400,000个和600,000个前脂肪细胞,并且制备身体替代物前体。据观察,生物墨水能够使脂肪的前脂肪细胞干细胞在身体替代物前体中存活,并且所述前体中的这些活细胞的浓度与生物墨水中的活细胞的浓度成比例(参见图16b)。上文已经描述了图16(c)和图16(d)(在“附图”部分中)。
实施例13:耳朵替代物前体的制备
在使用根据本发明的方法中,制备了最大尺寸为约8cm的人耳朵替代物的前体。在37℃的温度下,使用由Sigma Aldrich(法国)提供的10%(w/v)的牛明胶(CAS No.9000-70-8)、由Aesar(法国)提供的0.5%(w/v)的藻酸盐(极低粘度,CAS No.9005-38-3)和由Sigma Aldrich(法国)提供的2%(w/v)的纤维蛋白原(CAS No.9001-32-5)制备生物墨水。即将进行3D打印之前,以每毫升生物墨水具有1×106个细胞的含量添加新鲜胰蛋白酶消化的细胞。将均质化的生物墨水转移到注射器中;将该装满的注射器储存在15℃至37℃之间,以获得所需的流变性能。微量移液管的直径为200μm。基底处于环境温度下。将未经处理的打印对象(图17,图像1)在凝血酶(20U/mL,CAS No.9002-04-4)存在下在CaCl2溶液(100mM)中处理30分钟,参见图17(图像B和图像C)。
实施例14:加成沉积法的流变学
对于根据本发明的生物墨水,在28℃下,使用具有锥形/平面几何形状(25mm)的旋转粘度计(AR 2000,TA Instruments公司)使用剪切速率扫描模式(在0.1至100s-1之间)表征粘度,该温度代表加成沉积期间的温度。使用等式来计算剪切速率
其中τw[Pa]、和η[Pa.s]分别代表剪切应力、挤出喷嘴壁w上的剪切速率和生物墨水的粘度。
对于等于Q=0.183mm3.s-1的确定的生物墨水流量,根据下式使用泊肃叶方程计算剪切速率:
由半径(R)、剪切速率和粘度(η)开始,确定喷嘴入口(t)后和喷嘴出口(b)处的剪切应力(τw)。
表1:
通过截头锥形(frustro-conical)喷嘴(长度15mm)以流量Q=0.183mm3.s-1挤出根据本发明的生物墨水的方法的流变学表征。
可以看出,使用根据本发明的生物墨水并且在实际操作条件下,剪切应力为大约50Pa。这解释了在前面的实施例中观察到的优异的细胞存活率,已知据现有技术中的报道,对于许多类型的细胞而言,当对其施加约5,000Pa的剪切应力时,细胞存活率降低。因此,根据本发明的生物墨水可以用于使用加成沉积技术制造二维对象或三维对象的方法,特别是使用市售可得的注射器和孔口进行挤出的方法。
实施例15:用含有病理性细胞的生物墨水制成的身体组织替代物用于药理学试验。
在使用根据本发明的方法中,制备了含有病理性细胞的皮肤组织替代物,病理性细胞即取自患有局部皮炎的患者的成纤维细胞和角质形成细胞。该皮肤组织替代物用作研究模型,以研究该疾病的分子机制,并研究特别是局部形式(含有活性成分的乳膏)或全身形式(活性成分的培养基溶液)的各种药物和化妆品配制品的效果。
权利要求书(按照条约第19条的修改)
1.制造用于加成沉积的生物墨水的方法,其中:
(a)提供第一水性溶液,其含有5质量%至40质量%之间的明胶(优选6质量%至30质量%之间)和0质量%至5质量%之间的NaCl;
(b)提供第二水性溶液,其含有1质量%至12质量%之间的藻酸盐(优选1质量%至8质量%之间)和0质量%至5质量%之间的NaCl;
(c)提供第三水性溶液,其含有1质量%至15质量%之间的纤维蛋白原(优选3质量%至15质量%之间)和活细胞悬浮液;
(d)生成混合物,其包含:
约35体积%至65体积%的所述第一溶液;
约15体积%至35体积%的所述第二溶液;
约15体积%至35体积%的所述第三溶液;
选择这些比例使得总计100%,
并且在所述方法中:
-步骤(a)、步骤(b)和步骤(c)的顺序是不重要的,
-选择NaCl含量以使得:在合并的所述第一溶液和所述第二溶液中,NaCl含量为0.2质量%至5质量%之间,优选0.2质量%至3质量%之间,甚至更优选0.4质量%至2质量%之间,
-所述活细胞为从所有的人或动物的组织或器官中分离的原代细胞。
2.根据权利要求1所述的方法,其特征在于,所述活细胞选自由下列形成的组:干细胞(全能、多能和三能)或分化型(生殖细胞或体细胞)、从所有的人或动物的组织或器官中分离的原代细胞(例如生殖细胞)、体细胞、干细胞;来源于以下的细胞:结缔组织或支持组织(如骨骼、韧带、软骨、肌腱、脂肪组织)、肌肉组织(如血管壁的平滑肌细胞、心肌、骨骼肌)、神经组织和上皮细胞(如血管、下颌腺管、口腔黏膜、舌背、硬腭、食道、胰腺、肾上腺、前列腺、肝脏、甲状腺、胃、肠、小肠、直肠、肛门、胆囊、甲状腺滤泡、淋巴管、皮肤、汗腺,体腔间皮、卵巢、输卵管、子宫、子宫内膜、子宫颈(子宫颈内膜、外宫颈)、阴道、大阴唇,肾直小管、睾丸网、输出小管、附睾、输精管、射精管、尿道球腺、精囊、口咽、喉、声带、气管、细支气管、角膜、鼻、肾近曲小管、肾远端管、肾盂、输尿管、膀胱、前列腺尿道);中胚层、外胚层或内胚层来源的细胞;淋巴细胞(特别是B淋巴细胞、T淋巴细胞、细胞毒性T淋巴细胞、NKT淋巴细胞、调节性T淋巴细胞、辅助淋巴细胞)、骨髓细胞、粒细胞、嗜碱性粒细胞、嗜酸性粒细胞、中性粒细胞、多分叶核中性粒细胞、单核细胞、巨噬细胞、网织红细胞、血小板、肥大细胞、血小板、巨核细胞、树突细胞、甲状腺细胞、甲状腺上皮细胞、滤泡旁细胞、甲状旁腺细胞、甲状旁腺主细胞、嗜酸细胞、肾上腺细胞、嗜铬细胞、松果体细胞、神经胶质细胞、成神经胶质细胞、星形胶质细胞、少突胶质细胞、小神经胶质细胞、大细胞神经分泌细胞、星状细胞、伯特歇尔细胞;垂体细胞、促性腺激素细胞、促肾上腺皮质激素细胞、促甲状腺激素细胞、生长激素细胞、催乳素细胞、肺细胞(特别是I型肺泡壁细胞、II型肺泡壁细胞、克氏细胞);肺泡巨噬细胞、心肌细胞、周皮细胞、胃细胞(特别是胃酶细胞(胃主细胞)、壁细胞、杯状细胞、帕内特细胞、G细胞、D细胞、ECL细胞、I细胞、K细胞、S细胞、肠内分泌细胞、肠嗜铬细胞、APUD细胞)、肝细胞(特别是肝实质细胞、库普弗细胞)、骨骼细胞(特别是成骨细胞、骨细胞、破骨细胞、成牙质细胞、成牙骨质细胞、成釉细胞)、软骨骼细胞(特别是成软骨细胞、软骨细胞)、毛细胞(特别是丝胞)、皮肤细胞(特别是角质形成细胞、脂肪细胞、成纤维细胞、黑素细胞、痣细胞)、肌肉细胞(特别是肌细胞、成肌细胞、肌管)、肌腱细胞、肾脏细胞(特别是足细胞、肾小球旁细胞、肾小球内系膜细胞、肾小球外系膜细胞、致密斑细胞)、精子、睾丸支持细胞、睾丸间质细胞、卵母细胞。
3.根据权利要求1或2所述的方法,其特征在于,所述活细胞分离自结缔组织或支持组织、肌肉组织、神经组织或上皮细胞。
4.根据权利要求2或3所述的方法,其特征在于,所述活细胞选自由下列组成的组:脐带血细胞、干细胞、胚胎干细胞、成体干细胞、癌症干细胞、祖细胞、自体细胞、同系异体移植细胞、同种异体细胞、异种移植细胞、遗传修饰细胞、诱导祖细胞、转染细胞。
5.能够通过根据权利要求1至4中任一项所述的方法获得的生物墨水。
6.制造身体组织替代物的方法,其中:
(i)提供根据权利要求5所述的生物墨水;
(ii)提供水性溶液(称为“聚合溶液”),其含有1质量%至5质量%之间的钙离子和2U/mL至40U/mL之间(并且优选5U/mL至40U/mL之间,甚至更优选10U/mL至30U/mL之间)的凝血酶;
(iii)使所述生物墨水达到其凝胶点以上的温度T1,并在所述生物墨水的凝胶点以下的温度T2下将所述生物墨水沉积在基底上,在温度T2下,所述生物墨水形成凝胶以形成被称为“未经处理的打印对象”的可控三维物体;
(iv)利用所述聚合溶液对所述未经处理的打印对象进行处理,以将所述未经处理的打印对象固结成身体组织替代物;
(v)将所述身体替代物前体在细胞培养基中培养。
7.根据权利要求6所述的方法,其中T1为27℃至32℃之间,并且T2为4℃至20℃之间。
8.根据权利要求6或7所述的方法,其中在高于T1并且优选35℃至38℃之间的温度T3下,利用所述聚合溶液通过浸渍对所述未经处理的打印对象进行处理。
9.根据权利要求6至8中任一项所述的方法,其中,
o所述身体组织前体为皮肤替代物前体,并且
o所述生物墨水为含有活的成纤维细胞的悬浮液;
o在36℃至38℃之间的温度下进行所述培养,并且其包括持续八天至四十天之间的第一培养阶段和持续五天至十天之间的第二培养阶段,已知角质形成细胞的水性悬浮液在所述第一阶段和所述第二阶段之间沉积在所述皮肤替代物的表面上。
10.根据权利要求9所述的方法,其中所述未经处理的打印对象包括大致平坦的上表面并且具有均匀分布的成纤维细胞,相当于每cm2的平坦的上表面具有0.2×105个至10×105个之间(优选0.2×105个至2×105个之间)的成纤维细胞。
11.根据权利要求9或10所述的方法,其中成纤维细胞的浓度为每cm3的生物墨水具有0.6×105个至12×105个之间的成纤维细胞,优选每cm3的生物墨水具有1×105个至7×105个之间的成纤维细胞,甚至更优选每cm3的生物墨水具有1×105个至5×105个之间的成纤维细胞。
12.根据权利要求9至11中任一项所述的方法,其中沉积的角质形成细胞的量为每cm2的平坦的上表面具有0.05×105个至50×105个之间(优选0.2×105个至20×105个之间,并且更优选0.5×105个至10×105个之间)的角质形成细胞。
13.根据权利要求6至12中任一项所述的方法,其中所述身体组织替代物为皮肤替代物,并且在所述方法中:
(i)在第一步骤中,利用根据权利要求1至5中任一项所述的生物墨水打印多层皮下组织,所述生物墨水含有前脂肪细胞和/或成熟脂肪细胞,
(ii)在第二步骤中,利用根据权利要求1至5中任一项所述的生物墨水打印多层皮下组织,所述生物墨水含有成纤维细胞,
(iii)在第三步骤中,利用根据权利要求1至5中任一项所述的生物墨水打印一层或多层,所述生物墨水含有角质形成细胞。
14.能够通过根据权利要求6至13中任一项所述的方法获得的身体组织替代物。
15.根据权利要求14所述的身体组织替代物,其特征在于,其为皮肤替代物,其包括:
·包含成纤维细胞的真皮层,
·包含角质形成细胞的表皮层,和
·包含角质形成细胞的角质层。
16.根据权利要求14或15所述的身体组织替代物,旨在用于植入人或动物患者的体内,特别是用于修复、美容或整形手术。
17.根据权利要求14或15所述的身体组织替代物用于以下的用途:药物或化妆品的活性成分的测试,或化学产品的测试,特别是用于评价其毒性、其治疗或美容效果、或其在身体组织中的渗透力。
18.根据权利要求17所述的用途,其中所述身体组织替代物由含有病理性细胞的生物墨水制成,所述用途旨在表征活性成分的一般治疗效果或个体治疗效果。
- 还没有人留言评论。精彩留言会获得点赞!