一种利用盐生红胞藻产藻红蛋白和多不饱和脂肪酸的方法与流程
本发明属于微生物应用技术领域,具体涉及一种利用盐生红胞藻产藻红蛋白和多不饱和脂肪酸的方法。
背景技术:
十八碳四烯酸(18:4n-3)(SA)是一种重要的ω-3系列多不饱和脂肪酸(Δ6,9,12,15-全顺式-十八碳四烯酸),作为EPA的前体物质,SA在动物体内的转化效率比花生四烯酸高很多,具有辅助降低体内胆固醇和甘油三酯的含量,促进体内饱和脂肪酸代谢的作用,从而降低血液粘稠度,增进血液循环,提高组织供氧而消除疲劳。防止脂肪在血管壁的沉积,预防动脉粥样硬化的形成和发展、预防脑血栓、脑溢血、高血压等心血管疾病。目前SA主要来源于植物油(高SA大豆油)以及微藻。大豆来源主要存在SA相对含量低,受地域限制等诸多问题,从而导致气味不良、纯化成本高等。相反,微生物油脂(Single Cell Oils,SCO)不但容易实现大规模生产,同时还克服了传统高SA大豆存在受地域和气候条件制约的问题,应用前景广阔。
盐生红胞藻(Rhodomonas salin or R.salina)属Pyrenomonadaceae家族成员,为有鞭毛的单细胞红藻。由于其富含长碳链多不饱和脂肪酸和天然色素-藻红蛋白,R.salina已被视为一个极具潜力的资源藻种,在食品、化妆品、医药、科学研究以及水产养殖等方面应用广泛。R.salina合成的多不饱和脂肪酸十八碳四烯酸(SA,18:4n-3)和α-亚麻酸(ALA 18:3n-3)分别占胞内总脂肪的20–30.2%和20.7–29.9%。
技术实现要素:
本部分的目的在于概述本发明的实施例的一些方面以及简要介绍一些较佳实施例。在本部分以及本申请的说明书摘要和发明名称中可能会做些简化或省略以避免使本部分、说明书摘要和发明名称的目的模糊,而这种简化或省略不能用于限制本发明的范围。
鉴于上述和/或现有利用盐生红胞藻(R.salina)生产藻红蛋白和多不饱和脂肪酸的方法存在的问题,提出了本发明。
因此,本发明的目的是提供一种利用不同波长和强度光源自养发酵盐生红胞藻(R.salina)生产藻红蛋白和多不饱和脂肪酸的方法,大幅度提高了盐生红胞藻(R.salina)生产藻红蛋白和多不饱和脂肪酸的效率,从而降低了生产成本。
为解决上述技术问题,本发明提供了如下技术方案:一种利用盐生红胞藻产藻红蛋白和多不饱和脂肪酸的方法,包括,利用种子培养基培养盐生红胞藻;将盐生红胞藻接种到人工海水发酵培养基,利用不同波长和强度的光培养盐生红胞藻。
作为本发明所述利用盐生红胞藻产藻红蛋白和多不饱和脂肪酸的方法的一种优选方案,其中:所述种子培养基包括甘油、Na2EDTA、H3BO3、FeCl3、MnSO4、ZnSO4、CoCl2、HCl、HEPES bufferpH 7.8、Vitamin B12中的一种或几种。
作为本发明所述利用盐生红胞藻产藻红蛋白和多不饱和脂肪酸的方法的一种优选方案,其中:所述种子培养基包括占培养基质量10%的甘油、Na2EDTA·2H2O 80mM、H3BO32mM、FeCl3·6H2O 5.02mM、MnSO4·H2O 0.01mM、ZnSO4·7H2O 0.001mM、CoCl2·6H2O 0.001mM、HCl 0.1M、HEPES buffer pH 7.8、Vitamin B12 0.3g/L。
作为本发明所述利用盐生红胞藻产藻红蛋白和多不饱和脂肪酸的方法的一种优选方案,其中:所述人工海水发酵培养基包括NaCl、MgSO4·7H2O、KCl、NaNO3、CaCl2·2H2O、KH2PO4、Tricine pH 7.8、NH4Cl、Na2EDTA·2H2O、H3BO3、FeCl3·6H2O、MnSO4·H2O、ZnSO4·7H2O、CoCl2·6H2O、HCl、HEPES bufferpH 7.8或Vitamin B12中的一种或几种。
作为本发明所述利用盐生红胞藻产藻红蛋白和多不饱和脂肪酸的方法的一种优选方案,其中:所述利用种子培养基培养盐生红胞藻,其是将盐生红胞藻以10~50%的接种量接入种子培养基中,培养温度为21~30℃、100~200rpm下培养40~50h。
作为本发明所述利用盐生红胞藻产藻红蛋白和多不饱和脂肪酸的方法的一种优选方案,其中:所述利用不同波长和强度的光培养,其是利用不同波长和强度的光在温度为21~30℃,pH值为5~9,通气速率为0.01~10m3·min-1,光照强度50~500为μmol m-2s-1的条件下,培养5~14天。
作为本发明所述利用盐生红胞藻产藻红蛋白和多不饱和脂肪酸的方法的一种优选方案,其中:所述利用不同波长和强度的光,其中,所述光包括红光、蓝光、红蓝混合光,其与发酵培养基液面的距离为15~30cm。
作为本发明所述利用盐生红胞藻产藻红蛋白和多不饱和脂肪酸的方法的一种优选方案,其中:所述红蓝混合光,其混合比例为蓝光:红光=1:0.1~10。
作为本发明所述利用盐生红胞藻产藻红蛋白和多不饱和脂肪酸的方法的一种优选方案,其中:所述红蓝混合光,其混合比例为蓝光:红光=1:1~5。
作为本发明所述利用盐生红胞藻产藻红蛋白和多不饱和脂肪酸的方法的一种优选方案,其中:所述红光,其波长为590~670nm,波峰为640nm;所述蓝光,其波长420~510nm,波峰为460nm。
本发明具有的有益效果:
本发明提升了盐生红胞藻(R.salina)发酵时菌体的生长速度、生物量、底物利用率、藻红蛋白,总蛋白、多不饱和脂肪酸和总脂含量,生长速度提升3倍以上,藻红蛋白增加8倍以上,总多不饱和脂肪酸增加4倍以上,生物量增加7倍以上,减少了盐生红胞藻(R.salina)收获的问题,降低了生物质浓缩以及目的产物提取的前处理成本。
附图说明
为了更清楚地说明本发明实施例的技术方案,下面将对实施例描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动性的前提下,还可以根据这些附图获得其它的附图。其中:
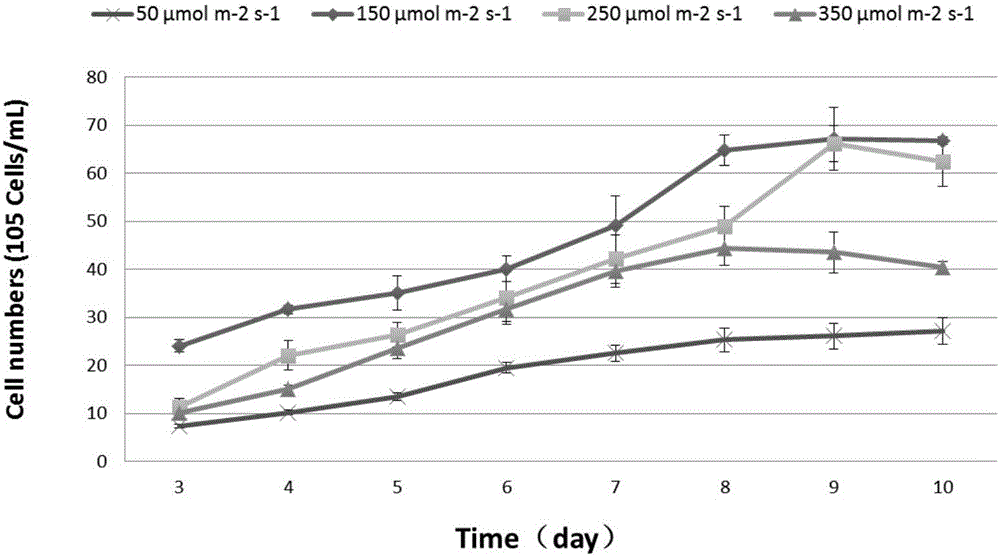
图1是本发明中不同强度白光照射条件发酵盐生红胞藻(R.salina)生长情况示意图;
图2是本发明中不同强度白光照射条件发酵盐生红胞藻(R.salina)藻红蛋白合成情况示意图;
图3是本发明中不同强度红光照射条件发酵盐生红胞藻(R.salina)生长情况示意图;
图4是本发明中不同强度红光照射条件发酵盐生红胞藻(R.salina)藻红蛋白合成情况示意图;
图5是本发明中不同强度蓝光照射条件发酵盐生红胞藻(R.salina)生长情况示意图;
图6是本发明中不同强度蓝光照射条件发酵盐生红胞藻(R.salina)藻红蛋白合成情况示意图;
图7是本发明中不同强度红蓝混合光照射条件发酵盐生红胞藻(R.salina)生长情况示意图;
图8是本发明中不同强度红蓝混合光照射条件发酵盐生红胞藻(R.salina)藻红蛋白合成情况示意图。
具体实施方式
为使本发明的上述目的、特征和优点能够更加明显易懂,下面结合具体实施例对本发明的具体实施方式做详细的说明。
在下面的描述中阐述了很多具体细节以便于充分理解本发明,但是本发明还可以采用其他不同于在此描述的其它方式来实施,本领域技术人员可以在不违背本发明内涵的情况下做类似推广,因此本发明不受下面公开的具体实施例的限制。
其次,此处所称的“一个实施例”或“实施例”是指可包含于本发明至少一个实现方式中的特定特征、结构或特性。在本说明书中不同地方出现的“在一个实施例中”并非均指同一个实施例,也不是单独的或选择性的与其他实施例互相排斥的实施例。
实施例1:
盐生红胞藻(R.salina)种子培养基:
盐生红胞藻来源海水、甘油10%、Na2EDTA·2H2O 80mM、H3BO3 2mM、FeCl3·6H2O 5.02mM、MnSO4·H2O 0.01mM、ZnSO4·7H2O 0.001mM、CoCl2·6H2O 0.001mM、Na2EDTA·2H2O 50mM、HCl 0.1M、HEPES buffer pH 7.8 10mM、Vitamin B12 0.3g/L。
种子培养两代,每代在装液量50mL/250mL三角瓶中进行,接种量20%(V/V),23℃、120rpm下摇床培养48h。第二代种子按20%(V/V)的接种量接入装液量400mL/600mL爆气式反应器中,反应器中为人工海水发酵培养基,白光强度50~350μmol m-2s-1,发酵条件为23℃、通气速率为0.1m3·min,发酵10天。
人工海水发酵培养基成分为,NaCl 310mM、MgSO4·7H2O 10mM、KCl 8mM、NaNO312mM、CaCl2·2H2O 2mM、KH2PO40.37mM、Tricine pH 7.8 25mM、NH4Cl0.5mM、Na2EDTA·2H2O 0.27mM、H3BO31.84mM、FeCl3·6H2O0.018mM、MnSO4·H2O0.097mM、ZnSO4·7H2O0.007mM、CoCl2·6H2O0.002mM、HCl0.1mM、FeCl3·6H2O3mM、HEPES buffer pH 7.8 10mM、Vitamin B120.13g/L。
实验结果如图1和图2所示:
结果表明:
白光强度150μmol·m-2·s-1发酵盐生红胞藻(R.salina),8天达最大生物量6.71×106个/mL,藻红蛋白达到14.97mg/L,底物利用率为60.5%。总脂占干重8.56%,SA占总脂肪酸27.78%。
其中,总脂肪酸及总脂的测定如下,
总脂肪酸的提取:将冷冻干燥后的细胞研磨均匀,精确称取约1.00g加入7mL 20%HCl,75℃水浴震荡60min。然后用20mL正己烷分三次提取脂质,旋转蒸发脱溶后,用氮气吹除残留溶剂。称重并计算总脂含量。
总脂含量(%)=m1/m2*100%
式中,m1代表称重得到总脂质量(g),m2代表用于脂质提取的冻干菌丝体质量(g)。
脂肪酸组成的测定:毛细管柱(CP Sil-88:50.0m×250μm×0.20μm),氮气作为载气,FID为检测器。进样口的温度为250℃,每次进样体积为1μL。柱温条件:80℃持续2min,然后以10℃/min速度升温到120℃,再以5℃/min升温到180℃,持续2min,以2℃/min升温到230℃,最后230℃持续5min。以归一化法计算总脂中各脂肪酸的百分含量。
白光强度低于350μmol m-2s-1时,盐生红胞藻(R.salina)生物量、总脂含量高以及藻红蛋白均与光照强度成正比,白光强度高于350μmol m-2s-1时会抑制盐生红胞藻(R.salina)的生长,尤其是藻红蛋白的合成。
实施例2:
盐生红胞藻(R.salina)种子培养基:
盐生红胞藻来源海水、甘油10%、Na2EDTA·2H2O 80mM、H3BO3 2mM、FeCl3·6H2O 5.02mM、MnSO4·H2O 0.01mM、ZnSO4·7H2O 0.001mM、CoCl2·6H2O 0.001mM、Na2EDTA·2H2O 50mM、HCl 0.1M、HEPES buffer pH 7.8 10mM、Vitamin B12 0.3g/L。
种子培养两代,每代在装液量50mL/250mL三角瓶中进行,接种量20%(V/V),23℃、120rpm下摇床培养48h。第二代种子按20%(V/V)的接种量接入装液量400mL/600mL爆气式反应器中,反应器中为人工海水发酵培养基,红光强度50~350μmol m-2s-1,发酵条件为23℃、通气速率为0.1m3·min-1,发酵10天。其中,红光的波长为590~670nm,波峰为640nm。
人工海水发酵培养基成分为,NaCl 310mM、MgSO4·7H2O 10mM、KCl 8mM、NaNO312mM、CaCl2·2H2O 2mM、KH2PO40.37mM、Tricine pH 7.8 25mM、NH4Cl0.5mM、Na2EDTA·2H2O 0.27mM、H3BO31.84mM、FeCl3·6H2O0.018mM、MnSO4·H2O0.097mM、ZnSO4·7H2O0.007mM、CoCl2·6H2O0.002mM、HCl0.1mM、FeCl3·6H2O3mM、HEPES buffer pH 7.8 10mM、Vitamin B120.13g/L。
实验结果如图3和图4所示:
结果表明:
红光强度250μmol m-2s-1发酵盐生红胞藻(R.salina),10天达最大生物量1.31×107个/mL。红光强度150μmol m-2s-1发酵盐生红胞藻(R.salina)9天时藻红蛋白达到37.60mg/L,底物利用率为75.5%。红光强度350μmol m-2s-1发酵盐生红胞藻(R.salina)10天时总脂占干重11.12%,SA占总脂肪酸30.00%左右。
其中,总脂肪酸及总脂的测定如下,
总脂肪酸的提取:将冷冻干燥后的细胞研磨均匀,精确称取约1.00g加入7mL 20%HCl,75℃水浴震荡60min。然后用20mL正己烷分三次提取脂质,旋转蒸发脱溶后,用氮气吹除残留溶剂。称重并计算总脂含量。
总脂含量(%)=m1/m2*100%
式中,m1代表称重得到总脂质量(g),m2代表用于脂质提取的冻干菌丝体质量(g)。
脂肪酸组成的测定:毛细管柱(CP Sil-88:50.0m×250μm×0.20μm),氮气作为载气,FID为检测器。进样口的温度为250℃,每次进样体积为1μL。柱温条件:80℃持续2min,然后以10℃/min速度升温到120℃,再以5℃/min升温到180℃,持续2min,以2℃/min升温到230℃,最后230℃持续5min。以归一化法计算总脂中各脂肪酸的百分含量。
红光强度低于50μmol m-2s-1时,盐生红胞藻(R.salina)生物量、总脂含量高以及藻红蛋白合成均受到抑制。
实施例3:
盐生红胞藻(R.salina)种子培养基:
盐生红胞藻来源海水、甘油10%、Na2EDTA·2H2O 80mM、H3BO3 2mM、FeCl3·6H2O 5.02mM、MnSO4·H2O 0.01mM、ZnSO4·7H2O 0.001mM、CoCl2·6H2O 0.001mM、Na2EDTA·2H2O 50mM、HCl 0.1M、HEPES buffer pH 7.8 10mM、Vitamin B12 0.3g/L。
种子培养两代,每代在装液量50mL/250mL三角瓶中进行,接种量20%(V/V),23℃、120rpm下摇床培养48h。第二代种子按20%(V/V)的接种量接入装液量400mL/600mL爆气式反应器中,反应器中为人工海水发酵培养基,蓝光强度50~350μmol m-2s-1,发酵条件为23℃、通气速率为0.1m3·min-1,发酵10天。其中,蓝光的波长为420~510nm,波峰为460nm。
人工海水发酵培养基成分为,NaCl 310mM、MgSO4·7H2O 10mM、KCl 8mM、NaNO312mM、CaCl2·2H2O 2mM、KH2PO40.37mM、Tricine pH 7.8 25mM、NH4Cl0.5mM、Na2EDTA·2H2O 0.27mM、H3BO31.84mM、FeCl3·6H2O0.018mM、MnSO4·H2O0.097mM、ZnSO4·7H2O0.007mM、CoCl2·6H2O0.002mM、HCl0.1mM、FeCl3·6H2O3mM、HEPES buffer pH 7.8 10mM、Vitamin B120.13g/L。
实验结果如图5和图6所示:
结果表明:
蓝光对盐生红胞藻中的天线色素的激发更加有效,从而提升叶绿体的转化效率,为细胞提供更多的能量。蓝光强度250μmol m-2s-1发酵盐生红胞藻(R.salina),10天达最大生物量1.22×107个/mL,底物利用率为75.8%。藻红蛋白达到49.60mg/L,总脂占干重12.32%,SA占总脂肪酸31.15%。
其中,总脂肪酸及总脂的测定如下,
总脂肪酸的提取:将冷冻干燥后的细胞研磨均匀,精确称取约1.00g加入7mL 20%HCl,75℃水浴震荡60min。然后用20mL正己烷分三次提取脂质,旋转蒸发脱溶后,用氮气吹除残留溶剂。称重并计算总脂含量。
总脂含量(%)=m1/m2*100%
式中,m1代表称重得到总脂质量(g),m2代表用于脂质提取的冻干菌丝体质量(g)。
脂肪酸组成的测定:毛细管柱(CP Sil-88:50.0m×250μm×0.20μm),氮气作为载气,FID为检测器。进样口的温度为250℃,每次进样体积为1μL。柱温条件:80℃持续2min,然后以10℃/min速度升温到120℃,再以5℃/min升温到180℃,持续2min,以2℃/min升温到230℃,最后230℃持续5min。以归一化法计算总脂中各脂肪酸的百分含量。
蓝光强度低于50μmol m-2s-1或高于250μmol m-2s-1时,盐生红胞藻(R.salina)生物量、总脂含量高以及藻红蛋白合成均受到抑制。
实施例4:
盐生红胞藻(R.salina)种子培养基:
盐生红胞藻来源海水、甘油10%、Na2EDTA·2H2O 80mM、H3BO3 2mM、FeCl3·6H2O 5.02mM、MnSO4·H2O 0.01mM、ZnSO4·7H2O 0.001mM、CoCl2·6H2O 0.001mM、Na2EDTA·2H2O 50mM、HCl 0.1M、HEPES buffer pH 7.8 10mM、Vitamin B12 0.3g/L。
种子培养两代,每代在装液量50mL/250mL三角瓶中进行,接种量20%(V/V),23℃、120rpm下摇床培养48h。第二代种子按20%(V/V)的接种量接入装液量400mL/600mL爆气式反应器中,反应器中为人工海水发酵培养基,红蓝混合光强度50~350μmol m-2s-1,发酵条件为23℃、通气速率为0.1m3·min-1,发酵10天。其中,蓝光的波长为420~510nm,波峰为460nm。其中,红光的波长为590~670nm,波峰为640nm。混合光中,蓝光与红光的比例为1:3。光源与发酵培养基液面的距离为15cm。
人工海水发酵培养基成分为,NaCl 310mM、MgSO4·7H2O 10mM、KCl 8mM、NaNO312mM、CaCl2·2H2O 2mM、KH2PO40.37mM、Tricine pH 7.8 25mM、NH4Cl0.5mM、Na2EDTA·2H2O 0.27mM、H3BO31.84mM、FeCl3·6H2O0.018mM、MnSO4·H2O0.097mM、ZnSO4·7H2O0.007mM、CoCl2·6H2O0.002mM、HCl0.1mM、FeCl3·6H2O3mM、HEPES buffer pH 7.8 10mM、Vitamin B120.13g/L。
实验结果如图7和图8所示:
结果表明:
红蓝混合光强度250μmol m-2s-1发酵盐生红胞藻(R.salina),9天达最大生物量1.23×107个/mL。红蓝混合光强度150μmol m-2s-1发酵盐生红胞藻(R.salina)9天时藻红蛋白达到53.17mg/L,底物利用率为91.8%,总脂占干重14.07%,SA占总脂肪酸26.43%。
其中,总脂肪酸及总脂的测定如下,
总脂肪酸的提取:将冷冻干燥后的细胞研磨均匀,精确称取约1.00g加入7mL 20%HCl,75℃水浴震荡60min。然后用20mL正己烷分三次提取脂质,旋转蒸发脱溶后,用氮气吹除残留溶剂。称重并计算总脂含量。
总脂含量(%)=m1/m2*100%
式中,m1代表称重得到总脂质量(g),m2代表用于脂质提取的冻干菌丝体质量(g)。
脂肪酸组成的测定:毛细管柱(CP Sil-88:50.0m×250μm×0.20μm),氮气作为载气,FID为检测器。进样口的温度为250℃,每次进样体积为1μL。柱温条件:80℃持续2min,然后以10℃/min速度升温到120℃,再以5℃/min升温到180℃,持续2min,以2℃/min升温到230℃,最后230℃持续5min。以归一化法计算总脂中各脂肪酸的百分含量。
红蓝混合光强度高于250μmol m-2s-1时,盐生红胞藻(R.salina)藻红蛋白合成受到抑制。
实施例5(对比实施例)
将布朗葡萄藻接种于同实施例1~4中的种子培养基中,培养两代,每代在装液量50mL/250mL三角瓶中进行,接种量20%(V/V),23℃、120rpm下摇床培养48h。第二代种子按20%(V/V)的接种量接入装液量400mL/600mL爆气式反应器中,反应器中为人工海水发酵培养基,红蓝混合光强度50~350μmol m-2s-1,发酵条件为23℃、通气速率为0.1m3·min-1,发酵10天。其中,蓝光的波长为420~510nm,波峰为460nm。其中,红光的波长为590~670nm,波峰为640nm。混合光中,蓝光与红光的比例为1:3。光源与发酵培养基液面的距离为15cm。
实验结果为,布朗葡萄藻各组生长缓慢,在红蓝混合光下,只在300~350μmol m-2s-1有少量产物,个别组几乎不生长。
由此可见,本发明提升了盐生红胞藻(R.salina)发酵时菌体的生长速度、生物量、藻红蛋白,总蛋白、多不饱和脂肪酸和总脂含量,生长速度提升3倍以上,藻红蛋白增加8倍以上,总多不饱和脂肪酸增加4倍以上,生物量增加7倍以上,减少了盐生红胞藻(R.salina)收获的问题,降低了生物质浓缩以及目的产物提取的前处理成本。
应说明的是,以上实施例仅用以说明本发明的技术方案而非限制,尽管参照较佳实施例对本发明进行了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的精神和范围,其均应涵盖在本发明的权利要求范围当中。
- 还没有人留言评论。精彩留言会获得点赞!