用于动物细胞培养的一次性智能消化器系统的制作方法
本发明涉及一种用于动物细胞培养过程中细胞与微载体分离而获得游离细胞的技术,更特别地涉及用于动物细胞培养的一次性智能消化器系统。
背景技术:
在疫苗、抗体、蛋白类药物等高附加值生物制品生产时,所用的一些哺乳动物细胞不能直接悬浮于培养液中生长,需要依附于带有少量正电荷的载体表面才能生长,其基本过程是:将哺乳动物细胞经机械分散或消化后制成细胞悬液,经过滤、离心、纯化、漂洗后接种到含有新鲜培养基的反应器中培养。用此法培养的细胞生长良好且易于观察,但该方法仅适于实验室研究。然而,在细胞规模化培养、接种和扩培过程中,贴壁生长的细胞有接触抑制的特性,一旦细胞长满表面,生长就会受到抑制,影响最终的细胞产量。因此,需要将细胞与载体消化分离,进入到新的载体上。
目前,细胞消化的方法主要有消化接种、原位消化接种、直接接种等方法。
但是,以上无论哪种消化方法,所采用的消化器仍为转瓶、锥形瓶、机械搅拌发酵罐等。这些消化器是由玻璃、钢或优选不锈钢材质构成的反应容器与控制单元构成。在每次使用后,为保证消化器达到无菌清洁效果,必须经反复的拆装、清洗以及灭菌处理,该些清洁过程本身是一个费时、费力的过程,所使用的清洗方法增加了生产成本,且仍存在被残余有机物污染的风险。
另外,传统的消化方法只是简单地将细胞与载体分离或直接进行细胞转接,整个过程只是靠技术人员手动操作消化器,经验性判断消化过程是否完成,这不仅造成消化过程中细胞大量损失,而且批与批次之间结果难以重复。因此,细胞与载体分离获得游离细胞仍是细胞规模化培养过程中的一大技术难题。
技术实现要素:
本发明的主要目的在于提供一种用于动物细胞培养的一次性智能消化器系统,以克服现有技术的不足。
为了实现上述目的,本发明的技术方案如下:
本发明实施例提供了一种用于动物细胞培养的一次性智能消化器系统,包括一次性消化器单元和智能控制单元,所述一次性消化器单元包括至少可用于容置培养细胞的流体及消化液的无菌封闭腔室,与所述封闭腔室连通的至少一进料口、至少一出气口、至少一进气口、至少一消化液入口、至少一清洗液入口、至少一培养基入口、至少一清洗液和消化液出口以及至少一取样口,并且所述封闭腔室内至少还设有截留组件和搅拌组件,所述截留组件至少用以在所述封闭腔室内将流体中的载体截留并使动物细胞通过,所述搅拌组件至少用以将所述封闭腔室内的物质混合。
作为较佳优选实施方案之一,用于动物细胞培养的一次性智能消化器系统,包括密闭袋,所述密闭袋的内腔形成所述封闭腔室,所述密闭袋上设置有所述进料口、出气口、进气口、消化液入口、清洗液入口、培养基入口,同时所述密闭袋下部还设有所述的清洗液和消化液出口以及取样口;
进一步的,所述截留组件设于所述密闭袋内腔下部,并与所述密闭袋内壁环绕密封连接;优选的,所述密闭袋上还设置有至少一酸液入口和至少一碱液入口;
进一步的,所述密闭袋上还设置有至少一细胞转接入口和至少一细胞转接出口;
进一步的,优选的,所述密闭袋顶部及侧部形成多个端口,所述的多个端口分别用作所述进料口、出气口、进气口、消化液入口、清洗液入口、培养基入口、清洗液和消化液出口以及取样口;
更进一步的,所述端口至少通过帽、鲁尔接头、软管倒钩接头、单向阀、取样装置、无菌过滤器中的任一种与外界环境隔离。
进一步的,至少一进气管通过所述进气口插入所述封闭腔室,所述进气管下端与空气分布器连通,所述空气分布器位于所述封闭腔室内的流体液面下方;
更进一步的,所述空气分布器包括通气环,所述通气环上均匀分布有复数个通气孔,所述通气孔的孔径小于载体的直径;
更进一步的,所述进气管上还连接流量计和过滤器;
更进一步的,所述出气管上还连接有压力表或压力传感器和压力控制阀;
更进一步的,所述封闭腔室内的压力维持在0.01-0.05Mpa之间;
进一步的,所述密闭袋的材质包括刚性、半刚性或柔性的塑料;
更进一步的,所述塑料包括聚碳酸酯、聚酯、含氟聚合物、丙烯酸、PET、聚氯乙烯、ABS、PC、PS、GAG、亚克力和聚烯烃中的任意一种或两种以上的组合;再进一步的的,所述塑料包括聚烯烃。
作为较佳优选实施方案之一,所述一次性消化器单元包括支撑结构,所述支撑结构至少用于支撑所述密闭袋;
进一步的,所述支撑结构包括在所述密闭袋上部和下部向外延伸的固定卡扣;
进一步的,所述支撑结构包括设于所述密闭袋之外的支撑架,所述密闭袋安装在所述支撑架上或所述支撑架内,所述支撑架为固定支撑架或可移动支撑架;
更进一步的,所述支撑结构包括设于所述密闭袋内的支撑架;
进一步的,所述支撑结构至少选自金属桶、塑料桶、木桶或玻璃桶中的任意一种。
作为较佳优选实施方案之一,所述搅拌组件与驱动机构传动连接,所述驱动机构与所述支撑结构连接,并设置在所述密闭袋之外或内部;
优选的,所述驱动机构包括电机。
作为较佳优选实施方案之一,所述搅拌组件包括机械搅拌机构和/或磁力搅拌机构;
作为较佳优选实施方案之一,所述搅拌组件包括搅拌轴及搅拌桨,所述搅拌桨与搅拌轴一端固定连接并设于所述封闭腔室内,所述搅拌轴的另一端位于所述封闭腔室之外并与驱动机构传动连接,且所述搅拌轴与所述封闭腔室室壁的接合处还经一个以上密封圈密封连接;
进一步的,所述搅拌桨至少选自单层或多层的直叶桨、箭叶桨、弯叶桨、螺旋桨中的任意一种。
作为较佳优选实施方案之一,所述截留组件包括至少一筛板或滤网,所述筛板或滤网的孔径大于动物细胞的直径且小于微载体的直径。
作为较佳优选实施方案之一,所述智能控制单元包括下列组件中的任意一种或两种以上的组合:
温度控制组件,至少用以控制所述封闭腔室内的温度;
pH控制组件,至少用以监测所述封闭腔室内的流体的pH值;
溶氧组件,至少用以检测所述封闭腔室内的溶氧变化;
在线活细胞传感器组件,至少用以监控消化过程中流离的活细胞数目变化;
称重组件,至少用以在线监控流体进入量;
中央控制器,至少用以控制各组件的运行状态;
所述温度控制组件、pH控制组件、溶氧组件、在线活细胞传感器组件和称重组件均与所述中央控制器及所述封闭腔室连接;
进一步的,所述温度控制组件、pH控制组件、溶氧组件、在线活细胞传感器组件和称重组件均为一次性组件;
优选的,所述智能控制单元还包括下列组件中的任意一种或两种以上的组合,所述的下列组件均与所述中央控制器连接:
二氧化碳传感组件,至少用以检测所述封闭腔室内的二氧化碳变化;
混合速率传感组件,至少用以检测所述封闭腔室内的流体的混合状况;
光电传感组件,至少用以检测所述封闭腔室内的流体的浊度。
进一步的,所述温度控制组件包括加热器、夹套循环水系统以及插入式或非插入式温度电极。
进一步的,所述PH控制组件包括PH值电极。
进一步的,所述溶氧组件包括溶氧电极。
进一步的,所述在线活细胞传感器组件以插入式或非插入式方式安装于所述封闭腔室侧部,且所述在线活细胞传感器组件接近于所述截留组件。
进一步的,所述称重组件包括支承所述一次性消化器单元的一个以上称重模块和接线盒,所述称重模块与接线盒电连接。
更进一步的,所述称重组件包括安装于所述一次性消化器单元的支脚处的3-4只称重模块。
作为较佳优选实施方案之一,所述智能控制单元还包括液体泵送组件,所述液体泵送组件包括清洗液泵、消化液泵、培养基泵、酸泵、碱泵、清洗液排出泵、消化液排出泵以及细胞转移泵中的任意一种或两种以上的组合,所述清洗液泵、消化液泵、培养基泵、酸泵、碱泵、清洗液排出泵、消化液排出泵以及细胞转移泵分别与所述中央控制器连接。
作为较佳优选实施方案之一,所述中央控制器还包括无线通信模块,所述中央控制器经所述无线通信模块与远程终端无线连接。
与现有技术相比,本发明的优点至少在于:
1)本发明省去了SIP(在线消毒)和CIP(在线清洗)、设备反复安装调试等步骤,简化了操作流程,从根本上减轻了仪器设备的日常维护工作,因步骤简化,节约了蒸汽、水、清洗液的用量,节省了设备安装调试时间,从而节省了生产成本和人力成本。
2)一次性组件使用完毕后即抛弃,不用于后续的工艺操作,避免了批与批之间的交叉污染,提高了生产稳定性和产品品质。
3)一次性组件的使用降低了GMP验证的复杂度,因为几乎没有可反复使用的组件,节省了大量的灭菌、清洁验证流程,从而简化了研发过程中GMP认证周期,缩短产品上市时间。
4)本发明所设计智能控制单元,可自动控制消化反应的整个过程,大大降低了细胞消化损失率,损失率最低可达2%。
5)本发明所设计的一次性消化器单元在容器设计、搅拌设计、通气策略方面与经典的多次性消化器设计原则一致,不同反应器规模上保持几何相似性,因此,工艺转移和工艺放大不会增加额外的风险,有助于将现有的工艺转移至已有的工业反应设备中去。
附图说明
为了更清楚地说明本发明结构特征和技术要点,下面结合附图和具体实施方式对本发明进行详细说明。
图1为对比例1中消化反应实施流程图;
图2为本发明实施例1中一次性消化器单元的结构示意图;
图3为本发明实施例1中一次性消化器单元的封闭腔室的前视图;
图4为本发明实施例1中一次性消化器单元的封闭腔室的后视图;
图5为本发明实施例1中消化反应实施流程图;
图6为本发明实施例2中消化反应实施流程图。
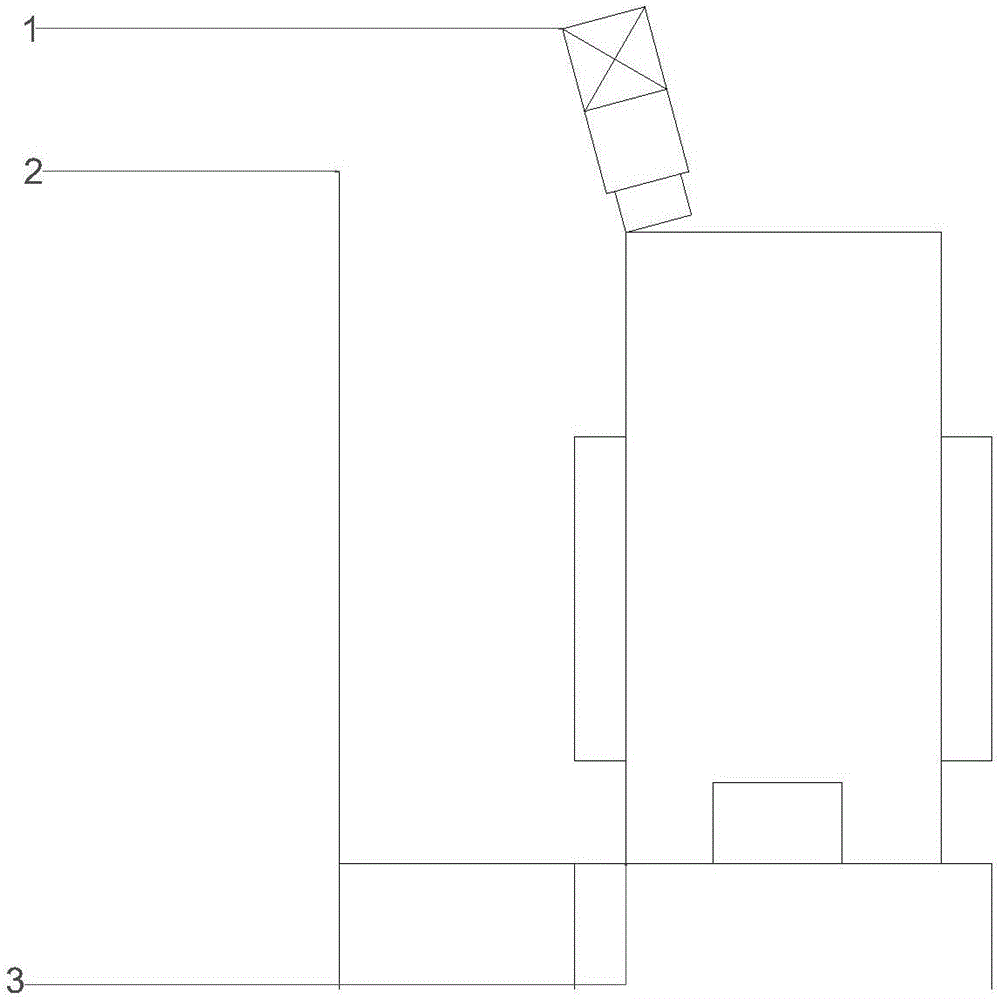
附图标记说明:1-电动机,2-支撑结构,3-称重组件,4-酸液入口,5-碱液入口,6-细胞转接入口,7-清洗液入口,8-封闭腔室,9-搅拌组件,10-温度控制组件,11-pH控制组件,12-取样口2,13-清洗液/消化液出口,14-进料口,15-消化液入口,16-取样口1,17-溶氧组件,18-活细胞传感器组件,19-细胞转接出口,20-出气管,21-进气管,22-空气分布器,23-截留组件。
具体实施方式
以下将结合本实施例中的附图,对实施例中的技术方案进行具体、清楚、完整地描述。
术语定义
术语“消化”是指具有贴壁生长特性的动物细胞长满载体表面时,为避免细胞之间相互抑制,需要将细胞与旧载体分离,转移至新载体上的过程。
“一次性消化器单元”主要是为细胞消化反应过程提供一次性的反应场所。
参见图2-4所示,本发明实施例提供了一种用于动物细胞培养的一次性智能消化器系统,包括一次性消化器单元和智能控制单元,一次性消化器单元包括至少可用于容置培养细胞的流体及消化液的无菌的封闭腔室8,封闭腔室8内设有截留组件23和搅拌组件9,截留组件23与封闭腔室8的内壁环绕密封连接,其中,截留组件23至少用以在封闭腔室8内将流体中的载体截留并使动物细胞通过,搅拌组件9至少用以将封闭腔室8内的物质混合。
优选的,智能控制单元包括:温度控制组件10,至少用以控制封闭腔室8内的温度;pH控制组件11,至少用以检测封闭腔室8内的流体的pH值;溶氧组件17,至少用以检测封闭腔室8内的溶氧变化;在线活细胞传感器组件18,至少用以监控消化过程中流离的活细胞数目变化;称重组件3,至少用以在线监控流体进入量,称重组件3通过监控消化器重量变化,从而可监控流体的进入量;中央控制器,至少用以控制各组件的运行状态;温度控制组件10、pH控制组件11、溶氧组件17、在线活细胞传感器组件18和称重组件3分别与中央控制器及封闭腔室8连接。
更为优选的,所述智能控制单元还包括下列组件中的任意一种或两种以上的组合:二氧化碳传感组件,至少用以检测所述封闭腔室内的二氧化碳变化;混合速率传感组件,至少用以检测所述封闭腔室内的流体的混合状况;光电传感组件,至少用以检测所述封闭腔室内的流体的浊度;所述的二氧化碳传感组件、混合速率传感组件和光电传感组件均与所述中央控制器连接:
更为优选的,温度控制组件10、pH控制组件11、溶氧组件17、在线活细胞传感器组件18和称重组件3均为一次性组件。且,各组件可固定于封闭腔室8内,也可包埋于或粘结于封闭腔室8的表面。
优选的,封闭腔室8上设置有以供物料和气体进出的端口,端口包括与封闭腔室8的上端部相连通的的进料口14、消化液入口15、清洗液入口7、酸液入口4、碱液入口5、细胞转接入口6和各组件接口,端口还包括与封闭腔室8的底部相连通的清洗液/消化液出口13、取样口12和细胞转接出口19,端口还包括与封闭腔室8的上端部相通的进气口和出气口。
进一步的,进气口和出气口内分别插设有进气管21和出气管20,进气管21和出气管20延伸至封闭腔室8内,进气管21的下端与空气分布器连通,空气分布器位于封闭腔室内的流体液面下方。
更进一步的,空气分布器应选择通气环,通气环上均布有通气孔,通气孔的孔径小于微载体的直径,进气管21中通入气体,以使得封闭腔室8内压力维持在设定值,并使得密闭腔体快速成型以及定型。其中,进气管21中通入无菌空气、氧气或二氧化碳,空气、氧气、二氧化碳的进气管21可并联连接,提供密闭袋内容物的鼓泡。
更进一步的,进气管21上连接流量计和过滤器,出气管20连接压力表或压力传感器和压力控制阀,压力表或压力传感器用于检测封闭腔室8内的压力,使得封闭腔室8内的压力保持在0.01-0.05Mpa之间,以保证封闭腔室8快速成型,避免褶皱的形成。压力控制阀用于排出封闭腔室8内的废气。
进一步的,上述的各个端口通过帽、鲁尔接头、软管倒钩接头、单向阀、取样装置、无菌过滤器中的任一种方式与外部隔离。
优选的,一次性消化器单元可以采用密闭袋这种简单形式,密闭袋的内腔形成所述的封闭腔室8,其中,密闭袋上设置有进料口14、消化液入口15、清洗液入口7、酸液入口4、碱液入口5、细胞转接入口6、清洗液/消化液出口13、取样口12、细胞转接出口19、进气口和出气口,在进气口和出气口中分别插设有进气管21和出气管20。
进一步的,密闭袋的材质为刚性、半刚性或柔性的塑料;更进一步优选的,塑料包括聚碳酸酯、聚酯、含氟聚合物、丙烯酸、PET、聚氯乙烯、ABS、PC、PS、GAG、亚克力和聚烯烃中的任意一种或两种以上的组合;再进一步优选的,塑料包括聚烯烃。
优选的,一次性消化器单元包括至少一用于支撑封闭腔室8的支撑结构2。
优选的,封闭腔室8的上部和下部向外延伸形成用于固定和支撑封闭腔室8的固定卡扣。
进一步的,支撑结构2包括设于密闭袋之外的支撑架,密闭袋安装在所述支撑架上或支撑架内,所述支撑架为固定支撑架或可移动支撑架;更进一步的,所述支撑结构包括设于密闭袋内的支撑架。
进一步的,支撑结构2至少采用金属桶、塑料桶、木桶或玻璃桶中的任意一种。
优选的,至少封闭腔室8和各组件经灭菌处理,的灭菌处理方式包括γ射线辐照、β射线辐照、环氧乙烷气体处理和蒸汽灭菌中的任意一种或两种以上的组合,在经过γ射线、β射线、环氧乙烷灭菌、蒸汽灭菌处理也可以再次使用。
优选的,截留组件23包括至少一层塑料制得的筛板或滤网,筛板或滤网的孔径大于细胞的直径且小于微载体的直径。
优选的,搅拌组件9包括机械搅拌机构和/或磁力搅拌机构;搅拌组件9可采用中心竖立、中心倾斜、偏心竖立、偏心倾斜的方式安装。
进一步的,搅拌组件9包括搅拌轴及搅拌桨,搅拌桨与搅拌轴一端固定连接并设于封闭腔室8内,搅拌轴的另一端位于封闭腔室8之外并与电动机1传动连接,且搅拌轴与封闭腔室8的室壁的接合处还经一个以上密封圈密封连接。
更进一步的,搅拌桨采用单层或多层的直叶桨、箭叶桨、弯叶桨、螺旋桨中的任意一种或两种以上的组合。
更进一步的,搅拌轴和/或搅拌桨的材质为经γ射线、β射线、环氧乙烷灭菌或蒸汽灭菌处理的高密度聚乙烯。
优选的,温度控制组件10包括加热器、夹套循环水系统以及插入式或非插入式温度电极,插入式或非插入式温度电极用于调节加热器、夹套循环水系统的启闭。可选择的是,温度控制组件10可结合到支撑结构2的壳体上。温度控制组件10也可应用于排气管的冷凝上,以使排出的气体冷凝防止过滤器变湿影响气体过滤效果。
优选的,pH控制组件11包括PH值电极,控制酸液、碱液、培养基的流加。
优选的,溶氧组件17包括溶氧电极,溶氧与转速、补料、压力相关联。
优选的,在线活细胞传感器组件18以插入式或非插入式方式安装于封闭腔室8侧部,且在线活细胞传感器组件18接近于截留组件23。
优选的,称重组件3包括安装于一次性消化器单元的支脚处的3-4只称重模块和接线盒,接线盒与各称重模块电连接,接线盒联络各称重模块的信号,并根据各模块的受载情况调节各支脚处的重量差值,之后接线盒将汇集后的信号输送至中央控制器。
优选的,智能控制单元还包括液体泵送组件,液体泵送组件包括清洗液泵、消化液泵、培养基泵、酸泵、碱泵、清洗液排出泵、消化液排出泵以及细胞转移泵,清洗液泵、消化液泵、培养基泵、酸泵、碱泵、清洗液排出泵、消化液排出泵以及细胞转移泵分别与中央控制器连接,并且分别用于转移清洗液、消化液、培养基、酸液、碱液、富含游离细胞的培养基。液体泵送组件由数据线连接中央控制器,各个泵体可接受中央控制器指令,实现泵运转的自动和手动控制。
优选的,所述中央控制器还包括无线通信模块,中央控制器经无线通信模块与远程终端无线连接。
用于动物细胞培养的一次性智能消化器系统的消化过程如下:
(i)安装调试阶段:密闭袋通过固定卡扣固定在消化器支撑结构2的外壁上,通过快速接头无菌连接密闭袋上的气体和液体管道,酸液、碱液、消化液、清洗液、培养基、清洗液和消化液排出、细胞转接管道安装到相应的蠕动泵上。完成气体流量组件21、温度控制组件10、pH控制组件11、溶氧控制组件17、压力控制组件(进气管、出气管、流量计、过滤器和压力控制阀形成所述的压力控制组件)、称重组件3、在线活细胞传感器组件18、搅拌组件9与中央控制器的连接。通入压缩空气、氧气或二氧化碳经气源入口进入密闭袋内部,维持压力在0.01-0.05Mpa,以保证密闭袋快速成型,同时检查密闭袋和各管路连接的气密性。根据消化条件,设定初始参数,包括通气量、温度、pH、溶氧、压力、转速。
(ii)消化开始阶段:待安装调试完毕后,开启消化液进入步骤,通过称重组件3在线监控消化液进入量;同时,根据预设的pH,系统自动启动酸液或者碱液的流加;根据预设的温度,系统自动启动加热器进行加热或启动夹套循环水系统进行冷却;根据预设的溶氧,将溶氧与通气量、压力、转速等参数关联控制;随着消化反应过程的进行,游离悬浮活细胞数目逐渐升高,并在一定时间后,游离悬浮活细胞数目不再增加,在线活细胞传感器18在线全程监控消化过程,将游离悬浮活细胞数目变化的信号传递至中央控制系统;当游离悬浮活细胞数目达到预设值后,该一次性智能消化器系统自动关闭pH控制组件11、温度控制组件10,开启消化液排出步骤,消化液经消化液泵快速排出,载体被截留组件截留在封闭腔室8内。
(iii)消化清洗阶段:消化液排尽后,开启清洗步骤,降低转速,调节温度至细胞培养温度,设定清洗液加入量和清洗次数(一般为1-3次),系统按照预先设定的清洗程序,开启清洗液通道的清洗液泵,清洗液进入封闭腔室8内,在线活细胞传感器18监控细胞损失情况。
(iv)消化终止阶段:待清洗完毕之后,开启消化终止步骤。提高搅拌转速,调节温度和pH控制在培养温度和pH范围内,设定培养基加入量,将溶氧与通气量、压力、转速等参数关联,将pH与补料、酸、碱关联控制。系统按照预先设定的消化终止程序,开启培养基通道的培养基泵,培养基进入封闭腔室8内。该过程可以持续较长时间,当游离悬浮细胞数目保持平稳,或细胞活性开始下降,则视为消化终止。
(v)细胞转移阶段:待消化终止程序结束后,可通过以下两种方式将细胞转移至下一级反应器:a)提高消化器罐压至0.03-0.05Mpa,降低下一级反应器的罐压至0.01-0.02Mpa,通过压差法将培养液压送至下一级反应器;b)开启细胞转移通道的蠕动泵,富含游离悬浮细胞的细胞转移泵送至下一级反应器,而空载体被截留组件截留在封闭腔室8内。
以下结合实施例1-2、对比例1以及附图1、5和6对本发明的技术方案做进一步的说明。
实施例1
参见图5所示,该实施例中的10L一次性生物反应器用作种子反应器,进行微载体细胞悬浮培养;10L一次性消化器用作培养完成的种子细胞消化反应的场所,实现PK-15细胞与微载体的分离,游离的细胞转移至50L一次性生物反应器进行继续培养。10L和50L多次性生物反应器的工作体积分别是7L和35L,反应器的高径比1.8:1.0,搅拌桨采用单层提升带桨,桨径与反应器直径比为:1.0:1.8。10L一次性消化器单元结构设计如图2、3、4所示,工作体积是7L。10L一次性消化器载体介质使用GE公司生产的Cytodex-1,3g/L,细胞密度为2.5×106cells/mL。消化反应实施过程如图2所示,具体实施步骤如下:
(i)液体配制阶段:配制清洗液20L、消化液1L、培养基5L,酸液(1N HCl)2L、碱液(3N NaOH)2L,其中培养基中含3%新生牛血清。
(ii)安装调试阶段:密闭袋通过固定卡扣固定在消化器支架的外壁上,通过快速接头使得密闭袋上的气体管道和液体管道(酸液、碱液、消化液、清洗液、培养基管道)与相应的蠕动泵实现无菌连接;完成温度控制组件、pH控制组件、溶氧组件、称重组件、在线活细胞传感器组件、搅拌组件与中央控制器的连接。通入压缩空气、氧气或二氧化碳经进气管进入密闭袋内部,维持压力在0.01-0.05Mpa,从而实现压力的控制,以保证密闭袋快速成型,同时检查密闭袋和各管路连接的气密;根据消化条件,设定初始参数,包括通气量0.5vvm、温度37℃、pH7.0、压力0.02Mpa、转速25rpm。
(iii)消化开始阶段:待安装调试完毕后,将10L一次性使用反应器培养的培养液直接转移至10L一次性使用消化器内。开启消化液进入步骤,通过称重组件在线监控消化液进入量,将0.6L消化液通过消化液泵送至消化器的密闭袋内;设定温度为37℃,转速为25rpm,pH为7.0,同时根据预设的pH,系统自动启动酸液或者碱液的流加;根据预设的温度,系统自动启动加热器加热或启动夹套循环水系统冷却;根据预设的溶氧,将溶氧与通气量、压力、转速等参数关联控制。在线活细胞传感器在线全程监控消化过程,将游离悬浮活细胞数目变化的信号传递至中央控制系统;当细胞数目不再增加时,则视为消化过程完成;达到预设值后,该消化器系统自动关闭pH控制组件、温度控制组件,开启消化液排出步骤。消化液经消化液泵快速排出,载体被截留组件23截留在该消化器的密闭袋内。
(iv)消化清洗阶段:消化液排尽后,开启清洗步骤,转速提高至50rpm,调节温度至37℃,设定清洗液加入量5L和清洗次数2次、清洗时间10min。系统按照预先设定的清洗程序,开启清洗液通道的清洗液泵,清洗液进入消化器的密闭袋内;清洗完毕后,自动启动清洗液排出泵快速排尽清洗液,在线活细胞传感器监控细胞损失情况。
(v)消化终止阶段:待清洗完毕之后,开启消化终止步骤。提高搅拌转速,设定温度为37℃、转速为100rpm,设定培养基加入量5L,将pH与酸、碱关联控制。系统按照预先设定的消化终止程序,开启培养基通道的培养基泵,培养基进入消化器的密闭袋内;5min之后,在线活细胞传感器监测游离悬浮细胞数目开始升高,而后一段时间游离悬浮细胞数目保持平稳,便可视为消化终止。
(vi)细胞转移阶段:待消化终止程序结束后,开启细胞转移通道的细胞转移泵,富含游离悬浮细胞的培养基泵送至50L一次性生物反应器,而载体被截留组件截留在10L一次性消化器内。数据监测得到游离细胞数目为0.49×106cells/mL,11小时后细胞贴附至新的载体上,细胞损失率仅为2.01%。
实施例2
参见图6所示,该实施例中的90L一次性生物反应器用作种子反应器,进行微载体细胞悬浮培养;90L一次性消化器用作培养完成的种子细胞消化反应的场所,实现PK-15细胞与微载体的分离,游离的细胞转移至300L一次性生物反应器进行继续培养。90L和300L一次性生物反应器的工作体积分别是63L和210L,反应器的高径比1.8:1.0,搅拌桨采用单层提升带桨,桨径与反应器直径比为:1.0:1.8。90L一次性消化器和10L一次性消化器具有几何相似性特征,其他消化反应步骤参照实施例2,具体的实施流程图如图6所示,此处不再赘述。
富含游离悬浮细胞的培养基泵送至300L一次性生物反应器,而载体被截留组件截留在90L一次性消化器内。数据监测得到游离细胞数目为0.48×106cells/mL,11小时后细胞贴附至新的载体上,细胞损失率仅为3.98%。
对比例1
参见图1所示,该对比例中的10L多次性生物反应器(不锈钢发酵罐)用作种子反应器,进行微载体细胞悬浮培养;10L多次性消化器用作培养完成的种子细胞消化反应的场所,实现PK-15细胞与微载体的分离,游离的细胞转移至50L多次性生物反应器(不锈钢发酵罐)进行继续培养。其中,10L多次性消化器与10L多次性生物反应器的设计相同。10L和50L多次性生物反应器的工作体积分别是7L和35L,反应器的高径比1.8:1.0,搅拌桨采用单层提升带桨,桨径与反应器直径比为:1.0:1.8。1L生物反应器载体介质使用GE公司生产的Cytodex-1,3g/L,细胞密度为2.5×106cells/mL。消化反应实施过程如图1所示,具体实施步骤如下:
(i)液体配制阶段:配制清洗液20L、消化液1L、培养基5L,酸液(1N HCl)2L、碱液(3N NaOH)2L,其中培养基中含3%新生牛血清。
(ii)消化器安装阶段:松掉反应器盖和各管路连接处螺丝,拆掉反应器上盖,卸下各电极、孔塞、帽头,用抹布清洗干净,并用纯水冲洗洁净。对接口处、反应器内壁和搅拌装置封口处,用纯水重点清洗,冲尽残渣和残液。检查各垫圈、皮圈是否老化损坏,并及时更换。将各管道部件连接完毕,并将电极与中央控制器通过电极线连接,对pH值电极、溶氧电极进行零点标定和斜率标定。通入空气保压,检查反应器的气密性。
(iii)消化器灭菌阶段:121℃空消灭菌30min。插入pH值电极和溶氧电极,消化器内装有7L纯水,121℃实消灭菌30min。
(iv)消化器调试阶段:灭菌完毕后,启动温度控制组件,设定温度为37℃,系统通过循环水系统冷却降温至设定温度;PID控制加热器加热和循环水冷却,温度保持在37℃。
(v)消化清洗阶段:开启排出阀门,将纯水从罐体内排出。关闭消化液排出阀,开启清洗液进入阀,通过压差法加入清洗液5L,冲洗罐体30min;开启清洗液排出阀,排尽清洗液。反复清洗1-3次,直到清洗验证无残留。将10L多次性反应器培养的培养液沉降,抽调上清液,通过罐体底阀将沉降液转移至10L多次性消化器内。加入清洗液5L至消化器内再次清洗、沉降。清洗时,设定温度为37℃、转速为50rpm。清洗完毕后,停止搅拌,待沉降后排空清洗液。
(vi)消化开始阶段:待清洗阶段结束后,开启消化液进入阀,将0.6L消化液泵送至消化器内,设定温度为37℃,转速为25rpm,pH为7.0。每隔10min取样测定游离细胞数目,当细胞数目不再增加时,视为消化过程完成,关闭搅拌、pH,开启消化液排出阀,排净消化液。
(vii)消化终止阶段:待消化结束之后,开启培养基进入阀,将5L培养基泵送至消化器内,设定温度为37℃、转速为100rpm。每隔10min,取样测定游离细胞数目,当细胞数目不再增加或细胞活性下降,视为消化终止。
(viii)细胞转移阶段:待消化终止后,开启细胞转移阀,通过压差法将细胞转移至50L多次性生物反应器内。取样测定游离细胞数目为0.3×106cells/mL,14小时后细胞贴附至新的载体上,细胞损失率为41.56%。
对比例1中的多次性消化器需要反复安装调试,需要在线进行消毒和清洗,因而浪费时间和人力,且多次性智能消化器的细胞损失率高达41.56%,而本发明提供的一次性消化器省去了SIP(在线消毒)和CIP(在线清洗)、设备反复安装调试等步骤,简化了操作流程,节省了物力、人力成本;且,一次性消化器损失率最低可达2%,大大降低了细胞消化损失率。
上述具体实施方式,仅为说明本发明的技术构思和结构特征,目的在于让熟悉此项技术的相关人士能够据以实施,但以上所述内容并不限制本发明的保护范围,凡是依据本发明的精神实质所作的任何等效变化或修饰,均应落入本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!