一种在微流控芯片中利用透明质酸功能化的磁珠识别和分离循环肿瘤细胞的方法与流程
本发明属于分离循环肿瘤细胞领域,特别涉及一种在微流控芯片中利用透明质酸功能化的磁珠识别和分离循环肿瘤细胞的方法。
背景技术:
循环肿瘤细胞(circulatingtumorcells,ctcs)可以自发或因诊疗操作从原发肿瘤脱落,随血液循环扩散的肿瘤细胞。它的生成被认为是肿瘤发生转移的必要前提。ctcs的检测有助于研究肿瘤转移机制、指导肿瘤治疗、判断治疗效果、为推断预后提供可靠参考,是国内外肿瘤治疗关注的焦点。此外,对检测到的ctcs进行更加深入的研究对于理解肿瘤转移与复发也具有重要意义。然而ctcs的检测十分困难,因其在血液中的浓度极低,出现概率约为每1千万白细胞或50亿个红细胞中才有一个ctcs,所以ctcs研究的关键在于能否在复杂环境中对其进行高效、迅速、准确地富集和检测。
微流控技术(microfluidics)是一种在微米尺度的通道内对微量液体进行操纵或控制的技术,从采样、样品预处理、反应、分离富集到检测的整个分析过程在集成的微芯片上完成,在极大减少样品和试剂用量的同时,提高分析速度,实现分析系统的微型化、集成化和自动化,并且具有低成本、高通量、使用简便、可多部件组合等优点。由于用于分选ctcs的样品量非常有限,微流控技术处理微量样品的优势可以有效地弥补这一问题。而且实现该技术的微通道尺寸在微米量级和细胞尺寸非常匹配,非常适合应用于细胞分离。近年来,多种灵敏、特异的ctcs检测技术已经建立,并使用不同的工作机制,例如利用声学原理、磁学原理、介电电泳原理、流体动力学原理而进行ctcs分离的微流控技术。而基于磁分离技术的微流控芯片用于ctcs分离是一种简便、对样本损害小、效率高的通用方法。
免疫磁珠分离方法是常用的循环肿瘤细胞分离方法。由于不同肿瘤细胞表面具有不同的标记物,通过在磁珠表面包被单克隆抗体再与含有相应抗原的肿瘤细胞特异性地结合,可以形成磁珠-细胞的复合物。当施加外加磁场时,这种复合物因受到磁力作用而与其它组分分离。cellsearch系统是目前唯一通过美国食品药品监督管理局(fda)认证的应用于临床对转移性乳腺癌、结直肠癌或前列腺癌等ctcs分离和计数系统。该系统通过在磁颗粒表面偶联抗上皮细胞黏附分子抗体(epithelialcelladhesionmolecule,epcam)抗体,与人体血液样本混合后,与血液中的ctcs表面的抗原特异性结合,在磁场作用下将ctcs分离,且该系统分离ctcs效率可达80%[riethdorfs,etal.detectionofcirculatingtumorcellsinperipheralbloodofpatientswithmetastaticbreastcancer:avalidationstudyofthecellsearchsystem[j].clincancerres,2007,13(3):920-928]。由于该系统广泛的临床应用前景,song[songeq,etal.fluorescent-magnetic-biotargetingmultifunctionalnanobioprobesfordetectingandisolatingmultipletypesoftumorcells[j].acsnano:2011.5(2):761-770]等人分别将红色荧光标记的cd3抗体或黄色荧光标记的psma抗体修饰在磁性纳米颗粒表面,红色荧光的含有cd3抗体的磁性纳米颗粒可以靶向白细胞,黄色荧光的含有psma抗体的磁性纳米颗粒可以靶向捕获前列腺癌细胞。在外加磁场的作用下,该方法很容易将白细胞和前列腺癌细胞从正常细胞中分离。
基于微流控技术高通量以及能够实现连续操纵流体的优势,研究者们开发了结合微流控技术的磁分离设备。越来越多的研究表明,在微流控芯片上利用免疫磁珠分离循环肿瘤细胞的方法操作步骤简单,选择性高,灵敏度高,芯片管道无需修饰,捕获效率高,具有较大的应用潜力。hoshino等[hoshinok,etal.microchip-basedimmunomagneticdetectionofcirculatingtumorcells.labchip.2011;11:3449-3457]根据最基本的磁性吸附原理,采用上皮细胞粘附分子(epcam)修饰的纳米免疫磁珠来靶向标记ctcs,被磁珠标记的细胞在芯片中被磁场力吸附在硅片表面,未标记细胞流出微流控芯片外部。强大的磁场力使快速分离成为可能,利用该芯片,可以达到每小时处理10ml样品,并且加入的磁珠的比例和cellsearch系统相比减低了25%。该系统捕获ctcs会在一个梯度场强的作用下,分散在一定面积的玻璃表面,避免了聚集。earhart等[earhartcm,etal.isolationandmutationalanalysisofcirculatingtumorcellsfromlungcancerpatientswithmagneticsiftersandbiochips.labchip.2014,14(1):78-88.]依据同样的原理,制备了另一种依靠磁性吸附力ctcs的芯片,该芯片的主要结构为微孔直径40μm的滤网,成分为在氮化硅薄膜上镀上12μm厚的磁性软坡莫合金,使得芯片本身具有磁性。经过免疫磁珠处理的血液样品流过滤网时,正常的血细胞从微孔通过,而磁性微球标记的ctcs则被吸附在微孔边缘。但是这种吸附捕获会造成微流控通道的堵塞,处理的样品量有限,也不利于自动化的分析。近来武汉大学张教授课题组[tangm,etal.achipassistedimmunomagneticseparationsystemfortheefficientcaptureandinsituidentificationofcirculatingtumorcells.labchip.2016;16:1214-1223.]在磁性纳米球(magneticnanospheres,mn)上修饰抗上皮细胞粘附分子(epcam)抗体以制备免疫磁性纳米球(imn),然后将imn装载到磁场可控的微流体芯片中以形成均匀的imn阵列,去靶向捕获癌细胞。结果证明,将癌细胞注入血液中通入通道内,白细胞流出通道,癌细胞被捕获在免疫纳米球上,最后再用pbs冲洗通道将癌细胞收集,细胞活力实验证明该微流控装置对细胞活性影响不大。综上所述,结合生物标志物识别的免疫磁珠分离方法已经被证明是进行细胞分离和检测的有效工具。
迄今为止在微流控芯片中使用较多的肿瘤细胞捕获方法多为基于抗原-抗体亲和力介导的识别。但是抗体存在不易保存、价格昂贵、反应条件苛刻、且容易失活等一系列缺陷,从而限制其在癌症早期诊断中的实际应用。所以磁分离的突破点在于找到一种特异性强、价格便宜、灵敏度高的配体去捕获癌细胞。
透明质酸(ha)是脊椎动物组织和体液中的一种重要成分,而且在各种生物过程中起着非常重要的作用,如细胞粘附,细胞迁移,伤口修复和细胞增殖[kamatm,etal.hyaluronicacidimmobilizedmagneticnanoparticlesforactivetargetingandimagingofmacrophages.bioconjugatechem.2010;21:2128-2135.]。除此之外,ha是一些癌细胞表面cd44受体的靶分子[[47]toolebp,etal.hyaluronan-cellinteractionsincancerandvasculardisease.jbiolchem.2002;277:4593-4596.]。li等[lij,etal.hyaluronicacid-modifiedhydrothermallysynthesizedironoxidenanoparticlesfortargetedtumormrimaging.biomaterials.2014;35:3666-3677]在水热法合成的pei包覆的fe3o4纳米颗粒的基础上,通过edc化学键和的方法在其表面修饰不同分子量的ha,用于肿瘤的单模态分子影像诊断,结果表明修饰靶向分子的纳米平台对高靶向分子受体表达的体内癌细胞或体内肿瘤模型移植瘤有很好的靶向作用。研究证明,cd44在许多种癌细胞如上皮癌、淋巴癌、乳腺癌及肺癌中均有表达,因此,目前广泛采用ha来靶向过度表达cd44的癌细胞用于癌症诊疗。ma等人[ma,m.,etal.hyaluronicacid-conjugatedmesoporoussilicananoparticles:excellentcolloidaldispersityinphysiologicalfluidsandtargetingefficacy.journalofmaterialschemistry,2012;22:5615-5621]将ha接枝到介孔二氧化硅纳米粒子(msns)表面并用于药物载体,细胞试验表明msns-ha能够选择性地靶向到过度表达cd44受体的hela细胞上。并且透明质酸具有价格低廉,性质稳定等特性,可以代替抗体作为靶向因子来捕获肿瘤细胞,具有更广阔的商业应用价值。
检索国内外相关文献和专利结果表明,在微流控技术中还未发现基于在磁珠表面修饰透明质酸靶向结合肿瘤细胞,依靠磁场力来实现细胞分离的报道。
技术实现要素:
本发明所要解决的技术问题是提供一种在微流控芯片中利用透明质酸功能化的磁珠识别和分离循环肿瘤细胞的方法,该方法分离过程简单、方便、快速、易操作、特异性强、成本低,在癌症的早期诊断方面具有良好的应用前景。
本发明提供了一种在微流控芯片中利用透明质酸功能化的磁珠识别和分离循环肿瘤细胞的方法,包括:
(1)制备用于磁力分离循环肿瘤细胞的微流控芯片,其中,微流控芯片入口和出口包含有两个分支;
(2)在氨基化二氧化硅包覆的磁珠表面修饰透明质酸ha,得到ha功能化的sio2磁珠;
(3)将含有循环肿瘤细胞的样品与ha功能化的sio2磁珠混匀孵育,得到混合样品;然后将混合样品通入微流控芯片通道内,同时从入口的另一分支注入缓冲溶液,在外加磁场的作用下实现结合磁珠的细胞与未结合磁珠的细胞的分离。
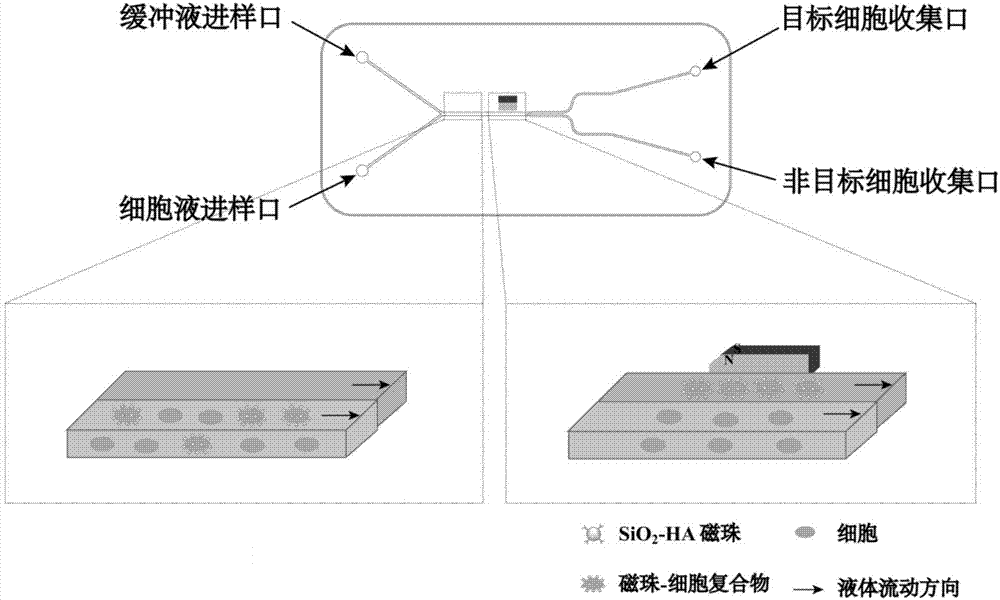
所述步骤(1)中的微流控芯片的入口包括缓冲液入口和细胞液入口,出口包括目标细胞收集口和非目标细胞收集口。
所述步骤(2)中的修饰包括如下步骤:
a.将透明质酸ha溶于超纯水中,加入溶解在溶剂里的edc和nhs活化ha上的羧基,磁力搅拌3h~5h,得到活化的ha溶液;
b.将氨基化二氧化硅包覆的磁珠加入到超纯水中,磁分离洗涤除去保存液里的乙醇;
c.将洗涤好的二氧化硅磁珠重新分散在超纯水中,再加入到活化的ha溶液中,搅拌反应2-4天,得到ha功能化的sio2磁珠。
所述的氨基化二氧化硅包覆的磁珠是购自苏州海狸磁珠公司,磁核为fe3o4,壳层为sio2和聚丙烯酰胺聚合物,粒径为2μm。
所述步骤a中的溶剂为dmso。
所述步骤a中的ha的分子量mw为11200,ha与edc、nhs的摩尔比为10:1:1。
所述步骤b中的磁分离时间为2min。
所述步骤c中的氨基化二氧化硅包覆的磁珠与ha的摩尔比为1:4。
所述步骤(3)中的混合样品中磁珠的浓度为0.5mg/ml,细胞浓度为1×106/ml。
所述步骤(3)中的孵育条件为37-38℃培养箱静置30min-1h。
所述步骤(3)中的混合样品通入微流控芯片通道内的流量为75μl/min。
所述步骤(3)中的缓冲溶液为pbs。
所述步骤(3)中的分离效率的计算方法为:
本发明的原理图见图1、图2,具体过程为:将修饰有ha的sio2磁珠与癌细胞共培养后使sio2-ha磁珠特异性捕获癌细胞,通入微流控芯片通道的细胞进样口中,同时将pbs从缓冲液进样口注入通道中,当其与细胞液入口的样品接触时,由于流体的层流特性,最初二者会继续沿着各自的流线进行流动,而不会发生混合。在出口方的交叉口前,靠近缓冲液流层的一侧放置小型磁铁,在外加磁场的作用下,包覆磁珠的癌细胞受到磁力的吸引,偏离自身的流线,进入目标细胞收集出口,未被捕获的细胞沿着原来的流线轨迹从非目标出口流出,从而实现被磁珠捕获的细胞与未被磁珠捕获的磁珠的分离。
有益效果
(1)本发明采用的二氧化硅磁珠尺寸在2μm左右,磁性良好,利用在其表面修饰的透明质酸配体捕获相应受体表达的肿瘤细胞,通过配体受体之间较强结合力,提高肿瘤细胞的捕获效率;
(2)本发明采用的ha修饰的sio2磁珠,特异性吸附高表达cd44受体的靶细胞,而不吸附或较少吸附cd44受体低表达细胞,从而实现了对癌细胞的特异性识别和捕获;
(3)本发明是使用配体-受体结合力特异性识别、捕获、分离肿瘤细胞的方法;
(4)本发明的分离过程不需要对芯片进行修饰,具有简单、方便、易操作、特异性强、成本低等优势,在癌症的早期诊断方面具有良好的应用前景。
附图说明
图1为本发明对氨基化sio2磁珠的修饰以及捕获细胞的示意图;
图2为本发明芯片对肿瘤细胞进行分离的原理图;
图3为本发明ha(a)、氨基化sio2磁珠(b)和sio2-ha磁珠(c)的热重分析图;
图4为氨基化sio2磁珠、sio2-ha磁珠的表面电势结果图;
图5为sio2-ha磁珠捕获细胞的荧光显微镜下的视野图,其中(a,b)为经ha修饰的sio2的磁珠对hela细胞的捕获结果的相差及相差荧光合成图,(c,d)为经ha修饰的sio2的磁珠对l929细胞的捕获结果的相差及相差荧光合成图;
图6为通道中两种液体相遇后的层流效果图;通道入口(a),通道中间部位(b)及通道出口处(c)两种溶液层流现象,液体流动方向如箭头所示;
图7a-b为通道中磁分离细胞的荧光图;白色虚线标示通道结构,液体流动方向为由左至右,由于细胞流动速度较快,荧光图片拍摄曝光时间长,因此在荧光图片中显示为一条沿细胞移动方向的亮线;
图8为不同浓度sio2-ha磁珠对靶细胞hela的分离效率结果图;
图9为相同浓度sio2-ha磁珠对hela和l929细胞的分离效率结果图。
具体实施方式
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。此外应理解,在阅读了本发明讲授的内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
实施例1
微流控芯片的制备
(1)通道图案掩模及su-8模具的制备:用autocad软件设计、绘制掩模图形,然后交由打印公司制成掩模,随后采用光刻法制成su-8模具。该通道的有效长度为10mm,有两个入口(缓冲液入口和细胞液入口)和出口(目标细胞收集口和非目标细胞收集口)。
(2)配制硅胶:将聚二甲基硅氧烷(pdms)预聚物和交联剂按10:1质量比混合,充分搅拌均匀后用真空泵进行抽真空除气泡处理,待气泡除尽后备用。
(3)将加工好的通道阳模水平放置于直径为10cm的培养皿中,倒入25g配制好的pdms硅胶,将阳模全部浸没。在桌上轻震,除去小气泡。将培养皿水平放置于80℃烘箱中加热2h凝固处理。
(4)凝固后取出,用手术刀切割出阳模板的区域范围。然后轻轻揭下pdms块,这时pdms块底部会出现掩模版图案上的通道。用打孔器在通道两端的入口和出口处打上小孔。
(5)将载玻片和pdms块用等离子清洁机,有通道图案的一面朝上,等离子化处理45s,结束后立即取出,将两者朝上面粘紧键合。
(6)往通道通入2%bsa溶液,在倒置显微镜下观察流动是否顺畅以及是否渗漏。如果液体流动顺畅并且键合完好则通道做成功。
实施例2
功能化sio2磁珠的制备
(1)将购买的尺寸为2μm的氨基化sio2磁珠(4mg)溶液用超纯水磁分离3次,分散到1mldmso溶液中;
(2)将ha(mw=11200,26.9mg)置于2ml60-70℃的水中溶解,以摩尔比ha:edc:nhs=1:10:10,将edc(4.58mg)、nhs(2.76mg)分别溶在1ml的dmso溶液中,搅拌反应3小时,以活化ha表面的羧基;随后,再将活化好的ha溶液逐滴加入到上述(1)中的sio2磁珠溶液中,温和搅拌反应2~4天,磁分离洗涤并分散于0.4mlpbs中,得到修饰ha的sio2磁珠。tga的测试结果(图3)显示上载率为12.3%,证明ha成功修饰在磁珠表面。表面电势测试结果(图4)表明ha修饰前,由于氨基化sio2磁珠存在大量表面氨基,电势是+16.7mv,经过ha修饰之后,制备的ha修饰的sio2-ha磁珠的表面电势降到了-37.4mv,说明了ha成功修饰到氨基化sio2磁珠的表面。
实施例3
hela细胞培养在添加了10%的fbs和1%青-链霉素双抗的细胞培养液(dmem)中,培养瓶放置在37℃,5%co2,95%rh的细胞培养箱中。当hela细胞增值量达到90%时,将细胞培养瓶中的细胞用胰酶消化处理后,加入细胞培养液,转移入15ml离心管中。离心,去除上清液,将细胞溶于1ml的培养液中。接下来用细胞计数器对细胞液计数确定细胞浓度,再经钙黄绿素染色,离心洗涤多余的染液,最后取1×106个hela细胞加入到sio2-ha磁珠的pbs溶液中(50μl),在37℃下共培养1h,于ep管中让靶向磁珠去结合肿瘤细胞。对照组采用l929细胞(不表达cd44受体的正常细胞)与sio2-ha磁珠采用上述同样条件下共培养。1h小时后,分别取出适量的细胞与材料的悬浮液置于载玻片上,在显微镜下观察磁珠和细胞的结合情况,以此评价ha修饰的sio2对hela细胞(cd44受体高表达)的特异性靶向效果。图5a和5c是两种细胞与磁珠结合的相差图,结果显示hela细胞周围都有粘附靶向磁珠,并且每个细胞基本都有粘附磁珠。由经过放大的结合图可以看出结合了磁珠的细胞尺寸明显变大了,而l929细胞周围几乎没有粘附靶向磁珠,细胞尺寸也相对较小。为了更明显的看出二者的结合效果,将经钙黄绿素染色的细胞与靶向磁珠共培养后,在荧光显微镜下观察二者的结合效果。如图5b,相差荧光的合成图显示,呈现绿色荧光的hela细胞周围粘附很多sio2-ha磁珠,而绿色的l929细胞周围粘附极少量的sio2-ha磁珠(图5d)。以上实验说明ha修饰的sio2的磁珠的特异性靶向效果很好,为实现通道内细胞的有效分离实验奠定了基础。
实施例4
为了证明细胞液和缓冲液在通道内保持流体层流,在通道的细胞液进样口注入绿色荧光染液,同时在缓冲液进样口注入pbs缓冲液,保证进样口储存的液体高度相同。待流速稳定后,在荧光显微镜下观察通道里两种液体相遇后的层流效果。如图6所示,在荧光显微镜下观察到通道的荧光染液流层为绿色荧光,缓冲液流层的颜色是没有荧光的。最后在同一个视野下,拍下相差和荧光照片,再将二者合成,荧光染液流层和缓冲液流层明显呈现不同的颜色,结果表明,通道中流体在出口方的分叉口处仍为层流。
实施例5
(1)用2%bsa溶液浸泡通道10分钟,使bsa均匀吸附到pdms表面,减少通道表面对细胞的粘附力。
(2)将共培养1h后的细胞和sio2-ha磁珠的悬浮液注入通道的细胞液进样口中,同时将缓冲液pbs从缓冲液进样口注入通道中,当其与细胞液接触时形成动态稳定的层流界面。
(3)在通道的交叉出口处缓冲液一侧放置一块小型长方体钕铁硼超强磁铁(12mm*4mm*4mm,表磁为2500高斯),用以捕获磁珠包覆的hela细胞。结果,被磁珠捕获的细胞从目标细胞出口流出收集,未被磁珠捕获的细胞从非目标细胞出口流出收集。
(4)最后在荧光显微镜下观察通道内磁铁捕获癌细胞的情况。如图7a所示,hela细胞和sio2-ha磁珠的悬浮液注入通道后,在施加磁场之前,绿色荧光细胞和磁珠共培养后的混合液由于层流性质在通道右侧流动。如图7b所示,施加磁场之后,观察到结合了磁珠的绿色荧光细胞跨越到缓冲液流层从缓冲液出口流出与未结合磁珠的细胞分离开。因此该ha功能化磁珠可以有效地用于磁分离细胞。
实施例6
本实施例评价了制备的sio2-ha磁珠珠分离靶细胞的效率。提前用bsa浸泡通道2h,再将1×106个高表达cd44受体的hela细胞胰酶消化,离心收集经钙黄绿素染色后,再与不同浓度的sio2-ha磁珠(0.005,0.1,0.5,1,1.5mg/ml)共同孵育1h通入通道内。然后,在通道出口处试验了一个合适位置放置磁铁,每次磁铁放置同一个位置,在显微镜的低倍数下测量磁铁与通道边缘的距离以此来保证每次磁铁的位置是固定的。在外加磁场的作用下,用荧光显微镜观察细胞被分离的情况,同时记录流向通道两个出口处的细胞数,最后计算磁珠对靶细胞的分离效率。每组实验的分离效率计数3次取平均值(图8),结果表明,随着材料浓度的增加,细胞分离效率呈现递增的趋势,当材料浓度在1mg/ml时,靶细胞的磁分离效率达到饱和(92.2%)。由于材料浓度在0.5mg/ml时对靶细胞的分离已经达到89.5%,考虑到材料的用量问题,故下述实验所使用的材料浓度为0.5mg/ml。
实施例7
本实施例选取两种细胞,分别是cd44受体高表达的hela细胞及不表达cd44受体的l929细胞作为目标细胞和对照细胞模型。两种细胞培养在dmem培养液中,所用培养液均加了10%的fbs和1%青-链霉素双抗中,在37℃,5%co2,95%rh的环境下连续传代培养。参照实施例6中的具体实验条件来比较两种细胞的磁分离效率,以此来评估sio2-ha磁珠对高表达cd44受体细胞的特异靶向性。经过实施例6实验条件的优化,选择的实验条件为磁珠的浓度为0.5mg/ml,分别将两种细胞胰酶消化,离心收集后经钙黄绿素染色,再与材料sio2-ha磁珠共同孵育1h(保证两种细胞与材料共培养条件相同),再分别通入通道内,在外加磁场的作用下,被靶向磁珠包覆的细胞会受到磁场力偏移自己的流线移动到缓冲液的出口,与未被磁珠包覆的细胞分离开,最后再统计两种细胞的分离效率。如图9所示,可以看出,同等条件下hela细胞的分离效率高达89.5%,而l929细胞的分离效率仅达到13.8%。说明ha的修饰赋予了sio2磁珠对hela细胞的特异靶向能力,从而为该靶向材料成功高效地应用到宫颈癌症患者的早期诊断方面提供了可靠的依据。
- 还没有人留言评论。精彩留言会获得点赞!