一种伪狂犬病病毒gE蛋白的抗原表位、抗体的制备及应用的制作方法
本发明属于生物技术领域。更具体涉及一种伪狂犬病病毒ge蛋白的抗原表位、抗体的制备及应用。
背景技术:
伪狂犬病(pseudorabies,pr),是由伪狂犬病毒(pseudorabiesvirus,prv)引起多种动物发热、奇痒、脑脊髓炎为主要特征的一种急性烈性传染病,又称aujeszky’s病。prv属于疱疹病毒科,α疱疹病毒亚科成员,双链线状dna病毒。猪是该病原的主要宿主和传染源,成年猪大多为隐性感染,仔猪发病主要表现为发热,食欲不振,精神萎靡,伴有明显的神经症状。妊娠母猪感染会导致流产,产死胎及木乃伊胎。随着养殖业的规模化发展,该病的发生及流行日趋严重,症状愈发明显。该病也给全世界养猪业带来了极大的经济损失。
伪狂犬病毒的ge基因位于us区,全长1.7kb,是伪狂犬病毒的主要毒力基因之一。伪狂犬病自我国发现以来一直在猪群中流行,ge基因缺失活疫苗的广泛使用使得该病得到了有效控。但由于伪狂犬病有着高度的潜伏感染特性,易在体内外环境变化的应激下爆发疫情。ge-elisa配合ge基因缺失疫苗使用,能用血清学方法鉴别出疫苗接种猪和野毒感染住,对于伪狂犬病的防控与净化具有重要意义。随着2011年伪狂犬病在中国爆发,伪狂犬病毒毒力增强,传统疫苗不能对新出现的变异毒株提供完全保护,这提示单纯使用疫苗不可能根除伪狂犬病。为了有效控制直至根除伪狂犬病,需建立一种有效快速的血清学诊断方法以区分野毒株感染猪与疫苗免疫猪。而现有技术中并没有相关抗体的研究,也并没有相关抗原表位的研究,从而导致无法有效的区分野毒株感染猪与疫苗免疫猪。
技术实现要素:
本发明的目的是在于提供了伪狂犬病病毒ge蛋白的抗原表位,所述抗原表位为:编码2e5抗原表位的短肽,序列如seqidno.1:rlrre所示,定位在161-165aa。编码5c3抗原表位的短肽,序列如seqidno.2:emgigdy所示,定位在148-154aa。所述抗原表位可以被js-2012毒株(野生毒株)的单克隆抗体所识别,但不与bartha-k61毒株(疫苗株)和vero细胞的单克隆抗体发生反应。
本发明还有一个目的是在于提供了一种伪狂犬病病毒ge蛋白的抗原表位在伪狂犬病病毒抗体药物检测试剂中的应用,该应用使得伪狂犬病病毒抗体诊断抗原可以用普通化学合成方法制备,相比基因工程表达蛋白做为诊断抗原,合成抗原工艺简便,纯度更高。
为了实现上述的目的,本发明通过以下技术措施实现.
一种伪狂犬病病毒ge蛋白的抗原表位的制备方法,其步骤是:
a、利用分子生物学对ge主要抗原表位区域基因的扩增与重组质粒的构建。
b、将重组蛋白的诱导表达与纯化,
c、利用纯化蛋白进行小鼠免疫,获得杂交瘤细胞和单克隆抗体。
d、单克隆抗体的稳定性和特异性检测。
e、获得上述特异性单克隆抗体的抗原表位,并对其进行鉴定。
一种伪狂犬病病毒ge蛋白的抗原表位在制备治疗或预防伪狂犬病病毒elsia抗体药物检测(试剂盒)中的应用,其步骤是:
1、以获得的抗原表位作为参考化学合成抗原。
2、以合成抗原制备试剂盒主要组分抗原包被板。
3、按常规方法制备试剂盒其他组分。
4、使用试剂盒检测血清中狂犬病病毒抗体。
本发明与现有技术相比,具有以下优点和效果:
1、本发明的抗原表位是由针对js-2012株的特定单抗筛选而来,具有极高的特异性和稳定性。
2、与现有的灭活病毒抗原或基因表达抗原技术相比,生产过程中不涉及菌种和毒株,工艺安全有保障,不会对环境造成污染。
3、利用获得的抗原表位合成肽抗原与基因工程表达抗原相比,生产周期短,易纯化且纯度较高。
4、本发明适合大规模的临床血清检测,反应时间短,2小时即可出结果。
5、本发明试剂盒与其他病毒阳性血清无交叉反应,敏感性高,特异性好。
6、本发明试剂盒操作简便,与伪狂犬病病毒正向间接血凝试剂盒符合率高。
附图说明
图1为ge基因扩增和重组质粒pcold-ge酶切鉴定,其中,a:ge基因的pcr扩增.1:ge基因pcr扩增结果;2:阴性对照;m:dna分子量标准b:重组质粒pcold-ge酶切鉴定.1:pcold-tf质粒ecori酶切;2:pcold-ge质粒ecori酶切;m:dna分子量标准。
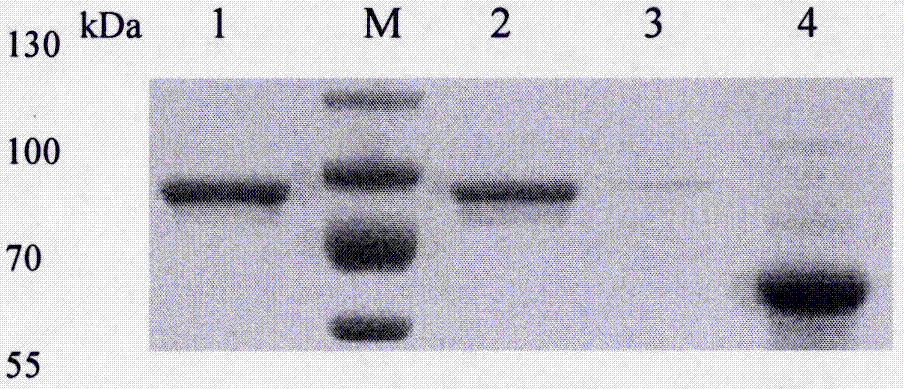
图2为ge重组蛋白的表达与纯化,其中,1:纯化的重组ge蛋白;2:iptg诱导的pcold-ge转化菌裂解物上清;3:iptg诱导的pcold-ge转化菌裂解物沉淀;4:iptg诱导的pcold-tf转化菌;m:蛋白质分子量标准.
图3为ifa鉴定ge蛋白单克隆抗体的特异性。
图4为ge蛋白单抗的westernblot鉴定,其中,1:prvjs-2012感染的vero细胞;2:prvbarthak61感染的vero细胞;3:未感染的vero细胞
图5为ge2e5鉴定表位示意图,其中a为鉴定第1轮,b为鉴定第2轮,c为鉴定第3轮。
图6为ge5c3鉴定表位示意图,其中a为鉴定第1轮,b为鉴定第2轮,c为鉴定第3轮。
具体实施方式
实施例1:材料与方法
毒株、细胞和实验动物
伪狂犬病病毒js-2012株,bartha-k61株,sp2/0骨髓瘤细胞,pk-15,vero细胞均由中国农业科学院上海兽医研究所保存。细胞均在37℃,5%co2和10%fbs(fbs,sigma,shanghai,china)条件下培养。balb/c雌性小鼠购自上海斯莱克实验动物公司。
载体、试剂和菌株
pcold-tf载体,大肠杆菌bl21(de3)购自takara(上海)公司;hrp标记的山羊抗鼠igg和fitc标记的山羊抗鼠igg购于sigma(上海)公司;核酸内切酶ecori购自neb(上海)公司。
实施例2:ge主要抗原表位的扩增、蛋白制备
ge主要抗原表位区域基因的扩增与重组质粒的构建
根据ncbi发表的prv(js-2012)ge基因序列(序列号:kp257591.1),设计特异性引物扩增ge基因第151-750位核苷酸。
上游引物ge-f:5’-accctcgagggatccgaattcatgaccgaggccgacgac-3’(seqidno.3);
下游引物ge-r:5’-caggtcgacaagcttgaattcttagaccacgcgcggcat-3’(seqidno.4)。小写部分是与pcold-tf进行同源重组的同源臂序列,扩增产物为600bp。按照天根dna小量提取试剂盒说明书提取prv(js-2012)dna(-20℃保存),用primestarhs(takara)高保真酶扩增ge部分基因。pcr扩增程序:95℃5min;98℃10s,68℃10s,72℃1min(35个循环);72℃10min。将pcr产物通过同源重组(诺唯赞)的方法,与pcold-tf载体多克隆位点的相应位置重组,质粒测序正确后,阳性质粒命名为pcold-ge。pcr扩增得到了伪狂犬病毒ge基因约600bp的片段(图1a),pcr产物经凝胶电泳分离,将目的片段纯化回收并克隆到pcold-tf表达载体中。重组质粒酶切鉴定结果显示,阳性质粒出现与预期大小一致的片段(图1b)。测序结果显示阳性质粒携带目的基因与预期序列一致,阳性质粒pcold-ge可以用于下一步的试验研究。
重组蛋白的诱导表达与纯化
将重组质粒pcold-ge转化到bl21(de3)大肠杆菌中,37℃振荡培养至od600值达到0.6~0.8时,加入终浓度为1mm的iptg诱导,16℃振荡24小时。收集菌体加入pbs进行超声裂解,加入5×sdsbuffer煮沸10min后进行sds-page电泳,对sds-page蛋白胶进行考马斯亮蓝染色,观察蛋白表达情况,同时设置空载体表达组作为对照。之后将pcold-ge转化表达菌按1∶1000比例接种到4ml含100μg/mlamp的lb培养基中,37℃、200r/min振荡培养12h。然后再按1∶100将复苏的菌液接种于100ml含100μg/mlamp的lb培养液中,37℃、200r/min培养,至od600达到0.6~0.8时停止,加入终浓度为1mmol/liptg,16℃诱导24h后,离心收集菌体。表达后的菌体进行超声破碎,差速离心后收集上清蛋白。采用带his标签的磁珠(biotool)根据说明书进行纯化,纯化的蛋白分装后保存于-80℃。pcold-ge载体转化的表达菌e.colibl21(de3)经iptg诱导后,收集菌体超声裂解进行sds-page凝胶检测。结果显示,与载体对照组相比,pcold-ge表达菌出现了相对分子量约为90kda(tf辅助蛋白约60kda)的目的条带,与重组蛋白大小相符。目的蛋白主要都在裂解物上清中。重组蛋白经磁珠纯化后,电泳结果显示纯化目的蛋白纯度较高(图2)。
实施例3:单克隆抗体的制备
小鼠免疫
取100μg纯化蛋白与弗式完全佐剂1∶1混合乳化,接种6周龄健康雌性balb/c小鼠,此后每隔2周用等量纯化蛋白与弗氏不完全佐剂乳化进行第二和第三次免疫,第三次免疫后第10天采血,测定elisa抗体效价,效价在1∶10000以上的小鼠,在细胞融合前第3-4天经腹腔注射纯抗原200μg,进行加强免疫。
mcabs的制备
融合前1d取小鼠腹腔巨噬细胞作为饲养层细胞,之后选取免疫效价最高的小鼠进行脾细胞与sp2/0细胞融合。将杂交瘤细胞培养在铺有饲养层细胞的96孔板里,在37℃、5%co2在hat选择性培养基条件下培养。在杂交瘤细胞长满96孔板1/3~1/2面积时,通过间接elisa以及ifa的方法检测以筛选阳性细胞克隆株。将筛选的阳性细胞克隆株经3~5轮细胞亚克隆之后,对能稳定分泌抗体的杂交瘤细胞进行扩大培养,液氮冻存。将筛选的杂交瘤细胞株连续传代20代,分别取第5、10、15和20代细胞上清液,用间接elisa的方法进行检测,鉴定杂交瘤细胞分泌抗体稳定性。
实施例4:单克隆抗体的鉴定
间接免疫荧光试验检测单克隆抗体
将vero细胞铺在12孔板中,1moiprv感染18h后,弃去上清后,用pbs洗3遍,用丙醇在-20℃固定细胞20分钟,5%bsa室温封闭1h,pbs洗板之后加入收集的杂交瘤细胞上清液,室温孵育1h。pbs洗3遍,避光加入fitc标记的羊抗鼠igg(1∶800pbs稀释)室温避光孵育1h。在荧光显微镜下观察荧光。以1moiprv(js-2012株或bartha-k61株)感染vero细胞24h,固定细胞进行间接免疫荧光试验,以检测单克隆抗体与不同毒株的特异性反应。结果显示,4株单克隆抗体均能与prvjs-2012毒株反应,而不与bartha-k61毒株反应,也不与vero细胞发生反应(图3)。
westernblot检测单克隆抗体
将prv(js-2012)病毒感染vero细胞,12h以后用细胞裂解液裂解细胞,收取细胞蛋白进行sds-page电泳。使用伯乐
实施例5:ge单克隆抗体表位的鉴定
根据ge基因的151-750位核苷酸序列,设计21对引物(表1),引物分别带有pcold-tf载体ecori酶切位点上游臂和下游臂,对ge基因进行截短,将扩增出的dna片段连接到pcold-tf原核表达载体上,经测序正确后,转化到bl21(de3)大肠杆菌中进行表达并诱导,将诱导表达的蛋白经sds-page分析,用单克隆抗体进行westernblot鉴定。
表1引物序列
注:小写部分是与pcold-tf进行同源重组的同源臂序列;大写部分是扩增ge片段的引物。
ge5c3和2e5株单克隆抗体表位的鉴定结果将截短的ge蛋白经过单克隆抗体westernblot鉴定,单克隆抗体2e5株针对的抗原表位定位在159-165aa和161-167aa(图5),氨基酸序列分别为159vprlrre165和161rlrrepp167,并由此确定ge蛋白的2e5株单克隆抗体针对的抗原表位定位在161-165aa,氨基酸序列为161rlrre165。单克隆抗体5c3株针对的抗原表位定位在148-154aa,148emgigdy154(图6)。
实施例6:一种伪狂犬病病毒ge蛋白的抗原表位在制备治疗或预防伪狂犬病病毒elsia抗体药物检测(试剂盒)中的应用,其步骤是:
a、伪狂犬病病毒elisa抗体检测试剂盒中的抗原包被板制备:
根据本发明seqidno:1或2所示的序列,利用本领域中常规的化学合成方法,制备纯度大于95%的短肽,此短肽即为检测抗原。将此抗原用碳酸盐缓冲液溶解并稀释至2μg/ml,然后按每孔100μl加入到96孔酶标板中,4℃放置过夜,使抗原吸附在酶标板中。第二天弃去孔中液体,每孔再加入150μl磷酸盐缓冲液(含0.5%bsa),置37℃温箱中2小时、弃去孔中液体。拍干。
b、伪狂犬病病毒elisa抗体检测试剂盒其他组分制备:
试剂盒其他组分还包含酶标记物、样品稀释液、阳性对照、阴性对照、显色液a、显色液b、洗涤液和终止液。酶标记物为羊抗猪二抗,样品稀释液为磷酸盐缓冲液,阳性对照为伪狂犬病病毒疫苗免疫的猪阳性对照血清,阴性对照为未免疫伪狂犬病病毒疫苗的健康猪阴性血清。洗涤液为含有0.05%tween-20的pbs缓冲液;显色液a为含有50mg/ml过氧化氢脲的柠檬酸盐缓冲液,显色液b液为含有0.2mg/mltmbph5.0的柠檬酸/柠檬酸钠缓冲液。终止液为含0.25%体积比氢氟酸溶液。
c、伪狂犬病病毒elisa抗体检测试剂盒操作步骤:
1)从试剂盒中取出预包被有抗原的检测板,将稀释好的待检血清(1∶40稀释)100μl加入抗原包被板中,同时设阴、阳性对照孔,各设2孔,每孔100μl。
2)轻轻振匀孔中样品,置37℃温育60分钟。甩掉板孔中的溶液,加洗涤液200μl/孔,洗板5次,最后一次在吸水纸上拍干。
3)每孔加酶标记物100μl,置37℃温育30分钟。洗涤5次,方法同步骤2。
4)每孔加显色液a、显色液b各50μl,混匀,室温(18~26℃)避光显色10分钟。每孔加终止液50μl,10分钟内用酶标仪测定每孔od450nm读值。
本发明试剂盒判定标准为:试验成立条件是阴性对照孔平均od450nm值与阳性对照孔平均od450nm值之差大于或等于0.5。s=样品孔od450nm值,n=阴性对照孔平均od450nm值。若s/n比值大于2.1,样品判为伪狂犬病病毒抗体阳性。若s/n比值小于或等于2.1,样品判为伪狂犬病病毒抗体阴性。
d、伪狂犬病病毒elsia抗体检测试剂盒的应用:
1、特异性试验用伪狂犬病病毒elisa抗体检测试剂盒(试剂盒1、试剂盒2,分别使用的是seqidno:1或2所示的抗原表位)检测猪瘟病毒、伪狂犬病病毒、猪口蹄疫(o型)、猪细小病毒、猪流感和猪繁殖与呼吸综合征等标准阳性血清和伪狂犬病病毒阴性血清,除伪狂犬病病毒标准阳性血清的的s/n值显著大于2.1外,其余血清s/n值均小于2.1,符合阴性血清的判定标准,表明这种方法的特异性良好(见表2,其中所列数字为od450nm值)。
表2血清特异性检测
2、敏感性的检测用试剂盒检测不同稀释度的伪狂犬病病毒阳性血清,从表3中可以看出即使1280倍稀释的伪狂犬病病毒阳性血清,依然检测为阳性,说明试剂盒的敏感性很高。
表3血清敏感性检测
3、重复性实验
利用优化后的条件建立的elisa条件进行检测,获得的组间变异系数在1.12%~5.02%之间;获得组间变异系数在1.23%~6.01%之间,表明建立的elisa具有良好的重复性。
综上,利用本发明制备所得的伪狂犬病病毒特异性表位建立的elisa试剂盒检测伪狂犬病病毒具有特异性强、重复性好、灵敏度高的优点,可用于临床伪狂犬病病毒样本的检测。
应当理解,虽然上文中已经用一般性说明及具体实施方案对本发明内容作了详尽的描述,但在本发明的基础上,可以对之进行一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
- 还没有人留言评论。精彩留言会获得点赞!