一种角蛋白生物大分子一氧化氮供体及其合成与应用的制作方法
本发明涉及一种一氧化氮供体,特别是涉及一种角蛋白生物大分子一氧化氮供体及其合成方法,以及所述的一氧化氮供体在血液接触材料、伤口愈合材料等生物医学材料中的应用。
背景技术:
1992年no成为《science》杂志的年度明星分子。1998年度的诺贝尔医学奖授予美国科学家ignarro,murad和fuchgott,以表彰他们在“no作为心血管系统的信号分子”研究中的杰出贡献。no在心血管系统中主要有三个作用:抑制血小板聚集、舒张血管、防止心肌缺血再灌注损伤。此外,no还可以杀菌、消炎、促进伤口愈合。
一氧化氮供体主要有有机硝酸酯类、金属-no配合物类、有机亚硝酸酯类、n-亚硝胺类、肽偶联nonoates类、亚硝基硫醇类等,其中n-亚硝胺类和亚硝基硫醇类研究最广。常见的外源性no小分子供体,在体内的半衰期很短,不稳定,并且具有生物毒性等,因而限制了其生物学作用的有效性和持续性。理想的no供体应具备良好的稳定性、释放机制简单、长时间作用无耐受性、释放过程便于控制等特点。
no可以与硫醇类物质的巯基以共价键的方式结合形成rsno,使其性质相对稳定。亚硝基硫醇类不需细胞代谢,可通过自发均裂反应产生no。人工合成的no供体rsno类药物snap(s-亚硝基乙酰青霉胺)已用于临床。临床上常用的no供体药物是有机硝酸酯和金属-no配合物类(如硝普钠),典型代表分别为三硝酸甘油酯和硝普钠。
技术实现要素:
本发明的目的在于提供一种角蛋白生物大分子一氧化氮供体及其制备方法,能够克服现有的外源性no供体的缺陷,所述的一氧化氮供体分子量大、稳定性良好、生物相容性好,具有可控释放no的功能。
本发明的另一目的还在于提供所述的角蛋白生物大分子一氧化氮供体的应用。
为实现本发明目的,采用以下技术方案:
一种角蛋白生物大分子一氧化氮供体,其特征在于,所述的一氧化氮供体包含角蛋白经还原法处理后所得到的还原型角蛋白,所述还原型角蛋白上的巯基上形成sno基团。
本发明的一氧化氮供体为一种s-亚硝基化角蛋白(ksno),其中sno基团可以在一定条件下分解,从而释放no。所述一氧化氮供体中sno基团的量,可以根据巯基取代度的大小控制,通过硫亚硝基化前后巯基的浓度的变化测定得到。
所述的角蛋白生物大分子一氧化氮供体采用以下方法制备:
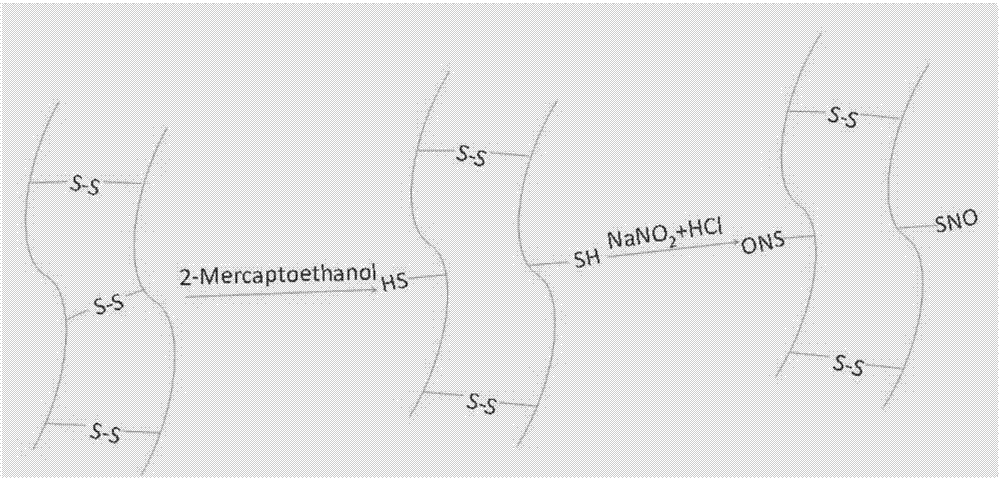
一种角蛋白生物大分子一氧化氮供体的制备方法可称之为“油相法”,其合成过程如图1所示,具体合成方法包括:将还原型角蛋白和亚硝酸叔丁酯的甲醇溶液混合,暗处避光,氮气气氛室温下搅拌;优选还原型角蛋白中的巯基和亚硝酸叔丁酯的化学计量比为1∶1。反应结束后,室温旋转蒸发去除未反应的亚硝酸叔丁酯和副产物叔丁醇,冻干避光保存,即得角蛋白生物大分子一氧化氮供体。
另一种角蛋白生物大分子一氧化氮供体的制备方法可称之为“水相法”,其合成过程如图2所示,具体合成方法包括:将还原型角蛋白在亚硝酸钠水溶液中搅拌溶解,优选还原型角蛋白中的巯基和亚硝酸钠的化学计量比为1∶1;冰浴下,滴加浓盐酸,避光搅拌反应;透析除去多余小分子,冻干制得角蛋白生物大分子一氧化氮供体。
所述的还原型角蛋白的制备参照中国专利(公开号cn104784744a,cn104784758a),主要原理是将角蛋白中的二硫键通过还原剂处理,从而断裂为巯基基团。巯基基团的含量可以通过dtnb法测定得到。
本发明还涉及所述的角蛋白生物大分子一氧化氮供体在制备生物医学材料或no药物方面的应用。
所述的生物医学材料包括人工血管、血管支架、伤口敷料等血液接触材料。所述的角蛋白生物大分子一氧化氮供体可以应用于制备no释放型人工血管或血管支架、no释放型伤口敷料等。可将角蛋白生物大分子一氧化氮供体与聚合物共混复合,采用静电纺丝法、冷冻干燥法、流延成膜法等制备成纤维状、膜状或多孔性等材料,用于人工血管、血管支架或伤口敷料等用途。例如,可以将角蛋白生物大分子一氧化氮供体与聚合物共混复合,制备薄膜或涂层;或与其他聚合物共混,流延成膜。特别地,可以通过静电纺丝法制备角蛋白生物大分子一氧化氮供体/聚合物纳米纤维,用于制备人工血管、血管支架、伤口敷料等材料。
有益效果:本发明与现有小分子no供体相比,突出的优点在于,合成的大分子一氧化氮供体分子量大、可以稳定保存,生物相容性好、毒性低,具备角蛋白的性质,还可以释放no。所述的角蛋白生物大分子一氧化氮供体可以直接作为no供体使用,也可以容易地与其他材料复合,制备出具有可控释放no功能的生物医用材料,具有抗血小板粘附、促进血管内皮细胞生长,抑制平滑肌细胞生长的特性,可用于心血管疾病的治疗和皮肤修复等。
附图说明
图1角蛋白生物大分子一氧化氮供体(ksno)的油相法合成示意图;
图2角蛋白生物大分子一氧化氮供体(ksno)的水相法合成示意图;
图3角蛋白no供体ksno的紫外光谱图;
图4nano2标准曲线;
图5角蛋白no供体ksno的稳定性测试;
图6角蛋白no供体ksno的no释放图;
图7pcl(a)和pcl/ksno(b)纳米纤维扫描电镜图sem图;
图8pcl(a)、pcl/ksno(b)和pcl/ksno/asc(c)纳米纤维的血小板粘附图;
图9huvec细胞培养3天的mtt图;***表示不同组之间的显著性差异p<0.001;
图10大肠杆菌的mtt图。
具体实施方式
下面通过具体实施例对本发明所述的技术方案给予进一步详细的说明,但有必要指出以下实施例只用于对发明内容的描述,并不构成对本发明保护范围的限制。
实施例1:角蛋白生物大分子一氧化氮供体及其合成(油相法)
取0.1g实验室提取的还原型角蛋白(ksh,巯基角蛋白)于棕色瓶中用5ml乙醚分散,加入1ml亚硝酸叔丁酯的乙醚溶液,暗处避光,氮气气氛室温下搅拌24h。室温旋转蒸发去除未反应的亚硝酸叔丁酯、副产物叔丁醇和乙醚,即得s-亚硝基化角蛋白(ksno),是一种no供体的角蛋白。
将上述制备的s-亚硝基化角蛋白(ksno)配成一定浓度的溶液,在200~600nm波长范围内测量紫外吸收光谱,如图3所示。在334nm处出现的吸收峰为改性后角蛋白上s-no键上n0-π*电子跃迁吸收(v.b.damodaran,l.w.place,m.j.kipper,m.m.reynolds.
enzymaticallydegradablenitricoxidereleasings-nitrosateddextranthiomersforbiomedicalapplications.journalofmaterialschemistry,2012,22:23038-23048.),而巯基角蛋白的特征吸收峰在276nm(x.l.zhi,y.f.wang,p.f.li,j.yuan,j.shen.preparationofkeratin/chlorhexidinecomplexnanoparticlesforlong-termanddualstimuliresponsiverelease.
rscadvances,2015,5,82334-82341.)。这些结果显示ksno合成成功。
实施例2:角蛋白生物大分子一氧化氮供体及其合成(水相法)
将还原型角蛋白样品0.1g投入2ml,50mg/ml亚硝酸钠水溶液中搅拌溶解。冰浴下,慢慢滴加5ml,5m盐酸。避光搅拌反应2h。透析除去多余小分子,冻干制得sno端基角蛋白。样品-20℃避光保存。
实施例3:角蛋白生物大分子一氧化氮供体的稳定性实验
取实施例1或2制备的角蛋白生物大分子一氧化氮供体ksno20mg,先用5ml磷酸盐缓冲液中溶解,将此溶液用35ml含0.1mmoledta的磷酸盐缓冲液37℃透析。设定时间取样,用no试剂盒测定no的含量,结果如图5所示。由图5可见,角蛋白生物大分子一氧化氮供体在磷酸盐缓冲液溶液中稳定性较好。
实施例4:体外no释放
分别采用cu(ii)和抗坏血酸这两种引发剂诱导引发合成的ksno分解释放no。
用1mol·l-1的nano2标准溶液进行稀释,得到不同浓度梯度的nano2溶液,每种浓度梯度的溶液取50μl加入96孔板中,再依次加入50μlgriess试剂i和griess试剂ii,避光静置反应15min后,用酶标仪测540nm吸光度。以nano2溶液浓度为横坐标,吸光度为纵坐标,绘制标准曲线,如图4。所得标准曲线方程为:a=0.00273+0.00623c,r2=0.992。
称取两份5mgksno样品分别放入螺口瓶中设置为a和b两组,另设一组空白对照组(不加任何样品)。每瓶加入5mlpbs缓冲溶液中(a含有50mg/mlcubr2溶液,b含有250μg/ml抗坏血酸(asc)溶液),密封后在37℃空气浴中进行摇动,每隔一定时间(12h,24h,36h,48h,60h,72h,96h)。反应结束后,转移溶液至96孔板中,用no检测试剂盒检测亚硝酸根含量,然后依据nano2标准曲线换算出no生成量。
按上述方法,取实施例1或2制备的角蛋白生物大分子一氧化氮供体ksno,用no试剂盒测定no的含量,结果如图6所示。由图可见,在加入cu(ii)和抗坏血酸两种引发剂后,no释放量比空白有明显增加,表明引发剂的加入促进ksno释放no。
实施例5:具有no释放功能的pcl/ksno聚合物纳米纤维的制备
纺丝溶液配制:纺丝液浓度为7wt%,溶剂为六氟异丙醇(hfip),pcl,pcl与ksno共聚物按比例为9/1(w/w),同时含1%n-聚乙烯吡咯烷酮(pvp),以及pcl与ksno共聚物按比例为7/3(w/w),室温下充分搅拌溶解至纺丝液均匀。
静电纺丝:将配制好的pcl/ksno溶液加入到20ml医用注射器中,采用内径为0.6mm的针头,将注射器固定于输液泵中(型号为cp-1100,slgo医学科技有限公司,北京),调整发射电极和接收电极的距离为15cm,静电纺丝的流速为2.0ml/h,开启静电发生器,以相同电压20kv暗处进行纺丝,得到淡黄色混纺纳米纤维,50℃真空烘箱中避光干燥6h左右,待溶剂挥发完全后取出。
对pcl和pcl/ksno表面通过sem进行表征。如图7所示,从sem图可以观察到纳米纤维是均匀的,具有光滑的表面和纳米级纤维结构。
采取静态法测定纤维表面水接触角的变化。结果显示,pcl静电纺纳米纤维膜水接触角为133.59±4.18°,呈现出很强的疏水性。混入改性后的角蛋白,其亲水性有了明显改善,pcl/ksno水接触角为0.557±0.32°,改性后的角蛋白仍然保持角蛋白的良好亲水性。
血小板粘附
取新鲜抗凝兔血以1500rpm/min的速度离心15min后,吸取上层清液富血小板血浆(prp)。将提前准备好的样品放在24孔板中,并用pbs浸泡24h,结束后除去pbs,在每孔中加入0.5mlprp以及催化剂抗坏血酸(asc)(浓度为250μg/ml)溶液,在37℃静态下孵化3h,结束后除去多余的prp,用pbs轻轻洗涤3次。用2.5%戊二醛水溶液在4℃下固定2h。用25%,50%,75%,90%,100%梯度的乙醇水溶液相继脱水20min。结束后冷冻干燥,sem下观察纤维表面的血小板粘附情况。
为了表征制备的pcl/ksno纳米纤维的血液相容性,通过扫描电子显微镜观察粘附在材料表面的血小板数量情况来进行表征如图8所示。大量血小板粘附在pcl纳米纤维垫上,粘附在pcl/ksno纳米纤维垫的表面上的血小板数量低于粘附在纯pcl纳米纤维垫上的血小板数量,这主要是由于改性后的角蛋白固定在纳米纤维后,pcl表面亲水性提高。相比较pcl/ksno和纯的pcl材料,加入抗坏血酸的pcl/ksno纳米纤维垫表面血小板数量明显降低,基本没有被激活,这可能原因是抗坏血酸的加入催化pcl/ksno释放no,从而抑制纤维表面血小板粘附和活化。
人脐静脉血管内皮细胞培养
以含20%的胎牛血清的改良型rpmi-1640为培养基,将人脐静脉血管内皮细胞(huvec)于37℃含5%co2的细胞培养箱中培养。0.25%胰蛋白酶消化,配成5×104cells/ml的细胞悬液。将样品剪成2×2cm2方片,放在超净台中并在紫外线下正反面各照射1h,然后将其放入24孔细胞培养板中,并用灭菌的玻璃圈固定。用75%的酒精浸泡30min,结束后用pbs缓冲溶液清洗3次,最后向每孔内加入1ml细胞悬液以及15μl抗坏血酸(浓度为250μg/ml)溶液,于37℃含5%co2的细胞培养箱中培养,每12h加一次15μl抗坏血酸溶液,于37℃含5%co2的细胞培养箱中培养,阴性对照实验(negativecontrol)为1ml含20%胎牛血清的细胞悬液,将培养板放入温度为37℃,co2浓度为5%的培养箱中培养3d。结束后向每个孔里加入100μlmtt溶液(浓度为0.5mg/ml),37℃继续培养4h。然后将mtt溶液和细胞培养液吸去,用pbs溶液洗涤后,加入500μldmso,避光并用振荡器震荡20min后,吸取甲瓒溶液转入96孔板中,用酶标仪测570nm处其od值。
用mtt法检测纳米纤维表面内皮细胞(huvec)的生长情况如图9所示,在抗坏血酸的存在下,细胞存活数量在pcl/ksno纳米纤维上明显高于无抗坏血酸pcl/ksno和pcl纳米纤维的表面,表明抗坏血酸能够诱导亚硝基硫醇释放出no,促进内皮细胞的生长,有利于血管的形成。
抑菌mtt法
将pcl和pcl/ksno样品剪成2×2cm2方片,放入24孔培养板中,在超净台中并在紫外线下正反面各照射1h,取大肠杆菌菌液,用pbs溶液稀释到1×107cfus·ml-1(560nmod=0.1)[11]。每孔加入1ml稀释后的菌液以及15μl抗坏血酸(浓度为250μg/ml)溶液,置于培养箱里37℃培养12h。结束后向每个孔里加入100μl5%mtt溶液(浓度为0.5mg.ml-1),37℃继续培养12h。然后将mtt溶液和细胞培养液吸去,用pbs溶液洗涤后,加入500μldmso,避光振震荡30min后,用酶标仪(bio-teksynergy2型酶标仪,美国)测570nm处od值。
在真皮伤口中通常存在包括金黄色葡萄球菌和大肠杆菌的病原体,它们是延迟伤口愈合,甚至脓毒症的原因。通过mtt方法对pcl/ksno的抑菌性做了定性表征。实验结果如图10所示,pcl/ksno在无抗坏血酸存在下对大肠杆菌有温和的生长抑制现象。这归因于s-亚硝基化硫醇在生理ph和温度下的缓慢分解。相比之下,在抗坏血酸存在下,催化pcl/ksno释放no,加速细菌的生长抑制及灭杀。增强的杀菌效力可能是由抗坏血酸诱导使初始no量增加的结果。通过材料的杀菌活性实验表明其可有效的对no存储和释放提供良好的平台。
总之,本发明的角蛋白生物大分子一氧化氮供体可以采用静电纺丝法、冷冻干燥法、流延成膜法等制备成纤维状、多孔性等材料,制备得到复合人工血管、血管支架或伤口敷料等材料,用于人工血管、血管支架或伤口敷料等用途。
- 还没有人留言评论。精彩留言会获得点赞!