鉴别检测猪腹泻冠状病毒的引物及多重RT‑PCR方法与流程
本发明属于动物病毒学与动物传染病学技术领域。具体涉及鉴别检测猪腹泻冠状病毒的引物及多重rt-pcr方法,所述的猪腹泻冠状病毒涉及猪流行性腹泻病毒经典毒株与变异毒株、猪δ冠状病毒和猪传染性胃肠炎病毒及其多重rt-pcr引物与检测方法。
背景技术:
猪流行性腹泻病毒(pedv)、猪δ冠状病毒(pdcov)和猪传染性胃肠炎病毒(tgev)均属于尼多病毒目、冠状病毒科,是引起猪腹泻的3种主要病毒。3种病毒感染猪后引起的临床症状和病理变化极为相似,且混合感染现象普遍,临床上难以区分。虽然已有检测这3种病毒的多重rt-pcr方法报道,但2010年以来出现了毒力明显增强的猪流行性腹泻病毒变异毒株的流行,而且临床上猪流行性腹泻病毒经典毒株与变异毒株同时存在,目前还没有能同时区分猪流行性腹泻病毒经典毒株与变异毒株及猪δ冠状病毒和猪传染性胃肠炎病毒的检测方法。
技术实现要素:
本发明的目的就是针对上述现有技术存在的缺陷,提供一种能同时区分猪流行性腹泻病毒经典毒株与变异毒株及猪δ冠状病毒和猪传染性胃肠炎病毒的多重rt-pcr引物及检测方法。
本发明技术方案如下所述:
适用于鉴别检测猪腹泻冠状病毒如猪流行性腹泻病毒经典毒株与变异毒株、猪δ冠状病毒和猪传染性胃肠炎病毒多重rt-pcr检测引物的dna序列如下所示:
(1)猪流行性腹泻病毒经典毒株的引物序列:
上游引物f1:5’-ttgcaagtggcgctgtgatt-3’,
下游引物r1-1:5’-gccgacaacaatatcttttcca-3’;
扩增得到748bp的猪流行性腹泻病毒经典毒株s基因片段;
(2)猪流行性腹泻病毒变异毒株的引物序列:
上游引物f1:5’-ttgcaagtggcgctgtgatt-3’,
下游引物r1-2:5’-gacaccctggttttcaccaa-3’;
扩增得到445bp的猪流行性腹泻病毒变异毒株s基因片段;
(3)猪δ冠状病毒引物序列:
上游引物f2:5’-tactggctgcgttacacc-3’,
下游引物r2:5’-ccgcctgaaagttgctct-3’;
扩增得到622bp的猪δ冠状病毒n基因片段;
(4)猪传染性胃肠炎病毒的引物序列:
上游引物f3:5’-cttggtagtcgtggtgct-3’,
下游引物r3:5’-tatctggtcgccatcttc-3’;
扩增得到528bp的猪传染性胃肠炎病毒n基因片段;
申请人提供了一种利用上述引物检测猪流行性腹泻病毒经典毒株和变异毒株、猪δ冠状病毒、猪传染性胃肠炎病毒的多重rt-pcr方法,所述的多重rt-pcr方法分两步进行,提取病毒rna后,首先按照大连宝生物公司(takara)的反转录试剂盒说明书反转录成cdna,再通过pcr反应对病毒进行检测。反转录和多重pcr反应体系和反应条件如下:
反转录反应体系,在10μl体系中加入以下成份:
反转录的反应条件为:42℃30min,99℃5min,5℃5min。反转录完成后,cdna直接用于pcr扩增或者置于-20℃保存。
多重pcr反应体系,在25μl体系中加入以下成份:
反应条件为:95℃,5min,95℃,30s,54℃,30s,72℃,1min;35个循环,72℃延伸10min。
本发明的检测猪流行性腹泻病毒经典毒株与变异毒株及猪δ冠状病毒和猪传染性胃肠炎病毒的多重rt-pcr引物可用于非诊断目的的检测试剂盒和检测鉴别方法中的应用。
所述的在试剂盒中的应用,是将所述的引物作为核心检测试剂,配合其他常用试剂(按常规方法)可以用于上述猪流行性腹泻病毒经典毒株与变异毒株及猪δ冠状病毒和猪传染性胃肠炎病毒的试剂盒,所述的试剂盒的组装参照常规方法组装和配制。
本发明的有益效果:
本发明提供了同时检测猪流行性腹泻病毒经典毒株与变异毒株及猪δ冠状病毒和猪传染性胃肠炎病毒的多重rt-pcr引物和检测方法,可以通过一次实验同时检测并区分当前严重危害养猪业的猪流行性腹泻病毒经典毒株与变异毒株、猪δ冠状病毒和猪传染性胃肠炎病毒。本发明为这三种主要猪腹泻病毒的鉴别和临床上疾病的诊断提供了新的、快速有效的检测方法,并且可缩短检测时间,降低检测成本。
附图说明
序列表seqidno:1和seqidno:2是扩增猪流行性腹泻病毒(pedv)经典毒株cv777株s基因的引物序列。
序列表seqidno:1和seqidno:3是扩增猪流行性腹泻病毒(pedv)变异毒株aj1102株s基因的引物序列。
序列表seqidno:4和seqidno:5是扩增猪δ冠状病毒(pdcov)chn-hn-2014株n基因的引物序列。
序列表seqidno:6和seqidno:7是扩增猪传染性胃肠炎病毒(tgev)wh-1株n基因的引物序列。
序列表seqidno:8是扩增的猪流行性腹泻病毒(pedv)即pedvcv777株s基因序列。
序列表seqidno:9是扩增的猪流行性腹泻病毒(pedv)即pedvaj1102株s基因序列。
序列表seqidno:10是扩增的猪δ冠状病毒(pdcov)即pdcovchn-hn-2014株n基因序列。
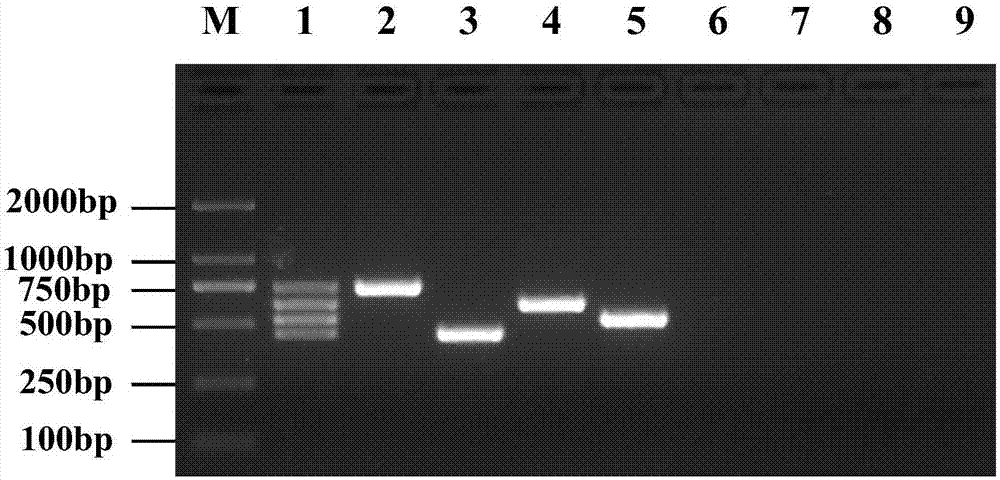
序列表seqidno:11是扩增的猪传染性胃肠炎病毒(tgev)即tgevwh-1株n基因序列。图1:多重rt-pcr电泳图。附图标记说明:m为dl2000dnamarker;1、2为多重rt-pcr;3、4为pedv经典毒株rt-pcr;5、6为pedv变异毒株rt-pcr;7、8为pdcovrt-pcr;9、10为tgevrt-pcr;1、3、5、7、9的模板均为pedvcv777株、pedvaj1102株、pdcovchn-hn-2014株、tgevwh-1株4株病毒的混合rna;2、4、6、8、10的模板均为ddh2o
图2:多重rt-pcr特异性试验结果。附图标记说明:m为dl2000dnamarker;1的模板为pedvcv777株、pedvaj1102株、pdcovchn-hn-2014株、tgevwh-1株4株病毒的混合rna;2的模板为pedvcv777株rna;3的模板为pedvaj1102株rna;4的模板为pdcovchn-hn-2014株rna;5的模板为tgevwh-1株rna;6的模板为prrsvwuh-3株rna;7的模板为porvtm-a株rna;8的模板为csfvc株rna;9的模板为pcv2wh株dna。
图3:pedv-cv777的rt-pcr敏感性试验结果。附图标记说明:m为dl2000dnamarker;1-8的模板依次是病毒稀释倍数为5×、50×、100×、500×、1000×、2000×、5000×、10000×的混合病毒液提取的rna;9为阴性对照
图4:pedv-aj1102的rt-pcr敏感性试验结果。附图标记说明:m为dl2000dnamarker;1-8的模板依次是病毒稀释倍数为5×、50×、100×、500×、1000×、2000×、5000×、10000×的混合病毒液提取的rna;9为阴性对照
图5:pdcov的rt-pcr敏感性试验结果。附图标记说明:m为dl2000dnamarker;1-8的模板依次是病毒稀释倍数为5×、50×、100×、500×、1000×、2000×、5000×、10000×的混合病毒液提取的rna;9为阴性对照
图6:tgev的rt-pcr敏感性试验结果。附图标记说明:m为dl2000dnamarker;1-8的模板依次是病毒稀释倍数为5×、50×、100×、500×、1000×、2000×、5000×、10000×的混合病毒液提取的rna;9为阴性对照。
图7:多重rt-pcr敏感性试验结果。附图标记说明:m为dl2000dnamarker;1-7的模板依次是病毒稀释倍数为5×、50×、100×、500×、1000×、2000×、5000×的混合病毒液提取的rna;8为阴性对照。
具体实施方式
本发明根据genbank登录的(1)猪流行性腹泻病毒(pedv)经典毒株cv777株全基因组序列(登录号为af353511.1)、(2)pedv变异毒株aj1102株全基因组序列(登录号为jx188454.1)、(3)猪δ冠状病毒(pdcov)chn-hn-2014株全基因组序列(登录号为kt336560.1)、(4)猪传染性胃肠炎病毒(tgev)wh-1株全基因组序列(登录号为hq462571.1),通过序列分析获得pedvcv777株s基因、pedvaj1102株s基因、pdcovchn-hn-2014株n基因、tgevwh-1株n基因高度保守的特异性序列,并针对上述序列设计了7条特异性引物,利用设计的特异性引物建立了区分pedv经典毒株和变异毒株、pdcov和tgev的多重rt-pcr检测方法,并对其特异性和敏感性进行分析。
适用于猪流行性腹泻病毒经典毒株和变异毒株、猪δ冠状病毒、猪传染性胃肠炎病毒多重rt-pcr检测引物的dna序列:
其中:
(1)猪流行性腹泻病毒经典毒株的引物序列如下:
上游引物f1:5’-ttgcaagtggcgctgtgatt-3’(对应seqidno:1)
下游引物r1-1:5’-gccgacaacaatatcttttcca-3’(对应seqidno:2)
扩增猪流行性腹泻病毒经典毒株s基因片段,长度为748bp;
(2)猪流行性腹泻病毒变异毒株的引物序列如下:
上游引物f1:5’-ttgcaagtggcgctgtgatt-3’,(对应seqidno:1)
下游引物r1-2:5’-gacaccctggttttcaccaa-3’;(对应seqidno:3)
扩增猪流行性腹泻病毒变异毒株s基因片段,长度为445bp;
(3)猪δ冠状病毒引物序列如下:
上游引物f2:5’-tactggctgcgttacacc-3’,(对应seqidno:4)
下游引物r2:5’-ccgcctgaaagttgctct-3’;(对应seqidno:5)
扩增猪δ冠状病毒n基因片段,长度为622bp;
(4)猪传染性胃肠炎病毒的引物序列如下:
上游引物f3:5’-cttggtagtcgtggtgct-3’,(对应seqidno:6)
下游引物r3:5’-tatctggtcgccatcttc-3’;(对应seqidno:7)
扩增猪传染性胃肠炎病毒n基因片段,长度为528bp。
申请人建立了一种利用上述引物检测所述的猪流行性腹泻病毒经典毒株和变异毒株、猪δ冠状病毒、猪传染性胃肠炎病毒的多重rt-pcr方法,主要步骤为:
提取病毒rna后(按照大连宝生物公司的反转录试剂盒说明书报道的方法操作)通过反转录成cdna,按如下多重rt-pcr反应体系和反应条件对上述三种病毒进行检测,体系如下:
多重rt-pcr反应体系(在25μl体系中加入以下成份):
反应总体积为25μl。
反应条件为:95℃,5min;95℃,30s;54℃,30s;72℃,1min;35个循环;72℃延伸10min。
具体操作如下:
1试验材料
1.1病毒
猪流行性腹泻病毒(pedv)经典毒株cv777株(全基因组序列已提交genbank,登录号为af353511.1)、pedv变异毒株aj1102株(全基因组序列已提交genbank,登录号为jx188454.1)、猪δ冠状病毒(pdcov)chn-hn-2014株(全基因组序列已提交genbank,登录号为kt336560.1)、猪传染性胃肠炎病毒wh-1株(全基因组序列已提交genbank,登录号为hq462571.1)、猪2型圆环病毒(pcv-2)wh株(郭海兵.猪圆环病毒2型灭活疫苗的研究.华中农业大学硕士论文.2009)、猪繁殖与呼吸综合征病毒(prrsv)wuh-3株(李彬.华中地区高致病性猪繁殖与呼吸综合征病毒的分子进化特征研究.华中农业大学博士学位论文.2009)、猪轮状病毒(porv)tm-a株(库旭钢等.猪a群轮状病毒的分离与鉴定.畜牧兽医学报,2012,43(2):275-281)、猪瘟病毒(csfv)c株(全基因组序列已提交genbank,登录号为ay805221.1),由华中农业大学动物医学院预防兽医学实验室保存并供应。vero细胞、st细胞和llc-pk1细胞均购自中国.武汉.武汉大学,中国典型培养物保藏中心。
1.2主要试剂或试剂盒
rnapcrkit(amv)试剂盒、dnamarker和反转录试剂盒购自宝生物工程大连有限公司。琼脂糖凝胶回收试剂盒购自天根生化(北京)科技有限公司、trizol总rna提取试剂盒购自omega公司。
1.3引物的设计及合成
应用primerprimer5.0基因分析软件,参照genbank中登录的pedvcv777株全基因组序列(登录号为af353511.1)、pedvaj1102株全基因组序列(登录号为jx188454.1),pdcovchn-hn-2014株全基因组序列(登录号为kt336560.1)、tgevwh-1株全基因组序列(登录号为hq462571.1),设计7条引物(其中扩增pedv经典毒株s基因和变异毒株s基因的上游引物相同),分别扩增得到pedv经典毒株s基因片段(748bp)、变异毒株s基因片段(445bp)、pdcovn基因片段(622bp)和tgevn基因片段(528bp)。上述引物由武汉擎科生物有限公司合成。用depc水稀释至10μmol/l,于-20℃下保存。
表1多重rt-pcr引物信息
2试验方法
2.1病毒tcid50的测定
2.1.1pedvcv777株tcid50的测定
用dmem细胞生长液(含10%牛血清的dmem培养液,其中dmem培养液购自gibco公司)将pedvcv777株病毒液作连续10倍稀释,取适宜稀释度的病毒悬液接种96孔细胞培养板,每个稀释度接种一纵排共8孔,每孔100μl,再在每孔加入100μl细胞密度为3×105~5×105个/ml的vero细胞悬液(每孔的细胞量为3×104~5×104个);同时设8孔正常细胞对照,正常细胞对照孔每孔先加入100μldmem细胞生长液,再加入100μl细胞密度为3×105~5×105个/ml的细胞悬液。置37℃,5%co2条件下培养观察4日,正常细胞对照孔应不出现细胞病变。按reed-muench法(殷震,刘景华主编.动物病毒学(第二版).北京:科学出版社.1997)计算tcid50。
2.1.2pedvaj1102株tcid50的测定
用含7.5μg/ml胰酶的无血清dmem培养液(购自gibco公司)将pedvaj1102株病毒液作连续10倍稀释,取适宜稀释度的病毒悬液接种预先用无血清dmem培养液洗2次的vero细胞单层,每个稀释度接种一纵排共8孔(96孔细胞培养板),每孔100μl;同时设8孔正常细胞对照,细胞对照孔的细胞单层同样用无血清dmem培养液洗2次,并加入100μl含7.5μg/ml胰酶的无血清dmem培养液。置37℃,5%co2条件下培养观察4日。正常细胞对照孔应不出现细胞病变。按reed-muench法(殷震,刘景华主编.动物病毒学(第二版).北京:科学出版社.1997)计算tcid50。
2.1.3pdcovchn-hn-2014株tcid50的测定
用含7.5μg/ml胰酶的无血清mem培养液(购自gibco公司)将pdcovchn-hn-2014株病毒液作连续10倍稀释,取适宜稀释度的病毒悬液接种预先用无血清mem培养液洗2次的llc-pk1细胞单层,每个稀释度接种一纵排共8孔(96孔细胞培养板),每孔100μl;同时设8孔正常细胞对照,细胞对照孔的细胞单层同样用无血清mem培养液洗2次,并加入100μl含7.5μg/ml胰酶的无血清mem培养液。置37℃,5%co2条件下培养观察4日。正常细胞对照孔应不出现细胞病变。按reed-muench法(殷震,刘景华主编.动物病毒学(第二版).北京:科学出版社.1997)计算tcid50。
2.1.4tgevwh-1株tcid50的测定
用dmem细胞生长液(含10%牛血清的dmem培养液,其中dmem培养液购自gibco公司)将tgevwh-1株病毒液作连续10倍稀释,取适宜稀释度的病毒悬液接种96孔细胞培养板,每个稀释度接种一纵排共8孔,每孔100μl,再在每孔加入100μl细胞密度为3×105~5×105个/ml的st细胞悬液(每孔的细胞量为3×104~5×104个);同时设8孔正常细胞对照,正常细胞对照孔每孔先加入100μldmem细胞生长液,再加入100μl细胞密度为3×105~5×105个/ml的细胞悬液。置37℃,5%co2条件下培养观察4日,正常细胞对照孔应不出现细胞病变。按reed-muench法(殷震,刘景华主编.动物病毒学(第二版).北京:科学出版社.1997)计算tcid50。
2.24株猪腹泻病毒rna的提取与反转录
根据2.1的测定结果用无血清dmem培养液将4株病毒调整为相同浓度的病毒液,再将其等体积混合,利用omega公司的trizol总rna提取试剂盒提取混合病毒液的rna,再利用宝生物工程大连有限公司的反转录试剂盒反转录获得cdna(按照该试剂盒的说明书操作)。
2.3单重rt-pcr反应
4株病毒的单重rt-pcr反应均在25μl体系中进行,包括2×mastermix12.5μl,cdna模板2μl,适量的上、下游引物,其中pedv经典毒株单重rt-pcr反应的上、下游引物体积为0.65μl(浓度为10μmol/l),pedv变异毒株、pdcov和tgev单重rt-pcr反应的上、下游引物的体积均为0.5μl(浓度为10μmol/l),用ddh2o补足至25μl。
pcr反应条件:95℃,5min;94℃,30s;54℃,30s;72℃,45s;共35个循环,72℃延伸10min。将所得的pcr产物用常规的2%琼脂糖凝胶进行电泳检测。
2.4多重rt-pcr反应
通过对多重rt-pcr的退火温度,引物浓度,2×taqmastermix浓度和反应体积的优化,本发明确定了本实施例的多重rt-pcr的反应的总体积为25μl,其中包括2×mastermix12.5μl,涉及pedv经典株的上、下游引物的体积各为0.65μl(浓度为10μmol/l);pedv变异株、pdcov和tgev的上、下游引物的体积均为0.5μl(浓度为10μmol/l)。
反应条件:95℃,5min;95℃,30s;54℃,30s;72℃,1min;共35个循环。72℃延伸10min。取5μlrt-pcr扩增产物于常规的2%琼脂糖凝胶中进行电泳检测。
2.5特异性试验
采用建立的多重rt-pcr方法分别以pedvcv777株、pedvaj1102株、tgevwh-1株、pdcovchn-hn-2014株混合的cdna,pedvcv777株、pedvaj1102株、tgevwh-1株、pdcovchn-hn-2014株、prrsvwuh-3株、porvtm-a株、csfvc株的cdna和pcv-2wh株的dna为模板进行扩增,扩增完成后用2%琼脂糖凝胶进行电泳,验证所建立方法的特异性。
2.6敏感性试验
根据测定的tcid50结果将如上所述的4株病毒调整到相同的tcid50之后进行等量混合,再加入1/4体积的dmem(相当于每种病毒稀释了5倍),混合均匀后再作10×、20×、100×、200×、400×、1000×、2000×稀释,获得8种不同稀释度的病毒混合液,这8种混合液中每种病毒最终的稀释倍数为5×,50×,100×,500×,1000×,2000×,5000×和10000×,利用omega公司出品的trizol总rna提取试剂盒(按该试剂盒说明书操作)提取各稀释度混合病毒液的rna,再利用宝生物工程大连有限公司出品的反转录试剂盒,通过反转录获得cdna(按该试剂盒说明书操作)。按照上述确定的单重rt-pcr和多重rt-pcr的反应条件进行单重和多重rt-pcr扩增,扩增完成后用常规的2%琼脂糖凝胶进行电泳检测。
3试验结果
3.14株猪腹泻病毒tcid50的测定与稀释
待细胞病变稳定后记录病变的孔数,按reed-muench法计算tcid50,结果pedvcv777株tcid50为105.5/100μl,pedvaj1102株tcid50为105.0/100μl,pdcovchn-hn-2014株tcid50为106.5/100μl,tgevwh-1株tcid50为106.0/100μl。按照测定的结果用dmem培养液将pedvcv777株、pdcovchn-hn-2014株和tgevwh-1株的病毒液均稀释为105.0tcid50/100μl。
3.2多重rt-pcr反应
以pedvcv777株、pedvaj1102株、pdcovchn-hn-2014株和tgevwh-1株病毒液混合后提取的rna为模板,进行多重和单重rt-pcr扩增(反应条件同本实施例中2.3和2.4),结果多重rt-pcr扩增出了445bp的pedv变异毒株的s基因片段、748bp的pedv经典毒株的s基因片段、622bp的pdcovn基因片段和528bp的tgevn基因片段。单重rt-pcr也均扩增出相应大小的特异性片段,而阴性对照未出现任何特异性条带(结果见图1)。
3.3特异性试验
以pedvcv777株、pedvaj1102株、tgevwh-1株、pdcovchn-hn-2014株混合的rna为模板及pedvcv777株、pedvaj1102株、tgevwh-1株和pdcovchn-hn-2014株单独的rna分别为模板,经过多重rt-pcr均获得了相应大小的条带,而分别以prrsv、porv、csfv和pcv2的rna或dna为模板,经过多重rt-pcr扩增未出现特异性条带,说明本发明建立的多重rt-pcr的特异性良好(结果见图2)。
3.4单重rt-pcr敏感性试验
以不同稀释度混合病毒液的rna为模板,用建立的单重rt-pcr方法进行扩增,结果对pedv经典毒株、pdcov和tgev的最低检测限均为50tcid50/100μl(结果见图3、图5和图6),对pedv变异毒株的最低检测限为100tcid50/100μl(结果见图4)。
3.5多重rt-pcr敏感性试验
以不同稀释度混合病毒液提取的rna为模板进行多重rt-pcr扩增,结果多重rt-pcr对pedv经典毒株与变异毒株及pdcov和tgev的最低检测限均为100tcid50/100μl(结果见图7)。
本发明的检测猪流行性腹泻病毒经典毒株与变异毒株及猪δ冠状病毒和猪传染性胃肠炎病毒的多重rt-pcr引物可用于非诊断目的的检测试剂盒和检测鉴别方法中的应用。
所述的在试剂盒中的应用,是将所述的引物作为核心检测试剂,配合其他常用试剂(按常规方法)可以用于上述猪流行性腹泻病毒经典毒株与变异毒株及猪δ冠状病毒和猪传染性胃肠炎病毒的试剂盒,所述的试剂盒的组装参照常规方法组装和配制。
序列表
<110>华中农业大学
<120>鉴别检测猪腹泻冠状病毒的引物及多重rt-pcr方法
<141>2017-09-23
<160>11
<170>siposequencelisting1.0
<210>1
<211>20
<212>dna
<213>猪流行性腹泻病毒(pedv)
<220>
<221>primer_bind
<222>(1)..(20)
<400>1
ttgcaagtggcgctgtgatt20
<210>2
<211>22
<212>dna
<213>猪流行性腹泻病毒(pedv)
<220>
<221>primer_bind
<222>(1)..(22)
<400>2
gccgacaacaatatcttttcca22
<210>3
<211>20
<212>dna
<213>猪流行性腹泻病毒(pedv)
<220>
<221>primer_bind
<222>(1)..(20)
<400>3
gacaccctggttttcaccaa20
<210>4
<211>18
<212>dna
<213>猪δ冠状病毒(pdcov)
<220>
<221>primer_bind
<222>(1)..(18)
<400>4
tactggctgcgttacacc18
<210>5
<211>18
<212>dna
<213>猪δ冠状病毒(pdcov)
<220>
<221>primer_bind
<222>(1)..(18)
<400>5
ccgcctgaaagttgctct18
<210>6
<211>18
<212>dna
<213>猪传染性胃肠炎病毒(tgev)
<220>
<221>primer_bind
<222>(1)..(18)
<400>6
cttggtagtcgtggtgct18
<210>7
<211>18
<212>dna
<213>猪传染性胃肠炎病毒(tgev)
<220>
<221>primer_bind
<222>(1)..(18)
<400>7
tatctggtcgccatcttc18
<210>8
<211>748
<212>dna
<213>猪流行性腹泻病毒(pedv)
<220>
<221>gene
<222>(1)..(748)
<400>8
ttgcaagtggcgctgtgattgacggcaacaccatgcatgccaattatatcttctggcgta60
attccacaattatgactatgtcttacaacagtgtgcttgatttaagcaagttcaattgta120
agcataaggctacagttgttgttaatttaaaagactcatccattagtgatgttgtgttag180
gcttgttgaagaatggtaagttgctagtgcgtaataatgacgccatttgtggcttttcta240
atcatttggtcaacgtaaacaaatgaggtctttaatttacttctggttgctcttaccagt300
acttccaacactcagcctaccacaagatgtcactaggtgccagtctactactaactttag360
gcggttcttttcaaaatttaatgttcaggcacctgccgtcgtcgttttgggtggttacct420
acctagtatgaactcttctagctggtactgtggcacaggcattgaaactgctagtggcgt480
tcatggtatttttctcagctacatcgattctggtcagggctttgagattggcatttcgca540
agagccgtttgatcctagtggttaccagctttatttacataaggccactaatggtaacac600
taatgctattgcacgactgcgcatttgccagtttcccgataataaaacattgggccctac660
tgttaatgatgttacaacaggtcgtaactgcctattcaacaaagccattccagcttatat720
gcgtgatggaaaagatattgttgtcggc748
<210>9
<211>445
<212>dna
<213>猪流行性腹泻病毒(pedv)
<220>
<221>gene
<222>(1)..(445)
<400>9
ttgcaagtggcgctgtgattgacggcaacactatgcatgccaattatatcttctggcgta60
attccacaattatgactatgtcttacaatagtgtacttgatttaagcaagttcaattgta120
agcataaggctacagttgttattaatttaaaagattcatccattagtgatgttgtgttag180
gtttgttgaagaatggtaagttgctagtgcgtaataatgacgccatttgtggtttttcta240
atcatttggtcaacgtaaacaaatgaagtctttaacctacttctggttgttcttaccagt300
actttcaacacttagcctaccacaagatgtcaccaggtgctcagctaacactaattttag360
gcggttcttttcaaaatttaatgttcaggcgcctgcagttgttgtactgggcggttatct420
acctattggtgaaaaccagggtgtc445
<210>10
<211>622
<212>dna
<213>猪δ冠状病毒(pdcov)
<220>
<221>gene
<222>(1)..(622)
<400>10
tactggctgcgttacaccagacaaaagccaggtggtactccgattcctccatcctatgcc60
ttttattatactggcacaggtcccagaggaaatcttaagtatggtgaactccctcctaat120
gataccccagcaaccactcgtgttacttgggttaagggttcgggagctgacacttctatt180
aagcctcatgttgccaaacgcaaccccaacaatcctaaacatcagctgctacctctccga240
ttcccaaccggagatggcccagctcaaggtttcagagttgaccccttcaacgctagagga300
agacctcaggagcgtggaagtggcccaagatctcaatctgttaactccagaggcacaggc360
aatcagcccaggaaacgcgaccaatctgcacccgctgcggtacgtcgtaagacccaacat420
caagctcccaagcggactttacctaagggtaaaaccatttctcaggtatttggcaaccgg480
tctcgtactggtgccaatgtcggctctgcagacactgagaagacgggtatggctgatcct540
cgcatcatggctctagccagacatgtgcctggtgttcaggaaatgcttttcgctggccac600
cttgagagcaactttcaggcgg622
<210>11
<211>528
<212>dna
<213>猪传染性胃肠炎病毒(tgev)
<400>11
cttggtagtcgtggtgctaataatgaatccaaagctttgaaattcgatggtaaagtgcca60
ggcgaatttcaacttgaagttaatcaatcaagagacaattcaaggtcacgctctcaatct120
agatctcggtctagaaatagatctcaatctagaggcaggcaacaattcaataacaagaag180
gatgacagtgtagaacaagctgttcttgccgcacttaaaaagttaggtgttgacacagaa240
aaacaacagcaacgctctcgttctaaatctaaagaacgtagtaactctaagacaagagat300
actacacctaagaatgaaaacaaacacacctggaagagaactgcaggtaaaggtgatgtg360
acaagattttatggagctagaagcagttcagccaattttggtgacactgacctcgttgcc420
aatgggagcagtgccaagcattacccacaactggctgaatgtgttccatctgtgtctagc480
attctgtttggaagctattggacttcaaaggaagatggcgaccagata528
- 还没有人留言评论。精彩留言会获得点赞!