一种草鱼垂体细胞体外培养方法与流程
本发明属于生物工程技术领域,具体涉及一种草鱼垂体细胞体外培养方法。
背景技术:
草鱼是我国养殖产量最大的大宗淡水鱼(2015年产量为568万吨),在其养殖过程中面临的一个主要问题是种质资源严重退化,因此草鱼新品种的选育十分迫切。然而由于草鱼性成熟时间较长,雌鱼一般需要4-5年方能达到性成熟,严重制约了其良种选育的进程。因此,揭示调控草鱼性腺发育和性成熟启动的分子机制,在此基础上通过基因编辑技术缩短草鱼性成熟时间,对于加速草鱼育种进程具有重要的意义。与哺乳动物类似,鱼类性成熟启动和生殖能力的获得受“下丘脑-垂体-性腺(hpg)”轴的控制,其中垂体作为该生殖轴的中间环节,起到承上启下的作用。
垂体是机体重要的内分泌腺,由生长激素(gh)细胞、促性腺激素激素(gth)细胞、催乳素(prl)细胞、甲状腺激素(tsh)细胞和促肾上腺皮质激素(acth)细胞等多种激素分泌细胞组成;下丘脑通过调控垂体中的各种激素的释放(生长激素、促性腺激素、泌乳素、甲状腺激素及促肾上腺激素),参与鱼类生长、发育、生殖及渗透压调节等各种生命活动。因此研究鱼类垂体的具体功能,对于揭示鱼类生长和生殖调控机制具有重要的意义。采用体内注射的方法研究垂体功能会受到其他组织的影响,无法直接观察到鱼类垂体的具体功能;而体外细胞培养实验可以很好地解决这个问题,能够检测到下丘脑分泌的神经递质对垂体的直接调控作用。垂体细胞单层培养能够长时间保持细胞的活力和功能,被广泛应用于哺乳动物垂体功能的验证,而在鱼类中的相关研究才刚起步。本发明所采用的草鱼垂体细胞分离和原代培养技术,能够为揭示草鱼垂体在生殖、生长及免疫等方面的功能提供基础。
鱼类细胞培养同哺乳动物细胞培养一样,包括原代培养和传代培养两个阶段。原代培养是指直接从动物的组织器官获得细胞所做的首次培养;传代细胞培养则是对体外生长的细胞进行扩大和继代。一般来说传代培养细胞随着传代次数的增多,会逐渐失去原代培养细胞的生理生化功能特性,而原代培养细胞仍然保留部分甚至全部同在体细胞一样的生理功能特性,细胞仍然保持高度的分化性以及功能性,因此,原代培养细胞被认为可以取代动物活体开展部分生命科学研究。就目前细胞培养的应用现状而言,原代细胞培养所应用的研究领域更为宽广,在某些研究领域如环境毒理学研究、鱼类生理学研究和遗传学研究等方面的作用更是传代培养的细胞所无法代替的。
由于鱼类种类、年龄、不同组织器官的生理结构不同,不同细胞生活的内环境也千差万别,因此对于不同鱼类和同种鱼类不同器官材料的取材方法、培养方式以及培养条件也因细胞而异。在鱼类细胞原代培养中,垂体和脑等神经细胞是比较难培养的种类,因此在鱼类中也鲜有报道。草鱼垂体细胞的体外培养方法,申请人团队在1998年的一篇国外文档中报道过(wong,1998),不过之前的方法是仿照金鱼垂体细胞的分离方法,其培养基的配方也是按照金鱼的特性配制两种培养基,因此细胞产量和细胞活力方面都不是很高。本发明所采用的方法与二十年前的方法相比较,在培养基的配方方面结合草鱼自身的特性进行了进一步的改良,根据分离和培养过程中的不同阶段配置了wm、cm、pm和tm四种不同的培养基;另外,本发明还采用草鱼自身的血清替代胎牛血清,一方面草鱼血清更好保持了草鱼垂体细胞的活力,另一方面也极大降低了细胞培养的成本。最后,本方面对细胞分离和培养方法也进一步进行了改良,使得垂体细胞收获量和活力保持能力进一步得到了提高。
技术实现要素:
本发明的目的在于提供了一种草鱼垂体细胞体外培养方法,方法简单,易行,所得原代细胞性能稳定,非常完好的保存了垂体细胞的分泌功能。
为了达到上述目的,本发明采取以下技术措施:
一种草鱼垂体细胞体外培养方法,包括下述步骤:
(一)草鱼垂体细胞分离
(1)健康新鲜草鱼垂体使用wm培养基清洗后,将垂体切成0.5~0.8mm的小块,wm培养基再次清洗去除血块和杂质;
(2)取50-100mg胰蛋白酶溶解于10mlwm培养基中,将垂体小块置于胰蛋白酶溶液中,20-37℃水浴锅中消解;
(3)吸去含有胰蛋白酶的wm培养基,加入含有2.0-5.0mg/ml胰蛋白酶抑制剂的wm培养基,室温静置中和未去除的胰蛋白酶;
(4)吸去含有胰蛋白酶抑制剂的wm培养基,加入含有0.1-0.5mg/mldnaseii的wm培养基,室温静置以消解细胞间的dna连接;
(5)吸去含有dnaseii的wm培养基,加入含有1.5~3.0mmedta的cm培养基摇晃或是静置后将培养基吸走;
(6)将垂体碎片转移到新的离心管中,向管中加入cm培养基,使用吸管轻轻吹打垂体碎片,细胞被吹散,此时将上层细胞使用40-100μm孔径的细胞筛过滤后收集到离心管中;
(7)对收集的细胞溶液,使用500-2000rpm常温下离心5-20分钟收集细胞;
(8)使用pm培养基对细胞进行重悬并镜检;
(二)草鱼垂体细胞培养
(9)用pm培养基稀释细胞接种至细胞培养板;
优选的,每孔接种2.5×106个垂体细胞;
(10)将接种好的细胞置于细胞培养箱中培养,待细胞贴在细胞培养板底部,向每个孔中加入含有草鱼血清的pm培养基,使每孔中的草鱼血清终浓度为5-10%(体积分数),置于细胞培养箱继续培养。
(11)垂体细胞在含有5-10%草鱼血清的pm培养基中培养贴壁后,将培养基吸去,加入:
a.含有5-15ng/ml碱性成纤维生长因子的nm培养基进行传代培养;或b.加入tm培养基培养后进行后续加药实验。
以上所述方法中,优选的,步骤(11)中,当加入的是含有5-15ng/ml碱性成纤维生长因子的nm培养基进行传代培养时,每三天更换一次培养基;
以上所述的方法中,优选的,步骤(11)中,当加入的是nm培养基培养后继续加药实验时,药物溶于tm培养基后,再与细胞一起孵育。
所述的wm培养基配方包括:
mem:5.0-10.0mg/ml,hepes:5.0-10.0mg/ml,nahco3:2.0-5.0mg/ml,bsa:2.0-5.0mg/ml,青霉素:50-100u/ml,链霉素:50-100μg/ml,其余为双蒸水;
所述的cm培养基配方包括:
m199:5.0-10.0mg/ml,hepes:5.0-10.0mg/ml,nahco3:2.0-5.0mg/ml,青霉素:50-100u/ml,链霉素:50-100μg/ml,其余为双蒸水;
所述的pm培养基配方包括:
mem:5.0-10.0mg/ml,nahco3:2.0-5.0mg/ml,hepes:5.0-10.0mg/ml,青霉素:50-100u/ml,链霉素:50-100μg/ml,其余为双蒸水;
所述的tm培养基配方包括:
mem:5.0-10.0mg/ml,nahco3:2.0-5.0mg/ml,hepes:5.0-10.0mg/ml,bsa:1.0-3.0mg/ml,青霉素:50-100u/ml,链霉素:50-100μg/ml,其余为双蒸水;
所述的nm培养基的配方包括:
mem:10.0-12.0mg/ml,nahco3:2.0-3.0mg/ml,hepes:6.0-8.0mg/ml,青霉素:100-200u/ml,链霉素:100-200μg/ml,glutamaxsupplement:25-50μm,b27supplement(50×):2-5%,fbs:5-10%。
以上所述的培养基,优选的:
所述的wm培养基配方包括:
mem(thermoscientific):9.6mg/ml,hepes:6.0mg/ml,nahco3:2.2mg/ml,bsa:3.0mg/ml,青霉素:50u/ml,链霉素:50μg/ml,其余为双蒸水;
所述的cm培养基配方包括:
m199(thermoscientific):9.6mg/ml,hepes:6.0mg/ml,nahco3:2.2mg/ml,青霉素:50u/ml,链霉素:50μg/ml,其余为双蒸水;
所述的pm培养基配方包括:
mem(thermoscientific):9.6mg/ml,nahco3:2.2mg/ml,hepes:6.0mg/ml,青霉素:100u/ml,链霉素:100μg/ml,其余为双蒸水;
所述的tm培养基配方包括:
mem(thermoscientific):9.6mg/ml,nahco3:2.2mg/ml,hepes:6.0mg/ml,bsa:1.0mg/ml,青霉素:100u/ml,链霉素:100μg/ml,其余为双蒸水;
所述的nm培养基的配方包括:
mem(gibico):9.6mg/ml,nahco3:2.2mg/ml,hepes:6.0mg/ml,青霉素:100u/ml,链霉素:100μg/ml,glutamaxsupplement:25μm,2%b27supplement(50×),5%fbs。
与现有技术相比,本发明具有以下特点:
(1)本发明对草鱼垂体细胞进行了分离和原代培养,所得原代细胞性能稳定,非常完好的保存了垂体细胞的分泌功能,为研究鱼类垂体的功能以及鱼类神经内分泌学提供了很好的体外实验材料;
(2)本发明所配制的四种垂体细胞培养基(wm培养基、cm培养基、pm培养基和tm培养基),均是依据草鱼的垂体细胞特性自己配制;此外,本发明使用草鱼自身分离的血清替代胎牛血清,这些培养基和草鱼血清不仅能够非常好的满足草鱼垂体细胞生长的需要,而且极大降低了成本,这为大规模培养提供了可能。
附图说明
图1垂体细胞在接种3、24和48小时后细胞状态。
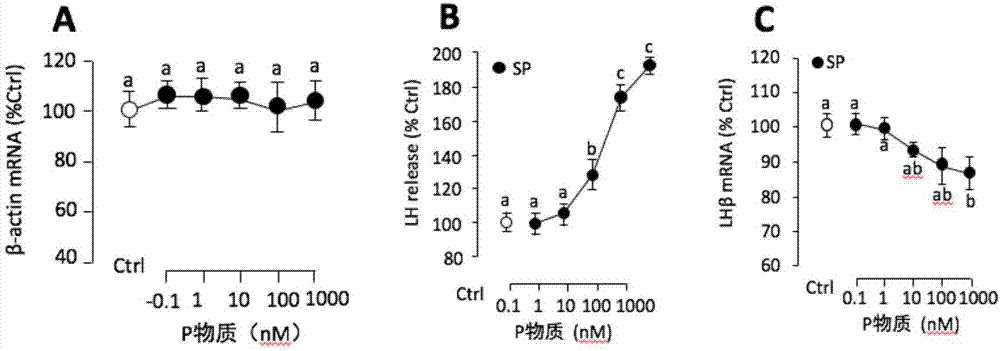
图2为速激肽p物质对草鱼垂体原代培养细胞中lh蛋白分泌和lhβmrna表达量的影响示意图。
图3为草鱼垂体细胞传代后的生长示意图。
具体实施方式
本发明所述技术方案,如未特别说明,均为本领域的常规技术;所述试剂或材料,如未特别说明,均来源于商业渠道。
实施例1:
一种草鱼垂体细胞体外培养方法,包括下述步骤:
(一)草鱼垂体细胞分离
(1)健康新鲜草鱼垂体使用wm培养基清洗后,将垂体切成0.5~0.8mm的小块,wm培养基再次清洗去除血块和杂质;
(2)取65mg胰蛋白酶溶解于10mlwm培养基中,将垂体小块置于胰蛋白酶溶液中,28℃水浴锅中消解30分钟;
(3)吸去含有胰蛋白酶的wm培养基,加入10ml含有2.5mg/ml胰蛋白酶抑制剂的wm培养基,室温静置5分钟中和未去除的胰蛋白酶;
(4)吸去含有胰蛋白酶抑制剂的wm培养基,加入10ml含有0.1mg/mldnaseii的wm培养基,室温静置5分钟,消解细胞间的dna连接;
(5)吸去含有dnaseii的wm培养基,加入10ml含有2mmedta的cm培养基抑制未去除干净的dnaseii,摇晃后立即将培养基吸走;
(6)使用一次性吸管,将垂体碎片转移到15ml离心管中,向管中加入10mlcm培养基,使用无菌一次性吸管轻轻吹打垂体碎片25-30次后,细胞被吹散,此时将上层细胞使用45微米孔径的细胞筛过滤后收集到50ml离心管中;
(7)对收集的细胞溶液,使用1000rpm常温下离心10分钟收集细胞;
(8)使用10mlpm培养基对细胞进行重悬,吸取10微升细胞溶液与90微升台酚蓝溶液混匀染色后,吸取20微升混合液置于细胞计数板上,显微镜下计数细胞总数;
(二)草鱼垂体细胞培养
(9)根据细胞总数再次加入pm培养基,使细胞浓度稀释为3.125×106个/ml;然后将细胞种入24孔细胞培养板,每孔种2.5×106个垂体细胞(0.8ml);
(10)将接种好的细胞置于28℃,5%co2培养箱中培养6小时,待细胞贴在细胞培养板底部,向每个孔中加入200微升含有25%草鱼血清(0.22μm滤膜过滤除菌)的pm培养基,使每孔中的草鱼血清终浓度为5%,置于28℃,5%co2培养箱继续培养。
所述的wm培养基配方包括:
mem(thermoscientific):9.6mg/ml,hepes:6.0mg/ml,nahco3:2.2mg/ml,bsa:3.0mg/ml,青霉素:50u/ml,链霉素:50μg/ml,其余为双蒸水;
所述的cm培养基配方包括:
m199(thermoscientific):9.6mg/ml,hepes:6.0mg/ml,nahco3:2.2mg/ml,青霉素:50u/ml,链霉素:50μg/ml,其余为双蒸水;
所述的pm培养基配方包括:
mem(thermoscientific):9.6mg/ml,nahco3:2.2mg/ml,hepes:6.0mg/ml,青霉素:100u/ml,链霉素:100μg/ml,其余为双蒸水;
所述的tm培养基配方包括:
mem(thermoscientific):9.6mg/ml,nahco3:2.2mg/ml,hepes:6.0mg/ml,bsa:1.0mg/ml,青霉素:100u/ml,链霉素:100μg/ml,其余为双蒸水;
所述的nm培养基的配方包括
mem(gibico):9.6mg/ml,nahco3:2.2mg/ml,hepes:6.0mg/ml,青霉素:100u/ml,链霉素:100μg/ml,glutamaxsupplement:25μm,2%b27supplement(50×),5%fbs。
实施例2:
细胞培养情况:
实施例1中刚接种的细胞(即添加了含有草鱼血清pm培养基后3h时)呈现出一个一个分离的状态(图1中a);经过24小时的培养后,垂体细胞开始长出突触(图1中b);而48小时培养后垂体细胞之间通过突触相互连接在一起(图1中c),呈现出“手牵手”状态;这种细胞状态表明垂体生长良好。
实施例3:
细胞活性验证:
本实施例通过检测速激肽p物质对草鱼垂体中促性腺激素lh的直接调控作用来验证实施例1所述方法培养的细胞的活性
实施例1的细胞继续培养24小时后,将含有5%草鱼血清的pm培养基吸走;换上含有一定浓度p物质(浓度分别为0.1nm,1nm,10nm,100nm,1000nm)的tm培养基继续孵育细胞24小时后,分别收集上层细胞养培基和底层细胞;
利用elisa试剂盒检测培养基中lh的蛋白分泌量,并利用定量pcr检测lhβmrna表达量;通过检测分析发现各组间内参基因β-actin的表达量并没有显著性差异(图2中a),表明细胞培养体系比较稳定,可以满足药物处理的实验。此外,p物质能够诱导垂体细胞中lh分泌(图2中b)和lhβ(图2中c)mrna表达量,并且每组四个重复之间的标准差均控制在10%以内,上述结果表明培养的垂体细胞保持了很好的活力,此外每个孔的细胞生长比较均匀,适合作为研究垂体的细胞模型。
实施例4:
草鱼垂体细胞的传代培养:
实施例1的步骤(10),垂体细胞在含有5%草鱼血清的pm培养基中培养24小时后,将培养基吸去,加入含有5ng/ml碱性成纤维生长因子的nm培养基继续培养,每3天更换一次培养基。
草鱼垂体细胞在含有5ng/ml碱性成纤维生长因子的nm培养基中培养两周后,使用0.25%trypsin消化细胞并以1000rpm转速离心10分钟收集细胞;nm培养基重悬细胞后,取三分之一的细胞转移至新的细胞培养瓶中,加入含有5ng/ml碱性成纤维生长因子的nm培养基继续培养,待细胞长满培养瓶后,进行第二次传代;按照上述方式,细胞传至第五代时,其生长与原代无显著差异(图3)。
- 还没有人留言评论。精彩留言会获得点赞!