使用胎盘干细胞的血管生成的制作方法
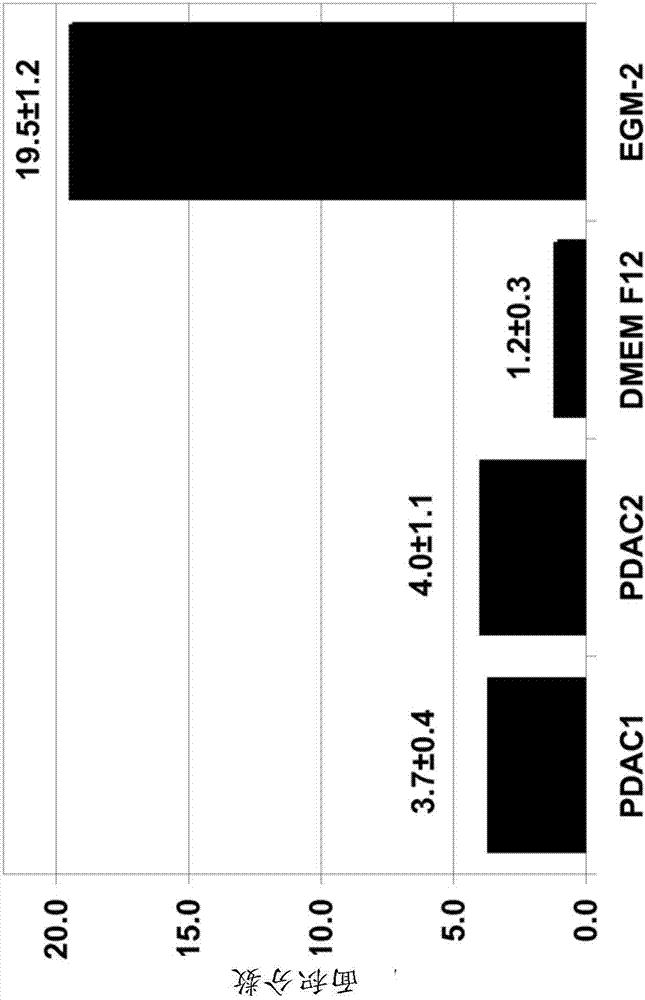
本申请是申请日为2011年4月6日,申请号为201180028088.2,名称为“使用胎盘干细胞的血管生成”的中国发明专利申请的分案申请。本申请要求于2010年4月7日提交的美国专利申请第61/321,822号的优先权,其在此通过全文引用并入本发明。1.
技术领域:
本文提供了利用组织培养贴壁胎盘细胞(例如,胎盘干细胞,本文称为pdac)促进血管生成和治疗循环系统疾病或病症(例如,与血管化或血流不足有关或由它们所引起的疾病或病症,或者通过改善血管生成可治疗的疾病或病症)的方法。2.
背景技术:
:胎盘是一种特别有吸引力的干细胞来源。由于哺乳动物胎盘丰富并且通常作为医学废物被丢弃,因此它们是医学上有用的干细胞的独特来源。本文提供了这类分离的胎盘干细胞、胎盘干细胞群体以及利用它们促进血管生成和治疗循环系统疾病或病症(例如,通过促进血管生成可治疗的疾病或病症)的方法。3.技术实现要素:在一个方面,本文提供了患有循环系统疾病或病症的个体中的治疗,其包括以足以可检测地改善所述疾病或病症的一种或多种症状的量和时间向所述个体施用治疗有效量的组织培养贴壁胎盘细胞(例如,胎盘干细胞,本文中还称为pdac(胎盘源贴壁细胞,例如,以下5.2节中所述的胎盘源贴壁细胞))。然而,本文所述的pdac不是2009年11月19日提交的标题为“羊膜源血管生成细胞(amnionderivedangiogeniccells)”的未决美国专利申请no.12/622352中所述的羊膜源贴壁细胞,该专利公开以其全部内容作为参考并入本文。在某些实施方式中,所述方法包括以与施用所述pdac之前的所述个体相比,可检测地改善一种或多种心脏功能的指标的量和时间向所述个体施用pdac,其中所述心脏功能的指标为心输出量(co)、心脏指数(ci)、肺动脉楔压(pawp)、心脏指数(ci)、缩短率%(%fs)、射血分数(ef)、左心室射血分数(lvef);左心室舒张末期直径(lvedd)、左心室收缩末期直径(lvesd)、收缩性(dp/dt)、心房或心室功能降低、泵血效率提高、泵血效率损失率降低、血液动力学功能损失降低或与心肌病有关的并发症减少。在其他实施方式中,所述循环系统的疾病或病症是心肌梗塞。在另一种实施方式中,所述疾病或病症是心肌病。在其他实施方式中,所述疾病或病症是动脉瘤、绞痛、主动脉瓣狭窄、主动脉炎、心律不齐、动脉硬化、动脉炎、非对称性间隔肥厚(ash)、动脉粥样硬化、心房颤动和扑动、细菌性心内膜炎、巴洛氏综合征(二尖瓣脱垂)、心搏徐缓、伯格氏病(闭塞性血栓血管炎)、心肥大、心脏炎、颈动脉病、主动脉缩窄、先天性心脏缺损、充血性心力衰竭、冠状动脉病、艾森门格综合征、栓塞、心内膜炎、红斑性肢痛病、原纤化、纤维肌性发育异常、心传导阻滞、心杂音、高血压、低血压、小儿先天性动脉钙化、川崎氏病(皮肤粘膜淋巴结综合征、皮肤粘膜淋巴结病、婴儿多动脉炎)、代谢综合征、微血管性心绞痛、心肌炎、阵发性房性心动过速(pat)、结节性动脉周围炎(多动脉炎、多发性结节性动脉炎)、心包炎、周围性血管疾病、严重肢体缺血、静脉炎、肺动脉瓣狭窄(肺动脉狭窄)、雷诺氏病、肾动脉狭窄、肾血管性高血压、风湿性心脏病、糖尿病血管病变、间隔缺损、隐匿性局部缺血、x综合征、心动过速、大动脉炎、紫绀四联症、大血管移位、三尖瓣闭锁、动脉干、瓣膜性心脏病、静脉曲张性溃疡、静脉曲张、血管炎、室中隔缺损、预激综合征、心内膜垫缺损、急性风湿热、急性风湿性心包炎、急性风湿性心内膜炎、急性风湿性心肌炎、慢性风湿病心脏病、二尖瓣病、二尖瓣狭窄、风湿性二尖瓣关闭不全、主动脉瓣疾病、其他心内结构疾病、缺血性心脏病(急性和亚急性)、心绞痛、急性肺心病、肺栓塞、慢性肺原性心脏病、脊柱后侧凸性心脏病、心肌炎、心内膜炎、心内膜心肌纤维化、心内膜弹力纤维增生症、房室传导阻滞、心脏节律障碍、心肌变性、脑血管疾病、动脉、小动脉和毛细血管疾病或静脉和淋巴管疾病。在其他具体的实施方式中,所述疾病或病症是大脑前动脉阻塞和狭窄或脑动脉阻塞。在一个方面,本文提供了对患有个体脑中或周围血液流动破坏的个体(例如,患有由于个体脑或中枢神经系统(cns)中或周围的血液流动破坏而造成的症状或神经功能缺损的个体)进行治疗的方法,其包括向所述个体施用治疗有效量的分离的胎盘细胞(例如,pdac)。在某些实施方式中,血液流动破坏导致个体脑或cns的缺氧损伤(anoxicinjury)或低氧损伤(hypoxicinjury)。在其他具体的实施方式中,所述疾病或病症是周围动脉阻塞和狭窄。在一个方面,本文提供了对患有四肢中或周围血液流动破坏的个体(例如,患有由于个体周围血管系统中或周围的血液流动破坏而造成的症状或血管缺损的个体)进行治疗的方法,包括向所述个体施用治疗有效量的分离的pdac。在某些实施方式中,血液流动破坏导致个体四肢和/或肢的缺氧损伤或低氧损伤。在所述治疗方法的另一种具体实施方式中,通过注射将所述细胞施用给所述个体。在更具体的实施方式中,所述注射是注射到所述个体心脏的缺血性区域中。在所述治疗方法的另一种具体实施方式中,通过静脉内输注将所述细胞施用给所述个体。在所述治疗方法的另一种具体实施方式中,通过在所述个体中植入包含如上所述的胎盘源贴壁细胞的基质或支架将所述细胞,或所述细胞群体,或包含所述细胞的细胞群体施用到所述个体。在某些实施方式中,将所述胎盘细胞静脉内施用于所述个体。在其他实施方式中,所述治疗方法包括向所述个体施用至少约1×107、5×107、1×108、5×108、1×109、5×109或1×1010个胎盘细胞。在另一种具体的实施方式中,本文所述的胎盘细胞在体外增殖不超过2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49或50次群体倍增。在另一种具体的实施方式中,本文所述的任何胎盘细胞来自传代至少1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20次或更多次的所述细胞的培养。在本文任何实施方式的另一种实施方式中,在所述施用之前已将所述胎盘细胞冷冻保存并解冻。在其他实施方式中,在所述接触之前已将所述胎盘细胞冷冻保存并解冻。在任何上述方法的某些实施方式中,所述胎盘细胞附着于组织培养塑料并且是如通过流式细胞术所检测的cd34-、cd10+、cd105+和cd200+。在某些实施方式中,所述胎盘细胞具有分化为成骨或软骨形成细胞的能力。在另一种实施方式中,所述胎盘细胞附着于组织培养塑料;为如通过流式细胞术所检测的cd34-、cd10+、cd105+和cd200+;和具有分化为具有成骨或软骨形成细胞的一种或多种特征(例如,骨细胞或软骨细胞的特征)的细胞的能力。在其他实施方式中,所述胎盘细胞还具有分化为具有神经细胞或神经源性细胞的一种或多种特征(例如,神经元的特征);胶质细胞的一种或多种特征(例如,神经胶质或星形细胞的特征);成脂细胞的一种或多种特征(例如,脂肪细胞的特征);胰腺细胞的一种或多种特征;和/或心肌细胞的一种或多种特征的细胞的能力。在另一种实施方式中,所述胎盘细胞是cd34-、cd10+、cd105+和cd200+,以及cd38-、cd45-、cd80-、cd86-、cd133-、hla-dr,dp,dq-、ssea3-、ssea4-、cd29+、cd44+、cd73+、cd90+、cd105+、hla-a,b,c+、pdl1+、abc-p+和/或oct-4+中的一种或多种,如通过流式细胞术和/或rt-pcr所检测的。在另一种实施方式中,所述胎盘细胞是cd34-、cd45-、cd10+、cd90+、cd105+和cd200+,如通过流式细胞术所检测的。在另一种实施方式中,所述胎盘细胞是cd34-、cd45-、cd10+、cd80-、cd86-、cd90+、cd105+和cd200+,如通过流式细胞术所检测的。在另一种实施方式中,所述胎盘细胞是cd34-、cd45-、cd10+、cd80-、cd86-、cd90+、cd105+和cd200+,并且另外是cd29+、cd38-、cd44+、cd54+、sh3+或sh4+中的一种或多种,如通过流式细胞术所检测的。在另一种实施方式中,所述胎盘细胞是cd34-、cd38-、cd45-、cd10+、cd29+、cd44+、cd54+、cd73+、cd80-、cd86-、cd90+、cd105+和cd200+,如通过流式细胞术所检测的。在另一种实施方式中,所述cd34-、cd10+、cd105+和cd200+胎盘细胞另外是cd117-、cd133-、kdr-(vegfr2-)、hla-a,b,c+、hla-dp,dq,dr-或编程死亡-1配体(pdl1)+中的一种或多种,或它们的任意组合。在另一种具体的实施方式中,所述胎盘细胞是cd34-、cd38-、cd45-、cd10+、cd29+、cd44+、cd54+、cd73+、cd80-、cd86-、cd90+、cd105+、cd117-、cd133-、cd200+、kdr-(vegfr2-)、hla-a,b,c+、hla-dp,dq,dr-或编程死亡-1配体(pdl1)+,如通过流式细胞术所检测的。在另一种实施方式中,本文所述的任何胎盘细胞另外是abc-p+,如通过流式细胞术所检测的,或oct-4+(pou5f1+),例如,如通过rt-pcr所确定的,其中abc-p是胎盘特异性abc转运蛋白(也称为乳腺癌耐药蛋白(bcrp)和耐米托蒽醌蛋白(mxr))。在另一种实施方式中,本文所述的任何胎盘细胞另外地是ssea3-或ssea4-的,例如,如通过流式细胞术确定的,其中ssea3是阶段特异性胚胎抗原3,而ssea4是阶段特异性胚胎抗原4。在另一种实施方式中,本文所述的任何胎盘细胞另外是ssea3-和ssea4-。在本文所述方法的另一种实施方式中,本文所述的任何胎盘细胞另外是mhc-i+(例如,hla-a,b,c+)、mhc-ii-(例如,hla-dp,dq,dr-)或hla-g-中的一种或多种。在另一种实施方式中,本文所述的任何胎盘细胞另外是mhc-i+(例如,hla-a,b,c+)、mhc-ii-(例如,hla-dp,dq,dr-)和hla-g-中的每一个。在另一种实施方式中,所述cd34-、cd10+、cd105+、cd200+细胞另外是cd29+、cd38-、cd44+、cd54+、cd80-、cd86-、sh3+或sh4+中的一种或多种。在另一种实施方式中,所述细胞另外是cd44+。在另一种实施方式中,所述cd34-、cd10+、cd105+、cd200+胎盘细胞另外是cd13+、cd29+、cd33+、cd38-、cd44+、cd45-、cd54+、cd62e-、cd62l-、cd62p-、sh3+(cd73+)、sh4+(cd73+)、cd80-、cd86-、cd90+、sh2+(cd105+)、cd106/vcam+、cd117-、cd144/ve-钙粘素low、cd184/cxcr4-、cd133-、oct-4+、ssea3-、ssea4-、abc-p+、kdr-(vegfr2-)、hla-a,b,c+、hla-dp,dq,dr-、hla-g-或编程死亡-1配体(pdl1)+中的一种或多种,或者它们的任意组合。在另一种实施方式中,所述cd34-、cd10+、cd105+、cd200+胎盘细胞另外是cd13+、cd29+、cd33+、cd38-、cd44+、cd45-、cd54/icam+、cd62e-、cd62l-、cd62p-、sh3+(cd73+)、sh4+(cd73+)、cd80-、cd86-、cd90+、sh2+(cd105+)、cd106/vcam+、cd117-、cd144/ve-钙粘素dim、cd184/cxcr4-、cd133-、oct-4+、ssea3-、ssea4-、abc-p+、kdr-(vegfr2-)、hla-a,b,c+、hla-dp,dq,dr-、hla-g-和编程死亡-1配体(pdl1)+。在本文所公开的方法的其他实施方式中,所述分离的胎盘细胞是cd200+和hla-g-;cd73+、cd105+和cd200+;cd200+和oct-4+;cd73+、cd105+和hla-g-;cd73+和cd105+;或oct-4+;或者它们的任意组合。在本文所公开的方法的某些实施方式中,所述分离的胎盘细胞是cd10+、cd29+、cd34-、cd38-、cd44+、cd45-、cd54+、cd90+、sh2+、sh3+、sh4+、ssea3-、ssea4-、oct-4+、mhc-i+或abc-p+中的一种或多种,其中abc-p是胎盘特异性abc转运蛋白(也称为乳腺癌耐药蛋白(bcrp)和耐米托蒽醌蛋白(mxr))。在另一种实施方式中,所述分离的胎盘细胞是cd10+、cd29+、cd34-、cd38-、cd44+、cd45-、cd54+、cd90+、sh2+、sh3+、sh4+、ssea3-、ssea4-和oct-4+。在另一种实施方式中,所述分离的胎盘细胞是cd10+、cd29+、cd34-、cd38-、cd45-、cd54+、sh2+、sh3+和sh4+。在另一种实施方式中,所述分离的胎盘细胞是cd10+、cd29+、cd34-、cd38-、cd45-、cd54+、sh2+、sh3+、sh4+和oct-4+。在另一种实施方式中,所述分离的胎盘细胞是cd10+、cd29+、cd34-、cd38-、cd44+、cd45-、cd54+、cd90+、mhc-1+、sh2+、sh3+、sh4+。在另一种实施方式中,所述分离的胎盘细胞是oct-4+和abc-p+。在另一种实施方式中,所述分离的胎盘细胞是sh2+、sh3+、sh4+和oct-4+。在另一种实施方式中,所述分离的胎盘细胞是oct-4+、cd34-、ssea3-和ssea4-。在具体的实施方式中,所述oct-4+、cd34-、ssea3-和ssea4-细胞另外是cd10+、cd29+、cd34-、cd44+、cd45-、cd54+、cd90+、sh2+、sh3+和sh4+。在另一种实施方式中,所述分离的胎盘细胞是oct-4+和cd34-,以及sh3+或sh4+中的任一个。在另一种实施方式中,所述分离的胎盘细胞是cd34-,以及cd10+、cd29+、cd44+、cd54+、cd90+或oct-4+中的任一个。在某些实施方式中,所述分离的胎盘细胞是cd10+、cd34-、cd105+和cd200+。在另一种实施方式中,在本文所述的方法中有用的所述分离的胎盘细胞是cd10+、cd29+、cd44+、cd45-、cd54/icam-、cd62-e-、cd62-l-、cd62-p-、cd80-、cd86-、cd103-、cd104-、cd105+、cd106/vcam+、cd144/ve-钙粘素dim、cd184/cxcr4-、β2-微球蛋白dim、mhc-idim、mhc-ii-、hla-gdim和/或pdl1dim中的一个或多个。在某些实施方式中,这类胎盘细胞至少为cd29-和cd54-。在另一种实施方式中,这类分离的胎盘细胞至少为cd44+和cd106+。在另一种实施方式中,这类分离的胎盘细胞至少为cd29+。在任何上述特征的某些实施方式中,通过流式细胞术确定了细胞标志物的表达(例如,分化或免疫原性标志物簇)。在某些其他实施方式中,通过rt-pcr确定了细胞标志物的表达。在另一种实施方式中,在本文所公开的方法中有用的所述胎盘细胞,例如,所述cd10+、cd34-、cd105+、cd200+细胞以比相等数目的骨髓源间质干细胞可检测地更高的水平表达一种或多种基因,其中所述一种或多种基因是以下一种或多种:actg2、adarb1、amigo2、arts-1、b4galt6、bche、c11orf9、cd200、col4a1、col4a2、cpa4、dmd、dsc3、dsg2、elovl2、f2rl1、flj10781、gata6、gpr126、gprc5b、icam1、ier3、igfbp7、il1a、il6、il18、krt18、krt8、lipg、lrap、matn2、mest、nfe2l3、nuak1、pcdh7、pdlim3、pkp2、rtn1、serpinb9、st3gal6、st6galnac5、slc12a8、tcf21、tgfb2、vtn和zc3h12a,并且其中所述骨髓源间质干细胞在培养中已经历了与所述分离的胎盘细胞所经历的传代次数相等的传代次数。在某些实施方式中,通过(例如)rt-pcr或微阵列分析(例如,使用u133-a微阵列(affymetrix))确定了所述一种或多种基因的所述表达。在另一种实施方式中,当在包含60%dmem-lg(例如,获自gibco)和40%mcdb-201(例如,获自sigma);2%胎牛血清(例如,获自hyclonelabs);1×胰岛素-转铁蛋白-硒(its);1×亚油酸-牛血清白蛋白(la-bsa);10-9m地塞米松(例如,获自sigma);10-4m抗坏血酸2-磷酸酯(例如,获自sigma);表皮生长因子10ng/ml(例如,获自r&dsystems);和血小板源生长因子(pdgf-bb)10ng/ml(例如,获自r&dsystems)的培养基中培养(例如)约3次至约35次之间任何次数的群体倍增时,所述分离的胎盘细胞表达所述一个或多个基因。在另一种实施方式中,当在包含60%dmem-lg(例如,获自gibco)和40%mcdb-201(例如,获自sigma);2%胎牛血清(例如,获自hyclonelabs);1×胰岛素-转铁蛋白-硒(its);1×亚油酸-牛血清白蛋白(la-bsa);10-9m地塞米松(例如,获自sigma);10-4m抗坏血酸2-磷酸酯(例如,获自sigma);表皮生长因子10ng/ml(例如,获自r&dsystems);和血小板源生长因子(pdgf-bb)10ng/ml(例如,获自r&dsystems)的培养基中培养(例如)约3次至约35次群体倍增时,所述分离的胎盘细胞表达所述一个或多个基因。在某些实施方式中,所述胎盘细胞以比相等数目的骨髓源间质干细胞(bm-msc)可检测更高的水平表达cd200和arts1(1型肿瘤坏死因子氨肽酶调控因子);arts-1和lrap(白血球源性精氨酸氨肽酶);il6(白细胞介素-6)和tgfb2(转化生长因子,β2);il6和krt18(角蛋白18);ier3(即刻早期反应蛋白3)、mest(中胚层特异性转录本同源物)和tgfb2;cd200和ier3;cd200和il6;cd200和krt18;cd200和lrap;cd200和mest;cd200和nfe2l3(核因子(网织红细胞源性2)-样3);或者cd200和tgfb2,其中所述骨髓源间质干细胞在培养中已经历了与所述分离的胎盘细胞所经历的传代次数相等的传代次数。在其他实施方式中,所述胎盘细胞以比相等数目的骨髓源间质干细胞bm-msc可检测地更高的水平表达arts-1、cd200、il6和lrap;arts-1、il6、tgfb2、ier3、krt18和mest;cd200、ier3、il6、krt18、lrap、mest、nfe2l3和tgfb2;arts-1、cd200、ier3、il6、krt18、lrap、mest、nfe2l3和tgfb2;或者ier3、mest和tgfb2,其中所述骨髓源间质干细胞在培养中已经历了与所述分离的胎盘细胞所经历的传代次数相等的传代次数。当使用人细胞时,全部基因标记是指人序列,并且如本领域技术人员所熟知的,可以在文献中或在genbank中查找到代表性序列。可以通过公开可用的序列或通过商业来源确定针对序列的探针,所述商业来源例如特异性探针或血管生成阵列(appliedbiosystems,部件号no.4378710)。在多种实施方式中,在本文所公开的方法中有用的所述分离的胎盘细胞(例如,胎盘干细胞或胎盘多能细胞)包含在细胞群体中,其中至少10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、98%或99%的所述细胞是所述分离的胎盘细胞。在某些其他实施方式中,所述细胞群体中的所述胎盘细胞基本不含具有母体基因型的细胞;例如,所述群体中至少40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、98%或99%的胎盘细胞具有胎儿基因型,即,是胎儿来源的。在某些其他实施方式中,包含所述胎盘细胞的细胞群体基本不含具有母体基因型的细胞;例如,所述群体中至少40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、98%或99%的细胞具有胎儿基因型,即,是胎儿来源的。在某些其他实施方式中,包含所述胎盘细胞的细胞群体包含具有母体基因型的细胞;例如,所述群体中至少10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、98%或99%的细胞具有母体基因型,即,是母体来源的。在本文中胎盘细胞(例如,pdac)的任何实施方式的实施方式中,当胎盘细胞群体在允许胚状体样体(embryoid-likebody)形成的条件下培养(例如,在增殖条件下培养)时,胎盘细胞有利于包含所述分离的胎盘细胞的胎盘细胞群体中一个或多个胚状体样体的形成。在某些实施方式中,在暴露于1至100ng/mlvegf4至21天后,在本文所提供的方法中有用的所述胎盘细胞(例如,pdac)不表达cd34,如通过免疫定位所检测的。在具体的实施方式中,所述胎盘贴壁细胞附着于组织培养塑料。在另一种具体的实施方式中,当在存在血管生成因子(如血管内皮生长因子(vegf)、上皮生长因子(egf)、血小板源生长因子(pdgf)或碱性成纤维细胞生长因子(bfgf))的情况下在(例如)如matrigeltm的基质上培养时,所述细胞群体形成芽或管样结构。在另一个方面,本文所提供的pdac,细胞群体,例如,pdac群体或其中所述分离的细胞群体中至少约50%、60%、70%、80%、90%、95%或98%的细胞是pdac的细胞群体将vegf、hgf、il-8、mcp-3、fgf2、卵泡抑素、g-csf、egf、ena-78、gro、il-6、mcp-1、pdgf-bb、timp-2、upar或半乳凝素-1中的一种或多种或全部分泌到(例如)其中细胞生长的培养基中。在另一种实施方式中,与含氧量正常的情况(例如,约20%或约21%的o2)相比,pdac在含氧量低的情况(例如,小于约5%的o2)下表达较高水平的cd202b、il-8和/或vegf。在另一种实施方式中,本文所述的任何pdac或包含pdac的细胞群体可以导致在与所述胎盘源贴壁细胞接触的内皮细胞群体中形成芽或管样结构。在具体的实施方式中,例如,当在存在细胞外基质蛋白(如i型和iv型胶原)和/或血管生成因子(如血管内皮生长因子(vegf)、上皮生长因子(egf)、血小板源生长因子(pdgf)或碱性成纤维细胞生长因子(bfgf))的情况下在(例如)如胎盘胶原或matrigeltm的基质中或上培养至少4天时,所述胎盘源血管生成细胞与人内皮细胞共培养,从而形成芽或管样结构或支持内皮细胞出芽。在本文所公开的任何胎盘细胞的某些实施方式中,所述细胞是人细胞。在某些实施方式中,任何胎盘细胞,例如,本文所述的胎盘干细胞或胎盘多能细胞对受体是自体同源的。在某些其他实施方式中,任何胎盘细胞,例如,本文所述的胎盘干细胞或胎盘多能细胞对受体是异源的。在某些实施方式中,在所述施用之前将所述胎盘细胞冷冻保存。在另一种实施方式中,所述分离的胎盘细胞得自胎盘细胞库(例如,pdac库)。在分离的胎盘细胞的任何上述实施方式中,所述分离的胎盘细胞在生长培养基(即配制以促进(例如)在生长培养基中增殖期间增殖的培养基)中培养期间一般不分化。在另一种实施方式中,所述分离的胎盘细胞不需要饲养层来增殖。在另一种实施方式中,仅由于在不存在饲养细胞层的情况下培养,因此所述分离的胎盘细胞在培养时不分化。在某些实施方式中,通过已排去血液并灌注以除去残余血液;已排去血液但未灌注以除去残余血液;或既未排去血液又未灌注以除去残余血液的产后胎盘的灌注来获得所述分离的胎盘细胞。在另一种具体的实施方式中,通过胎盘组织的物理和/或酶促破坏来获得所述分离的胎盘细胞。在本文所提供的方法中有用的胎盘细胞的细胞表面、分子和遗传标志物将在以下5.2节中详细说明。在如上所述的方法的另一种具体实施方式中,通过推注来施用所述分离的胎盘细胞。在另一种具体的实施方式中,通过静脉内输注施用所述分离的胎盘细胞。在具体的实施方式中,所述静脉内输注是约1至约8小时内的静脉内输注。在另一种具体的实施方式中,颅内施用所述分离的胎盘细胞。在另一种具体的实施方式中,腹膜内施用所述分离的胎盘细胞。在另一种具体的实施方式中,动脉内施用所述分离的胎盘细胞。在所述治疗方法的另一种具体的实施方式中,肌内、皮内、皮下、鞘内或眼内施用所述分离的胎盘细胞。在如上所述方法的另一种实施方式中,通过将包含所述分离的胎盘细胞的物质组合物手术植入到所述个体中来施用所述分离的胎盘细胞。在具体的实施方式中,所述物质组合物是基质或支架。在另一种具体的实施方式中,所述基块或支架是水凝胶。在另一种具体的实施方式中,所述基块或支架是脱细胞化组织。在另一种具体的实施方式中,所述基质或支架是合成生物可降解组合物。在另一种具体的实施方式中,所述基质或支架是泡沫。在如上所述的方法的另一种具体实施方式中,将所述分离的胎盘细胞一次施用至所述个体。在另一种具体的实施方式中,以两次或多次单独的施用将所述分离的胎盘细胞施用至所述个体。在另一种具体的实施方式中,所述施用包括施用约1×104至1×105个分离的胎盘细胞(例如,每千克所述个体)。在另一种具体的实施方式中,所述施用包括施用约1×105至1×106个分离的胎盘细胞/千克所述个体。在另一种具体的实施方式中,所述施用包括施用约1×106至1×107个分离的胎盘细胞/千克所述个体。在另一种具体的实施方式中,所述施用包括施用约1×107至1×108个分离的胎盘细胞/千克所述个体。在其他具体的实施方式中,所述施用包含施用约1×106至约2×106个分离的胎盘细胞/千克所述个体;约2×106至约3×106个分离的胎盘细胞/千克所述个体;约3×106至约4×106个分离的胎盘细胞/千克所述个体;约4×106至约5×106个分离的胎盘细胞/千克所述个体;约5×106至约6×106个分离的胎盘细胞/千克所述个体;约6×106至约7×106个分离的胎盘细胞/千克所述个体;约7×106至约8×106个分离的胎盘细胞/千克所述个体;约8×106至约9×106个分离的胎盘细胞/千克所述个体;或约9×106至约1×107个分离的胎盘细胞/千克所述个体。在另一种具体的实施方式中,所述施用包括施用约1×107至约2×107个分离的胎盘细胞/千克所述个体至所述个体。在另一种具体的实施方式中,所述施用包括施用约1.3×107至约1.5×107个分离的胎盘细胞/千克所述个体至所述个体。在另一种具体的实施方式中,所述施用包括施用多至约3×107个分离的胎盘细胞/千克所述个体至所述个体。在具体的实施方式中,所述施用包括施用约5×106至约2×107个分离的胎盘细胞至所述个体。在另一种具体的实施方式中,所述施用包括以约20毫升溶液将约150×106个分离的胎盘细胞施用至所述个体。在具体的实施方式中,所述施用包括施用约5×106至约2×107个分离的胎盘细胞至所述个体,其中所述细胞包含在含有10%葡聚糖(例如,葡聚糖-40)、5%人血清白蛋白和可选地免疫抑制剂的溶液中。在另一种具体的实施方式中,所述施用包括静脉内施用约5×107至3×109个分离的胎盘细胞。在具体的实施方式中,所述施用包括静脉内施用约9×108个分离的胎盘细胞或约1.8×109个分离的胎盘细胞。在另一种具体的实施方式中,所述施用包括病灶内施用约5×107至1×108个分离的胎盘细胞。在另一种具体的实施方式中,所述施用包括病灶内施用约9×107个分离的胎盘细胞。在某些实施方式中,在本文所提供的方法中使用的胎盘细胞可以是基因工程的以产生有利于血管生成的一种或多种蛋白质。在某些实施方式中,有利于血管生成的所述蛋白质是肝细胞生长因子(hgf)、血管内皮生长因子(vegf)(例如,vegfd)、成纤维细胞生长因子(fgf)(例如,fgf2)、血管生成素(ang)、表皮生长因子(egf)、上皮中性粒细胞激活蛋白78(ena-78)、卵泡抑素、粒性白细胞集落刺激因子(g-csf)、生长调节致癌基因蛋白(gro)、白细胞介素-6(il-6)、il-8、致轻素、单核细胞趋化蛋白-1(mcp-1)、mcp-3、血小板源性生长因子亚基b(pdgfb)、rantes、转化生长因子β1(tgf-β1)、促血小板生成素(tpo)、金属蛋白酶组织抑制剂1(timp1)、timp2和/或尿激酶纤维蛋白溶酶原活化因子受体(upar)中的一种或多种。3.1定义如本文所使用的,当涉及说明的数值时,术语“约”表示所说明的数值正或负10%内的值。如本文所使用的,与本文所述的胎盘源贴壁细胞有关的术语“血管生成的”是指细胞可以形成血管或血管样芽,或者细胞可以在另一细胞(例如,内皮细胞)群体中促进血管生成(例如,形成血管或血管样结构)。如本文所使用的,术语“血管生成”是指血管形成的过程,其包括(但不限于)内皮细胞激活、迁移、增殖、基质重塑和细胞稳定。如本文所使用的,术语“源”表示分离自或另外表示纯化自。例如,胎盘源贴壁细胞分离自胎盘。术语“源”涵盖了从直接分离自组织(例如胎盘)的细胞培养的细胞以及从原代分离物培养或扩增的细胞。如本文所使用的,“免疫定位”表示在(例如)流式细胞术、荧光激活细胞分类术、磁性细胞分选、原位杂交、免疫组织化学等中使用免疫蛋白(例如,抗体或其片段)的化合物(例如,细胞标志物)的检测。如本文所使用的,术语“sh2”是指结合细胞标志物cd105上的表位的抗体。因此,称为sh2+的细胞是cd105+。如本文所使用的,术语“sh3”和“sh4”是指结合细胞标志物cd73上所存在的表位的抗体。因此,称为sh3+和/或sh4+的细胞是cd73+。胎盘具有在其中发育的胎儿的基因型,但是在妊娠期间它还与母体组织紧密物理接触。照此,如本文所使用的,术语“胎儿基因型”表示胎儿的基因型,例如,与从中获得如本文所述的特定的分离的胎盘细胞的胎盘有关的胎儿的基因型与带有胎儿的母体的基因型相反。如本文所使用的,术语“母体基因型”表示带有胎儿的母体的基因型,例如,与从中获得如本文所述的特定的分离的胎盘细胞的胎盘有关的胎儿。如本文所使用的,术语“分离的细胞”,例如,“分离的胎盘细胞”、“分离的胎盘干细胞”等表示与从中获得干细胞的组织(例如胎盘)的其他不同细胞基本分离的细胞。如果在(例如)干细胞的收集和/或培养期间,从干细胞中除去了至少50%、60%、70%、80%、90%、95%或至少99%的细胞(例如,干细胞天然与之相关联的非干细胞或显示出不同标志物谱的干细胞),则细胞是“分离的”。如本文所使用的,当涉及细胞时,“多能”表示细胞具有分化成一些(但不必需是所有)体细胞类型或者分化成具有一些(但不必需是所有)体细胞类型的特征的细胞或者分化成三种胚层中的一种或多种的细胞的能力。在某些实施方式中,例如,如以下5.2节中所述的具有分化成具有神经细胞、软骨形成细胞和/或生骨细胞特征的细胞的能力的分离的胎盘细胞(pdac)是多能细胞。如本文所使用的,术语“分离的细胞群体”表示与从中获得细胞群体的组织(例如胎盘)的其他细胞基本分离的细胞群体。如本文所使用的,术语“胎盘细胞”是指从哺乳动物胎盘分离的(例如,如以下5.2节中所述)或由从哺乳动物胎盘分离的细胞培养的干细胞或祖细胞,本文中还称为“pdac”,其作为原代分离物或培养的细胞而不考虑原代培养后的传代次数。然而,在某些实施方式中,如本文所使用的术语“胎盘细胞”不表示,并且然而,在本文所提供的方法中使用的胎盘细胞不是滋养层、细胞滋养层、合体滋养细胞(syncitiotrophoblast)、成血管细胞(angioblast)、成血管细胞(hemangioblast)、胚胎生殖细胞、胚胎干细胞、得自胚泡内细胞群的细胞或得自后期胚胎生殖嵴的细胞,例如,胚胎生殖细胞。本文所述的胎盘细胞(例如,pdac)不是2009年11月19日提交的标题为“羊膜源血管生成细胞(amnionderivedangiogeniccells)”的未决美国专利申请no.12/622352中所述的羊膜源贴壁细胞,该专利公开以其全部内容作为参考并入本文。如果细胞显示出干细胞的特征,例如,与一种或多种类型的干细胞有关的标志物或基因表达谱;在培养中复制至少10-40次的能力和分化成显示出三种胚层中一种或多种的分化细胞的特征的细胞的能力,则认为该细胞是“干细胞”。除非在本文中另作说明,否则术语“胎盘”包括脐带。在某些实施方式中,本文所公开的分离的胎盘细胞在分化条件下体外分化,体内分化,或两者。如本文所使用的,当特定标志物在背景之上是可检测的时,胎盘细胞对该标志物是“阳性的”。例如,可以通过抗体的使用或者基于编码该标志物的基因或mrna的序列通过寡核苷酸探针或引物来完成特定标志物的检测。例如,由于cd73在胎盘细胞上是以比背景(与(例如)同型对照相比)可检测地更大的量可检测的,因此胎盘细胞对于(例如)cd73是阳性的。当由细胞所提供或表达时标志物可用于将该细胞与至少一种其他细胞类型进行区分或可用于选择或分离该细胞时,该细胞对于标志物也是阳性的。在(例如)抗体介导的检测的背景中,作为存在特定细胞表面标志物的指示,“阳性”表示使用对该标志物特异的抗体(例如,荧光标记抗体),该标志物是可检测的;“阳性”还是指显示出处于在(例如)血细胞计数器中产生可检测地高于背景的信号的量的标志物的细胞。例如,当用对cd200特异的抗体可检测地标记细胞并且来自该抗体的信号可检测地高于对照(例如,背景或同型对照)的信号时,该细胞是“cd200+”。相反,相同背景中的“阴性”表示与对照(例如,背景或同型对照)相比,使用对该标志物特异的抗体,该细胞表面标志物是不可检测的。例如,当未使用对cd34特异的抗体可重复、可检测地将细胞标记至比对照(例如,背景或同型对照)更大的程度时,则细胞是“cd34-”。使用适当的对照,以类似的方式确定使用抗体未检测出或不可检测的标志物是阳性或阴性的。例如,如果如(例如)通过如rt-pcr、狭缝印迹等检测rna的方法所确定的,在来自细胞或细胞群体的rna中所检测的oct-4rna的量可检测地大于背景时,可以将细胞或细胞群体确定为oct-4+。除非在本文中另作说明,否则使用抗体检测分化(“cd”)标志物簇。在某些实施方式中,如果oct-4是使用rt-pcr可检测的,则确定oct-4存在并且细胞为“oct-4+”。如本文所使用的,当涉及在流式细胞术中可检测的标志物的表达时,符号“低(low)”表示少于10%的所测试细胞表达了该标志物,或者在(例如)流式细胞术中由该标志物所发出的荧光小于背景之上的1log。如本文所使用的,“治疗”涵盖了疾病、病症或病况或其任何参数或症状的补救、改善、严重程度的减轻或者时间过程的缩短。4.附图说明图1示出了通过胎盘源贴壁细胞分泌所选的血管生成蛋白。图2示出了胎盘源贴壁细胞条件培养基对人内皮细胞(huvec)管腔形成的血管生成影响。图3示出了胎盘源贴壁细胞条件培养基对人内皮细胞迁移的血管生成影响。图4示出了胎盘源贴壁细胞条件培养基对人内皮细胞增殖的影响。图5示出了huvec和胎盘源贴壁细胞的管腔形成。图6示出了胎盘源贴壁细胞在含氧量低和含氧量正常的情况下的vegf和il-8的分泌。图7示出了pdac对小鸡绒毛膜尿囊血管生成模型中血管生成的阳性影响。bfgf:碱性成纤维细胞生长因子(阳性对照)。mdamb231:血管生成乳腺癌细胞系(阳性对照)。y轴:血管形成的程度。图8示出了pdac条件培养基(上清液)对小鸡绒毛膜尿囊血管生成模型中血管生成的阳性影响。bfgf:碱性成纤维细胞生长因子(阳性对照)。mdamb231:血管生成乳腺癌细胞系(阳性对照)。y轴:血管形成的程度。图9:星形细胞培养或星形细胞和pdac的共培养中存在的产生过氧化氢的活性氧。rfuros活性:活性氧的相对荧光单位。5.发明详述5.1与血流不良有关或由其所导致的疾病或病况的血管生成和治疗本文提供了治疗循环系统疾病或病症的方法,其包括施用有效量的组织培养贴壁胎盘细胞,例如pdac,如以下5.2节中所述的。在某些实施方式中,所述pdac是血管生成的。pdac能够支持内皮细胞和内皮细胞群体以及上皮细胞和上皮细胞群体的体外和体内生长。5.1.1循环系统疾病本文所提供的pdac、这类细胞的群体以及包含pdac的细胞群体可以用于治疗表现出将受益于血管生成增加的多种疾病状况或情况的个体。这类疾病状况或情况的实例包括心肌梗塞、充血性心力衰竭、周围动脉疾病、左心发育不全综合征、糖尿病性溃疡、褥疮、静脉曲张性溃疡、动脉性溃疡、灼伤、不连接骨折、骨关节炎和颌面骨修复。在某些实施方式中,pdac和这类细胞的群体可以用于在表现出外伤性组织损失的个体中促进血管生成,或防止疤痕形成,或在进行全关节置换术或假牙修补术的个体中使用。在更具体的实施方式中,本文所提供的pdac和这类细胞的群体可以用于治疗患有循环系统功能不全的个体,例如,和患有周围性血管疾病或冠状动脉病的个体。在一个方面,本文提供了治疗患有心脏病或损伤的患者的方法,其包括向患有心脏或循环系统疾病或损伤的患者施用治疗性细胞组合物并评价所述患者心脏功能的改善,其中所述细胞组合物包含如本文所述的pdac。在一种实施方式中,所述心脏病是心肌病。在具体的实施方式中,所述心肌病是特发性的或者是具有已知原因的心肌病。在其他具体的实施方式中,所述心肌病在本质上是缺血性的或是非缺血性的。在另一种实施方式中,所述心脏或循环系统疾病包括血管成形术、动脉瘤、绞痛(心绞痛)、主动脉瓣狭窄、主动脉炎、心律不齐、动脉硬化、动脉炎、非对称性间隔肥厚(ash)、动脉粥样硬化、心房颤动和扑动、细菌性心内膜炎、巴洛氏综合征(二尖瓣脱垂)、心搏徐缓、伯格氏病(闭塞性血栓血管炎)、心肥大、心肌病、心脏炎、颈动脉病、主动脉缩窄、先天性心脏病(先天性心脏缺损)、充血性心力衰竭(心力衰竭)、冠状动脉病、艾森门格综合征、栓塞、心内膜炎、红斑性肢痛病、原纤化、纤维肌性发育异常、心传导阻滞、心杂音、高血压、低血压、小儿先天性动脉钙化、川崎氏病(皮肤粘膜淋巴结综合征、皮肤粘膜淋巴结病、婴儿多动脉炎)、代谢综合征、微血管性心绞痛、心肌梗塞(心脏病发作)、心肌炎、阵发性房性心动过速(pat)、结节性动脉周围炎(多动脉炎、多发性结节性动脉炎)、心包炎、周围性血管疾病、严重肢体缺血、糖尿病血管病变、静脉炎、肺动脉瓣狭窄(肺动脉狭窄)、雷诺氏病、肾动脉狭窄、肾血管性高血压、风湿性心脏病、间隔缺损、隐匿性局部缺血、x综合征、心动过速、大动脉炎、紫绀四联症、大血管移位、三尖瓣闭锁、动脉干、瓣膜性心脏病、静脉曲张性溃疡、静脉曲张、血管炎、室中隔缺损、预激综合征或心内膜垫缺损中的一种或多种。在其他实施方式中,所述心脏或循环系统疾病包括急性风湿热、急性风湿性心包炎、急性风湿性心内膜炎、急性风湿性心肌炎、慢性风湿性心脏病、二尖瓣疾病、二尖瓣狭窄、风湿性二尖瓣关闭不全、主动脉瓣疾病、其他心内结构疾病、缺血性心脏病(急性和亚急性)、心绞痛、肺循环疾病(急性肺心病、肺栓塞、慢性肺原性心脏病)、脊柱后侧凸性心脏病、心肌炎、心内膜炎、心内膜心肌纤维化、心内膜弹力纤维增生症、房室传导阻滞、心脏节律障碍、心肌变性,包括脑血管疾病在内的循环系统疾病、大脑前动脉阻塞和狭窄、脑动脉阻塞、动脉、小动脉和毛细血管疾病(动脉粥样硬化、动脉瘤)或静脉和淋巴管疾病。在另一种实施方式中,治疗包括用包含pdac并且含有或不含另一种细胞类型的治疗性细胞组合物治疗患有心肌病的个体。在某些实施方式中,所述个体受益于所述疗法,例如,受益于所述细胞支持包括存在于心脏中的干细胞或祖细胞在内的其他细胞生长的能力,受益于组织向内生长或组织血管化以及受益于有益的细胞因子(cellularfactor)、趋化因子、细胞因子(cytokine)等的存在,但所述细胞在所述个体中不结合或繁殖。在另一种实施方式中,所述患者受益于使用所述细胞的治疗性治疗,但是所述细胞在所述患者中不会长期存活。在一种实施方式中,所述细胞的数目、活力或生化活性逐渐降低,在其他实施方式中,可以在细胞中所述降低之前存在一段时间的活性,例如,生长、分裂或生化活性。在其他实施方式中,衰老的、不能存活的或甚至死细胞都能够具有有益的治疗效果。可以通过循环系统的疾病或病症的一种或多种症状的可检测的改善来评价或显示患有循环系统疾病或病症的个体的改善,其中向所述个体施用了本文所提供的pdac或治疗性组合物。在另一种实施方式中,可以通过心脏功能的一种或多种征候的可检测的改善,例如,与施用pdac之前所述个体相比,心输出量(co)、心脏指数(ci)、肺动脉楔压(pawp)和心脏指数(ci)、缩短率%(%fs)、射血分数(ef)、左心室射血分数(lvef);左心室舒张末期直径(lvedd)、左心室收缩末期直径(lvesd)、收缩性(dp/dt)、压力-容量环、心脏作功的测量、心房或心室功能的提高;泵血效率提高、泵血效率损失率降低、血液动力学功能降低;和与心肌病有关的并发症的减少中一种或多种的可检测改善的表现,来评价或显示患有循环系统疾病或病症的个体中的改善,其中向所述个体施用了pdac或包含pdac的治疗性组合物。还可以通过主观度量标准(例如,施用后个体对其健康状况的自我评价)评价接受本文所提供的pdac或包含pdac的治疗性组合物的个体中的改善。在某些实施方式中,细胞施用的成功不是基于个体中所施用的pdac的存活。相反,成功是基于对如上所述的心脏或循环系统健康改善的一种或多种度量标准。因此,所述细胞不需要结合并随患者心脏搏动,或结合到血管中。在某些实施方式中,本文所提供的治疗方法包括诱导pdac沿间质系(mesenchymallineage)向(例如)心肌原、血管生成或血管原性表型分化或者分化为细胞,如肌细胞、心肌细胞(cardiomyocyte)、内皮细胞、心肌细胞(myocardialcell)、心外膜下细胞、血管内皮细胞、平滑肌细胞(例如,血管平滑肌细胞)。可以通过(例如)移植、植入(例如,细胞本身或作为基质-细胞结合物的一部分的细胞的植入)、注射(例如,直接向疾病或病况位点注射,例如,直接向患有心肌梗塞的个体的心脏中的缺血性位点注射)、输注、通过导管递送或本领域中已知用于提供细胞疗法的任何其他方式来完成pdac或包含这些细胞的治疗性组合物向对其有需要的个体的施用。在一种实施方式中,例如,通过向个体中一个或多个位点注射来向对其有需要的个体提供所述治疗性细胞组合物。在具体的实施方式中,通过(例如)向心脏中缺血性区域的心内注射来提供所述治疗性细胞组合物。在其他具体的实施方式中,将所述细胞注射到心脏表面、相邻区域或甚至更远的区域。在优选的实施方式中,所述细胞可以靶向患病或创伤区域。可以在细胞将具有治疗性益处的任何时候向患有冠状动脉或血管系统疾病或病况的个体施用pdac。在某些实施方式中,例如,在心肌梗塞1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23或24小时或1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29或30天内施用根据本发明的pdac或治疗性组合物。在心肌梗塞早期施用(例如,1-3天或1-7天内)优于晚期施用(例如,心肌梗塞后3或7天)。在其他实施方式中,在疾病或病况的最初诊断的1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23或24小时或1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29或30天内施用根据本发明的细胞或治疗性组合物。本文还提供了在心肌梗塞治疗中使用的试剂盒。所述试剂盒提供了包含pdac的治疗性细胞组合物,其可以制备成药物可用的形式,例如,通过与可药用载体混合;和施用器;以及使用说明书。理想地,所述试剂盒可以在(例如)内科医师的办公室中或由紧急救护人员应用于诊断为患有心肌梗塞或类似心脏事件的患者的情况中使用。在本文所提供的治疗方法的具体实施方式中,pdac与干细胞(即,非pdac干细胞)、成肌细胞、肌细胞、心肌母细胞、心肌细胞,或者成肌细胞、肌细胞、心肌母细胞和/或心肌细胞的祖细胞一起施用。在具体的实施方式中,本文所提供的治疗方法包括向患有心脏或循环系统疾病的患者施用pdac,例如,包含所述细胞的治疗性组合物;和评价患者心脏功能的改善,其中所述治疗性细胞组合物是作为基质-细胞复合物施用的。在某些实施方式中,所述基质是包含至少所述细胞的支架,优选地,是生物可吸收的。为此目的,本文还提供了与刺激干细胞或祖细胞沿心原性、血管生成、血管形成或血管原性途径分化的一种或多种因子接触,例如,在存在所述因子的情况下孵育或培养的pdac群体。这些因子包括(但不限于)因子,如生长因子、趋化因子、细胞因子、细胞产物、脱甲基试剂和现在已知或随后确定刺激(例如)干细胞沿心原性、血管生成、血管形成或血管原性途径或系分化的其他因子。在某些实施方式中,通过在存在包括脱甲基试剂、bmp(骨形态发生蛋白)、fgf(成纤维细胞生长因子)、wnt因子蛋白、刺猬蛋白和/或抗wnt因子中至少一种的因子的情况下体外培养细胞可以使pdac沿心原性、血管生成、血管形成或血管原性途径或系分化。包含脱甲基试剂往往会促进pdac沿间质系向心肌原途径分化。可以通过(例如)心肌肌球蛋白、骨骼肌球蛋白或gata4中的至少一种的表达确定分化,例如,如通过免疫染色或rt-pcr;或通过自发或诱导的搏动节律的获得;或通过至少部分结合至个体心肌而不引起心律不齐的能力所确定的。可用于引起这种分化的脱甲基试剂包括(但不限于)5-氮杂胞苷、5-氮杂-2'-脱氧胞苷、二甲亚砜、白屈菜红碱氯化物、视黄酸或其盐、2-氨基-4-(乙硫基)丁酸、普鲁卡因胺和/或普鲁卡因。在本文的某些实施方式中,与如上所鉴别的一种或多种因子接触的pdac可以成为心肌原、血管生成、血管形成或血管原性细胞或祖细胞。优选地,至少一些细胞至少部分结合至受体的心血管系统,其包括(但不限于)心肌、心脏的血管和其他结构、心脏或周围血管等。在某些实施方式中,分化的pdac分化为表现出心肌原细胞或其祖细胞的两种或更多种特征的细胞,并且分化的pdac能够部分或全部结合到受体的心脏或脉管系统。在具体的实施方式中,当施用给个体时,所述细胞不会导致心律不齐、心脏缺损、血管缺损或个体循环系统或健康的其他异常的增加。在某些实施方式中,pdac起作用以促进天然存在于心肌、血管、血液等中的干细胞向其自身分化,并分化为(例如)心肌细胞,或至少沿心肌原、血管生成、血管形成或血管原性系分化。可以向个体(例如,患有影响心脏或循环系统的疾病、病症或病况的个体)治疗性或预防性地提供pdac和这类细胞的群体。这些疾病、病症或病况可以包括由于动脉粥样硬化所造成的充血性心力衰竭、心肌病或心脏损伤,例如,缺血性损伤,如由于心肌梗塞或伤口(急性或慢性)所造成的。在某些实施方式中,例如,在包含pdac的细胞群体中向个体施用了治疗有效量的pdac。在具体的实施方式中,所述群体包括约50%的pdac。在另一种具体的实施方式中,所述群体是基本同种的pdac群体。在其他实施方式中,所述群体包括至少约5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、98%或99%的pdac。可以以包含所述细胞和另一种治疗剂的治疗性组合物的形式将pdac施用于个体,所述治疗剂如胰岛素样生长因子(igf)、血小板源性生长因子(pdgf)、表皮生长因子(egf)、成纤维细胞生长因子(fgf)、血管内皮生长因子(vegf)、肝细胞生长因子(hgf)、白细胞介素18(il-8)、抗凝血试剂(例如,肝素、肝素衍生物、尿激酶或ppack(d-苯丙氨酸-脯氨酸-精氨酸-氯甲酮)、抗凝血酶化合物、血小板受体拮抗剂、抗凝血酶抗体、抗血小板受体抗体、阿司匹林、双嘧达莫、鱼精蛋白、水蛭素、前列腺素抑制剂和/或血小板抑制剂)、抗细胞凋亡试剂(例如,促红细胞生成素(epo)、epo衍生物或类似物或其盐、促血小板生成素(tpo)、igf-i、igf-ii、肝细胞生长因子(hgf)或半胱天冬氨酸酶抑制剂)、抗炎症药(例如,p38map激酶抑制剂、抑制素、il-6抑制剂、il-1抑制剂、吡嘧司特、曲尼司特、瑞米凯德(remicade)、西罗莫司和/或非类固醇抗炎化合物(例如,阿司匹林、布洛芬、替泊沙林、托美丁或舒洛芬))、免疫抑制或免疫调节试剂(例如,钙神经素抑制剂,例如环胞霉素、他克莫司;mtor抑制剂,如西罗莫司或依维莫司;抗增殖剂,如硫唑嘌呤和/或吗替麦考酚酯;皮质类固醇,例如,泼尼松龙或氢化可的松;抗体,如抗il-2rα受体单克隆抗体、巴利昔单抗、达利珠单抗、抗t细胞的多克隆抗体,如抗胸腺细胞球蛋白(atg)、抗淋巴细胞球蛋白(alg)和/或抗t细胞单克隆抗体okt3或如美国专利no.7468276和美国专利申请公开no.2007/0275362中所述的贴壁胎盘干细胞,以上每一篇专利的公开内容以其全部内容作为参考并入本文),和/或抗氧化剂(例如,普罗布考、维生素a、c和/或e、辅酶q-10、谷胱甘肽、l-半胱氨酸、n-乙酰半胱氨酸或上述任何的抗氧化剂衍生物、类似物或盐)。在某些实施方式中,包含pdac的治疗性组合物还包含一种或多种其他细胞类型,例如,成体细胞(例如,成纤维细胞或内胚层细胞)、干细胞和/或祖细胞。可以将这些治疗剂和/或一种或多种其他类型的细胞分别或组合或以两种或更多种这类化合物或试剂施用给对其有需要的个体。在某些实施方式中,待治疗的个体是哺乳动物。在具体的实施方式中,待治疗的个体是人。在具体的实施方式中,所述个体是家畜动物或家养动物。在其他具体的实施方式中,所述待治疗个体是马、绵羊、母牛或阉牛、猪、狗或猫。5.1.2缺血性疾病的治疗在某些实施方式中,本文提供了治疗(例如)周围血管系统中血流破环的个体的方法,其包括向所述个体施用治疗有效量的pdac。在某些具体的实施方式中,所述缺血是周围动脉疾病(pad),例如,是严重肢体缺血(cli)。在某些其他实施方式中,所述缺血是周围性血管疾病(pvd)、周围动脉疾病、缺血性血管病、缺血性心脏病或缺血性肾病。在具体的实施方式中,所述血流的破环是严重肢体缺血。在另一个更具体的实施方式中,所述cli是下肢动脉中严重的阻塞,其显著降低了血流。在另一个更具体的实施方式中,所述cli的特征在于缺血性静息痛、个体不移动时腿和脚的严重疼痛、脚或腿的难愈性疼痛、脚的疼痛或麻木、腿或脚的皮肤发亮、平滑、干燥、脚趾甲变厚、腿或脚中脉搏缺少或减弱、开放性疼痛、难愈的皮肤感染或溃疡和/或腿或脚的干性坏疽(干燥、黑色皮肤)。在另一种具体的实施方式中,患有cli的个体经受了至少一个手指(脚趾)和/或整体肢的损失。在所述方法的另一种具体的实施方式中,所述治疗有效量是导致由于个体周围血管系统中血液流动的破坏所造成的四肢功能损失和/或缺氧的一种或多种症状的消除、可检测的改善、严重程度的减轻或进展的减缓的pdac的个数。在另一种具体的实施方式中,将所述治疗有效量的分离的pdac预防性地施用于所述个体(例如)以减少或消除所述血液流动破环后由四肢中或周围的血液流动的第二次或后续破环所引起的组织损伤。在其他实施方式中,可以在中风(例如,缺血性中风)的治疗(例如,通过在cns的缺血性区域中促进血管生成的中风治疗)中使用pdac。在一个方面,本文提供了治疗患有个体脑中或周围血液流动破坏的个体(例如,患有由于个体脑或中枢神经系统(cns)中或周围的血液流动破坏而造成的症状或神经功能缺损的个体)的方法,其包括向所述个体施用治疗有效量的分离的组织培养贴壁人胎盘细胞,其中所述分离的胎盘细胞具有多能细胞或干细胞的特征。在某些实施方式中,血液流动破坏导致个体脑或cns的缺氧损伤(anoxicinjury)或低氧损伤(hypoxicinjury)。如本文所考虑的,由个体脑中或周围的血液流动的破坏所造成的个体中症状或神经功能缺损的治疗包括由可以伴随个体脑中或周围的这种血液流动破坏的再灌注损伤所造成的症状或神经功能缺损的治疗。除了是血管生成的之外,本文所提供的胎盘细胞(例如,如下所述的pdac)是神经保护性的。在某些实施方式中,所述胎盘细胞在低氧环境中是神经保护性的,例如,在含氧量低的情况下(例如,小于约5%o2)。在某些实施方式中,当与神经元或其他神经细胞或星形细胞接触时,所述胎盘干细胞提高了神经元、神经细胞或星形细胞的健康,例如,通过pdac和神经元的共培养中体外轴突长度的增加所见。在某些其他实施方式中,pdac降低了含氧量低的环境中的一种或多种活性氧的浓度。此外,在某些实施方式中,胎盘细胞(例如,pdac)分泌神经营养性细胞因子bdnf、vegf、hgf、g-csf、神经生长因子(ngf)和/或神经营养蛋白-3(ntf3)中的一种或多种。照此,pdac在cns和pns两者的缺血性损伤的治疗中是有用的,例如,由中风所引起的cns中神经系统的缺血性损伤或者由严重肢体缺血或周围性血管疾病所引起的pns中神经系统的缺血性损伤。在其他实施方式中,pdac可以用于治疗(例如)多发性硬化、肌萎缩性侧索硬化、帕金森氏疾病、阿尔茨海默病和/或周围神经病,例如,糖尿病性神经病变。5.2分离的胎盘细胞和分离的胎盘细胞群体在患有循环系统疾病或病症的个体的治疗中有用的分离的胎盘细胞(例如、pdac)是从胎盘或其部分可获得的附着于组织培养基质并具有多能细胞或干细胞特征的细胞,但是不是滋养层。在某些实施方式中,在本文所公开的方法中有用的分离的胎盘细胞具有分化为非胎盘细胞类型的能力。在本文所公开的方法中有用的分离的胎盘细胞在来源上可以是胎儿的或母体的(即,可以分别具有胎儿或母体的基因型)。优选地,所述分离的胎盘细胞和分离的胎盘细胞群体在来源上是胎儿来源的。如本文所使用的,短语“胎儿来源”或“非母体来源”表示分离的胎盘细胞或分离的胎盘细胞群体得自与胎儿有关的脐带或胎盘结构,即具有胎儿基因型。如本文所使用的,短语“母体来源”表示所述细胞或细胞群体得自与母体有关的胎盘结构,例如,具有母体基因型的结构。分离的胎盘细胞(例如,pdac)或包含分离的胎盘细胞的细胞群体可以包含仅是胎儿或母体来源的分离的胎盘细胞,或者可以包含胎儿和母体来源的分离的胎盘细胞的混合群体。可以通过以下所讨论的形态学、标志物和培养特征来鉴别和选择所述分离的胎盘细胞和包含所述分离的胎盘细胞的细胞群体。在某些实施方式中,任何胎盘细胞(例如,本文所述的胎盘干细胞或胎盘多能细胞)对受体(例如,患有循环系统疾病或病症的个体)是自体同源的。在某些其他实施方式中,任何胎盘细胞(例如,本文所述的胎盘干细胞或胎盘多能细胞)对受体(例如,患有循环系统疾病或病症的个体)是异源的。5.2.1物理和形态特征当在原代培养或在细胞培养中培养时,本文所述的分离的胎盘细胞(pdac)贴壁到组织培养基质(例如,组织培养容器表面(例如,组织培养塑料))上或者贴壁到涂覆了胞外基质或配体的组织培养表面上,所述配体如层粘连蛋白、胶原(例如,天然的或变性的)、明胶、纤连蛋白、鸟氨酸、玻连蛋白和胞外膜蛋白(例如,(bddiscoverylabware,bedfordmass.))。培养中的所述分离的胎盘细胞呈现出一般成纤维样星形外观,其中多个胞质突从中央细胞体中伸出。然而,由于所述分离的胎盘细胞显示出比成纤维细胞数目更多的这些过程,因此这些细胞在形态上是与相同条件下培养的成纤维细胞可区分的。在形态上,分离的胎盘细胞还与造血干细胞是可区分的,造血干细胞在培养时一般呈现出更圆的或卵石形态。在某些实施方式中,当在生长培养基中培养时,在本文所公开的方法中有用的分离的胎盘细胞发育为胚状体样体(embryoid-likebody)。胚状体样体是可以在增殖的分离的胎盘细胞贴壁层的顶部生长的非相邻细胞块。由于细胞块与胚状体(由胚胎干细胞的培养生长的细胞块)类似,因此使用了术语“胚状体样”。其中胚状体样体可以在分离的胎盘细胞的增殖培养中发育的生长培养基包括包含以下成分的培养基:例如,dmem-lg(例如,获自gibco);2%胎牛血清(例如,获自hyclonelabs.);1×胰岛素-转铁蛋白-硒(its);1×亚油酸-牛血清白蛋白(la-bsa);10-9m地塞米松(例如,获自sigma);10-4m抗坏血酸2-磷酸盐(例如,获自sigma);10ng/ml表皮生长因子(例如,获自r&dsystems);10ng/ml和血小板源性生长因子(pdgf-bb,例如,获自r&dsystems)。5.2.2细胞表面、分子和遗传标志物在本文所公开的方法(例如,治疗循环系统疾病或病症的方法)中有用的分离的胎盘细胞(例如,分离的多能胎盘细胞或分离的胎盘干细胞)和该类分离的胎盘细胞的群体是组织培养贴壁人胎盘细胞,其具有多能细胞或干细胞的特征并且表达可用于鉴别和/或分离这些细胞或包含所述干细胞的细胞群体的多种标志物。在某些实施方式中,所述pdac在(例如)体外或体内是血管生成的。本文所述的这些分离的胎盘细胞和胎盘细胞群体(即,两种或更多种分离的胎盘细胞)包括直接得自胎盘或其任何部分(例如,绒毛膜、胎盘绒毛叶等)的胎盘细胞和含有胎盘细胞的细胞群体。分离的胎盘细胞群体还包括培养中的(也就是说,两种或更多种)分离的胎盘细胞的群体和容器(例如,袋)中的群体。本文所述的分离的胎盘细胞不是骨髓源间充质细胞、脂肪源间质干细胞或得自脐带血、胎盘血或周围血液的间充质细胞。在本文中和(例如)美国专利no.7311904;7311905和7468276中;以及在美国专利申请公开no.2007/0275362中说明了在本文所述的方法和组合物中有用的胎盘细胞,例如,胎盘多能细胞和胎盘细胞,以上专利的公开内容以其全部内容作为参考并入本文。在某些实施方式中,这些分离的胎盘细胞是分离的胎盘干细胞。在某些其他实施方式中,这些分离的胎盘细胞是分离的胎盘多能细胞。在一种实施方式中,所述分离的胎盘细胞(例如,pdac)是cd34-、cd10+和cd105+,如通过流式细胞术所检测的。在另一种具体的实施方式中,分离的cd34-、cd10+、cd105+胎盘细胞具有分化为神经表型细胞、成骨表型细胞和/或软骨形成表型细胞的潜能。在另一种具体的实施方式中,所述分离的cd34-、cd10+、cd105+胎盘细胞另外是cd200+。在另一种具体的实施方式中,所述分离的cd34-、cd10+、cd105+胎盘细胞另外是cd45-或cd90+。在另一种具体的实施方式中,所述分离的cd34-、cd10+、cd105+胎盘细胞另外是cd45-和cd90+,如通过流式细胞术所检测的。在另一种具体的实施方式中,所述分离的cd34-、cd10+、cd105+、cd200+胎盘细胞另外是cd90+或cd45-,如通过流式细胞术所检测的。在另一种具体的实施方式中,如通过流式细胞术所检测的,所述分离的cd34-、cd10+、cd105+、cd200+胎盘细胞另外是cd90+和cd45-,即,所述细胞是cd34-、cd10+、cd45-、cd90+、cd105+和cd200+。在另一种具体的实施方式中,所述cd34-、cd10+、cd45-、cd90+、cd105+、cd200+细胞另外是cd80-和cd86-。在某些实施方式中,所述胎盘细胞是cd34-、cd10+、cd105+和cd200+,以及cd38-、cd45-、cd80-、cd86-、cd133-、hla-dr,dp,dq-、ssea3-、ssea4-、cd29+、cd44+、cd73+、cd90+、cd105+、hla-a,b,c+、pdl1+、abc-p+和/或oct-4+中的一种或多种,如通过流式细胞术所检测的。在其他实施方式中,如上所述的任何cd34-、cd10+、cd105+细胞另外是cd29+、cd38-、cd44+、cd54+、sh3+或sh4+中的一种或多种。在另一种具体的实施方式中,所述细胞另外是cd44+。在以上任何分离的cd34-、cd10+、cd105+胎盘细胞的另一种具体的实施方式中,所述细胞另外是cd117-、cd133-、kdr-(vegfr2-)、hla-a,b,c+、hla-dp,dq,dr-或编程死亡-1配体(pdl1)+中的一种或多种,或它们的任意组合。在另一种实施方式中,所述cd34-、cd10+、cd105+细胞另外是cd13+、cd29+、cd33+、cd38-、cd44+、cd45-、cd54+、cd62e-、cd62l-、cd62p-、sh3+(cd73+)、sh4+(cd73+)、cd80-、cd86-、cd90+、sh2+(cd105+)、cd106/vcam+、cd117-、cd144/ve-钙粘素low、cd184/cxcr4-、cd200+、cd133-、oct-4+、ssea3-、ssea4-、abc-p+、kdr-(vegfr2-)、hla-a,b,c+、hla-dp,dq,dr-、hla-g-或编程死亡-1配体(pdl1)+中的一种或多种,或它们的任意组合。在其他实施方式中,所述cd34-、cd10+、cd105+细胞另外是cd13+、cd29+、cd33+、cd38-、cd44+、cd45-、cd54/icam+、cd62e-、cd62l-、cd62p-、sh3+(cd73+)、sh4+(cd73+)、cd80-、cd86-、cd90+、sh2+(cd105+)、cd106/vcam+、cd117-、cd144/ve-钙粘素low、cd184/cxcr4-、cd200+、cd133-、oct-4+、ssea3-、ssea4-、abc-p+、kdr-(vegfr2-)、hla-a,b,c+、hla-dp,dq,dr-、hla-g-和编程死亡-1配体(pdl1)+。在另一种具体的实施方式中,本文所述的任何胎盘细胞另外是abc-p+,如通过流式细胞术所检测的,或oct-4+(pou5f1+),如通过rt-pcr所确定的,其中abc-p是胎盘特异性abc转运蛋白(也称为乳腺癌耐药蛋白(bcrp)和耐米托蒽醌蛋白(mxr)),并且oct-4是八聚体-4蛋白(pou5f1)。在另一种具体的实施方式中,本文所述的任何胎盘细胞另外是ssea3-或ssea4-,如通过流式细胞术确定的,其中ssea3是阶段特异性胚胎抗原3,而ssea4是阶段特异性胚胎抗原4。在另一种具体的实施方式中,本文所述的任何胎盘细胞另外是ssea3-和ssea4-。在另一种具体的实施方式中,本文所述的任何胎盘细胞另外是mhc-i+(例如,hla-a,b,c+)、mhc-ii-(例如,hla-dp,dq,dr-)或hla-g-中的一种或多种。在另一种具体的实施方式中,本文所述的任何胎盘细胞另外是mhc-i+(例如,hla-a,b,c+)、mhc-ii-(例如,hla-dp,dq,dr-)和hla-g-中的一种或多种。本文还提供了所述分离的胎盘细胞的群体或细胞群体,例如,包含(例如,富含)在本文所公开的方法和组合物中有用的所述分离的胎盘细胞的胎盘细胞群体。包含所述分离的胎盘细胞的优选细胞群体,其中所述细胞群体包含(例如)至少10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或98%的分离的cd10+、cd105+和cd34-胎盘细胞;即所述群体中至少10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或98%的细胞是分离的cd10+、cd105+和cd34-胎盘细胞。在具体的实施方式中,所述分离的cd34-、cd10+、cd105+胎盘细胞另外是cd200+。在另一种具体的实施方式中,所述分离的cd34-、cd10+、cd105+、cd200+胎盘细胞另外是cd90+或cd45-,如通过流式细胞术所检测的。在另一种具体的实施方式中,所述分离的cd34-、cd10+、cd105+、cd200+胎盘细胞另外是cd90+和cd45-,如通过流式细胞术所检测的。在另一种具体的实施方式中,如上所述的任何分离的cd34-、cd10+、cd105+胎盘细胞另外是cd29+、cd38-、cd44+、cd54+、sh3+或sh4+中的一种或多种。在另一种具体的实施方式中,所述分离的cd34-、cd10+、cd105+胎盘细胞或分离的cd34-、cd10+、cd105+、cd200+胎盘细胞另外是cd44+。在包含上述分离的cd34-、cd10+、cd105+胎盘细胞的任何细胞群体的具体实施方式中,所述分离的胎盘细胞另外是cd13+、cd29+、cd33+、cd38-、cd44+、cd45-、cd54+、cd62e-、cd62l-、cd62p-、sh3+(cd73+)、sh4+(cd73+)、cd80-、cd86-、cd90+、sh2+(cd105+)、cd106/vcam+、cd117-、cd144/ve-钙粘素low、cd184/cxcr4-、cd200+、cd133-、oct-4+、ssea3-、ssea4-、abc-p+、kdr-(vegfr2-)、hla-a,b,c+、hla-dp,dq,dr-、hla-g-或编程死亡-1配体(pdl1)+中的一种或多种,或它们的任意组合。在另一种具体的实施方式中,所述cd34-、cd10+、cd105+细胞另外是cd13+、cd29+、cd33+、cd38-、cd44+、cd45-、cd54/icam+、cd62e-、cd62l-、cd62p-、sh3+(cd73+)、sh4+(cd73+)、cd80-、cd86-、cd90+、sh2+(cd105+)、cd106/vcam+、cd117-、cd144/ve-钙粘素low、cd184/cxcr4-、cd200+、cd133-、oct-4+、ssea3-、ssea4-、abc-p+、kdr-(vegfr2-)、hla-a,b,c+、hla-dp,dq,dr-、hla-g-和编程死亡-1配体(pdl1)+。在某些实施方式中,在本文所述的方法和组合物中有用的分离的胎盘细胞是cd10+、cd29+、cd34-、cd38-、cd44+、cd45-、cd54+、cd90+、sh2+、sh3+、sh4+、ssea3-、ssea4-、oct-4+和abc-p+中的一种或多种或者全部,其中所述分离的胎盘细胞是通过胎盘组织的物理和/或酶促破环获得的。在具体的实施方式中,所述分离的胎盘细胞是oct-4+和abc-p+。在另一种具体的实施方式中,所述分离的胎盘细胞是oct-4+和cd34-,其中所述分离的胎盘细胞具有以下特征中的至少一种:cd10+、cd29+、cd44+、cd45-、cd54+、cd90+、sh3+、sh4+、ssea3-和ssea4-。在另一种具体的实施方式中,所述分离的胎盘细胞是oct-4+、cd34-、cd10+、cd29+、cd44+、cd45-、cd54+、cd90+、sh3+、sh4+、ssea3-和ssea4-。在另一种实施方式中,所述分离的胎盘细胞是oct-4+、cd34-、ssea3-和ssea4-。在另一种具体的实施方式中,所述分离的胎盘细胞是oct-4+和cd34-,以及sh2+或sh3+中的任一种。在另一种具体的实施方式中,所述分离的胎盘细胞是oct-4+、cd34-、sh2+和sh3+。在另一种具体的实施方式中,所述分离的胎盘细胞是oct-4+、cd34-、ssea3-和ssea4-,以及sh2+或sh3+中的任一种。在另一种具体的实施方式中,所述分离的胎盘细胞是oct-4+和cd34-,以及sh2+或sh3+中的任一种,并且是cd10+、cd29+、cd44+、cd45-、cd54+、cd90+、ssea3-或ssea4-中的至少一种。在另一种具体的实施方式中,所述分离的胎盘细胞是oct-4+、cd34-、cd10+、cd29+、cd44+、cd45-、cd54+、cd90+、ssea3-和ssea4-,以及sh2+或sh3+中的任一种。在另一种实施方式中,在本文所公开的方法和组合物中有用的所述分离的胎盘细胞是sh2+、sh3+、sh4+和oct-4+。在另一种具体的实施方式中,所述分离的胎盘细胞是cd10+、cd29+、cd44+、cd54+、cd90+、cd34-、cd45-、ssea3-或ssea4-。在另一种实施方式中,所述分离的胎盘细胞是sh2+、sh3+、sh4+、ssea3-和ssea4-。在另一种具体的实施方式中,所述分离的胎盘细胞是sh2+、sh3+、sh4+、ssea3-和ssea4-、cd10+、cd29+、cd44+、cd54+、cd90+、oct-4+、cd34-或cd45-。在另一种实施方式中,在本文所公开的方法和组合物中有用的分离的胎盘细胞是cd10+、cd29+、cd34-、cd44+、cd45-、cd54+、cd90+、sh2+、sh3+和sh4+;其中所述分离的胎盘细胞另外是oct-4+、ssea3-或ssea4-中的一种或多种。在某些实施方式中,在本文所公开的方法和组合物中有用的分离的胎盘细胞是cd200+或hla-g-。在具体的实施方式中,所述分离的胎盘细胞是cd200+和hla-g-。在另一种具体的实施方式中,所述分离的胎盘细胞另外是cd73+和cd105+。在另一种具体的实施方式中,所述分离的胎盘细胞另外是cd34-、cd38-或cd45-。在另一种具体的实施方式中,所述分离的胎盘细胞另外是cd34-、cd38-和cd45-。在另一种具体的实施方式中,所述干细胞是cd34-、cd38-、cd45-、cd73+和cd105+。在另一种具体的实施方式中,所述分离的cd200+或hla-g-胎盘细胞在允许胚状体样体形成的条件下在包含所述分离的胎盘细胞的胎盘细胞群体中有利于胚状体样体的形成。在另一种具体的实施方式中,所述分离的胎盘细胞是从非干细胞或多能细胞的胎盘细胞中分离出来的。在另一种具体的实施方式中,所述分离的胎盘细胞是从不表现出这些标志物的胎盘细胞中分离出来的。在另一种实施方式中,在本文所述的方法和组合物中有用的细胞群体是包含(例如,富含)cd200+、hla-g-干细胞的细胞群体。在具体的实施方式中,所述群体是胎盘细胞群体。在多种实施方式中,所述细胞群体中至少约10%、至少约20%、至少约30%、至少约40%、至少约50%或至少约60%的细胞是分离的cd200+、hla-g-胎盘细胞。优选地,所述细胞群体中至少约70%的细胞是分离的cd200+、hla-g-胎盘细胞。更优选,至少约90%、95%或99%的所述细胞是分离的cd200+、hla-g-胎盘细胞。在所述细胞群体的具体实施方式中,所述分离的cd200+、hla-g-胎盘细胞还是cd73+和cd105+。在另一种具体的实施方式中,所述分离的cd200+、hla-g-胎盘细胞还是cd34-、cd38-或cd45-。在另一种具体的实施方式中,所述分离的cd200+、hla-g-胎盘细胞还是cd34-、cd38-、cd45-、cd73+和cd105+。在另一种实施方式中,当在允许胚状体样体形成的条件下培养时,所述细胞群体产生一个或多个胚状体样体。在另一种具体的实施方式中,所述细胞群体是从非干细胞的胎盘细胞中分离出来的。在另一种具体的实施方式中,所述分离的cd200+、hla-g-胎盘细胞是从不表现出这些标志物的胎盘细胞中分离出来的。在另一种实施方式中,在本文所述的方法和组合物中有用的所述分离的胎盘细胞是cd73+、cd105+和cd200+。在另一种具体的实施方式中,所述分离的胎盘细胞是hla-g-。在另一种具体的实施方式中,所述分离的胎盘细胞是cd34-、cd38-或cd45-。在另一种具体的实施方式中,所述分离的胎盘细胞是cd34-、cd38-和cd45-。在另一种具体的实施方式中,所述分离的胎盘细胞是cd34-、cd38-、cd45-和hla-g-。在另一种具体的实施方式中,当胎盘细胞群体在允许胚状体样体形成的条件下培养时,所述分离的cd73+、cd105+和cd200+胎盘细胞在包含所述分离的胎盘细胞的胎盘细胞群体中有利于一个或多个胚状体样体的形成。在另一种具体的实施方式中,所述分离的胎盘细胞是从非分离的胎盘细胞的胎盘细胞中分离出来的。在另一种具体的实施方式中,所述分离的胎盘细胞是从不表现出这些标志物的胎盘细胞中分离出来的。在另一种实施方式中,在本文所述的方法和组合物中有用的细胞群体是包含(例如,富含)分离的cd73+、cd105+、cd200+胎盘细胞的细胞群体。在多种实施方式中,所述细胞群体中至少约10%、至少约20%、至少约30%、至少约40%、至少约50%或至少约60%的细胞是分离的cd73+、cd105+、cd200+胎盘细胞。在另一种实施方式中,所述细胞群体中至少约70%的所述细胞是分离的cd73+、cd105+、cd200+胎盘细胞。在另一种实施方式中,所述细胞群体中至少约90%、95%或99%的细胞是分离的cd73+、cd105+、cd200+胎盘细胞。在所述群体的具体实施方式中,所述分离的胎盘细胞是hla-g-。在另一种具体的实施方式中,所述分离的胎盘细胞另外是cd34-、cd38-或cd45-。在另一种具体的实施方式中,所述分离的胎盘细胞另外是cd34-、cd38-和cd45-。在另一种具体的实施方式中,所述分离的胎盘细胞另外是cd34-、cd38-、cd45-和hla-g-。在另一种具体的实施方式中,当在允许胚状体样体形成的条件下培养时,所述细胞群体产生一个或多个胚状体样体。在另一种具体的实施方式中,所述胎盘细胞群体是从非干细胞的胎盘细胞中分离出来的。在另一种具体的实施方式中,所述胎盘细胞群体是从不表现出这些特征的胎盘细胞中分离出来的。在某些其他实施方式中,所述分离的胎盘细胞是cd10+、cd29+、cd34-、cd38-、cd44+、cd45-、cd54+、cd90+、sh2+、sh3+、sh4+、ssea3-、ssea4-、oct-4+、hla-g-或abc-p+中的一种或多种。在具体的实施方式中,所述分离的胎盘细胞是cd10+、cd29+、cd34-、cd38-、cd44+、cd45-、cd54+、cd90+、sh2+、sh3+、sh4+、ssea3-、ssea4-和oct-4+。在另一种具体的实施方式中,所述分离的胎盘细胞是cd10+、cd29+、cd34-、cd38-、cd45-、cd54+、sh2+、sh3+和sh4+。在另一种具体的实施方式中,所述分离的胎盘细胞是cd10+、cd29+、cd34-、cd38-、cd45-、cd54+、sh2+、sh3+、sh4+和oct-4+。在另一种具体的实施方式中,所述分离的胎盘细胞是cd10+、cd29+、cd34-、cd38-、cd44+、cd45-、cd54+、cd90+、hla-g-、sh2+、sh3+、sh4+。在另一种具体的实施方式中,所述分离的胎盘细胞是oct-4+和abc-p+。在另一种具体的实施方式中,所述分离的胎盘细胞是sh2+、sh3+、sh4+和oct-4+。在另一种实施方式中,所述分离的胎盘细胞是oct-4+、cd34-、ssea3-和ssea4-。在具体的实施方式中,所述分离的oct-4+、cd34-、ssea3-和ssea4-胎盘细胞另外是cd10+、cd29+、cd34-、cd44+、cd45-、cd54+、cd90+、sh2+、sh3+和sh4+。在另一种实施方式中,所述分离的胎盘细胞是oct-4+和cd34-,以及sh3+或sh4+中的任一种。在另一种实施方式中,所述分离的胎盘细胞是cd34-,以及cd10+、cd29+、cd44+、cd54+、cd90+或oct-4+中的任一种。在另一种实施方式中,在本文所述的方法和组合物中有用的所述分离的胎盘细胞是cd200+和oct-4+。在具体的实施方式中,所述分离的胎盘细胞是cd73+和cd105+。在另一种具体的实施方式中,所述分离的胎盘细胞是hla-g-。在另一种具体的实施方式中,所述分离的cd200+、oct-4+胎盘细胞是cd34-、cd38-或cd45-。在另一种具体的实施方式中,所述分离的cd200+、oct-4+胎盘细胞是cd34-、cd38-和cd45-。在另一种具体的实施方式中,所述分离的cd200+、oct-4+胎盘细胞是cd34-、cd38-、cd45-、cd73+、cd105+和hla-g-。在另一种具体的实施方式中,当胎盘细胞群体在允许胚状体样体形成的条件下培养时,所述分离的cd200+、oct-4+胎盘细胞有利于通过包含所述分离的细胞的胎盘细胞群体产生一个或多个胚状体样体。在另一种具体的实施方式中,所述分离的cd200+、oct-4+胎盘细胞是从非干细胞的胎盘细胞中分离出来的。在另一种具体的实施方式中,所述分离的cd200+、oct-4+胎盘细胞是从不表现出这些特征的胎盘细胞中分离出来的。在另一种实施方式中,在本文所述的方法和组合物中有用的细胞群体是包含(例如,富含)cd200+、oct-4+胎盘细胞的细胞群体。在多种实施方式中,所述细胞群体中至少约10%、至少约20%、至少约30%、至少约40%、至少约50%或至少约60%的细胞是分离的cd200+、oct-4+胎盘细胞。在另一种实施方式中,至少约70%的所述细胞是所述分离的cd200+、oct-4+胎盘细胞。在另一种实施方式中,所述细胞群体中至少约80%、90%、95%或99%的细胞是所述分离的cd200+、oct-4+胎盘细胞。在所述分离的群体的具体实施方式中,所述分离的cd200+、oct-4+胎盘细胞另外是cd73+和cd105+。在另一种具体的实施方式中,所述分离的cd200+、oct-4+胎盘细胞另外是hla-g-。在另一种具体的实施方式中,所述分离的cd200+、oct-4+胎盘细胞另外是cd34-、cd38-和cd45-。在另一种具体的实施方式中,所述分离的cd200+、oct-4+胎盘细胞另外是cd34-、cd38-、cd45-、cd73+、cd105+和hla-g-。在另一种具体的实施方式中,当在允许胚状体样体形成的条件下培养时,所述细胞群体产生一个或多个胚状体样体。在另一种具体的实施方式中,所述细胞群体是从非分离的cd200+、oct-4+胎盘细胞的胎盘细胞中分离出来的。在另一种具体的实施方式中,所述细胞群体是从不表现出这些标志物的胎盘细胞中分离出来的。在另一种实施方式中,在本文所述的方法和组合物中有用的所述分离的胎盘细胞是cd73+、cd105+和hla-g-。在另一种具体的实施方式中,所述分离的cd73+、cd105+和hla-g-胎盘细胞另外是cd34-、cd38-或cd45-。在另一种具体的实施方式中,所述分离的cd73+、cd105+、hla-g-胎盘细胞另外是cd34-、cd38-和cd45-。在另一种具体的实施方式中,所述分离的cd73+、cd105+、hla-g-胎盘细胞另外是oct-4+。在另一种具体的实施方式中,所述分离的cd73+、cd105+、hla-g-胎盘细胞另外是cd200+。在另一种具体的实施方式中,所述分离的cd73+、cd105+、hla-g-胎盘细胞另外是cd34-、cd38-、cd45-、oct-4+和cd200+。在另一种具体的实施方式中,当胎盘细胞群体在允许胚状体样体形成的条件下培养时,所述分离的cd73+、cd105+、hla-g-胎盘细胞在包含所述细胞的胎盘细胞群体中有利于胚状体样体的形成。在另一种具体的实施方式中,所述分离的cd73+、cd105+、hla-g-胎盘细胞是从非分离的cd73+、cd105+、hla-g-胎盘细胞的胎盘细胞中分离出来的。在另一种具体的实施方式中,所述分离的cd73+、cd105+、hla-g-胎盘细胞是从不表现出这些标志物的胎盘细胞中分离出来的。在另一种实施方式中,在本文所述的方法和组合物中有用的细胞群体是包含(例如,富含)分离的cd73+、cd105+和hla-g-胎盘细胞的细胞群体。在多种实施方式中,所述细胞群体中至少约10%、至少约20%、至少约30%、至少约40%、至少约50%或至少约60%的细胞是分离的cd73+、cd105+、hla-g-胎盘细胞。在另一种实施方式中,所述细胞群体中至少约70%的细胞是分离的cd73+、cd105+、hla-g-胎盘细胞。在另一种实施方式中,所述细胞群体中至少约90%、95%或99%的细胞是分离的cd73+、cd105+、hla-g-胎盘细胞。在上述群体的具体实施方式中,所述分离的cd73+、cd105+、hla-g-胎盘细胞另外是cd34-、cd38-或cd45-。在另一种具体的实施方式中,所述分离的cd73+、cd105+、hla-g-胎盘细胞另外是cd34-、cd38-和cd45-。在另一种具体的实施方式中,所述分离的cd73+、cd105+、hla-g-胎盘细胞另外是oct-4+。在另一种具体的实施方式中,所述分离的cd73+、cd105+、hla-g-胎盘细胞另外是cd200+。在另一种具体的实施方式中,所述分离的cd73+、cd105+、hla-g-胎盘细胞另外是cd34-、cd38-、cd45-、oct-4+和cd200+。在另一种具体的实施方式中,所述细胞群体是从非cd73+、cd105+、hla-g-胎盘细胞的胎盘细胞中分离出来的。在另一种具体的实施方式中,所述细胞群体是从不表现出这些标志物的胎盘细胞中分离出来的。在另一种实施方式中,当所述群体在允许胚状体样体形成的条件下培养时,在本文所述的方法和组合物中有用的所述分离的胎盘细胞是cd73+和cd105+并且在包含所述cd73+、cd105+细胞的分离的胎盘细胞群体中有利于一个或多胚状体样体形成。在另一种具体的实施方式中,所述分离的cd73+、cd105+胎盘细胞另外是cd34-、cd38-或cd45-。在另一种具体的实施方式中,所述分离的cd73+、cd105+胎盘细胞另外是cd34-、cd38-和cd45-。在另一种具体的实施方式中,所述分离的cd73+、cd105+胎盘细胞另外是oct-4+。在另一种具体的实施方式中,所述分离的cd73+、cd105+胎盘细胞另外是oct-4+、cd34-、cd38-和cd45-。在另一种具体的实施方式中,所述分离的cd73+、cd105+胎盘细胞是从非所述细胞的胎盘细胞中分离出来的。在另一种具体的实施方式中,所述分离的cd73+、cd105+胎盘细胞是从不表现出这些特征的胎盘细胞中分离出来的。在另一种实施方式中,当所述群体在允许胚状体样体形成的条件下培养时,在本文所述的方法和组合物中有用的细胞群体是包含(例如,富含)作为cd73+、cd105+的分离的胎盘细胞的细胞群体并且在包含所述细胞的分离的胎盘细胞群体中有利于一个或多个胚状体样体的形成。在多种实施方式中,所述细胞群体中至少约10%、至少约20%、至少约30%、至少约40%、至少约50%或至少约60%的细胞是所述分离的cd73+、cd105+胎盘细胞。在另一种实施方式中,所述细胞群体中至少约70%的细胞是所述分离的cd73+、cd105+胎盘细胞。在另一种实施方式中,所述细胞群体中至少约90%、95%或99%的细胞是所述分离的cd73+、cd105+胎盘细胞。在上述群体的具体实施方式中,所述分离的cd73+、cd105+胎盘细胞另外是cd34-、cd38-或cd45-。在另一种具体的实施方式中,所述分离的cd73+、cd105+胎盘细胞另外是cd34-、cd38-和cd45-。在另一种具体的实施方式中,所述分离的cd73+、cd105+胎盘细胞另外是oct-4+。在另一种具体的实施方式中,所述分离的cd73+、cd105+胎盘细胞另外是cd200+。在另一种具体的实施方式中,所述分离的cd73+、cd105+胎盘细胞另外是cd34-、cd38-、cd45-、oct-4+和cd200+。在另一种具体的实施方式中,所述细胞群体是从非所述分离的cd73+、cd105+胎盘细胞的胎盘细胞中分离出来的。在另一种具体的实施方式中,所述细胞群体是从不表现出这些标志物的胎盘细胞中分离出来的。在另一种实施方式中,当所述群体在允许胚状体样体形成的条件下培养时,在本文所述的方法和组合物中有用的所述分离的胎盘细胞是oct-4+并且在包含所述细胞的分离的胎盘细胞群体中有利于一个或多胚状体样体形成。在具体的实施方式中,所述分离的oct-4+胎盘细胞另外是cd73+和cd105+。在另一种具体的实施方式中,所述分离的oct-4+胎盘细胞另外是cd34-、cd38-或cd45-。在另一种具体的实施方式中,所述分离的oct-4+胎盘细胞另外是cd200+。在另一种具体的实施方式中,所述分离的oct-4+胎盘细胞另外是cd73+、cd105+、cd200+、cd34-、cd38-和cd45-。在另一种具体的实施方式中,所述分离的oct-4+胎盘细胞是从非oct-4+胎盘细胞的胎盘细胞中分离出来的。在另一种具体的实施方式中,所述分离的oct-4+胎盘细胞是从不表现出这些特征的胎盘细胞中分离出来的。在另一种实施方式中,当所述群体在允许胚状体样体形成的条件下培养时,在本文所述的方法和组合物中有用的细胞群体是包含(例如,富含)作为oct-4+的分离的胎盘细胞的细胞群体并且在包含所述细胞的分离的胎盘细胞群体中有利于一个或多个胚状体样体的形成。在多种实施方式中,所述细胞群体中至少约10%、至少约20%、至少约30%、至少约40%、至少约50%或至少约60%的细胞是所述分离的oct-4+胎盘细胞。在另一种实施方式中,所述细胞群体中至少约70%的细胞是所述分离的oct-4+胎盘细胞。在另一种实施方式中,所述细胞群体中至少约80%、90%、95%或99%的细胞是所述分离的oct-4+胎盘细胞。在上述群体的具体实施方式中,所述分离的oct-4+胎盘细胞另外是cd34-、cd38-或cd45-。在另一种具体的实施方式中,所述分离的oct-4+胎盘细胞另外是cd34-、cd38-和cd45-。在另一种具体的实施方式中,所述分离的oct-4+胎盘细胞另外是cd73+和cd105+。在另一种具体的实施方式中,所述分离的oct-4+胎盘细胞另外是cd200+。在另一种具体的实施方式中,所述分离的oct-4+胎盘细胞另外是cd73+、cd105+、cd200+、cd34-、cd38-和cd45-。在另一种具体的实施方式中,所述细胞群体是从非所述细胞的胎盘细胞中分离出来的。在另一种具体的实施方式中,所述细胞群体是从不表现出这些标志物的胎盘细胞中分离出来的。在另一种实施方式中,在本文所述的方法和组合物中有用的分离的胎盘细胞是分离的hla-a,b,c+、cd45-、cd133-和cd34-胎盘细胞。在另一种实施方式中,在本文所述的方法和组合物中有用的细胞群体是包含分离的胎盘细胞的细胞群体,其中所述分离的细胞群体中至少约70%、至少约80%、至少约90%、至少约95%或至少约99%的细胞是分离的hla-a,b,c+、cd45-、cd133-和cd34-胎盘细胞。在具体的实施方式中,所述分离的胎盘细胞或分离的胎盘细胞群体是从非hla-a,b,c+、cd45-、cd133-和cd34-胎盘细胞的胎盘细胞中分离出来的。在另一种具体的实施方式中,所述分离的胎盘细胞在来源上是非母体的。在另一种具体的实施方式中,所述分离的胎盘细胞群体基本不含母体成分;例如,所述分离的胎盘细胞群体中至少约40%、45%、50%、55%、60%、65%、70%、75%、90%、85%、90%、95%、98%或99%的所述细胞是非母体来源的。在另一种实施方式中,在本文所述的方法和组合物中有用的分离的胎盘细胞是分离的cd10+、cd13+、cd33+、cd45-、cd117-和cd133-胎盘细胞。在另一种实施方式中,在本文所述的方法和组合物中有用的细胞群体是包含分离的胎盘细胞的细胞群体,其中所述细胞群体中至少约70%、至少约80%、至少约90%、至少约95%或至少约99%的细胞是分离的cd10+、cd13+、cd33+、cd45-、cd117-和cd133-胎盘细胞。在具体的实施方式中,所述分离的胎盘细胞或分离的胎盘细胞群体是从非所述分离的胎盘细胞的胎盘细胞中分离出来的。在另一种具体的实施方式中,所述分离的cd10+、cd13+、cd33+、cd45-、cd117-和cd133-胎盘细胞在来源上是非母体的,即具有胎儿基因型。在另一种具体的实施方式中,所述分离的胎盘细胞群体中至少约40%、45%、50%、55%、60%、65%、70%、75%、90%、85%、90%、95%、98%或99%的所述细胞在来源上是非母体的。在另一种具体的实施方式中,所述分离的胎盘细胞或分离的胎盘细胞群体是从不表现出这些特征的胎盘细胞中分离出来的。在另一种实施方式中,在本文所述的方法和组合物中有用的分离的胎盘细胞是分离的cd10-、cd33-、cd44+、cd45-和cd117-胎盘细胞。在另一种实施方式中,在本文所述的方法和组合物中有用的细胞群体是包含(例如,富含)分离的胎盘细胞的细胞群体,其中所述细胞群体中至少约70%、至少约80%、至少约90%、至少约95%或至少约99%的细胞是分离的cd10-、cd33-、cd44+、cd45-和cd117-胎盘细胞。在具体的实施方式中,所述分离的胎盘细胞或分离的胎盘细胞群体是从非所述细胞的胎盘细胞中分离出来的。在另一种具体的实施方式中,所述分离的胎盘细胞在来源上是非母体的。在另一种具体的实施方式中,所述细胞群体中至少约40%、45%、50%、55%、60%、65%、70%、75%、90%、85%、90%、95%、98%或99%的所述细胞在来源上是非母体的。在另一种具体的实施方式中,所述分离的胎盘细胞或分离的胎盘细胞群体是从不表现出这些标志物的胎盘细胞中分离出来的。在另一种实施方式中,在本文所述的方法和组合物中有用的分离的胎盘细胞是分离的cd10-、cd13-、cd33-、cd45-和cd117-胎盘细胞。在另一种实施方式中,在本文所述的方法和组合物中有用的细胞群体是包含(例如,富含)分离的cd10-、cd13-、cd33-、cd45-和cd117-胎盘细胞的细胞群体,其中所述群体中至少约70%、至少约80%、至少约90%、至少约95%或至少约99%的细胞是cd10-、cd13-、cd33-、cd45-和cd117-胎盘细胞。在具体的实施方式中,所述分离的胎盘细胞或分离的胎盘细胞群体是从非所述细胞的胎盘细胞中分离出来的。在另一种具体的实施方式中,所述分离的胎盘细胞在来源上是非母体的。在另一种具体的实施方式中,所述细胞群体中至少约40%、45%、50%、55%、60%、65%、70%、75%、90%、85%、90%、95%、98%或99%的所述细胞在来源上是非母体的。在另一种具体的实施方式中,所述分离的胎盘细胞或分离的胎盘细胞群体是从不表现出这些特征的胎盘细胞中分离出来的。在另一种实施方式中,在本文所述的方法和组合物中有用的分离的胎盘细胞是hlaa,b,c+、cd45-、cd34-和cd133-,并且另外是cd10+、cd13+、cd38+、cd44+、cd90+、cd105+、cd200+和/或hla-g-,和/或对cd117是阴性的。在另一种实施方式中,在本文所述的方法中有用的细胞群体是包含分离的胎盘细胞的细胞群体,其中所述群体中至少约20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、98%或约99%的细胞是作为hlaa,b,c-、cd45-、cd34-、cd133-的分离的胎盘干细胞,并且另外对cd10、cd13、cd38、cd44、cd90、cd105、cd200是阳性的,和/或对cd117和/或hla-g是阴性的。在具体的实施方式中,所述分离的胎盘细胞或分离的胎盘细胞群体是从非所述细胞的胎盘细胞中分离出来的。在另一种具体的实施方式中,所述分离的胎盘细胞在来源上是非母体的。在另一种具体的实施方式中,所述细胞群体中至少约40%、45%、50%、55%、60%、65%、70%、75%、90%、85%、90%、95%、98%或99%的所述细胞在来源上是非母体的。在另一种具体的实施方式中,所述分离的胎盘细胞或分离的胎盘细胞群体是从不表现出这些标志物的胎盘细胞中分离出来的。在另一种实施方式中,在本文所述的方法和组合物中有用的分离的胎盘细胞是作为cd200+和cd10+的分离的胎盘细胞,如通过抗体结合所确定的,并且是cd117-,如通过抗体结合和rt-pcr两者所确定的。在另一种实施方式中,在本文所述的方法和组合物中有用的所述分离的胎盘细胞是cd10+、cd29-、cd54+、cd200+、hla-g-、mhci类+和β-2-微球蛋白+的分离的胎盘细胞,例如,胎盘干细胞或胎盘多能细胞。在另一种实施方式中,在本文所述的方法和组合物中有用的分离的胎盘细胞是胎盘细胞,其中至少一种细胞标志物的表达比间质干细胞(例如,骨髓源间质干细胞)高至少两倍。在另一种具体的实施方式中,所述分离的胎盘细胞在来源上是非母体的。在另一种具体的实施方式中,所述细胞群体中至少约40%、45%、50%、55%、60%、65%、70%、75%、90%、85%、90%、95%、98%或99%的所述细胞在来源上是非母体的。在另一种实施方式中,在本文所述的方法和组合物中有用的分离的胎盘细胞是分离的胎盘细胞,例如,胎盘干细胞或胎盘多能细胞,即cd10+、cd29+、cd44+、cd45-、cd54/icam+、cd62e-、cd62l-、cd62p-、cd80-、cd86-、cd103-、cd104-、cd105+、cd106/vcam+、cd144/ve-钙粘素low、cd184/cxcr4-、β2-微球蛋白low、mhc-ilow、mhc-ii-、hla-glow和/或pdl1low中的一种或多种。在具体的实施方式中,所述分离的胎盘细胞为至少cd29+和cd54+。在另一种具体的实施方式中,所述分离的胎盘细胞为至少cd44+和cd106+。在另一种具体的实施方式中,所述分离的胎盘细胞为至少cd29+。在另一种实施方式中,在本文所述的方法和组合物中有用的细胞群体包含分离的胎盘细胞,并且所述细胞群体中至少50%、60%、70%、80%、90%、95%、98%或99%的细胞是cd10+、cd29+、cd44+、cd45-、cd54/icam+、cd62-e-、cd62-l-、cd62-p-、cd80-、cd86-、cd103-、cd104-、cd105+、cd106/vcam+、cd144/ve-钙粘素dim、cd184/cxcr4-、β2-微球蛋白dim、hla-idim、hla-ii-、hla-gdim和/或pdl1dim中一种或多种的分离的胎盘细胞。在另一种具体的实施方式中,所述细胞群体中至少50%、60%、70%、80%、90%、95%、98%或99%的细胞是cd10+、cd29+、cd44+、cd45-、cd54/icam+、cd62-e-、cd62-l-、cd62-p-、cd80-、cd86-、cd103-、cd104-、cd105+、cd106/vcam+、cd144/ve-钙粘素dim、cd184/cxcr4-、β2-微球蛋白dim、mhc-idim、mhc-ii-、hla-gdim和pdl1dim。在另一种实施方式中,在本文所述的方法和组合物中有用的分离的胎盘细胞是cd10+、cd29+、cd34-、cd38-、cd44+、cd45-、cd54+、cd90+、sh2+、sh3+、sh4+、ssea3-、ssea4-、oct-4+和abc-p+中的一种或多种或者全部的分离的胎盘细胞,其中abc-p是胎盘特异的abc转运蛋白(也称为乳腺癌耐药蛋白(bcrp)和耐米托蒽醌蛋白(mxr)),其中所述分离的胎盘细胞是通过已排出脐带血并灌注以除去残余血液的哺乳动物(例如,人)胎盘的灌注获得的。在任何上述特征的另一种具体的实施方式中,细胞标志物(例如,分化或免疫原性标志物簇)的表达是通过流式细胞术确定的;在另一种具体的实施方式中,所述标志物的表达是通过rt-pcr确定的。基因谱确认分离的胎盘细胞和分离的胎盘细胞群体与其他细胞(例如,间质干细胞,例如,骨髓源间质干细胞)是可区分的。根据一种或多种基因的表达,本文所述的分离的胎盘细胞可以不同于(例如)间质干细胞,与骨髓源间质干细胞相比,在分离的胎盘细胞或在某些分离的脐带干细胞中所述基因的表达显著更高。具体地,根据一种或多种基因的表达,在本文提供的治疗方法中有用的分离的胎盘细胞可以不同于间质干细胞,当细胞在相同条件下生长时,在所述分离的胎盘细胞中所述基因的表达显著高于(即至少两倍高于)相等个数的骨髓源间质干细胞中的表达,其中所述一种或多种基因为actg2、adarb1、amigo2、arts-1、b4galt6、bche、c11orf9、cd200、col4a1、col4a2、cpa4、dmd、dsc3、dsg2、elovl2、f2rl1、flj10781、gata6、gpr126、gprc5b、hla-g、icam1、ier3、igfbp7、il1a、il6、il18、krt18、krt8、lipg、lrap、matn2、mest、nfe2l3、nuak1、pcdh7、pdlim3、pkp2、rtn1、serpinb9、st3gal6、st6galnac5、slc12a8、tcf21、tgfb2、vtn、zc3h12a或任何上述基因的组合。参见(例如)美国专利申请公开no.2007/0275362,该专利的公开内容以其全部内容作为参考并入本文。在某些具体的实施方式中,通过(例如)rt-pcr或微阵列分析(例如,使用u133-a微阵列(affymetrix))确定了所述一种或多种基因的所述表达。在另一种具体的实施方式中,当在包含dmem-lg(例如,获自gibco);2%胎牛血清(例如,获自hyclonelabs);1×胰岛素-转铁蛋白-硒(its);1×亚油酸-牛血清白蛋白(la-bsa);10-9m地塞米松(例如,获自sigma);10-4m抗坏血酸2-磷酸酯(例如,获自sigma);10ng/ml表皮生长因子(例如,获自r&dsystems);和10ng/ml血小板源性生长因子(pdgf-bb)(例如,获自r&dsystems)的培养基中培养多次群体倍增(例如,约3至约35次之间任何次数的群体倍增)时,所述分离的胎盘细胞表达所述一个或多个基因。在另一种具体的实施方式中,所述分离的胎盘细胞特异的或分离的脐带细胞特异的基因是cd200。这些基因的具体序列以2008年3月的登录号no.nm_001615(actg2)、bc065545(adarb1)、(nm_181847(amigo2)、ay358590(arts-1)、bc074884(b4galt6)、bc008396(bche)、bc020196(c11orf9)、bc031103(cd200)、nm_001845(col4a1)、nm_001846(col4a2)、bc052289(cpa4)、bc094758(dmd)、af293359(dsc3)、nm_001943(dsg2)、af338241(elovl2)、ay336105(f2rl1)、nm_018215(flj10781)、ay416799(gata6)、bc075798(gpr126)、nm_016235(gprc5b)、af340038(icam1)、bc000844(ier3)、bc066339(igfbp7)、bc013142(il1a)、bt019749(il6)、bc007461(il18)、(bc072017)krt18、bc075839(krt8)、bc060825(lipg)、bc065240(lrap)、bc010444(matn2)、bc011908(mest)、bc068455(nfe2l3)、nm_014840(nuak1)、ab006755(pcdh7)、nm_014476(pdlim3)、bc126199(pkp-2)、bc090862(rtn1)、bc002538(serpinb9)、bc023312(st3gal6)、bc001201(st6galnac5)、bc126160或bc065328(slc12a8)、bc025697(tcf21)、bc096235(tgfb2)、bc005046(vtn)和bc005001(zc3h12a)可见于genbank。在某些具体的实施方式中,当细胞在相同条件下生长时,所述分离的胎盘细胞以比相同个数的骨髓源间质干细胞可检测地更高的水平表达actg2、adarb1、amigo2、arts-1、b4galt6、bche、c11orf9、cd200、col4a1、col4a2、cpa4、dmd、dsc3、dsg2、elovl2、f2rl1、flj10781、gata6、gpr126、gprc5b、hla-g、icam1、ier3、igfbp7、il1a、il6、il18、krt18、krt8、lipg、lrap、matn2、mest、nfe2l3、nuak1、pcdh7、pdlim3、pkp2、rtn1、serpinb9、st3gal6、st6galnac5、slc12a8、tcf21、tgfb2、vtn和zc3h12a中的每一个。在具体的实施方式中,所述胎盘细胞以比相同个数的骨髓源间质干细胞(bm-msc)可检测地更高的水平表达cd200和arts1(1型氨肽酶调节子肿瘤坏死因子);arts-1和lrap(白血球源性精氨酸氨肽酶);il6(白介素-6)和tgfb2(转化生长因子β2);il6和krt18(角蛋白18);ier3(即刻早期反应蛋白3)、mest(中胚层特异性转录本同源物)和tgfb2;cd200和ier3;cd200和il6;cd200和krt18;cd200和lrap;cd200和mest;cd200和nfe2l3(核因子(红细胞源2)-样蛋白3);或cd200和tgfb2,其中在培养中所述骨髓源间质干细胞经历了与所述分离的胎盘细胞所经历的传代次数相等的传代次数。在其他具体的实施方式中,所述胎盘细胞以比相同个数的骨髓源间质干细胞bm-msc可检测地更高的水平表达arts-1、cd200、il6和lrap;arts-1、il6、tgfb2、ier3、krt18和mest;cd200、ier3、il6、krt18、lrap、mest、nfe2l3和tgfb2;arts-1、cd200、ier3、il6、krt18、lrap、mest、nfe2l3和tgfb2;或ier3、mest和tgfb2,其中在培养中所述骨髓源间质干细胞经历了与所述分离的胎盘细胞所经历的传代次数相等的传代次数。可以通过标准技术评价上述提及的基因的表达。例如,可以通过常规方法分别选择并构建基于所述基因序列的探针。可以在(例如)包含一种或多种基因的探针的微阵列(例如,affymetrix人基因组u133a2.0阵列或affymetrix人基因组u133plus2.0(santaclara,california))上评价基因的表达。由于可以使用众所周知的标准技术容易地产生对修改的序列特异的探针,因此即使特定genbank登录号的序列被修改,但仍可以评价这些基因的表达。这些基因的表达水平可用于确认分离的胎盘细胞群体的身份,鉴别细胞群体(由于包含至少多个分离的胎盘细胞)等。身份确认的分离的胎盘细胞群体可以是无性系的(例如,分离的胎盘细胞群体是从单个分离的胎盘细胞扩增的),或者是干细胞的混合群体(例如,仅包含从多个分离的胎盘细胞扩增的分离的胎盘细胞的细胞群体),或者是包含如本文所述的分离的胎盘细胞和至少一种其他类型细胞的细胞群体。这些基因的表达水平可用于选择分离的胎盘细胞群体。例如,如果在来自细胞群体的样品中以上所列的一种或多种基因的表达显著高于相等的间质干细胞群体中的表达,则可以选择细胞群体(例如,克隆扩增的细胞)。这种选择可以是来自多个分离的胎盘细胞群体,来自身份未知的多个细胞群体等的群体。可以根据与(例如)间质干细胞对照中所述一种或多种基因的表达水平(例如,相等个数的骨髓源间质干细胞中所述一种或多种基因的表达水平)相比的一种或多种这些基因的表达水平选择分离的胎盘细胞。在一种实施方式中,将包含相等个数的间质干细胞的样品中所述一种或多种基因的表达水平用作对照。在另一种实施方式中,在一定条件下测试的分离的胎盘细胞的对照是表示在所述条件下间质干细胞中所述一种或多种基因的表达水平的数值。在某些实施方式中,在暴露于1至100ng/mlvegf4至21天后,在本文所提供的方法中有用的所述胎盘细胞(例如,pdac)不表达cd34,如通过免疫定位所检测的。在具体的实施方式中,所述胎盘贴壁细胞附着于组织培养塑料。在另一种具体的实施方式中,当在存在血管生成因子(如血管内皮生长因子(vegf)、上皮生长因子(egf)、血小板源生长因子(pdgf)或碱性成纤维细胞生长因子(bfgf))的情况下在(例如)如matrigeltm的基质上培养时,所述细胞群体诱导内皮细胞以形成芽或管样结构。在另一个方面,本文所提供的pdac,细胞群体,例如,pdac群体或其中所述分离的细胞群体中至少约50%、60%、70%、80%、90%、95%或98%的细胞是pdac的细胞群体将vegf、hgf、il-8、mcp-3、fgf2、卵泡抑素、g-csf、egf、ena-78、gro、il-6、mcp-1、pdgf-bb、timp-2、upar或半乳凝素-1中的一种或多种或全部分泌到(例如)其中细胞生长的培养基中。在另一种实施方式中,与含氧量正常的情况(例如,约20%或约21%的o2)相比,pdac在含氧量低的情况(例如,小于约5%的o2)下表达较高水平的cd202b、il-8和/或vegf。在另一种实施方式中,本文所述的任何pdac或包含pdac的细胞群体可以导致在与所述胎盘源贴壁细胞接触的内皮细胞群体中形成芽或管样结构。在具体的实施方式中,例如,当在存在细胞外基质蛋白(如i型和iv型胶原)和/或血管生成因子(如血管内皮生长因子(vegf)、上皮生长因子(egf)、血小板源生长因子(pdgf)或碱性成纤维细胞生长因子(bfgf))的情况下在(例如)如胎盘胶原或matrigeltm的基质中或上培养至少4天时,所述pdac与人内皮细胞共培养,从而形成芽或管样结构或支持内皮细胞出芽。在另一种实施方式中,当在存在细胞外基质蛋白(如i型或iv型胶原)的情况下在(例如)基质(如胎盘胶原或matrigeltm)中或上培养时,本文所述的包含胎盘源贴壁细胞的任何细胞群体分泌血管生成因子,如血管内皮生长因子(vegf)、肝细胞生长因子(hgf)、血小板源生长因子(pdgf)、碱性成纤维细胞生长因子(bfgf)或白细胞介素-8(il-8)并借此可以诱导人内皮细胞形成芽或管样结构。在另一种实施方式中,包含胎盘源贴壁细胞(pdac)的任何上述细胞群体分泌血管生成因子。在具体的实施方式中,所述细胞群体分泌血管内皮生长因子(vegf)、肝细胞生长因子(hgf)、血小板源生长因子(pdgf)、碱性成纤维细胞生长因子(bfgf)和/或白细胞介素-8(il-8)。在其他具体的实施方式中,包含pdac的细胞群体分泌一种或多种血管生成因子并借此诱导人内皮细胞在体外伤口愈合测定中迁移。在其他具体的实施方式中,包含胎盘源贴壁细胞的细胞群体诱导人内皮细胞、内皮祖细胞、肌细胞或成肌细胞成熟、分化或增殖。本文所述的分离的胎盘细胞在原代培养中或者在包含(例如)dmem-lg(gibco)、2%胎牛血清(fcs)(hyclonelaboratories)、1×胰岛素-转铁蛋白-硒(its)、1×亚麻酸-牛血清白蛋白(la-bsa)、10-9m地塞米松(sigma)、10-4m抗坏血酸2-磷酸酯(sigma)、10ng/ml表皮生长因子(egf)(r&dsystems)、10ng/ml血小板源性生长因子(pdgf-bb)(r&dsystems)和100u青霉素/1000u链霉素的培养基中增殖期间显示出上述特征(例如,细胞表面标志物和/或基因表达谱的组合)。在本文所公开的任何胎盘细胞的某些实施方式中,所述细胞是人细胞。在本文所公开的任何胎盘细胞的某些实施方式中,所述细胞标志物特征或基因表达特征是人标志物或人基因。在所述分离的胎盘细胞或包含所述分离的胎盘细胞的细胞群体的另一种具体的实施方式中,所述细胞或群体已扩增,(例如)传代了至少,约或者不超过1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20次或以上,或者增殖了至少,约或者不超过1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49或50次群体倍增。在所述分离的胎盘细胞或包含所述分离的胎盘细胞的细胞群体的另一种具体的实施方式中,所述细胞或群体是原代分离物。在分离的胎盘细胞或包含本文所公开的分离的胎盘细胞的细胞群体的另一种具体的实施方式中,所述分离的胎盘细胞是胎儿来源的(即具有胎儿基因型)。在某些实施方式中,所述分离的胎盘细胞在生长培养基(即,配制以促进增殖的培养基)中培养期间(例如,在生长培养基中增殖期间)不分化。在另一种具体的实施方式中,所述分离的胎盘细胞不需要饲养层来增殖。在另一种具体的实施方式中,仅由于饲养细胞层的缺少,所述分离的胎盘细胞在不存在饲养层的情况下培养时不分化。在另一种实施方式中,在本文所述的方法和组合物中有用的细胞是分离的胎盘细胞,其中多个所述分离的胎盘细胞对醛脱氢酶(aldh)是阳性的,如通过醛脱氢酶活性测定所评价的。这些测定在本领域中是已知的(参见,例如,bostian和betts,biochem.j.,173,787,(1978))。在具体的实施方式中,所述aldh测定使用(aldagen,inc.,ashland,oregon)作为醛脱氢酶活性的标志物。在具体的实施方式中,所述多个是所述细胞群体中约3%至约25%之间的细胞。在另一种实施方式中,本文提供了分离的脐带细胞(例如,多能的分离的脐带细胞)群体,其中多个所述分离的脐带细胞对醛脱氢酶是阳性的,如通过使用作为醛脱氢酶活性指示剂的醛脱氢酶活性测定所评价的。在具体的实施方式中,所述多个是所述细胞群体中约3%至约25%之间的细胞。在另一种实施方式中,所述分离的胎盘细胞或分离的脐带细胞群体显示出比具有大致相同的细胞个数并且在相同条件下培养的骨髓源间质干细胞群体高至少三倍或至少五倍的aldh活性。在包含本文所述的分离的胎盘细胞的任何细胞群体的某些实施方式中,所述细胞群体中的胎盘细胞基本不含具有母体基因型的细胞;例如,在所述群体中至少40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、98%或99%的胎盘细胞具有胎儿基因型。在包含本文所述的分离的胎盘细胞的任何细胞群体的某些其他实施方式中,包含所述胎盘细胞的细胞群体基本不含具有母体基因型的细胞;例如,所述群体中至少40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、98%或99%的细胞具有胎儿基因型。在任何上述分离的胎盘细胞或分离的胎盘细胞的细胞群体的具体实施方式中,所述群体中细胞或至少约95%或约99%的细胞的染色体组型是正常的。在任何上述胎盘细胞或细胞群体的另一个具体实施方式中,所述细胞或细胞群体中的细胞是非母体来源的。可以将具有任何上述标志物组合的分离的胎盘细胞或分离的胎盘细胞的群体以任何比例混合。可以将任何两种或更多种上述分离的胎盘细胞群体混合以形成分离的胎盘细胞群体。例如,分离的胎盘细胞群体可以包含由如上所述的标志物组合之一所定义的第一分离的胎盘细胞群体和由如上所述的标志物组合中另一种所定义的第二分离的胎盘细胞群体,其中所述第一和第二群体以约1:99、2:98、3:97、4:96、5:95、10:90、20:80、30:70、40:60、50:50、60:40、70:30、80:20、90:10、95:5、96:4、97:3、98:2或约99:1的比值混合。以类似的方式,可以将任何三种、四种、五种或更多种上述的分离的胎盘细胞或分离的胎盘细胞群体混合。可以通过(例如)使用或不使用酶促消化(参见5.3.3节)或灌注(参见5.3.4节)的胎盘组织破坏来获得在本文所述的方法和组合物中有用的分离的胎盘细胞。例如,可以根据以下方法产生分离的胎盘细胞群体,所述方法包括灌注已排出脐带血并灌注以除去残余血液的哺乳动物胎盘;用灌注溶液灌注所述胎盘;和收集所述灌注溶液,其中灌注后的所述灌注溶液包含含有分离的胎盘细胞的胎盘细胞群体;和从所述细胞群体分离多个所述分离的胎盘细胞。在具体的实施方式中,将灌注溶液通过脐静脉和脐动脉并在其从胎盘流出后收集。在另一种具体的实施方式中,将灌注溶液通过脐静脉并从脐动脉收集,或者通过脐动脉并从脐静脉收集。在多种实施方式中,包含在得自胎盘灌注的细胞群体内的所述分离的胎盘细胞是所述胎盘细胞群体的至少50%、60%、70%、80%、90%、95%、99%或至少99.5%。在另一种具体的实施方式中,通过灌注收集的分离的胎盘细胞包含胎儿细胞和母体细胞。在另一种具体的实施方式中,通过灌注收集的分离的胎盘细胞是至少50%、60%、70%、80%、90%、95%、99%或至少99.5%的胎儿细胞。在另一种具体的实施方式中,本文提供了包含通过灌注收集的如本文所述的分离的胎盘细胞群体的组合物,其中所述组合物包含用于收集所述分离的胎盘细胞的灌注溶液的至少一部分。可以通过用组织破坏酶消化胎盘组织来产生本文所述的分离的胎盘细胞的分离群体以获得包含所述细胞并且从所述胎盘细胞的剩余物中分离或基本分离了多个胎盘细胞的胎盘细胞群体。可以将全部或任何部分的胎盘消化以获得本文所述的分离的胎盘细胞。在具体的实施方式中,例如,所述胎盘组织可以是整个胎盘、羊膜、绒毛膜、羊膜和绒毛膜的组合或任何上述的组合。在其他具体的实施方式中,所述组织破坏酶是胰蛋白酶或胶原酶。在多种实施方式中,包含在得自水解胎盘的细胞群体内的所述分离的胎盘细胞是所述胎盘细胞群体的至少50%、60%、70%、80%、90%、95%、99%或至少99.5%。如上所述的胎盘细胞的分离的群体和分离的胎盘细胞的群体一般可以包含约、至少或不超过1×105、5×105、1×106、5×106、1×107、5×107、1×108、5×108、1×109、5×109、1×1010、5×1010、1×1011或更多的分离的胎盘细胞。在本文所述的治疗方法中有用的分离的胎盘细胞群体包含至少50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、98%或99%的活的分离的胎盘干细胞,例如,如通过(例如)台盼蓝排阻法所确定的。5.2.3培养中的生长就任何哺乳动物细胞而言,在5.4.2节中本文所述的分离的胎盘细胞的生长部分取决于选择用于生长的特定培养基。在最适条件下,所述分离的胎盘细胞通常在约1天中个数加倍。在培养期间,在培养中本文所述的分离的胎盘细胞贴壁到基质上,例如,组织培养容器(例如,塑料组织培养皿、纤连蛋白涂覆的塑料等)的表面上,并且形成单层。当在适合的条件下培养时,包含本文所述的分离的胎盘细胞的胎盘细胞群体可以形成胚状体样体,即细胞立体簇在贴壁细胞层的顶上生长。胚状体样体内的细胞可以表达与极早期干细胞有关的标志物,例如,oct-4、nanog、ssea3和ssea4。胚状体样体内的细胞通常不附着于培养基质,本文所述的分离的胎盘细胞也不贴壁,但是在培养期间往往保持与贴壁细胞连接。由于在不存在贴壁的分离的胎盘细胞的情况下胚状体样体不形成,因此胚状体样体细胞的活力取决于贴壁的分离的胎盘细胞。因此,贴壁的分离的胎盘细胞有利于包含贴壁的分离的胎盘细胞的胎盘细胞群体中的一种或多种胚状体样体的生长。不希望受理论的束缚,认为胚状体样体细胞在贴壁的分离的胎盘细胞上的生长差不多就像胚胎干细胞在细胞饲养层上生长一样。5.3获得分离的胎盘细胞的方法5.3.1干细胞收集组合物本文还提供了收集和分离胎盘细胞(例如,以上5.2.2节中所述的分离的胎盘细胞)的方法。一般地,这些细胞是使用生理学可用的溶液(例如,细胞收集组合物)从哺乳动物胎盘获得的。在标题为“用于收集胎盘干细胞和保存器官的改良培养基(improvedmediumforcollectingplacentalstemcellsandpreservingorgans)”的相关美国专利申请公开no.2007/0190042中详细描述了示例性的细胞收集组合物,该专利的公开内容以其全部内容作为参考并入本文。细胞收集组合物可以包括适合于细胞(例如,本文所述的分离的胎盘细胞)收集和/或培养的任何生理学可用的溶液,例如,盐溶液(例如,磷酸盐缓冲盐水、克氏液、改良的克氏液、伊格尔氏溶液、0.9%nacl等)、培养基(例如,dmem、h.dmem等)等。细胞收集组合物可以包含趋于维持分离的胎盘细胞的一种或多种成分,即在从收集到培养期间防止分离的胎盘细胞死亡或延缓分离的胎盘细胞死亡、减少细胞群体中死亡的分离的胎盘细胞的数目等。这些成分可以是(例如)细胞凋亡抑制剂(例如,半胱氨酸天冬氨酸酶抑制剂或jnk抑制剂);血管扩张剂(例如,硫酸镁、抗高血压药、心房钠尿肽(anp)、促肾上腺皮质激素、促肾上腺皮质激素释放激素、硝普钠、肼屈嗪、三磷腺苷、腺苷、吲哚美辛或硫酸镁、磷酸二酯酶抑制剂等);坏死抑制剂(例如,2-(1h-吲哚-3-基)-3-戊基氨基-马来酰亚胺、吡咯烷二硫代氨基甲酸盐或氯硝西泮);tnf-α抑制剂;和/或携氧全氟化碳(例如,全氟辛基溴化物、全氟癸基溴化物等)。细胞收集组合物可以包含一种或多种组织降解酶,例如,金属蛋白酶、丝氨酸蛋白酶、中性蛋白酶、核糖核酸酶或脱氧核糖核酸酶等。这些酶包括(但不限于)胶原酶(例如,胶原酶i、ii、iii或iv、得自溶组织梭状芽孢杆菌(clostridiumhistolyticum)的胶原酶等);分散酶、嗜热菌蛋白酶、弹性酶、胰蛋白酶、释放酶、玻璃酸酶等。细胞收集组合物可以包含杀菌或细菌抑制有效量的抗生素。在某些非限制性实施方式中,所述抗生素是大环内酯(例如,妥布霉素)、头孢菌素(例如,头孢氨苄、环己烯胺头孢菌素、头孢呋辛、头孢丙烯、头孢克洛、头孢克肟或头孢羟氨苄)、克拉霉素、红霉素、青霉素(例如、青霉素v)或喹诺酮(例如,氧氟沙星、环丙沙星或诺氟沙星)、四环素、链霉素等。在具体的实施方式中,所述抗生素对革兰氏(+)和/或革兰氏(-)细菌是有活性的,例如,铜绿假单胞菌(pseudomonasaeruginosa)、金黄色葡萄球菌(staphylococcusaureus)等。在一种实施方式中,所述抗生素是庆大霉素,例如,在培养基中的约0.005%至约0.01%(w/v)。细胞收集组合物还可以包含一种或多种下列化合物:腺苷(约1mm至约50mm);d-葡萄糖(约20mm至约100mm);镁离子(约1mm至约50mm);分子量大于20000道尔顿的大分子,在一种实施方式中,其以足以维持内皮完整性和细胞活力的量存在(例如,合成或天然存在的胶体,如葡聚糖的多糖或聚乙二醇,其以约25g/l至约100g/l或者约40g/l至约60g/l存在);抗氧化剂(例如,丁基羟基苯甲醚、丁基羟基甲苯、谷胱甘肽、维生素c或维生素e,其以约25mm至约100mm存在);还原剂(例如,以约0.1mm至约5mm存在的n-乙酰半胱氨酸);防止钙进入细胞的试剂(例如,以约2mm至约25mm存在的维拉帕米);硝酸甘油(例如,约0.05g/l至约0.2g/l);抗凝剂,在一种实施方式中,其以足以帮助防止残余血液凝结的量存在(例如,以约1000单位/升至约100000单位/升的浓度存在的肝素或水蛭素);或含有阿米洛利的化合物(例如,阿米洛利、乙基异丙基阿米洛利、六亚甲基阿米洛利、二甲基阿米洛利或异丁基阿米洛利,其以约1.0μm至约5μm存在)。5.3.2胎盘的收集和处理一般地,在分娩后胎盘娩出后不久回收人胎盘。在优选的实施方式中,在知情同意后并且在获得患者的完整病历并且该病历与胎盘有关后从患者回收胎盘。优选地,病历在产后连续。该病历可用于配合由此收获的胎盘或分离的胎盘细胞的后续使用。例如,根据病历,分离的人胎盘细胞可用于与胎盘有关的婴儿或者婴儿的父母、兄弟或其他亲属的个人化医学。在分离的胎盘细胞的回收之前,优选地除去脐带血和胎盘血。在某些实施方式中,产后回收胎盘中的脐带血。可以对胎盘进行常规脐带血回收过程。通常,借助于重力使用针或插管对胎盘抽血(参见,例如,anderson,美国专利no.5372581;hessel等人,美国专利no.5415665)。通常将针或插管置于脐静脉中,并且可以轻轻地按摩胎盘以帮助从胎盘中排出脐带血。可以通过商业进行这种脐带血回收,例如,lifebankusa,cedarknolls,n.j。优选地,将胎盘重力放血而无需其他操作从而使脐带血回收期间的组织破环程度最小。通常,将胎盘从分娩或生产房间输送到另一个位置(例如,实验室)以用于通过(例如)灌注或组织解离的脐带血回收和干细胞收集。优选地,将胎盘在无菌、隔热的输送装置(将胎盘温度维持在20-28℃之间)中输送,例如,通过将近端脐带夹紧的胎盘置于无菌自封塑料袋中,然后置于保温容器中。在另一种实施方式中,在基本如未决美国专利no.7147626中所述的脐带血收集试剂盒中输送胎盘,该专利的公开内容作为参考并入本文。优选地,在分娩后的4至24小时将胎盘输送到实验室。在某些实施方式中,在脐带血回收之前将近端脐带夹紧,优选地,在胎盘中插入的4-5cm(厘米)内。在其他实施方式中,在脐带血回收后但在胎盘的其他处理前将近端脐带夹紧。在细胞收集前,可以将胎盘储存在无菌条件下和室温或5℃至25℃的温度下。在灌注胎盘以除去任何残留脐带血之前,可以将胎盘储存4至24小时,多至48小时或48小时以上的一段时间。在一种实施方式中,在娩出后约0小时至约2小时收获胎盘。优选地,将胎盘在5℃至25℃的温度下储存在抗凝剂溶液中。适合的抗凝剂溶液在本领域中是熟知的。例如,可以使用肝素或华法令钠溶液。在优选的实施方式中,所述抗凝剂溶液包括肝素溶液(例如,1:1000溶液中的1%(w/w))。优选地,在收集胎盘细胞之前将放血的胎盘储存不超过36小时。在一般地如上所述收集并制备之后,则可以采用任何本领域已知的方式(例如,可以灌注或破坏,例如,用一种或多种组织破坏酶消化)处理哺乳动物胎盘或其部分以获得分离的胎盘细胞。5.3.3胎盘组织的物理破环和酶促消化在一种实施方式中,通过部分或全部器官的物理破环从哺乳动物胎盘中收集干细胞。例如,可以(例如)将胎盘或其部分挤压、剪切、剁碎、切块、切碎、浸软等。然后,可以培养组织以获得分离的胎盘细胞群体。通常,使用(例如)培养基、盐溶液或干细胞收集组合物(参见5.5.1节以及下文)来破坏胎盘组织。在物理破环和/或酶促消化以及干细胞回收之前,可以将胎盘切割成部分。分离的胎盘细胞可以得自羊膜、绒毛膜、脐带、胎盘绒毛叶的全部或部分,或它们的任意组合,包括来自整个胎盘。优选地,分离的胎盘细胞得自包括羊膜和绒毛膜的胎盘组织。通常,可以通过小块胎盘组织(例如,体积为约1、2、3、4、5、6、7、8、9、10、20、30、40、50、60、70、80、90、100、200、300、400、500、600、700、800、900或约1000立方毫米的胎盘组织块)的破环获得分离的胎盘细胞。可以使用任何物理破环方法,但前提条件是所述破环方法在所述器官中留下多个,更优选地大多数,并且更优选地至少60%、70%、80%、90%、95%、98%或99%的活细胞,如通过(例如)台盼蓝排阻法所确定的。一般地,可以在娩出后约前三天内的任何时候从胎盘或其部分收集分离的贴壁胎盘细胞,但优选地在娩出后约8小时至约18小时之间收集。在具体的实施方式中,在适合于分离的胎盘细胞增殖(参见(例如)以下描述胎盘细胞(例如,pdac)培养的5.6节)的组织培养基中培养破坏的组织。在另一种具体的实施方式中,通过胎盘组织的物理破环收集了分离的胎盘细胞,其中所述物理破环包括可以通过利用一种或多种组织水解酶完成的酶促消化。还可以将胎盘或其部分物理破坏并用一种或多种酶水解,并且然后将所得材料浸没或混合到细胞收集组合物中。优选的细胞收集组合物包含一种或多种组织破坏酶。可以用于破坏胎盘组织的酶包括木瓜蛋白酶、脱氧核糖核酸酶、丝氨酸蛋白酶,如胰蛋白酶、糜蛋白酶、胶原酶、分散酶或弹性酶。可以通过血清中的α2微球蛋白抑制丝氨酸蛋白酶,并因此用于消化的媒介通常是不含血清的。通常在酶消化程序中使用edta和脱氧核糖核酸酶以提高细胞回收的效率。优选地,稀释消化物以避免将细胞限制在粘稠的消化液内。可以使用组织消化酶的任意组合。使用胰蛋白酶消化的典型浓度包括0.1%至约2%的胰蛋白酶,例如,约0.25%的胰蛋白酶。蛋白酶可以组合使用,即在相同消化反应中使用两种或更多种蛋白酶,或者可以顺序使用以释放胎盘细胞,例如,胎盘干细胞和胎盘多能细胞。例如,在一种实施方式中,首先用约1至约2mg/ml的适量胶原酶i将胎盘或其部分消化(例如)30分钟,然后以约0.25%的浓度使用胰蛋白酶在37℃消化(例如)10分钟。优选地,在使用其他酶之后,连续使用丝氨酸蛋白酶。在另一种实施方式中,还可以通过将螯合剂(例如,乙二醇双(2-氨基乙醚)-n,n,n',n'-四乙酸(egta)或乙二胺四乙酸(edta))加入至包含干细胞的干细胞收集组合物中,或者加入到其中在干细胞的分离之前用干细胞收集组合物破坏和/或消化组织的溶液中来破坏组织。消化后,用培养基清洗消化物(例如)三次并且将清洗的细胞接种到培养瓶中。然后,通过差异贴壁性分离细胞并鉴别(例如)活力、细胞表面标志物、分化等。将理解当整个胎盘或胎盘的一部分包含胎儿和母体细胞两者时(例如,当胎盘的一部分包含绒毛膜或绒毛叶时),所分离的胎盘细胞可以包含来源于胎儿和母体来源两者的胎盘细胞的混合。当胎盘的一部分不包含或包含个数可忽略的母体细胞(例如,羊膜)时,由此分离的胎盘细胞将几乎只包含胎儿胎盘细胞(也就是说,胎盘细胞具有胎儿基因型)。可以通过差异胰酶消化(参见以下5.3.5节)并随后在一个或多个新培养容器中的新鲜增殖培养基中培养并可选地随后进行第二差异胰酶消化步骤来从破坏的胎盘组织中分离胎盘细胞,例如,以上5.2.2节中所述的胎盘细胞。5.3.4胎盘灌注还可以通过哺乳动物胎盘的灌注获得胎盘细胞,例如,以上5.2.2节中所述的胎盘细胞。例如,在hariri的美国专利no.7045148和no.7255729、在美国专利申请公开no.2007/0275362和no.2007/0190042中公开了灌注哺乳动物胎盘以获得胎盘细胞的方法,以上每篇专利的公开内容以其全部内容作为参考并入本文。可以通过使用(例如)细胞收集组合物作为灌注溶液(例如)通过胎盘脉管系统灌注来收集胎盘细胞。在一种实施方式中,通过将灌注溶液穿过脐动脉和脐静脉之一或两者来灌注哺乳动物胎盘。可以使用(例如)重力流动至胎盘来完成通过胎盘的灌注溶液的流动。优选地,使用泵(例如,蠕动泵)迫使灌注溶液通过胎盘。可以(例如)用连接到无菌连接装置(如,无菌管)的插管(例如,或塑料插管)插入脐静脉。将无菌连接装置连接到灌注歧管。在为灌注做准备时,优选地以使脐动脉和脐静脉位于胎盘最高点的方式定向(例如,悬挂)胎盘。可以通过将灌注液体穿过胎盘脉管系统和周围组织来灌注胎盘。还可以通过将灌注液体穿过脐静脉并从脐动脉收集或者将灌注液体穿过脐动脉并从脐静脉收集来灌注胎盘。在一种实施方式中,例如,同时将脐动脉和脐静脉连接至(例如)通过挠性连接器连接至灌注溶液储罐的吸移管。将灌注溶液通过至脐静脉和动脉。灌注溶液从血管壁流出和/或穿过血管壁至胎盘的周围组织,并且从连接至妊娠期间的母体子宫的胎盘表面收集至适合的开放容器中。还可以将灌注溶液引入通过脐带开口并允许从与母体子宫壁连接的胎盘壁中的开口中流出或渗出。通过这种方法(该方法可以称为“盘”法(“pan”method))收集的胎盘细胞通常是胎儿和母体细胞的混合物。在另一种实施方式中,将灌注溶液通过脐静脉并从脐动脉收集,或者通过脐动脉并从脐静脉收集。通过这种方法(该方法可以称为“封闭回路”法(“closedcircuit”method))收集的胎盘细胞通常几乎只是胎儿细胞。将理解使用盘法(即,其中在灌注液从胎盘母体侧流出后收集灌注液)的灌注导致产生了胎儿和母体细胞的混合。因此,通过该方法收集的细胞可以包含胎儿和母体来源的胎盘细胞(例如,胎盘干细胞或胎盘多能细胞)的混合群体。相反,仅通过封闭回路法中的胎盘脉管系统的灌注(其中灌注液通过一个或两个胎盘血管并仅通过剩余的血管收集)导致收集了几乎只有胎儿来源的胎盘细胞群体。在一种实施方式中,可以如下所示进行封闭回路灌注法。在分娩后约48小时内获得分娩后胎盘。夹紧脐带并在夹子上方切割。可以将脐带丢弃,或加工以回收(例如)脐带干细胞和/或以加工脐带膜用于生产生物材料。可以在灌注期间保留羊膜,或者可以(例如)用手指使用钝器切开将其与绒毛膜分离。如果在灌注之前将羊膜与绒毛膜分离,则可以将其(例如)丢弃或通过酶促消化处理以(例如)获得干细胞或以产生(例如)羊膜生物材料,例如,美国专利申请公开no.2004/0048796中所述的生物材料,该专利的公开内容以其全部内容作为参考并入本文。在(例如)使用消毒纱布清洗胎盘的所有可见血块和残余血液后,通过(例如)部分切割脐带膜以暴露脐带横截面来暴露脐带血管。鉴别血管并通过(例如)将闭合的鳄鱼夹向前通过每根血管的切头来打开血管。然后,将所述装置(例如,连接到灌注装置或蠕动泵的塑料管)插入每根胎盘动脉。所述泵可以是适合于该目的的任何泵,例如,蠕动泵。然后,将连接到无菌收集储罐(例如,血液袋,如250ml收集袋)的塑料管插入胎盘静脉。作为另外一种选择,将连接到泵的管插入胎盘静脉,并将连接到收集储罐的管插入胎盘动脉之一或两者。然后,用大量灌注溶液(例如,约750ml灌注溶液)灌注胎盘。然后,通过(例如)离心作用收集灌注液中的细胞。在某些实施方式中,在灌注以收集胎盘细胞,例如,胎盘干细胞和/或胎盘多能细胞之前,用灌注溶液(例如,100-300ml灌注溶液)灌注胎盘以除去残余血液。在另一种实施方式中,在灌注以收集胎盘细胞之前不用灌注溶液灌注胎盘以除去残余血液。在一种实施方式中,在灌注期间将近端脐带夹紧,并且更优选地,在胎盘中脐带插入的4-5cm(厘米)内夹紧近端脐带。一般地,放血过程中来自哺乳动物胎盘的第一次收集的灌注液被脐带血和/或胎盘血的残留红细胞染色。随着灌注的进行,灌注液变得更无色并且残留的脐带血细胞被清洗出胎盘。一般地,30ml至100ml(毫升)的灌注液满足了初始对胎盘的放血,但是根据观察结果可以使用更多或更少的灌注液。可以根据要收集的细胞数目、胎盘的尺寸、对单个胎盘进行收集的次数等改变用于分离胎盘细胞的灌注液的量。在多个实施方式中,灌注液的量可以为50ml至5000ml、50ml至4000ml、50ml至3000ml、100ml至2000ml、250ml至2000ml、500ml至2000ml或者750ml到2000ml。通常,在放血后用700-800ml的灌注液灌注胎盘。可以在几小时或几天的过程中对胎盘灌注多次。当将胎盘灌注多次时,可以将其在无菌条件下在容器或其他适合的器皿中维持或培养,并用细胞收集组合物或标准灌注溶液(例如,生理盐溶液,如加入或未加入抗凝剂(例如,肝素、华法令钠、香豆素、双香豆素)和/或加入或未加入抗微生物剂(例如,β-巯基乙醇(0.1mm);抗生素,如链霉素(例如,40-100μg/ml)、青霉素(例如,40u/ml)、两性霉素b(例如,0.5μg/ml))的磷酸盐缓冲盐水(“pbs”))灌注。在一种实施方式中,将分离的胎盘维持或培养一段时间而不收集灌注液,从而在灌注液的灌注和收集之前将该胎盘维持或培养1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23或24小时,或者2或3或更多天。可以将灌注的胎盘维持额外的一次或多次,例如,1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24或更多个小时,并用(例如)700-800ml灌注液灌注第二次。可以将胎盘灌注1、2、3、4、5或更多次,例如,每1、2、3、4、5或6小时一次。在优选的实施方式中,重复胎盘的灌注和灌注溶液(例如,细胞收集组合物)的收集直至回收的有核细胞的数目低于100个细胞/毫升。可以在不同的时间点分别进一步处理灌注液以回收时间依赖的细胞(例如,干细胞)群体。还可以将来自不同时间点的灌注液混合。在优选的实施方式中,在娩出后约8小时至约18小时之间收集一次或多次胎盘细胞。优选地,灌注导致收集了比从未用所述溶液灌注并且未处理以获得胎盘细胞(例如,通过组织破环,例如,酶促消化)的哺乳动物胎盘中可获得的数目显著更多的胎盘细胞。在本文的背景中,“显著更多”表示至少多10%。灌注获得了比(例如)从其中已培养了胎盘或其部分的培养基中可分离的胎盘细胞的数目显著更多的胎盘细胞。可以通过用包含一种或多种蛋白酶或其他组织破坏酶的溶液灌注来从胎盘分离胎盘细胞。在具体的实施方式中,使胎盘或其部分(例如,羊膜、羊膜和绒毛膜、胎盘小叶或胎盘绒毛叶、脐带或任何上述部分的组合)恢复至25-37℃,并在200ml培养基中与一种或多种组织破坏酶孵育30分钟。收集来自灌注液的细胞,使其恢复至4℃,并用包含5mmedta、2mm二硫苏糖醇和2mmβ-巯基乙醇的冷抑制剂混合物清洗。几分钟后,用冷的(例如,4℃)干细胞收集组合物清洗胎盘细胞。5.3.5胎盘细胞的分离、分选和鉴别开始,可以通过ficoll梯度离心从其他细胞纯化(即,分离)无论是通过灌注还是通过(例如)酶促消化的物理破环获得的分离的胎盘细胞,例如,以上5.2.2节中所述的细胞。这种离心作用可以按照对于离心速度等的任何标准规程进行。在一种实施方式中,例如,通过在室温下以5000×g离心15分钟从灌注液回收了收集自胎盘的细胞,该离心作用将细胞与(例如)污染碎片和血小板分离。在另一种实施方式中,将胎盘灌注液浓缩至约200ml,轻轻地在聚蔗糖上方成层,并在22℃以约1100×g离心20分钟,并且收集细胞的低密度中间层以用于其他处理。可以将细胞颗粒在新鲜的干细胞收集组合物中或者在适合于细胞维持(例如,干细胞维持)的培养基(例如,含有2u/ml肝素和2mmedta的imdm无血清培养基(gibcobrl,ny))中再悬浮。可以(例如)根据生产商推荐的程序使用lymphoprep(nycomedpharma,oslo,norway)分离总单核细胞部份。可以通过使用(例如)含有0.2%edta(sigma,st.louismo)的0.05%的胰蛋白酶溶液的差异胰酶消化来(例如)进一步或初始分离通过灌注或消化获得的胎盘细胞。差异胰酶消化可能是由于组织培养贴壁的分离的胎盘细胞通常在约5分钟内从塑料表面上分离,而其他贴壁群体通常需要20-30分钟以上的孵育。可以在胰酶消化和使用(例如)胰蛋白酶中和溶液(tns,cambrex)的胰蛋白酶中和后收获分开的胎盘细胞。在贴壁细胞分离的一种实施方式中,将细胞等份(例如,约5-10×106个细胞)分别置于几个t-75烧瓶中,优选地纤连蛋白涂覆的t75烧瓶。在这种实施方式中,可以用可商购的间质干细胞生长培养基(mscgm)(cambrex)培养细胞并将其置于组织培养箱(37℃,5%的co2)中。10到15天后,通过用pbs清洗从烧瓶中除去非贴壁细胞。然后,用mscgm替代pbs。优选地,每天针对多种贴壁细胞类型的存在检验烧瓶,并且具体地,针对成纤维样细胞簇的鉴别与扩增检验烧瓶。可以(例如)通过使用标准细胞检测技术(如流式细胞术、细胞分选、免疫细胞化学(例如,用组织特异或细胞标志物特异的抗体染色)、荧光激活细胞分选(facs)、磁性激活细胞分选(macs))测量形态和细胞表面标志物的变化,通过使用光学或共聚焦显微镜检查法检查细胞形态和/或通过使用本领域中熟知的技术(如pcr和基因表达谱)测量基因表达的变化来监测从哺乳动物胎盘收集的细胞的个数和类型。这些技术也可以用于鉴别对一种或多种特定标志物呈阳性的细胞。例如,使用抗cd34抗体,使用上述技术可以确定细胞是否包含可检测数量的cd34;如果是,则该细胞是cd34+。同样,如果细胞产生通过rt-pcr可检测的足够的oct-4rna或者产生比成体细胞显著更多的oct-4rna,则该细胞是oct-4+。抗细胞表面标志物(例如,cd标志物,如cd34)的抗体和干细胞特异基因(如oct-4)的序列在本领域中是熟知的。可以使用荧光激活细胞分选仪(facs)分选胎盘细胞,特别是已通过ficoll分离、差异贴壁或两者组合分离的细胞。荧光激活细胞分选(facs)是根据颗粒的荧光性能分离包括细胞在内的颗粒的熟知方法(kamarch,1987,methodsenzymol,151:150-165)。各个颗粒中荧光部分的激光激发导致产生少量电荷,其使得正负颗粒与混合物电磁分离。在一种实施方式中,用不同的荧光标记物标记细胞表面标志物特异的抗体或配体。通过细胞分选仪处理细胞,从而允许根据它们与所使用的抗体结合的能力分离细胞。可以将facs分选的颗粒直接沉积到96孔板或384孔板的各个孔中以有利于分离和克隆。在一个分选方案中,根据标志物cd34、cd38、cd44、cd45、cd73、cd105、oct-4和/或hla-g中一种或多种的表达,分选来自胎盘(例如,pdac)的细胞。这可以与根据它们在培养中的贴壁性能选择这些细胞的程序结合完成。例如,可以在根据标志物表达的分选之前或之后完成组织培养塑料贴壁选择。在一种实施方式中,例如,首先根据它们的cd34表达分选细胞;保留cd34-细胞,并且将另外是cd200+和hla-g-的cd34-细胞与所有其他cd34-细胞分离。在另一种实施方式中,根据它们的标志物cd200和/或hla-g的表达分选来自胎盘的细胞;例如,将显示出cd200和缺少hla-g的细胞分离用于以后使用。在具体的实施方式中,可以根据它们的cd73和/或cd105表达,或者通过抗体sh2、sh3或sh4识别的表位,或者cd34、cd38或cd45表达的缺少进一步分选表达(例如)cd200和缺少(例如)hla-g的细胞。例如,在另一种实施方式中,通过cd200、hla-g、cd73、cd105、cd34、cd38和cd45的表达或表达缺少来分选胎盘细胞,并且将cd200+、hla-g-、cd73+、cd105+、cd34-、cd38-和cd45-的胎盘细胞与其他胎盘细胞分离以用于以后使用。在分选的胎盘细胞的任何上述实施方式的具体实施方式中,分选后在细胞群体中保留的至少50%、60%、70%、80%、90%或95%的细胞是所述分离的胎盘细胞。可以根据以上5.2.2节中所述的任何标志物中的一种或多种来分选胎盘细胞。在具体的实施方式中,例如,将(1)附着于组织培养塑料和(2)作为cd10+、cd34-和cd105+的胎盘细胞从其他胎盘细胞中分选(即,分离)出。在另一种具体的实施方式中,将(1)附着于组织培养塑料和(2)作为cd10+、cd34-、cd105+和cd200+的胎盘细胞从其他胎盘细胞中分选(即,分离)出。在另一种具体的实施方式中,将(1)附着于组织培养塑料和(2)作为cd10+、cd34-、cd45-、cd90+、cd105+和cd200+的胎盘细胞从其他胎盘细胞中分选(即,分离)出。相对于胎盘细胞的核苷酸序列基检测,本文所列的标志物序列在公开可用的数据库(如genbank或embl)中是易于获得的。相对于胎盘细胞(例如,胎盘干细胞或胎盘多能细胞)的抗体介导的检测和分选,可以与适合于细胞检测和分选的任何荧光团或其他标记物(例如,荧光激活细胞分选)结合使用对特定标志物特异的任何抗体。相对于特定标志物的抗体/荧光团组合包括(但不限于)抗hla-g(获自serotec,raleigh,northcarolina)、cd10(获自bdimmunocytometrysystems,sanjose,california)、cd44(获自bdbiosciencespharmingen,sanjose,california)和cd105(获自r&dsystemsinc.,minneapolis,minnesota)的异硫氰酸荧光素(fitc)结合的单克隆抗体;抗cd44、cd200、cd117和cd13的藻红蛋白(pe)结合的单克隆抗体(bdbiosciencespharmingen);抗cd33和cd10的藻红蛋白-cy7(pecy7)结合的单克隆抗体(bdbiosciencespharmingen);抗cd38的别藻蓝蛋白(apc)结合的抗生蛋白链菌素和单克隆抗体(bdbiosciencespharmingen);和生物素化的cd90(bdbiosciencespharmingen)。可以使用的其他抗体包括(但不限于)cd133-apc(miltenyi)、kdr-生物素(cd309,abcam)、细胞角蛋白k-fitc(sigma或dako)、hlaabc-fitc(bd)、hladr,dq,dp-pe(bd)、β-2-微球蛋白-pe(bd)、cd80-pe(bd)和cd86-apc(bd)。可以使用的其他抗体/标记物组合包括(但不限于)cd45-percp(藻多甲素叶绿素蛋白);cd44-pe;cd19-pe;cd10-f(荧烷二醇);hla-g-f和7-氨基-放线菌素-d(7-aad);hla-abc-f等。该列表不是完全的,并且来自其他供应商的其他抗体也是可商购的。可以使用(例如)藻红蛋白-cy5(pecy5)结合的抗生蛋白链菌素和抗cd117或cd133的生物素结合的单克隆抗体对cd117或cd133测定本文所提供的分离的胎盘细胞;然而,使用该系统,由于相对高的背景,细胞可以分别表现为对cd117或cd133呈阳性。可以用抗单个标志物的抗体标记分离的胎盘细胞并对其进行检测和/分选。还可以用抗不同标志物的多个抗体同时标记胎盘细胞。在另一种实施方式中,磁珠可用于分离细胞。可以使用磁性激活细胞分选(macs)技术对细胞进行分选,该技术是基于它们结合磁珠(直径为0.5-100μm)的能力分离颗粒的方法。可以对磁性微球体进行多种有用的修饰,其包括特异性识别特定细胞表面分子或半抗原的抗体的共价加成。然后,将珠与细胞混合以使其结合。然后,将细胞通过磁场以分离出具有特异性细胞表面标志物的细胞。在一种实施方式中,然后可以将这些细胞分离并与和抗其他细胞表面标志物的抗体结合的磁珠再混合。将这些细胞再次通过磁场,从而分离出与两种抗体结合的细胞。然后,可以将这些细胞稀释至单独的盘中,如用于无性系分离的微量滴定盘。还可以根据细胞形态和生长特征来鉴别和/或分选分离的胎盘细胞。例如,可以将培养中的分离的胎盘细胞鉴别为具有(例如)成纤维样外观和/或根据(例如)成纤维样外观进行选择。还可以将分离的胎盘细胞鉴定为具有形成胚状体样体的能力和/或根据它们形成胚状体样体的能力进行选择。在一种实施方式中,例如,将处于成纤维样形状,表达cd73和cd105并且在培养中产生一个或多个胚状体样体的胎盘细胞与其他胎盘细胞分离。在另一种实施方式中,将在培养中产生一个或多个胚状体样体的oct-4+胎盘细胞与其他胎盘细胞分离。在另一种实施方式中,可以通过集落形成单位测定鉴别分离的胎盘细胞和显示其特征。集落形成单位测定一般在本领域中是已知的,如mesenculttm培养基(stemcelltechnologies,inc.,vancouverbritishcolumbia)。可以使用本领域中已知的标准技术对分离的胎盘细胞测定活力、增殖潜能和寿命,所述标准技术如台盼蓝排阻测定、荧光素二乙酸酯吸收测定、碘化丙啶吸收测定(以评价活力);和胸苷吸收测定、mtt(3-(4,5-二甲基噻唑-2-基)-2,5-二苯四唑溴化物)细胞增殖测定(以评价增殖)。可以通过本领域中熟知的方法确定寿命,如通过确定扩大培养中群体倍增的最大次数。还可以使用本领域中已知的其他技术将分离的胎盘细胞(例如,以上5.2.2节中所述的分离的胎盘细胞)与其他胎盘细胞分离,所述技术例如所需细胞的选择性生长(阳性选择)、不希望的细胞的选择性破坏(阴性选择);基于混合群体中差异细胞可凝集性的分离,如(例如)使用大豆凝集素;冻融程序;过滤;常规和区带离心;离心淘选(逆流离心作用);单位重力分离;逆流分配;电泳等。5.4分离的胎盘细胞的培养5.4.1培养基分离的胎盘细胞或分离的胎盘细胞群体或从中生长出胎盘细胞的细胞或胎盘组织可以用于引起或接种细胞培养。一般将细胞转移至未用胞外基质或配体涂覆或用其涂覆的无菌组织培养容器中,所述胞外基质或配体如层粘连蛋白、胶原(例如,天然或变性)、明胶、纤连蛋白、鸟氨酸、玻连蛋白、聚赖氨酸、cellstarttm和/或胞外膜蛋白(例如,(bddiscoverylabware,bedford,mass.))或其他适合的生物分子或合成模拟剂。可以在本领域中认为是对细胞(例如,干细胞)培养可用的任何培养基中和任何条件下培养分离的胎盘细胞。优选地,所述培养基包含血清。分离的胎盘细胞可以在(例如)含有its(胰岛素-转铁蛋白-硒)、la+bsa(亚油酸-牛血清白蛋白)、地塞米松l-抗坏血酸、pdgf、egf、igf-1和青霉素/链霉素的dmem-lg(达尔伯克氏改良基础培养基,低葡萄糖)/mcdb201(小鸡成纤维细胞基础培养基);包含10%胎牛血清(fbs)的dmem-hg(高葡萄糖);包含15%fbs的dmem-hg;包含10%fbs、10%马血清和氢化可的松的imdm(伊思考夫改良达尔伯克氏培养基);包含1%至20%fbs、egf和肝素的m199;包含10%fbs、glutamaxtm和庆大霉素的α-mem(最低必需培养基);包含10%fbs、glutamaxtm和庆大霉素的dmem等中培养。其中可用于培养胎盘细胞的其他培养基包括dmem(高或低葡萄糖)、伊格尔基础培养基、汉姆氏f10培养基(f10)、汉姆氏f-12培养基(f12)、伊思考夫改良的达尔伯克氏培养基、间质细胞生长培养基(mscgm)、莱博维茨l-15培养基(liebovitz'sl-15medium)、mcdb、dmem/f12、rpmi1640、高级dmem(gibco)、dmem/mcdb201(sigma)和cell-grofree。所述培养基可以单独或组合补充一种或多种成分,其包括(例如)血清(例如,胎牛血清(fbs),优选地约2-15%(v/v);马(马)血清(es);人血清(hs));β-巯基乙醇(bme),优选地约0.001%(v/v);一种或多种生长因子,例如,血小板源性生长因子(pdgf)、表皮生长因子(egf)、碱性成纤维细胞生长因子(bfgf)、胰岛素样生长因子-1(igf-1)、白血病抑制因子(lif)、血管内皮生长因子(vegf)和促红细胞生成素(epo);氨基酸,其包括l-缬氨酸;和控制微生物污染的一种或多种抗生素和/或抗霉菌剂,如(例如)青霉素、链霉素硫酸盐、两性霉素b、庆大霉素和制霉菌素。可以在标准的组织培养条件下(例如,在组织培养盘或多孔板中)培养分离的胎盘细胞。还可以使用悬滴法培养分离的胎盘细胞。在该方法中,将分离的胎盘细胞以约1×104个细胞/毫升悬浮在约5ml培养基中,并且将一滴或多滴培养基置于组织培养容器(例如,100ml培养皿)盖板内侧上。所述滴可以是来自(例如)多通道吸液管的(例如)单滴或多滴。小心地将所述盖板翻转并置于培养皿底部的上方,所述培养皿底部含有大量液体(例如,足以维持培养皿气氛中湿度的无菌pbs),并且培养干细胞。在一种实施方式中,在存在起维持分离的胎盘细胞中未分化表型的作用的化合物的情况下培养分离的胎盘细胞。在具体的实施方式中,该化合物是取代的3,4-二氢吡啶酚[4,5-d]嘧啶。在另一种具体的实施方式中,该化合物是具有以下化学结构的化合物:该化合物可以(例如)以约1μm至约10μm之间的浓度与分离的胎盘细胞或分离的胎盘细胞群体接触。5.4.2胎盘细胞的扩增和增殖一旦分离的胎盘细胞或分离的胎盘细胞群体(例如,与至少50%的干细胞或干细胞群体通常在体内与之相联系的胎盘细胞分离的胎盘细胞或胎盘细胞群体),则所述细胞或细胞群体可以体外增殖和扩增。例如,可以在组织培养容器(例如,盘、烧瓶、多孔板等)中将分离的胎盘细胞群体培养足以使所述细胞增殖至70-90%汇合(即,直至所述细胞以及它们的子代占据组织培养容器的培养表面积的70-90%)的一段时间。可以将分离的胎盘细胞以允许细胞生长的密度接种到培养容器中。例如,可以将细胞以低密度(例如,约1000至约5000个细胞/平方厘米)至高密度(例如,约50000个细胞/平方厘米或以上)接种。在优选的实施方式中,在空气中存在约0至约5体积%的co2的情况下培养细胞。在一些优选的实施方式中,将细胞在空气中约2至约25%的o2的情况下培养,优选地,在空气中约5至约20%的o2的情况下培养。优选地,将细胞在约25℃至约40℃培养,优选地,在37℃培养。优选地,将细胞在孵育箱中培养。培养基可以是静止的或搅拌的,例如,使用生物反应器。优选地,胎盘细胞(例如,胎盘干细胞或胎盘多能细胞)在低氧胁迫的条件(例如,加入谷胱甘肽、抗坏血酸、过氧化氢酶、维生素e、n-乙酰半胱氨酸等)下生长。一旦获得小于100%(例如,70%至90%)的汇合,则细胞可以传代。例如,可以使用本领域中熟知的技术将细胞酶促处理(例如,胰蛋白酶化)以将它们从组织培养表面上分离。通过吸取除去细胞并对细胞计数后,将约10,000-100,000个细胞/平方厘米传代至含有新鲜培养基的新培养容器中。通常,新的培养基与从中除去分离的胎盘细胞的培养基的类型相同。可以将分离的胎盘细胞传代约,至少或不超过1、2、3、4、5、6、7、8、9、10、12、14、16、18或20次或更多次。5.4.3分离的胎盘细胞群体本文还提供了在本文所述的方法和组合物中有用的分离的胎盘细胞群体,例如,以上5.2.2节中所述的分离的胎盘细胞。分离的胎盘细胞群体可以直接从一个或多个胎盘中分离;即,所述细胞群体可以是包含分离的胎盘细胞的胎盘细胞群体,其中所述分离的胎盘细胞得自或包含在灌注液内,或者得自或包含在破坏的胎盘组织(例如,胎盘组织消化物(即,通过胎盘或其部分的酶促消化获得的细胞收集物))内。还可以培养并扩增本文所述的分离的胎盘细胞以产生分离的胎盘细胞群体。还可以培养并扩增包含分离的胎盘细胞的胎盘细胞群体以产生胎盘细胞群体。在本文所提供的治疗方法中有用的胎盘细胞群体包含分离的胎盘细胞,例如,如本文5.4.2节中所述的分离的胎盘细胞。在多个实施方式中,胎盘细胞群体中至少10%、20%、30%、40%、50%、60%、70%、80%、90%、95%或99%的细胞是所述分离的胎盘细胞。也就是说,分离的胎盘细胞群体可以包含(例如)多至1%、5%、10%、20%、30%、40%、50%、60%、70%、80%、90%的非分离的胎盘细胞的细胞。可以通过(例如)选择表达特定标志物和/或特定培养或形态特征的分离的胎盘细胞而无论其来源于酶促消化或灌注以产生在本文所述的方法和组合物中有用的分离的胎盘细胞群体。在一种实施方式中,例如,本文提供了通过选择(a)附着于基质和(b)表达cd200并且缺少hla-g表达的胎盘细胞并且将所述细胞与其他细胞分离以形成细胞群体的产生细胞群体的方法。在另一种实施方式中,通过选择表达cd200并且缺少hla-g表达的胎盘细胞;并且将所述细胞与其他细胞分离以形成细胞群体产生了细胞群体。在另一种实施方式中,通过选择(a)附着于基质和(b)表达cd73、cd105和cd200的胎盘细胞并且将所述细胞与其他细胞分离以形成细胞群体来产生细胞群体。在另一种实施方式中,通过鉴别表达cd73、cd105和cd200的胎盘细胞并且将所述细胞与其他细胞分离以形成细胞群体来产生细胞群体。在另一种实施方式中,通过选择(a)附着于基质(substrate),并且(b)表达cd200和oct-4的胎盘细胞并且将所述细胞与其他细胞分离以形成细胞群体来产生细胞群体。在另一种实施方式中,通过选择表达cd200和oct-4的胎盘细胞并且将所述细胞与其他细胞分离以形成细胞群体来产生细胞群体。在另一种实施方式中,通过选择(a)附着于基质,(b)表达cd73和cd105,并且(c)当在允许胚状体样体形成的条件下培养所述群体时有利于在胎盘细胞群体中形成一种或多种胚状体样体的胎盘细胞;并且将所述细胞与其他细胞分离以形成细胞群体来产生细胞群体。在另一种实施方式中,通过选择表达cd73和cd105并且当在允许胚状体样体形成的条件下培养所述群体时有利于在胎盘细胞群体中形成一种或多种胚状体样体的胎盘细胞,并且将所述细胞与其他细胞分离以形成细胞群体来产生细胞群体。在另一种实施方式中,通过选择(a)附着于基质,并且(b)表达cd73和cd105并且缺少hla-g的表达的胎盘细胞并且将所述细胞与其他细胞分离以形成细胞群体来产生细胞群体。在另一种实施方式中,通过选择表达cd73和cd105并且缺少hla-g的表达的胎盘细胞并且将所述细胞与其他细胞分离以形成细胞群体来产生细胞群体。在另一种实施方式中,产生细胞群体的方法包括选择(a)附着于基质,(b)表达oct-4,并且(c)当在允许胚状体样体形成的条件下培养所述群体时有利于在包含所述干细胞的胎盘细胞群体中形成一种或多种胚状体样体的胎盘细胞;并且将所述细胞与其他细胞分离以形成细胞群体。在另一种实施方式中,通过选择表达oct-4并且当在允许胚状体样体形成的条件下培养所述群体时有利于在包括所述干细胞的胎盘细胞群体中形成一种或多种胚状体样体的胎盘细胞,并且将所述细胞与其他细胞分离以形成细胞群体来产生细胞群体。在另一种实施方式中,通过选择(a)附着于基质,并且(b)表达cd10和cd105而不表达cd34的胎盘细胞并且将所述细胞与其他细胞分离以形成细胞群体来产生细胞群体。在另一种实施方式中,通过选择表达cd10和cd105而不表达cd34的胎盘细胞并且将所述细胞与其他细胞分离以形成细胞群体来产生细胞群体。在另一种实施方式中,通过选择(a)附着于基质,并且(b)表达cd10、cd105和cd200而不表达cd34的胎盘细胞并且将所述细胞与其他细胞分离以形成细胞群体来产生细胞群体。在另一种实施方式中,通过选择表达cd10、cd105和cd200而不表达cd34的胎盘细胞并且将所述细胞与其他细胞分离以形成细胞群体来产生细胞群体。在另一种具体的实施方式中,通过选择(a)附着于基质,并且(b)表达cd10、cd90、cd105和cd200而不表达cd34和cd45的胎盘细胞并且将所述细胞与其他细胞分离以形成细胞群体来产生细胞群体。在另一种具体的实施方式中,通过选择表达cd10、cd90、cd105和cd200而不表达cd34和cd45的胎盘细胞并且将所述细胞与其他细胞分离以形成细胞群体来产生细胞群体。可以以类似的方式分离或获得包含具有以上5.2.2节中所述的任何标志物组合的胎盘细胞的细胞群体的选择。在任何上述实施方式中,分离的细胞群体的选择另外可以包括选择表达abc-p(胎盘特异性abc转运蛋白;参见,例如,allikmets等人,cancerres.58(23):5337-9(1998))的胎盘细胞。所述方法还可以包括选择表现出对(例如)间质干细胞特异的至少一种特性(例如,cd44的表达、cd90的表达或上述组合的表达)的细胞。在上述实施方式中,所述基质可以是在其上可以完成细胞(例如,分离的胎盘细胞)的培养和/或选择的任何表面。通常,所述基材是塑料,例如,组织培养盘或塑料多孔板。可以用生物分子(例如,层粘连蛋白或纤连蛋白)涂覆组织培养塑料。可以通过细胞选择领域中已知的任何方式对胎盘细胞群体选择细胞(例如,分离的胎盘细胞)。例如,可以在(例如)流式细胞术或facs中使用抗一种或多种细胞表面标志物的抗体选择细胞。可以使用与磁珠结合的抗体完成选择。对某些干细胞相关标志物特异的抗体在本领域中是已知的。例如,抗oct-4(abcam,cambridge,ma)、cd200(abcam)、hla-g(abcam)、cd73(bdbiosciencespharmingen,sandiego,ca)、cd105(abcam;biodesigninternational,saco,me)等的抗体。抗其他标志物的抗体也是可商购的,例如,购自(例如)stemcelltechnologies或biodesigninternational的cd34、cd38和cd45。所述分离的胎盘细胞群体可以包含非干细胞的胎盘细胞或非胎盘细胞的细胞。包含本文所述的胎盘源贴壁细胞的分离的细胞群体可以包含第二种细胞类型,例如,非胎盘源贴壁细胞的胎盘细胞,或例如,非胎盘细胞的细胞。例如,分离的胎盘源贴壁细胞群体可以包含第二种类型细胞的群体(例如,可以与之混合),其中所述第二种类型细胞是(例如)胚胎干细胞、血细胞(例如,胎盘血、胎盘血细胞、脐带血、脐带血细胞、周围血、周围血细胞、来自胎盘血、脐带血或周围血的有核细胞等)、分离自血液的干细胞(例如,分离自胎盘血、脐带血或周围血的干细胞)、来自胎盘灌注液的有核细胞(例如,来自胎盘灌注液的总有核细胞);脐带干细胞、血液源有核细胞群体、骨髓源间质基质细胞、骨髓源间质干细胞、骨髓源造血干细胞、粗骨髓、成体(体细胞)干细胞、包含在组织内的干细胞群体、培养的细胞(例如,培养的干细胞)、完全分化的细胞(例如,软骨细胞、成纤维细胞、羊膜细胞、成骨细胞、肌细胞、心肌细胞等)的群体、外膜细胞等。在具体的实施方式中,包含胎盘源贴壁细胞的细胞群体包含来自脐带的胎盘干细胞或干细胞。在其中第二种类型细胞是血液或血细胞的某些实施方式中,已从所述细胞群体中除去了红血球。在具体的实施方式中,所述第二种类型细胞是造血干细胞。这些造血干细胞可以(例如)包含在未处理的胎盘、脐带血或周围血液中;来自胎盘血、脐带血或周围血液的所有有核细胞中;来自胎盘血、脐带血或周围血液的分离的cd34+细胞群体中;未处理的骨髓中;来自骨髓的所有有核细胞中;来自骨髓的分离的cd34+细胞群体中等。在另一种实施方式中,分离的胎盘源贴壁细胞群体与来自血管系统的多个成体或祖细胞混合。在多种实施方式中,所述细胞是内皮细胞、内皮祖细胞、肌细胞、心肌细胞、外膜细胞、成血管细胞、成肌细胞或心肌母细胞。在另一种实施方式中,第二种细胞类型是在培养中调控以表达与胚胎干细胞有关的多能性和功能的标志物的非胚细胞类型。在上述分离的胎盘源贴壁细胞群体的具体实施方式中,胎盘源贴壁细胞和第二种类型细胞中的任一种或两者与预定的细胞受体是自体同源的或异源的。在另一种具体的实施方式中,所述组合物包含胎盘源贴壁细胞和胚胎干细胞。在另一种具体的实施方式中,所述组合物包含胎盘源贴壁细胞和间质基质细胞或干细胞,例如,骨髓源间质基质细胞或干细胞。在另一种具体的实施方式中,所述组合物包含骨髓源造血干细胞。在另一种具体的实施方式中,所述组合物包含胎盘源贴壁细胞和造血祖细胞,例如,来自骨髓、胎儿血液、脐带血液、胎盘血和/或外周血液的造血祖细胞。在另一种具体的实施方式中,所述组合物包含胎盘源贴壁细胞和成体干细胞。在更具体的实施方式中,所述成体干细胞是神经干细胞、肝脏干细胞、胰腺干细胞、内皮干细胞、心脏干细胞或肌肉干细胞。在其他具体的实施方式中,第二种类型细胞在所述群体中占约、至少或不超过10%、15%、20%、25%、30%、35%、40%、45%或50%的细胞。在其他具体的实施方式中,所述组合物中的pdac在所述组合物中占至少50%、55%、60%、65%、70%、75%、80%、85%或90%的细胞。在其他具体的实施方式中,所述胎盘源贴壁细胞在所述群体中占约、至少或不超过10%、15%、20%、25%、30%、35%、40%或45%的细胞。通过比较每个群体中总有核细胞的个数,可以将分离的胎盘源贴壁细胞群体中的细胞与多个另一种类型细胞(例如,与干细胞群体)以约100000000:1、50000000:1、20000000:1、10000000:1、5000000:1、2000000:1、1000000:1、500000:1、200000:1、100000:1、50000:1、20000:1、10000:1、5000:1、2000:1、1000:1、500:1、200:1、100:1、50:1、20:1、10:1、5:1、2:1、1:1;1:2;1:5;1:10;1:100;1:200;1:500;1:1000;1:2000;1:5000;1:10000;1:20000;1:50000;1:100000;1:500000;1:1000000;1:2000000;1:5000000;1:10000000;1:20000000;1:50000000或约1:100000000的比值混合。也可以将分离的胎盘源贴壁细胞群体中的细胞与多种细胞类型的多个细胞混合。在其他实施方式中,本文所述的胎盘细胞群体(例如,如上所述的pdac)与成骨胎盘贴壁细胞(opac)(例如,2009年8月24日提交的标题为“用胎盘干细胞治疗骨缺损的方法和组合物(methodsandcompositionsfortreatmentofbonedefectswithplacentalstemcells)”的专利申请no.12/546556中所述的opac)混合,或者与羊膜源血管原细胞(amdac)(例如,标题为“羊膜源血管原细胞(amnionderivedangiogeniccells)”的美国专利申请no.12/622352中所述的amdac)混合,以上专利的公开内容以其全部内容作为参考并入本文。5.5胎盘细胞库的产生可以以多种不同的方式培养来自产后胎盘的分离细胞(例如,以上5.2.2节中所述的分离的胎盘细胞)以产生一组分离的胎盘细胞批次,例如,其中一批次是一组可单独施用的剂量。这些批次可以(例如)得自来源于胎盘灌注液的细胞或来源于酶消化胎盘组织的细胞。可以将得自多个胎盘的胎盘细胞批次的组布置在分离的胎盘细胞库中以用于(例如)长期储存。一般地,组织培养贴壁胎盘细胞得自形成种子培养的胎盘材料的初始培养,所述种子培养在控制条件下扩增以形成来自大致相等的加倍次数的细胞群体。优选地,批次来源于单个胎盘组织,但是也可以来源于多个胎盘组织。在一种实施方式中,如下所示获得了胎盘细胞批次。首先,通过(例如)切碎使胎盘组织破裂,用适合的酶(例如,胰蛋白酶或胶原酶(参见,以上5.3.3节))消化。优选地,胎盘组织包括(例如)来自单个胎盘的整个羊膜、整个绒毛膜或两者,也可以仅包含羊膜或绒毛膜中任一种的一部分。将消化的组织培养(例如)约1-3周,优选地约2周。除去非贴壁细胞后,通过(例如)胰酶消化收集所形成的高密度集落。收集这些细胞并在适量的培养基中再悬浮,然后用于种子扩增培养。扩增培养可以是单个细胞培养设备的任何排布,例如,nunctm的细胞工厂(cellfactory)。细胞可以再分裂至任意程度从而以(例如)1×103、2×103、3×103、4×103、5×103、6×103、7×103、8×103、9×103、1×104、1×104、2×104、3×104、4×104、5×104、6×104、7×104、8×104、9×104或10×104个细胞/cm2接种扩增培养。优选地,将约1×103至约1×104个细胞/cm2用于接种每个扩增培养。根据从中获得细胞的特定胎盘,扩增培养的数目可以更多或更少。扩增培养生长直至培养中的细胞密度达到某一值,例如,约1×105个细胞/cm2。此时可以收集细胞并将其冷冻保存,或者可以传代到如上所述的新的扩增培养中。使用前,可以将细胞传代(例如)2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19或20次。优选地,在扩增培养期间,保持群体倍增累计次数的记录。可以将来自培养的细胞扩增2、3、4、5、6、7、8、9、10、12、14、16、18、20、22、24、26、28、30、32、34、36、38或40次倍增,或多至60次倍增。然而,优选地,在将细胞群体分成单个剂量之前,群体倍增次数在约15至约30之间。可以在整个扩增过程中连续培养细胞,或者可以在扩增期间的一个或多个点处冷冻细胞。可以将用于单个剂量的细胞冷冻,例如,冷冻保存以备随后使用。单个剂量可以包含(例如)约100万至约5000万个细胞/ml,并且总计可以包含约106至约1010个细胞。因此,在一种实施方式中,可以通过以下方法制备胎盘细胞库,其包括:将来自人产后胎盘的原代培养胎盘细胞扩增第一多次群体倍增;冷冻保存所述胎盘细胞以形成主细胞库(mastercellbank);将来自所述主细胞库的多个胎盘细胞扩增第二多次群体倍增;冷冻保存所述胎盘细胞以形成工作细胞库(workingcellbank);将来自所述工作细胞库的多个胎盘细胞扩增第三多次群体倍增;并且在单个剂量中冷冻保存所述胎盘细胞,其中所述单个剂量总体组成胎盘细胞库。可选地,可以将来自所述第三多次群体倍增的多个胎盘细胞扩增第四多次群体倍增并在单个剂量中冷冻保存,其中所述单个剂量总体组成胎盘细胞库。在另一种具体的实施方式中,所述原代培养胎盘细胞包含来自胎盘灌注液的胎盘细胞。在另一种具体的实施方式中,所述原代培养胎盘细胞包含来自消化的胎盘组织的胎盘细胞。在另一种具体的实施方式中,所述原代培养胎盘细胞包含来自胎盘灌注液和来自消化的胎盘组织的胎盘细胞。在另一种具体的实施方式中,所述胎盘细胞原代培养中的所有所述胎盘细胞来自相同的胎盘。在另一种具体的实施方式中,所述方法还包括从来自所述工作细胞库的所述多个所述胎盘细胞中选自cd200+或hla-g-胎盘细胞以形成单个剂量的步骤。在另一种具体的实施方式中,所述单个剂量包含约104至约105个胎盘细胞。在另一种具体的实施方式中,所述单个剂量包含约105至约106个胎盘细胞。在另一种具体的实施方式中,所述单个剂量包含约106至约107个胎盘细胞。在另一种具体的实施方式中,所述单个剂量包含约107至约108个胎盘细胞。在另一种具体的实施方式中,所述单个剂量包含约108至约109个胎盘细胞。在另一种具体的实施方式中,所述单个剂量包含约109至约1010个胎盘细胞。在优选的实施方式中,对从中获得胎盘的供体(例如,母体)检测至少一种病原体。如果所述母体对所测试的病原体测试为阳性,则弃去来自所述胎盘的整个批次。可以在胎盘细胞批次生产期间的任何时候进行这种测试,例如,在扩增培养期间。测试其存在性的病原体可以(无限制地)包括甲型肝炎、乙型肝炎、丙型肝炎、丁型肝炎、戊型肝炎、人类免疫缺陷性病毒(i和ii型)、巨细胞病毒、疱疹病毒等。5.6胎盘细胞的保存可以保存分离的胎盘细胞(例如,如以上5.3.2节中所述的分离的胎盘细胞),即可以将它们置于使其长期保存的条件或抑制通过(例如)细胞凋亡或坏死的细胞死亡的条件下。可以使用(例如)包含细胞凋亡抑制剂、坏死抑制剂和/或携氧全氟化碳的组合物保存胎盘细胞,如相关美国专利申请公开no.2007/0190042中所述,该专利的公开内容以其全部内容作为参考并入本文。在一种实施方式中,保存在本文所述的方法和组合物中有用的细胞群体的方法包括将所述细胞群体与包含细胞凋亡抑制剂和携氧全氟化碳的细胞收集组合物接触,其中所述细胞凋亡抑制剂以与未接触细胞凋亡抑制剂的细胞群体相比足以降低或防止细胞群体中细胞凋亡的量和时间存在。在具体的实施方式中,所述细胞凋亡抑制剂是半胱氨酸天冬氨酸酶抑制剂。在另一种具体的实施方式中,所述细胞凋亡抑制剂是jnk抑制剂。在另一种具体的实施方式中,所述jnk抑制剂不调节所述细胞的分化或增殖。在另一种实施方式中,所述细胞收集组合物包含处于分离的相的所述细胞凋亡抑制剂和所述携氧全氟化碳。在另一种实施方式中,所述细胞收集组合物包含处于乳液中的所述细胞凋亡抑制剂和所述携氧全氟化碳。在另一种实施方式中,所述细胞收集组合物另外包含乳化剂,例如,卵磷脂。在另一种实施方式中,所述细胞凋亡抑制剂和所述全氟化碳在与细胞接触时处于约0℃至约25℃之间。在另一种具体的实施方式中,所述细胞凋亡抑制剂和所述全氟化碳在与细胞接触时处于约2℃至10℃之间,或者约2℃至约5℃之间。在另一种具体的实施方式中,在所述细胞群体的输送期间进行所述接触。在另一种具体的实施方式中,在所述细胞群体的冻融期间进行所述接触。可以通过(例如)包括将所述细胞群体与细胞凋亡抑制剂和器官保存化合物接触的方法来保存胎盘细胞群体,其中所述细胞凋亡抑制剂以与未接触细胞凋亡抑制剂的细胞群体相比足以降低或防止所述细胞群体中细胞凋亡的量和时间存在。在具体的实施方式中,所述器官保存化合物是uw溶液(美国专利no.4798824中所述;也称为viaspan;另外参见southard等人,transplantation49(2):251-257(1990))或在stern等人,美国专利no.5552267中所述的溶液,该专利的公开内容以其全部内容作为参考并入本文。在另一种实施方式中,所述器官保存化合物是羟乙基淀粉、乳糖酸、棉子糖或它们的组合。在另一种实施方式中,所述细胞收集组合物另外包含处于两相或作为乳液的携氧全氟化碳。在所述方法的另一种实施方式中,在灌注期间将胎盘细胞与包含细胞凋亡抑制剂和携氧全氟化碳、器官保存化合物或它们的组合的细胞收集组合物接触。在另一种实施方式中,在组织破环处理(例如,酶促消化)期间接触所述细胞。在另一种实施方式中,在通过灌注收集后或在通过组织破环(例如,酶促消化)收集后,将胎盘细胞与所述细胞收集化合物接触。通常,在胎盘细胞收集、富集和分离期间,优选地减少或消除由于缺氧和机械应力所造成的细胞胁迫。因此,在所述方法的另一种实施方式中,在收集、富集或分离期间将细胞或细胞群体在所述保存期间在含氧量低的条件下暴露少于6小时,其中含氧量低的条件是低于正常血氧浓度的氧浓度。在另一种具体的实施方式中,在所述保存期间将所述细胞群体在所述缺氧条件下暴露两小时以下。在另一种具体的实施方式中,在收集、富集或分离期间将所述细胞群体在所述缺氧条件下暴露1小时以下或30分钟以下或不暴露于缺氧条件。在另一种具体的实施方式中,在收集、富集或分离期间未将所述细胞群体暴露于剪切应力。胎盘细胞可以在(例如)小容器(例如,安瓿)中的冷冻保存培养基中冷冻保存。适合的冷冻保存培养基包括(但不限于)包含(例如)生长培养基或细胞冷冻培养基(例如,可商购的细胞冷冻培养基,例如,c2695、c2639或c6039(sigma))的培养基。冷冻保存培养基优选地包含约2%至约15%(v/v)浓度(例如,约10%(v/v))的dmso(二甲亚砜)。冷冻保存培养基可以包含其他试剂,例如,甲基纤维素和/或甘油。优选地,在冷冻保存期间将胎盘细胞以约1℃/min冷却。优选的冷冻保存温度为约-80℃至约-180℃,优选地,约-125℃至约-140℃。在融化使用前,可以将冷冻保存的细胞转移至液氮。在一些实施方式中,例如,一旦安瓿达到约-90℃,则将它们转移至液氮储存区。还可以使用速率控制的冰箱进行冷冻保存。优选地,在约25℃至约40℃的温度下,优选地在约37℃的温度下融化冷冻保存的细胞。5.7包含分离的胎盘细胞的组合物可以将在本文中(例如)5.4.2节中所述的胎盘细胞与在本文所述的方法和组合物中有用的任何生理学可用或医学可用的化合物、组合物或装置混合。在本文所提供的治疗方法中有用的组合物可以包含本文所述的胎盘细胞的任何一种或多种(参见以上5.4.2节)。在某些实施方式中,所述组合物是药物可用组合物,例如,在药物可用载体中包含胎盘细胞的组合物。参见以下5.9.2节。在某些实施方式中,包含分离的胎盘细胞的组合物另外包含基质,例如,脱细胞化基质或合成基质。在另一种具体的实施方式中,所述基质是立体支架。在另一种具体的实施方式中,所述基质包含胶原、明胶、层粘连蛋白、纤连蛋白、果胶、鸟氨酸或玻连蛋白。在另一种具体的实施方式中,所述基质是羊膜或羊膜来源的生物材料。在另一种具体的实施方式中,所述基质包含细胞外膜蛋白。在另一种具体的实施方式中,所述基质包含合成化合物。在另一种具体的实施方式中,所述基质包含生物活性化合物。在另一种具体的实施方式中,所述生物活性化合物是生长因子、细胞因子、抗体或小于5000道尔顿的有机分子。在另一种实施方式中,在本文所提供的治疗方法中有用的组合物包含由任何上述胎盘细胞或任何上述胎盘细胞群体调节的培养基。5.7.1冷冻保存的分离的胎盘细胞可以将在本文所述的方法和组合物中有用的分离的胎盘细胞群体保存(例如,冷冻保存)以备以后使用。用于细胞(如干细胞)冷冻保存的方法在本领域中是熟知的。可以将分离的胎盘细胞群体制备成可易于施用至个体的形式,例如,包含在适合于医学使用的容器内的分离的胎盘细胞群体。这种容器可以是(例如)注射器、无菌塑料袋、烧瓶、罐或从中可以容易地分配分离的胎盘细胞群体的其他容器。例如,所述容器可以是血袋或者是适合于液体静脉内施用至受者的其他医学上可用的塑料袋。在某些实施方式中,所述容器是允许混合细胞群体冷冻保存的容器。所述冷冻保存的分离的胎盘细胞群体可以包含来源于单个供体或多个供体的分离的胎盘细胞。所述分离的胎盘细胞群体可以是与预定受体完全hla匹配的或者是部分或完全hla不匹配的。因此,在一种实施方式中,可以在本文所述的方法中使用处于容器中包含组织培养贴壁胎盘细胞群体的组合物的形式的分离的胎盘细胞。在具体的实施方式中,将分离的胎盘细胞冷冻保存。在另一种具体的实施方式中,所述容器是袋、烧瓶或罐。在另一种具体的实施方式中,所述袋是无菌塑料袋。在另一种具体的实施方式中,所述袋适合于,允许或有利于(例如)通过静脉内输注的所述分离的胎盘细胞群体的静脉内施用。所述袋可以包含互相连接以允许在施用之前或期间所述分离的胎盘细胞和一种或多种其他溶液(例如,药物)混合的多个腔或隔室。在另一种具体的实施方式中,所述组合物包含有利于混合细胞群体冷冻保存的一种或多种化合物。在另一种具体的实施方式中,所述分离的胎盘细胞群体包含在生理学可用的水溶液内。在另一种具体的实施方式中,所述生理学可用的水溶液是0.9%nacl溶液。在另一种具体的实施方式中,所述分离的胎盘细胞群体包含与所述细胞群体的受体hla匹配的胎盘细胞。在另一种具体的实施方式中,所述混合的细胞群体包含与所述细胞群体的受体至少部分hla不匹配的胎盘细胞。在另一种具体的实施方式中,所述分离的胎盘细胞来源于多个供体。在某些实施方式中,所述容器中的分离的胎盘细胞是分离的cd10+、cd34-、cd105+胎盘细胞,其中已将所述细胞冷冻保存并包含在容器内。在具体的实施方式中,所述cd10+、cd34-、cd105+胎盘细胞还是cd200+。在另一种具体的实施方式中,所述cd10+、cd34-、cd105+、cd200+胎盘细胞还是cd45-或cd90+。在另一种具体的实施方式中,所述cd10+、cd34-、cd105+、cd200+胎盘细胞还是cd45-和cd90+。在另一种具体的实施方式中,所述cd34-、cd10+、cd105+胎盘细胞另外是cd13+、cd29+、cd33+、cd38-、cd44+、cd45-、cd54+、cd62e-、cd62l-、cd62p-、sh3+(cd73+)、sh4+(cd73+)、cd80-、cd86-、cd90+、sh2+(cd105+)、cd106/vcam+、cd117-、cd144/ve-钙粘素dim、cd184/cxcr4-、cd200+、cd133-、oct-4+、ssea3-、ssea4-、abc-p+、kdr-(vegfr2-)、hla-a,b,c+、hla-dp,dq,dr-、hla-g-或编程死亡-1配体(pdl1)+中的一种或多种,或它们的任意组合。在另一种具体的实施方式中,所述cd34-、cd10+、cd105+胎盘细胞另外是cd13+、cd29+、cd33+、cd38-、cd44+、cd45-、cd54/icam+、cd62e-、cd62l-、cd62p-、sh3+(cd73+)、sh4+(cd73+)、cd80-、cd86-、cd90+、sh2+(cd105+)、cd106/vcam+、cd117-、cd144/ve-钙粘素dim、cd184/cxcr4-、cd200+、cd133-、oct-4+、ssea3-、ssea4-、abc-p+、kdr-(vegfr2-)、hla-a,b,c+、hla-dp,dq,dr-、hla-g-和编程死亡-1配体(pdl1)+。在某些其他实施方式中,以上所提到的分离的胎盘细胞是分离的cd200+、hla-g-胎盘细胞,其中已将所述细胞冷冻保存并包含在容器内。在另一种实施方式中,所述分离的胎盘细胞是已冷冻保存并包含在容器内的cd73+、cd105+、cd200+细胞。在另一种实施方式中,所述分离的胎盘细胞是已冷冻保存并包含在容器内的cd200+、oct-4+干细胞。在另一种实施方式中,所述分离的胎盘细胞是已冷冻保存并包含在容器内的cd73+、cd105+细胞,并且其中当在使得胚状体样体形成的条件下与胎盘细胞群体培养时,所述分离的胎盘细胞有利于一个或多个胚状体样体形成。在另一种实施方式中,所述分离的胎盘细胞是已冷冻保存并包含在容器内的cd73+、cd105+、hla-g-细胞。在另一种实施方式中,所述分离的胎盘细胞是已冷冻保存并包含在容器内的oct-4+胎盘细胞,并且其中当在使得胚状体样体形成的条件下与胎盘细胞群体培养时,所述细胞有利于一个或多个胚状体样体形成。在另一种具体的实施方式中,以上所提及的分离的胎盘细胞是cd34-、cd10+和cd105+的胎盘干细胞或胎盘多能细胞,如通过流式细胞术(例如,pdac)所检测的。在另一种具体的实施方式中,所述分离的cd34-、cd10+、cd105+胎盘细胞具有分化为神经表型细胞、成骨表型细胞或软骨形成表型细胞的潜能。在另一种具体的实施方式中,所述分离的cd34-、cd10+、cd105+胎盘细胞另外是cd200+。在另一种具体的实施方式中,所述分离的cd34-、cd10+、cd105+胎盘细胞另外是cd90+或cd45-,如通过流式细胞术所检测的。在另一种具体的实施方式中,所述分离的cd34-、cd10+、cd105+胎盘细胞另外是cd90+或cd45-,如通过流式细胞术所检测的。在另一种具体的实施方式中,所述分离的cd34-、cd10+、cd105+、cd200+胎盘细胞另外是cd90+或cd45-,如通过流式细胞术所检测的。在另一种具体的实施方式中,所述cd34-、cd10+、cd105+、cd200+细胞另外是cd90+和cd45-,如通过流式细胞术所检测的。在另一种具体的实施方式中,所述cd34-、cd10+、cd105+、cd200+、cd90+、cd45-细胞另外是cd80-和cd86-,如通过流式细胞术所检测的。在另一种具体的实施方式中,所述cd34-、cd10+、cd105+细胞另外是cd29+、cd38-、cd44+、cd54+、cd80-、cd86-、sh3+或sh4+中的一种或多种。在另一种具体的实施方式中,所述细胞另外是cd44+。在以上任何分离的cd34-、cd10+、cd105+胎盘细胞的具体实施方式中,所述细胞另外是cd117-、cd133-、kdr-(vegfr2-)、hla-a,b,c+、hla-dp,dq,dr-和/或pdl1+中的一种或多种。在任何上述冷冻保存的分离的胎盘细胞的具体实施方式中,所述容器是袋。在多个具体的实施方式中,所述容器包含约,至少或至多1×106个所述分离的胎盘细胞,5×106个所述分离的胎盘细胞,1×107个所述分离的胎盘细胞,5×107个所述分离的胎盘细胞,1×108个所述分离的胎盘细胞,5×108个所述分离的胎盘细胞,1×109个所述分离的胎盘细胞,5×109个所述分离的胎盘细胞,1×1010个所述分离的胎盘细胞或1×1010个所述分离的胎盘细胞。在任何上述冷冻保存群体的其他具体的实施方式中,所述分离的胎盘细胞已传代了约,至少或不超过5次、不超过10次、不超过15次或不超过20次。在任何上述冷冻保存的分离的胎盘细胞的另一种具体的实施方式中,已经在所述容器内扩增了所述分离的胎盘细胞。在某些实施方式中,单个单位剂量的胎盘源贴壁细胞可以包含,在多个实施方式中,约,至少或不超过1×105、5×105、1×106、5×106、1×107、5×107、1×108、5×108、1×109、5×109、1×1010、5×1010、1×1011个或更多个胎盘源贴壁细胞。在某些实施方式中,本文所提供的药物组合物包含含有50%或以上的活细胞的胎盘源贴壁细胞群体(也就是说,所述群体中至少50%的细胞是功能性的或活的)。优选地,在所述群体中至少60%的细胞是有活力的。更优选地,在所述药物组合物中的所述群体中至少70%、80%、90%、95%或99%的细胞是有活力的。5.7.2基因工程胎盘细胞本文还提供了胎盘细胞,例如,以上5.2.2节中所述的任何胎盘多能细胞或胎盘细胞,或者包含这类胎盘细胞的药物组合物,其中所述胎盘细胞已通过基因工程设计以产生与血管生成有关或促进血管生成的重组或外源细胞因子。在某些实施方式中,有利于血管生成的所述蛋白质是肝细胞生长因子(hgf)、血管内皮生长因子(vegf)(例如,vegfd)、成纤维细胞生长因子(fgf)(例如,fgf2)、血管生成素(ang)、表皮生长因子(egf)、上皮中性粒细胞激活蛋白78(ena-78)、卵泡抑素、粒性白细胞集落刺激因子(g-csf)、生长调节致癌基因蛋白(gro)、白细胞介素-6(il-6)、il-8、致轻素、单核细胞趋化蛋白-1(mcp-1)、mcp-3、血小板源性生长因子亚基b(pdgfb)、rantes、转化生长因子β1(tgf-β1)、促血小板生成素(tpo)、金属蛋白酶组织抑制剂1(timp1)、timp2和/或尿激酶纤维蛋白溶酶原活化因子受体(upar)中的一种或多种。可以使用本领域技术人员所知的使用(例如)反转录病毒载体、腺病毒载体、腺相关病毒载体、聚乙二醇或其他方法的基因工程细胞方法。这些包括使用在细胞中输送并表达核酸分子的表达载体。(参见geoddel;基因表达技术:酶学方法(geneexpressiontechnology:methodsinenzymology)185,academicpress,sandiego,calif.(1990))。可以通过常规转化或转染技术将载体dna引入到原核或真核细胞。用于转化或转染宿主细胞的适合的方法可见于sambrook等人的“分子克隆:实验室手册(molecularcloning:alaboratorymanual)”,第二版,coldspringharborlaboratorypress(1989)及其他实验室教科书。可以通过包括病毒转移(其包括dna或rna病毒载体的使用,如(例如)反转录病毒(包括慢病毒)、猿猴病毒40(sv40),腺病毒、辛德毕斯病毒和牛乳头状瘤病毒);化学转移(其包括磷酸钙转染和deae葡聚糖转染法);使用dna加载的膜囊(如,例如,脂质体、红细胞影和原生质体)的膜融合转移;或物理转移技术(如微量注射、电穿孔或裸dna转移)在内的方法通过将dna或rna(例如,编码所关心蛋白的dna或rna)引入到细胞中来基因修饰胎盘细胞,例如,以上5.2节中所述的pdac。可以通过外源dna的插入或通过用外源dna对细胞基因组片段的替换来基因改变胎盘细胞。可以(例如)使用质粒表达载体和核定位序列通过同源重组或通过病毒整合至宿主细胞基因组或通过将dna引入至细胞,具体地引入至细胞核来完成外源dna序列的插入。所述dna可以包含使用某些化学品/药物(例如,四环素)允许所关心蛋白质表达的正或负诱导的一个或多个启动子;在其他实施方式中,所述启动子可以是组成型的。可以使用磷酸钙转染将(例如)含有编码所关心蛋白质的多核苷酸序列的质粒dna引入到细胞中。在某些实施方式中,将dna与氯化钙溶液混合,然后加入至磷酸盐缓冲溶液中。一旦形成沉淀物,则直接将溶液加入至培养细胞。可以将使用dmso或甘油的处理用于改善转染效率,并且可以使用双羟乙基氨基乙烷磺酸盐(bes)来改善稳定转染剂的水平。磷酸钙转染系统是可商购的(例如,promegacorp.,madison,wis.)。还可以使用deae-葡聚糖转染。还可以通过微量注射来基因工程设计分离的胎盘细胞。在某些实施方式中,在光学显微镜下将玻璃微量吸移管导入细胞核中以注射dna或rna。还可以使用电穿孔对胎盘细胞进行基因修饰。在某些实施方式中,将dna或rna加入到培养细胞的悬液中并且将dna/rna细胞悬液置于两个电极之间并进行电脉冲,从而在细胞外膜导致通过穿过膜的气孔的出现所显示的瞬时渗透性。可以使用阳离子脂质体进行dna或rna的脂质体递送以基因修饰所述细胞,所述阳离子脂质体可选地包括二油酰基磷脂酰乙醇胺(dope)或二油酰基磷脂酰胆碱(dopc),例如,(lifetechnologies,inc.)。其他可商购的递送系统包括effectenetm(qiagen)、dotap(rochemolecularbiochemicals)、fugene6tm(rochemolecularbiochemicals)和(promega)。可以将病毒载体用于通过(例如)靶标基因、多核苷酸、反义分子或核糖酶序列向所述细胞的递送来基因改变胎盘细胞。反转录病毒载体对于转导快速分裂细胞是有效的,尽管同样已发展了多种反转录病毒载体来有效地将dna转移到非分裂细胞。反转录病毒载体的包装细胞系是本领域技术人员所知的。在某些实施方式中,反转录病毒dna载体含有两个反转录病毒ltr,从而使得第一ltr位于sv40启动子的5',其可操作地连接至克隆到多克隆位点的靶标基因序列,随后是3'第二ltr。一旦形成,如前所述使用磷酸钙介导的转染将反转录病毒dna载体转移至包装细胞系。病毒产生约48小时后,收获现含有靶标基因序列的病毒载体。使用慢病毒载体、重组疱疹病毒、腺病毒载体或α病毒载体转染细胞的方法在本领域中是已知的。可以在本领域技术人员所知的技术中使用遗传标志物来表明靶细胞的成功转染或转导。例如,已表明水晶水母(aequoreavictoria)的绿色荧光蛋白是鉴别和追踪基因修饰造血细胞的有效标志物。替代性可选择标志物包括β-gal基因、截短型神经生长因子受体或药物可选择性标志物(其包括(但不限于)neo、mtx或潮霉素)。5.7.3药物组合物可以将分离的胎盘细胞群体(例如,pdac)或包含所述分离的胎盘细胞的细胞群体配制到用于在(例如)本文所提供的治疗方法中体内使用的药物组合物中。这些药物组合物包含药物可用载体(例如,盐溶液或用于体内施用的其他可用的生理学可用溶液)中的分离的胎盘细胞群体或含有分离的胎盘细胞的细胞群体。包含本文所述的分离的胎盘细胞的药物组合物可以包含本文其他处所述的任何分离的胎盘细胞群体或分离的胎盘细胞或它们的任意组合。所述药物组合物可以包含胎儿、母体或胎儿和母体两者的分离的胎盘细胞。本文所提供的药物组合物还可以包含得自单个个体或胎盘或者得自多个个体或胎盘的分离的胎盘细胞。本文所提供的药物组合物可以包含任意个数的分离的胎盘细胞。例如,单个单位剂量的分离的胎盘细胞可以包含,在多个实施方式中,约,至少或不超过1×105、5×105、1×106、5×106、1×107、5×107、1×108、5×108、1×109、5×109、1×1010、5×1010、1×1011个或更多个分离的胎盘细胞。本文所提供的药物组合物包含含有50%或以上的活细胞的细胞群体(也就是说,所述群体中至少50%的细胞是功能性的或活的)。优选地,在所述群体中至少60%的细胞是有活力的。更优选地,在所述药物组合物中的所述群体中至少70%、80%、90%、95%或99%的细胞是有活力的。本文所提供的药物组合物可以包含(例如)有利于移植的一种或多种化合物(例如,抗t细胞受体抗体、免疫抑制剂等);稳定剂,如白蛋白、葡聚糖40、明胶、羟乙基淀粉、勃脉力(plasmalyte)等。在一种实施方式中,当配制为可注射溶液时,所述药物组合物包含约1%至1.5%的hsa和约2.5%的葡聚糖。在优选的实施方式中,所述药物组合物在包含5%hsa和10%葡聚糖(可选地包含免疫抑制剂,例如,(例如)10mg/kg的环胞霉素a)的溶液中包含约5×106个细胞/毫升至约2×107个细胞/毫升。在其他实施方式中,所述药物组合物(例如,溶液)包含多种细胞,例如,分离的胎盘细胞,例如,胎盘干细胞或胎盘多能细胞,其中所述药物组合物包含约1.0±0.3×106个细胞/毫升至约5.0±1.5×106个细胞/毫升。在其他实施方式中,所述药物组合物包含约1.5×106个细胞/毫升至约3.75×106个细胞/毫升。在其他实施方式中,所述药物组合物包含约1×106个细胞/毫升至约50×106个细胞/毫升,约1×106个细胞/毫升至约40×106个细胞/毫升,约1×106个细胞/毫升至约30×106个细胞/毫升,约1×106个细胞/毫升至约20×106个细胞/毫升,约1×106个细胞/毫升至约15×106个细胞/毫升或约1×106个细胞/毫升至约10×106个细胞/毫升。在某些实施方式中,所述药物组合物不包含可见的细胞团(即,无大细胞团),或者基本没有这样可见的团块。如本文所使用的,“大细胞团”表示无需放大即可看见(例如,肉眼可见)的细胞聚集体,并且一般地是指大于约150微米的细胞聚集体。在一些实施方式中,所述药物组合物包含约2.5%、3.0%、3.5%、4.0%、4.5%、5.0%、5.5%、6.0%、6.5%、7.0%、7.5%、8.0%、8.5%、9.0%、9.5%或10%葡聚糖,例如,葡聚糖-40。在具体的实施方式中,所述组合物包含约7.5%至约9%的葡聚糖-40。在具体的实施方式中,所述组合物包含约5.5%的葡聚糖-40。在某些实施方式中,所述药物组合物包含约1%至约15%的人血清白蛋白(hsa)。在具体的实施方式中,所述药物组合物包含约1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、11%、12%、13%、14%或15%的hsa。在具体的实施方式中,所述细胞已冷冻保存并融化。在另一种具体的实施方式中,所述细胞已通过70μm至100μm过滤器过滤在另一种具体的实施方式中,所述组合物不包含可见的细胞块。在另一种具体的实施方式中,所述组合物包含少于约200个细胞团/106个细胞,其中所述细胞块仅在显微镜(例如,光学显微镜)下可见。在另一种具体的实施方式中,所述组合物包含少于约150个细胞团/106个细胞,其中所述细胞块仅在显微镜(例如,光学显微镜)下可见。在另一种具体的实施方式中,所述组合物包含少于约100个细胞团/106个细胞,其中所述细胞块仅在显微镜(例如,光学显微镜)下可见。在具体的实施方式中,所述药物组合物包含约1.0±0.3×106个细胞/毫升、约5.5%的葡聚糖-40(w/v)、约10%的hsa(w/v)和约5%的dmso(v/v)。在其他实施方式中,所述药物组合物在包含10%葡聚糖-40的溶液中包含多个细胞,例如,多个分离的胎盘细胞,其中所述药物组合物包含约1.0±0.3×106个细胞/毫升至约5.0±1.5×106个细胞/毫升,并且其中所述组合物不包含肉眼可见的细胞团(即,不包含大细胞团)。在一些实施方式中,所述药物组合物包含约1.5×106个细胞/毫升至约3.75×106个细胞/毫升。在具体的实施方式中,所述细胞已冷冻保存并解冻。在另一种具体的实施方式中,所述细胞已通过70μm至100μm过滤器过滤在另一种具体的实施方式中,所述组合物包含少于约200个微细胞团(即,仅通过放大可见的细胞团)/106个细胞。在另一种具体的实施方式中,所述药物组合物包含少于约150个微细胞团/106个细胞。在另一种具体的实施方式中,所述药物组合物包含少于约100个微细胞团/106个细胞。在另一种具体的实施方式中,所述药物组合物包含小于15%、14%、13%、12%、11%、10%、9%、8%、7%、6%、5%、4%、3%或2%的dmso,或小于1%、0.9%、0.8%、0.7%、0.6%、0.5%、0.4%、0.3%、0.2%或0.1%的dmso。本文还提供了包含细胞的组合物,其中所述组合物是通过本文所公开的方法中的一种产生的。例如,在一种实施方式中,所述药物组合物包含细胞,其中所述药物组合物是通过以下方法产生的,所述方法包括过滤包含胎盘细胞(例如,胎盘干细胞或胎盘多能细胞)的溶液以形成含有过滤的细胞的溶液;例如,在冷冻保存之前用第一溶液将所述含有过滤的细胞的溶液稀释至约1至50×106、1至40×106、1至30×106、1至20×106、1至15×106或1至10×106个细胞/毫升;和用包含葡聚糖但不包含人血清白蛋白(hsa)的第二溶液稀释所得的含有过滤的细胞的溶液以产生所述组合物。在某些实施方式中,所述稀释将达到不超过约15×106个细胞/毫升。在某些实施方式中,所述稀释将达到不超过约10±3×106个细胞/毫升。在某些实施方式中,所述稀释将达到不超过约7.5×106个细胞/毫升。在其他某些实施方式中,如果在稀释之前含有过滤的细胞的溶液包含小于约15×106个细胞/毫升,则过滤是可选的。在其他某些实施方式中,如果在稀释之前含有过滤的细胞的溶液包含小于约10±3×106个细胞/毫升,则过滤是可选的。在其他某些实施方式中,如果在稀释之前含有过滤的细胞的溶液包含小于约7.5×106个细胞/毫升,则过滤是可选的。在具体的实施方式中,将细胞在使用第一稀释溶液的所述稀释和使用所述第二稀释溶液的所述稀释之间冷冻保存。在另一种具体的实施方式中,所述第一稀释溶液包含葡聚糖和hsa。所述第一稀释溶液或第二稀释溶液中的葡聚糖可以是任何分子量的葡聚糖,例如,分子量从约10kda至约150kda的葡聚糖。在一些实施方式中,所述第一稀释溶液或所述第二溶液中的所述葡聚糖为约2.5%、3.0%、3.5%、4.0%、4.5%、5.0%、5.5%、6.0%、6.5%、7.0%、7.5%、8.0%、8.5%、9.0%、9.5%或10%的葡聚糖。在另一种具体的实施方式中,所述第一稀释溶液或所述第二稀释溶液中的葡聚糖是葡聚糖-40。在另一种具体的实施方式中,所述第一稀释溶液和所述第二稀释溶液中的葡聚糖是葡聚糖-40。在另一种具体的实施方式中,所述第一稀释溶液中的所述葡聚糖-40是5.0%的葡聚糖-40。在另一种具体的实施方式中,所述第一稀释溶液中的所述葡聚糖-40是5.5%的葡聚糖-40。在另一种具体的实施方式中,所述第二稀释溶液中的所述葡聚糖-40是10%的葡聚糖-40。在另一种具体的实施方式中,包含hsa的所述溶液中的所述hsa是1至15%的hsa。在另一种具体的实施方式中,包含hsa的所述溶液中的所述hsa为约1%、2%、3%、4%、5%、6%、7%、8%、9%、10%、11%、12%、13%、14%或15%的hsa。在另一种具体的实施方式中,包含hsa的所述溶液中的所述hsa是10%的hsa。在另一种具体的实施方式中,所述第一稀释溶液包含hsa。在另一种具体的实施方式中,所述第一稀释溶液中的所述hsa是10%的hsa。在另一种具体的实施方式中,所述第一稀释溶液包含冷冻保护剂。在另一种具体的实施方式中,所述冷冻保护剂是dmso。在另一种具体的实施方式中,所述第二稀释溶液中的所述葡聚糖-40为约10%的葡聚糖-40。在另一种具体的实施方式中,包含细胞的所述组合物包含约7.5%至约9%的葡聚糖。在另一种具体的实施方式中,所述药物组合物包含约1.0±0.3×106个细胞/毫升至约5.0±1.5×106个细胞/毫升。在另一种具体的实施方式中,所述药物组合物包含约1.5×106个细胞/毫升至约3.75×106个细胞/毫升。在另一种实施方式中,通过以下方法制备了所述药物组合物,其包括(a)在冷冻保存之前,过滤包含胎盘细胞(例如,胎盘干细胞或胎盘多能细胞)的含有细胞的溶液以产生含有过滤的细胞的溶液;(b)以约1至50×106、1至40×106、1至30×106、1至20×106、1至15×106或1至10×106个细胞/毫升冷冻保存所述含有过滤的细胞的溶液中的细胞;(c)融化细胞;和(d)用葡聚糖-40溶液以约1:1至约1:11(v/v)稀释所述含有过滤的细胞的溶液。在某些实施方式中,如果在步骤(a)之前细胞的数目小于约10±3×106个细胞/毫升,则过滤是可选的。在另一种具体的实施方式中,以约10±3×106个细胞/毫升冷冻保存步骤(b)中的细胞。在另一种具体的实施方式中,在包含约5%至约10%的葡聚糖-40和hsa的溶液中冷冻保存步骤(b)中的细胞。在某些实施方式中,步骤(b)中的所述稀释将达到不超过约15×106个细胞/毫升。在另一种实施方式中,通过以下方法制备了所述药物组合物,所述方法包括:(a)将胎盘细胞(例如,胎盘干细胞或胎盘多能细胞)悬浮于包含10%hsa的5.5%葡聚糖-40溶液中以形成含有细胞的溶液;(b)通过70μm过滤器过滤含有细胞的溶液;(c)用包含5.5%葡聚糖-40、10%hsa和5%dmso的溶液将含有细胞的溶液稀释至约1至50×106、1至40×106、1至30×106、1至20×106、1至15×106或1至10×106个细胞/毫升;(d)冷冻保存所述细胞;(e)融化所述细胞;和(f)用10%的葡聚糖-40以1:1至1:11(v/v)稀释含有细胞的溶液。在某些实施方式中,步骤(c)中的所述稀释将达到不超过约15×106个细胞/毫升。在某些实施方式中,步骤(c)中的所述稀释将达到不超过约10±3×106个细胞/毫升。在某些实施方式中,步骤(c)中的所述稀释将达到不超过约7.5×106个细胞/毫升。在另一种实施方式中,通过以下方法制备了包含细胞的所述组合物,所述方法包括:(a)将多个细胞离心以收集所述细胞;(b)将所述细胞在5.5%的葡聚糖-40中再悬浮;(c)将所述细胞离心以收集所述细胞;(d)在包含10%hsa的5.5%的葡聚糖-40溶液中再悬浮所述细胞;(e)通过70μm过滤器过滤所述细胞;(f)在5.5%葡聚糖-40、10%hsa和5%dmso中将细胞稀释至约1至50×106、1至40×106、1至30×106、1至20×106、1至15×106或1至10×106个细胞/毫升;(g)冷冻保存所述细胞;(h)融化所述细胞;和(i)用10%葡聚糖-40以1:1至1:11(v/v)稀释所述细胞。在某些实施方式中,步骤(f)中的所述稀释将达到不超过约15×106个细胞/毫升。在某些实施方式中,步骤(f)中的所述稀释将达到不超过约10±3×106个细胞/毫升。在某些实施方式中,步骤(f)中的所述稀释将达到不超过约7.5×106个细胞/毫升。在其他某些实施方式中,如果细胞个数小于约10±3×106个细胞/毫升,则过滤是可选的。本文所述的组合物(例如,包含分离的胎盘细胞的药物组合物)可以包含任何本文所述的分离的胎盘细胞。可以使用适合于细胞产品施用的其他可注射制剂。在一种实施方式中,所述药物组合物包含在来源上基本或完全是非母体的(即,具有胎儿基因型的)分离的胎盘细胞;例如,至少约90%、95%、98%、99%或约100%在来源上是非母体的。例如,在一种实施方式中,药物组合物包含cd200+和hla-g-;cd73+、cd105+和cd200+;cd200+和oct-4+;cd73+、cd105+和hla-g-;cd73+和cd105+的并且当所述胎盘细胞群体在允许胚状体样体形成的条件下培养时有利于在包含所述分离的胎盘细胞群体的胎盘细胞群体中的一种或多种胚状体样体的形成的分离的胎盘细胞群体,或者包含oct-4+的并且当所述胎盘细胞群体在允许胚状体样体形成的条件下培养时有利于在包含所述分离的胎盘细胞群体的胎盘细胞群体中的一种或多种胚状体样体的形成的分离的胎盘细胞群体;或者上述的组合,其中至少70%、80%、90%、95%或99%的所述分离的胎盘细胞在来源上是非母体的。在另一种实施方式中,药物组合物包含cd10+、cd105+和cd34-;cd10+、cd105+、cd200+和cd34-;cd10+、cd105+、cd200+、cd34-和cd90+或cd45-中至少一种;cd10+、cd90+、cd105+、cd200+、cd34-和cd45-;cd10+、cd90+、cd105+、cd200+、cd34-和cd45-;cd200+和hla-g-;cd73+、cd105+和cd200+;cd200+和oct-4+;cd73+、cd105+和hla-g-;cd73+和cd105+并且当所述胎盘细胞群体在允许胚状体样体形成的条件下培养时有利于在包含所述分离的胎盘细胞的胎盘细胞群体中的一种或多种胚状体样体的形成的分离的胎盘细胞群体,oct-4+的并且当所述胎盘细胞群体在允许胚状体样体形成的条件下培养时有利于在包含所述分离的胎盘细胞的胎盘细胞群体中的一种或多种胚状体样体的形成的分离的胎盘细胞群体;或者cd117-、cd133-、kdr-、cd80-、cd86-、hla-a,b,c+、hla-dp,dq,dr-和/或pdl1+中的一种或多种的分离的胎盘细胞群体;或者上述的组合,其中至少70%、80%、90%、95%或99%的所述分离的胎盘细胞在来源上是非母体的。在具体的实施方式中,所述药物组合物另外包含非得自胎盘的干细胞。本文所提供的所述组合物(例如,药物组合物)中的分离的胎盘细胞可以包含来源于单个供体或多个供体的胎盘细胞。所述分离的胎盘细胞可以是与预定受体完全hla匹配的或者是部分或完全hla不匹配的。5.7.4包含分离的胎盘细胞的基质本文还提供了包含含有胎盘细胞或分离的胎盘细胞群体的基质、水凝胶、支架等的组合物。可以代替液体悬液中的细胞或者除液体悬液中的细胞以外使用这些组合物。可以将本文所述的分离的胎盘细胞接种到天然基质上,例如,胎盘生物材料,如羊膜材料。这种羊膜材料可以是(例如)直接从哺乳动物胎盘上切下的羊膜;固定或热处理的羊膜、基本干燥(即,<20%的h2o)的羊膜、绒毛膜、基本干燥的绒毛膜、基本干燥的羊膜和绒毛膜等。在hariri,美国专利申请公开no.2004/0048796中描述了可以在其上接种分离的胎盘细胞的优选的胎盘生物材料,该专利的公开内容以其全部内容作为参考并入本文。可以将本文所述的分离的胎盘细胞悬浮在适合于(例如)注射的水凝胶溶液中。适合于这些组合物的水凝胶包括自组装肽,如rad16。在一种实施方式中,可以使包含细胞的水凝胶溶液在(例如)模具中硬化以形成具有分散于其中的细胞的移植用基质。还可以培养该基质中的分离的胎盘细胞从而使细胞在植入前通过有丝分裂扩增。水凝胶是(例如)通过共价键、离子键或氢键交联以产生捕获水分子以形成凝胶的立体开放网格结构的(天然或合成)有机聚合物。水凝胶形成材料包括多糖(如海藻酸盐及其盐)、肽、聚磷嗪和聚丙烯酸酯,它们通过阴离子交联或者是嵌段聚合物(如聚环氧乙烷-聚丙二醇嵌段共聚物),其分别是通过温度或ph交联的。在一些实施方式中,所述水凝胶或基质是生物可降解的。在一些实施方式中,所述制剂包括原位可聚合凝胶(参见,例如,美国专利申请公开2002/0022676,该专利的公开内容以其全部内容作为参考并入本文,anseth等人,j.controlrelease,78(1-3):199-209(2002);wang等人,biomaterials,24(22):3969-80(2003))。在一些实施方式中,具有带电侧基的聚合物或其一价离子盐在水溶液(如水、缓冲盐溶液或酒精水溶液)中至少是部分可溶的。具有可以与阳离子反应的酸性侧基的聚合物的实例是聚(磷腈)、聚(丙烯酸)、聚(甲基丙烯酸)、丙烯酸和甲基丙烯酸的共聚物、聚(醋酸乙烯酯)和磺化聚合物,如磺化聚苯乙烯。还可以使用具有通过丙烯酸或甲基丙烯酸与乙烯基醚单体或聚合物反应形成的酸性侧基的共聚物。酸性基团的实例是羧基、磺酸基、卤化(优选地,氟化)醇基、酚oh基和酸性oh基。在具体的实施方式中,所述基质是毡制物,其可以由生物可吸收材料(例如,pga、pla、pcl共聚物或共混物)或者透明质酸制成的复丝组成。使用由卷曲、切割、梳理和针刺组成的标准纺织加工技术将纱制成毡制物。在另一个优选的实施方式中,将本发明的细胞接种到可以是复合结构的泡沫支架上。另外,可以将立体框架塑模成有用的形状,如体内待修复、替换或扩大的具体结构。可以使用的支架的其他实例包括非纺织垫、多孔泡沫或自组装肽。可以使用由乙醇酸和乳酸(例如,pga/pla)的合成可吸收共聚物(vicryl,ethicon,inc.,somerville,n.j.)组成的纤维来形成非纺织垫。还可以将通过如冷冻干燥或冻干法(参见,例如,美国专利no.6355699)的工艺所形成的由(例如)聚(ε-己内酯)/聚(羟基乙酸)(pcl/pga)共聚物组成的泡沫用作支架。可以将本文所述的分离的胎盘细胞或其共培养接种到立体框架或支架上并体内植入。可以将该框架与任何一种或多种生长因子、细胞、药物或(例如)刺激组织形成的其他组分结合植入。可以使用的支架的实例包括非纺织垫、多孔泡沫或自组装肽。可以使用由乙醇酸和乳酸(例如,pga/pla)的合成可吸收共聚物(vicryl,ethicon,inc.,somerville,n.j.)组成的纤维来形成非纺织垫。还可以将通过如冷冻干燥或冻干法(参见,例如,美国专利no.6355699)的工艺所形成的由(例如)聚(ε-己内酯)/聚(羟基乙酸)(pcl/pga)共聚物组成的泡沫用作支架。在另一种实施方式中,可以将分离的胎盘细胞接种到毡制物上或者与毡制物接触,所述毡制物可以由(例如)生物可吸收材料(如pga、pla、pcl共聚物或共混物)或者透明质酸制成的复丝组成。在另一种实施方式中,可以将本文所提供的分离的胎盘细胞接种到可以是复合结构的泡沫支架上。可以将这些泡沫支架塑模成有用的形状,如在体内待修复、替换或扩大的具体结构的一部分。在一些实施方式中,在细胞接种之前用(例如)0.1m乙酸处理所述框架,然后在聚赖氨酸、pbs和/或胶原中孵育以提高细胞附着。可以(如)通过血浆涂覆基质或一种或多种蛋白(例如,胶原、弹性纤维、网状纤维)、糖蛋白、糖胺聚糖(例如,硫酸肝素、4-硫酸软骨素、6-硫酸软骨素、硫酸皮肤素、硫酸角蛋白等)、细胞基质和/或其他材料(如,但不限于,明胶、海藻酸盐、琼脂、琼脂糖和植物树胶等)的加入来修饰基质的外表面以改善细胞的附着或生长和组织的分化。在一些实施方式中,所述支架包含使其为非血栓形成性的材料或用该材料处理。这些处理和材料还可以促进并保持内皮的生长、迁移和胞外基质的沉积。这些材料和处理的实例包括(但不限于)天然材料,如基底膜蛋白(如层粘连蛋白和iv型胶原蛋白);合成材料,如eptfe和嵌段聚氨酯脲硅酮(polyurethaneureasilicones),如purspantm(thepolymertechnologygroup,inc.,berkeley,calif.)。所述支架还可以包含抗血栓形成试剂,如肝素;还可以在用分离的胎盘细胞接种之前处理所述支架以改变表面电荷(例如,用血浆涂覆)。还可以将本文所提供的胎盘细胞(例如,pdac)接种到生理学可用的陶瓷材料上或与之接触,所述陶瓷材料包括(但不限于)磷酸一钙、磷酸二钙、磷酸三钙、α-磷酸三钙、β-磷酸三钙和磷酸四钙、羟基磷灰石、氟磷灰石、硫酸钙、氟化钙、氧化钙、碳酸钙、磷酸镁钙、生物活性玻璃(如)及其混合物+目前可商购的多孔生物相容性陶瓷材料包括(canmedicacorp.,canada)、(merckbiomaterialfrance,france)、(mathys,ag,bettlach,switzerland)和矿化胶原骨移植产品,如healostm(depuy,inc.,raynham,ma)和rhakosstm和(orthovita,malvern,pa.)。所述框架可以是天然和/或合成材料的混合物、共混物或复合材料。在一种实施方式中,将分离的胎盘细胞以约0.5×106至约8×106个细胞/毫升接种到适合的支架上或与之接触。5.8永生化胎盘细胞系可以通过用含有生长促进基因(即编码在适合的条件下促进转染细胞生长的蛋白的基因)的任何适合载体转染使哺乳动物胎盘细胞(例如,pdac)有条件地永生化,从而生长促进蛋白的产生和/或活性是通过外部因素可调控的。在优选的实施方式中,所述生长促进基因是致癌基因,如(但不限于)v-myc、n-myc、c-myc、p53、sv40大t抗原、多瘤大t抗原、e1a腺病毒或人乳头状瘤病毒的e7蛋白。可以通过将生长促进基因置于外部可调控启动子(例如,可以通过(例如)改变转染细胞的温度或与所述细胞接触的培养基的组成来控制其活性的启动子)的控制之下来实现生长促进蛋白的外部调控。在一种实施方式中,可以使用四环素(tet)控制的基因表达系统(参见gossen等人,proc.natl.acad.sci.usa89:5547-5551,1992;hoshimaru等人,proc.natl.acad.sci.usa93:1518-1523,1996)。在不存在tet的情况下,该载体内的tet控制的反式激活因子(tta)强烈激活从phcmv*-1(融合至tet操纵子序列的来自人巨细胞病毒的最小启动子)的转录。tta是大肠杆菌(escherichiacoli.)的转座子-10源tet耐受操纵子的抑制因子(tetr)和单纯疱疹病毒vp16的酸性域的融合蛋白。低、无毒浓度的tet(例如,0.01-1.0μg/ml)几乎完全消除了tta的反式激活。在一种实施方式中,所述载体还含有编码可选择标志物(例如,赋予抗药性的蛋白)的基因。细菌新霉素抗性基因(neor)是可以在本发明方法中使用的一个这种标志物。可以通过本领域技术人员已知的方式选择具有neor的细胞,如向生长培养基中加入(例如)100-200μg/ml的g418。可以通过本领域技术人员已知的任何多种方式来实现转染,其包括(但不限于)反转录病毒感染。一般地,可以通过与从载体的生产细胞系收集的条件培养基和含有n2添加剂的dmem/f12的混合物孵育来转染细胞培养。例如,可以在(例如)体外五天后通过在一体积条件培养基和两体积含有n2添加剂的dmem/f12中孵育约20小时来感染如上所述制备的胎盘细胞培养。然后,可以如上所述选择具有可选择标志物的转染细胞。转染后,将培养传代至允许增殖(例如,允许至少30%的细胞在24小时的周期内倍增)的表面上。优选地,所述基材是由用聚鸟氨酸(10μg/ml)和/或层粘连蛋白(10μg/ml)涂覆的组织培养塑料组成的聚鸟氨酸/层粘连蛋白基材、聚赖氨酸/层粘连蛋白基材或用纤连蛋白处理的表面。然后,每3-4天用可以或可以不补充一种或多种增殖增强因子的生长培养基饲养培养物。当培养小于50%汇合时,可以将增殖增强因子加入至生长培养基。当80-95%汇合时,可以使用标准技术(如通过胰酶消化)使条件永生化胎盘细胞系传代。在一些实施方式中,直至约第二十次传代,维持选择(例如,通过对含有新霉素抗性基因的细胞加入g418)是有益的。还可以将细胞在液氮中冷冻以用于长期储存。可以从如上所述制备的条件永生化人胎盘细胞系分离无性细胞系。一般地,可以使用标准技术(如通过限度稀释或使用克隆环)分离这些无性细胞系并扩增。一般地,可以如上所述饲养无性细胞系并使其传代。一般地,可以通过在有利于分化的培养条件下抑制生长促进蛋白的产生和/或活性来诱导条件永生化人胎盘细胞系(其可以但不需要是无性系)分化。例如,如果编码生长促进蛋白的基因受外界可调控启动子的控制,则可以改变条件(例如,温度或培养基组成)以抑制所述生长促进基因的转录。对于以上所讨论的四环素控制基因表达系统,可以通过四环素的加入来抑制生长促进基因的转录从而实现分化。一般地,4-5天的1μg/ml的四环素足以引起分化。为了促进进一步分化,可以在生长培养基中包含其他试剂。5.9试剂盒在另一个方面,本文提供了适合于患有循环系统疾病或病症的个体的治疗的试剂盒,其包括处于与其余试剂盒内容物分离的容器内的组织培养贴壁多能胎盘细胞,例如,胎盘干细胞或胎盘多能细胞,例如,在以上5.2节中所述的细胞(pdac)以及使用说明。优选地,在药物可用溶液(例如,适合于病灶内施用的溶液或适合于静脉内施用的溶液)中提供了所述胎盘细胞。在某些实施方式中,所述胎盘干细胞或胎盘多能细胞是任何本文所述的cd10+、cd34-、cd105+胎盘细胞,例如,cd10+、cd34-、cd105+、cd200+胎盘细胞或cd10+、cd34-、cd45-、cd90+、cd105+、cd200+胎盘细胞。在某些实施方式中,所述试剂盒包含有利于胎盘细胞向所述个体递送的一种或多种组分。例如,在某些实施方式中,所述试剂盒包含有利于所述胎盘细胞向所述个体病灶内递送的组分。在这些实施方式中,所述试剂盒可以包含(例如)适合于细胞向所述个体递送的注射器和针等。在这些实施方式中,所述胎盘细胞可以包含在试剂盒中的袋或一个或多个小瓶中。在某些其他实施方式中,所述试剂盒包含有利于胎盘细胞向所述个体静脉内或动脉内递送的组分。在这些实施方式中,所述胎盘细胞可以包含在(例如)瓶或袋(例如,血液袋或能够包含多至约1.5l含有细胞的溶液的类似的袋)内,并且所述试剂盒另外包含适合于细胞向所述个体递送的管和针。另外,所述试剂盒可以包含减轻所述个体中疼痛或炎症的一种或多种化合物(例如,止痛、甾族或非甾族抗炎化合物等)。所述试剂盒还可以包含抗菌或抗病毒化合物(例如,一种或多种抗生素)、减轻个体中焦虑的化合物(例如,阿普唑仑)、减轻个体中免疫应答的化合物(例如,环胞霉素a)、抗组胺剂(苯海拉明、氯雷他定、地氯雷他定、喹硫平、非索非那定、西替利嗪、异丙嗪、氯苯那敏、左旋西替利嗪、西眯替丁、法莫替丁、雷尼替丁、尼扎替丁、罗沙替丁、拉呋替丁等)。另外,试剂盒可以包含一次性用品,例如,无菌擦拭物、一次性纸制品、手套等,其有利于个体对递送的准备或降低由于胎盘细胞的施用所导致的个体中感染的可能性。6.实施例6.1实施例1:胎盘源贴壁细胞的表型鉴定本实施例显示了胎盘细胞(cd10+、cd34-、cd105+、cd200+胎盘干细胞,也称为pdac)的血管生成因子的分泌。6.1.1评价胎盘源贴壁细胞血管新生能力的分泌蛋白质组学谱图复用珠测定:以相等的细胞数将传代6次的胎盘源贴壁细胞在生长培养基和条件培养基上铺板,并在48小时后收集。使用基于磁珠的复用测定(bio-plexprotm,bio-rad,ca)在细胞条件培养基中进行了多个血管生成细胞因子/生长因子的同时定性分析,所述测定允许在包括血清、血浆和细胞/组织培养上清液在内的不同基质中进行血管生成生物标志物的测量。这些96孔板形式的基于珠的测定的原理与捕获夹层免疫测定类似。抗所需血管生成靶标的抗体共价偶联到内部染色的珠上。所述偶联的珠能够与含有血管生成靶标的样品反应。在一系列清洗除去未结合的蛋白质后,将对不同表位特异的生物素化检测抗体加入到反应中。结果是形成了围绕血管生成靶标的抗体夹层。然后,加入抗生蛋白链菌素-pe以结合所述珠表面上的生物素化检测抗体。简言之,根据生产商的说明书进行复用测定,并且评价条件培养基中各个血管生成生长因子的量。酶联免疫吸附测定:使用可商购自r&dsystems(minneapolis,mn)的试剂盒在细胞条件培养基中进行单个血管生成细胞因子/生长因子的定量分析。简言之,根据生产商的说明书进行酶联免疫吸附测定,并且评价条件培养基中各个血管生成生长因子的量。图1中示出了pdac的多种血管生成蛋白的分泌水平。表1血管生成标志物的复用测定和elisa结果pdac标志物阳性阴性分泌蛋白质组学分析elisa,复用测定angxxegfxxena-78xxfgf2xx卵泡抑素xxg-csfxxgroxxhgfxxil-6xxil-8xx致轻素xxmcp-1xxmcp-3xxpdgfbxxplgfxxrantesxxtgfb1xx促血小板生成素xxtimp1xxtimp2xxuparxxvegfxxvegfdxx在单独的实验中,确认pdac还分泌血管生成素-1、血管生成素-2、pecam-1(cd31;血小板内皮细胞粘附分子)、层粘连蛋白和纤连蛋白。6.2实施例2:胎盘细胞的功能性特征本实施例显示了胎盘细胞(cd10+、cd34-、cd105+、cd200+胎盘干细胞,也称为pdac)与血管生成和分化能力有关的不同特征。6.2.1用于评价pdac的血管生成能力的huvec小管形成将人脐静脉内皮细胞(huvec)在传代3次或以内时在egm-2培养基(cambrex,eastrutherford,nj)中继代培养3天并在约70%-80%汇合时收获。用基础培养基/抗生素(dmem/f12(gibco))清洗huvec一次并以所需浓度在相同培养基中再悬浮。在制备1小时内使用huvec。将人胎盘胶原(hpc)在10mmhcl(ph2.25)中达到1.5mg/ml的浓度,用缓冲液中和至ph7.2并在冰上保持直至使用。将hpc与huvec悬液混合至最终细胞浓度为4000个细胞/μl。以3μl/孔,立即将所得的huvec/hpc悬液吸取到96孔板中(板周边必须用无菌pbs预填充以避免蒸发,每个条件n=5)。在不加入培养基的情况下,以37℃和5%co2将huvec滴孵育75-90分钟以允许胶原聚合。一旦“干”孵育完成,用200μl条件pdac培养基(n=2个细胞系)或对照培养基(例如,以dmem/f12作为阴性对照,并且以egm-2作为阳性对照)轻轻填充每个孔,并在37℃和5%co2条件下孵育20小时。通过在生长培养基中将传代6次的pdac孵育4-6小时制备了条件培养基;在附着和伸展后,将培养基转换为dmem/f1224小时。孵育后,从孔中除去培养基而不扰动huvec滴,并且用pbs清洗孔一次。然后,将huvec滴固定10秒并使用diff-quik细胞染色试剂盒染色1分钟,随后用无菌水清洗3次。将染色的滴风干,并使用zeissstereodiscoveryv8显微镜获得每个孔的图像。然后,使用计算机软件包imagej和/或matlab分析图像。将图像由彩色转换为8位灰阶图像,并设置阈值以转换为黑白图像。然后,使用颗粒分析功能分析图像,该功能提供了像素密度数据,其包括计数(各个颗粒数)、总面积、(各个颗粒的)平均粒度和区域分数,其等于所述测定中内皮小管形成的量。条件培养基对内皮细胞具有血管生成作用,如通过诱导小管形成所证明的(参见图2)。6.2.2huvec迁移测定本实验证明了胎盘源贴壁细胞的血管生成能力。将huvec在纤连蛋白(fn)涂覆的12孔板中生长至单层汇合,并且用1ml塑料移液器头将所述单层“划伤”以产生穿过所述孔的无细胞线。通过将“划伤”细胞与从生长3天后的pdac所获得的不含血清的条件培养基(ebm2;cambrex)孵育来测试huvec迁移。将无细胞的ebm2培养基用作对照。15小时后,使用倒置显微镜记录(n=3)无细胞区域中的细胞迁移。然后,使用计算机软件包imagej和/或matlab分析图片。将图像由彩色转换为8位灰阶图像,并设置阈值以转换为黑白图象。然后,使用颗粒分析功能分析图像,该功能提供了像素密度数据,其包括计数(各个颗粒数)、总面积、(各个颗粒的)平均粒度和区域分数,其等于所述测定中内皮迁移的量。根据开始所记录的划伤线的尺寸对细胞迁移的程度评分,并将结果归一化至1×106个细胞。胎盘源贴壁细胞所分泌的营养因子对内皮细胞具有血管生成作用,如通过诱导细胞迁移所证明的(图3)。在单独的实验中,在24孔板底部培养huvec进行egm2中的过夜确立,随后在ebm中进行半天饥饿。同时,将培养基培养的pdac融化并在transwell(8μm)中培养过夜。在ec饥饿后,将调节的不含血清的dmem以及transwell转移到ec上以进行过夜增殖。每个实验中包括4次重复,并且用promega细胞滴度glo测定评价24小时后的增殖。将ebm-2培养基用作阴性对照,并且将egm-2用作阳性对照。误差线表示分析性重复的标准偏差(n=3)。pdac所分泌的营养因子导致huvec细胞个数的增加,它是huvec增殖的指示。参见图4。6.2.3用于评价胎盘源贴壁细胞的血管生成能力的小管形成一般说来,将pdac在不含vegf的生长培养基或者含有vegf的egm2-mv的任一种中生长以评价细胞的血管生成效力,以及vegf对细胞分化潜能的影响。将作为小管形成对照细胞的huvec在egm2-mv中生长。将细胞在各个培养基中培养4-7天直至它们达到70-80%的汇合。将冷(4℃)matrigeltm溶液(50μl;bdbiosciences)分散到12孔板的孔中,并且将所述板在37℃培养60分钟以使溶液成凝胶。将pdac和huvec细胞胰蛋白酶化,在适当的培养基(加入或未加入vegf)中再悬浮,并且将100μl稀释的细胞(1-3×104个细胞)加入到每个含有matrigeltm的孔中。在存在或不存在0.5至100ngvegf的情况下,将聚合的matrigeltm上的细胞在37℃下在5%co2培养箱中放置4-24小时。孵育后,使用标准光学显微术评价细胞小管形成的迹象。pdac在不存在vegf的情况下显示出最小的小管形成,但是通过vegf刺激诱导/分化以形成小管样结构。参见图5。6.2.4用于评价胎盘源贴壁细胞的血管生成能力的缺氧反应为了评价内皮细胞和/或内皮祖细胞的血管生成功能,可以在含氧量低和含氧量正常的情况下对细胞评价它们分泌血管生成生长因子的能力。在含氧量低的情况下的培养通常诱导内皮细胞或内皮祖细胞的血管生成生长因子的较高分泌,其可以在条件培养基中测量。将胎盘源贴壁细胞以相等的细胞数在它们的标准生长培养基中铺板并使所述细胞生长至约70-80%汇合。随后,将所述细胞转移到不含血清的培养基(ebm-2)中并在含氧量正常(21%o2)或含氧量低(1%o2)的情况下孵育24h。收集条件培养基,并且使用可商购自r&dsystems的elisa试剂盒分析血管生成生长因子的分泌。根据生产商的说明书进行elisa测定,将条件培养基中各个血管生成生长因子(vegf和il-8)的量归一化至1×106个细胞。胎盘源贴壁细胞显示在含氧量低的情况下多种血管生成生长因子的分泌提高。参见图6。6.2.5huvec对pdac条件培养基的响应将pdac在包含60%dmem-lg(gibco);40%mcbd-201(sigma);2%fbs(hyclonelabs);1×胰岛素-转铁蛋白-硒(its);10ng/ml亚油酸-牛血清白蛋白(la-bsa);1n-地塞米松(sigma);100μm抗坏血酸2-磷酸酯(sigma);10ng/ml表皮生长因子(r&dsystems);和10ng/ml血小板源生长因子(pdgf-bb)(r&dsystems)的生长培养基中培养48小时,然后在不含血清的培养基中再培养48小时。收集来自pdac培养的条件培养基并用于对血清饥饿的huvec刺激5、15和30分钟。随后,将huvec细胞溶解并用bdtmcba(cytometricbeadassay,流式微珠测定)细胞信号flex试剂盒(bdbiosciences)对已知在血管生成途径信号中起作用的磷蛋白染色。发现pdac是akt-1(抑制细胞凋亡过程)、akt-2(huvec中胰岛素信号途径和erk1/2细胞增殖途径中的重要信号蛋白)的强激活剂。这些结果进一步证明了pdac的血管生成能力。6.3实施例3:pdac对血管生成的诱导本实施例表明如以上实施例1中所述的pdac在使用鸡胚绒毛尿囊膜(cam)的体内测定中促进血管生成。进行了两个单独的cam测定。在第一cam测定中,评价了来自不同pdac制备的完整细胞颗粒。在第二cam测定中,评价了不同pdac制备的上清液。将成纤维细胞生长因子(bfgf)用作阳性对照,并且将mda-mb-231人乳腺癌细胞用作参比,将赋形剂和培养基对照物用作阴性对照。研究终点将确定所有处理组和对照组的血管密度。6.3.1使用pdac的cam测定使用了如上所述制备和冷冻保存的pdac。将pdac融化以用于剂量施用并且确定了剂量施用于cam的细胞数。研究设计:本研究包括5组,每组10个胚胎。在表2中描述了研究设计。表2:研究组,鸡胚绒毛尿囊膜血管生成测定。cam分析程序:将新鲜的受精卵在标准蛋孵化器中在37℃下孵育3天。第3天,在无菌条件下将蛋打碎并且将胚胎放置到20个100mm的塑料板中,并且在37℃下在底架上带有贮水槽的胚胎孵育箱中培养。使用小泵连续将空气鼓泡到贮水槽中,从而孵育箱中的湿度保持恒定。第6天,将无菌硅酮“o形”圈放置在每个cam上,然后在无菌罩中将密度为7.69×105个细胞/40μl培养基/matrigeltm混合物(1:1)的pdac递送到每个“o形”圈中。表2a和表2b表示所使用的细胞数以及加入到每个细胞制剂中用于剂量施用的培养基的量。赋形剂对照胚胎接受了40μl赋形剂(pbs/matrigeltm,1:1),阳性对照接受了100ng/mlbfgf在40μldmem培养基/matrigeltm混合物(1:1)中的溶液,而培养基对照仅接受了40μldmem培养基。在每次剂量施用完成后,将胚胎返回到孵育箱中。第8天,从孵育箱中除去胚胎并且在室温下保持,以100×放大使用图像捕获系统确定每个“o形”圈下的血管密度。通过使用算术数0至5或指数数1至32来表示cam上处理位点处存在的血管个数的血管生成评分系统来测量血管密度。较高的评分值表示较高的血管密度,而0表示无血管生成。使用对每个剂量施用位点所记录的分数除以从对照样品获得的对每个单独的实验的平均分数计算了该位点的抑制百分比。通过混合从8-10个胚胎对该剂量所获得的所有结果计算给定化合物的每个剂量的抑制百分比。表3:加入到每个细胞制剂中用于将剂量施用的最终细胞悬液归一化的培养基的量细胞系颗粒尺寸用dmem和matrigeltm归一化细胞悬液的最终体积pdac260μl0μl+260μlmatrigeltm520μlmda-mb-23140μl220μl+260μlmatrigeltm520μl使用传代6次的pdac。结果图7中示出了血管密度得分的结果。结果明确表明用pdac细胞悬液或100ng/mlbfgf或mdamb231乳腺癌细胞悬液处理的鸡胚绒毛尿囊膜的血管密度得分在统计学上显著高于赋形剂对照cam的得分(p<0.001,学生氏“t”检验)。用于培养pdac(阴性对照)的培养基对血管密度不具有任何作用。此外,pdac制剂的血管密度的诱导显示出一些变化,但是这些变化不是统计学显著的。6.3.2使用pdac上清液的cam测定在如上所述的第二cam测定中使用了来自mda-mb-231细胞和pdac的上清液样品。将bfgf和mda-mb-231上清液用作阳性对照,将培养基和赋形剂用作阴性对照。研究设计:本研究包括5组,每组10个胚胎。在表4中描述了研究设计。表4:研究设计-使用细胞上清液的cam测定pdac上清液得自传代6次的细胞。cam分析程序:该分析程序与以上6.3.1节中所述的相同。仅有的差异是将来自每个干细胞制剂或者来自mda-mb-231细胞的上清液用作测试材料。对于剂量施用,将每个上清液与matrigeltm混物(体积比1:1)并且将40μl混合物剂量施用至每个胚胎。结果:血管密度得分(参见图8)表明每个干细胞制剂的上清液的血管形成的诱导是不同的。来自pdac的上清液样品显示出对血管诱导的显著影响,其中分别为p<0.01,p<0.001和p<0.02(学生氏“t”检验)。如所预期的,阳性对照bfgf还显示出有效的血管形成诱导,如以上cam测定no.1中所见(p<0.001,学生氏“t”检验)。然而,与赋形剂对照相比,来自mda-mb-231人乳腺癌细胞的上清液对血管形成未显示出显著诱导。如前所示,单独的培养基不具有任何影响。6.4实施例4:pdac显示出神经保护性作用本实施例表明pdac在使用氧-葡萄糖剥夺(ogd)损害测定的低氧和低葡萄糖条件下具有神经保护性作用并且使活性氧减少。照此,这些结果表明pdac将在治疗缺血性病况(如中风或周围性血管疾病)中是有用的,并且将保护不受由缺血性病况所引起的再灌注损伤。根据生产商的建议培养人神经元(sciencell,目录号#1520)。简要地,在37℃用聚l-赖氨酸(2μg/ml)在无菌蒸馏水中的溶液涂覆培养容器1小时。用双蒸h2o将所述容器清洗三次。将神经元培养基(sciencell)加入到容器中并且在孵育箱中平衡至37℃。将神经元融化,并且不离心直接加入到所述容器中。在后续培养期间,在培养开始后一天更换培养基,并且此后每隔一天更换一次。通常,神经元在第4天对损害就绪。通过首先在水浴中加热培养基制备了ogd培养基(达尔伯克氏改良的伊格尔培养基-不含葡萄糖)以部分降低氧在液体培养基中的溶解度。使用0.5μm分散器将100%的氮鼓泡通过培养基30分钟以除去溶解氧。将hepes缓冲液加入至1mm的最终浓度。在鼓泡结束时,将培养基直接加入到神经元中。将培养基的小样本等分以用于使用浸没式氧传感器确认含氧量。通常,含氧量降低至0.9%至约5.0%的氧。通过在放气之前将所述室放置在37℃的孵育箱中至少4小时(优选过夜)制备了缺氧室。除去培养容器中的培养基并更换为脱气培养基,并且将所述培养容器放置在缺氧室中。然后,以20-25lpm的速率使95%n2/5%co2气体通过系统冲入缺氧室至少5分钟。将所述系统在37℃在孵育箱中孵育4小时,并且在1小时后对所述室再次脱气。在损害程序完成时,将ogd培养基吸出并将热培养基加入到神经元中。24-28小时后,将pdac和神经元以在神经元培养基中悬浮的100000个细胞/孔(6孔板)的相等数目铺板,并且加入到神经元中并共培养6天。对于每个条件,在6孔板中对随即视野拍摄显微照片。标记具有典型神经元形态的细胞,并记录轴突长度。轴突的平均长度与神经元的健康性正相关,并且在神经元和pdac的共培养中更长,表明pdac保护细胞不受损害。活性氧测定确定pdac在缺氧期间表达过氧化物歧化酶、过氧化氢酶和血红素加氧酶基因在使用过氧化氢作为活性氧产生剂的测定中确定了pdac清除活性氧和保护细胞不受这类物质损伤的能力。测定说明:将靶细胞(星形细胞,sciencellresearchlaboratories)接种到以6000/cm2用聚l-赖氨酸预涂覆的96孔黑色孔板中。允许星形细胞在37℃和5%二氧化碳的条件下在生长培养基中连接过夜。第二天,除去培养基并且将细胞与细胞可渗透的染料dcfh-da(双氯荧光黄乙酸乙酯)孵育,所述染料是荧光探针。通过用达尔伯克氏磷酸盐缓冲盐水或汉克氏缓冲盐溶液清洗除去过量染料。然后,通过加入1000μm过氧化氢用活性氧对细胞损害30-60分钟。然后,除去含有过氧化氢的培养基,并更换为不含血清、不含葡萄糖的生长培养基。以6000/cm2加入pdac,并且将所述细胞另外培养24小时。然后,将细胞以480ex和530em在标准荧光读板器中读数。培养基的活性氧含量与细胞胞液中dcfh-da的水平成正比。通过比较测量活性氧含量以预确定dcf标准曲线。以n=24完成所有实验。对于测定,在立即要使用之前通过在不含胎牛血清的细胞培养基中将20×dcfh-da母液稀释至1×并搅拌均匀制备了1×dcfh-da。根据需要,在dmem或dpbs中制备了过氧化氢(h2o2)稀释液。通过在细胞培养基中稀释1mmdcf标准品,并将100μldcf标准品转移至适合于荧光测量的96孔板并加入100μl细胞溶解缓冲液,将标准曲线制备为浓度范围0μm至10μm的1:10稀释系列。在480ex和530em读取荧光。结果:pdac显著降低了星形细胞共培养中的活性氧浓度。参见图9。6.5实施例5:利用胎盘干细胞的治疗方法6.5.1心肌梗塞的治疗50多岁的男性个体表现出辐射至左臂超过20分钟的胸痛、气促、恶心、心悸、出汗。根据心电图结果以及血液肌酸激酶水平的升高和降低,做出了心前壁心肌梗塞(透壁)的鉴别诊断。在用硝酸甘油和链激酶使所述个体稳定后,通过局部麻醉使用心脏注射器对所述个体向发病区域直接施用1×108至5×108个cd10+、cd34-、cd105+、cd200+胎盘干细胞(pdac)在0.9%盐水中的溶液。在随后的72小时内,监测个体的紧急状况。在治疗后的随后三个月中,通过心电图和/或染料可视化技术进一步监控个体以评价梗塞区域血管再形成的程度。如果与pdac施用之前相比心电图结果可辨别地更接近于正常,或者如果如所显示的梗塞区域可辨别地血管再形成,则产生了疗效。6.5.2心肌病的治疗个体表现出呼吸急促、腿和踝部肿胀以及心律不齐。在排除其他原因之后,并且通过确实的心电图,做出了心肌病的诊断。超声波扫描图确认所述个体患有充血型心肌病。通过局部麻醉使用心脏注射器对所述个体向心脏动脉直接施用1×108至5×108个cd10+、cd34-、cd105+、cd200+胎盘干细胞在0.9%盐水中的溶液。在随后的三个月中监测所述个体的超声波扫描图的变化,其表明血流更加正常,并且呼吸急促的感觉得到改善以及腿和踝部的肿胀减轻。如果监测期间任何这些迹象表现出改善,则对所述个体产生了疗效。6.5.3周围性血管疾病的治疗个体表现出发冷、脚部发麻并且一旦悬垂就会发红,以及腿部疼痛、虚弱和疲劳。在排除糖尿病后,做出了周围动脉疾病的诊断。对所述个体静脉内施用1×109至5×109个cd10+、cd34-、cd105+、cd200+胎盘干细胞在450ml0.9%盐水中的溶液,并且在随后的三个月中每两周监测一次。如果在监测期间任何上述症状得到改善,则产生了疗效。6.5.4周围性血管疾病的治疗个体表现出发冷、脚部发麻并且一旦就悬垂会发红,以及腿部疼痛、虚弱和疲劳。在排除糖尿病后,做出了周围动脉疾病的诊断。对所述个体肌内施用1×108至5×108个cd10+、cd34-、cd105+、cd200+胎盘干细胞在5ml0.9%盐水中的溶液,和/或静脉内或动脉内施用,在脚趾间局部施用相等数目的所述胎盘干细胞,并且在随后的三个月中每两周监测一次。如果在监测期间任何上述症状得到改善,则产生了疗效。6.5.5周围性血管疾病的组合治疗个体表现出发冷、脚部发麻并且一旦悬垂就会发红,以及腿部疼痛、虚弱和疲劳。在排除糖尿病后,做出了周围动脉疾病的诊断。对所述个体静脉内施用1×109至5×109个cd10+、cd34-、cd105+、cd200+胎盘干细胞在450ml0.9%盐水中的溶液,并且在随后的三个月中每两周监测一次。还对所述个体开了100mg的西洛他唑,每天服用两次。如果在监测期间任何上述症状得到改善,则产生了疗效。6.5.6周围性血管疾病的组合疗法个体表现出发冷、右脚发麻并且一旦悬垂就会发红、右腿疼痛、虚弱和疲劳。在排除糖尿病后,做出了周围动脉疾病的诊断。所述个体经历了血管成形术,并且通过手术在股动脉中植入支架。随后,对所述个体静脉内施用1×109至5×109个cd10+、cd34-、cd105+、cd200+胎盘干细胞在450ml0.9%盐水中的溶液,并且在随后的三个月中每两周监测一次。如果在监测期间任何上述症状得到改善,则产生了疗效。6.5.7利用pdac治疗中风52岁男性表现为左侧身体半身不遂和部分失语。做出缺血性中风的诊断。在使用磁共振成象确定缺血区域后,所述个体准备通过手术在颅骨发病侧制造开口。制造开口后,将5×107至1×108个cd10+、cd34-、cd105+、cd200+胎盘干细胞在1-2ml0.9%盐溶液中的溶液施用至所述缺血性区域。在随后的7-14天,监测所述个体的任何中风症状的改善迹象,特别是半身不遂或失语症。如果在监测期间任何上述症状得到改善,则产生了疗效。6.5.8利用pdac治疗中风52岁男性表现为左侧身体半身不遂和部分失语。做出缺血性中风的诊断。在使用磁共振成象确定缺血区域后,所述个体准备通过手术在颅骨发病侧制造开口。制造开口后,静脉内施用1×109至5×109个cd10+、cd34-、cd105+、cd200+胎盘干细胞在450ml0.9%盐溶液中的溶液。在随后的7-14天,监测所述个体的任何中风症状的改善迹象,特别是半身不遂或失语症。如果在监测期间任何上述症状得到改善,则产生了疗效。等同性:本发明并不受到本文所述的具体实施方式的范围的限制。的确,除所述那些以外,对于本领域技术人员而言,通过上述说明和附图对本文所提供主题的多种改变将是显而易见的。这些改变旨在包括在所附权利要求的范围内。在本文中引用了多种出版物、专利和专利申请,以上出版物、专利和专利申请的公开内容以其全部内容结合于本文作为参考。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1