一种鸡成骨细胞体外分离培养方法与流程
本发明属于生物技术领域,更具体地,涉及一种鸡成骨细胞体外分离培养方法。
背景技术:
成骨细胞是间质来源细胞,具有强大的分泌功能,骨基质成分几乎都由成骨细胞分泌。作为骨形成和发育过程中的一种重要功能细胞,成骨细胞是骨组织修复和骨质疏松等领域的研究热点。自1964年首次成功分离新生大鼠成骨细胞至今,采用人和动物的正常骨或骨肉瘤组织培养了许多成骨样细胞培养体系。虽然来源于骨肉瘤的细胞系常用于研究,但是它具有肿瘤细胞的特点,与正常成骨细胞在基本结构、代谢和功能特性等方面存在一定的差异,无法真实反应体内正常的生物学特点。
与骨肉瘤细胞系相比,原代培养的成骨细胞更接近正常生理水平。成骨细胞的原代培养方法主要有酶消化法(程浩等,新生大鼠成骨细胞原代培养与鉴定,中国组织工程研究,2013,17(41),7199-7204)和组织块贴壁法(cn105505862a),而且主要取材于大鼠。不同于大鼠等胎生动物,鸡是卵生动物,它的成骨细胞可能具有特异的生物学特点。从孵化的鸡胚取材,分离原代的成骨细胞更加简单方便。此外,鸡胚成骨细胞是探究鸡的骨骼发育、代谢和骨质疏松等疾病的重要研究对象。
目前,鸡的原代成骨细胞分离通常采用酶消化法,主要有两种,一种是用胰蛋白酶和胶原酶混合酶液反复消化5次,取第2-5次的消化液收集细胞(yaoetal.,effectsofipriflavoneoncagedlayerbonemetabolisminvitroandinvivo,poultryscience,2007,86,503-507.),该方法通常细胞得率非常低,步骤繁琐。另一种方法是先用胰蛋白酶消化颅骨,再用胶原酶消化颅骨组织块(江莎等,鸡骨钙素蛋白的原核表达及其生物学活性,南京农业大学学报,2013,36(6),60-66;chenetal.,17β-estradiolcombinedwithtestosteronepromoteschickenosteoblastproliferationanddifferentiationbyacceleratingthecellcycleandinhibitingapoptosisinvitro,veterinaryresearchcommunications,2010,34,143-152.),这种方法细胞得率高,但是忽略了细胞纯化的步骤,细胞的纯度非常低。成骨细胞属于成纤维细胞样的细胞,容易受到成纤维细胞的污染,需要用适当的方法去除成纤维细胞,并从理化特性上鉴定区分成骨细胞和成纤维细胞。
因此,有必要开发一种操作过程简便、细胞得率和纯度高、生长迅速的鸡成骨细胞分离培养方法。
技术实现要素:
本发明的目的在于克服现有技术中存在的上述缺陷,开发一种操作过程简便、细胞得率和纯度高、生长迅速、状态良好的鸡成骨细胞体外分离培养方法。
为了实现上述目的,本发明提供一种鸡成骨细胞体外分离培养方法,该方法包括以下步骤:
(1)选用15-16胚龄的种蛋,无菌条件下取鸡胚的颅骨,剥离结缔组织,刮除骨膜直至颅骨发白,用含有抗生素的缓冲溶液洗涤;胚龄的选择很关键,过早颅骨还没有形成,过晚成骨细胞的分化能力较差;
(2)将洗涤后的颅骨置于胰蛋白酶溶液中,于37℃培养箱中孵育,弃去消化液,用缓冲溶液洗涤;
(3)将步骤(2)处理后的颅骨剪成0.8-1.2mm3的组织块,并转移至离心管中,加入ii型胶原酶溶液,于37℃培养箱中孵育;
(4)用含有胎牛血清的培养基终止消化,使未消化的大块骨组织沉降,取消化液;
(5)将所述消化液离心弃去上清液,用含有胎牛血清、青霉素和链霉素的培养基重悬沉淀物,混匀后移入t25细胞培养瓶中;
(6)采用差速贴壁的方法去除成纤维细胞,在37℃、5%co2培养箱中培养25-35min后,弃去贴壁的成纤维细胞,将未贴壁的细胞悬液转移至另一t25细胞培养瓶中,置于培养箱中培养;25-35min的培养时间很关键,时间过短无法去除成纤维细胞,时间过长成骨细胞也会被除去;
(7)定期更换培养液,待原代成骨细胞长满,用胰蛋白酶消化,差速贴壁纯化后传代。
根据本发明一种优选实施方式,步骤(1)中,所述抗生素为青霉素和链霉素;所述青霉素的浓度为90-110u/ml,所述链霉素的浓度为90-110μg/ml,体积为1.5-3ml;所述缓冲溶液为pbs缓冲液。
根据本发明一种优选实施方式,步骤(2)中,所述胰蛋白酶溶液的浓度为0.25-0.5%;所述孵育的时间为10-20min;所述缓冲溶液为pbs缓冲液。
根据本发明一种优选实施方式,步骤(3)中,所述ii型胶原酶溶液的浓度为0.8-1.2g/l;所述孵育的时间为40-60min。
根据本发明一种优选实施方式,步骤(4)中,所述胎牛血清的浓度为10-15%;所述培养基为dmem/f12培养基。
根据本发明一种优选实施方式,步骤(5)中,所述胎牛血清的浓度为10-15%;所述青霉素的浓度为80-120u/ml;所述链霉素的浓度为80-120μg/ml;所述培养基为dmem/f12培养基。
根据本发明一种优选实施方式,步骤(7)中,所述胰蛋白酶的浓度为0.25-0.5%。
根据本发明一种具体实施方式,该方法包括以下步骤:
(1)选用20个15胚龄的种蛋,无菌条件下取鸡胚的颅骨,剥离结缔组织,刮除骨膜直至颅骨发白,用含有抗生素的pbs洗涤3-4次;
(2)将洗涤后的颅骨置于1.5-3ml0.25-0.5%的胰蛋白酶溶液中,于37℃培养箱中孵育10-20min,弃去消化液,用pbs洗涤;
(3)将步骤(2)处理后的颅骨剪成0.8-1.2mm3的组织块,并转移至离心管中,加入0.8-1.2g/lii型胶原酶溶液,在37℃培养箱中孵育40-60min;
(4)用含有10-15%胎牛血清的dmem/f12培养基终止消化,将离心管上下颠倒混匀以后室温静置,使未消化的大块骨组织沉降,取消化液;
(5)将所述消化液离心弃去上清液,用含有10-15%胎牛血清、80-120u/ml青霉素和80-120μg/ml链霉素的dmem/f12培养基重悬沉淀物,轻轻吹打混匀后移入t25细胞培养瓶中;
(6)采用差速贴壁的方法去除成纤维细胞,在37℃、5%co2培养箱中培养25-35min后,弃去贴壁的成纤维细胞,将未贴壁的细胞悬液转移至另一t25细胞培养瓶中,置于培养箱中培养;
(7)定期更换培养液,每天在倒置显微镜下观察细胞生长情况,待原代成骨细胞长满,用0.25%胰蛋白酶消化,差速贴壁纯化后传代。
本发明在原有酶消化法的基础上,建立了一种操作简便、细胞得率和纯度高、生长迅速的成骨细胞分离培养方法。
本发明的其它特征和优点将在随后具体实施方式部分予以详细说明。
附图说明
通过结合附图对本发明示例性实施方式进行更详细的描述,本发明的上述以及其它目的、特征和优势将变得更加明显。
图1为碱性磷酸酶染色图,显微镜放大100倍观察。左图为染色阳性鉴定结果,细胞呈蓝色;右图为染色阴性鉴定结果,细胞未染色。
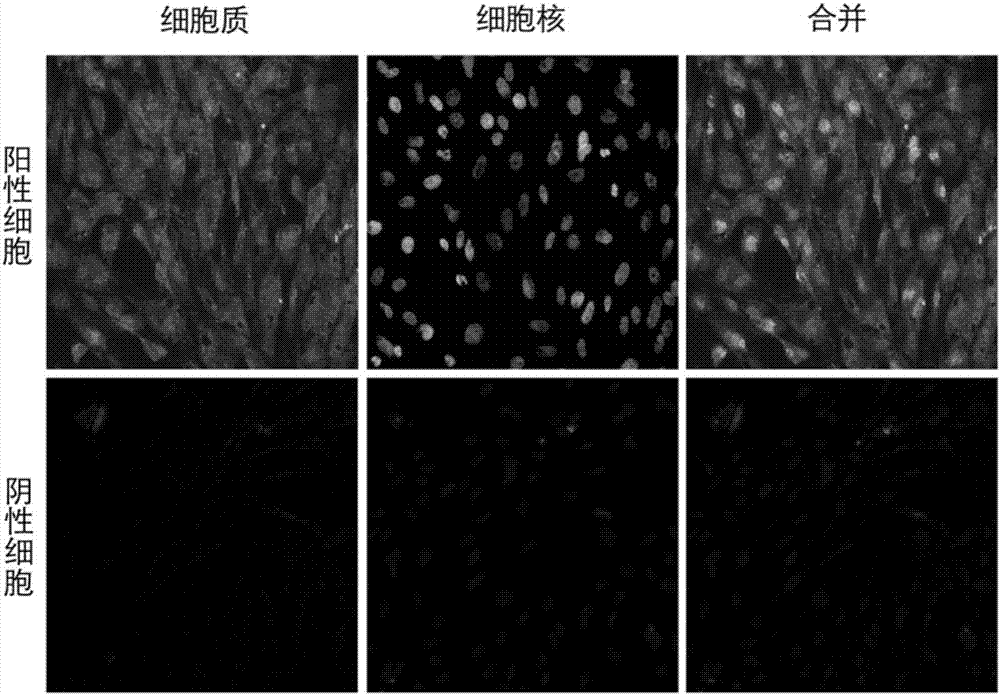
图2为i型胶原免疫荧光染色图,显微镜放大200倍观察。上图为染色阳性鉴定结果,i型胶原被染成绿色;下图为染色阴性鉴定结果,少量绿色荧光或无。
图3为茜素红染色图,显微镜放大100倍观察。图中箭头指向的橘红色团块为钙化结节。
具体实施方式
下面将更详细地描述本发明的优选实施方式。虽然以下描述了本发明的优选实施方式,然而应该理解,可以以各种形式实现本发明而不应被这里阐述的实施方式所限制。
试验试剂:pbs(hyclone公司),dmem/f12(hyclone公司),胎牛血清(gibco公司),0.25%胰蛋白酶(吉诺生物医药技术有限公司),ii型胶原酶(gibco公司),hbss缓冲液(gibco公司),bcip/nbt碱性磷酸酶显色试剂盒(北京雷根生物技术有限公司),i型胶原抗体、浓缩型dylight488-sabc(兔igg)试剂盒和dapi染色液(武汉博士德生物工程有限公司),4%多聚甲醛、tritonx-100和茜素红染色液(北京索宝莱科技有限公司),co2培养箱(thermoscientific公司),倒置显微镜(olympus公司)。
实施例1
操作步骤:
1、选用20个15胚龄的种蛋,无菌条件下取鸡胚的颅骨,剥离结缔组织,刮除骨膜直至颅骨发白,用含有抗生素的pbs洗涤3-4次。
2、将颅骨置于2ml0.25%的胰蛋白酶溶液中,于37℃培养箱中孵育15min,弃去消化液。用pbs洗涤2次。
3、将颅骨剪成大小约为1mm3的组织块,并转移至15ml离心管中,加入10ml1g/lii型胶原酶溶液,在37℃培养箱中孵育50min。
4、用含有10%胎牛血清的dmem/f12培养基终止消化,将离心管上下颠倒混匀以后室温静置1min,使未消化的大块骨组织沉降,取消化液。
5、将该消化液在1500r/min离心10min,弃去上清液。用含有10%胎牛血清、100u/ml青霉素和100μg/ml链霉素的dmem/f12培养基重悬沉淀物,轻轻吹打混匀后移入t25细胞培养瓶中。
6、采用差速贴壁的方法去除成纤维细胞。在37℃、5%co2培养箱中培养30min后,弃去贴壁的成纤维细胞,将未贴壁的细胞悬液转移至另一t25细胞培养瓶中,置于培养箱中培养。
7、每隔48h更换一次培养液,每天在倒置显微镜下观察细胞生长情况。待培养5-6d,原代成骨细胞长满,用0.25%胰蛋白酶消化,差速贴壁纯化后传代。
测试例
鸡成骨细胞的鉴定:
1、碱性磷酸酶在碱性条件下水解有机磷化合物的酯键,在骨骼矿化中起重要作用。成骨细胞生长活跃,便开始产生碱性磷酸酶,并释放类骨质促进矿物质沉积。因此,碱性磷酸酶是最为广泛认可的成骨细胞活性的生物标志物。
将纯化后的第二代细胞调整细胞浓度至1.2×105个/ml,接种到12孔细胞培养板中,每孔接种1ml,每隔48h换液。待细胞达到80%融合时,用pbs溶液轻轻清洗细胞1次,用95%乙醇固定30min,按照bcip/nbt碱性磷酸酶显色试剂盒的要求进行染色鉴定,显微镜下观察染色情况,结果如图1所示,本发明方法得到的阳性成骨细胞呈蓝色,阴性对照不显色。
2、成骨细胞生成和i型胶原分泌,构成了约90%的有机骨基质或类骨质。体外培养的成骨细胞具有合成i型胶原蛋白的能力,因此本发明采用i型胶原免疫荧光染色的方法鉴别i型胶原蛋白的合成。
将纯化后的第二代细胞调整细胞浓度至5.0×105个/ml,接种到12孔细胞培养板中,每孔接种1ml,每隔48h换液。待细胞达到80%融合时,用pbs溶液轻轻清洗细胞1次,用4%多聚甲醛固定15min,用pbs洗涤5min×3次,而后用含有5%bsa和0.3%tritonx-100的pbs室温封闭1h。将i型胶原抗体按照1:100比例稀释,稀释液为含有1%bsa和0.3%tritonx-100的pbs。将细胞与i型胶原抗体在4℃孵育过夜,用pbs洗涤5min×3次。滴加1:100稀释的生物素标记羊抗兔igg,室温作用1h后,用pbs洗涤5min×3次。滴加1:200稀释的dylight488-sabc,室温作用1h后,用pbs洗涤5min×3次。滴加dapi染色液,室温作用10min后,用pbs洗涤5min×3次。荧光显微镜观察,结果如图2所示,本发明方法得到的i型胶原阳性成骨细胞呈绿色,细胞核呈蓝色,i型胶原阴性对照不显色。
3、成骨细胞负责骨基质的合成、分泌和矿化,对矿化过程具有调节功能。因此,矿化能力是成骨细胞的又一重要生物学特征。成骨细胞经过连续培养后可形成钙化结节,这是其矿化能力的表现。钙化结节的形成过程大致经过成骨细胞快速增殖期、细胞外基质成熟期、基质矿化期3个生长阶段。成骨细胞局部聚集形成细胞团,为钙化结节的形成打下基础,同时成骨细胞之间相互促进成熟,胞体变小,转变为骨细胞,并随着钙化基质的增多而逐渐被埋入其内,最终形成明显的钙化结节。
将纯化后的第五代细胞调整细胞浓度至1.0×105个/ml,接种到六孔细胞培养板中,每孔接种2ml。在细胞的培养基中加入10mmβ-甘油磷酸钠和0.2mm维生素c诱导钙化结节的形成。β-甘油磷酸钠能为细胞提供磷酸根成分,促进生理钙盐沉积;维生素c可促进体外成骨细胞合成i型胶原,并促进胶原纤维的羟化。每隔48h换液,连续培养两周以后用95%乙醇固定细胞,用双蒸水洗涤3次,加入0.2%茜素红溶液,在37℃条件下孵育30min,最后用双蒸水洗去染色液。在显微镜下观察,结果如图3所示,本发明方法得到的成骨细胞的矿化结节呈橘红色。
对比例1
按照文献(yao等,effectsofipriflavoneoncagedlayerbonemetabolisminvitroandinvivo,poultryscience,2007,86,503-507.)中所提供的方法进行鸡胚成骨细胞的分离培养:
无菌取出15胚龄鸡胚的颅骨,去除结缔组织,刮除骨膜直至颅骨发白,用含有抗生素的pbs洗涤3-4次。将颅骨剪成1mm3的组织块,用酶液(4mlpbs中加入0.5ml粗胶原酶和1ml胰蛋白酶-edta)在37℃环境下慢速旋转消化10min。该消化步骤共反复进行5次,弃去第一次消化下来的细胞,最后一次消化时间为20min。分离第2-5次消化后的消化液,用胎牛血清终止反应。用1500r/min离心10min,收集第2-5次消化的细胞,加入含有10%胎牛血清、100u/ml青霉素和50mg/ml链霉素的dmem培养基,置于t25细胞培养瓶中,在37℃、5%co2培养箱中培养。每天在倒置显微镜下观察细胞的生长情况,每隔48h更换一次培养液。
对比例2
按照文献(江莎等,鸡骨钙素蛋白的原核表达及其生物学活性,南京农业大学学报,2013,36:60-66.)中所提供的方法进行鸡胚成骨细胞的分离培养:
取15胚龄鸡胚,消毒后取颅骨,在37℃预热的pbs液中刮除骨膜及其他组织,直至颅骨发白,然后用2.5g/l胰蛋白酶在37℃预消化10min,弃消化液。将颅骨剪成大小约0.1mm×0.1mm,再用1g/l胶原酶(37℃预热)消化50min。用含体积分数为15%小牛血清的dmem/f12培养基终止消化,将其消化液移入离心管。1500r/min离心10min,弃上清液。用含15%小牛血清dmem/f12培养基悬浮细胞,移入培养瓶中,在5%co2、37℃条件下培养。每2天更换培养液1次,倒置显微镜观察所培养贴壁细胞形态。
将实施例1与对比例1和对比例2的分离培养方法进行比较,结果列于表1。
表1
由表1数据可以看出,本发明方法的细胞纯度非常高;所需种蛋数量少,说明细胞得率高;细胞长满t25细胞培养瓶所需时间短,说明细胞生长速度快。
以上已经描述了本发明的各实施例,上述说明是示例性的,并非穷尽性的,并且也不限于所披露的各实施例。在不偏离所说明的各实施例的范围和精神的情况下,对于本技术领域的普通技术人员来说许多修改和变更都是显而易见的。
- 还没有人留言评论。精彩留言会获得点赞!