靶向破骨细胞相关蛋白Siglec-15的抗体的制作方法
技术领域:
本发明涉及可用作骨代谢异常的治疗和/或预防剂的物质、可用作骨代谢异常的治疗和/或预防剂的物质的筛选方法、骨代谢异常的检查方法以及骨代谢异常的治疗和/或预防方法。
背景技术:
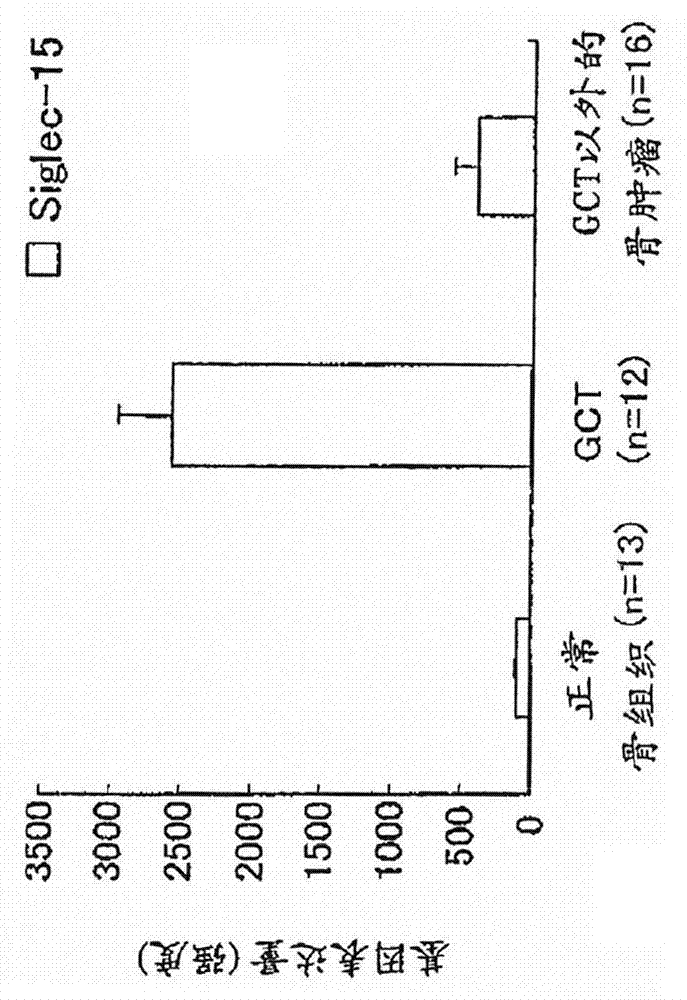
:已知骨骼为通过重复形成和吸收,以进行持续重建的动态性器官,以使其本身的形态变化以及维持血钙浓度。健康的骨骼维持由成骨细胞进行的骨形成和由破骨细胞进行的骨吸收的平衡关系,从而骨质量保持恒定。然而,当骨形成和骨吸收之间的平衡关系被破坏时,则产生骨质疏松症等骨代谢异常(EndocrinologicalReview,(1992)13,第66-80页,PrinciplesofBoneBiology,AcademicPress,NewYork,(1996)第87-102页)。作为调节骨代谢的因子,报道了很多全身性激素以及局部性细胞因子,且这些因子互相合作以形成和维持骨(EndocrinologicalReview,(1992)13,第66-80页,EndocrinologicalReview),(1996)17,第308-332页)。因老龄化导致的骨组织的变化,骨质疏松症的发病众所周知,但是其发病机理包含各种因素,如性激素的分泌降低以及该激素受体异常、骨局部细胞因子表达变动、老化基因的表达、破骨细胞或成骨细胞的分化衰退或功能不全,因此,难以理解为老龄化引起的单纯的生理现象。原发性骨质疏松症主要分为由于雌激素的分泌降低导致的绝经后骨质疏松症和老龄化导致的老年性骨质疏松症,为了了解其发病机理和开发治疗药物,在骨形成和骨吸收的调节机制方面的进一步基础研究很重要。破骨细胞是来自造血干细胞的多核细胞,通过在破骨细胞粘附的骨表面上业已发现破骨细胞的前体细胞通过在骨表面的成骨细胞/基质细胞的细胞膜上表达的RNAKL(NF-κB配体的受体活化因子)的刺激,分化为破骨细胞(ProceedingsoftheNationalAcademyofScienceoftheUnitedStatesofAmerica,(1998)95,第3597-3602页,Cell,(1998)93,第165-176页,)。还发现RNAKL是成骨细胞/基质细胞所产生的膜蛋白,其表达受骨吸收因子的调节,以及RNAKL诱导由破骨细胞前体细胞向多核破骨细胞的分化等(ProceedingsoftheNationalAcademyofScienceoftheUnitedStatesofAmerica,(1998)95,第3597-3602页,JournalofBoneandMineralResearch,(1998)23,S222)。此外,还发现敲除RNAKL的小鼠产生典型的骨硬化病样疾病,因此,证明RNAKL是生理性破骨细胞分化诱导因子(Nature,(1999)397,第315-323页)。使用二膦酸盐、活性维生素D3、降钙素及其衍生物、雌二醇等激素制剂、SERMs(选择性雌激素受体调节剂)、依普黄酮、维生素K2(四烯甲萘醌)、PTH(甲状旁腺激素)制剂和钙制剂等作为骨代谢疾病的治疗以及缩短治疗的持续时间的药物。但是,这些制剂没有始终表现满意的治疗效果,人们希望开发治疗效果更高的药物。免疫细胞的细胞膜上被如唾液酸等多种多糖高度覆盖,所述多糖被各种多糖结合蛋白识别。唾液酸结合免疫球蛋白样凝集素(Sialic-acid-bindingimmunoglobulin-likelectins,下面称为“Siglecs”)为识别并结合唾液酸化的多糖的I型膜蛋白家族。人们认为Siglecs大多在免疫细胞的细胞膜上表达,并识别类似地存在于免疫细胞的细胞膜上的唾液酸,调节细胞间的相互作用以及细胞功能,并被认为参与免疫应答(NatureReviewsImmunology,(2007)7,第255-266页)。然而,也有很多生理功能尚不明了的Siglec分子。最近报道了Siglec-15(唾液酸结合免疫球蛋白样凝集素15)为属于Siglecs的分子(Glycobiology,(2007)17,第838-846页),其与被称为CD33L3(CD33分子样3)的分子相同。该分子从鱼类到人类的进化高度保守,业已发现,在人脾以及淋巴结中,在树突细胞/巨噬细胞中有强的表达。此外,使用唾液酸探针的结合测试的结果是,还发现人Siglec-15与Neu5Acα2-6GalNAc结合、小鼠Siglec-15除与Neu5Acα2-6GalNAc结合外,还与Neu5Acα2-3Galβ1-4Glc结合(Glycobiology,(2007)17,第838-846页)。直至最近,还未明了Siglec-15的生理作用,但业已报道伴随着破骨细胞的分化和成熟,Siglec-15表达增加,以及通过用RNA干扰使Siglec-15的表达下降,从而抑制破骨细胞的分化(WO2007/093042)。但是,还不明确抗Siglec-15抗体对破骨细胞分化的作用。技术实现要素:发明所要解决的问题本发明的目的在于提供:在各种形式的骨代谢异常中特异表达的基因,如骨质疏松症、类风湿性关节炎、癌的骨转移等中可见的骨破坏;抑制破骨细胞的分化和成熟及其活性的物质;用于筛选骨代谢异常的治疗和/或预防剂的新方法;抑制破骨细胞的分化和成熟及其活性的物质;以及骨代谢异常的治疗和/或预防剂。解决问题的手段为了找到具有骨代谢异常的治疗和/或预防效果的物质,本发明人以阐明破骨细胞的分化、成熟和活化机制为目标进行研究,结果发现,伴随着破骨细胞的分化、成熟,Siglec-15基因的表达增加,还发现通过与Siglec-15特异性结合的抗体,抑制破骨细胞的分化,从而完成本发明。即,本发明包括以下发明。(1)抗体或该抗体的功能性片段,其特异性地识别包含以下的(a)至(i)中任一项记载的氨基酸序列的一个或多个多肽,并抑制破骨细胞的形成和/或由破骨细胞产生的骨吸收:(a)序列表中SEQIDNO:2表示的氨基酸序列;(b)由序列表中的SEQIDNO:22表示的氨基酸序列的氨基酸残基第21位至第328位构成的氨基酸序列;(c)由序列表中的SEQIDNO:2表示的氨基酸序列的氨基酸残基第1位至第260位构成的氨基酸序列;(d)由序列表中的SEQIDNO:2表示的氨基酸序列的氨基酸残基第21位至第260位的构成的氨基酸序列;(e)序列表中的SEQIDNO:4表示的氨基酸序列;(f)由序列表中的SEQIDNO:4表示的氨基酸序列的氨基酸残基第21位至第341位构成的氨基酸序列;(g)由序列表中的SEQIDNO:4表示的氨基酸序列的氨基酸残基第1位至第258位构成的氨基酸序列;(h)由序列表中的SEQIDNO:4表示的氨基酸序列的氨基酸残基第21位至第258位构成的氨基酸序列;(i)包括(a)至(h)中所述的氨基酸序列中一个或多个氨基酸残基的取代、缺失或添加的氨基酸序列。(2)抗体或该抗体的功能性片段,其特异性地识别包含以下的(j)至(n)中任一项记载的核苷酸序列编码的氨基酸序列的一个或多个多肽,并抑制破骨细胞的形成和/或由破骨细胞产生的骨吸收:(j)SEQIDNO:1表示的核苷酸序列;(k)SEQIDNO:3表示的核苷酸序列;(l)SEQIDNO:19表示的核苷酸序列;(m)SEQIDNO:43表示的核苷酸序列;(n)具有与包含与(j)至(m)中记载的核苷酸序列互补的核苷酸序列的多核苷酸在严格条件下进行杂交的多核苷酸的核苷酸序列。(3)抑制破骨细胞的细胞融合过程的如(1)或(2)所述的抗体或该抗体的功能性片段。(4)抑制由TNFα诱导的破骨细胞形成的如(1)至(3)中任一项所述的抗体或该抗体的功能性片段。(5)在30μg/ml或以下的浓度下抑制体外破骨细胞形成的如(1)至(4)中任一项所述的抗体或该抗体的功能性片段。(6)在3μg/ml或以下的浓度下抑制体外破骨细胞形成的如(5)所述的抗体或该抗体的功能性片段。(7)在1μg/ml或以下的浓度下抑制体外破骨细胞形成的如(6)所述的抗体或该抗体的功能性片段。(8)在63ng/ml至1μg/ml的浓度下抑制体外破骨细胞形成的如(7)所述的抗体或该抗体的功能性片段。(9)抑制破骨细胞性的骨吸收的如(1)至(4)中任一项所述的抗体或该抗体的功能性片段。(10)在3μg/ml或以下的浓度下抑制体外的破骨细胞性的骨吸收的如(9)所述的抗体或该抗体的功能性片段。(11)在0.3μg/ml至3μg/ml的浓度下抑制体外的破骨细胞性的骨吸收的如(10)所述的抗体或该抗体的功能性片段。(12)由包括以下的步骤1)和2)的方法得到的如(1)至(11)中任一项所述的抗体或该抗体功能性片段:1)制备抗体的步骤,所述抗体特异性识别以下(a)至(i)中任一项所记载的氨基酸序列的一个或多个序列:(a)序列表中的SEQIDNO:2表示的氨基酸序列;(b)由序列表中的SEQIDNO:2表示的氨基酸序列的氨基酸残基第21位至第328位构成的氨基酸序列;(c)由序列表中的SEQIDNO:2表示的氨基酸序列的氨基酸残基第1位至第260位构成的氨基酸序列;(d)由序列表中的SEQIDNO:2表示的氨基酸序列的氨基酸残基第21位至第260位构成的氨基酸序列;(e)序列表中的SEQIDNO:4表示的氨基酸序列;(f)由序列表中的SEQIDNO:4表示的氨基酸序列的氨基酸残基第21位至第341位构成的氨基酸序列;(g)由序列表中的SEQIDNO:4表示的氨基酸序列的氨基酸残基第1位至第258位构成的氨基酸序列;(h)由序列表中的SEQIDNO:4表示的氨基酸序列的氨基酸残基第21位至第258位构成的氨基酸序列;(i)包含(a)至(h)中记载的氨基酸序列中一个或几个氨基酸残基的取代、缺失或添加的氨基酸序列。2)筛选抗体的步骤,所述抗体显示破骨细胞形成抑制活性和/或骨吸收抑制活性。(13)由包括以下的步骤1)和2)的方法得到的如(1)至(11)中任一项所述的抗体或该抗体功能性片段:1)制备抗体的步骤,所述抗体特异性识别以下(j)至(n)中任一项所记载的核苷酸序列编码的一个或多个多肽:(j)SEQIDNO:1表示的核苷酸序列;(k)SEQIDNO:3表示的核苷酸序列;(l)SEQIDNO:19表示的核苷酸序列;(m)SEQIDNO:43表示的核苷酸序列;以及(n)多核苷酸的核苷酸序列,所述多核苷酸与包含与(j)至(m)中记载的核苷酸序列互补的核苷酸序列的多核苷酸在严格条件下进行杂交;以及2)筛选抗体的步骤,所述抗体显示破骨细胞形成抑制活性和/或骨吸收抑制活性。(14)如(1)至(13)中任一项所述的抗体或该抗体的功能性片段,其特征在于,所述抗体为单克隆抗体。(15)如(14)所述的抗体或该抗体的功能性片段,其特征在于,其具有与杂交瘤#32A1(FERMBP-10999)产生的抗体相同的表位特异性。(16)如(14)所述的抗体或该抗体的功能性片段,其特征在于,其与杂交瘤#32A1(FERMBP-10999)产生的抗体竞争。(17)如(14)所述的抗体或该抗体的功能性片段,其特征在于,所述抗体为杂交瘤#32A1(FERMBP-10999)产生的抗体。(18)如(14)所述的抗体或该抗体的功能性片段,其特征在于,其具有与杂交瘤#41B1(FERMBP-11000)产生的抗体相同的表位特异性。(19)如(14)所述的抗体或该抗体的功能性片段,其特征在于,其与杂交瘤#41B1(FERMBP-11000)产生的抗体竞争。(20)如(14)所述的抗体或该抗体的功能性片段,其特征在于,所述抗体为杂交瘤#41B1(FERMBP-11000)产生的抗体。(21)如(1)至(20)中任一项所述的抗体或该抗体的功能性片段,其特征在于,所述抗体为嵌合抗体。(22)如(1)至(21)中任一项所述的抗体或该抗体的功能性片段,其特征在于,所述抗体为人源化的。(23)如(1)至(16)、(18)、或(19)中任一项所述的抗体或该抗体的功能性片段,其特征在于,所述抗体为人抗体。(24)如(1)至(23)中任一项所述的抗体或该抗体的功能性片段,其特征在于,所述抗体为IgG抗体。(25)选自Fab、F(ab’)2、Fab'以及Fv的如(1)至(24)中所述的抗体的功能性片段。(26)如(1)至(16)、(18)和(19)中任一项所述的抗体,其特征在于,其为scFv。(27)药物组合物,其特征在于,其含有如(1)至(26)中所述的抗体或该抗体的功能性片段的至少一种。(28)如(27)中所述的药物组合物,其特征在于,其为骨代谢异常的治疗和/或预防剂。(29)治疗和/或预防骨代谢异常的药物组合物,其特征在于,其包含如(1)至(26)中所述的抗体或该抗体的功能性片段的至少一种,以及选自二膦酸盐、活性维生素D3、降钙素及其衍生物、如雌二醇的激素制剂、SERMs(选择性雌激素受体调节剂)、依普黄酮、维生素K2(四烯甲萘醌)、钙制剂、PTH(甲状旁腺激素)制剂、非甾体类抗炎药、可溶性TNF受体制剂、抗TNFα抗体或该抗体的功能性片段、抗PTHrP(甲状旁腺激素相关蛋白)抗体或该抗体的功能性片段、IL-1受体拮抗剂、抗IL-6受体抗体或该抗体的功能性片段、抗RANKL抗体或该抗体的功能性片段以及OCIF(破骨细胞发生抑制因子)的至少一种。(30)如(28)或(29)中所述的药物组合物,其中所述骨代谢异常选自骨质疏松症、伴随类风湿性关节炎的骨破坏、癌性高钙血症、伴随多发性骨髓瘤以及癌的骨转移的骨破坏、巨细胞瘤、牙周炎导致的牙齿缺失、人工关节周围的骨溶解、慢性骨髓炎中的骨破坏、骨佩吉特病、肾病性骨营养不良、以及成骨不全。(31)如(30)中所述的药物组合物,其特征在于,所述骨代谢异常为骨质疏松症、伴随类风湿性关节炎的骨破坏、或伴随癌的骨转移的骨破坏。(32)如(31)中所述的药物组合物,其特征在于,所述骨质疏松症为绝经后骨质疏松症、老年性骨质疏松症、由使用类固醇以及免疫抑制剂等治疗用药剂而导致的继发性骨质疏松症、或伴随类风湿性关节炎的骨质疏松症。(33)骨代谢异常的治疗和/或预防方法,其特征在于,给予如(1)至(26)中所述的抗体或该抗体的功能性片段的至少一种。(34)骨代谢异常的治疗和/或预防方法,其特征在于,同时或连续给予如(1)至(26)所述的抗体或该抗体的功能性片段的至少一种,以及选自二膦酸盐、活性维生素D3、降钙素及其衍生物、如雌二醇的激素制剂、SERMs(选择性雌激素受体调节剂)、依普黄酮、维生素K2(四烯甲萘醌)、钙制剂、PTH(甲状旁腺激素)制剂、非甾体类抗炎药、可溶性TNF受体制剂、抗TNFα抗体或该抗体的功能性片段、抗PTHrP(甲状旁腺激素相关蛋白)抗体或该抗体的功能性片段、IL-1受体拮抗剂、抗IL-6受体抗体或该抗体的功能性片段、抗RANKL抗体或该抗体的功能性片段以及OCIF(破骨细胞发生抑制因子)的至少一种。(35)如(33)或(34)所述的治疗和/或预防方法,其特征在于,所述骨代谢异常为骨质疏松症、伴随类风湿性关节炎的骨破坏、或伴随癌的骨转移的骨破坏。(36)如(35)所述的治疗和/或预防方法,其特征在于,所述骨质疏松症为绝经后骨质疏松症、老年性骨质疏松症、由使用类固醇以及免疫抑制剂等治疗用药剂而导致的继发性骨质疏松症、或伴随类风湿性关节炎的骨质疏松症。(37)杂交瘤#32A1(FERMBP-10999)。(38)杂交瘤#41B1(FERMBP-11000)。发明效果根据本发明,可得到用于骨代谢异常的治疗药物和/或预防剂,其中骨代谢异常的作用机制为抑制破骨细胞的分化和成熟及其活性。附图说明图1为表示人巨细胞瘤组织中的RANK、RANKL、组织蛋白酶K以及TRAP基因表达特征分析的曲线。图2为表示人巨细胞瘤组织中的Siglec-15基因表达特征分析的曲线。图3为表示诱导从RAW264.7或小鼠骨髓细胞到破骨细胞的分化时的Siglec-15基因的表达量的变化的图。图4为表示伴随RAW264.7细胞的破骨细胞分化的组织蛋白酶K以及TRAP基因表达的图。图5为表示伴随RAW264.7细胞的破骨细胞分化的Siglec-15基因表达的图。图6为通过SDS-聚丙烯酰胺电泳和使用抗6His-HRP抗体的免疫印迹法检测293F细胞的小鼠Siglec-15-His的表达随培养时间变动的结果。图7为通过SDS-聚丙烯酰胺电泳和使用抗人IgGFc-HRP抗体的免疫印迹法检测293F细胞的小鼠Siglec-15-Fc的表达随培养时间变动的结果。图8为通过SDS-聚丙烯酰胺电泳和银染色评估用HisTrapHP柱色谱和ResourceQ柱色谱纯化的小鼠Siglec-15-His纯度的结果。图9为通过SDS-聚丙烯酰胺电泳和使用抗V5-HRP抗体的免疫印迹法检测用HisTrapHP柱色谱和ResourceQ柱色谱纯化的小鼠Siglec-15-His行为的结果。图10为通过SDS-聚丙烯酰胺电泳和银染色评估用HiTrap蛋白A柱色谱纯化的小鼠Siglec-15-Fc纯度的结果。图11显示通过SDS-聚丙烯酰胺电泳以及使用抗小鼠Siglec-15多克隆抗体和抗兔IgG-HRP抗体的免疫印迹法确认纯化的抗小鼠Siglec-15多克隆抗体不只结合Siglec-15-Fc还结合Siglec-15-His的结果。图12显示用其上固定有小鼠Siglec-15-Fc的亲和柱纯化抗小鼠Siglec-15多克隆抗体的色谱图。图13显示用SDS-聚丙烯酰胺电泳和银染色评估用小鼠Siglec-15-Fc固定其上的亲和柱色谱纯化的小鼠Siglec-15-Fc纯度的结果。图14显示用Superose6凝胶过滤柱纯化抗小鼠Siglec-15多克隆抗体的色谱图。图15显示测试添加亲和纯化的抗小鼠Siglec-15多克隆抗体对小鼠骨髓非贴壁细胞向破骨细胞分化(用RANKL刺激)的影响的结果(N=3)。图16显示基于TRAP酶活性测试添加凝胶过滤纯化的抗小鼠Siglec-15多克隆抗体对小鼠骨髓非贴壁细胞向破骨细胞分化(用RANKL刺激)的影响的结果(N=3)。图17显示基于TRAP酶活性测试由于添加抗小鼠Siglec-15多克隆抗体的小鼠骨髓非贴壁细胞向破骨细胞分化(用RANKL刺激)的抑制被抗原中和的结果(N=3)。图18显示基于TRAP酶活性测试添加抗小鼠Siglec-15多克隆抗体对小鼠骨髓非贴壁细胞向破骨细胞分化(用TNFα刺激)的影响的结果(N=3)。图19显示用于通过TRAP染色评估添加抗小鼠Siglec-15多克隆抗体对小鼠骨髓非贴壁细胞向破骨细胞分化(用TNFα刺激)的影响的显微照片(N=3)。图20显示用TRAP酶活性表示通过添加抗小鼠Siglec-15多克隆抗体抑制从小鼠骨髓细胞到破骨细胞的分化(用活性维生素D3刺激)的图。图21为通过TRAP染色表示的通过添加抗小鼠Siglec-15多克隆抗体抑制从小鼠骨髓细胞到巨大破骨细胞形成(用活性维生素D3刺激)的显微照片。图22为通过TRAP染色表示的通过添加抗小鼠Siglec-15多克隆抗体抑制从小鼠骨髓细胞到巨大破骨细胞形成(用人RANKL刺激)的显微照片。图23显示通过TRAP染色表示通过添加抗小鼠Siglec-15多克隆抗体抑制从RAW264.7细胞到巨大破骨细胞形成(用人RANKL刺激)以及通过可溶型Siglec-15解除该抑制作用的显微照片。图24显示用ELISA法测试大鼠抗小鼠Siglec-15单克隆抗体对其上固定有小鼠Siglec-15-Fc的平板的结合的结果。符号(◆)表示#1A1抗体;符号(■)表示#3A1抗体;符号(▲)表示#8A1抗体;符号(×)表示#24A1抗体;符号(●)表示#32A1抗体;符号(○)表示#34A1抗体;符号(+)表示#39A1抗体;符号(-)表示#40A1抗体;符号(—)表示#41B1抗体;符号(◇)表示#61A1抗体;符号(□)表示对照IgG。图25显示测试添加抗小鼠Siglec-15单克隆抗体(#3A1、#8A1或#32A1)对小鼠骨髓非贴壁细胞向破骨细胞分化(用RANKL刺激)的影响的结果。此外,图中大鼠对照IgG为图25和26共有的阴性对照。图26显示测试添加抗小鼠Siglec-15单克隆抗体(#34A1、#39A1或#40A1)对小鼠骨髓非贴壁细胞向破骨细胞分化(用RANKL刺激)的影响的结果。此外,图中大鼠对照IgG为图25和26共有的阴性对照。此外,图中兔抗小鼠Siglec-15多克隆抗体No.3为图25和26共有的阳性对照。图27为表示诱导正常人破骨前体细胞向破骨细胞分化时的组织蛋白酶K、TRAP以及Siglec-15基因的表达变化的图。图28为通过SDS-聚丙烯酰胺电泳检测用HisTrapHP柱色谱和ResourceQ柱色谱纯化的人Siglec-15-His纯度的结果。图29为通过SDS-聚丙烯酰胺电泳检测用蛋白A柱色谱纯化的人Siglec-15-Fc纯度的结果。图30为用其上固定有人Siglec-15-Fc的亲和柱纯化的抗人Siglec-15多克隆抗体的色谱图。图31为通过TRAP染色表示的通过添加抗人Siglec-15多克隆抗体抑制从正常人破骨前体细胞到巨大破骨细胞形成的显微照片。图32为通过用倒置显微镜计数具有5个或以上核的TRAP阳性细胞评估添加抗人Siglec-15多克隆抗体对从正常人破骨前体细胞形成多核破骨细胞的影响的结果。图33显示用ELISA法测试大鼠抗小鼠Siglec-15单克隆抗体对其上固定有人Siglec-15-Fc的平板的结合的结果。符号(◆)表示#1A1抗体;符号(■)表示#3A1抗体;符号(▲)表示#8A1抗体;符号(×)表示#24A1抗体;符号(●)表示#32A1抗体;符号(○)表示#34A1抗体;符号(+)表示#39A1抗体;符号(-)表示#40A1抗体;符号(—)表示#41B1抗体;符号(◇)表示#61A1抗体;符号(□)表示对照IgG。图34为通过TRAP染色表示的通过添加大鼠抗小鼠Siglec-15单克隆抗体抑制从正常人破骨前体细胞到巨大破骨细胞形成的显微照片。图35为通过TRAP染色表示的添加大鼠抗小鼠Siglec-15单克隆抗体(#32A1抗体)对抑制从正常人破骨前体细胞形成巨大破骨细胞的显微照片。图36为表示通过添加大鼠抗小鼠Siglec-15单克隆抗体(#32A1抗体)抑制正常人破骨细胞的骨吸收活性的图(N=6)。具体实施方式在本说明书中,术语“基因”不仅包括DNA,还包括mRNA、cDNA以及cRNA。在本说明书中,术语“多核苷酸”用于与核酸相同的含义,并且还包括DNA、RNA、探针、寡核苷酸、以及引物。在本说明书中,术语“多肽”和“蛋白质”无区别使用。在本说明书中,术语“RNA组分”是指包含RNA的组分。在本说明书中,术语“细胞”也包括动物个体内的细胞和培养细胞。在本说明书中,术语“Siglec-15”用于与Siglec-15蛋白相同的含义。在本说明书中,术语“破骨细胞形成”用于与“破骨细胞分化”或“破骨细胞成熟”相同的含义。本说明书中的术语“抗体功能性片段”是指具有与抗原结合的活性并包括Fab、F(ab’)2、scFv等的抗体部分片段。另外,抗体功能性片段还包括Fab’,其为在还原条件下处理F(ab’)2得到的抗体的可变区的单价片段。但是,只要该片段具有与抗原的结合亲和力,该术语就不受限于这些分子。此外,这些功能性片段不仅包括用适当的酶处理抗体蛋白的全长分子得到的片段,还包括使用基因工程地改变的抗体基因在适当的宿主细胞中产生的蛋白。在本说明书中,术语“表位”是指特定的抗Siglec-15抗体结合的Siglec-15的部分肽。前述Siglec-15的部分肽的表位,可通过免疫测定法等本领域技术人员熟知的方法确定。或者,例如,可通过以下的方法进行。制备Siglec-15的各种部分结构。在制备部分结构时,可使用公知的寡肽合成技术。例如,从Siglec-15的C末端或N末端顺次缩短得到的具有适当的缩短长度的一系列多肽是使用本领域技术人员公知的基因重组技术制备的。其后,检测这些多肽的抗体的反应性,并粗略确定识别部位。进一步合成更短的肽并检测与这些肽的反应性,通过这些可确定表位。若二级抗Siglec-15抗体与初级抗Siglec-15抗体结合的部分肽结合,可判定初级抗体与二级抗体具有共有的表位。此外,通过证实抗Siglec-15的二级抗体与抗Siglec-15的初级抗体竞争与Siglec-15的结合(即二级抗体抑制Siglec-15和初级抗体的结合),能够确定初级抗体和二级抗体具有相同的表位,即使该表位的特异序列还没有得到确定。此外,当初级抗体和二级抗体结合共有表位,且初级抗体具有抗原中和活性等特殊效应时,可期待二级抗体也具有相同的活性。本发明中所用术语“在严格条件下杂交”是指在可通过该条件鉴定的条件下进行杂交:在市售的杂交溶液ExpressHyb杂交溶液(Clontech公司制备)中,在68℃下进行杂交,或者使用其上固定有DNA的滤器,在0.7-1.0MNaCl存在下,在68℃进行杂交,然后在用0.1-2X的SSC溶液(1X的SSC溶液由150mMNaCl、15mM柠檬酸钠组成)在68℃下洗涤,或在与其同等的条件下杂交。1.Siglec-15本发明人发现Siglec-15基因在巨细胞瘤中特异性表达。另外本发明人还发现,在来自单核细胞的细胞系分化为破骨细胞时,Siglec-15基因表达量增加。本发明中所使用的Siglec-15可从人、非人哺乳动物(例如豚鼠、大鼠、小鼠、兔、猪、绵羊、牛或猴)或鸡的单核细胞或骨髓细胞直接纯化使用,或者制备上述细胞的细胞膜组分使用。此外,Siglec-15还可以体外合成,或者通过遗传工程使其在宿主细胞内产生获得。具体来说,遗传工程中,将Siglec-15cDNA整合到可表达Siglec-15cDNA的载体中,然后在含有转录和翻译所必需的酶、底物和能量物质的溶液中合成Siglec-15,或者通过使其它原核生物或真核生物的宿主细胞转化,以表达Siglec-15,由此可得到该蛋白。人Siglec-15的cDNA核苷酸序列以登录号NM_213602登录在GenBank中,并表示为序列表的SEQIDNO:1,其氨基酸序列以序列表的SEQIDNO:2表示。小鼠Siglec-15的cDNA核苷酸序列以登录号XM_884636登录在GenBank中,并表示为序列表的SEQIDNO:3,其氨基酸序列以序列表的SEQIDNO:4表示。去除信号序列的成熟的人Siglec-15相当于由SEQIDNO:2表示的氨基酸序列的氨基酸残基第21位至第328位构成的氨基酸序列。另外,去除信号序列的小鼠Siglec-15相当于由SEQIDNO:4表示的氨基酸序列的氨基酸残基第21位至第341位构成的氨基酸序列。另外,Siglec-15有时被称为CD33抗原样3、CD33分子样3、CD33样3或CD33L3,这些都表示相同的分子。Siglec-15的cDNA例如可通过被称为PCR的方法获得,其中使用以表达Siglec-15cDNA的cDNA文库为模板,以及特异性扩增Siglec-15的cDNA的引物进行聚合酶链反应(以下称为“PCR”)(Saiki,R.K.,等.,Science,(1988)239,487-49)。此外,下述的多核苷酸也包含在Siglec-15的cDNA中,所述多核苷酸与由与选自序列表的SEQIDNO:1和3的至少一种表示的核苷酸序列互补的核苷酸序列构成的多核苷酸在严格条件下杂交,并且编码具有与Siglec-15同等生物活性的蛋白质。此外,下述多核苷酸也包含在Siglec-15的cDNA中,所述多核苷酸是由人或小鼠Siglec-15基因座转录的剪接变体或与其在严格条件下杂交,且编码与Siglec-15具有同等生物活性的蛋白的多核苷酸。此外,下述蛋白也包含在Siglec-15中,所述蛋白由在选自序列表的SEQIDNO:2和4表示的氨基酸序列的至少一种氨基酸序列中,或从这些序列中去除信号序列的氨基酸序列中,包含一个或多个氨基酸取代、缺失、或添加,且具有与Siglec-15同等的生物活性的氨基酸序列构成。此外,下述蛋白也包含在Siglec-15中,所述蛋白由人或小鼠Siglec-15基因座转录的剪接变体编码的氨基酸序列,或其中包含一个或多个氨基酸序列取代、缺失、或添加,且具有与Siglec-15同等的生物活性的氨基酸序列构成。2.骨代谢异常的检测对人各种骨组织测试样品组中的Siglec-15基因表达量的分析显示:Siglec-15基因在巨细胞瘤(Giantcelltumor;GCT)中表达量显著增加,其中所述巨细胞瘤是破骨细胞样多核巨细胞大量出现的骨肿瘤,其临床特征是产生骨溶解性的骨破坏(Bullough等.,AtlasofOrthopedicPathology2ndedition,pp17.6-17.8,LippincottWilliams&WilkinsPublishers(1992))。另外还发现,在来自单核细胞的细胞系分化为破骨细胞时Siglec-15基因表达量增加。因此,可认为Siglec-15参与GCT之类的骨吸收增加的人的病理学。即,通过测定Siglec-15基因和/或Siglec-15在各细胞和/或各组织中的表达量,可以判定伴随Siglec-15的过量表达的骨代谢异常的状态。本说明书中,骨代谢异常的实例包括但不限于骨质疏松症(绝经后骨质疏松症、老年性骨质疏松症、由使用类固醇以及免疫抑制剂等治疗用药剂而导致的继发性骨质疏松症、伴随类风湿性关节炎的骨质疏松症)、伴随类风湿性关节炎的骨破坏、癌性高钙血症、伴随多发性骨髓瘤以及癌的骨转移的骨破坏、巨细胞瘤、牙周炎导致的牙齿缺失、人工关节周围的骨溶解、慢性骨髓炎中的骨破坏、佩吉特骨病、肾病性骨营养不良、以及成骨不全。在本发明中,用于检测Siglec-15基因和/或Siglec-15表达量的对象的“测试样品”是指由受试者或临床样品得到的骨髓、骨、前列腺、精巢、阴茎、膀胱、肾脏、口腔、咽、唇、舌、牙龈、鼻咽、食道、胃、小肠、大肠、结肠、肝脏、胆囊、胰脏、鼻、肺、软组织、皮肤、乳房、子宫、卵巢、脑、甲状腺、淋巴结、肌肉、脂肪组织等的组织,或血液、体液或排泄物等的样品,本发明中更优选血液或骨髓。3.抑制向破骨细胞分化的物质的筛选方法。本发明的一个实施方案可例示通过测定Siglec-15基因和/或Siglec-15的表达量,筛选抑制向破骨细胞分化的物质的方法。本发明的另一实施方案可例示通过鉴定抑制Siglec-15的诱导向成熟破骨细胞分化的活性的物质,筛选对骨代谢异常具有治疗效果和/或预防效果的物质的方法。“受试物质”是指通过本发明的筛选方法用于检测具有破骨细胞分化抑制活性的物质。受试物质的实例包括化合物、微生物的代谢产物、植物或动物组织的提取物、它们的衍生物,以及它们的混合物。另外,设计成使Siglec-15的表达量降低的核酸或其衍生物(如反义寡核苷酸、核酶、dsRNA、或siRNA)也可作为受试物质使用。受试物质的给予剂量以及浓度可适当设定,或者通过例如制成稀释系列等,可设定多种给予剂量。受试物质也可以以固体、液体等适当状态给予,还可以溶解于适当的缓冲液或添加稳定剂等。在使用培养细胞进行筛选的方法中,受试物质可以添加到培养基中,细胞在其中培养。在添加到培养基中的情况下,受试物质可以在培养开始时添加,也可以在培养中途添加,另外,添加次数也不限于一次。在受试物质存在下进行培养的期间也可适当设定,然而,优选30分钟-2周,更优选30分钟-72小时。将受试物质给予哺乳动物个体时,根据受试物质的物物理性质等适当决定给予途径,给予途径包括口服给予、静脉注射、腹腔内注射、经皮给予、皮下注射等。另外,可选择从给予受试物质后到获得测试样品的适合时间。本发明的筛选方法中使用的培养细胞可以是正常的细胞,也可以是显示异常生长的确定的细胞系或细胞,如癌细胞,只要是表达Siglec-15的哺乳动物细胞即可。其实例包括但不限于正常人破骨前体细胞(NormalHumanNaturalOsteoclastPrecursorCells、可由三光纯药有限公司购得,产品目录号2T-110)、来自小鼠单核细胞的细胞RAW264.7(ATCCCat.No.TIB-71)、RAW264细胞(ECACCCat.No.85062803)、以及来自小鼠骨髓的原代培养细胞等。作为培养细胞的动物种,优选人、小鼠或其它哺乳动物(豚鼠、大鼠、兔、猪、绵羊、牛、猴等)、以及鸡等,但并不限于这些。另外,作为培养细胞,更优选使用过量表达Siglec-15的哺乳动物细胞,例如,可例示RAW264.7细胞、RAW264细胞、293细胞、CHO细胞、COS7细胞等,其通过将Siglec-15基因与其启动子区一起导入以过量表达Siglec-15而改造。本发明的筛选方法也包括不使用培养细胞而将受试物质给予哺乳动物个体后,检测由该动物个体摘除的器官或组织细胞中Siglec-15基因的表达的方法。用于检测基因表达的器官或组织只要表达Siglec-15即可,然而,优选骨代谢异常相关组织,更优选骨组织和骨髓。作为哺乳动物物种,可以使用非人哺乳动物,优选小鼠、大鼠或仓鼠,更优选小鼠或大鼠。此外,作为显示骨代谢异常的动物模型,可以使用卵巢摘除动物,精巢摘除动物,将肿瘤细胞移植到皮下、皮内、左心室、骨髓、静脉或腹腔等中的携带癌症的动物,坐骨神经切除动物,佐剂性关节炎动物模型,胶原诱发性关节炎动物模型,糖皮质激素诱发性骨质疏松症动物模型,促老化小鼠(SAMP6小鼠、Matsushita等.,Am.J.Pathol.125,276-283(1986)),甲状腺/甲状旁腺摘除动物,持续注入甲状旁腺激素相关肽(PTHrP)的动物,破骨细胞发生抑制因子(OCIF)敲除小鼠(Mizuno等.,Biochem.Biophys.Res.Commun.,(1998)247,610-615),给予可溶性RANKL的动物等。还可以使用牙周病导致牙齿缺失的动物模型以及经改造过量表达Siglec-15的动物。此外,将经筛选选择的受试物质给予上述动物模型,测定可由测定骨组织中成熟破骨细胞数、骨密度、骨强度或骨形态取得的各参数;血中和尿中骨代谢参数(CTx、NTx等);或血钙水平等因骨代谢异常而引起变动的参数,由此可以评价该受试物质对于骨代谢异常的治疗效果和/或预防效果。本发明的方法中使用的培养细胞可以在任何条件下培养,只要所述条件能使培养的细胞在未添加受试物质的情况下表达Siglec-15即可。例如,已知对该培养细胞的培养条件,当在该条件下该细胞表达Siglec-15时,该细胞即可在该条件下培养。另外,在检测由哺乳动物个体摘除的器官或组织中的Siglec-15的表达时,该动物的饲养条件可为任何条件,只要该条件能使该动物在未添加受试物质的情况下表达Siglec-15的条件即可。另外,为检测受试物质对Siglec-15的表达的影响,有测定Siglec-15基因的表达量的方法以及测定Siglec-15基因的翻译产物即Siglec-15的表达量的方法。可以认为,抑制Siglec-15基因和/或Siglec-15的表达的受试物质是对骨代谢异常,优选骨质疏松症、或伴随类风湿性关节炎和/或癌的骨转移的骨破坏具有治疗效果和/或预防效果的物质。关于培养细胞中的Siglec-15基因的表达量的测定或Siglec-15的表达量的测定,可使用以下方法进行:Northern分析、定量PCR法、ELISA法等。另外,使用哺乳动物培养细胞时,可根据需要,将受试物质与适当量的RANKL、TNF-α、M-CSF或活性维生素D3等一起添加在培养基中,在不添加受试物质的对照中也以适当量添加RANKL、TNF-α、M-CSF或活性维生素D3等。此外,构建测定对Siglec-15的内源性配体的结合量的实验系统,评价是否由于添加受试物质而抑制该内源性配体向Siglec-15结合,籍此可筛选抑制向破骨细胞分化的物质。在下面的(1)至(3)中说明各筛选方法。(1)使用Siglec-15基因的方法本发明的筛选方法例如有使用来自哺乳动物的培养细胞的方法和使用哺乳动物个体的方法,以下分别介绍。(a)使用来自哺乳动物的培养细胞的方法(i)包括以下步骤a)至c)的方法:a)由来自哺乳动物的培养细胞提取总RNA的步骤,其中所述培养细胞在添加有受试物质的培养基中培养;b)检测a)得到的总RNA和从未添加受试物质进行培养的哺乳动物培养细胞得到的总RNA之间的Siglec-15基因表达量的差异的步骤;c)通过分析b)所述的基因表达量的差异,判定受试物质对于骨代谢异常的治疗和/或预防效果的步骤。(ii)包括以下步骤a)至d)的方法:a)由来自哺乳动物的培养细胞提取总RNA的步骤,其中所述培养细胞在添加有受试物质的培养基中培养;b)由来自哺乳动物的培养细胞提取总RNA的步骤,其中所述培养细胞在未添加受试物质的培养基中培养;c)分别测定上述a)得到的总RNA和b)得到的总RNA中的Siglec-15基因表达量的步骤;以及d)通过分析上述c)测定的上述a)得到的总RNA和b)得到的总RNA间的基因表达量的差异,判定受试物质对于骨代谢异常的治疗和/或预防效果的步骤。(b)使用哺乳动物个体的方法(i)包括以下步骤a)至c)的方法:a)从给予了受试物质的哺乳动物个体中采集测试样品,由该样品提取总RNA的步骤;b)检测来自a)的总RNA和从由未给予受试物质的动物个体采集的样品得到的总RNA之间的Siglec-15基因表达量的差异的步骤;c)通过分析b)所述的基因表达量的差异,判定受试物质对于骨代谢异常的治疗和/或预防效果的步骤。(ii)包括以下步骤a)至d)的方法:a)从给予了受试物质的哺乳动物个体中采集测试样品,由该样品提取总RNA的步骤;b)从未给予受试物质的哺乳动物个体中采集测试样品,由该样品提取总RNA的步骤;c)分别测定上述步骤a)得到的总RNA和上述步骤b)得到的总RNA中的Siglec-15基因表达量的步骤,以及d)通过分析c)所述的基因表达量的差异,判定受试物质对于骨代谢异常的治疗和/或预防效果的步骤。(2)使用Siglec-15的方法关于利用测定Siglec-15表达量进行筛选的方法,使用哺乳动物培养细胞的方法和使用动物个体的方法,各包含以下步骤。(a)使用来自哺乳动物的培养细胞的方法(i)包括以下步骤a)和b)的方法:a)测定来自哺乳动物的培养细胞中的Siglec-15表达量的步骤,其中所述培养细胞在添加有受试物质的培养基中培养;以及b)通过分析a)中测定的蛋白质的表达量和在未添加受试物质的培养基上培养的来自哺乳动物的培养细胞中该蛋白质表达量的差异,判定受试物质对骨代谢异常的治疗效果和/或预防效果的步骤。(ii)包括以下步骤a)至c)的方法:a)测定来自哺乳动物的培养细胞中的Siglec-15表达量的步骤,其中所述培养细胞在添加有受试物质的培养基中培养;b)测定来自哺乳动物的培养细胞中的上述a)所述的蛋白表达量的步骤,其中所述培养细胞在未添加受试物质的培养基中培养;以及c)通过检测由上述a)测定的蛋白表达量和由上述b)测定的该蛋白表达量之间的差异,判定受试物质对骨代谢异常的治疗效果和/或预防效果的步骤。(iii)包括以下步骤a)至c)的方法:a)在添加有受试物质的培养基上培养来自哺乳动物的细胞,固定由该培养细胞得到的总蛋白的步骤;b)对上述固定蛋白中的Siglec-15蛋白表达量进行测定的步骤;c)通过分析上述b)中检测的Siglec-15的表达量和从在未添加受试物质的培养基上培养的来自哺乳动物的培养细胞得到的总蛋白中该蛋白表达量的差异,判定受试物质对骨代谢异常的治疗效果和/或预防效果的步骤。(iv)包括以下步骤a)至e)的方法:a)在添加有受试物质的培养基上培养来自哺乳动物的细胞,固定由该培养细胞得到的总蛋白的步骤;b)在未添加受试物质的培养基上培养来自哺乳动物的细胞,固定由该培养细胞得到的总蛋白的步骤;c)使用与Siglec-15蛋白特异性结合的抗体或配体,对上述步骤a)所述的固定蛋白中Siglec-15蛋白的表达量进行测定的步骤;d)使用与Siglec-15蛋白特异性结合的抗体或配体,对上述步骤b)所述的固定蛋白中Siglec-15蛋白的表达量进行测定的步骤;e)通过分析由上述步骤c)测定的蛋白表达量和由上述步骤d)测定的蛋白表达量之间的差异,判定受试物质对骨代谢异常的治疗效果和/或预防效果的步骤。(b)使用哺乳动物个体的方法(i)包括以下步骤a)和b)的方法:a)从已给予受试物质的哺乳动物个体采集测试样品,测定受试样品的Siglec-15表达量的步骤;b)通过分析上述步骤a)中测定的Siglec-15的表达量和由未给予受试物质的哺乳动物个体采集的样品中该蛋白表达量之间的差异,判定受试物质对骨代谢异常的治疗效果和/或预防效果的步骤。(ii)包括以下步骤a)至c)的方法:a)使用与Siglec-15蛋白特异性结合的抗体或配体,对由已给予受试物质的哺乳动物个体采集的测试样品中的该蛋白表达量进行测定的步骤;b)测定由未给予受试物质的哺乳动物个体采集的测试样品中该蛋白表达量的步骤;以及c)通过分析由a)测定的Siglec-15表达量和由b)测定的该蛋白表达量的差异,判定受试物质对骨代谢异常的治疗效果和/或预防效果的步骤。(iii)包括以下步骤a)至c)的方法:a)从已给予受试物质的哺乳动物个体采集测试样品,将该样品中的总蛋白进行固定的步骤;b)对上述固定蛋白中的Siglec-15蛋白表达量进行测定的步骤;以及c)通过上述b)中检测的Siglec-15的表达量和由未给予受试物质的哺乳动物个体采集的测试样品中该蛋白表达量之间的差异,判定受试物质对骨代谢异常的治疗和/或预防效果的步骤。(iv)包括以下步骤a)至e)的方法:a)从已给予受试物质的哺乳动物个体采集测试样品,将该样品中的总蛋白进行固定的步骤;b)从未给予受试物质的哺乳动物个体采集测试样品,将该样品中的总蛋白进行固定的步骤;c)使用与Siglec-15蛋白特异性结合的抗体或配体,对上述步骤a)所述的固定蛋白中Siglec-15的表达量进行检测的步骤;d)使用与Siglec-15蛋白特异性结合的抗体或配体,对上述b)所述的固定蛋白中Siglec-15的表达量进行检测的步骤;以及e)通过分析由上述c)检测的该蛋白表达量和由上述d)检测的该蛋白表达量之间的差异,判定受试物质对骨代谢异常的治疗效果和/或预防效果的步骤。(3)使用内源性配体的筛选方法通过观察是否由于添加受试物质而抑制内源性配体与Siglec-15的结合,也可进行抑制向破骨细胞分化的物质的筛选。作为Siglec-15的内源性配体的唾液酸化多糖的实例包含与人和小鼠Siglec-15结合的Neu5Acα2-6GalNAc以及与小鼠Siglec-15结合的Neu5Acα2-3Galβ1-4Glc,然而,Siglec-15的内源性配体不受限于这些多糖,只要具有对Siglec-15的结合亲和力即可。基于测试与Siglec-15的结合的目的,这些内源性配体可用适当的标签、放射性同位素或荧光物质标记。例如,生物素化聚丙烯酰胺,其已结合有如Neu5Acα2-6GalNAc的唾液酸化寡糖,可作为与Siglec-15结合的探针用于筛选。作为结合内源性配体的Siglec-15,可使用Siglec-15表达细胞或从该细胞制备的膜组分。另外,也可从Siglec-15表达细胞分离、然后纯化Siglec-15用于筛选。作为Siglec-15表达细胞,可使用任何表达Siglec-15的培养细胞系、在适当的培养细胞中通过基因工程使Siglec-15基因短暂或持续表达的细胞、或从活体内得到的表达Siglec-15的细胞中任一种。使用这样的内源性配体的筛选方法可通过下述步骤进行。(i)包括以下步骤a)和b)的方法:a)向Siglec-15表达细胞中添加Siglec-15的内源性配体和受试物质的步骤;以及b)通过比较添加和未添加受试物质时内源性配体与Siglec-15表达细胞的结合量,判定受试物质对骨代谢异常的治疗和/或预防效果的步骤。(ii)包括以下步骤a)至c)的方法:a)制备Siglec-15表达细胞的细胞膜组分的步骤;b)向该细胞膜组分中添加Siglec-15的内源性配体和受试物质的步骤;以及c)通过比较添加和未添加受试物质时内源性配体与该细胞膜组分的结合量,判定受试物质对骨代谢异常的治疗和/或预防效果的步骤。(iii)包括以下a)至c)步骤的方法:a)制备Siglec-15的步骤;b)向a)中的Siglec-15中添加Siglec-15的内源性配体和受试物质的步骤;以及c)通过比较添加和未添加受试物质时内源性配体与Siglec-15的结合量,判定受试物质对骨代谢异常的治疗和/或预防效果的步骤。当通过遗传工程使适当的细胞表达Siglec-15,且将得到的Siglec-15纯化供筛选时,待筛选的Siglec-15可选自由以下的(a)至(i)中表示的氨基酸序列构成的多肽:(a)序列表中的SEQIDNO:2表示的氨基酸序列;(b)由序列表的SEQIDNO:2表示的氨基酸序列的氨基酸残基第21位至第328位构成的氨基酸序列;(c)由序列表中的SEQIDNO:2表示的氨基酸序列的氨基酸残基第1位至第260位构成的氨基酸序列;(d)由序列表中的SEQIDNO:2表示的氨基酸序列的氨基酸残基第21位至第260位构成的氨基酸序列;(e)序列表中的SEQIDNO:4表示的氨基酸序列;(f)由序列表中的SEQIDNO:4表示的氨基酸序列的氨基酸残基第21位至第341位构成的氨基酸序列;(g)由序列表中的SEQIDNO:4表示的氨基酸序列的氨基酸残基第1位至第258位构成的氨基酸序列;(h)由序列表中的SEQIDNO:4表示的氨基酸序列的氨基酸残基第21位至第258位构成的氨基酸序列;以及(i)包括(a)至(h)中所述的氨基酸序列中一个或多个氨基酸残基的取代、缺失或添加的氨基酸序列。待筛选的Siglec-15也可选自由以下的(j)至(n)表示的核苷酸序列编码的氨基酸序列构成的多肽:(j)SEQIDNO:1表示的核苷酸序列;(k)SEQIDNO:3表示的核苷酸序列;(l)SEQIDNO:19表示的核苷酸序列;(m)SEQIDNO:43表示的核苷酸序列;(n)具有与由与(j)至(m)中记载的核苷酸序列互补的核苷酸序列构成的多核苷酸在严格条件下进行杂交的多核苷酸的核苷酸序列。此外,通过将适当的标签与任意这些多肽连接的多肽,或与不同的可溶性蛋白质融合的多肽也可用作筛选目标。另外,由序列表中的SEQIDNO:2表示的氨基酸序列的氨基酸残基第1位至第20位构成的多肽相当于人Siglec-15的信号肽,而由其氨基酸残基第21位至第260位构成的多肽相当于人Siglec-15的成熟蛋白的胞外域。另外,由序列表中的SEQIDNO:4表示的氨基酸序列的氨基酸残基第1位至第20位构成的多肽相当于小鼠Siglec-15的信号肽,而由其氨基酸残基第21位至第258位构成的多肽相当于小鼠Siglec-15的成熟蛋白的胞外域。另外,SEQIDNO:43表示的核苷酸序列编码人Siglec-15的胞外域,所述人Siglec-15由SEQIDNO:1表示的核苷酸序列编码,而SEQIDNO:19表示的核苷酸序列编码小鼠Siglec-15的胞外域,所述小鼠Siglec-15由SEQIDNO:3表示的核苷酸序列编码。对于用(1)至(3)中的任一筛选方法筛选的抑制向破骨细胞分化的物质的候选物质,可以以如实施例17、19以及20所示的破骨细胞的抗酒石酸酸性磷酸酶(Tartrate-ResistantAcidPhosphatase:TRAP)活性的抑制为指标进行二次评价。此外,也可以以实施例19、21、22和35表示的TRAP阳性多核破骨细胞形成的抑制,即破骨细胞的细胞融合的抑制为指标进行二次评价。(4)其它方法对哺乳动物个体给予受试物以引起过量表达Siglec-15和不给予受试物质的情况,测定随时间变化的骨代谢异常的发病率、骨代谢异常的程度、和/或存活率等。给予受试物质的哺乳动物中,骨代谢异常发病率显著降低、骨代谢异常的程度显著减轻、和/或存活率增高为约10%以上,优选为约30%以上,更优选为约50%以上,此时可以选择受试物质作为对骨代谢异常具有治疗和/或预防效果的化合物。4.抗Siglec-15抗体的制备本发明的抗Siglec-15的抗体可通过以下方法获得:根据常规的方法,用选自Siglec-15或Siglec-15的氨基酸序列的任意的多肽来免疫动物,并采集和纯化活体内产生的抗体。作为抗原的Siglec-15的生物种不限于人,也可以用从小鼠、大鼠等人以外的动物得到的Siglec-15来免疫动物。在这种情况下,通过测试与得到的异源Siglec-15结合的抗体与人Siglec-15之间的交叉反应性,能够选择可适用于人的疾病的抗体。另外,可根据公知的方法(例如,KohlerandMilstein,Nature(1975)256,第495-497页;Kennet,R.ed.,MonoclonalAntibody,第365-367页,PrenumPress,N.Y.(1980)),通过使产生Siglec-15抗体的抗体产生细胞与骨髓瘤细胞融合来建立杂交瘤,以得到单克隆抗体。另外,作为抗原的Siglec-15可通过以下方法得到:通过遗传工程,使宿主细胞产生Siglec-15基因。具体而言,所述遗传工程可如下进行:制备可以表达Siglec-15基因的载体,将得到的载体转染至宿主细胞中表达该基因,然后纯化表达的Siglec-15。下面具体说明获得Siglec-15抗体的方法。(1)抗原的制备作为用于制备抗Siglec-15抗体的抗原的实例包括Siglec-15,或由Siglec-15的至少6个连续氨基酸残基组成的部分氨基酸序列构成的多肽、或者在其上附加有给定的氨基酸序列或载体而得到的衍生物。此外,对于“3.向破骨细胞的分化抑制物质的筛选方法”部分中,作为筛选目标例示的Siglec-15也可以作为用来制备抗Siglec-15抗体的抗原。Siglec-15可从人的肿瘤组织或肿瘤细胞中直接纯化后使用。此外,Siglec-15还可以体外合成,或者通过遗传工程使其在宿主细胞中产生获得。具体而言,在遗传工程中,将Siglec-15cDNA整合到可表达Siglec-15的载体中,然后Siglec-15在含有转录和翻译所必需的酶、底物和能量物质的溶液中合成,或者通过使其它原核生物或真核生物的宿主细胞转化,以表达Siglec-15,由此可得到抗原。另外,还可通过使作为膜蛋白的Siglec-15的胞外域与抗体的恒定区连接得到的融合蛋白在适当的宿主-载体系中表达,可以以分泌蛋白得到抗原。Siglec-15的cDNA例如可通过如下方法获得:例如,被称为PCR的方法,其中使用以表达Siglec-15cDNA的cDNA文库为模板,以及特异性扩增Siglec-15的cDNA的引物进行聚合酶链反应(以下称为“PCR”)(参照Saiki,R.K.,等.Science(1988)239,第487-489页)。多肽的体外合成系统,例如可举出罗氏诊断产品公司制备的快速翻译系统(RTS),但不受其限制。原核细胞宿主的实例包括大肠杆菌(Escherichiacoli)和枯草杆菌(Bacillussubtilis)等。为了在这些宿主细胞内转化靶基因,可以用含有来自与所述宿主相容的的种的复制子(即复制起点)以及调控序列的质粒载体转化宿主细胞。另外,所述载体优选具有可使转化细胞具有表型选择性的序列。真核细胞的宿主细胞的实例包含脊椎动物、昆虫和酵母,脊椎动物经常使用例如:猿细胞COS细胞(Gluzman,Y.Cell(1981)23,第175-182页、ATCCCRL-1650)、小鼠成纤维细胞NIH3T3(ATCCNo.CRL-1658)以及中国仓鼠卵巢细胞(CHO细胞、ATCCCCL-61)的二氢叶酸还原酶缺失细胞株(Urlaub,G.和Chasin,L.A.Proc.Natl.Acad.Sci.USA(1980)77,第4126-4220页)等,但不受其限制。如上所述得到的转化体可根据常规的方法培养,病通过培养该转化体,在细胞内或细胞外产生目标多肽。该培养使用的适合培养基可根据所采用的宿主细胞从常用的各种培养基选择。如果使用大肠杆菌,则可以使用根据需要在其中添加氨苄青霉素等抗生素或IPMG的LB培养基。通过上述培养,在转化体的细胞内或细胞外生产的重组蛋白可利用该蛋白的物理性质或化学性质,通过各种公知的分离操作方法进行分离和纯化。该方法的具体实例包括,通过常规的蛋白质沉淀剂进行的处理、超滤、如分子筛层析(凝胶过滤)、吸附色谱、离子交换色谱和亲和层析等各种液相色谱、透析法、以及它们的组合等。另外,可以通过将由6个组氨酸残基与上述待表达的重组蛋白连接,该蛋白可用镍亲和柱高效纯化。或者,可以通过将IgG的Fc区与待表达的重组蛋白连接,该蛋白可用蛋白A柱高效纯化。通过将上述方法组合,可以高产率、高纯度容易地大量制备目标多肽。(2)抗Siglec-15单克隆抗体的制备与Siglec-15特异性结合的抗体的例子包括与Siglec-15特异性结合的单克隆抗体,该抗体的获得方法如下所述。制备单克隆抗体一般需要下述操作步骤:(a)纯化作为抗原使用的生物聚合物;(b)通过向动物注射该抗原免疫该动物,然后采集血液,测定其抗体滴度,并确定脾摘除时间,以制备抗体产生细胞;(c)制备骨髓瘤细胞(以下称为“骨髓瘤”);(d)将抗体生成细胞和骨髓瘤融合;(e)筛选生成目标抗体的杂交瘤群;(f)将杂交瘤分开成为单细胞克隆(克隆)(g)任选培养杂交瘤,或培育移植有杂交瘤的动物,以制备大量单克隆抗体;(h)检测上述制备的单克隆抗体的生物活性及其结合特异性,或者鉴定其带有标记试剂的特性等。以下,按照上述步骤对单克隆抗体的制备方法进行详述,但该体的制备方法并不限于此,例如也可以使用脾细胞以外的抗体生成细胞和骨髓瘤。(a)抗原的纯化可以使用按照上述方法制备的Siglec-15或其部分肽作为抗原。另外,可以使用由表达Siglec-15的重组细胞制备的膜组分、或者使用表达Siglec-15的重组细胞本身、以及本领城技术人员公知的方法进行化学合成得到的本发明的蛋白的部分肽作为抗原。(b)抗体生成细胞的制备将步骤(a)中所得的抗原、佐剂(如弗氏完全或不完全佐剂、或者硫酸钾铝)混合,以所得到的混合物作为免疫原,对实验动物进行免疫。对于实验动物,可无困难地使用公知的杂交瘤制备方法中所使用的任何动物。具体而言,例如可使用小鼠、大鼠、山羊、绵羊、牛、马等。但是,从容易获得与提取的抗体生成细胞融合的骨髓瘤细胞的角度考虑,优选以小鼠或大鼠作为被免疫动物。此外,对于实际使用的小鼠和大鼠的株没有特别限制,小鼠例如可以使用A、AKR、BALB/c、BDP、BA、CE、C3H、57BL、C57BL、C57L、DBA、FL、HTH、HT1、LP、NZB、NZW、RF、RIII、SJL、SWR、WB、以及129等各系,而为大鼠时,例如可使用Wistar、Low、Lewis、SpraqueDaweley、ACI、BN、Fischer等。这些小鼠和大鼠例如可从日本CLEA、日本CharlesRiverLaboratories等实验动物培育销售商购得。其中,从与后述的骨髓瘤细胞的融合相容性考虑,特别优选小鼠中的BALB/c株、以及大鼠中的Wistar和Low系作为被免疫动物。另外,考虑到人和小鼠之间的抗原同源性,还优选使用除去自身抗体、具有降低的生物功能的小鼠,即自身免疫疾病小鼠。另外,这些小鼠或大鼠在免疫时的周龄优选为5-12周龄,更优选6-8周龄。为了Siglec-15或其重组体免疫动物,例如可采用Weir,D.M.,HandbookofExperimentalImmunologyVol.I.II.III.,BlackwellScientificPublications,Oxford(1987)、Kabat,E.A.和Mayer,M.M.,ExperimentalImmunochemistry,CharlesCThomasPublisherSpigfield,Illinois(1964)等中详细记载的公知的方法。这些免疫方法中,本发明优选的具体方法例如如下所述。即,首先,将作为抗原的膜蛋白组分或表达抗原的细胞皮内或腹腔内给予动物。但是,为提高免疫效率,优选两种给予途径的组合,如果前半阶段进行皮内给予,则后半阶段或者只在最后给药时进行腹腔内给予,则可特别提高免疫效率。给予抗原的方案根据被免疫动物的种类、个体差异等而不同。然而,通常抗原给予次数优选为3-6次、更优选给予次数为3-4次,而给予间隔为2-6周,更优选为2-4周。另外,抗原给予剂量根据动物的种类、个体差异等不同。然而,通常剂量设定为0.05-5mg,优选0.1-0.5mg左右。加强免疫在上述给予抗原1-6周后、优选2-4周后、更优选2-3周后进行。另外,进行加强免疫时的抗原给予剂量根据动物的种类或大小等而不同。然而,为小鼠时,剂量通常为0.05-5mg,优选0.1-0.5mg,更优选0.1-0.2mg左右。上述加强免疫1-10天后、优选2-5天后、更优选2-3天后,从被免疫动物中无菌摘取含有抗体生成细胞的脾细胞或淋巴细胞。此时,测定抗体滴度,以抗体滴度足够升高的动物作为抗体生成细胞供给源,这样后续的操作更有效率。这里所采用的抗体滴度的测定方法包括,例如RIA法或ELISA法,但不受这些方法的限制。例如,如果使用ELISA法,则本发明中抗体滴度的测定可根据如下所述步骤进行。首先,将纯化或部分纯化的抗原吸附于ELISA用96孔板等固相表面,再将未吸附抗原的固相表面用与抗原无关的蛋白例如牛血清白蛋白(以下称为“BSA”)包被。洗涤该表面,然后使该表面与作为初级抗体的系列稀释的样品(例如小鼠血清)接触,使样品中所含的抗体与上述抗原结合。再加入作为二级抗体的酶标抗小鼠抗体,使之与小鼠抗体结合,洗涤后加入该酶的底物,通过底物降解等诱导而显色,可测定由显色产生的吸光度的变化等,并计算抗体滴度。可通过公知的方法从上述脾细胞或淋巴细胞中分离抗体生成细胞(例如,Kohler等.,Nature(1975)256,第495页;Kohler等.,Eur.J.Immnol.(1977)6,第511页;Milstein等.,Nature(1977),266,第550页,;Walsh,Nature,(1977)266,第495页)。例如,为脾细胞时,可采用将脾匀浆以得到细胞,用不锈钢网过滤细胞,然后使细胞悬浮于Eagle基本培养基(MEM),从而分离抗体生成细胞的常规方法。(c)骨髓瘤细胞(以下称为“骨髓瘤”)的制备对于细胞融合所使用的骨髓瘤细胞没有特别限制,可从公知的细胞系中选择适合的细胞。但是,基于从融合细胞中选择杂交瘤时的便利性角度考虑,优选使用其选择步骤已经得到确立的HGPRT(次黄嘌呤-鸟嘌岭磷酸核糖转移酶)缺失细胞株。更具体而言,HGPRT缺失细胞株的实例包括来自小鼠的X63-Ag8(X63)、NS1-ANS/1(NS1)、P3X63-Ag8.UI(P3UI)、X63-Ag8.653(X63.653)、SP2/0-Ag14(SP2/0)、MPC11-45.6TG1.7(45.6TG)、F0、S149/5XXO和BU.1等,来自大鼠的210.RSY3.Ag.1.2.3(Y3)等,以及来自人的U266AR(SKO-007)、GM1500·GTG-A12(GM1500)、UC729-6、LICR-LOW-HMy2(HMy2)和8226AR/NIP4-1(NP41)等。这些HGPRT缺失细胞株例如可由AmericanTypeCultureCollection(ATCC)等获得。这些细胞株可在适当的培养基例如8-氮杂鸟嘌呤培养基[RPMI-1640培养基中加入谷氨酰胺、2-巯基乙醇、庆大霉素、以及胎牛血清(以下称为“FCS”),在所得培养基中再加入8-氮杂鸟嘌呤得到的培养基]、Iscove′s改性Dulbecco′s培养基(Iscove’sModifiedDulbecco’sMedium;以下称为“IMDM”)、或者Dulbecco′s改性Eagle培养基(Dulbecco’sModifiedEagleMedium;以下称为“DMEM”)中继代培养。在这种情况下,可以在细胞融合之前3-4日在正常培养基[例如含有10%FCS的ASF104培养基(味之素(株)制造)]中继代培养,以在融合当天得到不少于2×107的细胞。(d)细胞融合抗体生成细胞与骨髓瘤细胞的融合可按照公知的方法(Weir,D.M.,HandbookofExperimentalImmunologyVol.I.II.III.,BlackwellScientificPublications,Oxford(1987)、Kabat,E.A.和Mayer,M.M.,ExperimentalImmunochemistry,CharlesCThomasPublisherSpigfield,Illinois(1964)等),在不使细胞存活率过度降低的条件下适当实施。所述方法的实例包括:在聚乙二醇等高浓度聚合物溶液中将抗体生成细胞和骨髓瘤细胞混合的化学方法;利用电刺激的物理方法。这些方法中,上述化学方法的具体例子如下所述。即,使用聚乙二醇作为高浓度聚合物溶液时,在分子量为1500-6000、优选2000-4000的聚乙二醇溶液中、在30-40℃、优选35-38℃的温度下,使抗体生成细胞和骨髓瘤细胞混合1-10分钟,优选5-8分钟。(e)杂交瘤群的选择由上述细胞融合得到的杂交瘤的选择方法没有特别限制,通常,可以采用HAT(次黄嘌呤,氨基蝶呤,胸苷)选择法(Kohler等.,Nature(1975)256,p.495;Milstein等.,Nature(1977)266,p.550)。该方法对于使用在氨基蝶呤存在下无法存活的HGPRT缺失细胞株的骨髓瘤细胞获得杂交瘤的情形有效。即,通过将未融合细胞和杂交瘤在HAT培养基中培养,仅选择性地容许对氨基蝶呤具有抗性的杂交瘤存活并增殖。(f)分开成为单细胞克隆(克隆化)杂交瘤的克隆方法例如可使用甲基纤维素法、软琼脂糖法、或有限稀释法等公知的方法(例如参照Barbara,B.M.和Stanley,M.S.:SelectedMethodsinCellularImmunology,W.H.Freeman和Company,SanFrancisco(1980))。这些方法中,特别优选有限稀释法。该方法中,向微孔板上接种来自胎大鼠的成纤维细胞株或如正常小鼠脾细胞、胸腺细胞、腹水细胞等的饲养细胞。另一方面,预先将杂交瘤在培养基中稀释以得到细胞密度为0.2-0.5个/0.2ml,每孔中各加入0.1ml该稀释的杂交瘤悬浮液,以预定的时间间隔(例如每3天)将约1/3的培养基更换为新鲜培养基,持续培养两周左右,由此可使杂交瘤克隆增殖。使已确认了抗体滴度的孔中的杂交瘤经受克隆化,例如将有限稀释法克隆重复2-4次。将已确认具有稳定抗体滴度的杂交瘤选作抗Siglec-15单克隆抗体生成杂交瘤细胞株。这样克隆的杂交瘤细胞株的例子包括杂交瘤#32A1和杂交瘤#41B1。杂交瘤#32A1和杂交瘤#41B1于2008年8月28日保藏在IPOD,NITE-国家高级工业科学技术学院,国际专利生物保藏中心(所在地:邮政编码305-8566日本国茨城县筑波市东1条1门1中央第6)。杂交瘤#32A1以抗Siglec-15杂交瘤#32A1的名称及保藏号FERMBP-10999保藏,以及杂交瘤#41B1以抗Siglec-15杂交瘤#41B1的名称及保藏号FERMBP-11000保藏。另外,本说明书中,杂交瘤#32A1产生的抗体以“#32A1抗体”,或简单的“#32A1”表示;杂交瘤#41B1产生的抗体以“#41B1抗体”,或简单的#41B1”表示。另外,对于本说明书的实施例中取得的除#32A1抗体和#41B1抗体以外的抗体,也用同样的方法以抗体名表示。(g)通过杂交瘤的培养制备单克隆抗体对于上述选择的杂交瘤进行培养,可以有效获得单克隆抗体,但优选在培养之前对生成目标单克隆抗体的杂交瘤进行筛选。该筛选可采用已知的方法。本发明的抗体滴度的测定例如可通过上述(b)项说明的ELISA法进行。由上述方法得到的杂交瘤可以在液氮中或者-80℃或以下的冷冻箱中以冷冻状态保存。对于完成克隆后的杂交瘤,将培养基由HT培养基换为正常培养基进行培养。大量培养可以通过使用大型培养瓶的旋转培养或者通过旋动培养进行。从该大量培养得到的上清液中,通过使用如凝胶过滤等本领域技术人员公知的方法进行纯化,可得到与本发明的蛋白特异性结合的单克隆抗体。另外,向与杂交瘤同株小鼠(例如上述的BALB/c)或者Nu/Nu小鼠的腹腔内注射杂交瘤,使该杂交瘤增殖,由此可以获得含有大量本发明的单克隆抗体的腹水。腹腔内给予杂交瘤时,如果事先(3-7天前)给予如2,6,10,14-四甲基十五碳烷(2,6,10,14-tetramethylpentadecane)(降植烷)等的矿物油,则可得到更大量的腹水。例如,预先向与杂交瘤同株的小鼠腹腔内注射免疫抑制剂,使T细胞失活。20天后,使106-107个杂交瘤克隆细胞悬浮于不含血清的培养基中(0.5ml),然后向小鼠腹腔内注射该悬浮液,通常在腹部膨胀、充满腹水时由该小鼠采集腹水。通过该方法,可得到比培养液中的单克隆抗体约高100倍以上浓度的单克隆抗体。由上述方法得到的单克隆抗体例如可通过Weir,D.M.:HandbookofExperimentalImmunology,Vol.I,II,III,BlackwellScientificPublications,Oxford(1978)中记载的方法纯化。即所述方法的实例包括硫酸胺盐析法、凝胶过滤法、离子交换色谱法、亲和层析法等。简便的纯化方法可以利用市售的单克隆抗体纯化试剂盒(例如,MAbTrapGII试剂盒;Pharmacia,Inc.制造)等。上述所得单克隆抗体对于Siglec-15具有高抗原特异性。(h)单克隆抗体的测定上述所得单克隆抗体的同种型和亚类的确定可如下进行。首先,鉴定法的实例包括奥脱洛尼(Ouchterlony)法、ELISA法以及RIA法。奥脱洛尼法简便,但是单克隆抗体浓度低时需要进行浓缩操作。另一方面,使用ELISA法或RIA法时,可使培养上清液与吸附有抗原的固相进行直接反应,再通过使用各种免疫球蛋白同种型和亚类所对应的抗体作为二级抗体,可以鉴定单克隆抗体的同种型和亚类。此外,更简便的方法可利用市售的用于鉴定的试剂盒(例如,小鼠分型试剂盒;Bio-RadLaboratories制造)等。此外,蛋白的定量可通过福林劳里法、以及基于280nm处的吸光度[1.4(OD280)=免疫球蛋白1mg/ml]计算的方法进行。(3)其他抗体本发明的抗体不仅包括上述抗Siglec-15的单克隆抗体,而且包括以降低对人的异种抗原性等为目的人工改造的重组型抗体,例如嵌合抗体、人源化抗体和人抗体等。这些抗体可使用已知的方法制备。作为嵌合抗体,可例示抗体可变区和恒定区来自不同的种的抗体,例如使来自小鼠的抗体的可变区与来自人的恒定区结合的嵌合抗体(参照Proc.Natl.Acad.Sci.U.S.A.,81,6851-6855,(1984))。作为人源化抗体,可例示只将互补决定区(CDR;complementaritydeterminingregion)整合到来自人的抗体中的抗体(参照Nature(1986)321,第522-525页),以及通过CDR移植法,将一部分构架的氨基酸残基和CDR序列移植到人抗体得到的抗体(国际公开小册子WO90/07861)。此外,本发明的抗体包括人抗体。抗Siglec-15人抗体是指只具有来自人染色体的抗体的基因序列的人抗体。抗Siglec-15人抗体可通过使用人抗体生成小鼠的方法获得(参照Tomizuka,K.等.,NatureGenetics(1997)16,第133-143页;Kuroiwa,Y.等.,Nuc.AcidsRes.(1998)26,第3447-3448页;Yoshida,H.等.,AnimalCellTechnology:Basic和AppliedAspectsvol.10,第69-73页(Kitagawa,Y.,Matuda,T.和Iijima,S.编辑),KluwerAcademicPublishers,1999;Tomizuka,K.等.,Proc.Natl.Acad.Sci.USA(2000)97,第722-727页等),该人抗体生成小鼠具有含人抗体的H链和L链的基因的人染色体片段。这样的转基因动物,可通过如下具体制备:已破坏非人哺乳动物的内源性免疫球蛋白重链和轻链的基因座,取代的是借由酵母人工染色体(YAC)载体等导入人免疫球蛋白重链和轻链的基因座的遗传改造动物通过制备基因敲除动物和转基因动物并使其交配制备。此外,根据遗传工程技术,通过分别编码这样的人抗体的重链和轻链的cDNA,优选包含该cDNA的载体转化真核细胞,培养生成重组人单克隆抗体的转化体,由此该抗体也可由培养上清液获得。这里,宿主例如可以使用真核细胞、优选哺乳动物细胞,如CHO细胞、淋巴细胞以及骨髓瘤细胞。另外,还已知获得由人抗体文库筛选的来自噬菌体展示的人抗体的方法(参照Wormstone,I.M.等,InvestigativeOphthalmology&VisualScience.(2002)43(7),第2301-2308页;Carmen,S.等.,BriefingsinFunctionalGenomicsandProteomics(2002),1(2),第189-203页;Siriwardena,D.等.,Opthalmology(2002)109(3),第427-431页等)。例如,可使用使人抗体可变区作为单链抗体(scFv)在噬菌体表面表达,并选择与抗原结合的噬菌体的噬菌体展示法(NatureBiotechnology(2005),23,(9),笫1105-1116页)。通过分析基于与抗原结合选择的噬菌体基因,可确定编码与抗原结合的人抗体的可变区的DNA序列。若已明确与抗原结合的scFvDNA序列,可通过制备具有该序列的表达载体,并将该载体导入适当的宿主中使其表达,而获得人抗体(WO92/01047,WO92/20791,WO93/06213,WO93/11236,WO93/19172,WO95/01438,WO95/15388、Annu.Rev.Immunol(1994)12,第433-455页、NatureBiotechnology(2005)23(9),第1105-1116页)。抗体基因一旦分离,然后将该基因导入到适当的宿主中制备抗体时,可使用适当的宿主和表达载体的组合。将真核细胞用作宿主时,可使用动物细胞、植物细胞、真核微生物细胞。作为动物细胞,可例示哺乳类细胞,例如猿细胞的COS细胞(Gluzman,Y.Cell(1981)23,第175-182页、ATCCCRL-1650)、小鼠成纤维细胞NIH3T3(ATCCNo.CRL-1658)和中国仓鼠卵巢细胞(CHO细胞、ATCCCCL-61)的二氢叶酸还原酶缺失细胞株(Urlaub,G.和Chasin,L.A.Proc.Natl.Acad.Sci.U.S.A.(1980)77,第4126-4220页)。当使用原核细胞时,例如可例示大肠杆菌和枯草杆菌。通过转化,向这些细胞中导入目标抗体基因,并体外培养这样转化的细胞,由此可得到该抗体。本发明的抗体同种型没有限制,其实例包括IgG(IgG1、IgG2、IgG3、IgG4)、IgM、IgA(IgA1、IgA2)、IgD和IgE,且其优选实例包括IgG和IgM。此外本发明的抗体可以是具有抗体的抗原结合部位的抗体功能性片段或其修饰的片段。通过将该抗体用如木瓜蛋白酶或胃蛋白酶等的蛋白酶处理,或根据遗传工程技术修饰该抗体基因,并使该修饰的基因在适当的培养细胞中表达,可得到该抗体的片段。在这些抗体片段中,保持抗体全长分子功能的全部或部分的片段,可称为该抗体的功能性片段。一般而言,抗体功能可例示抗原结合活性、中和抗原活性的活性、增强抗原活性的活性、抗体依赖性细胞毒活性、补体依赖性细胞毒活性以及补体依赖性细胞性细胞毒活性。本发明中抗体功能性片段保持的功能优选抑制破骨细胞形成的活性,更优选抑制破骨细胞的细胞融合过程的活性。所述抗体片段的实例包括Fab、F(ab’)2、Fv、或以适当的接头连接重链和轻链Fv的单链Fv(scFv)、双抗体、线状抗体、以及由抗体片段组成的多特异性抗体等。另外,抗体片段还包括作为在还原条件下处理F(ab’)2抗体的可变区的单价片段的Fab’。此外,本发明的抗体可以是具有对至少两种不同抗原的特异性的多特异性抗体。通常,这样的分子结合两个抗原(即,双特异性抗体),但本发明中的“多特异性抗体”包含对两种或两种以上(例如,3种)抗原具有特异性的抗体。本发明的抗体可以是多特异性抗体,所述多特异性抗体由全长抗体,或这样的抗体的片段(例如,F(ab’)2双特异性抗体)构成。该双特异性抗体可通过连接两种抗体的重链和轻链(HL对)来制备,也可以通过使生成不同单克隆抗体的杂交瘤融合,以制备生成双特异性抗体的融合细胞来制备(Millstein等.,Nature(1983)305,第537-539页)。本发明的抗体可以是单链抗体(也称为scFv)。该单链抗体可通过以多肽接头连接抗体的重链V区和轻链V区获得(Pluckthun,ThePharmacologyofMonoclonalAntibodies,113(Rosenburg和Moore编,SpringerVerlag,NewYork,第269-315页(1994)、NatureBiotechnology(2005),23,第1126-1136页)。此外,也可将通过多肽接头连接两种scFv制备的BiscFv片段作为双特异性抗体使用。制备单链抗体的方法在本领域中公知(例如,参照美国专利笫4,946,778号、美国专利笫5,260,203号、美国专利第5,091,513号、美国专利第5,455,030号等)。这种scFv中,重链V区和轻链V区通过不产生缀合体的接头、优选多肽接头连接(Huston,J.S.等.,Proc.Natl.Acad.Sci.U.S.A.(1988),85,第5879-5883页)。scFv中重链V区和轻链V区可来自同一抗体,也可来自不同抗体。作为用于连接V区的多肽接头,例如可以使用由12-19残基构成的给定单链肽。编码scFv的DNA可如下获得:使用编码全部或所需氨基酸序列的部分DNA序列为模板,所述全部或所需氨基酸序列的DNA选自编码上述抗体的重链或重链V区的DNA以及编码其轻链或轻链V区的DNA,并使用限定其两端的引物对,通过PCR法进行扩增,接着,进一步进行扩增,所述扩增结合了编码多肽接头部分的DNA和限定其两端的引物对,从而将其两端分别连接重链和轻链。此外,编码scFv的DNA一经制备,可根据常规方法获得包含该DNA的表达载体以及由该表达载体转化的宿主。另外,通过使用该获得的宿主,可根据常规方法获得scFv。这些抗体片段可通过以上述相同的方法获得基因并表达该基因,由宿主产生。本发明的抗体,可以使其增量以提高对抗原的亲和性。待增量的抗体可以是一种抗体,也可以是识别相同抗原的多种表位的多种抗体。作为增量抗体的方法,可例示IgGCH3结构域与两个scFv分子结合,与链霉抗生素蛋白结合,螺旋-转角-螺旋基序导入等。本发明的抗体可以是为氨基酸序列不同的多种抗Siglec-15抗体的混合物的多克隆抗体。作为该多克隆抗体的一个例子,可例示具有不同CDR的多种抗体的混合物。作为这样的多克隆抗体,可使用培养产生不同抗体的细胞混合物,并由所得到的培养物纯化的抗体(参照WO2004/061104号)。作为修饰的抗体,也可使用与任意如聚乙二醇(PEG)的各种类型的分子结合的抗体。此外,本发明的抗体可以是这些抗体和其它药剂形成缀合体的形式(免疫缀合物)。作为这样的抗体的例子包括该抗体与放射性物质或具有药理作用的化合物缀合的那些(NatureBiotechnology(2005)23,第1137-1146页)。可以将所得抗体纯化至均一。抗体的分离和纯化可使用常规的蛋白的分离和纯化方法进行。例如,可适当选择并组合使用色谱柱、滤器、超滤、盐析、透析、制备的聚丙烯酰胺凝胶电泳、等电聚焦电泳等,进行抗体的分离和纯化(StrategiesforproteinPurificationandCharcterization:ALaboratoyCourseManual,DanielR.Marshak等.编辑,ColdSpringHarborLaboratoryPress(1996);Antibodies:ALaboratoryManual.EdHarlowandDavidLane,ColdSpringHarborLaboratory(1988)),但该方法不受这些方法的限制。色谱法的实例包括亲和层析法、离子交换色谱法、疏水色谱法、凝胶过滤色谱法、反相色谱法、和吸附色谱法。这些色谱法可使用液相色谱法进行,如HPLC或FPLC。作为用于亲和层析法的柱子,可例示蛋白A柱和蛋白G柱。例如,作为使用蛋白A柱的柱子,可例示HyperD、POROS、SepharoseF.F.(Pharmacia)等。另外,通过使用其上固定有抗原的载体,利用该抗体对抗原的结合特性也可纯化抗体。5.含有Siglec-15抗体的药物从由上述“4.抗Siglec-15抗体的制备”一项中所述的方法中得到的抗Siglec-15抗体中,可获得中和Siglec-15的生物活性的抗体。这些中和Siglec-15的生物活性的抗体可抑制生物体内的Siglec-15生物活性,即,抑制破骨细胞的分化和/或成熟,因此可作为药物,用作由破骨细胞的分化和/或成熟异常引起的骨代谢异常的治疗和/或预防剂。骨代谢异常可以是任何以骨的净流失(骨质减少或骨质溶解)为特征的病症。一般地,用抗Siglec-15抗体的治疗和/或预防适用于需要抑制骨吸收的情况。可用抗Siglec-15抗体治疗和/或预防的骨代谢异常的实例包括骨质疏松症(绝经后骨质疏松症、老年性骨质疏松症、由使用类固醇以及免疫抑制剂等治疗用药剂而导致的继发性骨质疏松症、或伴随类风湿性关节炎的骨质疏松症)、伴随类风湿性关节炎的骨破坏、癌性高钙血症、伴随多发性骨髓瘤以及癌的骨转移的骨破坏、巨细胞瘤、牙周炎导致的牙齿缺失、人工关节周围的骨溶解、慢性骨髓炎中的骨破坏、佩吉特骨病、肾病性骨营养不良、以及成骨不全等,然而,骨代谢异常不受这些的限制,只要其是伴随破骨细胞性的骨的净流失的疾病即可。作为上述药物使用的抗Siglec-15抗体的例子包括从#32A1抗体或#41B1抗体由4.(3)“其他抗体”中所述的方法制备的嵌合抗体和人源化抗体。此外,具有与#32A1抗体或#41B1抗体相同表位的嵌合抗体、人源化抗体以及人抗体也可作为药物使用。某种抗Siglec-15抗体具有与32A1抗体或#41B1抗体相同表位,可通过观察这些抗体是否与相同的Siglec-15的特定部分肽结合确认。此外,若某种抗Siglec-15抗体与#32A1抗体或#41B1抗体竞争性结合Siglec-15,则也可判定这些抗体具有相同的表位。抗Siglec-15抗体中和Siglec-15的生物活性的体外活性可通过例如抑制过量表达Siglec-15的细胞向破骨细胞分化的活性来测定。例如,以各种浓度向来自小鼠单核细胞的细胞系的RAW264.7细胞或RAW264细胞中添加抗Siglec-15抗体,可测定通过RANKL和TNF-α的刺激抑制向破骨细胞分化的活性。此外,以各种浓度向来自骨髓的原代培养细胞中添加抗Siglec-15抗体,可测定通过RANKL、TNF-α或活性维生素D3的刺激抑制向破骨细胞分化的活性。此外,以各种浓度向正常人破骨前体细胞(可购自三光纯药产品目录号2T-110)中添加抗Siglec-15抗体,可测定通过RANKL和M-CSF的刺激抑制向破骨细胞分化的活性。这样的对破骨细胞分化的抑制效应可以通过以实施例17、19、20和26所示的破骨细胞的抗酒石酸酸性磷酸酶(TRAP)活性的抑制为指标进行测定。此外,也可以通过以实施例19、21、22和35所示的TRAP阳性多核破骨细胞形成的抑制,即破骨细胞的细胞融合的抑制为指标测定对破骨细胞分化的抑制效应。在上述破骨细胞分化的试验系统中,本发明的抗体在30μg/ml或以下的浓度下显示对细胞融合的抑制效应,一些抗体甚至在3μg/ml或以下,或1μg/ml或以下的浓度下也显示抑制效应。此外,在试验在更低浓度下的效应时,观察到多个抗体甚至在63ng/ml至1μg/ml的浓度范围下对破骨细胞分化的抑制效果。此外,在使用来自股骨和/或胫骨的细胞进行的陷窝测定实验(Takada等.,BoneandMineral,(1992)17,347-359)中,通过以各种浓度向来自股骨和/或胫骨的细胞中添加抗Siglec-15抗体,并观察象牙质切片上的陷窝形成,可测定抑制破骨细胞的骨吸收的体外活性。作为测定抑制破骨细胞导致的骨破坏的体外活性的系统,如实施例37所示,也可使用涂层有缀合铕的人胶原的平板。上述破骨细胞所致的骨吸收的试验系统中,本发明的抗体在3μg/ml或以下的浓度下,即在从0.3μg/ml至3μg/ml的浓度范围下抑制骨吸收。利用实验动物进行的抗Siglec-15抗体对骨代谢异常的体内治疗或预防效应可通过如下确认:例如,对骨质疏松模型动物或过量表达Siglec-15的转基因动物给予抗Siglec-15抗体,并测定破骨细胞的变化。上述所得的中和Siglec-15的生物活性的抗体可用作药物、特别是用作治疗或预防骨代谢异常的的药物组合物,所述骨代谢异常如骨质疏松症、伴随类风湿性关节炎的骨破坏、伴随癌的骨转移的骨破坏,或者用于上述疾病的免疫学诊断的抗体。在类风湿性关节炎(RA)的治疗中,伴随该疾病的发病的骨流失是主要的难题。业已报道在伴随RA的这种骨流失中,破骨细胞起主要作用。被认为是RA中破骨细胞的诱导(分化和成熟)、活化、以及骨破坏的原因最重要的细胞因子为RANKL和TNF-α(RomasE等.,Bone30,第340-346,2002)。如本说明书的实施例19所示,作为RANKL的诱饵受体的OCIF/OPG可抑制由RANKL诱导的破骨细胞形成,但是不抑制TNF-α诱导的破骨细胞形成。另一方面,如本发明的抗Siglec-15抗体有效抑制由RANKL诱导的破骨细胞形成和TNF-α诱导的破骨细胞形成。因此,期望本发明的抗Siglec-15抗体可以比RANKL阻滞剂(OCIF/OPG、抗RANKL抗体等)更强力地抑制RA等中的TNF-α诱导的骨流失和骨破坏。作为一实例,对于骨代谢异常的治疗或预防,抗Siglec-15抗体可以单独给予,或与至少一种骨相关疾病的治疗剂一起给予。作为另一实例,抗Siglec-15抗体可以与治疗有效量的抗骨代谢异常治疗剂一起给予。可与抗Siglec-15抗体一起给予的治疗剂的实例包括但不限于,二膦酸盐、活性维生素D3、降钙素及其衍生物、雌二醇等激素制剂、SERMs(选择性雌激素受体调节剂)、依普黄酮、维生素K2(四烯甲萘醌)、钙制剂、PTH(甲状旁腺激素)制剂、非甾体类抗炎药、可溶性TNF受体制剂、抗TNFα抗体或该抗体的功能性片段、抗PTHrP(甲状旁腺激素相关蛋白)抗体或该抗体的功能性片段、IL-1受体拮抗剂、抗IL-6受体抗体或该抗体的功能性片段、抗RANKL抗体或该抗体的功能性片段以及OCIF。根据骨代谢异常的状态和希望治疗和/或预防的程度,可以给予2、3或更多种药物,这些药物可以通过封装在同一制剂中一起给予。也可以将这些药物与抗Siglec-15抗体通过封装在同一制剂中一起给予。此外,这些药物也可以通过封装为治疗和/或预防用试剂盒的形式一起给予。另外,还可以将这些药物与抗Siglec-15抗体分别供给。在基因治疗中给予时,可以将蛋白性的骨疾病治疗剂的基因和抗Siglec-15抗体的基因插入到相同或不同启动子区的下游,从而可导入至相同或不同的载体中。通过使骨疾病治疗剂与抗Siglec-15抗体或其片段缀合,可以制备如M.C.Garnet“Targeteddrugconjugates:principlesandprogress”,AdvancedDrugDeliveryReviews,(2001)53,171-216中所述的靶式药物缀合物。为达到该目的,可使用除抗体分子外的任何抗体片段,只要其没有完全失去对破骨细胞的识别能力,其实例包括Fab、F(ab’)2、以及Fv。本发明中也可以以相同的方式使用该抗体和该片段。抗Siglec-15抗体或该抗体的片段与骨疾病治疗剂形成的缀合物可为,如M.C.Garnet“Targeteddrugconjugates:principlesandprogress”,AdvancedDrugDeliveryReviews,(2001)53,171-216、G.T.Hermanson“BioconjugateTechniques”AcademicPress,California(1996)、Putnam和J.Kopecek“PolymerConjugateswithAnticancerActivity”AdvancesinPolymerScience(1995)122,55-123等中所述的各种形式的任意一种。即,可例示抗Siglec-15抗体和骨疾病治疗剂彼此化学性直接缀合或经由寡肽等间隔区而缀合的缀合物形式、经由适当的药物载体缀合的缀合物形式。药物载体的例子包括脂质体和水溶性聚合物。通过这些药物载体的缀合物形式的更具体实例包括:将抗体和骨疾病治疗剂合并入脂质体中,并将该脂质体与抗体彼此缀合的缀合物形式;以及骨疾病治疗剂与水溶性聚合物(分子量1000-100000左右的化合物)化学性直接或经由寡肽等间隔区缀合,并将抗体与该水溶性聚合物缀合的缀合物形式。抗体(或其片段)与骨疾病治疗剂、或脂质体以及水溶性聚合物等药物载体的缀合可按照本领域技术人员公知的方法实施,如G.T.Hermanson“BioconjugateTechniques”AcademicPress,California(1996)、Putnam和J.Kopecek“PolymerConjugateswithAnticancerActivity”AdvancesinPolymerScience(1995)122,55-123中所述的方法。骨疾病治疗剂在脂质体中的合并可按照本领域技术人员公知的方法实施,如D.D.Lasic“Liposomes:FromPhysicstoApplications”,ElsevierSciencePublishersB.V.,Amsterdam(1993)中所述的方法等。骨疾病治疗剂与水溶性聚合物的合并可按照本领域技术人员公知的方法实施,如D.Putnam和JKopecek“PolymerConjugateswithAnticancerActivity”AdvancesinPolymerScience(1995)122,55-123中所述的方法。除上述方法外,抗体(或其片段)与蛋白性的骨疾病治疗剂(或其片段)的缀合物还可通过本领域技术人员公知的方法通过遗传工程实施。本发明也提供含有治疗和/或预防有效量的抗Siglec-15抗体和药学上可接受的稀释剂、载体、增溶剂、乳化剂、防腐剂和/或佐剂的药物组合物。本发明还提供含有治疗和/或预防有效量的抗Siglec-15抗体、治疗和/或预防有效量的至少一种骨疾病治疗剂,以及药学上可接受的稀释剂、载体、增溶剂、乳化剂、防腐剂和/或佐剂的药物组合物。骨疾病治疗剂的实例包括但不限于二膦酸盐、活性维生素D3、降钙素及其衍生物、如雌二醇的激素制剂、SERMs(选择性雌激素受体调节剂)、依普黄酮、维生素K2(四烯甲萘醌)、钙制剂、PTH(甲状旁腺激素)制剂、非甾体类抗炎药、可溶性TNF受体制剂、抗TNFα抗体或该抗体的功能性片段、抗PTHrP(甲状旁腺激素相关蛋白)抗体或该抗体的功能性片段、IL-1受体拮抗剂、抗IL-6受体抗体或该抗体的功能性片段、抗RANKL抗体或该抗体的功能性片段以及OCIF(破骨细胞发生抑制因子)。根据本发明的药物组合物中可接受的用于制剂中的物质优选在其给予量和给予浓度时对给予药物组合物的人没有毒性。本发明的药物组合物可包含能改变或维持pH、渗透压、粘度、透明度、颜色、等张性、颜色、无菌条件、稳定性、溶解度、缓释率、吸收率、以及渗透性的制剂用物质。制剂用的物质的实例包括但不限于以下物质:如甘氨酸、丙氨酸、谷氨酰胺、天冬酰胺、精氨酸和赖氨酸的氨基酸类;抗菌剂;如抗坏血酸、硫酸钠或亚硫酸氢钠的抗氧化剂;如磷酸盐、柠檬酸盐、硼酸盐缓冲液、碳酸氢盐和Tris盐酸(Tris-HCl)溶液的缓冲剂;如甘露醇和甘氨酸的填充剂;如四乙酸乙二胺(EDTA)的螯合剂;如咖啡因、聚乙烯吡咯烷、β-环糊精和羟丙基-β-环糊精的络合剂;如葡萄糖、甘露糖和糊精的增量剂,如单糖类和二糖类的其它碳水化合物;着色剂;香味剂;稀释剂;乳化剂;如聚乙烯吡咯烷的亲水聚合物;如低分子量多肽,成盐抗衡离子,笨扎氯铵、安息香酸盐、水杨酸、硫汞撒、苯乙醇、羟苯甲酯、羟苯丙酯、氯己定、山梨酸和过氧化氢的防腐剂;如甘油、丙二醇和聚乙二醇的溶剂;如甘露醇和山梨醇的糖醇;混悬剂;如脱水山梨糖醇酯、包括聚山梨酯20和聚山梨酯80的聚山梨酯、三硝基甲苯(triton)、氨丁三醇、卵磷脂和胆固醇的表面活性剂;如蔗糖和山梨醇的稳定性强化剂;如氯化钠、氨化钾和甘露醇和山梨醇的弹性增强剂;转运剂;稀释剂;赋形剂和/或药学上的佐剂。这些制剂用的物质的添加量优选添加抗Siglec-15抗体重量的0.01-100倍,特别优选0.1-10倍。制剂中合适的药物组合物的优选组成可由本领域技术人员根据所适用的疾病、适用的给予途径等适当确定。药物组合物中的赋形剂和载体可以是液体也可以是固体的形式。适当的赋形剂或载体还可以是注射用水、生理盐水、人工脑脊液或胃肠外给予中通常所使用的其它物质。此外,还可以将中性生理盐水或含有血清白蛋白的生理盐水作为载体使用。药物组合物可以含有pH7.0-8.5的Tris缓冲液或pH4.0-5.5的乙酸盐缓冲液,并可补充山梨醇或其它化合物。本发明的药物组合物的实例包括含有抗Siglec-15抗体的药物组合物、以及含有抗Siglec-15抗体和至少一种骨疾病治疗剂的药物组合物。本发明的药物组合物作为具有所选择的组成和所需的纯度的药剂,制成冻干品或液体形式。含有抗Siglec-15抗体的药物组合物以及含有抗Siglec-15抗体和至少一种骨代谢异常的治疗剂的药物组合物也可以使用适当的赋型剂(如蔗糖)形成冻干品。本发明的药物组合物可以制成胃肠外给予,还可以制成经口服的消化道吸收用的形式。制剂的组成和浓度可根据给予方法确定。对于本发明的药物组合物中所含的抗Siglec-15抗体对Siglec-15的亲和性较高,即,对Siglec-15的解离常数(Kd值)较低,则该抗Siglec-15抗体可显示其在较低剂量对人的药效,因此基于该结果,还可以确定本发明的药物组合物对人的剂量。对于剂量,在对人给予人抗Siglec-15抗体时,该抗体可以约0.1-100mg/kg、1~180天一次给予。本发明的药物组合物的剂型的实例包括如下:包括输液的注射剂、栓剂、经鼻剂、舌下剂、经皮吸收剂等。6.直接相互作用的物质的探索本发明的另一实施方案包括为获得抑制Siglec-15活性的物质并基于Siglec-15的构型的药物设计方法。所述方法已知有合理化药物设计方法,并用于探索有效抑制或激活酶活性或与配体、协同因子、或DNA结合的化合物。作为这样的化合物的例子,市场上的作为抗HIV药物的蛋白酶抑制剂广为人知。本发明的Siglec-15的三维结构分析也可以利用X射线晶体分析或核磁共振等通常广为人知的方法。此外,为了探索抑制Siglec-15功能的物质,还可以进行应用计算机辅助药物设计(CADD)的设计。其例子已知有抑制AP-1活性并有望作为类风湿性关节炎治疗的新型基因组新药的低分子量化合物(国际专利申请公开WO99/58515号)等。通过所述方法,有可能得到抑制Siglec-15功能的物质,其通过与Siglec-15直接结合或者通过抑制Siglec-15与其它因子的相互作用。此外,另一实施方案涉及与本发明的Siglec-15联合的多肽,即Siglec-15的伴侣蛋白。即,本发明涉及调节Siglec-15活性的伴侣蛋白的筛选方法。该筛选方法的一个实施方案包含使受试蛋白样品与Siglec-15接触,并选择与Siglec-15结合的蛋白的步骤。该方法例如可例示使用纯化的Siglec-15,亲和纯化与其结合的蛋白的方法。该方法的具体的实例描述如下。以由6个组氨酸组成的序列作为亲和标记物,使其与Siglec-15融合,以制备融合蛋白,将所得蛋白与细胞提取液(将细胞溶液装满镍-琼脂糖柱后,取通过该柱的组分)在4℃下孵育12小时,然后向该混合物中另外添加镍-琼脂糖载体,将该混合物在4℃下孵育1小时。用洗涤缓冲液充分洗涤镍-琼脂糖载体,然后在混合物中添加100mM咪唑,由此使细胞提取液中的与Siglec-15特异性结合的蛋白洗脱并纯化,然后,纯化的蛋白经分析并确定其结构。如上所述,可以纯化与Siglec-15直接结合的蛋白、以及与Siglec-15不具结合活性但与Siglec-15间接结合的蛋白,其中所述间接结合通过与上述作为亚单元的与Siglec-15直接结合的蛋白形成复合物达到。作为替代的方法,还可以有通过far-western免疫印迹法、或使用酵母或哺乳类动物细胞的双杂交系统法进行的克隆,但并不限于这些方法。如果如此得到与Siglec-15直接或间接相互作用的伴侣蛋白的cDNA,则该cDNA可以用于功能性筛选抑制Siglec-15与该伴侣蛋白的相互作用的物质。具体而言,例如制备Siglec-15与谷胱甘肽S-转移酶的融合蛋白,并使其与用抗谷胱甘肽S-转移酶抗体包被的微孔板结合,然后使生物素化的伴侣蛋白与该融合蛋白接触,通过链霉抗生物素缀合的碱性磷酸酶检测该伴侣蛋白与该融合蛋白的结合。添加生物素化的伴侣蛋白时也添加受试物质,以选择促进或抑制该融合蛋白与该伴侣蛋白结合的物质。通过该方法,可得到与该融合蛋白直接作用的物质或与该伴侣蛋白直接作用的物质。当该融合蛋白通过另一因子与该伴侣蛋白的间接结合时,例如,在含有该因子的细胞提取液存在下,进行上述测定。在这种情况下,也有可能选择对该因子作用的物质。此外,所得伴侣蛋白具有促进Siglec-15功能的活性时,按照上述的应用Siglec-15基因的表达载体的实验方法,可以进行可用作骨代谢异常治疗和/或预防药剂、例如骨质疏松症的治疗和/或预防药剂的候选物质的筛选。此外,当所得伴侣蛋白具有抑制Siglec-15的功能的活性时,编码上述抑制因子的多核苷酸可用于骨代谢异常的基因治疗。所述多核苷酸可通过如下方法获得:例如,对已鉴定的抑制因子的氨基酸序列进行分析,合成寡核苷酸探针,其中该寡核苷酸探针编码该氨基酸序列,并进行cDNA文库或基因组文库的筛选。此外,当具有抑制Siglec-15功能的活性的多肽为来自随机合成的人工肽文库时,化学合成由编码该肽的氨基酸序列的核苷酸序列构成的DNA。在基因治疗中,将编码上述所得的抑制因子的基因整合到例如病毒载体中,使具有所得重组病毒载体的病毒(已减毒处理)感染患者。患者体内产生抗骨破坏因子,并运行具有抑制破骨细胞分化的功能,因此,可以实现治疗和/或预防骨代谢异常。将基因治疗剂导入细胞内的方法可以采用利用病毒载体的基因转移方法、或非病毒性的基因转移方法。用病毒载体进行基因转移的方法的实例包括:将编码Siglec-15的抑制因子或其突变体的DNA整合到DNA病毒或RNA病毒中的方法,以实现基因转移,所述DNA病毒或RNA病毒反转录病毒、腺病毒、腺相关病毒、疱疹病毒、牛痘病毒、痘病毒、脊髓灰质炎病毒、或辛德比斯病毒。其中,特别优选使用反转录病毒、腺病毒、腺相关病毒或牛痘病毒的方法。非病毒性的基因转移方法的实例包括:将表达质粒直接给予肌肉的方法(DNA疫苗法)、脂质体法、脂转染法、微注射法、磷酸钙法以及电穿孔法。具体而言,优选DNA疫苗法和脂质体法。此外,为了使基因治疗剂实际作为药物使用,还有将DNA直接导入体内的体内法和由人体取出某种细胞,在体外将DNA导入该细胞,再将该细胞返回体内的回体法(exvivo)。例如,通过体内法给予该基因治疗剂时,根据疾病、症状等,可通过静脉或动脉、皮下、皮内、或肌内等适当的给予途径给予。另外,通过体内法给予时,该基因治疗剂通常配制成注射剂,然而,也可以根据需要加入常用的载体。此外,制成脂质体或膜融合脂质体(如仙台病毒-脂质体)的形式时,可以配制成如混悬剂、冷冻剂、离心浓缩和冷冻剂等脂质体制剂。与序列表中的SEQIDNO:1或3表示的核苷酸序列的全长序列或部分序列互补的核苷酸序列,可用于所谓的反义治疗。反义分子可以作为与选自序列表中的SEQIDNO:1和3表示的核苷酸序列的核苷酸序列的一部分互补、通常由15-30个核苷酸构成的DNA使用;或作为其稳定的DNA衍生物,如其硫代磷酸酯、膦酸甲酯或吗啉代衍生物;或稳定的RNA衍生物,如2'-O-烷基RNA使用。通过注射极小量该反义分子、通过将该分子形成脂质体胶囊,或者利用具有反义序列的载体表达该分子等本发明的
技术领域:
中公知的方法,可将上述反义分子导入到细胞中。上述反义疗法用于治疗由于序列表中的SEQIDNO:1或3表示的核苷酸序列所编码的蛋白活性过度增加而引起的疾病。另外,还可例示使用双链短RNA(siRNA)的方法(“ジ一ンズ·ァンド·デヴェロシプメンシ(GenesandDevelopments)”),2001年1月15日,笫15卷,第2号,第188-200页)。例如,制备Siglec-15基因的siRNA,并根据该文献所述的方法导入细胞,由此可制备伴随Siglec-15的过量表达的骨代谢性疾病的治疗剂。实施例以下,通过参考实施例更详细说明本发明,然而,本发明不受这些实施例的限定。此外,下述实施例中,如无特别说明,基因操作相关的各操作均按照“分子克隆(MolecularCloning)”(Sambrook,J.,Fritsch,E.F.和Maniatis,T.著,ColdSpringHarborLaboratoryPress,1989年发行)中所述的方法进行,或者在使用市售试剂或试剂盒时,按照市售品所附的说明书使用。实施例1巨细胞瘤组织中人Siglec-15基因的表达巨细胞瘤(GCT)是组织学上出现大量破骨细胞样多核巨细胞的骨肿瘤,且其特征是临床发现具有骨溶解性的骨破坏(Bullough等.,AtlasofOrthopedicPathology2ndedition,17.6-17.8,LippincottWilliams&WilkinsPublishers(1992))。使用GeneLogic,Inc.的数据库(Genesis2006Release3.0),对具有与人Siglec-15基因部分重复的核苷酸序列的EST探针(AffymetrixGeneChipHG-U133探针215856_at:Affymetrix,Inc.制备)在GCT组织中的表达谱进行分析。此外,对于对破骨细胞分化具有重要作用的RNAK(AffymetrixGeneChipHG-U133探针207037_at,Affymetrix,Inc制备)和RNAKL(AffymetrixGeneChipHG-U133探针210643_at,Affymetrix,Inc.制备)、以及对于作为破骨细胞分化标志物的组织蛋白K(AffymetrixGeneChipHG-U133probe202450_s_at,Affymetrix,Inc.制备)和TRAP(AffymetrixGeneChipHG-U133probe204638_at,Affymetrix,Inc.制备)的EST探针,也以相同的方式进行GCT组织中的表达谱分析。对13例正常骨组织、12例GCT组织、16例GCT以外的骨肿瘤组织进行表达量比较,其显示,与正常组织相比,GCT组织中的RNAK和RNAKL的转录特异性增加(图1-A)。另一方面,被认为不一定会引起骨吸收增加的GCT以外的骨肿瘤组织中,RNAK和RNAKL的转录比在GCT中的低,由此表明GCT提供促进破骨细胞形成和活化的环境。另外,对组织蛋白酶K和TRAP的基因表达量进行比较,在GCT中这些基因以高水平转录(图1-B),表明出现大量具有骨吸收活性的破骨细胞。类似地,对于Siglec-15基因进行转录水平比较,发现该基因与RNAK、RNAKL、组织蛋白酶K和TRAP各基因相同,在GCT中以高水平特异性转录(图2)。由此表明Siglec-15与如GCT的骨吸收增加的人的病理学相关。实施例2从来自小鼠的成熟破骨细胞的总RNA的提取a)用含有10%胎牛血清的α-MEM培养基将来自小鼠单核细胞的细胞RAW264.7(ATCCCat.No.TIB-71)制备成4.5×104细胞/ml,将所得到的细胞制剂接种于75cm2的烧瓶,每烧瓶10ml,添加人RANKL(PeproTech公司制备),得到终浓度为40ng/ml,在CO2培养箱中培养该细胞3天。另外,以相同的方式对未添加人RANKL的细胞进行培养。培养结束后,根据试剂所附的方法,使用总RNA提取用试剂(ISOGEN:日本基因公司制备),由在各自条件下培养的RAW264.7提取总RNA。在-80℃下保存收集的总RNA。b)在活性维生素D3存在下培养来自小鼠骨髓的原代培养细胞时,则出现大量TRAP阳性多核破骨细胞(Takahashi等.,Endocrinology,(1988)122,1373-1382)。在乙醚麻醉下用颈椎脱臼使8周龄雄性DDY小鼠安乐死,摘取股骨和胫骨。除去软组织,然后截断股骨或胫骨两端,用带有25号注射针头的注射筒向骨髓中注入包含10%胎牛血清的α-MEM培养基,并采集骨髓细胞。计数细胞数,然后在包含10%胎牛血清的α-MEM培养基中制备成5×106细胞/ml,将所得到的细胞制剂以100μl/孔×60孔接种于96孔板,添加活性维生素D3(Sigma公司制备)以得到终浓度为2×10-8M,在CO2培养箱中培养所述细胞8天。另外,一相同方式对未添加活性维生素D3的细胞进行培养。此外,在第3天和笫6天实施培养基替换和活性维生素D3的添加。接着,根据试剂所附的方法,使用总RNA提取用试剂(ISOGEN:日本基因公司制备),由在各自条件下培养的细胞提取总RNA。在-80℃下保存收集的总RNA直至使用。实施例3小鼠Siglec-15开放阅读框(ORF)序列的取得a)第一链cDNA合成向实施例2的a)中制备的总RNA1μg中加入1μl的1U/μlDNAseI、1μl10×DNAseI缓冲液(Invitrogen,Inc.制备),用H2O使终体积为10μl,在室温下使其反应15分钟,然后添加1μl25mMEDTA,得到的混合物在65℃下加热10分钟。由该溶液取8μl的等分样品,添加1μl的50μMoligo(dT)20引物和1μl的10mMdNTPs,得到的混合物在65℃下加热5分钟,然后在冰中孵育。向该溶液中加入2μl的10×RT缓冲液(Invitrogen,Inc.制备)、4μl的25mMMgCl2、2μl的0.1M二硫苏糖醇、1μlRNAse抑制剂(RNAseOUT,40U/μl,Invitrogen,Inc.制备)、1μlSuperscriptIII逆转录酶(200U/μl、Invitrogen,Inc.制备)并使其总体积为20μl。该混合物在50℃下反应50分钟,然后在85℃下加热5分钟,冰中孵育一分钟。之后将该混合物在-20℃下保存。b)PCR反应按照常规方法,合成具有以下序列的寡核苷酸:5'-agaattccaccATGGAGGGGTCCCTCCAACTC-3’(mSiglec-15-EcoRIkozak-F:序列表中的SEQIDNO:5)以及5'-cgccgctcgagTTATTTCTCATGGTGAATGAC-3'(mSiglec-15-XhoI-R:序列表中的SEQIDNO:6)其用作通过PCR法扩增小鼠Siglec-15的ORFcDNA的引物。使用所述引物组合和a)中制备的cDNA,以及高保真聚合酶(Invitrogen,Inc.制备)按照常规方法进行PCR。热循环仪条件设定如下:在94℃下加热2分钟,然后重复“94℃下0.5分钟、55℃下0.5分钟、68℃下1.5分钟”的温度循环35次,然后在68℃下加热5分钟,并在4℃下孵育。c)向pcDNA3.1(+)载体的克隆对b)中得到的PCR反应液和pcDNA3.1(+)载体(Invitrogen,Inc.制备)进行限制性酶处理(EcoRI、XhoI),柱纯化后,按照常规方法进行连接酶反应。用得到的载体向大肠杆菌DH5α-T1转化,并接种于含有氨苄青霉素的培养皿。由上述所得大肠杆菌菌落,分离出含有小鼠Siglec-15/pcDNA3.1(+)质粒的转化大肠杆菌。用DNA测序仪分析插入所得质粒中的ORFcDNA的总核苷酸序列,结果发现其为序列表中的SEQIDNO:3表示的序列。所述核苷酸序列,与以“小鼠CD33L3”(登录号:XM_884636)登录于NCBIGenBank数据库中的预测序列的ORF编码区相同,此外,由该核苷酸序列编码的氨基酸序列(序列表中的SEQIDNO:4)与小鼠CD33L3的预测氨基酸序列100%一致。实施例4伴随小鼠破骨细胞分化的Siglec-15的mRNA表达(实时PCR分析)a)向实施例2的a)或b)中制备的总RNA的1μg中加入1μl的1U/μlDNAseI、1μl的10×DNAseI缓冲液(Invitrogen,Inc.制备),用H2O至终体积为10μl,在室温下使其反应15分钟,然后添加1μl的25mMEDTA,所得到的混合物在65℃下加热10分钟。由该溶液取8μl等分样品,添加1μ的150μMoligo(dT)20引物和1μl的10mMdNTPs,将得到的混合物在65℃下加热5分钟,然后在冰中孵育。向该溶液中加入2μl的10×RT缓冲液(Invitrogen,Inc.制备)、4μl的25mMMgCl2、2μl的0.1M二硫苏糖醇、1μl的RNAse抑制剂(RNAseOUT、40U/μl、Invitrogen,Inc.制备)、1μlSuperscriptIII逆转录酶(200U/μl、Invitrogen,Inc.制备)并使其总体积为20μl,使该混合物在50℃下反应50分钟,然后在85℃下加热5分钟,在冰中孵育。使用如上所述制备的单链cDNA,用下面的引物和荧光标记探针(TaqMan探针、应用生物系统公司制备)的组合进行实时PCR。实时PCR条件:小鼠Siglec-15扩增用引物:5'-tcaggctcaggagtccaattat-3’(TqM-mSiglec-15-F:序列表中的SEQIDNO:7)以及5'-ggtctagcctggtactgtccttt-3’(TqM-mSiglec-15-R:序列表中的SEQIDNO:8)、小鼠Siglec-15检测用TaqMan探针:5’-Fam-atttgagccagatgagtcctccaggcca-TAMRA-3’(TqM-mSiglec-15-探针:序列表中的SEQIDNO:9)、小鼠L32核糖体蛋白扩增用引物:5'-aagaagttcatcaggcaccagt-3'(TqM-mL32-F:序列表中的SEQIDNO:10)以及5’-cttgacattgtggaccaggaac-3'(TqM-mL32-R:序列表中的SEQIDNO:11)小鼠L32核糖体蛋白检测用TaqMan探针:5’-Fam-aaacccagaggcattgacaacagggtgc-TAMRA-3’(TqM-mL32-探针:序列表中的SEQIDNO:12)使用实时PCR系统(ABIPrism7700序列检测器、(株)珀金埃尔默日本·应用生物系统事业部制),在以下条件下进行实时PCR分析。在反应中使用TaqMan通用PCR主要混合液(应用生物系统公司制备)。首先,向各25pmol的引物、8ng的单链cDNA和10pmol的TaqMan探针中加入蒸馏水使终体积为25μl,然后,加入25μlTaqMan通用PCR主要混合液,由此制备50μl的反应液。将该反应液在50℃加热2分钟,然后在95℃下加热10分钟,重复“95℃下0.25分钟、60℃下1分钟”的温度循环40次,进行实时PCR分析。此外,用L32核糖体蛋白的mRNA表达量校正小鼠Siglec-15的mRNA表达量。其结果是,在向RAW264.7中添加RANKL诱导破骨细胞时,以及向来自小鼠骨髓的原代培养细胞中添加活性维生素D3诱导破骨细胞时,Siglec-15基因的表达量都显著上升(图3)。b)在包含10%胎牛血清的α-MEM培养基中将RAW264.7制备成4.5×104细胞/ml,将得到的细胞制剂接种于75cm2的烧瓶,每烧瓶10ml,添加人RANKL(PeproTech公司制备)使其终浓度为40ng/ml,在CO2培养箱中将该细胞培养0、1、2和3天。另外,以相同的方式对未添加人RANKL的细胞进行培养。培养结束后,根据试剂所附的方法,使用总RNA提取用试剂(ISOGEN:日本基因公司制备),由在各自条件下培养的RAW264.7提取总RNA。在-80℃下保存收集的总RNA。向如此收集的总RNA1μg中加入1μl的1U/μlDNAseI、1μl的10×DNAseI缓冲液(Invitrogen,Inc.制备),用H2O使终体积为10μl,在室温下使其反应15分钟,然后添加1μl的25mMEDTA,将得到的混合物在65℃下加热10分钟。由该溶液取8μl等分样品,添加1μl的50μMoligo(dT)20引物和1μl的10mMdNTPs,将得到的混合物在65℃下加热5分钟,然后在冰中孵育。向该溶液中加入2μl的10×RT缓冲液(Invitrogen,Inc.制备)、4μl的25mMMgCl2、2μl的0.1M二硫苏糖醇、1μl的RNAse抑制剂(RNAseOUT、40U/μl、lnvitrogen,Inc.制备)、1μlSuperscriptIII逆转录酶(200U/μl、Invitrogen,Inc.制备)使其总体积为20μl.使该混合物在50℃下反应50分钟,然后在85℃下加热5分钟,然后在冰中孵育。使用如上所述制备的单链cDNA,用下面的引物和荧光标记探针(TaqMan探针、应用生物系统公司制备)的组合进行实时PCR。实时PCR条件:小鼠组织蛋白酶K扩增用引物:5'-ggcatctttccagttttacagc-3’(TqM-mcatK-F:序列表中的SEQIDNO:13)以及5'-gttgttcttattccgagccaag-3’(TqM-mcatK-R:序列表中的SEQIDNO:14)、小鼠组织蛋白酶K检测用TaqMan探针:5'-Fam-atgtgaaccatgcagtgttggtggtggg-TAMRA-3’(TqM-mcatK-探针:序列表中的SEQIDNO:15)、小鼠TRAP扩增用引物:5'-gaacttccccagcccttactac-3’(TqM-mTRAP-F:序列表中的SEQIDNO:16)以及5'-aactgctttttgagccaggac-3’(TqM-mTRAP-R:序列表中的SEQIDNO:17)小鼠TRAP检测用TaqMan探针:5’-Fam-ttgccagtcagcagcccaaaatgcct-TAMRA-3’(TqM-mTRAP-探针:序列表中的SEQIDNO:18)、小鼠Siglec-15扩增用引物:5'-tcaggctcaggagtccaattat-3’(TqM-mSiglec-15-F:序列表中的SEQIDNO:7)以及5'-ggtctagcctggtactgtccttt-3’(TqM-mSiglec-15-R:序列表中的SEQIDNO:8)、小鼠Siglec-15检测用TaqMan探针:5’-Fam-atttgagccagatgagtcctccaggcca-TAMRA-3’(TqM-mSiglec-15-探针:序列表的SEQIDNO:9)、小鼠L32核糖体蛋白扩增用引物:5'-aagaagttcatcaggcaccagt-3'(TqM-mL32-F:序列表中的SEQIDNO:10)以及5,-cttgacattgtggaccaggaac-3'(TqM-mL32-R:序列表中的SEQIDNO:11)小鼠L32核糖体蛋白检测用TaqMan探针:5’-Fam-aaacccagaggcattgacaacagggtgc-TAMRA-3’(TqM-mL32-探针:序列表中的SEQIDNO:12)使用实时PCR系统(ABIPrism7700序列检测器、(株)珀金埃尔默日本·应用生物系统事业部制),在以下条件下进行实时PCR分析。在反应中使用TaqMan通用PCR主要混合液(应用生物系统公司制备)。首先向各25pmol的引物、8ng的单链cDNA和10pmol的TaqMan探针中加入蒸馏水使终体积为25μl,然后加入25μl的TaqMan通用PCR主要混合液,由此制备50μl的反应液。将该反应液在50℃加热2分钟,然后在95℃下加热10分钟,重复“95℃下0.25分钟和60℃下1分钟”的温度循环40次,进行实时PCR分析。此外,用L32核糖体蛋白的mRNA表达量校正各基因的mRNA表达量。其结果是,已知作为破骨细胞的标记分子的组织蛋白酶K和TRAP基因表达量在RANKL添加后笫2-3天显著上升(图4-A、B)。类似地,Siglec-15基因表达量也在RANKL添加后第2-3天显著上升(图5)。由此结果可知,伴随破骨细胞分化的Siglec-15基因表达上调,特别是Siglec-15基因在分化后期有强的表达。实施例5可溶性小鼠Siglec-15蛋白的表达构建体的制备。编码小鼠Siglec-15蛋白的胞外域的部分核酸序列为序列表中的SEQIDNO:19,氨基酸序列为序列表中的SEQIDNO:20。通过利用这样的部分序列,可使动物细胞等的培养上清液中产生可溶性小鼠Siglec-15蛋白。a)通过PCR的可溶性小鼠Siglec-15基因的扩增按照常规方法,合成具有以下序列的寡核苷酸:5'-ggggacaagtttgtacaaaaaagcaggcttcaccATGGAGGGGTCCCTCCAACTC-3’(mSiglec-15-ECD-F:序列表中的SEQIDNO:21)以及5'-ggggaccactttgtacaagaaagctgggtcTCCGGGGGCGCCGTGGAAGCGGAAC-3’(mSiglec-15-ECD-R:序列表中的SEQIDNO:22)其用作通过PCR法扩增小鼠Siglec-15的胞外结构域cDNA的引物。此外,这些引物设计为在mSiglec-15-ECD-F中添加attB1序列,以及在mSiglec-15-ECD-R中添加attB2序列,作为扩增引物以制备Gateway进入克隆(entryclone),。按照常规方法,使用所述引物组合和作为模板的实施例3制备的小鼠Siglec-15/pcDNA3.1(+)质粒进行PCR。热循环仪条件设定如下:在94℃下加热5分钟,然后重复“94℃下0.5分钟、55℃下0.5分钟以及68℃下1.5分钟”的温度循环15次,再在68℃下加热5分钟,然后在4℃下孵育。b)通过GatewayBP反应的进入克隆的制备采用以下方法制备进入克隆,所述进入克隆通过应用λ噬菌体的部位特异性重组系统的Gateway技术(Invitrogen,Inc.),将小鼠Siglec-15胞外域的cDNA整合至克隆中。首先,在两端带有a)中制备的attB序列的PCR产物和具有attP序列的供体载体pDNOR221(Invitrogen,Inc.制备)之间,使用BP克隆酶进行BP反应。通过使用该反应液,转化大肠杆菌DH10B,对耐药性克隆进行菌落PCR,确认插入片段的大小。然后,对已确认具有正确大小的插入片段的克隆实施插入片段总DNA序列的序列分析,结果得到与编码小鼠Siglec-15蛋白的胞外域的目标核酸序列(序列表中的SEQIDNO:19)完全相同的进入克隆。c)通过GatewayLR反应的表达克隆的制备采用以下方法制备表达克隆,所述表达克隆通过应用λ噬菌体的部位特异性重组系统的Gateway技术(Invitrogen,Inc.),将小鼠Siglec-15胞外域的cDNA整合至克隆中。b)中制备的进入克隆含有两端具有attL序列的插入片段。在所述进入克隆和具有attR序列的两种目标载体之间,使用LR克隆酶进行LR反应。另外,作为目标载体,使用两种目标载体:设计成在该插入片段的C端添加V5表位标签和6×His标签的pDONM、和设计成在插入片段的C端添加人Fc标签的phIgFc。通过使用由LR反应得到的反应液,转化大肠杆菌DH10B,对所得耐药性克隆进行菌落PCR,确认插入片段大小。然后,对已确认插入片段正确大小的克隆进行从插入片段侧到载体侧的两端的序列分析。用于序列分析的引物序列:5'-tgcgtgaaggtgcagggcag-3’(mSiglec-15-ECD-seq-upstm:序列表中的SEQIDNO:23)以及5'-cctcgcctggtcgggtc-3’(mSiglec-15-ECD-seq-dnstm:序列表中的SEQIDNO:24)序列分析的结果是,分别得到pDONM和phIgFc的两种正确重组的表达克隆(可溶性小鼠Siglec-15/pDONM和可溶性小鼠Siglec-15/phIgFc)。通过将可溶性小鼠Siglec-15/pDONM转染到动物细胞等,具有序列表中的SEQIDNO:25表示的碱基序列的mDNA被转录,并被翻译成具有序列表中的SEQIDNO:26表示的氨基酸序列的蛋白(小鼠Siglec-15-His)。通过将可溶性小鼠Siglec-15/phIgFc转染到动物细胞等,具有序列表中的SEQIDNO:27表示的碱基序列的mDNA被转录,并被翻译成具有序列表中的SEQIDNO:28表示的氨基酸序列的蛋白(小鼠Siglec-15-Fc)。实施例6用于可溶性小鼠Siglec-15蛋白制备的最适培养时间的检测a)使用293-F细胞的蛋白表达分别以约100μg的量制备由实施例5得到的两种表达质粒(可溶性小鼠Siglec-15/pDONM和可溶型小鼠Siglec-15/phlgFc)。将制备的质粒各50μg与Opfi-MEM(Invitrogen,Inc.制备)混合,滤器灭菌后,向其中添加64μl作为转染试剂的293fectin(Invitrogen,Inc.製),得到的混合物在室温下孵育25分钟。向在摇瓶中培养的FreeStyle293-F细胞(Invitrogen,Inc.制备)添加中每种如此得到的混合液,使得细胞密度在FreeStyle293细胞表达培养基(Invitrogen,Inc.制备)中达到1.0×106细胞/ml×50ml。在8.0%CO2浓度、37℃下使所述细胞经受旋转培养(125转/分)96小时(4天)。以24小时间隔收集少量培养液(培养时间:0、24、48、72、96小时),并离心制备培养上清液。一般认为在上述制备的培养上清液中分别表达在小鼠Siglec-15的胞外域C端已添加V5表位标签和6×His标签的蛋白(小鼠Siglec-15-His)和在小鼠Siglec-15的胞外域C端已添加人Fc标签的蛋白(小鼠Siglec-15-Fc)。b)随表达小鼠Siglec-15-His的293F细胞的培养时间变化的表达量的变化通过使用a)中制备的表达小鼠Siglec-15-His的293F细胞的培养液(培养时间:0、24、48、72、96小时)样品和市售的含有His标签的蛋白质,重组人护骨素/his(OPG-Fc-His)(R&Dsystems,Inc.制备)用还原条件下的SDS-聚丙烯酰胺电泳和western免疫印迹法进行表达量的分析。即,向用MicroconYM-10(MilliporeCo.,Ltd.制备)将各培养液浓缩20倍得到的5μl样品或5μlOPG-Fc-His溶液中加入等量的SDS-处理液(包含1mMEDTA、2.5%SDS、0.1%溴酚蓝、和5%2-巯基乙醇的10mMTris-HCl缓冲液(pH8.0)),得到的混合物在95℃下加热10分钟。将0.8μl热处理过的各样品用于SDS-聚丙烯酰胺电泳。电泳的凝胶使用8-25%聚丙烯酰胺梯度胶(AmershamBiosciences,Inc.制备),并且电泳用Phastsystem进行(AmershamBiosciences,Inc.制备)。此外,分子量标记使用ECLDua/VueWestern免疫印记法标记(AmershamBiosciences,Inc.制备),。电泳结束后,使用PhastTransfer半干转移试剂盒(PhastTransferSemi-dryTransferKit)(AmershamBiosciences,Inc.制备),和快速电泳系统(快速电泳系统)将凝胶中的蛋白转印(印迹)到PVDF膜(Hybond-P、AmershamBiosciences,Inc.制备)上。将所述PVDF膜移入包含0.1%Tween20的10ml封闭剂(BlockAce,雪印乳业公司制备)中,在室温下缓慢振荡1小时。向所述封闭溶液中加入5μlS-蛋白HRP溶液(ECLDua/Vue免疫印记法标记,AmershamBiosciences,Inc.制备)和2μl抗6His-HRP抗体(PentaHisHRP共轭试剂盒,Qiagen,Inc.制备),再将该膜在室温下缓慢振荡1小时。通过将其在50ml包含0.01%Tween20的磷酸盐缓冲生理盐水(PBS)中缓慢振荡5分钟,洗涤所述PVDF膜4次。洗涤后,按照ECL检测试剂盒(ECLwestern免疫印记检测试剂与分析系统,AmershamBiosciences,Inc.制备)所附的方法处理PVDF膜,使含有His标签的蛋白质条带显色,使用ECLmini-camera(AmershamBiosciences,Inc.生产)和即显胶片(Polapan3200B,宝丽来公司生产)检测其显色。结果如图6所示。由此结果,产生最高浓度的分子量约35kDa的蛋白(小鼠Siglec-15-His)并与抗6His-HRP抗体反应的293F细胞的培养时间选择96小时。c)随表达小鼠Siglec-15-Fc的293F细胞的培养时间变化的表达量的变化使用a)中制备的表达小鼠Siglec-15-Fc的293F细胞的培养液(培养时间:0、24、48、72、96小时)样品和人IgG(Sigma公司生产),用非还原条件下的SDS-聚丙烯酰胺电泳和Western免疫印迹法进行表达量的分析。即向5μl各培养液样品和5μl人IgG溶液中加入等量的SDS-处理液,得到的混合物在95℃下加热10分钟。使用0.8μl热处理过的各试样,以与前述b)中所述的方法相同的方法实施SDS-聚丙烯酰胺电泳、向PVDF膜的转印(印迹)、以及PVDF膜的封闭。向封闭过的PVDF膜加入5μlS-蛋白HRP溶液(ECLDua/VueWestern免疫印迹法标记,AmershamBiosciences,Inc.生产)和2μl抗人IgGFc-HRP抗体(抗人IgG(Fc特异性)过氧化氢酶缀合物,Sigma公司生产),再将溶液中的膜在室温下缓慢振荡1小时。以与前述b)中所述相同的方法洗涤后,检测含有Fc的蛋白的条带的显色。结果如图7所示。由此结果,产生最高浓度的分子量约110kDa的蛋白(小鼠Siglec-15-Fc)并与抗人Fc抗体反应的293F细胞的培养时间选择96小时。实施例7使用293-F细胞大量制备含可溶性小鼠Siglec-15蛋白培养液分别以约5mg的量制备由实施例5得到的两种表达质粒(可溶性小鼠Siglec-15/pDONM和可溶性小鼠Siglec-15/phIgFc)。另外,纯化来自大量培养的大肠杆菌的质粒时,使用InvitrogenPureLinkHiPurePlasmidGigaprepKit(Invitrogen,Inc.生产)。将如此制备的质粒与Opti-MEM(Invitrogen,Inc.生产)混合,滤器灭菌后,添加10ml作为转染试剂的293fectin(Invitrogen,Inc.製),得到的混合物在室温下孵育20分钟。向在锥形烧瓶中培养的FreeStyle293-F细胞中(Invitrogen,Inc.生产)添加每种如此获得的混合液,以使在FreeStyle293表达培养基(Invitrogen,Inc.生产)中的细胞密度达到1.1×106细胞/ml×5L(1L/烧瓶,5瓶)。在8.0%CO2浓度、37℃下96小时(4日)旋转培养(125转/分)该细胞,然后收集该培养液,并离心以制备培养上清液。一般认为上述制备的培养上清液中,分别表达在小鼠Siglec-15的胞外域C端已添加V5表位标签和6×His标签的蛋白(小鼠Siglec-15-His)和在小鼠Siglec-15的胞外域C端已添加人Fc标签的蛋白(小鼠Siglec-15-Fc)。实施例8小鼠Siglec-15-His的纯化a)HisTrapHP柱色谱向2L实施例7制备的表达小鼠Siglec-15-His的293F细胞的培养液中加入225mL的10x缓冲液(500mMTris,1.5MNaCl,200mM咪唑,pH8.0),充分搅拌得到的混合物,然后用SterivexGV滤器(MilliporeCo.,Ltd.生产)过滤。将此培养液以流速2ml/min加载至串联的3根5mLHisTrapHP柱(AmershamBiosciences,Inc.生产),所述柱预先用热原去除剂PyroCLEAN(ALerCHEK公司生产)处理,并且用注射用蒸馏水洗涤。使用60ml含有300mMNaCl的50mMTris-HCl缓冲液(pH8.0),在流速1ml/min下洗涤该柱,然后使用50ml含有300mMNaCl,500mM咪唑的50mMTris-HCl缓冲液(pH8.0),在流速1ml/min下洗脱吸附于柱上的蛋白质。洗脱液以每馏分1ml被分馏到预先加入10μl的0%Tween20的Mini-sorp管(Nunc公司生产)中。合并含有洗脱蛋白的馏分(馏分14-20),将得到的约20ml的溶液用离心膜浓缩器AmiconUltra-15(MilliporeCo.,Ltd.生产)浓缩至2.5ml,将该浓缩液加载至预先用包含0.01%Tween20的磷酸盐缓冲生理盐水(T-PBS)平衡的PD-10脱盐柱(AmershamBiosciences,Inc.生产),用T-PBS洗脱,由此得到3.5ml溶剂置换为T-PBS的样品。b)ResourceQ柱色谱向3.5ml用HisTrapHP柱色谱纯化的TBS-P置换样品中加入22.5ml含有0.1%CHAPS的50mMTris-HCl缓冲液(pH7.5)并将得到的混合物搅拌,然后将该混合物在4℃、3,000r.p.m.下离心30分钟,除去沉淀物。用MillexGV滤器(MilliporeCo.,Ltd.生产)过滤得到的上清液,然后将滤出液以流速1ml/min加载至用含有0.1%CHAPS的50mMTris-HCl缓冲液(pH7.5)预先平衡的ResourceQ6mL柱(AmershamBiosciences,Inc.生产)。然后使用该缓冲液在流速1ml/min下洗涤柱,收集未吸附于柱上的蛋白馏分。用含有0.1%CHAPS和1MNaCl的50mMTris-HCl缓冲液(pH7.5)在流速1ml/min下洗脱吸附于柱上的蛋白。用离心膜浓缩器AmiconUltra-15(MilliporeCo.,Ltd.生产)将26.5ml未吸附于柱上的馏分浓缩为2.0ml,然后将该浓缩液在4℃、3,000r.p.m.下离心10分钟,并除去沉淀物。在-80℃下冷冻保存离心后的上清液直至使用。重复实施两次上述纯化操作(HisTrapHP柱色谱和ResourceQ柱色谱)。c)纯化的小鼠Siglec-15-His的检测和纯度分析使用上述纯化操作(HisTrapHP柱色谱和ResourceQ柱色谱)制备的样品在还原条件下进行SDS-聚丙烯酰胺电泳和银染色。即,向5μl经各纯化步骤纯化的各样品加入等量的SDS-处理液,得到的混合物在95℃下进行10分钟热处理。将3μl热处理过的各样品用于SDS-聚丙烯酰胺电泳。除使用彩虹分子量标记(AmershamBiosciences,Inc.生产)作为分子量标记之外,电泳操作用与前述实施例6的b)相同的方法实施。电泳结束后,使用PhastGel银试剂盒(AmershamBiosciences,Inc.生产)和快速电泳系统进行银染色,其结果如图8所示。所述结果表示在未吸附于ResourceQ柱的蛋白质馏分中,分子量约35kDa的蛋白(小鼠Siglec-15-His)被有效纯化并浓缩。除使用ECLDua/VueWestern免疫印记法标记(AmershamBiosciences,Inc.生产)作为分子量标记以外,在相同的条件下进行电泳。使用PhastTransfer半干转移试剂盒(AmershamBiosciences,Inc.生产)和快速电泳系统将电泳的凝胶中的蛋白转印到PVDF膜(Hybond-P、AmershamBiosciences,Inc.生产)上。将所述PVDF膜在含0.1%Tween20的10ml封闭剂(BlockAce,雪印乳业公司制备)中在室温下缓慢振荡1小时。向所述封闭剂溶液中加入10μlS-蛋白HRP(AmershamBiosciences,Inc.)和10μl抗V5-HRP抗体(抗Pk-TAG-HRP单克隆抗体,Acris抗体公司生产),再将在溶液中的膜在室温下缓慢振荡1小时。通过将该PVDF膜在50ml含0.01%Tween20的磷酸盐缓冲生理盐水(PBS)中缓慢振荡5分钟,洗涤PVDF膜4次。洗涤后,按照ECL检测试剂盒(AmershamBiosciences,Inc.生产)所附的方法处理该PVDF膜以使蛋白条带显色,并用ECLmini-camera(AmershamBiosciences,Inc.生产)和宝丽来胶片(Polapan3200B、Polaroid,Inc.生产)检测蛋白条带的显色。其结果如图9所示。由该结果也可确认,在未吸附于ResourceQ柱的蛋白质馏分中,分子量约35kDa并与抗V5-HRP抗体反应的蛋白(小鼠Siglec-15-His)被有效纯化和浓缩。d)纯化的小鼠Siglec-15-His的蛋白纯度的测定对于纯化小鼠Siglec-15-His(未吸附于ResourceQ柱的蛋白质馏分),使用牛血清白蛋白作为标准品,用DC-蛋白检测试剂盒(Bio-RadLaboratories,Inc.生产)测定蛋白浓度。如表1所示,通过2次纯化操作得到合计1.66mg的纯化小鼠Siglec-15-His蛋白。表1蛋白浓度(mg/ml)样品量(ml)总蛋白(mg)第一次0.4752.00.95第二次0.3542.00.71合计1.66实施例9小鼠Siglec-15-Fc的纯化a)HiTrap蛋白A柱色谱用LSterivexGV滤器(MilliporeCo.,Ltd.生产)过滤1.8L实施例7制备的表达小鼠Siglec-15-Fc的293F细胞的培养液,然后将滤出液以流速5ml/min加载至用Dulbecco’sPBS(D-PBS、Invitrogen,Inc.制备)预先平衡的HiTrap蛋白A5mL柱(AmershamBiosciences,Inc.生产)。在流速5ml/min下使用D-PBS洗涤柱,然后使用50ml的0.1M柠檬酸钠缓冲液(pH3.0)以流速5ml/min洗脱吸附于柱上的蛋白。洗脱液以每馏分5ml被分馏到Mini-sorp管(Nunc公司生产)中,然后立即加入1MTris1.3ml中和。将已检测被洗脱的蛋白馏分(馏分1和2)合并后得到的溶液用离心膜浓缩器AmiconUltra-15(MilliporeCo.,Ltd.生产)浓缩为2.5ml,浓缩液加载至用含0.01%Tween20的大塚注射用生理盐水(TO-SS,大塚制药公司生产)预先平衡的PD-10脱盐柱(AmershamBiosciences,Inc.生产),然后用TO-SS洗脱,由此得到溶剂置换为TO-SS的3.5ml样品。在-80℃下冷冻保存该样品直至使用。使用2.9L的293F细胞培养液,再重复实施1次同样的纯化操作。b)纯化的小鼠Siglec-15-Fc的检测和纯度分析使用通过上述纯化制备的样品,在还原条件下进行SDS-聚丙烯酰胺电泳和银染色。即,向5μl各纯化步骤纯化的各样品加入等量的SDS-处理液,得到的混合物在95℃下加热10分钟。将用1/2浓度的SDS-处理液对热处理过的各样品稀释至1/300或1/900倍得到的0.3μl样品用于SDS-聚丙烯酰胺电泳。用与实施例8的c)中所述的小鼠Siglec-15-His的纯度测定方法相同的方式实施电泳和银染色,其结果与少量预备纯化条件检测的结果(应用的培养液的pH为8.9或7.0)一起显示在图10中。其表示在由HiTrap蛋白A柱洗脱的蛋白馏分中,分子量约55kDa的蛋白(小鼠Siglec-15-Fc)被有效纯化并浓缩。c)纯化的小鼠Siglec-15-Fc的蛋白纯度的测定对于纯化小鼠Siglec-15-Fc(由PD-10脱盐柱洗脱的蛋白馏分),使用牛血清白蛋白作为标准品,用DC-蛋白检测试剂盒(Bio-RadLaboratories,Inc.生产)测定蛋白浓度。如表2所示,通过2次纯化操作得到合计92mg的纯化小鼠Siglec-15-Fc蛋白。表2蛋白浓度.(mg/ml)样品量(ml)总蛋白(mg)第一次8.03.528第二次18.53.564合计92实施例10兔抗小鼠Siglec-15多克隆抗体的制备(兔的免疫)a)抗原的制备将实施例9制备的小鼠Siglec-15-Fc蛋白制备成100μg/0.5ml,用玻璃注射器在其中添加等量佐剂,并制备乳液。另外,佐剂只在初次免疫时使用弗氏完全佐剂(FCA,Difco公司生产),第二次及后续的免疫使用弗氏不完全佐剂(FICA,Difco公司生产)。b)对兔的免疫3只兔(日本白色种雌性,体重3kg)用作免疫动物。另外,在免疫前采血,每只兔得到1ml免疫前血清。使用27号注射针头将a)中得到的乳液以1ml/兔注射到皮下和皮内。第一次免疫后每14天进行一次免疫,合计8次。从第8次免疫开始7天后,采集全血,每只兔得到76-79ml的抗血清。通过固定有抗原的ELISA法确认免疫前血清中和抗血清中的抗体滴度。其结果是3只兔的抗血清中抗体滴度均上升。在-20℃下保存该抗血清直至使用。实施例11.抗小鼠Siglec-15多克隆抗体的纯化a)HiTrap蛋白A柱色谱向实施例10中制备的3组20ml兔抗血清中各加入20mlDulbecco′sPBS(D-PBS,Invitrogen,Inc.生产)并混合,用SterivexGV滤器(MilliporeCo.,Ltd.生产)过滤得到的混合物后,将滤出液以2ml/min的流速加载至预先用D-PBS平衡的HiTrap蛋白A5mL柱(AmershamBiosciences,Inc.生产)。用37.5mlD-PBS以2.5ml/min的流速洗柱后,用50ml0.1M柠檬酸钠缓冲液(pH3.0)以2.5ml/min的流速洗脱吸附在柱上的蛋白。以每馏分2.5ml将洗脱液分馏在Mini-sorp管(Nunc,Inc.生产)中,然后立即加入0.65ml的1MTris进行中和。用离心膜浓缩器AmiconUltra-15(MilliporeCo.,Ltd.生产)将含有洗脱的蛋白的馏分约10ml(馏分2~5)浓缩至2.5ml后,加载至用含有0.01%Tween20的大塚注射用生理盐水(TO-SS)平衡的PD-10脱盐柱(大塚制药公司制备生产)并用TO-SS洗脱,得到将溶剂置换为TO-SS的样品3.5ml。将如此制备的样品在-80℃冷冻保存直至使用。b)抗小鼠Siglec-15多克隆抗体的检测和纯度测定用上述a)所述的纯化操作中制备的样品(第1、2、3三组)在还原条件下进行SDS-聚丙烯酰胺凝胶电泳和银染色。即在各纯化步骤纯化的5μl各样品中加入等量的SDS-处理液(含有1mMEDTA、2.5%SDS、0.1%溴酚蓝以及5%2-巯基乙醇的10mMTris-HCl缓冲液(pH8.0)),并将得到的混合物在95℃下加热10分钟。用1/2浓度的SDS-处理液将热处理的各样品稀释至1/100、1/300及1/900倍,并将0.3μl稀释后的样品用于SDS-聚丙烯酰胺凝胶电泳。采用与实施例8的c)中所述的小鼠Siglec-15-His纯度测定相同的方法进行电泳和银染色。结果显示,从PD-10脱盐柱洗脱的蛋白馏分中,由分子量约45kDa的重链和分子量约21kDa的轻链组成的IgG蛋白被有效地纯化并浓缩。c)纯化的抗小鼠Siglec-15多克隆抗体的蛋白浓度的测定对于纯化的抗小鼠Siglec-15多克隆抗体(从PD-10脱盐柱洗脱的蛋白馏分),将牛IgG作为标准品,用DC-蛋白测定试剂盒(BioRadLaboratories,Inc.)测定蛋白浓度。如表3所示,第1~3组的每组的100~170mg的抗小鼠Siglec-15多克隆抗体可被纯化。表3d)纯化的抗小鼠Siglec-15多克隆抗体对Siglec-15胞外结构域反应性的检测对上述a)项中制备的抗小鼠Siglec-15多克隆抗体不仅与Fc标签结合而且与Siglec-15蛋白的胞外结构域结合进行确认试验。在5μl纯化的小鼠Siglec-15-His样品(实施例8)和5μlSiglec-15-Fc样品(实施例9)中加入等量的SDS-处理液(添加或不添加5%2-巯基乙醇),将得到的混合物在95℃下加热10分钟。将0.3μl热处理的各样品用于SDS-聚丙烯酰胺凝胶电泳,采用与上述实施例6的b)所述的方法相同的方法进行电泳和向PVDF膜的转印(印迹)。将该PVDF膜在8ml含0.1%Tween20的封闭剂(BlockAce,雪印乳液社制)中于室温下缓慢振荡1小时。向该封闭溶液中加入1.6μl第1组抗小鼠Siglec-15多克隆抗体(表3),将溶液中的PVDF膜进一步于室温下缓慢振荡1小时。通过将该PVDF膜在50ml含0.01%Tween20的PBS中缓慢振荡5分钟,洗涤4次。将洗涤后的PDVF膜漫渍在8ml抗体稀释剂ECL促进封闭剂(ECL促进免疫印迹检测试剂盒,AmershamBiosciences,Inc.生产)中,并添加抗兔IgG-HRP(AmershamBiosciences,Inc.生产)使终浓度为1/200,000,再加入0.8μlS-蛋白HRP溶液(ECLDua/VueWestern免疫印迹标记、AmershamBiosciences,Inc.生产),将该膜进一步于室温下缓慢振荡1小时。通过将该PVDF膜在50ml含0.01%Tween20的PBS中缓慢振荡5分钟,洗涤4次。洗涤后,按照ECLAdvanceWestern免疫印迹检测试剂盒(AmershamBiosciences,Inc.生产)所附的说明书处理PVDF膜,用ECLmini-camera(AmershamBiosciences,Inc.生产)和宝丽来胶片(Polaroidfilm)(Polapan3200B、Polaroid,Inc.生产)检测蛋白条带的显色。结果如图11所示。该结果显示,纯化的抗小鼠Siglec-15多克隆抗体也与小鼠Siglec-15-His结合,从而可以确认,抗小鼠Siglec-15多克隆抗体不仅与Fc标签结合而且与Siglec-15蛋白的胞外结构域结合。重复进行同样的试验,结果确认第2组和第3组抗小鼠Siglec-15多克隆抗体也与小鼠Siglec-15-His结合。实施例12.免疫前兔IgG的纯化小鼠Siglec-15-Fc的免疫开始前,预先从在实施例10中使用的3只兔中采血以制备免疫前的血清。将各0.8ml该血清的等分样品彼此混合后加入2.4mlDulbecco’sPBS(D-PBS、Invitrogen,Inc.生产),用MillexGV滤器(MilliporeCo.,Ltd.生产)过滤得到的混合物。将该得到的血清样品以1ml/min的流速加载至预先用D-PBS平衡的HiTrap蛋白A5mL柱(AmershamBiosciences,Inc.生产)。用50mlD-PBS以2.5ml/min的流速洗柱后,用50ml0.1M柠檬酸钠缓冲液(pH3.0)以2.5ml/min的流速洗脱吸附在柱上的蛋白。以每馏分2.5ml将洗脱液分馏到Mini-sorp管(Nunc,Inc.生产)中,然后立即加入0.65ml1MTris进行中和该洗脱液。用离心膜浓缩器AmiconUltra-15(MilliporeCo.,Ltd.生产)将合并洗脱的蛋白馏分(馏分2~4)得到的溶液浓缩至2.5ml后,加载至用含0.01%Tween20的大塚注射用生理盐水(TO-SS)平衡的PD-10脱盐柱(AmershamBiosciences,Inc.生产)并用TO-SS进行洗脱,由此得到将溶剂置换为TO-SS的样品3.5ml。对于如此纯化的该免疫前兔IgG样品,采用上述实施例8的c)所述的方法进行聚丙烯酰胺凝胶电泳和银染色,以确认IgG蛋白被充分纯化,然后测定蛋白浓度。将纯化的该样品在-80℃冷冻保存直至使用。实施例13.将小鼠Siglec-15-Fc固相化的亲和柱的制备用PD-10脱盐柱将实施例9所述的0.54ml的18.5mg/ml纯化小鼠Siglec-15-Fc溶液(合计10mg蛋白)的溶剂置换为偶联缓冲液0.2MNaHCO3,0.5MNaCl,pH8.3)后,用离心膜浓缩器AmiconUltra4(MilliporeCo.,Ltd.生产)将得到的溶液浓缩至1ml。将NHS-活化的HiTrap柱(1ml、AmershamBiosciences,Inc.生产)内的异丙醇置换为1mM盐酸后,用注射器将1ml含有10mg/ml的小鼠Siglec-15-Fc的偶联缓冲液注入柱中。室温下反应30分钟后,为了灭活过剩的活性基,按照AmershamBiosciences,Inc.的说明书,依次注入6ml封闭缓冲液(含0.5MNaCl的乙醇胺缓冲液、pH8.3)、6ml洗涤缓冲液(含0.5MNaCl的醋酸钠缓冲液、pH4.0)、6ml封闭缓冲液后,将柱室温下放置30分钟。然后,再次向柱中依次注入洗涤缓冲液、封闭缓冲液、洗涤缓冲液各6ml,最后将柱内的缓冲液置换为含1MNaCl和0.01%Tween20的50mMTris-HCl缓冲液(pH7.0)。将该柱在4℃保存直至使用。实施例14.使用亲和柱对抗小鼠Siglec-15多克隆抗体进行的纯化a)亲和柱色谱向实施例11制备的第1、2、3组纯化抗小鼠Siglec-15多克隆抗体各2ml中加入8ml应用缓冲液(含0.15MNaCl的10mMTris-HCl缓冲液、pH7.2)后,得到的混合物以0.25ml/min的流速加载至预先用应用缓冲液平衡的亲和柱(实施例13)。用5ml应用缓冲液以流速0.25ml/min洗柱后,首先用5ml含0.5MNaCl的0.1M盐酸甘氨酸缓冲液(pH2.7)以流速0.25ml/min对吸附在柱中的蛋白进行洗脱,接着用5ml含0.5MNaCl的0.1M柠檬酸钠缓冲液(pH2.0)以流速0.25ml/min对吸附在柱中的蛋白进行洗脱。用亲和柱对第3组抗小鼠Siglec-15多克隆抗体进行纯化的色谱图如图12所示。以每馏分0.5ml将洗脱液分馏至Mini-sorp管(Nunc,Inc.生产)中,然后立即在0.5ml盐酸甘氨酸缓冲液洗脱的各馏分中加入16μl1MTris,在0.5ml柠檬酸钠缓冲液洗脱的各馏分中加入150μl1MTris中和洗脱液。大部分抗小鼠Siglec-15多克隆抗体被含有0.5MNaCl的0.1M盐酸甘氨酸缓冲液(pH2.7)洗脱出来。将合并用盐酸甘氨酸缓冲液洗脱的经检测含有IgG蛋白的各组馏分(馏分3~7)得到的约2.5ml溶液,分别加载至用含0.01%Tween20的大塚注射用生理盐水(TO-SS)预先平衡的PD-10脱盐柱(AmershamBiosciences,Inc.生产)并用TO-SS进行洗脱,由此得到溶剂置换为TO-SS的样品3.5ml。对于约2.5ml用柠檬酸钠缓冲液洗脱的IgG蛋白馏分(馏分16~19),将三组全部混合,得到的混合物用离心膜浓缩器AmiconUltra-4(MilliporeCo.,Ltd.生产)浓缩至2.5ml,然后将浓缩液加载至用TO-SS平衡的PD-10脱盐柱(AmershamBiosciences,Inc.生产制)并用TO-SS洗脱,由此得到溶剂置换为TO-SS的样品(柠檬酸盐-E)3.5ml。将如此制备的样品在-80℃冷冻保存直至使用。b)亲和纯化的抗小鼠Siglec-15多克隆抗体的蛋白浓度的测定对于纯化的抗小鼠Siglec-15多克隆抗体样品(从PD-10脱盐柱洗脱的蛋白馏分),将牛IgG作为标准品,用DC-蛋白测定试剂盒BioRadLaboratories,Inc.生产)测定蛋白浓度。将已测定蛋白浓度的样品制备为抗体浓度为15或50μg/ml,采用与实施例11的b)相同的方法进行电泳和银染色,其结果如图13所示。结果显示,从PD-10柱洗脱的蛋白馏分中,由分子量约45kDa的重链和分子量约21kDa的轻链组成的IgG蛋白被有效纯化浓缩。如表4所示,第1~3各组或作为柠檬酸盐-E馏分,均可制备约2.3~7.4mg的亲和纯化的抗小鼠Siglec-15多克隆抗体。表4实施例15.使用凝胶过滤柱对亲和纯化的抗小鼠Siglec-15多克隆抗体进行的纯化a)Superose6柱色谱为了从实施例14制备的亲和纯化的抗小鼠Siglec-15多克隆抗体中完全除去内毒素及低分子量的杂质,用凝胶过滤柱进一步纯化。将第2、3组亲和纯化的抗小鼠Siglec-15多克隆抗体各1ml加载至预先用热原去除剂PyroCLEAN(ALerCHEK,Inc.生产)处理并且用含0.01%Tween20的Dulbecco’sPBS(D-PBS、Invitrogen,Inc.生产)平衡的Superose6HR10/30柱(AmershamBiosciences,Inc.生产制),用含0.01%Tween20的D-PBS以0.4ml/min的流速进行洗脱。其色谱图如图14所示。以每馏分0.5ml将洗脱液分馏至Mini-sorp管(Nunc,Inc.生产制)中,得到凝胶过滤的抗小鼠Siglec-15多克隆抗体样品2.0ml(馏分28~31)。将如此制备的样品在-80℃冷冻保存直至使用。b)用凝胶过滤柱对纯化的兔IgG蛋白浓度进行的测定对凝胶过滤纯化的抗小鼠Siglec-15多克隆抗体样品(从Superose6柱洗脱的蛋白馏分)也进行蛋白浓度测定。如表5所示,第2、3组分别可以制备2.25mg和3.34mg的凝胶过滤纯化的抗小鼠Siglec-15多克隆抗体。表5实施例16.小鼠骨髓非贴壁细胞的制备从5~8周龄的雄性ddY小鼠中取出股骨和胫骨,并除去软组织。切除该股骨或者胫骨的两端,用带有25号注射针的注射器注入D-PBS并推出骨髓细胞,收集在离心管中。室温下以100g离心5分钟,去上清液后,收集细胞沉淀。向细胞沉淀中加入1ml溶血缓冲液(红细胞溶解缓冲液,SigmaCo.,Ltd.生产)并混悬,得到的悬浮液室温下放置5分钟。加入20mlD-PBS并于室温下以100g离心5分钟,去上清液后,向细胞沉淀加入10ml含有5ng/mlM-CSF(R&DSystems,Inc.生产)和10%胎牛血清(FBS)的MEM-α培养基(Invitrogen,Inc.生产)并混悬,通过细胞过滤器(cellstrainer)(40μm尼龙、BDFalcon生产)除去凝集物。将得到的细胞转移至75cm2-T烧瓶(附着细胞用)中,CO2培养箱中培养过夜。培养过夜后,收集未附着在T-烧瓶上的细胞,作为小鼠骨髓非贴壁细胞使用。实施例17.添加抗小鼠Siglec-15多克隆抗体对小鼠骨髓非贴壁细胞向破骨细胞分化的影响(用RANKL刺激)利用实施例14、15中制备的抗小鼠Siglec-15多克隆抗体,来研究小鼠骨髓非贴壁细胞向破骨细胞分化的影响。将采用上述实施例16的方法制备的小鼠骨髓非贴壁细胞用含有10%FBS和10ng/mlM-CSF(R&DSystems,Inc.生产)的α-MEM培养基配制成1.5×105细胞/ml,得到的细胞制剂以每孔200μl铺于96孔板,该细胞在CO2培养箱中培养2天。除去96孔板中旧的培养液,添加100μl含有10%FBS的MEM-α培养基,该FBS添加了终浓度分别为20ng/ml的人RANKL(RANKL、Peprotech,Inc.生产)和10ng/ml的M-CSF。在该细胞培养液中,以浓度30~1,000ng/ml添加实施例12、14和15制备的笫3组亲和纯化抗体、柠檬酸盐E抗体、第2组凝胶过滤纯化抗体、笫3组凝胶过滤纯化抗体、免疫前兔IgG以及市售的兔对照IgG(非免疫兔IgGCLRB00、CEDARLANELABORATORIESLtd.生产),该细胞进一步在CO2培养箱中培养3天。培养结束后,按照以下操作测定形成的破骨细胞对抗酒石酸酸性磷酸酶(TRAP)活性。吸除96孔板各孔的培养液,每孔加入50μl含1%TritonX-100的50mM柠檬酸钠缓冲液(pH6.1),用振板摇床振荡5分钟使细胞裂解。向每孔加入50μl底物溶液(含有5mg/mlp-硝苯基硫酸盐和0.46%酒石酸钠的50mM柠檬酸钠缓冲液(pH6.1))并将该板于室温下培养5分钟。培养后向96孔板的各孔中加入50μl1N氢氧化钠溶液以停止酶反应。酶反应停止后测定各孔405nm处的吸光度作为TRAP活性的指标。结果如图15、16所示。免疫前兔IgG以及市售的兔对照IgG未见对TRAP活性的显著抑制。另一方面,结果发现第3组亲和纯化抗体在30ng/ml或以上,柠檬酸盐E抗体在约130ng/ml或以上对TRAP活性具有显著的抑制作用(图15)。也观察到笫3组凝胶过滤纯化抗体在30ng/ml或以上对TRAP活性具有显著的抑制作用。并且发现第3组凝胶过滤纯化抗体比笫2组凝胶过滤纯化抗体具有更强的抑制活性(图16)。由于发现凝胶过滤纯化抗体也具有对破骨细胞形成的抑制活性,因此表明,观察到的抗小鼠Siglec-15多克隆抗体对破骨细胞形成的抑制活性,不是由于抗体样品中所含的内毒素或低分子量的杂质所致,而是归因于抗体分子自身的作用。以上结果显示,抗小鼠Siglec-15多克隆抗体具有较强的抑制破骨细胞形成(破骨细胞的分化和成熟)的作用。实施例18.抗原对添加抗小鼠Siglec-15多克隆抗体抑制小鼠骨髓非贴壁细胞向破骨细胞分化的中和(用RANKL刺激)通过在抗小鼠Siglec-15多克隆抗体中预先加入抗原形成免疫沉淀,确认抗小鼠Siglec-15多克隆抗体的作用取决于其与抗原的结合。向10μg/ml实施例14制备的第3组亲和纯化抗体中以浓度10、30、100或300μg/ml添加实施例8或9制备的小鼠Siglec-15-His或Siglec-15-Fc,得到的混合物37℃下培养2小时。培养后混合物用Chibitan离心5分钟,并用MillexGV滤器(MilliporeCo.,Ltd.生产)对得到的上清液进行过滤灭菌。将采用实施例16的方法制备的小鼠骨髓非贴壁细胞以200μl/孔铺于96孔板,该细胞在CO2培养箱中培养2天。除去96孔板中旧的培养液,向每孔添加100μl含有10%FBS的MEM-α培养基,该FBS添加了终浓度为20ng/ml的人RANKL(RANKL、Peprotech,Inc.生产)和10ng/ml的M-CSF。在该细胞培养液中,以1/200(v/v)添加上述制备的各测试样品,并将细胞进一步在CO2培养箱中培养3天。培养结束后,用实施例17所述的方法测定形成的破骨细胞的抗酒石酸酸性磷酸酶(TRAP)活性。结果如图17所示。无论是用Siglec-15-His中和抗体,还是用Siglec-15-Fc中和抗体,抗体的作用均被中和而消失。该结果证明,抗小鼠Siglec-15多克隆抗体对破骨细胞形成的抑制作用是与Siglec-15蛋白的结合以及阻断其功能所致。实施例19.添加抗小鼠Siglec-15多克隆抗体对小鼠骨髓非贴壁细胞向破骨细胞分化的影响(用TNF刺激)用抗小鼠Siglec-15多克隆抗体,研究TNF刺激对小鼠骨髓非贴壁细胞向破骨细胞分化的影响。将用实施例16的方法制备的小鼠骨髓非贴壁细胞在包含10%胎牛血清(FBS)、10ng/mlM-CSF以及2ng/mlTGF-β(R&Dsystems,Inc.生产)的α-MEM培养基中制成1.5×105细胞/ml,再将得到的细胞溶液以每孔200μl铺于96孔板,并在CO2培养箱中培养2天。除去96孔板中旧的培养液,向每孔添加100μl含有10%FBS的MEM-α培养基,该FBS中添加了终浓度为30ng/ml的人重组TNFα(R&Dsystems,Inc.生产)、终浓度为10ng/ml的M-CSF。向该细胞培养液中以浓度30~1,000ng/ml添加实施例12制备的免疫前IgG或实施例15制备的笫3组凝胶过滤纯化抗小鼠Siglec-15抗体,将该细胞进一步在CO2培养箱中培养3天。同时准备培养的孔,在孔中以浓度3~100ng/ml添加采用专利WO96/26217说明书记载的方法制备的人重组OCIF/OPG培养该细胞,。培养结束后,采用实施例17所述的方法测定形成的破骨细胞的抗酒石酸酸性磷酸酶(TRAP)活性。其结果如图18所示。免疫前IgG以及OCIF/OPG中未见对TRAP活性的显著抑制。另一方面,发现笫3组凝胶过滤纯化抗小鼠Siglec-15抗体在250ng/ml或以上的浓度抑制约50%的TRAP活性。这些结果显示,抗小鼠Siglec-15多克隆抗体还可以抑制TNF诱导的破骨细胞形成(破骨细胞的分化和成熟),而OCIF/OPG不能抑制TNF诱导的破骨细胞形成。对于采用与上述相同的方法培养制备的96孔板的各孔,使用白细胞酸性磷酸酶(SigmaCo.,Ltd.生产),按照试剂盒所附的说明书进行TRAP染色,观察到TRAP阳性多核破骨细胞的形成。其结果为,添加抗小鼠Siglec-15多克隆抗体抑制TRAP阳性的巨大的多核破骨细胞的形成(图19)。结果显示,即使添加抗小鼠Siglec-15多克隆抗体的情形也形成单核破骨细胞,因此抗小鼠Siglec-15多克隆抗体对TNF诱导的破骨细胞分化和成熟中的细胞融合过程具有较强的抑制作用。实施例20.添加抗小鼠Siglec-15多克隆抗体对小鼠骨髓来源的原代培养细胞向破骨细胞分化的影响(TRAP活性)在乙醚麻醉下,将7周龄雄性ddY小鼠颈椎脱臼,使其安乐死,摘除股骨和胫骨。除去软组织后,切去股骨或胫骨的两端,用带有25号注射针的注射器,将含10%胎牛血清的α-MEM培养基注入骨髓中,采集骨髓细胞。细胞计数后,将该细胞用含10%胎牛血清的α-MEM培养基制成5×106细胞/ml。将制备的细胞溶液以100μl/孔铺于96孔板,加入活性维生素D3(SigmaCo.,Ltd.生产),得到终浓度2×10-8M。在该细胞培养上清液中,加入实施例14制备的第3组亲和纯化的抗小鼠Siglec-15抗体以及实施例12制备的免疫前兔IgG使终浓度为4.57、13.7、41.2、123、370、1,111、3,333、10,000ng/ml,并在CO2培养箱中培养8天。另外,第3天和第6天更换培养基和添加受试物质。培养第8天除去培养上清液,用10%中性福尔马林进行细胞固定。细胞固定后,用蒸馏水洗涤2次,以100μl/孔添加TRAP底物溶液(15mMp-硝苯基磷酸盐、50mM酒石酸钠、0.1M醋酸钠缓冲液(pH5.0)),室温下反应30分钟。以50μl/孔添加1NNaOH停止反应,通过用酶标仪测定405nm的吸光度来评价细胞内的TRAP活性。其结果显示,添加的抗小鼠Siglec-15多克隆抗体可剂量依赖性地抑制TRAP活性(图20-A)。另一方面,添加免疫前IgG的情形中,未见TRAP活性的降低(图20-B)。由此可知,活性维生素D3所诱导的小鼠骨髓细胞来源的TRAP阳性破骨细胞的形成,被与Siglec-15特异性结合的抗体抑制。实施例21.添加抗小鼠Siglec-15多克隆抗体对小鼠骨髓来源原代培养细胞的破骨细胞融合的影响(TRAP染色)乙醚麻醉下,将7周龄雄性ddY小鼠颈椎脱臼,使其安乐死,摘除股骨和胫骨。除去软组织后,切去股骨或胫骨的两端,用带有25号注射针的注射器将含10%胎牛血清的α-MEM培养基注入骨髓中,采集骨髓细胞。细胞计数后,将该细胞用含10%胎牛血清的α-MEM培养基制成5×106细胞/ml,将该制备的细胞溶液以100μl/孔铺于96孔板。在该培养上清液中加入活性维生素D3(SigmaCo.,Ltd.生产)使终浓度为2×10-8M,并加入人RANKL(PeproTechInc.生产)使终浓度为80ng/ml,用作破骨细胞的分化诱导因子,制备细胞培养上清液。在这些细胞培养上清液中,添加实施例14中制备的笫3组亲和纯化的抗小鼠Siglec-15抗体使终浓度为370或3,333ng/ml,并添加实施例12制备的免疫前兔IgG使终浓度为3,333ng/ml。由活性维生素D3诱导的破骨细胞分化的培养系统中,细胞在CO2培养箱中培养8天,由人RANKL诱导分化的系统中,细胞在CO2培养箱中培养6天。另外,笫3天和笫6天更换培养基和添加受试物质。培养后除去上清液,添加10%中性福尔马林进行细胞固定。细胞固定后,用蒸馏水洗涤2次,以100μl/孔添加TRAP染色液(0.27mM萘酚AS-MX磷酸(SigmaCo.,Ltd.生产)、1.6mM固红紫色LB盐(SigmaCo.,Ltd.生产)、1%二甲基甲酰胺、50mM酒石酸钠、0.1M醋酸钠缓冲液(pH5.0)),室温下反应5分钟。然后用蒸馏水洗涤该细胞2次,显微镜下观察细胞。其结果为,无论是活性维生素D3(图21)还是人RANKL(图22)所诱导的破骨细胞分化,添加抗小鼠Siglec-15多克隆抗体均可抑制破骨细胞的细胞融合,且未见巨大的破骨细胞形成。另一方面,添加免疫前IgG的情形中,未见这种对破骨细胞的细胞融合的抑制。由此可知,活性维生素D3或者人RANKL所诱导的小鼠骨髓细胞来源的TRAP阳性破骨细胞的多核化和细胞融合,被与Siglec-15特异性结合的抗体抑制。实施例22.添加抗小鼠Siglec-15多克隆抗体对RAW264.7细胞的破骨细胞的细胞融合的影响(TRAP染色)a)抗原蛋白吸收的抗小鼠Siglec-15多克隆抗体的制备用含0.01%Tween20的D-PBS(Invitrogen,Inc.生产),分别将具有表6所示的各浓度的实施例14制备的笫3组亲和纯化抗小鼠Siglec-15抗体、实施例8和9制备的小鼠Siglec-15-His蛋白以及小鼠Siglec-15-Fc蛋白,配制成5种混合液(A~E)。将这些混合液于37℃下孵育2小时后,以20,000×g离心10分钟,将得到的上清液作为20倍浓度的测试样品。表6ABCDE抗-Siglec-15抗体2020202020Siglec-15-Fc02020000Siglec-15-His00020200(单位:μg/ml)b)用RAW264.7进行TRAP染色的评价用含10%胎牛血清的α-MEM培养基将RAW264.7制成2.25×104细胞/ml,将制备的细胞溶液以200μl/孔铺于96孔板,添加人RANKL(PeproTechInc.生产)使终浓度为40ng/ml。在该细胞培养上清液中添加a)中制备的A~E的测试样品使终浓度为1/20,并将该细胞在CO2培养箱中培养3天。培养后除去上清液,添加10%中性福尔马林进行细胞固定。细胞固定后,用蒸馏水洗涤2次,以100μl/孔添加TRAP染色液(0.27mM萘酚AS-MX磷酸(SigmaCo.,Ltd.生产)、1.6mM固红紫色LB盐(SigmaCo.,Ltd.生产)、1%二甲基甲酰胺、50mM酒石酸钠、0.1M醋酸钠缓冲液(pH5.0)),室温下反应5分钟。用蒸馏水洗涤该细胞2次,显微镜下观察细胞。其结果与未添加测试样品的对照组(图23-0)比较,添加抗小鼠Siglec-15多克隆抗体显著抑制破骨细胞的细胞融合(图23-A)。但是,通过用作为免疫抗原而使用的小鼠Siglec-15-Fc蛋白吸收抗小鼠Siglec-15多克隆抗体,可解除抗小鼠Siglec-15多克隆抗体对破骨细胞的细胞融合的抑制效应(图23-B、C)。并且,通过用小鼠Siglec-15-His蛋白吸收抗小鼠Siglec-15多克隆抗体,同样可解除抗小鼠Siglec-15多克隆抗体对破骨细胞的细胞融合的抑制效应(图23-D、E)。从这些结果可知,与Siglec-15特异性结合的抗体,可抑制人RANKL所诱导的RAW264.7细胞来源的TRAP阳性破骨细胞的多核化和细胞融合。另外,图23中A至E的符号所表示的结果,分别与表6中A至E的测试样品相对应。实施例23.产生大鼠抗小鼠Siglec-15单克隆抗体的杂交瘤细胞的建立a)抗原的制备将实施例8制备的小鼠Siglec-15-His蛋白配制成100μg/0.5ml,用玻璃注射器添加等量的佐剂并制成乳液。作为佐剂,仅在初次免疫时使用弗氏完全佐剂(FCA、DifcoLaboratories,Inc.生产),第二次及后续的免疫使用弗氏不完全佐剂(FICA、DifcoLaboratories,Inc.生产)。b)对大鼠的免疫使用4只大鼠(Wistar,雌性,6周龄,购自日本CLEA)作为免疫动物。将a)得到的乳液用27G注射针进行皮下和皮内注射,使抗原量为50μg/大鼠。第一次免疫后每7天进行一次共进行4次免疫。第四次免疫起的7天后,从尾静脉少量(200μl)采血,制备抗血清。为了确认抗血清的抗体滴度,进行使作为抗原使用的小鼠Siglec-15-His蛋白、实施例9制备的小鼠Siglec-15-Fc蛋白或者牛血清白蛋白(BSA)固相化的ELISA。结果发现4只大鼠(大鼠笫1~4只)中均具有对小鼠Siglec-15-His蛋白及小鼠Siglec-15-Fc蛋白的反应性。另一方面,未发现对BSA的反应性。由以上结果可以确认,各免疫的大鼠血清中抗体滴度升高,因此对抗体滴度最高的第2只大鼠进行细胞融合操作。c)细胞融合按照通常小鼠(大鼠)脾脏细胞与骨髓瘤细胞的融合法进行细胞融合。乙醚麻醉下从大鼠心脏取全血,并使其安乐死,然后摘除其脾脏。将采集的脾脏细胞和小鼠骨髓瘤细胞的P3X63Ag8.653细胞(ATCCCRL1580)用聚乙二醇(PEG)进行细胞融合。将得到的细胞铺于96孔板,加入含有次黄嘌呤H)、氨基蝶呤A)、胸苷T)的培养基(HAT选择培养基)培养7~10天。对确认存活的细胞融合后得到的杂交瘤细胞的61孔的培养上清液进行收集。然后通过用固相化的小鼠Siglec-15-His蛋白、实施例9制备的小鼠Siglec-15-Fc蛋白或者BSA作为抗原的ELISA,进行抗体滴度的评价,并筛选产生抗小鼠Siglec-15单克隆抗体的杂交瘤细胞。根据筛选的结果,选出抗体滴度高的12孔,对其中所含的杂交瘤细胞进行克隆操作。d)杂交瘤的克隆用有限稀释法对如此选出的杂交瘤细胞进行第一次克隆。有限稀释后将杂交瘤2周培养,用使固相化的实施例9制备的小鼠Siglec-15-Fc蛋白或者BSAELISA,对培养上清液中的抗体滴度进行确认。通过对已确认阳性克隆的11个克隆再次进行第二次克隆(采用与第一次克隆相同的操作),由此最终建立10个产生抗小鼠Siglec-15单克隆抗体的杂交瘤细胞的克隆(#1A1、#3A1、#8A1、#24A1、#32A1、#34A1、#39A1、#40A1、#41B1、#61A1)。另外,杂交瘤细胞#32A1以及杂交瘤细胞#41B1于2008年8月28日被保藏在IPOD,NITE-国家高级工业科学技术学院,国际专利生物保藏中心(所在地:邮政编码305-8566日本茨城县筑波市东1条1门1中央第6),杂交瘤细胞#32A1以名称抗-Siglec-15杂交瘤#32A1、保藏编号FERMBP-10999保藏,杂交瘤细胞#41B1以名称抗-Siglec-15杂交瘤#41B1、保藏编号FERMBP-11000保藏。实施例24.大鼠抗小鼠Siglec-15单克隆抗体的制备a)裸小鼠腹水的制备用含10%FCS的TIL培养基I((株)免疫生物研究所制)培养基培养实施例23建立的杂交瘤细胞。在细胞生长到5×105细胞/ml左右的时间点时,通过进行稀释至四分之一左右的细胞继代培养操作,每2~3天进行一次。向预先腹腔内给予(0.2ml/小鼠)降植烷的裸小鼠的腹腔内,以浓度为1×107细胞/小鼠植入如此培养的杂交瘤细胞。10个克隆的杂交瘤细胞各使用3只裸小鼠进行植入。植入后,在明显见到腹水蓄积的时间点采集腹水,将从另2只植入相同杂交瘤细胞的小鼠采集的腹水合并,并测定如此合并的腹水量后,冷冻保存该腹水,直至抗体纯化。各杂交瘤细胞的腹水采集量归纳于表7。表7b)抗体的纯化将采集的腹水总量进行IgG纯化,使用20ml蛋白G柱(GEHealthcare,Co.,Ltd.生产)。利用凝胶过滤分析(Superdex200柱色谱)对纯化的IgG进行纯度测定,一部分进行离心膜浓缩。即,将除#24A1抗体外的9种抗体用离心膜浓缩器AmiconUltra-15(MilliporeCo.,Ltd.生产)于3000r.p.m.、4℃下进行30~60分钟离心,使其浓缩至1/6-1/8。接着,将牛血清白蛋白(BSA)作为标准品,用DC-蛋白测定试剂盒Bio-RadLaboratories,Inc.生产)对#24A1抗体以及浓缩的其它9种抗体的蛋白浓度进行测定。通过以上操作制备抗小鼠Siglec-15单克隆抗体。实施例25.大鼠抗小鼠Siglec-15单克隆抗体对小鼠Siglec-15蛋白结合特性的评价采用ELISA法评价大鼠抗小鼠Siglec-15单克隆抗体对小鼠Siglec-15蛋白的结合特性。用0.1M碳酸钠缓冲液(pH9.5)将实施例9制备的小鼠Siglec-15-Fc蛋白稀释至5μg/ml,将得到的溶液以100μl/孔加入96孔板(NalgeNuncInternational,Inc.生产、商品编号:430341)中。室温下将板放置1小时后除去溶液,以300μl/孔加入洗涤缓冲液(含0.05%Tween20的磷酸盐缓冲生理盐水),再除去。将该洗涤操作再进行一次后,通过以200μl/孔加入含25%BlockAce(大日本住友制药社制)的磷酸盐缓冲生理盐水,将板在室温下放置1小时,由此进行封闭。除去液体,以300μl/孔的洗涤缓冲液洗涤该板2次后,用ELISA缓冲液(含12.5%BlockAce和0.05%Tween20的磷酸盐缓冲生理盐水)将实施例24制备的各大鼠抗小鼠Siglec-15单克隆抗体或者大鼠对照IgG(R&Dsystems,Inc.生产)稀释至终浓度为1.28~20,000ng/ml(5倍稀释系列),并将得到的稀释抗体溶液以100μl/孔添加至板中。将该板在室温下放置1小时后除去液体,以300μl/孔的洗涤缓冲液洗涤该板3次。接着,以100μl/孔添加用ELISA缓冲液稀释了1,000倍的HRP(辣根过氧化物酶)标记的山羊抗大鼠IgG抗体(BeckmanCoulter,Inc.生产),将该板在室温下放置1小时。除去溶液,以300μl/孔的洗涤缓冲液洗涤3次后,使用过氧化酶用显色试剂盒(SumitomoBakeliteCo.,Ltd.生产),按照试剂盒所附的说明书进行显色。显色后用酶标仪(日本MolecularDevicesCorporation生产)测定492nm下的吸光度。其结果确认,研究的所有大鼠抗小鼠Siglec-15单克隆抗体10个受试物质中,均以抗体浓度依赖性的方式与小鼠Siglec-15蛋白结合(图24)。另一方面,大鼠对照IgG中未见与小鼠Siglec-15蛋白的结合。实施例26.基于小鼠破骨细胞形成试验的大鼠抗小鼠Siglec-15单克隆抗体生物活性评价使用实施例24制备的所有10个受试物质的抗小鼠Siglec-15单克隆抗体,检测小鼠骨髓非贴壁细胞向破骨细胞分化的影响。用含有10%FBS和10ng/mlM-CSF(R&DSystems,Inc.生产)的α-MEM培养基将采用实施例16的方法制备的小鼠髓非贴壁细胞制成1.5×105细胞/ml,并将该制备的细胞溶液以每孔200μl铺于96孔板,该细胞在CO2培养箱中培养2天。除去96孔板中旧的培养液,向每孔添加100μl含10%FBS的MEM-α培养基,该FBS中添加了终浓度为20ng/ml的人RANKL(RANKL、PeproTechInc.生产)和10ng/ml的M-CSF。向该细胞培养液中,以浓度32~1,000ng/ml添加实施例24制备的大鼠抗小鼠Siglec-15单克隆抗体、从市售的大鼠对照IgG(纯化的大鼠IgG、R&DSystems,Inc.生产)除去了叠氮化钠的样品或实施例14制备的兔抗小鼠Siglec-15多克隆抗体(第3组),该细胞进一步在CO2培养箱中培养3天。培养结束后,采用实施例17记载的方法测定形成的破骨细胞的抗酒石酸酸性磷酸酶(TRAP)活性。酶反应停止后测定各孔405nm的吸光度,该测定作为TRAP活性的指标。其结果如图25及图26所示。市售的大鼠对照IgG中未见显著的TRAP活性抑制作用。另一方面,#32A1抗体在32ng/ml至1000ng/ml的范围内、#8A1抗体和第3组亲和纯化兔多克隆抗体在63ng/ml至1000ng/ml的范围内,具有显著的TRAP活性抑制。并且,观察到#3A1抗体、#34A1抗体、#39A1抗体在500ng/ml或以上的相对高浓度下剂量依赖性地抑制TRAP活性。未发现其它抗体对小鼠破骨细胞形成的抑制。根据以上结果,在制备的大鼠抗小鼠Siglec-15单克隆抗体中发现强烈抑制小鼠破骨细胞形成(破骨细胞的分化和成熟)的抗体。此外,作为#3A1抗体、#8A1抗体、#32A1抗体、#34A1抗体、#39A1抗体共同的性质,可例示1000ng/ml即1μg/ml或以下浓度下对破骨细胞形成的抑制活性。实施例27.人来源的成熟破骨细胞的总RNA的提取用添加含胎牛血清(终浓度10%)、人RANKL和人M-CSF等的OPGM补充套装(破骨细胞SingleQuotTM试剂盒,购自三光纯药、商品编号PT-9501)的破骨前体细胞用基础培养基(OPBM、购自三光纯药、商品编号PT-8201),培养正常人破骨细胞前体细胞(正常人天然破骨细胞前体细胞购自三光纯药,商品编号2T-110),3~7天后出现大量TRAP阳性多核破骨细胞。按照试剂盒所附说明书使用该细胞培养体系,来制备人来源的成熟破骨细胞。a)将正常人破骨细胞前体细胞以1×104细胞/孔铺于96孔板的60孔中,加入人RANKL使终浓度为66ng/ml,该细胞在CO2培养箱中培养4天。接着,按照试剂所附说明书用总RNA提取试剂(ISOGEN:NipponGeneCo.,Ltd.生产)从多核破骨细胞提取总RNA。将收集的总RNA在-80℃保存直至使用。b)将正常人破骨细胞前体细胞以1×104细胞/孔分别铺于两个96孔板的各84孔中,1个板中加入人RANKL使终浓度为53.2ng/ml,另一个板中不添加人RANKL,细胞在CO2培养箱中培养3天。接着,按照试剂所附说明书用总RNA提取试剂(ISOGEN:NipponGeneCo.,Ltd.生产),从该细胞中提取总RNA。将收集的总RNA在-80℃保存直至使用。实施例28.人Siglec-15开放阅读框(ORF)序列的获得a)第一链cDNA合成以实施例27的a)中制备的总RNA为模板,用oligo(dT)引物(Invitrogen,Inc.生产)和SuperscriptIII逆转录酶(Invitrogen,Inc.生产)进行cDNA合成。按照该酶所附说明书进行操作。b)PCR反应按照常规方法合成具有下列序列的寡核苷酸:5’-attaagcttcaccATGGAAAAGTCCATCTGGCTGC-3’(hSiglec-15-HindIIIkozak-F:序列表中SEQIDNO:29);以及5’-agtggatccTCACGGTGAGCACATGGTGGC-3’(hSiglec-15-BamHI-R:序列表中SEQIDNO:30)其用作通过PCR法扩增人Siglec-15的ORFcDNA的引物。使用该引物的组合和a)中制备的cDNA,按照常规方法进行PCR。用PureLinkPCR纯化试剂盒(Invitrogen,Inc.生产)对得到的PCR反应液进行纯化。c)向pcDNA3.1(+)载体克隆用限制酶处理(BamHI、HindIII)b)中得到的纯化PCR反应液以及pcDNA3.1(+)载体(Invitrogen,Inc.生产),凝胶切割并纯化后,按照常规方法进行连接酶反应。转化大肠杆菌TOP10,对得到的耐药性克隆进行菌落PCR。对于得到设想尺寸扩增产物的克隆,用DNA测序仪对插入到质粒中的ORFcDNA的总核苷酸序列进行分析,结果发现其是序列表中SEQIDNO:1所示的序列。该核苷酸序列与NCBIGeneBank数据库中登录为“人Siglec-15”(登录号:NM_213602)的序列的ORF编码区相同,并且,由该核苷酸序列编码的氨基酸序列(序列表中SEQIDNO:2)与人Siglec-15的氨基酸序列100%一致。实施例29.伴随人破骨细胞分化的人Siglec-15的mRNA表达(实时PCR分析)在1μg实施例27的b)中制备的总RNA中加入1μl的1U/μlDNAseI、1μl的10×DNAseI缓冲液(Invitrogen,Inc.生产),加H2O至终体积为10μl,室温下反应15分钟后,加入1μl的25mMEDTA并将得到的混合物于65℃加热10分钟。从该溶液中取8μl等分样品,加入1μl的50μMoligo(dT)20引物以及1μl的10mMdNTPs,得到的混合物在65℃下加热5分钟后,在冰中孵育。向该溶液中加入2μl10×RT缓冲液(Invitrogen,Inc.生产)、4μl25mMMgCl2、2μl0.1M二硫苏糖醇、1μlRNA酶抑制剂(RNAseOUT、40U/μl、Invitrogen,Inc.生产)、1μlSuperscriptIII逆转录酶(200U/μl、Invitrogen,Inc.生产)使总量为20μl,混合物50℃下反应50分钟后,85℃下加热5分钟,冰中孵育。使用如此制备的单链cDNA,用以下引物组合和荧光标记的探针(TaqMan探针、AppliedBiosystems,Inc.生产)进行实时PCR。实时PCR条件:人组织蛋白酶K扩增用引物:5’-ccgcagtaatgacacccttt-3’(TqM-hcatK-F:序列表中SEQIDNO:31)以及5’-aaggcattggtcatgtagcc-3’(TqM-hcatK-R:序列表中SEQIDNO:32)、人组织蛋白酶K检测用TaqMan探针:5’-Fam-tcagggtcagtgtggttcctgttgggct-TAMRA-3’(TqM-hcatK-探针:序列表中SEQIDNO:33)、人TRAP扩增用引物:5’-ctgtcctggctcaagaaaca-3’(TqM-hTRAP-F:序列表中SEQIDNO:34)以及5’-ccatagtggaagcgcagata-3’(TqM-hTRAP-R:序列表中SEQIDNO:35)人TRAP检测用TaqMan探针:5’-Fam-tgagaatggcgtgggctacgtgctgagt-TAMRA-3’(TqM-hTRAP-探针:序列表中SEQIDNO:36)、人Siglec-15扩增用引物:5’-cagccaccaacatccatttc-3’(TqM-hSiglec-15-F:序列表中SEQIDNO:37)以及5’-cgctcaagctaatgcgtgta-3’(TqM-hSiglec-15-R:序列表中SEQIDNO:38)、人Siglec-15检测用TaqMan探针:5’-Fam-aagaacaaaggccagtgcgaggcttggc-TAMRA-3’(TqM-hSiglec-15-探针:序列表中SEQIDNO:39)、人L32核糖体蛋白扩增用引物:5’-gagatcgctcacaatgtttcct-3’(TqM-hL32-F:序列表中SEQIDNO:40)以及5’-gatgccagatggcagtttttac-3’(TqM-hL32-R:序列表中SEQIDNO:41)人L32核糖体蛋白检测用TaqMan探针:5’-Fam-accgcaaagccatcgtggaaagagctg-TAMRA-3’(TqM-hL32-探针:序列表中SEQIDNO:42)使用实时PCR系统(ABIPrism7700序列检测器、PerkinElmerJapanAppliedBiosystemsDivision生产)在以下条件下进行实时PCR分析。反应中使用TaqMan通用PCR主要混合物(AppliedBiosystems,Inc.生产)。首先,向每个25pmol引物、8ng单链cDNA以及10pmolTaqMan探针中加入蒸馏水至终体积为25μl,再加入25μlTaqMan通用PCR主要混合物制成50μl反应液。将该反应液在50℃加热2分钟后在95℃加热10分钟,重复进行“95℃下0.25分钟,60℃下1分钟”的温度循环40次,由此进行实时PCR分析。另外,各基因的mRNA表达量用L32核糖体蛋白的mRNA表达量来校正。结果表明,以已知作为破骨细胞的标志分子的组织蛋白酶K以及TRAP基因相同的方式,Siglec-15基因的表达量在添加RANKL诱导人破骨细胞分化时显著升高(图27)。实施例30.可溶性人Siglec-15蛋白表达构建体的制备编码人Siglec-15蛋白胞外结构域的部分核酸序列由序列表中的SEQIDNO:43表示,其氨基酸序列由序列表中的SEQIDNO:44表示。通过利用这样的部分序列,可以使动物细胞等培养上清液中产生可溶性人Siglec-15蛋白。a)通过PCR对可溶性人Siglec-15基因的扩增按照常规方法合成具有下列序列的寡核苷酸:5’-ggggacaagtttgtacaaaaaagcaggcttcaccATGGAAAAGTCCATCTGGCTGC-3’(hSiglec-15-ECD-F:序列表中SEQIDNO:45)以及5’-ggggaccactttgtacaagaaagctgggtcCCCGCTGGCGCCATGGAAGCGG-3’(hSiglec-15-ECD-R:序列表中SEQIDNO:46)、其用作通过PCR法扩增人Siglec-15胞外结构域cDNA的引物。另外,将上述引物设计为在hSiglec-15-ECD-F上附加attB1序列,并在hSiglec-15-ECD-R上附加attB2序列,并作为扩增引物用于制备Gateway进入克隆。使用该引物的组合、以及作为模板的实施例28制备的人Siglec-15/pcDNA3.1(+)质粒,按照常规方法进行PCR。将得到的PCR反应液用PureLinkPCR纯化试剂盒(Invitrogen,Inc.生产)进行纯化。b)通过GatewayBP反应制备进入克隆采用以下方法来制备进入克隆,所述进入克隆通过应用λ噬菌体位点特异性重组系统的Gateway技术(Invitrogen,Inc.),将人Siglec-15胞外结构域的cDNA整合至克隆中。首先,在a)中制备的两端具有attB序列的PCR产物与具有attP序列的供体载体即pDNOR221(Invitrogen,Inc.生产)之间,使用BP克隆酶(Clonase)进行BP反应。用该反应液转化大肠杆菌TOP10,对耐药性克隆进行菌落PCR,确认插入片段大小。对于已确认具有正确大小的插入片段的克隆,对插入片段的总DNA序列进行序列分析,结果得到与编码人Siglec-15蛋白的胞外结构域的目标核酸序列(序列表中SEQIDNO:43)完全一致的进入克隆。c)通过GatewayLR反应的表达克隆的制备采用以下方法来制备表达克隆,所述表达克隆通过应用λ噬菌体位点特异性重组系统的Gateway技术(インビトロジエン社),将人Siglec-15胞外结构域的cDNA整合至克隆中.b)中制备的进入克隆含有两端具有attL序列的插入片段。在该进入克隆与具有attR序列的两种目标载体(destinationvectors)之间用LR克隆酶进行LR反应。另外,作为目标载体,使用设计为该插入片段的C末端附加V5表位标签和6×His标签的pDONM、以及该插入片段的C末端附加人Fc标签的phIgFc这两种载体。使用通过LR反应制得的反应液转化大肠杆菌TOP10,对得到的耐药性克隆进行序列分析,以确认是否发生正确重组。序列分析的结果是,pDONM和phIgFc均分别得到正确重组的表达克隆(可溶性人Siglec-15/pDONM以及可溶性人Siglec-15/phIgFc)。通过将可溶性人Siglec-15/pDONM转染到动物细胞等,具有序列表中SEQIDNO:47所示的碱基序列的mRNA转录,并翻译成具有序列表中SEQIDNO:48所示的氨基酸序列的蛋白(人Siglec-15-His)。此外,通过将可溶性人Siglec-15/phIgFc转染到动物细胞等,具有序列表中SEQIDNO:49所示的碱基序列的mRNA转录,并翻译成具有序列表中SEQIDNO:50所示的氨基酸序列的蛋白(人Siglec-15-Fc)。实施例31.使用293-F细胞,含可溶性人Siglec-15蛋白的培养液的大量制备a)含有人Siglec-15-His的培养液的制备制备约25mg实施例30得到的可溶性人Siglec-15/pDONM。另外,在来自大量培养的大肠杆菌的质粒纯化中,使用Invitrogen,Inc.的PureLinkHiPure质粒大量制备试剂盒Invitrogen,Inc.生产)。将如此制备的质粒与Opti-MEM(Invitrogen,Inc.生产)混合,加入50ml转染试剂293fectin(Invitrogen,Inc.生产),得到的混合物室温下孵育20分钟。将该混合液添加到FreeStyle293-F细胞(Invitrogen,Inc.生产)中,该FreeStyle293-F细胞在含1%青霉素-链霉素的FreeStyle293表达培养基(Invitrogen,Inc.生产)中培养,用25L生物过程培养装置(bioprocesscultureapparatus)(WAVEBioreactor)使细胞密度达到1.0~3.4×106细胞/ml。在6~12%CO2浓度、37℃下旋动培养(30转/分)96小时(4天)后,收集培养液,离心分离制成培养上清液。认为由此制备的培养上清液中,表达人Siglec-15的胞外结构域C末端侧附加V5表位标签和6×His标签的蛋白(人Siglec-15-His)。b)含有人Siglec-15-Fc的培养液的制备制备约5mg实施例30得到的可溶性人Siglec-15/phIgFc。另外,在来自大量培养的大肠杆菌的质粒纯化中,使用Invitrogen,Inc.的PureLinkHiPure质粒大量制备试剂盒(Invitrogen,Inc.生产)。将如此制备的质粒与Opti-MEM(Invitrogen,Inc.生产)混合,滤器灭菌后添加10ml转染试剂293fectin(Invitrogen,Inc.生产),并将得到的混合物在室温下孵育20分钟。将该混合液添加到锥形瓶中培养的FreeStyle293-F细胞(Invitrogen,Inc.生产)中,该FreeStyle293-F细胞在FreeStyle293表达培养基(Invitrogen,Inc.生产)中使细胞密度达到1.0~3.0×106细胞/ml×5L(5个1L/烧瓶)。在8.0%CO2浓度、37℃下旋转培养(125转/分)96小时(4天)后,收集培养液,离心分离制成培养上清液。认为由此制备的培养上清液中,表达人Siglec-15胞外结构域C末端侧附加人Fc标签的蛋白(人Siglec-15-Fc)。实施例32.可溶性人Siglec-15蛋白的纯化a)可溶性人Siglec-15-His的纯化a-i)HisTrapHP柱色谱在12L使实施例31的a)中制备的表达人Siglec-15-His的293F细胞培养液中加入1350mL10x缓冲液(500mMTris,1.5MNaCl,200mM咪唑,pHS.0),得到的混合物充分搅拌后,用MilliPak60滤器(MilliporeCo.,Ltd.生产)过滤。将该培养液以10ml/min的流速加载至预先用纯水(MilliQ水)洗涤的Ni-琼脂糖HP(AmershamBiosciences,Inc.生产制)100mL柱。用400ml含300mMNaCl的50mMTris-HCl缓冲液(pH8.0)以8mL/min的流速洗柱后,用200mL含300mMNaCl、500mM咪唑的50mMTris-HCl缓冲液(pH8.0)以2.5mL/min的流速对吸附在柱上的蛋白进行洗脱,洗脱液分馏在Mini-sorp管(Nunc,Inc.生产制)中。为防止蛋白沉淀,在约40mL含洗脱的蛋白的馏分中加入8mL5MNaCl溶液并搅拌,然后将得到的混合物用离心膜浓缩器AmiconUltra-15(MilliporeCo.,Ltd.生产)浓缩至约20mL。在3000r.p.m.、4℃下离心30分钟以除去浓缩时产生的不溶物,将2.5mL得到的上清液加载至预先用含1MNaCl的磷酸盐缓冲生理盐水(N-PBS)平衡的PD-10脱盐柱(AmershamBiosciences,Inc.生产制),并用N-PBS进行洗脱,由此得到将溶剂置换为N-PBS的3.5mL样品。将该操作进一步重复进行7次,得到约28mL部分纯化的人Siglec-15-His溶液。a-ii)ResourceQ柱色谱在含0.1%CHAPS的50mMTris-HCl缓冲液(pH7.5)中,将12ml用Ni-琼脂糖HP柱色谱纯化的溶剂置换为N-PBS的样品在4℃下透析过夜(1L、3次),得到的透析液在4℃、3,000r.p.m.下离心30分钟,除去沉淀。用MillexGV滤器(MilliporeCo.,Ltd.生产)过滤得到的上清液,然后将滤出液以1ml/min的流速加载至预先用含0.1%CHAPS的50mMTris-HCl缓冲液(pH7.5)平衡的ResourceQ6mL柱(AmershamBiosciences,Inc.生产)中,接着用该缓冲液以1ml/min的流速洗柱,收集未吸附在柱上的蛋白馏分。用含0.1%CHAPS、1MNaCl的50mMTris-HCl缓冲液(pH7.5)以1ml/min的流速洗脱吸附在柱上的蛋白。用离心膜浓缩器AmiconUltra-15(MilliporeCo.,Ltd.生产)将26.5ml未吸附在柱上的馏分浓缩至3.0ml后,浓缩液在4℃、3,000r.p.m.下离心10分钟,并除去沉淀。将2.5mL得到的上清液加载至预先用含50mM盐酸精氨酸的磷酸盐缓冲生理盐水(pH7.0、A-PBS)平衡的PD-10脱盐柱(AmershamBiosciences,Inc.生产),然后用A-PBS洗脱,由此得到溶剂置换为A-PBS的3.5mL样品。为防止可溶性人Siglec-15-His沉淀,在制备的样品溶剂中添加了盐酸精氨酸。将离心后的上清液在-80℃冷冻保存直至使用。以上的纯化操作(ResourceQ柱色谱)重复进行2次。a-iii)纯化的人Siglec-15-His的检测和纯度测定用上述纯化操作(Ni-琼脂糖HP柱色谱、ResourceQ柱色谱)中制备的样品,在还原条件下进行SDS-聚丙烯酰胺凝胶电泳和银染色。即,在5μl各纯化步骤的各样品中加入等量的SDS-处理液,得到的混合物在95℃下进行10分钟热处理。将0.3μl热处理后的各样品用于SDS-聚丙烯酰胺凝胶电泳。除了使用彩虹分子量标记(AmershamBiosciences,Inc.生产)作为分子量标记以外,采用与实施例8相同的方法进行电泳操作。电泳结束后用PhastGel银染色试剂盒(AmershamBiosciences,Inc.生产)和PhastSystem进行银染色,其结果如图28所示。结果显示,未吸附在ResourceQ柱上的蛋白馏分中分子量约35kDa的蛋白质(人Siglec-15-His)被有效纯化并浓缩。a-iv)纯化的人Siglec-15-His的蛋白浓度的测定对于纯化人Siglec-15-His(未吸附在ResourceQ柱上的蛋白馏分),将牛血清白蛋白作为标准品,用DC-蛋白测定试剂盒BioRadLaboratories,Inc.生产)测定蛋白浓度。通过2次纯化操作共得到1.66mg纯化的人Siglec-15-His。b)可溶性人Siglec-15-Fc的纯化b-i)HiTrap蛋白A柱色谱将1.5L实施例31的b)中制备的表达人Siglec-15-Fc的293F细胞培养液用SterivexGV滤器(MilliporeCo.,Ltd.生产)过滤后,滤出液以5ml/min的流速加载至预先用Dulbecco’sPBS(D-PBS、Invitrogen,Inc.生产)平衡的HiTrap蛋白A5mL柱(AmershamBiosciences,Inc.生产制)中。用70mlD-PBS以5ml/min的流速洗柱后,用24ml0.1M柠檬酸钠缓冲液(pH3.0)以1.2ml/min的流速对吸附在柱上的蛋白进行洗脱。以每馏分1.2ml将洗脱液分馏在Mini-sorp管(Nunc,Inc.生产制)中,然后立即加入0.31ml1MTris中和洗脱液。将约7.5ml合并洗脱的蛋白馏分(馏分5~9)得到的溶液中的2.5ml等分样品加载至预先用含50mM盐酸精氨酸的磷酸盐缓冲生理盐水(pH7.0、A-PBS)平衡的PD-10脱盐柱(AmershamBiosciences,Inc.生产制)中,然后用A-PBS洗脱,由此得到溶剂置换为A-PBS的3.5ml样品。将该操作重复进行2次。为了防止可溶性人Siglec-15-Fc沉淀,在溶剂中添加盐酸精氨酸。洗脱的蛋白馏分(馏分5~9)的剩余溶液的2.5ml加载至预先用含1MNaCl的磷酸盐缓冲生理盐水(pH6.7、N-PBS)平衡的PD-10脱盐柱(AmershamBiosciences,Inc.生产制)中,然后用N-PBS洗脱,由此得到溶剂置换为N-PBS的3.5ml样品。为了防止可溶性人Siglec-15-Fc沉淀,在制备的样品溶剂中添加NaCl而不添加精氨酸等含氨基的化合物。溶剂置换为N-PBS的人Siglec-15-Fc样品仅用于后述实施例34的c)中制备固定化柱时的情形,除此之外的实施例均使用溶剂置换为A-PBS的人Siglec-15-Fc。将以上操作所制备的样品在-80℃冷冻保存直至使用。b-ii)纯化的人Siglec-15-Fc的检测和纯度测定用上述纯化操作制备的样品在还原条件下进行SDS-聚丙烯酰胺凝胶电泳和银染色。即,在5μl各纯化步骤的各样品中加入等量的SDS-处理液,得到的混合物在95℃下加热10分钟。用1/2浓度的SDS-处理液将热处理的各样品稀释至1/100或1/300,将0.3μl得到的样品用于SDS-聚丙烯酰胺凝胶电泳。采用与a-iii)所述的人Siglec-15-His的纯度测定相同的方法进行电泳和银染色,其结果如图29所示。结果显示从HiTrap蛋白A柱洗脱的蛋白馏分中分子量约55kDa的蛋白质(人Siglec-15-Fc)被有效纯化并浓缩。b-iii)纯化的人Siglec-15-Fc的蛋白浓度的测定对于纯化人Siglec-15-Fc(从PD-10脱盐柱洗脱的蛋白馏分),将牛血清白蛋白作为标准品,用DC-蛋白纯化试剂盒BioRad社制)测定蛋白浓度。如表8所示,通过2次纯化操作共得到25.2mg纯化的人Siglec-15-Fc。表8实施例33.兔抗人Siglec-15多克隆抗体的制备(对兔的免疫)a)抗原的制备将实施例32的b)中制备的人Siglec-15-Fc蛋白制备成100μg/0.5ml,用玻璃注射器添加等量的佐剂制成乳液。作为佐剂,仅在初次免疫时使用弗氏完全佐剂(FCA、DifcoLaboratories,Inc.生产),第2次及后续的免疫使用弗氏不完全佐剂(FICA、DifcoLaboratories,Inc.生产)。b)对兔的免疫使用3只兔(日本白色种雌性兔,体重3kg)作为免疫动物。另外,在免疫前采血,每只兔得到10ml免疫前血清。用27G注射针在皮下和皮内注射a)中得到的乳液使抗原量为50μg/兔。第一次免疫后每14天进行一次共进行8次免疫。自第8次免疫起7天后采集全血,每只兔得到74.4~74.9ml的抗血清。通过将抗原固相化的ELISA法来确认免疫前血清中和抗血清中的抗体滴度。结果确认所有3只兔的抗血清中的抗体滴度均升高。将抗血清在-20℃保存直至使用。实施例34.兔抗人Siglec-15多克隆抗体的纯化a)HiTrap蛋白A柱色谱分别在40ml实施例33的b)中制备的三组兔抗血清中各加入40mlDulbecco’sPBS(D-PBS、Invitrogen,Inc.生产)并混合,得到的混合物用SterivexGV滤器(MilliporeCo.,Ltd.生产)过滤。然后将滤出液以2ml/min的流速加载至预先用D-PBS平衡的两根HiTrap蛋白A5mL柱(将两根柱串联,AmershamBiosciences,Inc.生产)。用35mlD-PBS以1ml/min的流速洗柱后,用50ml0.1M柠檬酸钠缓冲液(pH3.0)以1ml/min的流速对吸附在柱上的蛋白进行洗脱。以每馏分2.5ml将洗脱液分馏在Mini-sorp管(Nunc,Inc.生产制)中后,立即加入0.6ml1MTris中和洗脱液。用离心膜浓缩器AmiconUltra-15(MilliporeCo.,Ltd.生产)将约15.5ml合并含洗脱蛋白的馏分(Fr.3~7)得到的溶液浓缩至5ml后,将其中2.5ml等分样品加载至预先用含0.01%Tween20的大塚注射用生理盐水(TO-SS)平衡的PD-10脱盐柱(AmershamBiosciences,Inc.生产制),然后用TO-SS洗脱,由此得到溶剂置换为TO-SS的3.5ml样品。将该操作重复进行2次。将如此制备的样品在-80℃冷冻保存直至使用。b)免疫前兔IgG的纯化在人Siglec-15-Fc的免疫开始前,从实施例33中使用的3只兔中预先采血,制备免疫前血清。将该血清各5ml等分样品混合后加入15mlD-PBS,得到的混合物用MillexGV滤器(MilliporeCo.,Ltd.生产)过滤。然后将得到的血清样品以1ml/min的流速加载至预先用D-PBS平衡的两根HiTrap蛋白A5mL柱(AmershamBiosciences,Inc.生产制)。用35mlD-PBS以1ml/min的流速洗柱后,用50ml0.1M柠檬酸钠缓冲液(pH3.0)以1ml/min的流速对吸附在柱上的蛋白进行洗脱。以每馏分2.5ml将洗脱液分馏到Mini-sorp管(Nunc,Inc.生产制)中,然后立即加入0.6ml1MTris中和洗脱液。用离心膜浓缩器AmiconUltra-15(MilliporeCo.,Ltd.生产)将合并含洗脱的蛋白馏分(馏分4~6)得到的溶液浓缩至2.5ml后,将该浓缩液加载至预先用含0.01%Tween20的大塚注射用生理盐水(TO-SS)平衡的PD-10脱盐柱(AmershamBiosciences,Inc.生产制),然后用TO-SS洗脱,由此得到溶剂置换为TO-SS的3.5ml样品。采用实施例8所述的方法对如此纯化的该免疫前兔IgG样品进行聚丙烯酰胺凝胶电泳和银染色,以确认IgG蛋白被充分纯化,然后测定蛋白浓度。将如此纯化的该免疫前兔IgG样品在-80℃冷冻保存直至使用。c)将人Siglec-15-Fc固定其上的亲和柱的制备用离心膜浓缩器AmiconUltra4(MilliporeCo.,Ltd.生产)将3ml实施例32的b)中制备的溶剂置换为N-PBS的纯化人Siglec-15-Fc(合计7.8mg蛋白)浓缩至2ml。在浓缩液中加入偶联缓冲液(0.2MNaHCO3、0.5MNaCl,pH8.3)至终体积为2.5ml,然后用PD-10脱盐柱将其溶剂置换为3.5ml的偶联缓冲液。将NHS-活化的HiTrap柱(1ml、AmershamBiosciences,Inc.生产制)内的异丙醇置换为1mM盐酸后,用注射器向柱中注入3ml制备的人Siglec-15-Fc,用连接在柱出口的另一注射器交替注入溶液来进行偶联反应。室温下反应30分钟后,为了灭活过剩的活性基团,按照AmershamBiosciences,Inc.生产的说明书,依次注入6ml封闭缓冲液(含0.5MNaCl的乙醇胺缓冲液、pH8.3)、6ml洗涤缓冲液(含0.5MNaCl的醋酸钠缓冲液、pH4.0)、6ml封闭缓冲液,然后将柱在室温下放置30分钟。然后,再次依次向柱中注入6ml洗涤缓冲液、6ml封闭缓冲液、6ml洗涤缓冲液,最后将柱内的缓冲液置换为含0.15MNaCl的10mMTris-HCl缓冲液(pH7.2)。将该柱保存于4℃直至使用。d)兔抗人Siglec-15多克隆抗体的亲和柱纯化d-i)亲和柱色谱用MillexGV滤器(MilliporeCo.,Ltd.生产)过滤a)中制备的纯化抗人Siglec-15多克隆抗体(第1、2、3组)各7ml,然后将得到的滤出液以0.25ml/min的流速加载至c)中制备的将人Siglec-15-Fc固定其上的柱,所述柱预先用应用缓冲液平衡。用5ml应用缓冲液以0.25ml/min的流速洗柱后,用5ml含0.5MNaCl的0.1M盐酸甘氨酸缓冲液(pH2.7)以0.25ml/min的流速对吸附在柱上的蛋白进行洗脱。用亲和柱纯化抗人Siglec-15多克隆抗体(第1、2、3)的色谱图如图30所示。以每馏分0.5ml将洗脱液分馏在Mini-sorp管(Nunc,Inc.生产制)中,然后立即加入16μl1MTris中和该洗脱液。将约2.5ml用盐酸甘氨酸缓冲液洗脱每种抗体的IgG蛋白馏分(馏分3~7)合并得到的溶液,加载至预先用含0.01%Tween20的Dulbecco’s磷酸盐缓冲生理盐水溶液(T-PBS)平衡的PD-10脱盐柱(AmershamBiosciences,Inc.生产制),然后用T-PBS洗脱,由此得到溶剂置换为T-PBS的3.5ml样品。将制备的样品在-80℃冷冻保存直至使用。d-ii)亲和纯化的兔抗人Siglec-15多克隆抗体的蛋白浓度的测定对于纯化的兔抗人Siglec-15多克隆抗体样品(从PD-10脱盐柱洗脱的蛋白馏分),将牛IgG作为标准品,用DC-蛋白测定试剂盒BioRadLaboratories,Inc.生产)测定蛋白浓度。如表9所示,第1~3各组均可制成约9.1~11.9mg亲和纯化的抗人Siglec-15多克隆抗体。表9蛋白浓度(mg/ml)样品量(ml)总蛋白(mg)第13.03.510.5第22.63.59.1第33.43.511.9实施例35.添加兔抗人Siglec-15多克隆抗体对正常人破骨细胞前体细胞的细胞融合的影响(TRAP染色)将正常人破骨细胞前体细胞(正常人天然破骨细胞前体细胞、购自三光纯药、商品编号2T-110)按照细胞所附说明书以1×104细胞/孔铺于96孔板。作为培养基,使用添加了OPGM补充套装(破骨细胞SingleQuotTM试剂盒,购自三光纯药、商品编号PT-9501)的破骨细胞前体细胞用基础培养基(OPBM、购自三光纯药、商品编号PT-8201),OPGM补充套装含有胎牛血清(终浓度10%)、人RANKL(终浓度69ng/ml)以及人M-CSF(终浓度33ng/ml)等。向得到的培养上清液中添加实施例34的d)中制备的第2组亲和纯化抗人Siglec-15抗体使终浓度为3或30μg/ml,并添加实施例34的b)中制备的免疫前兔IgG使终浓度为30μg/ml,该细胞在CO2培养箱中培养5天。培养后除去上清液,添加10%中性福尔马林进行细胞固定。细胞固定后,用蒸馏水洗涤该细胞2次,以100μl/孔添加TRAP染色液(0.27mM萘酚AS-MX磷酸(SigmaCo.,Ltd.生产)、1.6mM固红紫色LB盐(SigmaCo.,Ltd.生产)、1%二甲基甲酰胺、50mM酒石酸钠、0.1M醋酸钠缓冲液(pH5.0)),室温下反应5分钟。然后用蒸馏水洗涤该细胞2次,然后显微镜下观察(图31)。其结果为,添加抗人Siglec-15多克隆抗体可显著抑制高度细胞融合所致的巨大破骨细胞的形成。另一方面,添加免疫前IgG的情形未见这种对破骨细胞融合的抑制。对于这些固定、染色后的孔,用倒置显微镜对细胞核数目在5个或以上的TRAP阳性多核细胞计数(图32)。其结果为,在添加了终浓度为30μg/ml的第2组亲和纯化抗人Siglec-15抗体的孔中,观察到对多核破骨细胞形成的显著抑制。而添加30μg/ml免疫前IgG时也可见对多核破骨细胞形成的抑制倾向。但与上述孔相比较,显示添加第2组抗人Siglec-15抗体可显著抑制多核破骨细胞的形成。由此,结果表明,来自正常人破骨细胞前体细胞的TRAP阳性破骨细胞的多核化和细胞融合,被与Siglec-15特异性结合的抗体抑制。实施例36.大鼠抗小鼠Siglec-15单克隆抗体对人Siglec-15蛋白的结合特性评价通过ELISA法评价大鼠抗小鼠Siglec-15单克隆抗体对人Siglec-15蛋白的结合特性。用0.1M碳酸钠缓冲液(pH9.5)将实施例32的b)中制备的人Siglec-15-Fc蛋白稀释至5μg/ml,将得到的溶液以100μl/孔添加于96孔板(NalgeNuncInternational,Inc.生产、商品编号:430341)。该板室温下放置1小时后除去溶液,以300μl/孔添加洗涤缓冲液(含有0.05%Tween20的磷酸盐缓冲生理盐水),并除去。将该洗涤操作再进行1次后,以200μl/孔添加含25%BlockAce(大日本住友制药社制)的磷酸盐缓冲生理盐水,该板在室温下放置1小时以进行封闭。除去溶液,以300μl/孔的洗涤缓冲液洗涤2次。然后用ELISA缓冲液(含12.5%BlockAce和0.05%Tween20的磷酸盐缓冲生理盐水)将实施例24制备的各大鼠抗小鼠Siglec-15单克隆抗体或者大鼠对照IgG(R&Dsystems,Inc.生产)稀释至终浓度为1.28~20,000ng/ml(5倍稀释系列),将得到的稀释抗体溶液以100μl/孔添加至板中。该板在室温下放置1小时后除去溶液,用300μl/孔的洗涤缓冲液洗涤3次。接着以100μl/孔添加用ELISA缓冲液稀释了1,000倍的HRP(辣根过氧化物酶)标记的山羊抗大鼠IgG抗体(BeckmanCoulter,Inc.生产),该板室温下放置1小时。除去溶液,用300μl/孔的洗涤缓冲液洗涤该板3次后,使用过氧化酶用显色试剂盒(SumitomoBakeliteCo.,Ltd.生产),按照试剂盒所附说明书进行显色。显色后,用酶标仪(日本NihonMolecularDevicesCorporation生产)测定492nm处的吸光度。结果确认,检测的大鼠抗小鼠Siglec-15单克隆抗体的10个受试物质中,所有抗体均以浓度依赖性的方式与人Siglec-15蛋白结合(图33)。具体来说,结合活性特别强的是#1A1、#3A1、#24A1、#32A1、#61A1这5个受试物质,而#8A1、#34A1、#39A1这3个受试物质的结合活性较弱。另一方面,大鼠对照IgG中未见与人Siglec-15蛋白的结合。以上结果表明,实施例24制备的大鼠抗小鼠Siglec-15单克隆抗体不仅与小鼠Siglec-15结合,而且也与人Siglec-15结合,此外,发现一部分抗体与人Siglec-15的结合活性较强。实施例37.添加大鼠抗小鼠Siglec-15单克隆抗体对正常人破骨细胞前体细胞的细胞融合以及骨吸收活性的影响(体外生物活性评价)既然实施例36中确认大鼠抗小鼠Siglec-15单克隆抗体也与人Siglec-15结合,因此检测这些抗体对人破骨细胞形成及骨吸收活性的效果。a)添加大鼠抗小鼠Siglec-15单克隆抗体对正常人破骨细胞前体细胞的破骨细胞融合的影响(TRAP染色)按照细胞所附说明书,以1×104细胞/孔将正常人破骨细胞前体细胞(正常人天然破骨细胞前体细胞、购自三光纯药、商品编号2T-110)铺于96孔板。作为培养基,使用添加了OPGM补充套装(破骨细胞SingleQuotTM试剂盒,购自三光纯药、商品编号PT-9501)的破骨前体细胞用基础培养基(OPBM、购自三光纯药、商品编号PT-8201),该OPGM补充套装含有胎牛血清(终浓度10%)、人RANKL(终浓度66ng/ml)以及人M-CSF(终浓度33ng/ml)等。在得到的培养上清液中,添加实施例24制备的大鼠抗小鼠Siglec-15单克隆抗体以及大鼠对照IgG(R&Dsystems,Inc.生产)使终浓度为30μg/ml,该细胞在CO2培养箱中培养4天。培养后除去上清液,添加10%中性福尔马林进行细胞固定。细胞固定后,用蒸馏水洗涤2次,以100μl/孔添加TRAP染色液(0.27mM萘酚AS-MX磷酸(SigmaCo.,Ltd.生产)、1.6mM固红紫色LB盐(SigmaCo.,Ltd.生产)、1%二甲基甲酰胺、50mM酒石酸钠、0.1M醋酸钠缓冲液(pH5.0)),室温下反应5分钟。然后该细胞用蒸馏水洗涤2次,显微镜下观察(图34)。其结果为,添加#32A1抗体几乎完全抑制高度细胞融合所致的巨大破骨细胞的形成。并且,#41B1抗体也显著抑制高度细胞融合所致的巨大破骨细胞的形成。另一方面,除此之外的其他大鼠抗小鼠Siglec-15单克隆抗体(例如#1A1抗体)以及大鼠对照IgG中未见这种对破骨细胞的细胞融合的显著抑制。由此结果表明,来自正常人破骨细胞前体细胞的TRAP阳性破骨细胞的多核化和细胞融合,被与Siglec-15蛋白特异性结合的单克隆抗体抑制。b)添加大鼠抗小鼠Siglec-15单克隆抗体(#32A1)对正常人破骨细胞前体细胞的破骨细胞融合的影响(TRAP染色)按照细胞所附说明书,以1×104细胞/孔将正常人破骨细胞前体细胞(正常人天然破骨细胞前体细胞、购自三光纯药、商品编号2T-110)铺于96孔板。作为培养基,使用添加了OPGM补充套装(破骨细胞SingleQuotTM试剂盒,购自三光纯药、商品编号PT-9501)的破骨前体细胞用基础培养基(OPBM、购自三光纯药、商品编号PT-8201),该OPGM补充套装含有胎牛血清(终浓度10%)、人RANKL(终浓度68.4ng/ml)以及人M-CSF(终浓度33ng/ml)等。在得到的培养上清液中添加实施例24制备的大鼠抗小鼠Siglec-15单克隆抗体(#32A1抗体)使终浓度为0.1、0.3、1或3μg/ml,细胞在CO2培养箱中培养3天。培养后除去上清液,添加10%中性福尔马林进行细胞固定。细胞固定后,用蒸馏水洗涤2次,以100μl/孔添加TRAP染色液(0.27mM萘酚AS-MX磷酸(SigmaCo.,Ltd.生产)、1.6mM固红紫色LB盐(SigmaCo.,Ltd.生产)、1%二甲基甲酰胺、50mM酒石酸钠、0.1M醋酸钠缓冲液(pH5.0)),室温下反应5分钟。然后该细胞用蒸馏水洗涤2次,显微镜下观察细胞(图35)。其结果为,#32A1抗体在0.3μg/ml至3μg/ml的范围内浓度依赖性地抑制TRAP阳性多核破骨细胞的形成。c)添加大鼠抗小鼠Siglec-15单克隆抗体(#32A1)对正常人破骨细胞前体细胞的骨吸收活性的影响(使用胶原涂层板的评价)。已知破骨细胞通过释放组织蛋白酶K等蛋白酶来降解作为骨组织的构成成分的I型胶原蛋白。破骨细胞裂解测定试剂盒(Lonza,Inc.生产、商品编号PA-1500)提供涂布有缀合铕的人胶原蛋白的96孔板(96-孔破骨细胞裂解细胞培养板),通过测定同一块板上培养破骨细胞时上清液中游离的荧光胶原蛋白片段量,可以评价体外的破骨细胞骨吸收活性。按照细胞所附说明书,以1×104细胞/孔将正常人破骨细胞前体细胞(正常人天然破骨细胞前体细胞、购自三光纯药、商品编号2T-110)铺于96-孔破骨细胞裂解细胞培养板。作为培养基,使用添加了OPGM补充套装(破骨细胞SingleQuotTM试剂盒,购自三光纯药、商品编号PT-9501)的破骨前体细胞用基础培养基(OPBM、购自三光纯药、商品编号PT-8201),该OPGM补充套装含有胎牛血清(终浓度10%)、人RANKL(终浓度68.4ng/ml)以及人M-CSF(终浓度33ng/ml)等。在得到的培养上清液中添加实施例24制备的大鼠抗小鼠Siglec-15单克隆抗体(#32A1抗体)使终浓度为0.1、0.3、1或3μg/ml,细胞在CO2培养箱中培养3天。收集10μl培养上清液的等份样品,添加200μl破骨细胞裂解测定套装中的荧光团释放试剂,通过用荧光板阅读仪(fluorescenceplatereader)(ARVDMX、PerkinElmerInc.生产)测定荧光强度(激发:340nm、发射:615nm),由此对培养上清液中释放的游离荧光胶原蛋白片段量进行定量(图36)。其结果为,#32A1抗体在0.3μg/ml至3μg/ml的范围内,以浓度依赖的方式抑制添加RANKL所増加的荧光胶原蛋白片段量。由此表明,人破骨细胞的骨吸收活性被与Siglec-15蛋白特异性结合的单克隆抗体抑制。实施例38.小鼠抗人Siglec-15单克隆抗体的制备可通过以下工序来制备抗人Siglec-15抗体。(1)免疫对4~10周龄雌性BALB/c小鼠腹腔内给予实施例30至32中获得的可溶性人Siglec-15蛋白。2周后腹腔内给予同样的膜组分溶液以加强免疫。(2)细胞融合加强免疫3天后取出小鼠脾脏,将其放入无血清培养基,在网筛(mesh)上用压舌板(spatula)研碎。对通过网筛的细胞悬浮液进行离心以使脾脏细胞沉淀。另一方面,以相同的方式用无血清培养基洗涤并混悬骨髓瘤细胞NS1(AmericanTypeCultureCollectionTIB-18)。按照常规方法用得到的表达Siglec-15的细胞和骨髓瘤细胞进行细胞融合。(3)筛选产生抗人Siglec-15抗体的融合细胞,可通过使用细胞ELISA的方法和使用流式细胞仪的方法进行筛选。(4)克隆对上述(3)筛选的一组细胞,重复进行5次包括(3)所述的使用细胞ELISA的方法和流式细胞仪的方法的一系列操作,可得到多个能产生单一抗体的杂交瘤细胞的克隆,该单一抗体与表达人Siglec-15的细胞结合,但不与转染前的细胞结合。(5)抗体的纯化对经过(1)至(4)步骤制备的小鼠-小鼠杂交瘤细胞进行培养,收集得到的上清液。对得到的上清液进行收集并透析后,用高效液相色谱仪进行抗体的部分纯化。通过使用人Siglec-15蛋白的ELISA法对色谱的各馏分中的抗人Siglec-15抗体滴度进行测定。收集抗体滴度高的馏分,用于抗体亲和纯化柱。用柱平衡缓冲液洗涤柱内后,抗体用柱洗脱缓冲液洗脱。洗脱结束后立即将各洗脱液加入离心超滤器的上部进行离心。除去滤器下部收集的滤液后,在上部加入PBS,洗涤5次。将滤器上部残留的溶液作为抗人Siglec-15抗体样品。实施例39.大鼠抗人Siglec-15单克隆抗体的制备根据实施例23以及24所述的方法,使用实施例30至32中获得的可溶性人Siglec-15蛋白,可制备大鼠抗人Siglec-15单克隆抗体。实施例40.抗人Siglec-15单克隆抗体对破骨细胞分化的影响使用实施例38或39得到的抗人Siglec-15单克隆抗体,可检验该抗体对破骨细胞形成的抑制效应。为了检验对小鼠破骨细胞形成的效应,可采用实施例17、19、20、21、22、或26的方法。为了检验对人破骨细胞形成的抑制效果,可采用实施例35或37的方法。产业上的可利用性本发明的抗Siglec-15抗体具有对破骨细胞分化或骨吸收活性的抑制作用,并且含有该抗Siglec-15抗体的药物组合物可为骨代谢异常疾病的治疗剂或预防剂。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1