一种手性反‑2,3‑二取代的二环吡唑烷酮化合物的制备方法与流程
本发明属于有机合成领域,尤其涉及一种手性反-2,3-二取代的二环吡唑烷酮化合物的制备方法。
背景技术:
二环吡唑烷酮化合物作为一种重要的含有两个氮原子的五元杂环骨架,它和它的一些衍生物普遍存在于各种具有生物或者药物活性的分子中。例如,化合物1是一类重要的抗阿茲海默症(老年痴呆症)的药物(isr.patent,isxxaqil94658);化合物2既可以作为杀虫剂,也可以作为除草剂使用(pctint.appl.wo2005016873);而化合物3则是一类用途非常广泛的抗生素(j.med.chem.1988,31,1227-1230.):
现如今文献报道中催化不对称合成手性二环吡唑烷酮化合物的方法主要有:
1)二价镍与手性配体催化的亚甲基马来酸酯与偶氮甲碱亚胺的不对称1,3-偶极环加成反应:该反应需要使用容易在产物中残留的重金属镍作为催化剂,底物只局限于带有两个酯基的缺电子烯烃,且偶氮甲碱亚胺只有三种适用(chem.eur.j.2013,19,5134-5140.)。
2)二价铜与手性配体催化的丙炔酸酯与偶氮甲碱亚胺的不对称1,3-偶极环加成反应:该反应同样需要使用容易在产物中残留的重金属铜作为催化剂,并且反应需要在低温下(-40℃)进行(chem.commun.2013,49,7776-7778.)。
3)手性磷酸催化的3-亚甲基-2-吲哚酮与偶氮甲碱亚胺的不对称1,3-偶极环加成反应:该反应的所需要使用的催化剂和底物结构复杂,需多步合成,不利于大规模生产(chem.commun.2013,49,6713-6715.)。
4)手性金鸡纳碱衍生物催化的烯酮与偶氮甲碱亚胺的不对称1,3-偶极环加成反应:该反应使用的底物烯酮稳定性差,需在-20℃下进行,且产物的非对映选择性不好(org.lett.2016,18,4108-4111.)。
综上所述,尽管二环吡唑烷酮及其衍生物是一类非常有价值的杂环化合物,但是目前已经开发的方法大都存在或需要使用有毒的重金属催化剂,或反应条件苛刻、底物适用性窄,或立体选择性(包括区域选择性、非对映选择性和对映选择性)差等局限性。基于此我们发展了一种可以在较温和条件下来高立体选择性合成手性反-2,3-二取代的二环吡唑烷酮化合物的方法。
技术实现要素:
本发明提供了一种较温和的条件下合成手性反-2,3-二取代的二环吡唑烷酮化合物的方法,该制备方法立体选择性好,操作简便,原料廉价易得,且无需使用可能会在产物中残留的重金属催化剂,后处理方便;此外,该方法还可以很轻易地放大至克级,为工业上大规模的生产应用提供了可能。
一种手性反-2,3-二取代的二环吡唑烷酮化合物的制备方法,主要包括如下步骤:将脂肪醛、偶氮甲碱亚胺、手性氮杂环卡宾催化剂、有机碱、氧化剂以及添加剂加入到有机溶剂中,加热至30~50℃进行反应,反应完全后,后处理得到所述的手性反-2,3-二取代的二环吡唑烷酮化合物;
所述的脂肪醛的结构如式(ii)所示:
所述的偶氮甲碱亚胺的结构如式(iii):
所述的手性氮杂环卡宾催化剂的结构如式(iv)所示:
所述的有机碱的结构如式(v)所示:
所述的氧化剂的结构如式(vi)所示:
所述的手性反-2,3-二取代的二环吡唑烷酮化合物的结构如式(ⅰ)所示:
式(ⅰ)~(iii)中,r1为烷基、烯基、取代或者未取代的苄基,所述的苄基上的取代基为c1~c4烷氧基或卤素,取代位置为苄基上的苯环上的任意位置;
r2为取代或者未取代的芳基、萘基或者杂环基,所述的芳基上的取代基选自c1~c4烷基、c1~c4烷氧基、三氟甲基或卤素。
其中,所述的烷基为烷烃分子中少掉一个氢原子而形成的取代基,优选为c1~c10烷基,进一步优选为c1~c10直链烷基;
所述的烯基为烷烃分子中少掉一个氢原子而形成的取代基,优选为c1~c10烯基,进一步优选为c1~c10直链烯基。
所述的脂肪醛:偶氮甲碱亚胺:手性氮杂环卡宾催化剂:有机碱:氧化剂=2:1:0.2:1.2:1.2;
反应式如下:
反应中可能是手性氮杂环卡宾催化剂(iv)先在有机碱dbu(v)的作用下脱去一分子氟硼酸生成游离的氮杂环卡宾催化剂,该催化剂接着与脂肪醛(ii)结合生成breslow中间体,然后breslow中间体经氧化剂(vi)氧化和dbu(v)脱质子反应生成烯醇负离子中间体,最终烯醇负离子中间体和偶氮甲碱亚胺发生高立体选择性的[2+3]环加成反应生成手性反-2,3-二取代的二环吡唑烷酮化合物。
本发明中,可选用的后处理过程包括:过滤,硅胶拌样,最后经过柱层析纯化得到相应的手性反-2,3-二取代的二环吡唑烷酮化合物,采用柱层析纯化为本领域常用的技术手段。
作为优选,r1为正丁基,正辛基、8-壬烯基、取代或者未取代的苄基;
所述苄基上的取代基为对甲氧基或者对溴,此时,所述的脂肪醛容易得到,并且反应的产率较高,立体选择性较好。其中,取代基的编号顺序按照iupac命名法确定。
作为优选,r2为1-萘基,2-萘基,2-呋喃基、2-噻吩基取代或者未取代的苯基;所述苯基上的取代基为对甲基、对甲氧基、对三氟甲基、对氟、对氯、对溴、间溴或邻溴,此时,所述的偶氮甲碱亚胺容易得到,并且反应的产率较高,立体选择性较好。其中,取代基的编号顺序按照iupac命名法确定。
所述的脂肪醛廉价易得,相对于所述的偶氮甲碱亚胺的用量为过量,为确保反应进行地较完全,有机碱和氧化剂相对于所述的偶氮甲碱亚胺的用量也为过量,作为优选,以摩尔量计,脂肪醛:偶氮甲碱亚胺:手性氮杂环卡宾催化剂:有机碱:氧化剂=2:1:0.2:1.2:1.2。
作为优选,所述的反应加入
作为优选,所述的反应的温度为40℃,反应温度过高增加反应成本,相反则难以保证反应的完全。
作为优选,所述的反应的时间为72小时,反应时间过长增加反应成本,相反则难以保证反应的完全。
本发明中,能将原料充分溶解的有机溶剂都能使反应发生,但反应效率差别较大,优选为非质子性溶剂,非质子性溶剂能够有效地促进反应的进行;作为优选,所述的非质子性有机溶剂为1,2-二氯乙烷或者氯仿;作为进一步的优选,所述的有机溶剂为氯仿,此时,各种原料都能以较高的转化率转化成产物。
所述的有机溶剂的用量能将原料较好的溶解即可,0.1mmol的偶氮甲碱亚胺使用的有机溶剂的量约为1ml。
作为进一步的优选,所述的手性反-2,3-二取代的二环吡唑烷酮化合物为式(i-1)-式(i-8)所示化合物中的一种:
如式(i-1)和(i-2)为已知化合物,其余为未知化合物。
上述制备方法中,所述的脂肪醛、手性氮杂环卡宾催化剂、有机碱、氧化剂以及
同现有技术相比,本发明的有益效果体现在:该制备方法可在温和的条件下进行,立体选择性好,操作方便,后处理简单,避免了使用可能会在产物中残留的重金属催化剂;反应原料廉价易得,底物官能团兼容性好,可根据实际需要设计合成出多样化的手性反-2,3-二取代的二环吡唑烷酮类化合物,实用性较强。
附图说明
图1为实施例1中得到的产物(i-1)的核磁氢谱图;
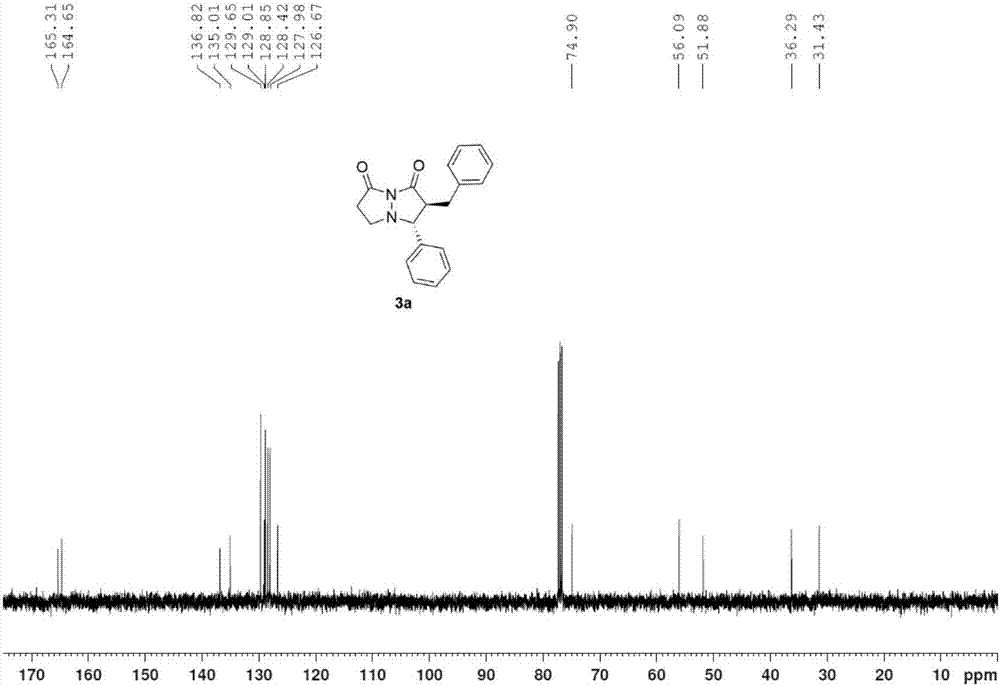
图2为实施例1的得到的产物(i-1)的核磁碳谱图;
图3的下图为实施例1的得到的产物(i-1)的高效液相色谱图,上图为按照实施例1的方法,但是采用非手性催化剂得到的相应的非手性产物。
图4为实施例1的得到的产物(i-1)的高分辨质谱图。
具体实施方式
下面结合具体实施例对本发明做进一步的描述,但需要强调的是本发明决不仅限于这几个实施示例所表示内容。
实施例1~15
按照表1的原料配比在10ml的schlenk管(或100ml三口圆底烧瓶)中依次加入脂肪醛(ii)、偶氮甲碱亚胺(iii)、手性氮杂环卡宾催化剂(iv)、有机碱(v)、氧化剂(vi)、
表1
表2
表1和表2中,
实施例1~15制备得到部分化合物的结构确认数据:
由实施例7制备得到的手性反-2,3-二取代的二环吡唑烷酮化合物(i-1)的核磁共振(1hnmr和13cnmr),高分辨质谱(hrms)和高效液相色谱(hplc)检测数据为:
1hnmr(400mhz,cdcl3)δ7.34(s,5h),7.22-7.14(m,3h),7.10(d,j=6.8hz,2h),3.55(d,j=12.4hz,1h),3.41-3.34(m,2h),3.14(dd,j1=14.8hz,j2=4.8hz,1h),2.98-2.85(m,2h),2.73-2.60(m,2h);13cnmr(100mhz,cdcl3)δ165.3,164.7,136.8,135.0,129.7,129.0,128.9,128.4,128.0,126.7,74.9,56.1,51.9,36.3,31.4;hrms(esi,m/z):calcd.forc19h18n2o2h+307.1441,found307.1454.[α]32d=+10.6(c=0.5inch2cl2);hplcanalysis:94%ee,[chiralpakidcolumn;1ml/min;solventsystem:i-proh/hexane=20:80;retentiontimes:23.0min(major),29.5min(minor)].
由实施例8制备得到的手性反-2,3-二取代的二环吡唑烷酮化合物(i-2)的核磁共振(1hnmr和13cnmr),高分辨质谱(hrms)和高效液相色谱(hplc)检测数据为:
1hnmr(400mhz,cdcl3)δ7.45-7.38(m,5h),3.64(d,j=12.4hz,1h),3.46(t,j=8.8hz,1h),3.01-2.93(m,2h),2.82-2.73(m,2h),1.77-1.71(m,1h),1.59-1.54(m,1h),1.37-1.33(m,1h),1.26-1.16(m,3h),0.80(t,j=7.2hz,3h);13cnmr(100mhz,cdcl3)δ166.2,164.7,135.7,129.1,128.9,127.7,76.7,54.9,52.1,36.4,28.3,26.0,22.5,13.6;hrms(esi,m/z):calcd.forc16h20n2o2h+273.1598,found273.1609.[α]32d=-3.4(c=0.5inch2cl2);hplcanalysis:92%ee,[chiralpakidcolumn;1ml/min;solventsystem:i-proh/hexane=20:80;retentiontimes:8.9min(minor),9.6min(major)].
由实施例9制备得到的手性反-2,3-二取代的二环吡唑烷酮化合物(i-3)的核磁共振(1hnmr和13cnmr),高分辨质谱(hrms)和高效液相色谱(hplc)检测数据为:
1hnmr(400mhz,cdcl3)δ7.26-7.17(m,5h),7.10(d,j=6.4hz,2h),6.89(d,j=8.4hz,2h),3.82(s,3h),3.48(d,j=12.4hz,1h),3.37-3.31(m,2h),3.14(dd,j1=14.8hz,j2=4.8hz,1h),2.97-2.81(m,2h),2.72-2.58(m,2h);13cnmr(100mhz,cdcl3)δ165.5,164.7,160.1,136.9,129.7,129.2,128.4,126.7,126.7,114.3,74.5,56.0,55.3,51.8,36.3,31.3;hrms(esi,m/z):calcd.forc20h20n2o3h+337.1547,found337.1554.[α]32d=+12.6(c=0.5inch2cl2);hplcanalysis:94%ee,[chiralpakidcolumn;1ml/min;solventsystem:i-proh/hexane=20:80;retentiontimes:29.3min(major),34.4min(minor)].
由实施例10制备得到的手性反-2,3-二取代的二环吡唑烷酮化合物(i-4)的核磁共振(1hnmr和13cnmr),高分辨质谱(hrms)和高效液相色谱(hplc)检测数据为:
1hnmr(400mhz,cdcl3)δ7.46(d,j=8.4hz,2h),7.19(br,5h),7.08-7.06(m,2h),3.52(d,j=12.0hz,1h),3.37-3.30(m,2h),3.12(dd,j1=14.4hz,j2=4.8hz,1h),2.99-2.87(m,2h),2.74-2.60(m,2h);13cnmr(100mhz,cdcl3)δ165.0,164.5,136.6,134.2,132.0,129.6,129.5,128.5,126.8,122.9,74.3,56.1,51.9,36.3,31.6;hrms(esi,m/z):calcd.forc19h17brn2o2h+385.0546,found385.0557.[α]32d=+13.0(c=0.5inch2cl2);hplcanalysis:90%ee,[chiralpakidcolumn;1ml/min;solventsystem:i-proh/hexane=20:80;retentiontimes:22.1min(major),25.8min(minor)].
由实施例11制备得到的手性反-2,3-二取代的二环吡唑烷酮化合物(i-5)的核磁共振(1hnmr和13cnmr),高分辨质谱(hrms)和高效液相色谱(hplc)检测数据为:
1hnmr(400mhz,cdcl3)δ7.44-7.43(m,2h),7.24-7.17(m,5h),7.08(d,j=6.4hz,2h),3.52(d,j=12.4hz,1h),3.40-3.31(m,2h),3.11(dd,j1=14.8hz,j2=5.6hz,1h),3.00-2.91(m,2h),2.75-2.61(m,2h);13cnmr(100mhz,cdcl3)δ164.9,164.5,137.6,136.4,132.0,131.0,130.3,129.5,128.5,126.9,126.6,122.8,74.3,56.2,52.0,36.3,31.8;hrms(esi,m/z):calcd.forc19h17brn2o2h+385.0546,found385.0558.[α]30d=+12.6(c=0.5inch2cl2);hplcanalysis:81%ee,[chiralpakidcolumn;1ml/min;solventsystem:i-proh/hexane=20:80;retentiontimes:20.9min(major),25.8min(minor)].
由实施例12制备得到的手性反-2,3-二取代的二环吡唑烷酮化合物(i-6)的核磁共振(1hnmr和13cnmr),高分辨质谱(hrms)和高效液相色谱(hplc)检测数据为:
1hnmr(400mhz,cdcl3)δ7.51-7.46(m,2h),7.29-7.26(m,1h),7.14-7.03(m,6h),4.44(d,j=12.0hz,1h),3.49-3.43(m,1h),3.38-3.35(m,1h),3.18(dd,j1=14.4hz,j2=5.2hz,1h),2.97-2.86(m,3h),2.77-2.67(m,1h);13cnmr(100mhz,cdcl3)δ165.2,164.8,136.8,134.0,133.1,130.2,129.4,129.0,128.2,127.9,126.5,124.9,73.1,56.2,51.8,36.2,32.6;hrms(esi,m/z):calcd.forc19h17brn2o2h+385.0546,found385.0553.[α]32d=+15.8(c=0.5inch2cl2);hplcanalysis:95%ee,[chiralpakidcolumn;1ml/min;solventsystem:i-proh/hexane=20:80;retentiontimes:24.0min(major),28.8min(minor)].
由实施例13制备得到的手性反-2,3-二取代的二环吡唑烷酮化合物(i-7)的核磁共振(1hnmr和13cnmr),高分辨质谱(hrms)和高效液相色谱(hplc)检测数据为:
1hnmr(400mhz,cdcl3)δ8.22(br,1h),7.90-7.83(m,2h),7.60(br,1h),7.54-7.49(m,2h),7.44(t,j=8.0hz,1h),7.08-7.07(m,3h),6.95-6.94(m,2h),4.34-4.31(br,1h),3.81(br,1h),3.32(t,j=8.8hz,1h),3.11(dd,j1=14.8hz,j2=5.2hz,1h),3.00-2.86(m,2h),2.77-2.69(m,2h);13cnmr(100mhz,cdcl3)δ165.7,164.9,136.6,134.1,131.4,130.1,129.7,129.4,129.1,128.2,127.0,126.6,126.3,125.9,125.2,123.2,55.6,52.4,36.4,32.1,29.6;hrms(esi,m/z):calcd.forc23h20n2o2h+357.1598,found357.1605.[α]32d=+18.2(c=0.5inch2cl2);hplcanalysis:98%ee,[chiralpakidcolumn;1ml/min;solventsystem:i-proh/hexane=20:80;retentiontimes:26.1min(major),28.9min(minor)].
由实施例14制备得到的手性反-2,3-二取代的二环吡唑烷酮化合物(i-8)的核磁共振(1hnmr和13cnmr),高分辨质谱(hrms)和高效液相色谱(hplc)检测数据为:
1hnmr(400mhz,cdcl3)δ7.87-7.81(m,3h),7.72(s,1h),7.55-7.50(m,3h),7.19-7.10(m,5h),3.72(d,j=12.4hz,1h),3.52-3.46(m,1h),3.35(t,j=8.0hz,1h),3.17(dd,j1=14.8hz,j2=4.8hz,1h),2.96-2.85(m,2h),2.74-2.67(m,2h);13cnmr(100mhz,cdcl3)δ165.3,164.7,136.8,133.5,133.0,132.3,129.7,128.9,128.4,128.1,127.8,127.7,126.7,126.6,126.5,124.6,75.1,55.9,51.9,36.3,31.5;hrms(esi,m/z):calcd.forc23h20n2o2h+357.1598,found357.1607.[α]32d=+13.0(c=0.5inch2cl2);hplcanalysis:90%ee,[chiralpakidcolumn;1ml/min;solventsystem:i-proh/hexane=20:80;retentiontimes:23.9min(major),25.4min(minor)]。
- 还没有人留言评论。精彩留言会获得点赞!