出芽短梗霉菌及其发酵生产普鲁兰多糖的方法与流程
本发明属于微生物技术领域,具体涉及一种高产普鲁兰多糖的出芽短梗霉菌株。
背景技术:
普鲁兰多糖以其优良的成膜性、阻气性、水溶性、生物相容性及可降解等特性,受到食品、医药等行业的青睐,尤其是在农产品保鲜方面得到越来越多的关注。作为优良的食品添加剂和保鲜剂,因国外产品一直处于垄断地位,导致价格居高不下,售价一直在25美元/公斤上下。目前国内该产品生产水平较低,产品质量不高,极大限制了普鲁兰多糖在国内食品行业尤其是农产品保鲜方面的广泛应用。目前,出芽短梗霉被认为是生产普鲁兰多糖的优良菌株,但是目前不同菌株的多糖生产能力参差不齐,并且大多出芽短梗霉菌株在发酵后期会产生黑色素,不易去除,导致普鲁兰多糖后续的纯化成本升高。因此获得不产黑色素的普鲁兰多糖高产菌株是解决以上问题的关键。
常压室温等离子体(artp)诱变技术,是利用大气压射频辉光放电(rfapgd)等离子体技术对生物体进行诱变的一种诱变育种技术。它具有等离子体射流温度低、放电均匀、化学活性粒子浓度高、操作简便、安全性高、诱变快速及突变率高等特点,已成为一种应用广泛的、快速高效的新型生物诱变育种方法。但目前未见关于使用artp诱变普鲁兰多糖生产菌株出芽短梗霉以提高多糖产量的报道。
技术实现要素:
为了解决上述的技术问题,本发明提供了一种高产普鲁兰多糖的微生物菌株(aurebasidiumpullulans)ncps2016-m,该菌株于2017年9月14日保藏于中国典型培养物保藏中心,保藏编号是:cctccm2017498,保藏地址为中国武汉。
为了解决上述提高普鲁兰多糖产量的技术问题,本发明提供了一种高产普鲁兰多糖的出芽短梗霉菌株(aurebasidiumpullulans)ncps2016-m,该高产普鲁兰多糖突变株菌株(aurebasidiumpullulans)ncps2016-m产量大于或等于60g/l,产普鲁兰多糖的能力为野生出芽短梗霉菌株的1.5-1.7倍左右;出芽短梗霉菌株诱变后单菌落大小与原始菌株单菌落相当,菌落形态规则、菌落中间凸起、质地坚硬、周围呈明显褶皱。
本发明的出芽短梗霉菌株(aurebasidiumpullulans)ncps2016-m发酵生产普鲁兰多糖的方法,包括下述的步骤:
(1)摇瓶种子培养:采用保藏编号为cctccm2017498的出芽短梗霉菌株(aurebasidiumpullulans)ncps2016-m为生产菌株,活化培养;
(2)将步骤(1)中经过活化培养的出芽短梗霉菌株(aurebasidiumpullulans)ncps2016-m转接到发酵培养基中进行发酵培养,66h后离心收集发酵上清液,用2倍体积的95%乙醇沉淀多糖,真空干燥。
更具体的,本发明提供的出芽短梗霉菌株(aurebasidiumpullulans)ncps2016-m发酵生产普鲁兰多糖的方法,包括下述的步骤:
(1)菌株活化培养的步骤:将出芽短梗霉菌株(aurebasidiumpullulans)ncps2016-m牛奶冷冻管解冻,转接于斜面培养基上,于恒温培养箱中28℃培养2d;再转接于斜面培养基中,于恒温培养箱中28℃培养2d,连续传代6次,得到第六代斜面培养物;
(2)摇瓶种子培养的步骤:采用保藏编号为cctccm2017498的出芽短梗霉菌株(aurebasidiumpullulans)ncps2016-m为生产菌株,从第六代斜面取两环培养物,转接于种子培养基中,于28℃恒温摇床中200rpm振荡培养24h,获得种子培养液。
(3)摇瓶发酵培养的步骤:将步骤(2)所得种子培养物按5%接种量转接到已灭菌的80ml发酵培养基(500ml摇瓶)中,于28℃恒温摇床中200rpm振荡培养66h。
(4)10l发酵罐小试发酵培养的步骤:将种子培养液按5%接种量转接到已灭菌的发酵罐培养基中,发酵温度为28℃,通风搅拌发酵60-66h,搅拌速度为350rpm,通风比为1:1。
(5)1m3发酵罐中试发酵培养步骤:将种子培养液按5%接种量转接到已灭菌的发酵罐培养基中,发酵温度为28℃,通风搅拌发酵60-66h,搅拌速度为220rpm,通风比为1:0.6。
(6)沉淀多糖的具体步骤:将发酵液于冷冻离心机4℃、10,000rpm离心20min收集发酵上清液,取上清液加2-4倍体积的95%乙醇后不断搅拌沉淀多糖,4℃冰箱中静置12h使多糖充分沉淀,于冷冻离心机中4℃、10,000rpm离心15min得沉淀,将沉淀于真空干燥机中烘干得普鲁兰多糖。
本发明的有益效果在于,本发明所获得的出芽短梗霉菌株(aurebasidiumpullulans)ncps2016-m产普鲁兰多糖的量达到了60g/l,产普鲁兰多糖的能力为野生出芽短梗霉菌株的的1.5-1.7倍,且不产黑色素。使用artp诱变技术诱变出芽短梗霉提高普鲁兰多糖产量是首次报道,并且效果明显,能有效降低工业生产普鲁兰多糖的生产成本,解决了由于普鲁兰多糖生产水平较低,产品质量不高,极大限制了普鲁兰多糖在国内食品行业尤其是农产品保鲜方面的广泛应用这一技术问题。
附图说明
图1原始菌株菌落形态及菌体形态(奥林巴斯光电显微镜ah-2油镜);
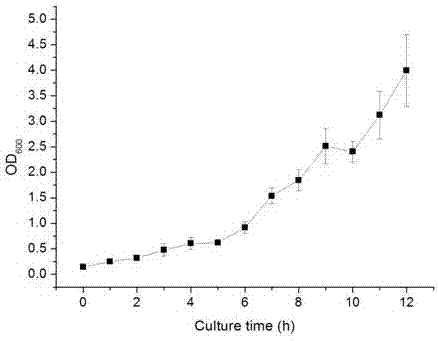
图2原始菌株的生长曲线;
图3出芽短梗霉as3.3984的artp诱变致死率曲线;
图4原始菌株与突变菌的菌落形态比较;
图5原始菌株与突变菌发酵72h的普鲁兰多糖产量比较;
图6原始菌株与突变株的普鲁兰多糖粗多糖;
图7原始菌株与突变菌的产普鲁兰多糖曲线。
具体实施方式
下面结合附图和具体实施方式来对本发明作更进一步的说明,以便本领域的技术人员更了解本发明,但并不以此限制本发明。
实施例1原始菌株的鉴定
原始菌株出芽短梗霉aureobasidiumpullulans购自中国普通微生物菌种保藏管理中心,该菌株的保藏编号是:as3.3984。
经its特征序列及18srrna基因序列扩增并测序,结果表明菌株as3.3984与出芽短梗霉菌株yy16序列相似度为99%,确定其为出芽短梗霉。测序由金唯智生物科技(北京)有限公司完成。
实施例2
出芽短梗霉as3.3984的artp诱变及高产突变株的筛选
2.1原始菌株的活化
配制斜面培养基:葡萄糖15-20g/l、酵母浸粉8-10g/l、蛋白胨15-20g/l及琼脂粉15-20g/l,ph自然,分装至试管中,加塞,115℃灭菌30min后制成试管斜面(18mm×180mm),备用;
配制固体平板培养基:配方同斜面培养基,115℃灭菌30min,冷却至约50℃,倒至灭菌平皿中,备用。
将出芽短梗霉as3.3984牛奶冷冻管解冻,转接于斜面培养基上,于恒温培养箱中28℃培养2d;转接平板,于恒温培养箱中28℃培养3d,待长出单菌落,在固体平板上28℃恒温培养3d后,可见单菌落呈乳黄色,菌落质地由粘稠状到坚硬和革状,菌落边缘规则,中间凸起(图1a)。挑取单菌落,结晶紫染色后,在奥林巴斯光电显微镜ah-2油镜下观察,可见出芽短梗霉as3.3984呈椭圆酵母状(4×100,图1b)。挑取单菌落,再转接于斜面培养基中,于恒温培养箱中28℃培养2d,连续传代6次,得到第六代斜面培养物。
2.2原始菌株种子液的培养
配制种子培养基:葡萄糖15-20g/l、酵母浸粉2-2.5g/l、硫酸铵0.6-0.8g/l、七水硫酸镁0.2-0.25g/l、氯化钠1.0-3.0g/l及三水磷酸氢二钾5.0-6.6g/l,ph6.5,115℃灭菌30min;
从第6代斜面取两环培养物,转接于种子培养基中,于28℃恒温摇床中200rpm振荡培养24h,获得种子培养液。
2.3原始菌株生长曲线的制作
将种子培养液按2.5%的接种量转接于种子培养基中,于28℃恒温摇床中200rpm振荡培养,每隔1h取样测定菌浓od600,测定12h内的生长情况。以时间为横轴,od600为纵轴制作生长曲线(图2)。图2所示5-8h是菌体增长迅速的阶段,这一时间段的菌体生长活跃,易于诱变,考虑尽可能获得较多菌体数目,因此选取培养8h的菌体作为下一步artp诱变处理的菌体。
2.4出芽短梗霉的artp诱变致死曲线
2.4.1原始菌株培养物准备
用接种环挑取两环出芽短梗霉第6代斜面培养物于种子培养基中28℃恒温200rpm振荡培养24h后,按2.5%的接种量再转接于种子培养基中,28℃恒温200rpm振荡培养8h以后,离心收集菌体,用生理盐水洗两遍,再用生理盐水重悬,得到原始菌株菌悬液。
2.4.2原始菌株不同时间梯度artp诱变处理
在2.4.1制备的原始菌株菌悬液中添加终浓度为5%的灭菌甘油保护菌体,取10μl原始菌株菌悬液于不锈钢载片上,以99.99%的高纯氦气为工作气体、电源功率120w、工作气流量10slpm、等离子体发射源距离菌体载片2mm、工作温度25-35℃为诱变条件,对菌体分别进行10s、30s、45s、60s、90s、120s、150s、180s及240s的诱变处理,每处理一个样品及时将其置于装有生理盐水的2ml小管中振荡洗脱菌体。诱变后的菌体进行梯度稀释后分别涂布于固体平板上,于恒温培养箱中28℃培养2-3d,待长出单菌落,通过cfu计算不同处理时间的菌落数,统计菌落数,按公式计算致死率,制作致死曲线(图3)。致死率按以下公式计算:致死率(%)=100×(未诱变处理对照菌的总菌落数-诱变处理后的总菌落数)/未诱变处理对照菌的总菌落数。artp处理150s,致死率达90%,处理180s,致死率达99%,由于突变的随机性,致死率与正突变率的关系并不明确,因此选取150s和180s这两个时间点作为下一步诱变处理的作用时间。
2.5出芽短梗霉as3.3984的artp诱变
如2.4.2所述,将处于对数生长期的出芽短梗霉as3.3984液体培养物进行150s和180s时长的artp诱变处理,诱变后菌体进行适量稀释后涂布于固体平板,于恒温培养箱中28℃培养2-3d,待长出单菌落,挑选平板内菌落数约为10-20个单菌落的平板进行计数,平板内菌株作为下一步筛选的菌株,共挑取了110个单菌落,分别划线于固体平板中28℃恒温培养2-3d,得到95个生长良好的菌株。诱变后菌株单菌落大小与原始菌株单菌落相当,菌落形态规则、菌落中间凸起、质地坚硬、周围呈明显褶皱(图4)。图4a为原始菌株菌落形态,图4b为突变菌株菌落形态。将以上菌株分别划线于斜面培养基上,28℃恒温培养2d,得到斜面培养物。
2.6液体发酵筛选普鲁兰多糖高产突变株
配制种子培养基:葡萄糖15-20g/l、酵母浸粉2-2.5g/l、硫酸铵0.6-0.8g/l、七水硫酸镁0.2-0.25g/l、氯化钠1.0-3.0g/l及三水磷酸氢二钾5.0-6.6g/l,ph6.5,115℃灭菌30min;
配制豆粕酸解液:浓度为0.25m的盐酸在121℃条件下酸解低温压榨豆粕30min,冷却后,8,000rpm离心5min,收集上清液,加蒸馏水重悬,再8,000rpm离心5min,收集上清液,定容使浓度达88g/l,121℃灭菌20min,冷却后按终浓度22g/l添加到发酵培养基中。
配制发酵培养基:葡萄糖80-100g/l、豆粕酸解液22-28g/l、硫酸铵0.6-0.8g/l、七水硫酸镁0.2-0.25g/l、氯化钠1.0-3.0g/l及三水磷酸氢二钾5.0-6.6g/l,ph7.0,115℃灭菌30min;葡萄糖单独灭菌。
将2.5中诱变后的95株菌株斜面培养物分别取两环于种子培养基中,28℃恒温、200rpm振荡培养24h,按5%接种量转接到发酵培养基中,28℃恒温、200rpm振荡培养72h,4℃、10,000rpm离心收集发酵上清液,用2倍体积无水乙醇沉淀胞外多糖(eps),置于80℃烘箱中烘干至恒重,称重,计算得率。经过发酵筛选,获得了一株普鲁兰多糖产量达60g/l的突变株,将其命名为出芽短梗霉ncps2016-m,相对原始菌株的36g/l的普鲁兰多糖产量,突变株的多糖产量提高了约67%(图5)。将该目标菌株(aurebasidiumpullulans)ncps2016-m保藏于中国典型培养物保藏中心,保藏编号是:cctccm2017498。将菌株制成牛奶冷冻管保藏。突变株与原始菌株的普鲁兰多糖粗多糖均呈乳黄色,无黑色素,图6a为原始菌株所产普鲁兰多糖,图6b为突变菌株所产普鲁兰多糖。
突变所获得的菌株(aurebasidiumpullulans)ncps2016-m于2017年9月14日保藏于中国典型培养物保藏中心,保藏编号是:cctccm2017498。
2.7出芽短梗霉原始菌株as3.3984与突变株(aurebasidiumpullulans)ncps2016-m产糖曲线
为了明确突变株(即保藏于中国典型培养物保藏中心,保藏编号是:cctccm2017498的菌株(aurebasidiumpullulans)ncps2016-m)的普鲁兰多糖最适发酵时间,根据2.6的液体发酵方法对获得的突变株和原始菌株进行了发酵培养,每隔12h取样,收集发酵上清液,无水乙醇沉淀多糖,烘干后称重,检测普鲁兰多糖产量;在66h时,也取样进行了普鲁兰多糖重量测定(图7)。结果显示,与原始菌株相比,突变株ncps2016-m自24h这个取样点开始,每个取样点的多糖产量均高于原始菌株,并且达到最大产量的时间为66h,比原始菌株的72h缩短了6h,在工业生产上可降低能耗。
实施例3
出芽短梗霉菌株(aurebasidiumpullulans)ncps2016-m发酵生产普鲁兰多糖的10l发酵罐小试方法,包括下述的步骤:
配制种子培养基:葡萄糖15-20g/l、酵母浸粉2-2.5g/l、硫酸铵0.6-0.8g/l、七水硫酸镁0.2-0.25g/l、氯化钠1.0-3.0g/l及三水磷酸氢二钾5.0-6.6g/l,ph6.5,115℃灭菌30min;
配制上罐培养基:按照75%的装液量计算,需配置7.5l:葡萄糖750g、8.8%豆粕酸解液940ml、(nh4)2so44.5g、mgso4·7h2o1.5g、nacl7.5g、k2hpo4·3h2o49.5g;ph6.5,121℃灭菌20min,冷却。
配制8.8%豆粕酸解液:低温压榨豆粕160g,加入1m盐酸312.5ml,加入蒸馏水补至1250ml,121℃酸解30min,冷却,用1mnaoh调节ph5.0-5.5之间,定容至浓度为8.8%。
取一支出芽短梗霉菌株斜面培养物,将其全部转接至种子培养基中,28℃恒温、200rpm,振荡培养24h,按5%接种量375ml种子培养液接到发酵培养基中,28℃恒温、350rpm搅拌,通风量0.45m3/h发酵60-66h;检测残糖(还原糖)低于2g/l为发酵终点。10l发酵罐普鲁兰多糖产量约为64g/l,比摇瓶发酵提高了约7%。
实施例4
出芽短梗霉菌株(aurebasidiumpullulans)ncps2016-m发酵生产普鲁兰多糖的中试方法,包括下述的步骤:
配制种子培养基:种子罐50l,按照75%的装液量计算,需配置37.5l:配方同实施例3种子培养基,ph6.5,定容至37.5l。121℃灭菌20min,冷却。
配制上罐培养基:发酵罐1.0m3,按照75%的装液量计算,需要配制0.75吨培养基:配方同实施例3上罐培养基,ph6.5,定容至0.75吨,121℃灭菌20min,冷却。
种子液的培养:取一支出芽短梗霉菌株斜面培养物,将其全部转接至种子培养基中,28℃恒温、200rpm,振荡培养24h,所得培养液按2%接种量750ml转接于50l发酵罐中,28℃恒温、250rpm搅拌,通风量0.45m3/h发酵24h。
发酵罐中发酵普鲁兰多糖:将种子液全部接种于发酵培养基中,28℃恒温、220rpm搅拌,通风量30.24m3/h发酵60-66h,检测残糖(还原糖)低于2g/l为发酵终点。最终ph:5.0-5.5。1.0m3发酵罐普鲁兰多糖产量约为70g/l,比摇瓶发酵提高了约17%。
实施例5
出芽短梗霉菌株(aurebasidiumpullulans)ncps2016-m发酵普鲁兰多糖的沉淀及干燥方法,具体步骤:
将发酵液于冷冻离心机4℃、10,000rpm离心20min收集发酵上清液,取上清液加2-4倍体积的95%乙醇后不断搅拌沉淀多糖,4℃冰箱中静置12h使多糖充分沉淀,于冷冻离心机中4℃、10,000rpm离心15min得沉淀,将沉淀于真空干燥机中烘干得普鲁兰多糖。
实施例6出芽短梗霉菌株(aurebasidiumpullulans)ncps2016-m发酵普鲁兰多糖的产量计算方法
干燥后普鲁兰多糖直接称重,按1l发酵液所得普鲁兰多糖重量计(g/l)。产量提高倍数=突变株产量/原始菌株产量。
- 还没有人留言评论。精彩留言会获得点赞!