硅烷介导的橡胶储存稳定性增强的制作方法
本发明涉及一种通过在特定支化剂和特定稳定化合物的存在下使共轭二烯聚合来制备支化弹性体聚合物的方法。所得弹性体聚合物可有利地用于橡胶制品诸如轮胎中。
背景技术:
不断上涨的油价和要求减少汽车二氧化碳排放的国家立法迫使轮胎和橡胶生产商生产“低燃油消耗的”从而节省燃油的轮胎。一种获得低燃油消耗的轮胎的方法在于生产具有降低的滞后损失的轮胎配制物。交联弹性体聚合物组合物的滞后损失与其在60℃下的tanδ值有关(参见iso4664-1:2005;rubber,vulcanizedorthermoplastic;determinationofdynamicproperties–part1:generalguidance)。通常,在60℃下具有相对低的tanδ值的硫化弹性体聚合物组合物因具有较低的滞后损失而是优选的。在最终的轮胎产品中,这意味着更低的滚动阻力和更好的燃油经济性。相反,0℃下较低的tanδ值对应于轮胎产品的劣化的湿路抓地力。因此,可以以劣化的湿路抓地性能为代价制造较低滚动阻力轮胎。例如,在无规溶液丁苯橡胶(无规ssbr)中,如果聚苯乙烯单元浓度相对于总聚丁二烯单元浓度降低,则ssbr玻璃化转变温度降低,结果是60℃下的tanδ和0℃下tanδ均减小,通常对应于轮胎的改善的滚动阻力和劣化的湿抓地性能。因此,在正确评估硫化橡胶的性能时,应监测60℃下的tanδ和0℃下的tanδ以及轮胎的热积聚。
wo2012/091753涉及硅烷官能化聚合物和由其制备的硫化橡胶。作者描述了用于引发阴离子聚合的某些烯基氨基硅烷的用途。
us8,299,167b2涉及通过在碱金属催化剂的存在下使共轭二烯单体和乙烯基氨基硅烷聚合获得的共轭二烯聚合物。
wo2011/028523涉及用于制备聚二烯的方法,所述方法包括在乙烯基硅烷、烯丙基硅烷或烯丙基乙烯基硅烷的存在下使用镧系元素基催化剂体系使共轭二烯单体聚合。
wo2015/055252描述了可在共轭二烯单体的聚合中用作改性单体(任选地连同芳族乙烯基单体一起)从而产生聚合物,特别是可用于生产轮胎的弹性体聚合物的乙烯基硅烷化合物。
当聚合物主链中可水解裂解的键实际裂解时,可导致聚合物粘度由于聚合物分子量的降低而降低。在偶联(支化)聚合物的情况下,可以观察到偶联率(支化聚合物链与未支化聚合物链的比例)和门尼粘度随着时间和温度的变化而降低。从商业角度来看,表现出这种不稳定储存行为的聚合物较差。本发明的目的是提供一种支化弹性体聚合物,其表现出如随时间不变或较少变化的聚合物粘度所体现的改进的储存稳定性并具有降低的温度依赖性。
技术实现要素:
本发明尤其基于这样的理解,即聚合物主链中可水解裂解的键包括聚合物-si(r2)-o-聚合物、聚合物-si(r2)-n(r)-聚合物和聚合物-si(r2)-s-聚合物键。在亲核试剂诸如水、醇等的存在下,所述键可被如下裂解:
为了防止这种水解裂解,可以向聚合物配方中添加水清除剂。一个商业实例是来自rheinchemie的
第一方面,本发明提供了一种用于制备支化弹性体聚合物的方法,所述方法包括:
(a)使至少一种共轭二烯与如下所定义的式1化合物以及任选地一种或多种芳族乙烯基单体在引发剂化合物的存在下聚合,
(a’)使至少一种共轭二烯与任选地一种或多种芳族乙烯基单体在引发剂化合物的存在下聚合,所述引发剂化合物可通过使如下所定义的式1化合物与有机碱金属化合物反应得到,或
(a”)使活性聚合物与如下所定义的式1化合物反应,所述活性聚合物可通过使至少一种共轭二烯与任选地一种或多种芳族乙烯基单体进行阴离子聚合得到,
其特征在于(a)、(a’)和(a”)在如下所定义的式2的稳定剂化合物的存在下进行;
(a)—bn(式1)
每个b独立地选自基团-si(r1)(r2)(r3),其中r1、r2和r3各自独立地选自乙烯基、丁二烯基、甲基、乙基、丙基、丁基、己基、辛基、苯基和苄基,条件是r1、r2和r3中的至少一个选自乙烯基和丁二烯基,其中每个基团b是基团a的氨基基团的取代基;
基团a的所述氨基基团中的至少两个各自被至少一个基团b取代;
n是至少2的整数,优选地是选自2至6的整数;且
基团a中的所有氨基基团均是叔氨基基团;
其中
r’独立地选自c1-c12烷基、c2-c12烯基、c6-c18芳基和c7-c18烷基芳基,其中两个r’基团可被连接以形成环且除与si键合的氮原子外,所述环还可含有氧原子、氮原子、>n(c1-c6烷基、c6-c18芳基、c7-c18烷基芳基)基团和硫原子中的一个或多个;
r”选自c1-c6烃基;
r”’独立地选自c1-c18烃基;
ra、rb和rc独立地选自氢、甲基、乙基和乙烯基;
x是选自1和2的整数;y是选自0、1和2的整数;z是选自0、1和2的整数;且x+y+z=3;
m选自0和1;条件是当ra、rb和rc都不是乙烯基时,则m=0。
在第二方面,本发明提供了可通过根据本发明第一方面的方法获得的支化弹性体聚合物。
在第三方面,本发明提供了一种非硫化(非固化)聚合物组合物,其包含根据本发明第二方面的支化弹性体聚合物和一种或多种选自以下的其它组分:(i)添加至用于制备所述聚合物的聚合方法中或作为用于制备所述聚合物的聚合方法的结果形成的组分,(ii)从所述聚合方法除去溶剂后保留的组分,和(iii)在完成聚合物制造过程后添加至所述聚合物的组分,因此包括通过应用(但不限于)机械混合器添加到“无溶剂”聚合物中的组分。
在第四方面,本发明提供了硫化(固化)聚合物组合物,其通过硫化(固化)根据本发明第三方面的包含一种或多种硫化(固化)剂的非固化聚合物组合物获得。
在第五方面,本发明提供了一种用于制备硫化聚合物组合物的方法,所述方法包括硫化根据本发明第三方面的包含一种或多种硫化剂的非硫化聚合物组合物。
在第六方面,本发明提供了一种包含至少一种由根据本发明第四方面的硫化聚合物组合物形成的组分的制品。
令人惊奇的是,已发现在聚合过程中加入乙烯基、丁二烯基或异戊二烯基氨基硅烷(即式2化合物)可稳定具有水解可裂解键的支化聚合物(即通过式1化合物支化的聚合物)的聚合物粘度。
附图说明
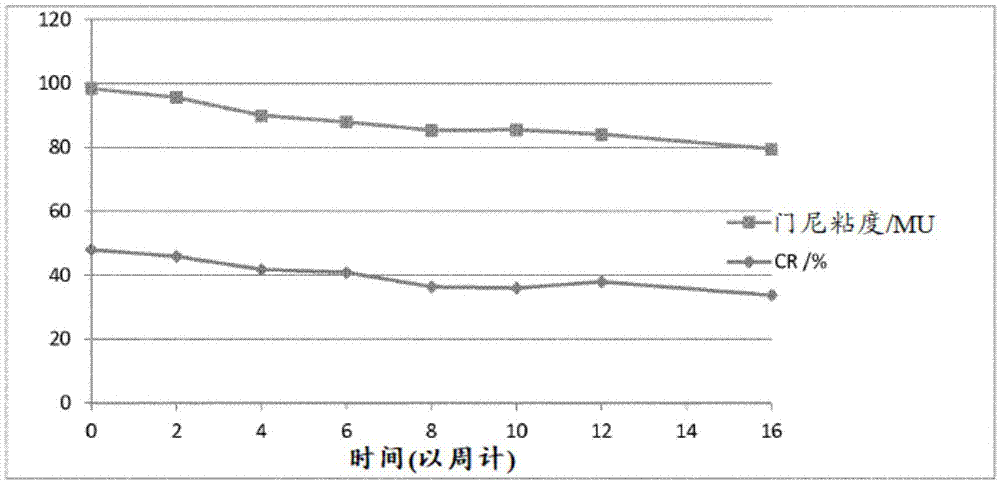
图1是显示根据比较例ex1的末端改性、支化且未稳定的聚合物的以门尼单位(mu)表示的门尼粘度和偶联率(cr)在25℃下随时间的发展的图。
图2是显示根据比较例ex2的末端改性、支化且未稳定的聚合物的以mu表示的门尼粘度和偶联率(cr)在25℃下随时间的发展的图。
图3是显示根据比较例ex3的末端改性、支化且未稳定的聚合物的以mu表示的门尼粘度和偶联率(cr)在25℃下随时间的发展的图。
图4是显示根据实施例ex4的末端改性、支化且稳定的聚合物的以mu表示的门尼粘度和偶联率(cr)在25℃下随时间的发展的图。
图5是显示下列五种聚合物的以mu表示的门尼粘度在70℃下随时间的发展(储存稳定性加速试验)的图:未稳定聚合物:d(降低18mu)、e(降低:11.5mu)。稳定聚合物:a(降低:12.5mu)、b(降低:27.2mu)、c(降低1.3mu)。用于聚合物b的稳定剂(s2)没有稳定作用。用于聚合物a的稳定剂s3具有中等效果(相对于聚合物b具有改进的储存稳定性,14.7mu),这可以通过更高的投加量来补偿。稳定剂s7在相同投加量下非常有效。
图6是显示下列四种聚合物的以mu表示的门尼粘度在70℃下随时间的发展(储存稳定性加速试验)的图:未稳定聚合物:i(降低19.5mu)。稳定聚合物:f(降低:1.7mu)、g(增加6.0mu,稳定剂s6的量可略有减少)、h(增加7.2mu,稳定剂s6的量可略有减少)。
图7是显示下列三种聚合物的以mu表示的门尼粘度在70℃下随时间的发展(储存稳定性加速试验)的图:稳定聚合物:j(减少14.4mu,稳定剂s16,投加2当量/引发剂),k(增加29.7mu,稳定剂s16,投加5当量/引发剂)、l(增加2.8mu,稳定剂s16,投加2当量/引发剂,如聚合物实施例j的较低的mp和较低的cr)。对非端基改性聚合物j和k的储存行为进行比较得到用于这些聚合物的约3当量/当量引发剂的最优s16投加量。聚合物l在分子量、偶联率和微观结构方面有所不同。
具体实施方式
式1化合物
式1化合物通常是多(乙烯基或丁二烯基)氨基硅烷,即它具有至少两个被至少一个烯属不饱和甲硅烷基b(如式1所定义)取代的氨基。表述“基团b是氨基的取代基”或“被基团b取代的氨基”在本文中用于描述基团b与氨基的氮原子的键合,即>n-si(r1)(r2)(r3)。基团a的氨基可以被0、1或2个基团b取代。基团a的所有氨基均是叔氨基,即不含氢原子的氨基。
有机基团a优选是不含活性氢的基团。表述“活性氢”在本发明的上下文中用于表示在共轭二烯诸如丁二烯或异戊二烯的阴离子聚合中非惰性的氢原子,即会反应的氢原子。
有机基团a也优选是不含亲电子基团的基团。术语“亲电子基团”在本发明的上下文中用于表示在共轭二烯诸如丁二烯或异戊二烯的阴离子聚合中与作为模型引发剂的正丁基锂和/或与活性链反应的基团。亲电子基团包括:炔烃、(碳)阳离子、卤原子、si-o、si-s、si-卤素基团、金属-c-基团、腈、(硫代)羧酸酯((thio)carboxylate)、(硫代)羧酸酯((thio)carboxylicester)、(硫代)酸酐、(硫代)酮、(硫代)醛、(硫代)氰酸酯、(硫代)异氰酸酯、醇、硫醇、(硫代)硫酸盐、磺酸盐、氨基磺酸盐、砜、亚砜、亚胺、硫代缩酮、硫代缩醛、肟、缩二氨基脲、碳二亚胺、脲、氨基甲酸乙酯、重氮盐、氨基甲酸酯、酰胺、硝酮、硝基、亚硝胺、黄原酸酯、磷烷、磷酸酯、膦、膦酸酯、硼酸、硼酸酯等。
更优选地,有机基团a是既不含活性氢也不含亲电子基团的基团。
在本发明第一方面的优选实施方案中,式1化合物选自下列式1-1至1-5的化合物,其中式1的相同限制和条件适用于基团b和指数n,即该化合物具有至少两个基团b,而对于基团a,式1的限制和条件本身就是满足的:
实施方案1:
其中
r11、r12、r13、r14和r15各自独立地选自基团b、c1-c18烷基、c6-c18芳基,任选地c1-c4烷基取代的c3-c12杂芳基、c7-c18芳烷基、(r4)a-o-(r5)b,其中r4和r5各自独立地选自c1-c6烷基和c6-c18芳基且a和b各自是独立选自0至4的整数,和-si(r6)(r7)(r8),其中r6、r7和r8各自独立地选自甲基、乙基、丙基、丁基、己基、辛基、苯基和苄基;
r9和r10各自独立地选自二价乙基、丙基、丁基、苯基和-(ch2)a’-c6h5-(ch2)b’-,其中a’和b’各自是独立选自0和1的整数;并且
c是选自0、1、2和3的整数。
优选地在式1-1中,r11、r12、r13、r14和r15各自独立地选自基团b和甲基;r9和r10各自是二价乙基;且c是选自0、1、2和3的整数。
式1-1的具体实施方案包括:
其中每个r独立地选自b、c1-c6烷基和苄基。
实施方案2:
其中基团-n<>n-是可为饱和或不饱和的且可在任一环碳原子上被c1-c6烷基基团取代的5至18元杂环基团,其中除在式1-2中清楚示出的两个n原子外的杂原子基团选自-n=、>nr16(其中r16选自基团b、c1-c6烷基、苯基和苄基)、-o-、-s-和>sir17r18(其中r17和r18各自独立地选自c1-c6烷基、苯基和苄基)。优选基团-n<>n-是哌嗪基、甲基哌嗪基、二甲基哌嗪基、四甲基哌嗪基。
式1-2的具体实施方案包括:
其中r是c1-c6烷基基团。
实施方案3:
其中r20、r21和r22各自独立地选自单键和二价c1-c10烷基基团,d是选自0、1和2的整数,d’是选自0和1的整数,其中当d’是0时d是0,每个基团-n<>x-独立地选自可为饱和或不饱和的且可在任一环碳原子上被c1-c6烷基基团取代的5至10元杂环基团,其中每个x独立地选自-n-、-c=和-ch-,并且除在式1-3中清楚示出的两个基团n和x外的杂原子基团选自-n=、>nr16(其中r16选自c1-c6烷基、基团b、苯基和苄基)、-o-、-s-和>sir17r18(其中r17和r18各自独立地选自c1-c6烷基、苯基和苄基)。优选基团-n<>x-包括哌啶基和哌嗪基。
式1-3的具体实施方案包括:
实施方案4:
其中d是可为饱和或不饱和的且可在任一环碳原子上被c1-c6烷基基团取代的5至10元碳环或杂环基团,其中杂原子基团选自-n=、>nr16(其中r16选自c1-c6烷基、基团b、苯基和苄基)、-o-、-s-和>sir17r18(其中r17和r18各自独立地选自c1-c6烷基和苯基),每个基团-n<>x-独立地选自可为饱和或不饱和的且可在任一环碳原子上被c1-c6烷基基团取代的5至10元杂环基团,其中每个x独立地选自-n-、-c=和-ch-,r23选自单键和二价c1-c10烷基基团,且e是选自2、3和4的整数。优选基团d包括环戊基、环己基、苯基和四氢呋喃基。优选基团-n<>x-包括哌啶基和哌嗪基。
优选地在式1-4中,d选自环戊基、环己基、苯基和四氢呋喃基;每个基团-n<>x-选自哌啶基和哌嗪基;r23是单键;且e是选自2和3的整数。
式1-4的具体实施方案包括:
实施方案5:
其中e是6至10元脂环族或芳族基团,每个r24独立地选自单键和c1-c2烷基,每个r独立地选自b、c1-c6烷基和苄基,且f是选自2和3的整数。
优选地在式1-5中,e选自环己基和苯基;r’是单键,r选自b、c1-c4烷基和苄基;且f是选自2和3的整数。
式1-5的具体实施方案包括:
其中每个r独立地选自b、c1-c6烷基和苯基。
可从式1化合物获得的引发剂化合物
在本发明第一方面的替代步骤(a’)中使用的引发剂化合物可通过使如上所述的式1化合物(包括其所有实施方案)与有机碱金属化合物反应得到。
合适的示例性有机碱金属化合物包括甲基锂、乙基锂、正丁基锂、仲丁基锂、叔丁基锂、叔辛基锂、异丙基锂、苯基锂、环己基锂、2-丁基锂、4-苯基丁基锂、叔丁基二甲基甲硅烷基氧基丙基锂、二烷基氨基丙基锂、n-吗啉代丙基锂、联苯基钠、萘基钠和萘基钾、1,3-双(1-(苯基)1-锂己基)苯、1,3-双(1-(4-乙基苯基)1-锂己基)苯、1,3-双(1-(4-甲基苯基)1-锂己基)苯、1,3-双(1-(4-丙基苯基)1-锂己基)苯、1,3-双(1-(4-(叔丁基)苯基)1-锂己基)苯、1,3-双(1-(4-(二乙基氨基)苯基)1-锂己基)苯、1,3-双(1-(4-(二甲基氨基)苯基)1-锂己基)苯、1,3-双(1-(4-乙氧基苯基)1-锂己基)苯、1,3-双(1-(4-(二甲氧基)苯基)1-锂己基)苯、(((二甲基氨基)二甲基-甲硅烷基)甲基)锂、(((二乙基氨基)二甲基甲硅烷基)甲基)锂、(((二丁基氨基)二甲基-甲硅烷基)甲基)锂、(((二己基氨基)二甲基甲硅烷基)甲基)锂、(((二辛基氨基)二甲基-甲硅烷基)甲基)锂、(((二苄基氨基)二甲基甲硅烷基)甲基)锂、((二甲基(哌啶-1-基)甲硅烷基)甲基)锂、((二甲基(吗啉代)甲硅烷基)甲基)锂、((二甲基(4-甲基-哌嗪-1-基)甲硅烷基)甲基)锂、((二甲基(4-乙基哌嗪-1-基)甲硅烷基)甲基)锂、和((二甲基(4-苄基哌嗪-1-基)甲硅烷基)甲基)锂。更优选地,引发剂化合物是单锂烷基、烷基芳基或芳基化合物。
可从式1化合物获得的引发剂化合物可在惰性溶剂中且在无规化剂化合物存在下制备,且合适的溶剂与它们在如下所定义的溶液聚合中使用的溶剂相同。
在另一个实施方案中,可从式1化合物获得的引发剂化合物可在惰性溶剂中制备而不使用无规化剂化合物,且合适的溶剂与它们在如下所定义的溶液聚合中使用的溶剂相同。
式1化合物的制备
通常,根据本发明第二方面,式1化合物通过在碱存在下使具有至少两个独立地选自伯氨基和仲氨基的基团的胺与以下式3的硅烷反应来制备:
x-si(r1)(r2)(r3)(式3)
其中
x选自cl、br、i、三氟甲磺酸酯(otf)和甲苯磺酸酯(otos);
r1、r2和r3各自独立地选自乙烯基、丁二烯基、甲基、乙基、丙基、丁基、己基、辛基、苄基和苯基,条件是r1、r2和r3中的至少一个选自乙烯基和丁二烯基。
可用于制备式1化合物的式3的硅烷包括氯二(c1-c4烷基)乙烯基硅烷,特别是氯二甲基乙烯基硅烷、氯二乙基乙烯基硅烷和氯二苯基乙烯基硅烷,优选地是氯二甲基乙烯基硅烷。
具有至少两个伯氨或仲氨基团的胺在结构上对应于式1中的基团a,但具有至少两个伯氨或仲氨基团而不是相应的叔氨基团。
因此,在实施方案1中,用于制备式1-1化合物的胺可以选自苯二胺、c2-c4单亚烷基二胺、c2-c4二亚烷基三胺和c2-c4三亚烷基四胺,优选地选自单亚乙基二胺、二亚乙基三胺、二亚丙基三胺、三亚乙基四胺和四亚乙基五胺。
在实施方案2中,用于制备式1-2化合物的胺可选自哌嗪和1,7-二氧杂-4,10-二氮杂环十二烷。
在实施方案3中,用于制备式1-3化合物的胺可选自三亚乙基四胺、4,4’-三亚甲基二哌啶、4,4’-亚乙基二哌啶和1-(3-哌嗪-1-基丙基)哌嗪。
在实施方案4中,用于制备式1-4化合物的胺可以是1,4-二(哌嗪-1-基)苯(由例如1,4-二溴苯和哌嗪制成)。用于制备式1-4化合物的饱和胺可以通过相应芳族胺的过渡金属催化氢化制备。
在实施方案5中,用于制备式1-5化合物的胺可选自1,2-环己二胺、邻-或对-苯二胺、1,3,5-三氨基苯、1,5-二氨基萘和1,8-二氨基萘。
通常,胺和式3的硅烷将按比例反应,以便将至少两个基团b连接到胺上,例如通过使用在0.5至0.1范围内的胺与式3的硅烷的摩尔比(取决于胺的数量)。对于每摩尔伯氨和仲氨基团,使用1至3摩尔的式3的硅烷。
式1化合物的制备还可以包括胺与式3的硅烷以外的硅烷之间的(部分)反应。在这种情况下,胺、式3的硅烷和另一种硅烷之间的反应可以依序进行,例如首先使胺与式3的硅烷反应,然后与另一种硅烷反应,反之亦然。
碱优选地选自叔脂族或芳族胺诸如三乙胺、吡啶和1,4-二氮杂双环[2.2.2]辛烷(dabco)或取代脒或胍诸如1,8-二氮杂双环十一烯(dbu)、1,5-二氮杂双环[4.3.0]壬-5-烯(dbn)、1,1,3,3-四甲基胍,优选地选自三乙胺和吡啶。所用碱的总量一般为每摩尔伯氨和仲氨基团0.5至5摩尔,优选地为每摩尔伯氨和仲氨基团1至3摩尔。也可以使用具有至少两个伯氨或仲氨基团的胺作为碱,然则必须相应地增加其量,通常增加1.5-5当量。确保碱相较于硅烷反应物过量(以摩尔量计)是重要的,以便反应中产生的所有hx都可以被碱捕获(猝灭)。
反应可在溶剂中,特别是在惰性溶剂中进行,诸如烃类溶剂,包括戊烷、正己烷、环己烷、庚烷、苯和甲苯;醚溶剂,包括二乙醚、四氢呋喃和叔丁基甲醚;氯化溶剂,包括氯仿、四氯甲烷和二氯甲烷;酯类溶剂诸如乙酸乙酯和乙酸甲酯,或其它两极性溶剂诸如丙酮、二甲基甲酰胺和乙腈。优选溶剂是二氯甲烷、氯仿、二乙醚、乙酸乙酯、甲苯和环己烷。溶剂中反应物的总浓度通常在0.1至2m的范围内。
胺和式3的硅烷之间的反应可以在本领域技术人员显而易见的条件下进行,例如在用于使胺与卤代硅烷反应的条件下。
该反应可适当地在从-30℃至反应混合物的回流温度的温度下进行,优选地在0℃-25℃下进行。
通常,通过将溶液中的或纯净的式3的硅烷滴加到胺和碱的溶液中来进行反应。将反应混合物搅拌并反应足够的时间,通常为数小时,优选地为至少一小时,温度通常为0℃至回流温度。在反应终止或完成后,可以过滤掉在反应过程中形成的任何不溶性盐,可以通过减压蒸馏除去溶剂,并诸如经由真空蒸馏或重结晶来提纯而得到式1化合物。
式2的稳定剂化合物
在本发明第一方面中使用的式2的稳定剂化合物的特征在于,在乙烯基、丁二烯基或异戊二烯基氨基硅烷的硅原子上连接至少一个氨基。将氨基和甲硅烷氧基组合连接至所述硅原子上可进一步提高稳定性能。
式2中r”’的c1-c18烃基优选地独立选自c1-c18烷基、c2-c18烯基、c6-c18芳基和c7-c18烷基芳基,优选地为甲基、乙基、异丙基、叔丁基、苯基和苄基。通过组合r”’和甲硅烷氧基(-o-si)形成的具体示例性三烃基甲硅烷氧基是叔丁基二甲基甲硅烷氧基、三乙基甲硅烷氧基、三异丙基甲硅烷氧基、三苯基甲硅烷氧基、叔丁基二苯基甲硅烷氧基、二乙基异丙基甲硅烷氧基、二甲基十八烷基甲硅烷氧基和三己基甲硅烷氧基。
r’优选地独立选自甲基、乙基、正丙基、正丁基、异丁基、戊基、己基和苄基。在一个实施方案中,两个r’基团各自是乙基基团,它们又经由氧原子连接,从而与si键合的氮原子形成吗啉环。在另一个实施方案中,两个r’基团连接且与si键合的氮原子一起形成5至12元环,诸如环戊胺基团、环己胺基团、环庚胺基团、环辛胺基团、环十二胺基团、吗啉基团、噁唑烷基团、噻唑烷基团、硫代吗啉基团、4-甲基哌嗪基团、4-乙基哌嗪基团、4-丙基哌嗪基团、4-丁基哌嗪基团和4-苄基哌嗪基团,优选地为5至8元环。在一个实施方案中,一个r’表示基团-si(crc=crarb)(osir”’3)y(r”)z,其中ra、rb、rc、r”’、r”、y和z独立地如上所定义且y+z=2。
r”的c1-c6烃基可选自c1-c6烷基和苯基。其优选地为甲基。
ra、rb和rc优选地相同且甚至更优选地为氢。在一个实施方案中,ra、rb和rc中只有一个是乙烯基,而其余两个是氢。在优选的实施方案中,x,y和z各自为1且m为0。在另一个优选的实施方案中,x=2,y=0,z=1且m=0。在另一个优选的实施方案中,x=1,y=0,z=2且m=1,并且ra、rb和rc中至少一个是乙烯基。
在式1的乙烯基硅烷化合物的优选实施方案中,参数和取代基取以下值:
a)r”’是(甲基、甲基、叔丁基)或(苯基、苯基、苯基)或(叔丁基、苯基、苯基)或(己基、己基、己基);r’独立地选自甲基、乙基、正丙基、正丁基、戊基、己基、庚基、辛基和苄基(经由甲基基团键合),或–nr’r’形成吗啉基团、吡咯烷基团、哌啶基团或噁唑烷基团;r”是甲基;ra、rb和rc各自是氢;且x=y=z=1
b)r”’是(甲基、甲基、叔丁基)或(己基、己基、己基);r’独立地选自甲基和乙基,或–nr’r’形成吗啉基团、吡咯烷基团、哌啶基团或噁唑烷基团;r”是甲基;ra、rb和rc各自是氢;且x=2,y=1且z=0
c)r”’是(甲基、甲基、叔丁基)或(己基、己基、己基);r’独立地选自甲基和乙基,或–nr’r’形成吗啉基团、吡咯烷基团、哌啶基团或噁唑烷基团;r”是甲基;ra和rb各自是氢且rc是乙烯基;且x=y=z=1
通常,对于基团-osir”’3,优选选择体积较大的取代基,基团-nr’2中的取代基越小。
式2的乙烯基硅烷化合物的优选实施方案是(叔丁基二甲基甲硅烷氧基)甲基-4-吗啉代(乙烯基)硅烷、(叔丁基二甲基甲硅烷氧基)(二甲基氨基)甲基(乙烯基)硅烷、(叔丁基二甲基甲硅烷氧基)(二乙基氨基)甲基(乙烯基)硅烷、(叔丁基二甲基甲硅烷氧基)(二丁基氨基)甲基(乙烯基)硅烷、(叔丁基二甲基甲硅烷氧基)(二苄基氨基)甲基(乙烯基)硅烷、1-[(叔丁基二甲基甲硅烷氧基)甲基(乙烯基)甲硅烷基]-4-乙基哌嗪、1-[(叔丁基二甲基甲硅烷氧基)甲基(乙烯基)甲硅烷基]-4-甲基哌嗪、4-乙基-1-(二甲基(2-亚甲基丁-3-烯-1-基)甲硅烷基)哌嗪、1-[(叔丁基二甲基甲硅烷氧基)甲基(乙烯基)甲硅烷基]-4-苄基哌嗪和1-[(叔丁基二甲基甲硅烷氧基)甲基(乙烯基)甲硅烷基]-4-丙基哌嗪。
m=0的式2化合物的制备以及此类化合物的其它细节描述于wo2015/055252中,该专利通过引用整体并入本文。在(i)选自镁、锌、铝和硼的金属和(ii)在溶剂中的过渡金属催化剂的存在下,或使用其变体,可通过使以下式4化合物与以下式5化合物反应来制备m=1的式2化合物:
其中
每个r’独立地选自c1-c12烷基、c6-c18芳基、c7-c18烷基芳基、三(c1-c6烷基、c6-c12芳基或c7-c18烷基芳基)甲硅烷基和烯丙基,其中两个r’基团可被连接以形成环且除与si键合的氮原子外,所述环还可含有氧原子、氮原子、>n(c1-c6烷基或c7-c18烷基芳基)基团和硫原子中的一个或多个;
每个r”独立地选自c1-c6烃基;
ra、rb、rc、rd和re独立地选自氢、甲基和乙基;
x是选自0、1和2的整数,y是选自1、2和3的整数且x+y=3。
聚合
式1化合物作为支化剂用于在弹性体聚合物中引入可逆支化。为此,它可以原样或在与有机碱金属化合物反应生成引发剂化合物后已经用于制备弹性体聚合物的聚合反应,或它可以被添加到活性弹性体聚合物中并与活性弹性体聚合物反应。两种或更多种式1化合物可以组合使用。在每种情况下,聚合或反应在式2的稳定剂化合物的存在下进行,并且两种或更多种式2的稳定剂化合物可以组合使用。
弹性体聚合物通常可以经由阴离子、自由基或过渡金属催化聚合来制备,但优选地通过阴离子聚合制备。聚合可以在溶剂中进行,并且可以使用一种或多种链端改性剂、其它偶联剂(包括改性偶联剂)、无规化剂化合物和聚合促进剂化合物进行。
除了下列具体公开内容之外,关于聚合技术的普遍适用指导(包括聚合引发剂化合物、极性配位化合物和促进剂(用于提高/改变引发剂的反应性,用于随机排列芳族乙烯基单体和/或用于随机排列和/或改变引入聚合物中的1,2-聚丁二烯或1,2-聚异戊二烯或3,4-聚异戊二烯单元的浓度);每种化合物的量;单体;和合适的工艺条件)描述于wo2009/148932中,该专利通过引用完整并入本文。
共轭二烯(共轭二烯单体)
可用于本发明的示例性共轭二烯单体包括1,3-丁二烯、2-(c1-c5烷基)-1,3-丁二烯诸如异戊二烯(2-甲基-1,3-丁二烯)、2,3-二甲基-1,3-丁二烯、1,3-戊二烯、2,4-己二烯、1,3-己二烯、1,3-庚二烯、1,3-辛二烯、2-甲基-2,4-戊二烯、环戊二烯、2,4-己二烯、α-和β-法尼烯和1,3-环辛二烯。可使用两种或更多种共轭二烯的混合物。优选的共轭二烯包括1,3-丁二烯和异戊二烯。在一个实施方案中,共轭二烯是1,3-丁二烯。
芳族乙烯基单体
可选的芳族乙烯基单体包括单乙烯基芳族化合物,即仅有一个连接到芳族基团上的乙烯基的化合物,和具有两个或更多个连接到芳族基团上的乙烯基的二-或更高乙烯基芳族化合物。任选地与至少一种共轭二烯一起使用的示例性芳族乙烯基单体包括苯乙烯、c1-4烷基取代的苯乙烯诸如2-甲基苯乙烯、3-甲基苯乙烯、4-甲基苯乙烯、2,4-二甲基苯乙烯、2,4,6-三甲基苯乙烯、α-甲基苯乙烯、2,4-二异丙基苯乙烯和4-叔丁基苯乙烯、二苯乙烯、乙烯基苄基二甲基胺、(4-乙烯基苄基)二甲基氨基乙醚、n,n-二甲基氨基乙基苯乙烯、4-(n,n-二乙基氨基二甲基)甲硅烷基苯乙烯、4-(二甲基氨基二甲基)甲硅烷基苯乙烯、4-((4-乙基哌嗪基)二甲基)甲硅烷基苯乙烯、4-((4-甲基哌嗪基))二甲基)甲硅烷基苯乙烯、叔丁氧基苯乙烯、乙烯基吡啶和二乙烯基芳族化合物诸如1,2-二乙烯基苯、1,3-二乙烯基苯和1,4-二乙烯基苯。两种或更多种芳族乙烯基单体可以组合使用。优选的芳族乙烯基单体是单乙烯基芳族化合物,更优选地是苯乙烯。
根据应用,可以以基于用于聚合反应的单体总重量的高达70重量%,特别是40-70重量%、或15-40重量%、或1-15重量%的总量使用单乙烯基芳族化合物,尤其包括苯乙烯。可以以1重量%或更少的总量(基于用于制造聚合物的单体的总摩尔量)使用二-或更高乙烯基芳族化合物诸如二乙烯基苯,包括1,2-二乙烯基苯、1,3-二乙烯基苯和1,4-二乙烯基苯。在一个优选实施方案中,1,2-二乙烯基苯与苯乙烯和丁二烯或异戊二烯组合使用。
其它单体
除了式1化合物或式2的稳定剂、可用于制备本发明的弹性体聚合物的共轭二烯单体和任选的芳族乙烯基单体之外的共聚单体包括丙烯酸类单体诸如丙烯腈、丙烯酸酯,例如丙烯酸、丙烯酸甲酯、丙烯酸乙酯、丙烯酸丙酯和丙烯酸丁酯;和甲基丙烯酸酯例如甲基丙烯酸甲酯、甲基丙烯酸乙酯、甲基丙烯酸丙酯和甲基丙烯酸丁酯。基于用于聚合反应的单体总重量,此类其它共聚单体通常以不超过5重量%的比例使用。
引发剂化合物
引发剂化合物用于本发明的聚合方法中,并且两种或更多种引发剂化合物可以组合使用。引发剂化合物可以是单价或多价(二价、三价等)引发剂化合物。合适的引发剂化合物包括碱金属、有机碱金属化合物、碱金属和极性化合物之间的络合物、含有碱金属的低聚物和路易斯酸碱络合物。示例性碱金属包括锂、钠、钾、铷和铯。示例性有机碱金属化合物包括与在可从式1化合物获得的引发剂化合物的描述中逐项列出的有机碱金属化合物相同者。碱金属和极性化合物之间的示例性络合物包括锂-四甲基乙二胺络合物、锂-四氢呋喃络合物、锂-二四氢呋喃丙烷络合物及其钠和钾类似物。更优选地,引发剂化合物是单锂烷基或二锂烷基、烷基芳基或芳基化合物。其它的可用引发剂包括在wo2014/040640中描述的氨基硅烷聚合引发剂和在wo2015/010710中描述的聚合引发剂。
在特定实施方案中,引发剂化合物可通过使式1化合物和如上所定义的有机碱金属化合物反应得到。在这个实施方案中,引发剂化合物能够执行引发剂化合物和支化剂两者的功能。
引发剂,特别是有机锂引发剂的总量将根据单体和目标分子量或聚合物进行调整。该总量通常是每100克0.05至5mmol,优选地是每100克单体0.2至3mmol。低分子量聚合物可以通过每100克单体使用5至20mmol引发剂来制备。
溶剂
聚合通常以溶液聚合的方式进行,其中所形成的聚合物基本上可溶于反应混合物中,或以悬浮/淤浆聚合的方式进行,其中所形成的聚合物基本上不溶于反应介质。更优选地,聚合物是在溶液聚合中获得的。作为聚合溶剂,通常使用不使引发剂、催化剂或活性聚合物链失活的烃溶剂。聚合溶剂可以是两种或更多种溶剂的组合。示例性烃溶剂包括脂族和芳族溶剂。具体实例包括(包括所有可能的构造异构体):丙烷、丁烷、戊烷、己烷、庚烷、丁烯、丙烯、戊烯、己烷、辛烷、苯、甲苯、乙基苯和二甲苯。
链端改性剂
一种或多种链端改性剂可用于本发明的聚合反应中,用于通过与本发明聚合物中聚合物链的末端反应来进一步控制聚合物性能。为此,通常可使用诸如在wo2007/047943、wo2009/148932、us6,229,036和us2013/0131263中公开的硅烷-硫化物ω链端改性剂,所述专利各自通过引用整体并入本文。适用于本发明的其它链端改性剂是在wo2014/040640和wo2015/010710中公开的那些以及在wo2014/040639中描述的硅烷硫化物改性剂,所述专利各自整体并入本文。
链端改性剂可以在聚合过程中间歇添加(以固定间隔或不固定间隔)或连续添加,但优选地以大于80%的聚合转化率添加,更优选地以大于90%的转化率添加。优选地,大量聚合物链端在与链端改性剂反应之前不被终止;也就是说,活性聚合物链端存在并且能够与改性剂反应。
偶联剂
为了进一步控制聚合物分子量和聚合物性质,偶联剂(“连接剂”)可用作本发明方法中的任选组分。与相同分子量的非偶联的基本线性的聚合物大分子相比,偶联剂将通过减少弹性体聚合物的自由链端的数量和/或降低聚合物溶液粘度来降低滞后损失。偶联剂诸如四氯化锡可以使聚合物链端官能化并与弹性体组合物的组分反应,例如与填料或与聚合物的不饱和部分反应。示例性偶联剂描述于u.s.3,281,383、u.s.3,244,664和u.s.3,692,874(例如四氯硅烷);u.s.3,978,103、u.s.4,048,206、4,474,908和u.s.6,777,569(封端的巯基硅烷);u.s.3,078,254(多卤素取代的烃,诸如1,3,5-三(溴甲基)苯);u.s.4,616,069(锡化合物和有机氨基或胺化合物);和u.s.2005/0124740。
通常,链端改性剂在添加偶联剂之前、期间或之后添加,并且改性反应优选地在添加偶联剂后进行。
所用偶联剂的总量会影响偶联聚合物的门尼粘度,并且通常在每100克弹性体聚合物0.001至4.5毫当量的范围内,例如每100克聚合物0.01至约1.5毫当量。
无规化剂化合物
如本领域通常已知的无规化剂化合物(也称为极性配位化合物)可任选地添加到单体混合物或聚合反应,以调节聚合物的共轭二烯部分的微结构(即乙烯基键的含量),或调整任何芳族乙烯基单体以及聚合物链中的乙烯基键的组成分布。可以使用两种或更多种无规化剂化合物的组合。可用于本发明的无规化剂化合物通常由路易斯碱化合物例证。用于本发明的合适的路易斯碱是例如醚化合物诸如二乙醚、二丁醚、乙二醇二乙醚、乙二醇二丁醚、二乙二醇二甲醚、丙二醇二甲醚、丙二醇二乙醚、丙二醇二丁醚、(c1-c8烷基)四氢呋喃醚(包括甲基四氢呋喃醚、乙基四氢呋喃醚、丙基四氢呋喃醚、丁基四氢呋喃醚、己基四氢呋喃醚和辛基四氢呋喃醚)、四氢呋喃、2,2-(双四氢糠基)丙烷、双四氢糠基甲缩醛、四氢糠醇甲醚、四氢糠醇乙醚、四氢糠醇丁醚、α-甲氧基四氢呋喃、二甲氧基苯和二甲氧基乙烷、以及叔胺诸如三乙胺、吡啶、n,n,n’,n’-四甲基乙二胺、二哌啶乙烷、n,n-二乙基乙醇胺甲醚、n,n-二乙基乙醇胺乙醚、n,n-二乙基乙醇胺和二甲基n,n-四氢糠胺。优选无规化剂化合物的实例在wo2009/148932中被鉴定,该专利通过引用整体并入本文。
通常将以0.012:1至10:1,优选地以0.1:1至8:1,且更优选地以0.25:1至约6:1的无规化剂化合物与引发剂化合物的摩尔比加入无规化剂化合物。
促进剂化合物
聚合可任选地包括促进剂以提高引发剂的反应性(且从而提高聚合速率)、以随机排列引入聚合物中的芳族乙烯基单体、或提供芳族乙烯基单体单链,从而影响芳族乙烯基单体在活性阴离子弹性体共聚物中的分布。促进剂实例包括醇钠或酚钠和醇钾或酚钾,优选地醇钾或酚钾,诸如异丙醇钾、叔丁醇钾、叔戊醇钾、正庚醇钾、苄醇钾、苯酚钾;羧酸的钾盐,羧酸诸如异戊酸、辛酸、月桂酸、棕榈酸、硬脂酸、油酸、亚麻酸、苯甲酸、邻苯二甲酸和2-乙基己酸;有机磺酸的钾盐,有机磺酸诸如十二烷基苯磺酸、十四烷基苯磺酸、十六烷基苯磺酸和十八烷基苯磺酸;和有机亚磷酸的钾盐,诸如二乙基亚磷酸盐、二异丙基亚磷酸盐、二苯基亚磷酸盐、二丁基亚磷酸盐和二月桂基亚磷酸盐。
此类促进剂化合物可以以每1.0克原子当量锂引发剂0.005至0.5mol的总量加入。如果加入小于0.005mol,则通常不会获得足够的效果。另一方面,如果促进剂化合物的量多于约0.5mol,则链端改性反应的生产率和效率会显著降低。
式1化合物的投加
式1化合物的投加取决于期望的偶联率,偶联率又对聚合物性能有影响。通常期望偶联率在5%至80%之间。因此,式1化合物可以以每当量引发剂化合物0.01-5当量、优选地0.05-2当量/当量、更优选地0.1-1.0当量/当量、最优选地0.15-0.8当量/当量的总量使用。在替代方案(a”)中,应用相应的投加,同时使用活性聚合物链端的当量作为“引发剂化合物的当量”。如本领域中通常已知,活性聚合物链端的当量可以通过滴定(例如gilman滴定)或经由光谱方法(uv光谱法)来测定。当式1化合物被用作引发剂化合物(替代方案(a’))时,即在与过量的一种或多种有机碱金属化合物反应后,其优选地按下列比率使用:0.05-0.9当量/当量有机碱金属化合物的总量,更优选地:0.1-0.5当量/当量有机碱金属化合物的总量。当本发明的聚合物用于轮胎应用中,例如用于轮胎胎面或轮胎侧壁的橡胶混料中时,上述量尤其适用。根据本发明,可以组合使用不同的式1化合物。
在聚合过程或反应中,式1化合物相对于共轭二烯单体和任选芳族乙烯基单体、引发剂化合物和其它组分的添加(“投加”)模式将影响所得聚合物的结构。因此,可以制备所需比例和顺序的具有多(乙烯基或丁二烯基)-氨基-硅烷聚合物嵌段和其它单体嵌段的统计共聚物和嵌段共聚物。示例性投加方案如下:
(1)随着聚合的进行,将式1化合物连续(增量)加入到包含共轭二烯单体,任选地芳族乙烯基单体和引发剂化合物的混合物中,从而提供统计共聚物。
(2)在加入主要量的引发剂连同主要量的共聚单体之前投加式1化合物。在单体定量或接近定量转化后,可以进行式1化合物的第二次添加以在聚合物末端产生嵌段结构。
(3)在加入主要量的引发剂连同主要量的共聚单体之前投加式1化合物,其可以在式1化合物的定量或接近定量转化后加入。另外,可以以可变比例在全部单体的限定转化度下进行式1化合物的几个投加步骤,以在聚合物链内产生n个锥形或嵌段结构元素。在单体定量或接近定量转化后,式1化合物或链端改性剂或偶联剂的最终添加可用于在聚合物末端产生嵌段结构或另一种官能化或偶联。
(4)可以以可变比例在全部单体的限定转化度下进行式1化合物的几个投加步骤,以在聚合物链内产生锥形或嵌段结构元素。在单体的定量或接近定量转化后,式1化合物或链端改性剂或偶联剂的最终添加可用于在聚合物末端产生嵌段结构或另一种官能化或偶联。
(5)在加入主要量的引发剂连同主要量的共聚单体(锥形结构)之前投加式1化合物,其可以在式1化合物的定量或接近定量转化后加入,以产生嵌段结构。在单体定量或接近定量转化后,可加入链端改性剂或偶联剂以官能化或偶联聚合物链,这是优选的投加选择。
式2的稳定剂化合物的投加
式2化合物的投加不仅取决于式1化合物的投加量和式2的稳定剂化合物的有效性,而且取决于聚合物的分子量因此取决于“偶联浓度”。此外,聚合物后处理条件和干燥橡胶的含水量会影响最佳储存行为所需的量。因此,应针对所涉及的每次聚合来调整并优选地优化式2化合物的量。
通常,式2的稳定剂化合物可以以每当量引发剂0.01-100当量的式2的化合物,优选地0.05-20当量/当量,更优选地0.1-5当量/当量,甚至更优选地不超过0.9当量/当量的量使用。在替代方案(a”)中,应用相应的投加,同时使用活性聚合物链端的当量作为“引发剂化合物的当量”。如本领域中通常已知,活性聚合物链端的当量可通过滴定(例如gilman滴定)或经由光谱方法(uv光谱法)来测定。
在聚合过程或反应中,式2化合物相对于共轭二烯单体和任选的芳族乙烯基单体、引发剂化合物和其它组分的加入(“投加”)模式可以按照与上述式1化合物的示例性投加方案(1)-(5)相对应的方式选择。
聚合物
根据本发明第二方面的弹性体聚合物可通过本发明方法获得:即通过(a)在引发剂化合物的存在下使至少一种共轭二烯与式1化合物聚合,(a’)在可通过使式1化合物与有机碱金属化合物反应获得的引发剂化合物的存在下使至少一种共轭二烯聚合,或(a”)使可通过使至少一种共轭二烯阴离子聚合获得的活性聚合物与式1化合物反应,其中(a)、(a’)和(a”)各自在式2的稳定剂化合物的存在下进行。本发明的聚合物可以是统计、嵌段或锥形共聚物,或α-或α,ω-改性聚合物,其中式1和2化合物通过它们的乙烯基或丁二烯基官能团并入聚合物链中。双引发剂诸如双锂化芳烃的使用会产生双链端改性聚合物。关于将式2的稳定剂化合物并入聚合物中可参见wo2015/055252。获得的聚合物通常是支化弹性体聚合物。
在优选的实施方案中,本发明的聚合物是ssbr(溶液丁苯橡胶),其乙烯基含量优选为15-80%,更优选30-75%,最优选40-70%(取决于具体应用),苯乙烯含量(取决于具体应用)的总量为40-70重量%,或15-40重量%,或1-15重量%;pbr(聚丁二烯橡胶),其乙烯基含量<15%,或15-40%,或40-80%;pir(聚异戊二烯橡胶);ssir(溶液苯乙烯异戊二烯橡胶);或ssibr(溶液苯乙烯异戊二烯丁二烯橡胶);更优选地是ssbr或pbr;甚至更优选地是ssbr,每一个都通过并入式1的多乙烯基氨基硅烷而改性。如果是ssbr,则弹性体聚合物的特征在于玻璃化转变温度(tg,通过dsc测定)为-90至0℃,优选地为-80至-5℃,更优选地为-70至-10℃。卡车轮胎应用中最优选的tg为-70至-40℃,而客车轮胎应用中最优选的tg为-40至-10℃。
非固化聚合物组合物
本发明第三方面的非固化聚合物组合物包括本发明第二方面的弹性体聚合物和一种或多种选自以下的其它组分:(i)添加至用于制备所述聚合物的聚合方法中或作为用于制备所述聚合物的聚合方法的结果形成的组分,(ii)从所述聚合方法除去溶剂后保留的组分,和(iii)在完成聚合物制造过程后添加至所述聚合物的组分。特别地,此类组分(i)至(iii)可以是一种或多种选自油(增量油)、填料、稳定剂和其它聚合物(其不是本发明的聚合物)的组分。特别地,可以在聚合完成后、在除去溶剂之前将增量油添加到聚合物溶液中。在一个实施方案中,聚合物组合物还包括一种或多种硫化剂。
在一个实施方案中,非固化(未交联或未硫化)聚合物组合物是通过对聚合方法中获得的反应混合物进行常规后处理获得的。后处理是指利用汽提或真空蒸发技术除去溶剂。
在另一个实施方案中,本发明的非固化聚合物组合物是由于进一步的机械混合方法获得的,该方法涉及后处理的反应混合物(包括本发明的聚合物),优选以橡胶块的形式(即在密炼机中和/或借助于双辊研磨机的常规混合方法的产物),以及至少一种填料。
通常将下列组分添加到用于轮胎的非固化组合物:增量油、稳定剂、填料、其它聚合物。
(增量剂)油
在一个实施方案中,本发明的聚合物组合物包括本发明的弹性体聚合物与一种或多种油,尤其是矿物油的组合。关于油的代表性实例和分类,参见wo2009/148932和us2005/0159513,其各自通过引用整体并入本文。此类油包括例如通常已知的增量油,诸如芳族、环烷烃和链烷烃增量油,例如mes(温和提取溶剂化物)、tdae(处理过的馏分芳族提取物)、橡胶制液体(rtl)油、生物质制液体(btl)油、油膏、增量树脂或具有500至20000g/mol的中值分子量(经由gpc根据bsiso11344:2004测定)的液体聚合物(诸如液体br)。当使用矿物油作为增量油时,其优选地是选自dae(馏出芳族提取物)、rae(残余芳族提取物)、tdae、mes和环烷油的一种或多种。上述油包含不同浓度的多环芳族化合物、链烷烃、环烷烃和芳族化合物,并且具有不同的玻璃化转变温度。在一些实施方案中,mes、rae和tdae是优选的橡胶增量油。
一种或多种油可以在聚合过程终止之前或之后添加到聚合物中。当增量油添加到聚合物溶液中时,添加的时机应优选地在聚合物改性或聚合终止之后,例如在添加改性剂或聚合终止剂之后。加入增量油后,可通过如下获得油增量的聚合物组合物:利用直接干燥方法或汽提将任何聚合溶剂从聚合物中分离出来,并使用真空干燥器、热风干燥器、滚筒等干燥橡胶。
聚合物组合物可以以0至70phr,优选地0.1至60phr,更优选地0.1至50phr的总量含有一种或多种油。当液体聚合物作为增量油用于本发明的聚合物组合物中时,在计算聚合物基质的组成时不考虑它们。
在另一个实施方案中,在机械混合器中将油与至少一种填料,优选地与至少一种填料和至少一种其它聚合物一起加入到“无溶剂”聚合物中。
填料
任选地包含一种或多种如上所定义的增量油的本发明的聚合物组合物还可以包含一种或多种填料。填料可以在聚合过程终止之前或之后添加到聚合物中。合适的填料的实例包括炭黑(包括导电炭黑)、碳纳米管(cnt)(包括离散的cnt、中空碳纤维(hcf)和带有一种或多种官能团诸如羟基、羧基和羰基基团的改性cnt)、石墨、石墨烯(包括离散的石墨烯薄片)、二氧化硅、碳-二氧化硅双相填料、粘土(层状硅酸盐,包括剥离的纳米粘土和有机粘土)、碳酸钙、碳酸镁、氧化镁、二氧化钛、橡胶凝胶、木质素、纤维素、无定形填料诸如玻璃颗粒基填料、淀粉基填料,以及它们的组合。合适的填料的其它实例描述于wo2009/148932中,该专利通过引用完整并入本文。
可以使用本领域技术人员通常已知的任何类型的炭黑。在一个实施方案中,炭黑具有根据astmd1510的20至250mg/g,优选地30至180mg/g,更优选地40至180mg/g,且甚至更优选地40至130mg/g的碘值,以及根据astmd2414的80至200ml/100g,优选地100至200ml/100g,更优选地115至200ml/100g的dbp值(dbp值通过邻苯二甲酸二丁酯测定炭黑或任何光亮填料的比吸收体积)。
可以使用本领域技术人员通常已知的并适合作为轮胎橡胶共混物的填料的任何类型的二氧化硅。特别优选使用具有35至350m2/g,优选地35至260m2/g,更优选地100至260m2/g且甚至更优选地130至235m2/g的氮表面积(bet表面积;根据diniso9277和din66132),并具有30至400m2/g,优选地30至250m2/g,更优选地100至250m2/g且甚至更优选地125至230m2/g的ctab表面积(根据astmd3765)的高分散沉淀二氧化硅。这种二氧化硅,例如在用于轮胎胎面的橡胶共混物中,得到硫化橡胶的特别有益的物理性质。此外,它可以在共混物的加工中带来优势,即通过减少共混所需的时间,同时保持产品性能,从而提高生产率。可用的二氧化硅包括
稳定剂
一种或多种稳定剂(“抗氧化剂”;不要与式2的稳定剂化合物相混淆)可任选地在聚合过程终止之前或之后添加至聚合物,以防止弹性体聚合物被分子氧降解。通常使用基于位阻酚的抗氧化剂,诸如2,6-二叔丁基-4-甲基苯酚、6,6’-亚甲基双(2-叔丁基-4-甲基苯酚)、3-(3,5-二叔丁基-4-羟基苯基)丙酸异辛基酯、双[3-(3,5-二叔丁基-4-羟基苯基)丙酸]六亚甲基酯、3-(3,5-二叔丁基-4-羟基苯基)丙酸十八烷基酯、3-(3,5-二叔丁基-4-羟基苯基)丙酸异十三烷基酯、1,3,5-三甲基-2,4,6-三(3,5-二叔丁基-4-羟基苄基)苯、2,2’-亚乙基双-(4,6-二叔丁基苯酚)、四[3-(3,5-二叔丁基-4-羟基苯基)丙酸亚甲基酯]甲烷、丙烯酸2-[1-(2-羟基-3,5-二叔戊基苯基)乙基]-4,6-二叔戊基苯基酯和丙烯酸2-叔丁基-6-(3-叔丁基-2-羟基-5-甲基苄基)-4-甲基苯基酯,以及基于硫酯的抗氧化剂,诸如4,6-双(辛基硫代甲基)-邻甲酚和四(3-月桂基硫代丙酸)季戊四醇酯。合适稳定剂的其它实例可以在f.
其它聚合物
除了本发明的聚合物、增量油、填料等之外,本发明的聚合物组合物还可以含有其它聚合物,特别是其它弹性体聚合物。在后处理聚合物共混物之前,可以将其它聚合物作为溶液加入到本发明聚合物的溶液中,或者可以在机械混合过程中加入,例如在brabender混合器中加入。
本文提及的其它(弹性体)聚合物是不与本发明的聚合物一致(即不含有衍生自式1和2化合物两者的重复单元)的弹性体聚合物。
硫化剂和硫化促进剂
本发明的聚合物组合物还可任选地包含至少一种硫化剂。通常用于制造橡胶产品的任何硫化剂均可用于本发明,并且可使用两种或更多种硫化剂的组合。
硫、用作硫供体的含硫化合物诸如二硫醇、硫促进剂体系和过氧化物是最常见的硫化剂。用作硫供体的含硫化合物的实例包括二硫基二吗啉(dtdm)、二硫化四甲基秋兰姆(tmtd)、二硫化四乙基秋兰姆(tetd)和四硫化双五亚甲基秋兰姆(dptt)。硫促进剂的实例包括胺衍生物、胍衍生物、醛胺缩合产物、噻唑、黄原酸盐、硫化秋兰姆、二硫代氨基甲酸盐和硫代磷酸盐。优选地使用一种或多种选自以下的磺酰胺促进剂:n-环己基-2-苯并噻唑次磺酰胺(cbs)、n,n-二环己基苯并噻唑2-次磺酰胺(dcbs)、苯并噻唑基2-次磺酰吗啉(mbs)和n-叔丁基2-苯并噻唑基次磺酰胺(tbbs)。诸如可按商品名
次磺酰胺型、胍型或秋兰姆型硫化促进剂可视需要与硫化剂一起使用。
此外,本发明的聚合物组合物可以按常规使用的比例含有常规添加剂和硫化助剂。此类添加剂包括:
a)老化抑制剂,诸如n-苯基-n’-(1,3-二甲基丁基)-对苯二胺(6ppd)、n,n’-二苯基-对苯二胺(dppd)、n,n’-二甲苯基-对苯二胺(dtpd)、n-异丙基-n’-苯基-对苯二胺(ippd)、2,2,4-三甲基1,2-二氢喹啉(tmq),
b)活化剂,诸如氧化锌和脂肪酸(例如硬脂酸),
c)蜡,
d)树脂,特别是粘合树脂,
e)塑炼添加剂,诸如2,2’-二苯甲酰氨基二苯基二硫化物(dbd)和
f)加工添加剂,诸如锌皂和脂肪酸酯及其衍生物。氧化锌(锌白)优选地用作硫促进剂体系的组分。
硫化剂通常以每100重量份总聚合物0.5至10重量份,或在一些实施方案中,1至6重量份的量加入聚合物组合物中。硫化促进剂的实例及其相对于总聚合物的添加量在wo2009/148932中给出,该专利通过引用整体并入本文。
硫化聚合物组合物及其制备方法
本发明第八方面的硫化聚合物组合物是通过在本领域通常已知的条件下和用本领域通常已知的机械来硫化包含一种或多种硫化剂的本发明第七方面的聚合物组合物而获得的。所述硫化方法构成本发明第九方面。
包含硫化聚合物组合物的制品
由于本发明的硫化聚合物组合物表现出低滚动阻力、低动态热积聚和增加的湿路抓地力,因此它们非常适合用于制造例如轮胎或轮胎部件,包括例如:轮胎胎面、侧壁和轮胎胎体,以及其它工业产品,诸如皮带、软管、减震器和鞋类部件。因此,本发明第十方面的制品包含至少一种由本发明的硫化聚合物组合物形成的组分。该制品可以是例如轮胎、轮胎胎面、轮胎侧壁、轮胎胎体、皮带、垫圈、密封件、软管、减震器、高尔夫球或鞋类部件,诸如鞋底。
定义
如本文所定义的烷基,无论是本身还是与其它基团诸如烷基芳基或烷氧基结合,都包括直链烷基,诸如甲基(me)、乙基(et)、正丙基(pr)、正丁基(bu)、正戊基、正己基、辛基(oct)等;支链烷基,诸如异丙基、叔丁基等;和环状烷基,诸如环己基。
如本文所定义的芳基包括苯基、联苯基和其它苯环型化合物。芳基优选地仅含有一个芳环,最优选地含有c6芳环。
如本文所定义的烷基芳基是指与一个或多个烷基结合的一个或多个芳基的组合,例如呈烷基-芳基、芳基-烷基、烷基-芳基-烷基和芳基-烷基-芳基的形式。烷基芳基优选地仅含有一个芳环,最优选地含有c6芳环。
将通过实施例更详细地解释本发明,这些实施例并不旨在限制本发明。
实施例
实验部分中使用的缩写:
dcm:二氯甲烷,ea:乙酸乙酯,
mtbe:叔丁基甲基醚,rt:室温(大约25℃)
tbs:叔丁基二甲基甲硅烷基,tea:三乙胺,
tes:三乙基甲硅烷基,tme:三甲胺,
thf:四氢呋喃,
1)支化剂和稳定剂的制备和表征
a)支化剂
n1-<2-{双[二甲基(乙烯基)甲硅烷基]氨基}乙基>-n1,n2,n2-三[二甲基(乙烯基)甲硅烷基]-乙烷-1,2-二胺(m1)
滤并除去所有挥发性物质,得到标题化合物m1(12.0g,23.0mmol,79%,纯度:91%),为黄色油状物。
c24h53n3si5,mw=524.13gmol–1
1hnmr(400mhz,20℃,c6d6):δ=6.29(dd,j=20.3hz,j=14.6hz,5h),5.94(dd,j=14.6hz,j=3.8hz,5h),5.74(dd,j=20.3hz,j=3.8hz,2h),2.99–2.95(m,4h),2.86–2.84(m,4h),0.29(s,24h),0.24(s,6h)ppm。13cnmr(100mhz,20℃,c6d6):δ=141.26(4ch),140.28(ch),132.23(4ch2),131.73(ch2),53.43(2ch2),47.25(2ch2),1.09(8ch3),–0.64(2ch3)ppm。gc-ms(ei,70ev):m/z(%)=524(m+,0.1),325(100),283(12),212(100),198(89),172(5),128(24),85(82)。
n1,n6-(乙烷-1,2-二基)双{n1,n2,n2-三[二甲基(乙烯基)甲硅烷基]乙烷-1,2-二胺}(m2)
当量)。将反应混合物在25℃下搅拌7天。过滤并除去所有挥发性物质,得到标题化合物m2(6.15g,9.44mmol,69%,纯度:80%主要异构体),为黄色油状物。
c30h66n4si6,mw=651.40gmol–1
1hnmr(400mhz,20℃,c6d6):δ=6.30(dd,j=20.3hz,j=14.6hz,4h),6.25(dd,j=20.0hz,j=14.8hz,2h),5.97(dd,j=14.7hz,j=3.9hz,2h),5.96(dd,j=14.6hz,j=3.8hz,4h),5.76(dd,j=20.2hz,j=3.9hz,2h),5.75(dd,j=20.3hz,j=3.8hz,4h),3.00–2.82(m,12h),0.30(s,24h),0.26(s,12h)ppm。13cnmr(100mhz,20℃,c6d6):δ=141.14(4ch),140.15(2ch),132.18(2ch2),131.81(4ch2),52.74(2ch2),50.06(2ch2),46.52(2ch2),0.96(8ch3),–0.91(4ch3)ppm。gc-ms(ei,70ev):主要异构体m/z(%)=452(m+–199,32),369(3),325(100),256(19),212(100),198(73),142(32),85(27);次要异构体m/z(%)=452(m+–199,100),212(2)。比率4.8:1(gc)。
1,4-双[二甲基(乙烯基)甲硅烷基]哌嗪(m3)
2.3当量),然后在25℃下滴加氯二甲基乙烯基硅烷(25.8g,214mmol,2.3当量)。将反应混合物在25℃下搅拌7天。过滤并除去溶剂,得到残余物,将其通过真空蒸馏纯化。得到标题化合物m3(17.4g,68.4mmol,74%),为无色油状物。
c12h26n2si2,mw=254.52gmol–1
bp=92–93℃(5毫巴)。1hnmr(400mhz,20℃,c6d6):δ=6.14(dd,j=20.2hz,j=14.7hz,2h),5.94(dd,j=14.7hz,j=4.1hz,2h),5.73(dd,j=20.2hz,j=4.1hz,2h),2.97(s,8h),0.12(s,12h)ppm。13cnmr(100mhz,20℃,c6d6):δ=139.34(2ch),132.15(2ch2),47.36(4ch2),–2.43(4ch3)ppm。gc-ms(ei,70ev):m/z(%)=254(m+,100),239(m+–ch3,9),210(2),170(9),140(20),85(44)。
b)单乙烯基硅烷和稳定剂
二甲基(三乙基甲硅烷氧基)(乙烯基)硅烷(s1)*
当量)和三乙胺(1.51g,14.9mmol,1.2当量)在环己烷(15ml)中的溶液中。将混合物在室温下搅拌16小时。过滤后,在减压下除去溶剂,在30毫巴下蒸馏,得到乙烯基硅烷s1(1.32g,6.1mmol,48%),为无色液体。
c10h24osi2,mw=216.47gmol–1
bp=95–97℃(30毫巴)。1hnmr(400mhz,20℃,c6d6):δ=6.20(dd,j=20.3hz,j=14.9hz,1h),5.90(dd,j=14.8hz,j=3.9hz,1h),5.76(dd,j=20.3hz,j=4.0hz,1h),0.99(t,j=7.9hz,9h),0.55(q,j=7.8hz,6h),0.20(s,6h)ppm。13cnmr(101mhz,20℃,c6d6):δ=139.85(ch,乙烯基),131.72(ch2,乙烯基),7.06(3ch3),6.67(3ch2),0.60(2ch3)ppm。gc-ms(ei,70ev):m/z(%)=216(m+,1),187(m+–c2h5,100),159(m+–c2h3–2ch3,69),131(m+–c4h9si,85),59(36)。
二甲基(叔丁基二甲基甲硅烷氧基)(乙烯基)硅烷(s2)*
1.0当量)和三乙胺(10.3g,102mmol,1.1当量)在环己烷(100ml)中的溶液中。将混合物在室温下搅拌18小时。过滤后,在减压下除去溶剂,在15毫巴下蒸馏,得到乙烯基硅烷s2(14.6g,67.4mmol,73%),为无色液体。
c10h24osi2,mw=216.47gmol–1
bp=49–51℃(15毫巴)。1hnmr(400mhz,20℃,c6d6):δ=6.17(dd,j=20.3hz,j=14.8hz,1h),5.89(dd,j=14.9hz,j=4.0hz,1h),5.75(dd,j=20.3hz,j=4.0hz,1h),0.94(s,9h),0.17(s,6h),0.06(s,6h)ppm。13cnmr(101mhz,20℃,c6d6):δ=139.75(ch,乙烯基),131.79(ch2,乙烯基),25.89(3ch3),18.28(c),0.55(2ch3),–2.71(2ch3)ppm。gc-ms(ei,70ev):m/z(%)=216(m+,0.1),201(m+–ch3,3),159(m+–叔丁基,100),131(11),145(100),73(12)。
1-[二甲基(乙烯基)甲硅烷基]-4-甲基哌嗪(s3)
ml)中的溶液中。将混合物在室温下搅拌18小时。过滤后,在减压下除去溶剂,在40毫巴下蒸馏,得到s3(14.1g,76.5mmol,76%),为无色油状物。
c9h20n2si,mw=184.36gmol–1
bp=55–57℃(0.2毫巴)。1hnmr(400mhz,20℃,c6d6):δ=6.12(dd,j=20.2hz,j=14.7hz,1h),5.93(dd,j=14.7hz,j=4.1hz,1h),5.71(dd,j=20.2hz,j=4.1hz,1h),2.88(t,j=4.8hz,4h),2.14–2.11(m,4h),2.11(s,3h),0.10(s,6h)ppm。13cnmr(101mhz,20℃,c6d6):δ=139.28(ch,乙烯基),132.20(ch2,乙烯基),57.22(2ch2),47.00(ch3),45.67(2ch2),–2.32(2ch3)ppm。gc-ms(ei,70ev):m/z(%)=184(m+,100),169(m+–ch3,24),155(5),140(22),114(28),85(c4h9si+,42)。
4-[(二甲基(乙烯基)甲硅烷基]吗啉(s4)
中的溶液中。将混合物在室温下搅拌18小时。过滤后,在减压下除去溶剂,在40毫巴下蒸馏,得到s4(14.6g,85.0mmol,73%),为无色油状物。
c8h17nosi,mw=171.31gmol–1
bp=85℃(37毫巴)。1hnmr(400mhz,20℃,c6d6):δ=6.05(dd,j=20.0hz,j=14.7hz,1h),5.91(dd,j=14.7hz,j=4.2hz,1h),5.67(dd,j=20.0hz,j=4.2hz,1h),3.44–3.41(m,4h),2.68–2.66(m,4h),0.04(s,6h)ppm。13cnmr(101mhz,20℃,c6d6):δ=138.71(ch,乙烯基),132.49(ch2,乙烯基),68.61(2ch2),45.92(2ch2),–2.77(2ch3)ppm。gc-ms(ei,70ev):m/z(%)=171(m+,70),156(m+–ch3,32),130(19),113(30),85(c4h9si+,100),59(65)。
(叔丁基二甲基甲硅烷氧基)甲基-4-吗啉代(乙烯基)硅烷(s5)
基甲基硅烷(15.0g,106mmol,1.0当量)和三乙胺(21.5g,213mmol,2.0当量)在ea(200ml)中的溶液中。将混合物在室温下搅拌14小时,然后加入吗啉(9.45g,108mmol,1.0当量),并将混合物再搅拌6小时。过滤后,在减压下除去溶剂,在3毫巴下蒸馏,得到s5(22.7g,78.9mmol,74%),为无色液体。
c13h29no2si2,mw=287.55gmol–1
bp=95–97℃(1毫巴)。1hnmr(400mhz,20℃,c6d6):δ=6.02(dd,j=19.3hz,j=14.7hz,1h),5.94(dd,j=14.8hz,j=5.4hz,1h),5.83(dd,j=19.0hz,j=5.4hz,1h),3.47(t,j=4.6hz,4h),2.85–2.75(m,4h),0.95(s,9h),0.11(s,3h),0.07(s,6h)ppm。13cnmr(101mhz,20℃,c6d6):δ=137.06(ch,乙烯基),133.73(ch2,乙烯基),68.56(2ch2),45.55(2ch2),25.92(3ch3),18.38(c),–2.46(ch3),–2.75(2ch3)ppm。gc-ms(ei,70ev):m/z(%)=287(m+,6),272(m+–ch3,9),230(m+–c4h9,100),202(4),174(6),145(39),117(16),70(22)。ir(atr):λ–1=2953(m),2855(w),1473(w),1373(w),1256(m),1115(m),1047(m),963(m),834(m),775(s),742(m),684(m)cm–1。
(叔丁基二甲基甲硅烷氧基)(二丁基氨基)甲基(乙烯基)硅烷(s6)
在ea/环己烷(150ml)中的溶液中。将混合物在室温下搅拌2.5小时。然后加入二丁胺(9.33g,72.3mmol,1.02当量),并将混合物再搅拌20小时。过滤后,在减压下除去溶剂,在4毫巴下蒸馏,得到改性剂s6(18.1g,54.9mmol,77%),为无色液体。
c17h39nosi2,mw=329.67gmol–1
bp=133–135℃(4毫巴)。1hnmr(400mhz,20℃,c6d6):δ=6.17(dd,j=20.1hz,j=14.8hz,1h),5.96(dd,j=14.8hz,j=4.3hz,1h),5.86(dd,j=20.0hz,j=4.3hz,1h),2.84(dd,j=8.4hz,j=6.9hz,4h),1.46(pent,j=7.5hz,4h),1.25(sext,j=7.4hz,4h),0.99(s,9h),0.91(t,j=7.4hz,6h),0.25(s,3h),0.13(s,6h)ppm。13cnmr(101mhz,20℃,c6d6):δ=138.60(ch,乙烯基),132.66(ch2,乙烯基),46.12(2ch2),32.86(2ch2),26.02(3ch3),20.73(2ch2),18.50(c),14.38(2ch3),–1.40(ch3),–2.64(ch3),–2.65(ch3)ppm。gc-ms(ei,70ev):m/z(%)=329(m+,4),315(m+,12),286(100),244(7),215(2),186(12),133(75),103(7),73(18)。ir(atr):λ–1=3053(w),2956(m),2929(m),2858(w),1463(w),1252(m),1163(w),1033(s),834(s),770(s)cm–1。
1-[(叔丁基二甲基甲硅烷氧基)甲基(乙烯基)甲硅烷基]-4-甲基哌嗪(s7)
(7.15g,70.8mmol,2.0当量)在乙酸乙酯(70ml)中的溶液中。将混合物在室温下搅拌2.5小时。然后加入n-甲基哌嗪(3.72g,37.2mmol,1.05当量),将混合物再搅拌20小时。过滤后,在减压下除去溶剂,在6毫巴下蒸馏,得到改性剂s7(8.57g,28.5mmol,81%),为无色液体。
c14h32n2osi2,mw=300.59gmol–1
bp=113–115℃(6毫巴)。1hnmr(400mhz,20℃,c6d6):δ=6.09(dd,j=19.7hz,j=14.8hz,1h),5.95(dd,j=14.8hz,j=4.7hz,1h),5.88(dd,j=19.7hz,j=4.6hz,1h),3.03–2.95(m,4h),2.20–2.11(m,4h),2.12(s,3h),0.96(s,9h),0.17(s,3h),0.10(s,6h)ppm。13cnmr(101mhz,20℃,c6d6):δ=137.53(ch,乙烯基),133.44(ch2,乙烯基),57.11(2ch2),46.98(ch3),45.26(2ch2),25.98(3ch3),18.42(c),–2.15(ch3),–2.68(2ch3)ppm。gc-ms(ei,70ev):m/z(%)=300(m+,100),243(m+–c4h9,65),188(13),133(35),99(8),70(23)。ir(atr):λ–1=2955(m),2928(m),2856(w),2785(w),1472(w),1289(m),1254(m),1151(m),1050(m),1004(m),964(m),834(m),774(s),742(m),685(m)cm–1。
(叔丁基二甲基甲硅烷氧基)(二乙基氨基)甲基(乙烯基)硅烷(s8)
248mmol,2.0当量)在乙酸乙酯(250ml)中的溶液中。将混合物在室温下搅拌3小时。然后加入二乙胺(10.6g,145mmol,1.02当量),并将混合物再搅拌4小时。过滤后,在减压下除去溶剂,在4毫巴下蒸馏,得到改性剂s8(27.1g,99.1mmol,70%),为无色液体。
c13h31nosi2,mw=273.56gmol–1
bp=78–80℃(4毫巴)。1hnmr(400mhz,20℃,c6d6):δ=6.15(dd,j=20.0hz,j=14.8hz,1h),5.95(dd,j=14.8hz,j=4.4hz,1h),5.86(dd,j=20.0hz,j=4.3hz,1h),2.84(q,j=7.0hz,4h),0.99(t,j=7.0hz,6h),0.98(s,9h),0.21(s,3h),0.11(s,6h)ppm。13cnmr(101mhz,20℃,c6d6):δ=138.47(ch,乙烯基),132.72(ch2,乙烯基),39.80(2ch2),25.99(3ch3),18.45(c),16.04(2ch3),–1.54(ch3),–2.70(2ch3)ppm。gc-ms(ei,70ev):m/z(%)=273(m+,8),258(m+–ch3,100),216(48),186(5),158(59),145(71),119(29),73(28)。
(叔丁基二甲基甲硅烷氧基)(二甲基氨基)甲基(乙烯基)硅烷(s9)
酯(60ml)中的溶液中。将混合物在该温度下搅拌3小时,然后在0℃下加入二甲胺(1.76g,38.9mmol,1.1当量),并将混合物再搅拌18小时。过滤后,在减压下除去溶剂,在24毫巴下蒸馏,得到改性剂s9(6.06g,24.7mmol,70%),为无色液体。
c11h27nosi2,mw=245.51gmol–1
bp=89–90℃(24毫巴)。1hnmr(400mhz,20℃,c6d6):δ=6.11(dd,j=19.8hz,j=14.8hz,1h),5.96(dd,j=14.8hz,j=4.5hz,1h),5.87(dd,j=19.8hz,j=4.5hz,1h),2.47(s6h),0.97(s,9h),0.19(s,3h),0.09(s,6h)ppm。13cnmr(101mhz,20℃,c6d6):δ=137.56(ch,乙烯基),133.27(ch2,乙烯基),37.56(2ch3),25.92(3ch3),18.42(c),–2.15(ch3),–2.84(2ch3)ppm。gc-ms(ei,70ev):m/z(%)=245(m+,6),230(m+–ch3,10),188(99),145(100),105(7),73(20)。ir(atr):λ–1=2955(m),2929(w),2888(w),2857(m),2795(w),1473(w),1254(m),1176(m),1046(m),890(s),834(m),780(s),743(s),687(m)cm–1。
(叔丁基二甲基甲硅烷氧基)(二辛基氨基)甲基(乙烯基)硅烷(s10)
mmol,2.2当量)在ea(10+20ml)中的溶液中。将混合物在室温下搅拌3小时。然后加入二辛胺(2.56g,10.6mmol,1.00当量),并将混合物再搅拌3天。由于转化率降低,加入三乙胺(1.07g,9.0mmol,0.85当量),并将混合物在室温下再搅拌1天。过滤后,在减压下除去溶剂,在0.4毫巴下蒸馏,得到改性剂s10(2.15g,4.87mmol,46%),为无色液体。
c25h55nosi2,mw=441.89gmol–1
bp=185–187℃(0.44毫巴)。1hnmr(400mhz,20℃,c6d6):δ=6.23(dd,j=20.0hz,j=14.8hz,1h),5.99(dd,j=14.8hz,j=4.4hz,1h),5.91(dd,j=20.0hz,j=4.4hz,1h),2.92(dd,j=8.0hz,j=6.8hz,1h),1.56(pent,j=7.6hz,4h),1.33–1.26(m,20h),1.01(s,9h),0.91(t,j=6.8hz,6h),0.30(s,3h),0.16(s,6h)ppm。13cnmr(101mhz,20℃,c6d6):δ=138.65(ch,乙烯基),132.66(ch2,乙烯基),46.54(2ch2),32.54(2ch2),30.77(2ch2),30.17(2ch2),29.90(2ch2),27.71(2ch2),26.08(3ch3),23.15(2ch2),18.54(c),14.40(2ch3),–1.34(ch3),–2.59(ch3),–2.60(ch3)ppm。gc-ms(ei,70ev):m/z(%)=441(m+,3),426(m+–ch3,8),414(4),384(9),343(100),286(5),244(8),186(18),160(46),133(48),119(16)。ir(atr):λ–1=2954(w),2926(m),2854(m),1463(w),1253(m),1046(m),834(m),775(s),685(w)cm–1。
叔丁基二甲基甲硅烷氧基)(二己基氨基)甲基(乙烯基)硅烷(s11)
mmol,1.00当量)和三甲胺(2.34g,39.6mmol,2.20当量)在环己烷(35ml)中的溶液中。将混合物在室温下搅拌18小时。然后加入二己胺(3.34g,18.0mmol,1.00当量),并将混合物再搅拌3天。过滤后,在减压下除去溶剂,在4毫巴下蒸馏,得到改性剂s11(6.11g,15.8mmol,88%),为无色液体。
c21h47nosi2,mw=385.78gmol–1
bp=155–158℃(4毫巴)。1hnmr(400mhz,20℃,c6d6):δ=6.22(dd,j=20.4hz,j=14.8hz,1h),5.98(dd,j=14.8hz,j=4.4hz,1h),5.90(dd,j=20.0hz,j=4.4hz,1h),2.94–2.87(m,4h),1.53(pent,j=7.4hz,4h),1.33–1.12(m,12h),1.00(s,9h),0.90(t,j=6.8hz,6h),0.29(s,3h),0.15(s,6h)ppm。13cnmr(101mhz,20℃,c6d6):δ=138.64(ch,乙烯基),132.68(ch2,乙烯基),46.50(2ch2),32.32(2ch2),30.70(2ch2),27.34(2ch2),26.02(3ch3),23.16(2ch2),18.50(c),14.32(2ch3),–1.37(ch3),–2.62(2ch3)ppm。gc-ms(ei,70ev):m/z(%)=385(m+,5),370(m+–ch3,16),315(100),274(1),244(15),215(1),202(8),186(c12h28n+,24),159(74),133(87),119(32),94(19)。ir(atr):λ–1=2956(m),2927(m),2856(m),1462(w),1253(m),1045(s),1003(m),834(s),770(s),745(m),687(m)cm–1。
1-[(叔丁基二甲基甲硅烷氧基)甲基(乙烯基)甲硅烷基]-4-乙基哌嗪(s12)
在dcm(160ml)中的溶液中。将混合物在室温下搅拌3小时。然后加入n-乙基哌嗪(8.10g,70.9mmol,1.00当量),并将混合物再搅拌18小时。过滤后,在减压下除去溶剂,在4毫巴下蒸馏,得到改性剂s12(19.4g,61.7mmol,87%),为无色液体。
c15h34n2osi2,mw=314.62gmol–1
bp=125–130℃(4毫巴)。1hnmr(400mhz,20℃,c6d6):δ=6.11(dd,j=19.6hz,j=14.8hz,1h),5.97(dd,j=14.8hz,j=4.8hz,1h),5.90(dd,j=19.6hz,j=4.8hz,1h),3.06–2.97(m,4h),2.25(q,j=7.2hz,2h),2.27–2.18(m,4h),0.99(t,j=7.2hz,2h),0.98(s,9h),0.19(s,3h),0.11(s,6h)ppm。13cnmr(101mhz,20℃,c6d6):δ=137.56(ch,乙烯基),133.45(ch2,乙烯基),55.09(2ch2),53.24(ch2),45.40(2ch2),25.98(3ch3),18.44(c),12.34(ch3),–2.15(ch3),–2.67(2ch3)ppm。gc-ms(ei,70ev):m/z(%)=314(m+,100),299(m+–ch3,53),257(37),230(34),201(20),159(36),133(50),72(37)。ir(atr):λ–1=2955(m),2901(w),2804(w),1472(w),1377(w),1253(m),1152(m),1048(m),976(s),834(m),776(s),742(m),684(m),651(w)cm–1。
4-苄基-1-[(叔丁基二甲基甲硅烷氧基)甲基(乙烯基)甲硅烷基]哌嗪(s13)
量)在dcm(120ml)中的溶液中。将混合物在室温下搅拌3小时。然后加入n-苄基哌嗪(8.31g,47.1mmol,1.00当量),并将混合物再搅拌18小时。过滤后,在减压下除去溶剂,在0.5毫巴下蒸馏,得到改性剂s13(12.3g,32.7mmol,69%),为无色液体。
c20h36n2osi2,mw=376.69gmol–1
bp=155–158℃(0.5毫巴)。1hnmr(400mhz,20℃,c6d6):δ=7.35(d,j=6.8hz,2h),7.21–7.18(m,2h),7.13–7.09(m,1h),6.08(dd,j=20.0hz,j=14.8hz,1h),5.95(dd,j=14.8hz,j=4.8hz,1h),5.87(dd,j=19.6hz,j=4.8hz,1h),3.34(s,2h),2.98–2.93(m,4h),2.20–2.24(m,4h),0.97(s,9h),0.16(s,3h),0.10(s,6h)ppm。13cnmr(101mhz,20℃,c6d6):δ=139.24(c),137.50(ch,乙烯基),133.44(ch2,乙烯基),129.36(2ch),128.48(2ch),127.21(ch),64.11(ch2,苄基),55.37(2ch2),45.31(2ch2),25.98(3ch3),18.43(c),–2.19(ch3),–2.69(2ch3)ppm。gc-ms(ei,70ev):m/z(%)=376(m+,92),361(m+–ch3,16),335(29),285(36),230(55),188(21),159(43),133(55),91(c7h7+,100)。ir(atr):λ–1=2954(m),2928(m),2798(w),1471(w),1378(w),1253(m),1132(m),1049(m),1001(m),966(m),834(m),775(s),736(s),696(m)cm–1。
(叔丁基二甲基甲硅烷氧基)(二苄基氨基)甲基(乙烯基)硅烷(s14)
1.00当量)和三乙胺(15.8g,156mmol,2.20当量)在环己烷(180ml)中的溶液中。将混合物在室温下搅拌3小时。然后加入二苄胺(14.0g,70.9mmol,1.00当量),并将混合物搅拌2天。gc分析显示仅有11%转化为所需化合物,因此进行溶剂变化。过滤后,在减压下除去溶剂,并加入dcm(150ml)。另外,加入tma溶液(10%在thf中)(33g,71mmol,1.0当量),并将反应混合物在室温下搅拌3天。过滤后,在减压下除去所有挥发性物质。在0.5毫巴下蒸馏,得到改性剂s14(20.0g,50.3mmol,71%),为无色液体。
c23h35nosi2,mw=397.71gmol–1
bp=167–170℃(0.5毫巴)。1hnmr(400mhz,20℃,c6d6):δ=7.26–7.09(m,10h),6.21(dd,j=20.4hz,j=15.2hz,1h),5.94(dd,j=15.0hz,j=4.0hz,1h),5.89(dd,j=20.4hz,j=4.0hz,1h),3.96(ab-系统的a部分,j=15.6hz,2h),3.92(ab-系统的b部分,j=15.7hz,2h),0.98(s,9h),0.32(s,3h),0.11(s,6h)ppm。13cnmr(101mhz,20℃,c6d6):δ=140.76(2c),137.68(ch,乙烯基),133.63(ch2,乙烯基),128.53(4ch),128.39(4ch),126.97(2ch),49.08(2ch2),26.02(3ch3),18.51(c),–1.56(ch3),–2.66(ch3),–2.67(ch3)ppm。gc-ms(ei,70ev):m/z(%)=397(m+,5),382(m+–ch3,4),340(m+–c4h9,100),221(11),181(3),145(24),91(c7h7+,60)。ir(atr):λ–1=3030(w),2954(m),2927(w),2855(w),1494(w),1453(w),1365(w),1255(m),1058(s),956(m),834(m),776(s),696(s),649(m)cm–1。
叔丁基二甲基甲硅烷氧基)(二烯丙基氨基)甲基(乙烯基)硅烷(s15)
量)在二氯甲烷(120ml)中的溶液中。将混合物在室温下搅拌3小时。然后加入二烯丙胺(6.89g,70.9mmol,1.00当量),并将混合物再搅拌18小时。过滤后,在减压下除去溶剂,在4毫巴下蒸馏,得到改性剂s15(17.7g,59.5mmol,84%),为无色液体。
c15h31nosi2,mw=297.59gmol–1
bp=96–98℃(4毫巴)。1hnmr(400mhz,20℃,c6d6):δ=6.11(dd,j=20.0hz,j=14.8hz,1h),5.93(dd,j=14.8hz,j=4.4hz,1h),5.85(dd,j=20.0hz,j=4.4hz,1h),5.73(ddt,j=17.2hz,j=10.0hz,j=5.6hz,2h),5.11(dq,j=17.2hz,j=1.7hz,2h),5.05(ddt,j=10.0hz,j=2.0hz,j=1.2hz,2h),3.45–3.43(m,4h),0.96(s,9h),0.21(s,3h),0.10(s,6h)ppm。13cnmr(101mhz,20℃,c6d6):δ=138.00(ch,乙烯基),137.81(2ch,烯丙基),133.24(ch2,乙烯基),115.46(2ch2,烯丙基),48.45(2ch2),25.96(3ch3),18.43(c),–1.73(ch3),–2.71(ch3),–2.72(ch3)ppm。gc-ms(ei,70ev):m/z(%)=297(m+,13),282(m+–ch3,37),270(49),240(100),198(32),159(47),145(64),133(65),119(40),103(15),73(39)。ir(atr):λ–1=2954(w),2855(w),1406(w),1254(m),1046(m),1004(m),914(m),834(m),776(s)cm–1。
4-乙基-1-(二甲基(2-亚甲基丁-3-烯-1-基)甲硅烷基)哌嗪(s16)
备氯丁二烯。
根据来自sakurai[sakurai等人.tetrahedron1983,39,883-894.]的修改程序制备以下氨基硅烷官能化二烯:
步骤1:在惰性条件下,将新研磨的mg切屑(1.15g,47.5mmol,1.10当量)和催化量的二溴乙烷和zncl2(在thf中的溶液)连同50mlthf一起加入到圆底烧瓶中。将温度设定为55℃,并将1-((氯甲基)-二甲基甲硅烷基)-4-乙基哌嗪(10.00g,45.3mmol,1.05当量)逐滴添加至反应混合物。然后将反应混合物在回流下搅拌15分钟,然后在50℃下搅拌3小时。此后,将反应混合物在惰性气体条件下过滤,并在步骤2中用作溶液。
步骤2:在惰性气体条件下,将新蒸馏的氯丁二烯(3.82g,43.1mmol,1.00当量)溶于50mlthf中,并在室温下添加1,3-双(二苯基膦基)丙烷镍(ii)氯化物(1.2g,2.2mmol,0.05当量)。在室温下搅拌1小时。然后逐滴加入步骤1中制备的溶液,并将反应物在室温下搅拌过夜。除去溶剂,然后将残余物溶于环己烷中,并滤出盐。再次除去剩余溶液的溶剂。通过真空蒸馏分离s16(4.42g,43%),为无色油状物。
c13h26n2si,mw=238.45gmol–1
bp=69℃(0.001毫巴)。1hnmr(400mhz,20℃,c6d6):δ=6.39(dd,j=17.3hz,j=10.8hz,1h),5.15(d,j=17.3hz,1h),5.00(d,j=10.8hz,j=4.8hz,1h),4.96–4.93(m,1h),4.89-4.86(m,1h),2.86(t,j=4.9hz,4h),2.25(q,j=7.3hz,2h),2.24–2.13(m,4h),1.73(s,2h),1.01(t,j=7.3hz,3h),0.08(s,6h)ppm。13cnmr(101mhz,20℃,c6d6):δ=144.44(c,丁二烯基),140.49(ch,丁二烯基),114.90(ch2,丁二烯基),113.68(ch2,丁二烯基),55.20(2ch2),53.26(ch2),45.86(2ch2),21.47(ch2),12.34(ch3),–2.17(2ch3),–2.67(2ch3)ppm。gc-ms(ei,70ev):m/z(%)=238(m+,100),171(63),142(28),114(33)。84(51),59(43)。ir(atr):λ–1=3084(m),2953(w),2815(w),1587(s),1447(w),1377(m),1307(m),1247(s),1151(m),1102(m),1032(m),990974(m),899(m),874(m),830(s),656(s)cm–1。
*)化合物s1和s2不在式2的范围内,并且已发现不能有效改善储存稳定性。
2)聚合程序
一般聚合程序:实施例ex1-ex4,
将环己烷(表1-5中给出的量)、丁二烯(表1-6中给出的量的98.3%)和苯乙烯(表中给出的量)加入到无空气的10升(或5升)反应器中,并将搅拌的混合物加热至40℃。然后加入tmeda(量在表中给出)和支化剂(ba)(量和改性剂在表1-5中给出),并滴加正丁基锂以使杂质反应,直到反应混合物的颜色变为淡黄色(滴定)。之后,立即加入对应于聚合物目标分子量的配方量的在环己烷中的引发剂以开始聚合。引发剂加料的开始时间用作聚合的开始时间。同时,从引发剂的加料开始,通过在反应器壁中加热或冷却,将温度增加到最终聚合温度60℃,持续80分钟。然后加入丁二烯(表中给出的量的1.7%)。5分钟后,加入链端改性剂3-甲氧基-3,8,8,9,9-五甲基-2-氧杂-7-硫杂-3,8-二硅杂癸烷(2f)(表1中给出的量)。20分钟后,通过加入甲醇终止反应。用irganox1520d稳定聚合物溶液,通过汽提回收聚合物并干燥,直至获得<0.6%的残余挥发物含量。表1给出了样品的完整数据集。
聚合程序:实施例a-e
将环己烷(表2中给出的量)、丁二烯(a-d,表1中给出的量的100%;e,总量的98%)加入到无空气10升反应器中,并将搅拌的混合物加热至40℃。然后加入tmeda(表2中给出的量)和支化剂m(表2中给出的量)和任选的稳定剂s(表2中给出的量),并逐滴加入正丁基锂以使杂质反应,直至反应混合物的颜色变为淡黄色(滴定)。之后,立即加入对应于聚合物目标分子量的配方量的在环己烷中的nb以开始聚合。引发剂加料的开始时间用作聚合的开始时间。同时,从引发剂的加料开始,通过在反应器壁中加热或冷却,将温度增加到最终聚合温度60℃,持续30分钟。将反应混合物在60℃下进一步搅拌约60分钟。对于e,加入丁二烯(表2中给出的量的2%)并将混合物再搅拌5分钟。然后加入端改性剂并将混合物再搅拌20分钟。然后通过加入甲醇终止反应。用irganox1520d稳定聚合物溶液。表2给出了样品的完整数据集。
聚合程序:实施例f-i
将环己烷(表3中给出的量)、丁二烯(总量的98%)加入到无空气10升反应器中,并将搅拌的混合物加热至40℃。然后加入tmeda(表3中给出的量)和支化剂m(表3中给出的量)和任选的稳定剂s(表3中给出的量),并逐滴加入正丁基锂以使杂质反应,直至反应混合物的颜色变为淡黄色(滴定)。之后,立即加入对应于聚合物目标分子量的配方量的在环己烷中的nb以开始聚合。引发剂加料的开始时间用作聚合的开始时间。同时,从引发剂的加料开始,通过在反应器壁中加热或冷却,将温度增加到最终聚合温度60℃,持续30分钟。将反应混合物在60℃下进一步搅拌约60分钟。加入丁二烯(表3中给出的量的2%)并将混合物再搅拌5分钟。然后加入端改性剂并将混合物再搅拌20分钟。然后通过加入甲醇终止反应。用irganox1520d稳定聚合物溶液。表3给出了样品的完整数据集。
聚合程序:实施例j-l
将环己烷(表4中给出的量)、丁二烯(总量的100%)加入到无空气10升反应器中,并将搅拌的混合物加热至40℃。然后加入tmeda(表4中给出的量)和支化剂m(表4中给出的量)和任选的稳定剂s(表4中给出的量),并逐滴加入正丁基锂以使杂质反应,直至反应混合物的颜色变为淡黄色(滴定)。之后,立即加入对应于聚合物目标分子量的配方量的在环己烷中的nb以开始聚合。引发剂加料的开始时间用作聚合的开始时间。同时,从引发剂的加料开始,通过在反应器壁中加热或冷却,将温度增加到最终聚合温度60℃,持续15分钟。将反应混合物在60℃下进一步搅拌约60分钟。然后加入端改性剂并将混合物再搅拌20分钟。然后通过加入甲醇终止反应。用irganox1520d稳定聚合物溶液。表4给出了样品的完整数据集。
表1:聚合1。
实施例ex1-ex3是未稳定的比较例。ex4用稳定剂s6进行稳定。
表2:聚合2。
聚合物a与具有非稳定改性剂s2的聚合物b相比显示出适度的稳定性。聚合物d是未稳定的比较例。聚合物e是未稳定的链端官能化的比较例。
表3:聚合3。
表4:聚合4。
nb=nbuli,2f=3-甲氧基-3,8,8,9,9-五甲基-2-氧杂-7-硫杂-3,8-二硅杂癸烷,bu-2f=[3-(丁基硫代)丙基]二甲氧基(甲基)甲硅烷,si1=二甲氧基二甲基甲硅烷,si4=3-氯丙基二甲氧基甲基甲硅烷。
凝聚橡胶的储存稳定性:
用于70℃储存的干燥柜:“memmertmodell800”,70℃下利用循环空气。
分析仪器:
使用hewlettpackardhp1100通过sec/ri进行分子量分析。将洗脱液thf在线脱气。溶剂流速为1.0ml/分钟。每次分析注入100μl聚合物溶液。分析在40℃下进行。最初基于聚苯乙烯校准计算分子量,并在表中作为聚苯乙烯给出。实际分子量(ssbr分子量)可以除以从sec/ri和sec/malls分子量之间的早期比较中得出的因子来确定。该因子的值取决于聚合物组成(苯乙烯和丁二烯含量)并且在某种程度上取决于分子量。1.52的因子可用于含21%和30%苯乙烯的ssbr。1.84的因子可用于含0%苯乙烯的sbr。1.56的因子可用于含16%苯乙烯的ssbr。1.41的因子可用于含45%苯乙烯的ssbr。
在5mmbbo探针中的brukeravance400上进行nmr光谱分析。溶剂、频率和温度在特征数据中给出。
在衰减全反射中测量的ftir光谱用于测定乙烯基含量和苯乙烯含量。
使用dscq2000在以下条件下测定玻璃化转变温度:
每个样品至少测量一次。测量包含两次加热。第二次加热用于确定玻璃化转变温度。
根据astmd5289-95,使用无转子剪切流变仪(mdr2000e)测量非硫化流变性能,以表征固化特性。
- 还没有人留言评论。精彩留言会获得点赞!