抗体及其制备方法与流程
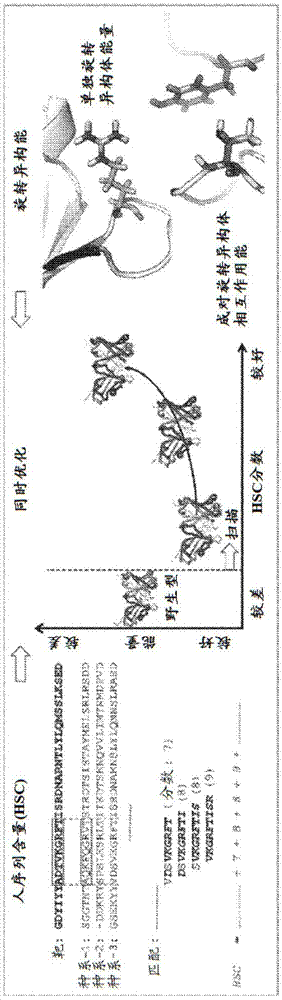
本申请要求2016年5月24日提交的美国临时专利申请号62/340,985的权益,所述临时专利申请以引用的方式整体并入本文。政府支持本发明是在政府支持下根据美国国立卫生研究院授予的r01gm098977进行。政府对本发明拥有某些权利。本发明涉及抗体、预测变体抗体的序列的方法以及其制备方法。本发明更具体地涉及针对人表皮生长因子受体(egfr)的变体抗体。发明背景抗体已经成为一类主要的生物治疗剂(aggarwal,2014),但是尽管历史悠久并且市场占有率高,新抗体的开发者仍然面临许多挑战(lu等人,2012)。一个这样的问题是免疫原性风险,其中抗生物治疗性抗体应答可降低治疗功效并表现出一系列其他有害副作用(jawa等人,2013;pendley等人,2003;roskos等人,2004;schellekens,2002;swann等人,2008)。这一问题已经部分地、但并非完全地(harding等人,2010;hwang和foote,2005)通过建立明确定义的人源化方法(baca等人,1997;dall’acqua等人,2005;dennis,2010;gonzales等人,2004;jones等人,1986;kheehwang等人,2005;lazar等人,2007;osbourn等人,2005;roguska等人,1994)和“完全人”抗体的出现(duvall等人,2011;feldhaus等人,2003;lee等人,2014;li等人,2006;lonberg,2008;mccafferty等人,1990)来解决。稳定性是治疗性抗体“可开发性”的另一个决定因素(jarasch等人,2015),因为结构完整性的丧失会降低结合活性,导致聚集并且通常破坏治疗潜力(frokjaer和otzen,2005;hermeling等人,2004)。生物治疗性聚集和免疫原性通常是相关的,因为由于热稳定性差或其他因素导致的蛋白质聚集体可加剧经典抗药物抗体应答并通过非经典途径产生有害应答(ratanji等人,2013;rosenberg,2006)。尽管完全人抗体技术的加速增长,但动物模型的免疫、随后抗体克隆和人源化是简单、方便且广泛使用的(nelson等人,2010)。通过互补决定区(cdr)移植进行人源化是一种常见策略。遗憾的是,cdr移植经常导致热稳定性和结合亲和力的显著降低,从而需要反向取代非人残基以减轻功能损失(clark,2000)。因此,人源化抗体的成功工程化需要同时考虑多个目标:人性、热稳定性和结合亲和力。技术实现要素:本发明部分基于变体西妥昔单抗序列的开发。本发明中的变体显示出增强的热稳定性(达到6℃的较高熔点)和显著改进的人性,即它们比起始或亲本西妥昔单抗抗体更紧密地类似于重链和/或轻链基因的种系形式。此外,结合亲和力接近或甚至优于亲本抗体的结合亲和力(达到高1.5倍的kd)。在一个方面,本发明提供了一种分离的变体西妥昔单抗抗体单克隆抗体或其抗原结合部分。所述抗体或抗原结合片段包含重链和/或轻链。所述重链和/或轻链在序列上相较于对应物西妥昔单抗多肽(例如,包含seqidno:1或seqidno:2的多肽)与种系egfr抗体序列更相似。在另一个方面,本发明提供了一种分离的单克隆抗体或其抗原结合部分。所述抗体或其抗原结合部分,所述抗体或抗原结合片段包含重链和轻链,所述重链和轻链比包含seqidno:1和seqidno:2的相应分离的单克隆抗体或其抗原结合部分热稳定性更高。在另一方面,本发明提供了一种分离的单克隆抗体或其抗原结合部分,其重链和/或轻链在序列方面相较于包含seqidno:1或seqidno:2的对应物多肽与种系egfr抗体序列更相似并且也比包含seqidno:1或seqidno:2的相应分离的单克隆抗体或其抗原结合部分热稳定性更高。在一些实施方案中,所述重链或轻链在序列方面相较于seqidno:1或seqidno:2与种系egfr抗体序列(例如,选自由seqidno:19-22和23组成的组的种系抗体序列)更相似。在一些实施方案中,所述重链或轻链序列包含表1中公开的序列。在一些实施方案中,所述分离的单克隆抗体还包含选自由seqidno:13、seqidno:14和seqidno:15组成的组的重链cdr1(hcdr1)区。在一些实施方案中,所述分离的单克隆抗体还包含选自由seqidno:16、seqidno:17和seqidno:18组成的组的轻链cdr1(lcdr1)区。在另一方面,本发明提供了一种分离的核酸序列,其编码变体西妥昔单抗单克隆抗体。所述核酸序列可编码重链抗体、轻链抗体或两者。本发明还提供了一种重组表达载体,其包含编码变体西妥昔单抗单克隆抗体的分离的核酸序列。在另一个方面,本发明包括一种重组表达宿主细胞,其包含编码变体西妥昔单抗单克隆抗体的核酸序列,例如具有变体西妥昔单抗单克隆抗体编码序列的重组表达载体。宿主细胞可包含编码重链变体西妥昔单抗多肽的核酸序列、编码轻链变体西妥昔单抗多肽的核酸序列、或重链和轻链变体西妥昔单抗多肽两者。在另一方面,本发明提供了一种药物组合物,其包含变体西妥昔单抗抗体或其抗原结合部分和药学上可接受的载体。在另一方面,本发明提供了一种治疗egfr相关疾病或病症的方法。所述方法包括向有需要的患者施用有效量的包含变体西妥昔单抗抗体或其抗原结合部分的药物组合物。在一些实施方案中,所述egfr相关疾病或病症是表达egfr的癌症或肿瘤。所述癌症或肿瘤可以是例如成胶质细胞瘤、导管或导管内乳腺癌、非小细胞鳞状细胞癌、卵巢癌、前列腺癌或头颈部鳞状细胞癌。在一些实施方案中,所述疾病或病症是炎性或自身免疫性疾病或病症,例如,慢性阻塞性肺病、系统性红斑狼疮、类风湿性关节炎、内脏动脉闭塞性休克、脊髓损伤、1型糖尿病或多发性硬化症。在一些实施方案中,所述药物组合物与一种或多种另外的治疗剂组合施用。另外的治疗剂可以是例如,il-18拮抗剂、il-12拮抗剂、tnf拮抗剂、甲氨蝶呤、皮质类固醇、环孢菌素、雷帕霉素、fk506和/或非类固醇抗炎剂。另外的一种或多种剂可与变体西妥昔单抗抗体药物组合物同时施用或在单独的时间施用。本发明还提供了一种制备变体西妥昔单抗抗体的方法。所述方法包括在允许变体西妥昔单抗抗体的表达和功能的条件下培养细胞。在一些实施方案中,所述方法包括纯化所表达的变体西妥昔单抗抗体。除非另外定义,否则本文中所用的所有技术和科学术语均具有与本发明所属领域的普通技术人员通常所理解的相同含义。尽管可在本发明的实践或测试中使用与本文所述的那些方法和材料类似或等效的方法和材料,但以下描述了合适的方法和材料。本文提及的所有公布、专利申请、专利以及其他参考文献以引用的方式整体并入。在冲突的情况下,以包括定义在内的本说明书为准。此外,材料、方法和实例仅是说明性的而非意图具有限制性。根据以下详细描述和权利要求书,本发明的其他特征和优点将变得显而易见。附图说明图1.基于结构的抗体人源化方法的概述。(左)通过人序列含量(humanstringcontent)(hsc)分数来评价人性,所述分数计算针对人抗体种系序列的比对的九聚体匹配。(右)通过来评价结构稳定性,包括单独位置(侧链内能加主链相互作用)和位置对(侧链相互作用)的旋转异构体的位置特异性项。(中心)选择多组突变,以便在竞争人性与能量分数之间进行最佳权衡。对于较高hsc,fab结构为深色。图2.codah设计。(图2a)codah产生西妥昔单抗的43种pareto最优人源化变体。示出了设计的系统发育树,其中每种设计用其相应的hsc分数注释。选择了五种不同的设计,以便广泛地采样序列多样性和人性程度(圆圈)。(图2b)对于选定codah设计(实心彩色圆圈),计算的旋转异构能被绘制为hsc分数的函数。还示出了codah交叉对(2-色调圆圈,左:vl,右:vh),cdr移植设计(阴影黑色圆圈)和西妥昔单抗亲本抗体(黑色星形)也是如此。图3.(图3a)重链和(图3b)轻链中的codah(浅色实线和圆形线)和移植(x和三角形线)设计的位置hsc。注意,由于缺乏种系序列,cdr3s未被标记。(图3c)平均而言,两种设计策略均产生类似的总体hsc分数水平。(图3d)与cdr移植相比,codah设计通常含有针对人种系抗体序列的更精确的九聚体匹配。图4.具有最佳hsc分数的codah和移植设计的hsc分数的可视化,其中较暗的颜色表示相应位置处的较高hsc。codah设计(c1vκ和c1vh)倾向于具有比移植设计(g2vκ和g4vh)更多的九聚体匹配,例如比较结构的中心和最右侧的阴影。图5.codah(左)和cdr移植(右)设计的差示扫描荧光法(dsf)解链曲线。将荧光强度值标准化至相应的峰值。示出来自两个独立测量的重复迹线(分别顶部和底部)。移植设计倾向于表现出多个转变,因此tm20*熔点被定义用于基于高于20%最大荧光强度的首次转变(水平虚线)的随后比较。类似的结论由其他任意选择的分级解链截止值得出(参见图7)。图6a-d.codah和cdr移植设计的解链温度曲线。图5a是codah重复1。图5b是codah重复2。图5c是cdr移植重复1。图5d是cdr移植重复2。最后一列和行是合并曲线。c3vκ/c2vh的曲线未测定并且被省略。垂直暗线表示tm20*值。图7.codah和cdr移植设计的结合亲和力和tm20*。codah设计(圆圈)的稳定性始终优于亲本西妥昔单抗的稳定性,而结合亲和力与亲本接近相同。cdr移植变体(三角形和正方形)表现出更广泛的结合亲和力和稳定性。一般来说,携带g2vh(灰色正方形)的移植设计(其含有cdr-h2附近的突变(图9))表现出比亲本西妥昔单抗(星形)更低的稳定性和更低的结合亲和力。示出了平均kd(顶部)和tm20*(右)值的盒形图(codahpareto最优设计深色实心圆圈;codah组合设计空心圆圈;包括g2vh的移植正方形;不包括g2vh的移植三角形)。图8.实验测量的稳定性和结合亲和力对比计算设计度量。图9.在每种人源化设计(c:codah,g:移植)中进行的突变。最后两列是西妥昔单抗与最接近的人抗体种系序列(不包括cdr)之间的位置差异。对于cdr移植设计,施加了基于知识的限制。对于g2vh,通过kabat和chothia编号方案(下划线斜体)在cdr-h2中的非重叠位置引入一些突变。图10.针对不同的最小转变截止值计算的tm*值。tm100*表示最大强度与最小强度之间的中点。tm10*、tm20*和tm50*表示最大强度与分别超过10%、20%或50%的第一局部最小值之间的中点。如果解链曲线具有单一转变,则这些都表现出相同的值。彩色阴影表示表现出两个(浅灰色)或更多个(深灰色)明显解链转变的设计。tm20*的原始解链曲线在图6a-6d中示出。图11.vh与ch1之间的结构域间相互作用。西妥昔单抗(pdb代码1yy8)的位置9的脯氨酸与ch1区中的其他脯氨酸残基紧密接触。具体实施方式应用codah来工程化西妥昔单抗的变体,西妥昔单抗是一种靶向表皮生长因子受体(egfr)的嵌合抗体(kirkpatrick等人,2004)。计算机设计的变体始终表现出增强的热稳定性(达到6℃)和显著改进的人性,以及接近或甚至优于亲本抗体的结合亲和力的结合亲和力(达到好1.5倍的kd)。抗体术语“抗体”在本文中以最广泛的含义使用,并且具体地涵盖任何同种型(如igg、igm、iga、igd和ige)的单克隆抗体(包括全长单克隆抗体)、多克隆抗体、多特异性抗体、嵌合抗体和抗体片段。与特定抗原反应的抗体可通过重组方法(如在噬菌体或类似载体中选择重组抗体的文库)或者通过用抗原或编码抗原的核酸免疫动物来产生。典型的igg抗体由通过二硫键连接的两条相同的重链和两条相同的轻链组成。每条重链和轻链含有恒定区和可变区。每个可变区含有称为“互补决定区”(“cdr”)或“高变区”的三个区段,所述区段主要负责结合抗原的表位。它们通常被称为cdr1、cdr2和cdr3,从n-末端顺序编号。可变区的更高度保守的部分被称为“框架区”。如本文所用,“vh”或”vh“是指抗体的免疫球蛋白重链的可变区,包括fv、scfv、dsfv、fab、fab'或f(ab')2片段的重链。提及“vl”或“vl”是指抗体的免疫球蛋白轻链的可变区,包括fv、scfv、dsfv、fab、fab'或f(ab')2片段的轻链。“多克隆抗体”是在一种或多种其他不相同的抗体之间或存在下产生的抗体。一般来说,多克隆抗体在产生不相同的抗体的若干其他b淋巴细胞存在下由b淋巴细胞产生。通常,直接从免疫的动物获得多克隆抗体。如本文所用,“单克隆抗体”是指获自基本上均质抗体的群体的抗体,即,除了可能少量存在的可能天然存在的突变以外,构成这一群体的抗体是基本上相同的。这些抗体针对单一表位并且因此具有高度特异性。“表位”是抗体所结合的抗原上的位点。如果抗原是聚合物,如蛋白质或多糖,则表位可通过连续残基或通过折叠抗原性聚合物而紧密接近的非连续残基形成。在蛋白质中,由连续氨基酸形成的表位通常在暴露于变性溶剂时保留,而由非连续氨基酸形成的表位通常在所述暴露下丧失。抗体的“人性”是其保留种系重链或轻链对应物抗体的序列的程度。如本文所用,术语“人源化抗体”是指嵌合抗体,其含有源自非人免疫球蛋白的最小序列。人源化的目标是降低诸如鼠类抗体的异种抗体的免疫原性以引入人中,同时维持抗体的完全抗原结合亲和力和特异性。人源化抗体或适于不受其他哺乳动物排斥的抗体可使用诸如表面重塑和cdr移植的若干技术来产生。如本文所用,表面重塑技术使用分子建模、统计分析和诱变的组合来改变抗体可变区的非cdr表面以类似于目标宿主的已知抗体的表面。cdr移植技术通常涉及将例如小鼠抗体的互补决定区取代到人框架结构域中,例如参见wo92/22653。人源化嵌合抗体优选具有恒定区以及除基本上或完全源自相应的人抗体区的互补决定区(cdr)和基本上或完全源自除人以外的哺乳动物的cdr以外的可变区。用于抗体表面重塑的策略和方法以及用于降低抗体在不同宿主内的免疫原性的其他方法公开于美国专利号5,639,641中,所述专利据此以引用的方式整体并入本文。简要来说,在一优选方法中,(1)产生一池抗体重链和轻链可变区的位置比对以给出一组重链和轻链可变区框架表面暴露的位置,其中对于所有可变区比对位置是至少约98%相同的;(2)确定啮齿动物抗体(或其片段)的一组重链和轻链可变区框架表面暴露的氨基酸残基;(3)鉴定与所述组啮齿动物表面暴露的氨基酸残基最接近相同的一组重链和轻链可变区框架表面暴露的氨基酸残基;(4)用步骤(3)中鉴定的所述组重链和轻链可变区框架表面暴露的氨基酸残基取代步骤(2)中确定的所述组重链和轻链可变区框架表面暴露的氨基酸残基,例外之处是在啮齿动物抗体的互补决定区的任何残基的任何原子的5.ang.内的那些氨基酸残基;以及(5)产生具有结合特异性的人源化啮齿动物抗体。可使用多种其他技术来人源化抗体,所述技术包括cdr移植(ep0239400;wo91/09967;美国专利号5,530,101;和5,585,089)、镶饰或表面重塑(ep0592106;ep0519596;padlane.a.,1991,molecularimmunology28(415):489-498;studnickag.m.等人,1994,proteinengineering,7(6):805-814;roguskam.a.等人,1994,pnas,91:969-973)以及链改组(美国专利号5,565,332)。可通过本领域中已知的多种方法(包括噬菌体展示方法)来制备人抗体。还参见美国专利号4,444,887、4,716,111、5,545,806和5,814,318;以及国际专利申请公布号wo98/46645、wo98/50433、wo98/24893、wo98/16654、wo96/34096、wo96/33735和wo91/10741(所述参照案以引用的方式整体并入)。变体西妥昔单抗分子根据本发明的变体西妥昔单抗分子在下文示出。重链西妥昔单抗变体对应于seqidno:3-7。轻链西妥昔单抗变体对应于seqidno:8-12。先前描述的西妥昔单抗重链和轻链序列分别示出为seqidno1和2。如下文所示,重链和轻链变体是可互换的。多核苷酸、载体和宿主细胞提供了编码本发明的人源化和热稳定化抗体的核酸。在一个实施方案中,所述核酸分子编码人源化和热稳定化免疫球蛋白的重链和/或轻链。在优选的实施方案中,单一核酸编码人源化和热稳定化免疫球蛋白的重链,并且另一种核酸分子编码人源化和热稳定化免疫球蛋白的轻链。为了表达本发明的人源化和热稳定化抗体的重链和/或轻链,将编码所述重链和/或轻链的多核苷酸插入表达载体中,以使得基因与转录和翻译序列可操作地连接。表达载体包括质粒、yac、粘粒、逆转录病毒、ebv来源的附加体,以及技术人员将了解便于确保所述重链和/或轻链的表达的所有其他载体。技术人员将认识到,编码重链和轻链的多核苷酸可克隆到不同的载体或同一载体中。在优选的实施方案中,将所述多核苷酸克隆在同一载体中。本发明的多核苷酸和包含这些分子的载体可用于转化合适的哺乳动物宿主细胞。转化可通过用于将多核苷酸引入细胞宿主的任何已知的方法进行。此类方法是本领域技术人员熟知的,并且包括葡聚糖介导的转化、磷酸钙沉淀、聚凝胺介导的转染、原生质体融合、电穿孔、将多核苷酸囊封于脂质体中、生物射弹注射和将dna直接显微注射到细胞核中。抗体片段本发明的抗体包括上文论述的全长抗体以及其表位结合片段。如本文所用,“抗体片段”包括抗体的保留结合至全长抗体所识别的表位的能力的任何部分,通常称为“表位结合片段”。抗体片段的实例包括但不限于,fab、fab'和f(ab')2、fd、单链fv(scfv)、单链抗体、二硫键连接的fv(dsfv)和包含vl或vh区的片段。表位结合片段(包括单链抗体)可包含单独的或与以下的整体或一部分组合的一个或多个可变区:铰链区、ch1、ch2和ch3结构域。此类片段可含有一个或两个fab片段或f(ab')2片段。优选地,所述抗体片段含有完整抗体的所有六个cdr,但是含有少于所有此类区(如三个、四个或五个cdr)的片段也是有功能的。此外,所述片段可以是或可组合以下免疫球蛋白类别中的任何一种的成员:igg、igm、iga、igd或ige以及其亚类。fab和f(ab')2片段可使用诸如木瓜蛋白酶(fab片段)或胃蛋白酶(f(ab')2片段)的酶通过蛋白水解裂解产生。“单链fv”(“scfv”)片段是表位结合片段,所述表位结合片段含有与抗体轻链可变区(vl)的至少一个片段连接的抗体重链可变区(vh)的至少一个片段。接头可以是短的、柔性的肽,经选择以确保一旦vl和vh区连接就发生所述区的适当三维折叠,以便维持单链抗体片段所来源的完整抗体的靶分子结合特异性。vl或vh序列的羧基末端可通过接头共价连接至互补vl或vh序列的氨基酸末端。本发明的单链抗体片段含有氨基酸序列,所述氨基酸序列具有本说明书中描述的完整抗体的可变区或互补决定区(cdr)中的至少一个;但缺乏那些抗体的一些或所有恒定结构域。这些恒定结构域对于抗原结合不是必需的,但是构成完整抗体的结构的主要部分。单链抗体片段因此可克服与使用含有部分或全部恒定结构域的抗体相关的一些问题。例如,单链抗体片段倾向于在生物分子与重链恒定区之间没有不希望的相互作用,或其他不想要的生物活性。另外,单链抗体片段比完整抗体显著更小,并且因此可具有比完整抗体更大的毛细管渗透性,从而允许单链抗体片段更有效地定位并结合靶抗原结合位点。此外,抗体片段可在原核细胞中以相对大的规模产生,从而促进它们的产生。此外,相对小尺寸的单链抗体片段使得它们在受体中比完整抗体更不可能引起免疫应答。单链抗体片段可通过分子克隆、抗体噬菌体展示文库或本领域技术人员熟知的类似技术产生。这些蛋白质可例如在真核细胞或原核细胞(包括细菌)中产生。本发明的表位结合片段还可使用本领域已知的各种噬菌体展示方法产生。在噬菌体展示方法中,功能性抗体结构域展示在携带编码它们的多核苷酸序列的噬菌体颗粒的表面上。特别地,这种噬菌体可用于展示从谱系或组合抗体文库(例如人或鼠类)表达的表位结合结构域。可用抗原,例如使用结合或捕捉至固体表面或珠粒的标记的抗原来选择或鉴定表达结合目标抗原的表位结合结构域的噬菌体。这些方法中使用的噬菌体通常是丝状噬菌体,所述噬菌体包含从与噬菌体基因iii或基因viii蛋白质重组融合的具有fab、fv或二硫键稳定的fv抗体结构域的噬菌体表达的fd和m13结合结构域。可用于制备本发明的表位结合片段的噬菌体展示方法的实例包括在以下文献中公开的那些:brinkman等人,1995,j.immunol.methods,182:41-50;ames等人,1995,j.immunol.methods,184:177-186;kettleborough等人,1994,eur.j.immunol.,24:952-958;persic等人,1997,gene,187:9-18;burton等人,1994,advancesinimmunology,57:191-280;wo/1992/001047;wo90/02809;wo91/10737;wo92/01047;wo92/118619;wo93/11236;wo95/15982;wo95/20401;以及美国专利号5,698,426;5,223,409;5,403,484;5,580,717;5,427,908;5,750,753;5,821,047;5,571,698;5,427,908;5,516,637;5,780,225;5,658,727;5,733,743以及5,969,108;其各自以引用的方式整体并入本文。在噬菌体选择后,所述噬菌体的编码所述片段的区域可分离并用于通过使用重组dna技术在选定宿主(包括哺乳动物细胞、昆虫细胞、植物细胞、酵母和细菌)中表达来产生表位结合片段,例如如下文详细描述的。例如,还可使用本领域已知的方法采用重组产生fab、fab'和f(ab')2片段的技术,所述方法诸如以下文献中公开的那些方法:wo92/22324;mullinax等人,1992,biotechniques,12(6):864-869;sawai等人,1995,ajri,34:26-34;以及better等人,1988,science,240:1041-1043;所述参考文献以引用的方式整体并入。可用于产生单链fv和抗体的技术的实例包括在美国专利号4,946,778和5,258,498;huston等人,1991,methodsinenzymology,203:46-88;shu等人,1993,pnas,90:7995-7999;skerra等人,1988,science,240:1038-1040中描述的那些。西妥昔单抗(也称为和imc-c225或cmab009)是与表皮生长因子受体(egfr)结合的嵌合人/小鼠抗体。公开西妥昔单抗及其用途的实施例公开于wo96/040210;wo99/060023;wo00/069459;wo02/045653;wo04/085474;wo05/051355;wo07/127936;wo07/147001;wo09/062083;wo10/056893;以及wo10/080463中,其各自以引用的方式整体并入本文。如本文所用,“热稳定化的”或“热稳定性”是指蛋白质或抗体抵抗由于温度升高所致的化学或物理变化的品质。出于本发明的目的,可进行对抗体的氨基酸序列的改变以相较于亲本抗体增加所述抗体的热稳定性。热稳定性可通过本领域中的任何已知方法确定,所述方法包括抗体解链温度(tm)的测量。热稳定性的改进包括tm增加大于或等于0.1℃至大于或等于10.0℃。治疗方法如本文所用,“治疗”是用于获得有益或所需的临床结果的方法。出于本发明的目的,有益或所需的结果包括但不限于以下中的一种或多种:减少赘生性或癌性细胞的增殖(或破坏赘生性或癌性细胞)、抑制赘生性细胞的转移、缩小或减小肿瘤的尺寸、缓解癌症、减少由癌症引起的症状、增加患有癌症的人的生活质量、减少治疗疾病所需的其他药物的剂量、延迟癌症的进展、治愈癌症和/或延长患有癌症的患者的存活。如本文所用,药物、化合物或药物组合物的“有效剂量”或“有效量”是足以实现任何一种或多种有益或所需结果的量。在更具体的方面,有效量预防、减轻或改善疾病的症状,和/或延长所治疗受试者的存活。对于预防性用途,有益或所需的结果包括消除或降低疾病的风险、减轻疾病的严重性或延迟疾病的发作,包括所述疾病的生物化学、组织学和/或行为症状、其并发症和在所述疾病的发展期间存在的中间病理学表型。对于治疗性用途,有益或所需的结果包括临床结果,诸如减轻疾病的一种或多种症状,所述疾病例如像癌症,包括例如但不限于胃癌、肉瘤、淋巴瘤、霍奇金淋巴瘤、白血病、头颈癌、鳞状细胞头颈癌、胸腺癌、上皮癌、唾液腺癌、肝癌、胃癌、甲状腺癌、肺癌、卵巢癌、乳腺癌、前列腺癌、食道癌、胰腺癌、神经胶质瘤、白血病、多发性骨髓瘤、肾细胞癌、膀胱癌、宫颈癌、绒毛膜癌、结肠直肠癌、口腔癌、皮肤癌和黑色素瘤;减少治疗所述疾病所需的其他药物的剂量、增强另一种药物的作用和/或延迟患者的癌症进展。有效剂量可在一次或多次施用中施用。出于本发明的目的,药物、化合物或药物组合物的有效剂量是足以直接地或间接地完成预防性或治疗性治疗的量。如在临床背景中所理解,药物、化合物或药物组合物的有效剂量可以或可以不与另一种药物、化合物或药物组合物联合实现。因此,“有效剂量”可在施用一种或多种治疗剂的背景中考虑,并且如果与一种或多种其他剂结合可实现或实现了所期望的结果,则可考虑以有效量给予单一剂。“个体”或“受试者”是哺乳动物、更优选地是人。哺乳动物还包括但不限于农场动物(例如,牛、猪、马、鸡等)、运动动物、宠物、灵长类动物、马、狗、猫、小鼠和大鼠。本发明将进一步在以下非限制性实施例中说明。实施例实施例1.计算设计codah(计算驱动的抗体人源化)(choi,hua,sentman,ackerman和bailey-kellogg,2015,以引用的方式并入本文)是基于结构的蛋白质设计方法,所述方法通过根据计算机评估突变对人性和稳定性的影响来选择多组允许的突变来优化亲本fv的变体。实施例2.人性分析根据抗体的人序列含量分数对抗体的人性进行评估(lazarga,desjarlaisjr,jacintoj,karkis,hammondpw.amolecularimmunologyapproachtoantibodyhumanizationandfunctionaloptimization.molimmunol2007;44:1986-98)(图1,左)。考虑从抗体链(轻或重)中的位置i开始的单一l长度肽p。在此以及lazar等人(上文)呈现的结果使用l=9,因为这代表结合mhc的核心肽的典型长度(parhamp,ohtat.populationbiologyofantigenpresentationbymhcclassimolecules.science1996;272:67-74和rechepa,reinherzel.sequencevariabilityanalysisofhumanclassiandclassiimhcmolecules:functionalandstructuralcorrelatesofaminoacidpolymorphisms.jmolbiol2003;331:623-41)。由所述肽贡献的位置特异性人性分数是其与来自一组所考虑的种系g的比对的人种系g中的相应肽(即,也从位置i开始)的最大同一性。如果断言为真,则指示函数i{}为1,即靶抗体中的氨基酸与种系中的相应氨基酸相同;否则为0。因此,如果其所有9个氨基酸与一些种系序列中的相应氨基酸相同,则由肽贡献的最大分数为9。整个抗体链v的hsc分数然后是所有其组成肽内的平均值,按比例缩放至百分比(0-100)。实施例3.结构能的评价通过基于旋转异构体的结构能来评估抗体稳定性(图1,右),其中位置特异性单一和成对项是基于amber力场。(pearlmanda,caseda,caldwelljw,rossws,cheathamte,debolts,fergusond,seibelg,kollmanp.amber,apackageofcomputerprogramsforapplyingmolecularmechanics,normalmodeanalysis,moleculardynamicsandfreeenergycalculationstosimulatethestructuralandenergeticpropertiesofmolecules.computphyscommun1995;91:1-41)。旋转异构体文库(lovellsc,wordjm,richardsonjs,richardsondc.thepenultimaterotamerlibrary.proteins2000;40:389-408)为原始蛋白质和可能的取代指定了一组离散的可能的侧链构象,并且通过osprey蛋白质重新设计软件包构建能量矩阵。(chenc-y,georgievi,andersonac,donaldbr.computationalstructure-basedredesignofenzymeactivity.procnatlacadsci2009;106:3764-9和gainzap,robertske,donaldbr.proteindesignusingcontinuousrotamers.ploscomputbiol2012;8:e1002335)。osprey消除了需要空间冲突的旋转异构体,以及可能不是最优设计或足够接近最优设计的一部分的那些。(goldsteinrf.efficientrotamereliminationappliedtoproteinside-chainsandrelatedspinglasses.biophysj1994;66:1335-40)。在能量计算中仅考虑fv区。实施例4.取代的鉴定在人源化过程中不允许cdr突变。为了鉴定cdr,使用abnum程序通过kabat编号方案注释抗体序列。(abhinandank,martinac.analysisandimprovementstokabatandstructurallycorrectnumberingofantibodyvariabledomains.molimmunol2008;45:3832-9)。轻链cdr被定义为残基24-34(l1)、50-56(l2)和89-97(l3),并且重链cdr由残基31-35(h1)、50-65(h2)和95-102(h3)组成。在每个位置,在一些人种系抗体序列中在相应比对位置处出现的任何氨基酸被认为是可能的取代。还有可能根据需要基于足够频繁地在特定种系中出现的那些或基于其他标准来过滤所述组。实施例5.基于结构的抗体人源化算法人源化算法鉴定了pareto最优蛋白质设计,(hel,friedmanam,bailey-kelloggc.adivide-and-conquerapproachtodeterminetheparetofrontierforoptimizationofproteinengineeringexperiments.proteins2012;80:790-806)即,在hsc分数与基于旋转异构体的能量的2个竞争目标之间做出最佳权衡的那些。所述算法遵循类似于先前针对酶去免疫化开发的方法的“扫描”方法。(parkeras,choiy,griswoldke,bailey-kelloggc.structure-guideddeimmunizationoftherapeuticproteins.jcomputbiol2013;20:152-65)。最初,计算原始靶抗体序列的hsc分数(等式1,上文)。然后优化具有比原始的hsc分数更好的hsc分数的最低能量变体,从而在图1中的曲线上向右移动一步。然后重复所述过程,从而在具有比第一变体更好的hsc分数的那些中找到最小能量变体,沿着所述曲线诸如此类。在已经生成完整的曲线之后,可重复所述过程以产生接近最优曲线,从而将序列限制为与已经鉴定的那些序列相差至少一个突变。同样可产生进一步越来越次优的曲线。为了优化实现至少指定hsc分数的最小能量变体,parker等人(同上)的整数规划公式适于使用hsc。整数规划将变体表示为一组旋转异构体,一些来自原始序列并且一些作为取代,其由一组二进制变量编码:si,r指示所述变体是否使用位置i处的旋转异构体r。为了并入成对能量项,整数规划还包括对变量:pir,jt指示变体是否使用i处的旋转异构体r和j处的旋转异构体t。最后,为了评估并由此约束hsc分数,“窗口”二进制变量wi,p被定义为指示跨越位置i至i+l-1(在这种情况下l=9)的氨基酸是否对应于线性肽p(即,9个氨基酸的序列)。仅允许具有优于原始序列的hsc分数的肽。用于整数规划的目标函数是最小化能量e,计算如下:其中ei(r)是位置i处的旋转异构体r的能量,并且eij(r,t)是i处的旋转异构体r与j处的旋转异构体t之间的成对能量。在扫描期间,下一个变体被约束为将hsc分数提高到超出前一变体的值h:变量进一步如下约束,以便确保所述对变量和窗口变量与单例变量一致,并且在每个位置仅采用一个旋转异构体:其中p[h]是肽p中的位置h处的氨基酸类型,并且a(r)是旋转异构体r的氨基酸类型。另外,可约束突变负荷m,从而指定不具有相应原始氨基酸类型的旋转异构体的数量:其中t[i]是原始靶标中的位置i处的氨基酸。实施例6.人性分析和codah抗体变体产生人序列含量(hsc)分数(lazar,desjarlais,jacinto,karki和hammond,2007)将人性评估为变体内的九聚体肽与人种系抗体序列内的相应九聚体的同一性程度。将西妥昔单抗的重链(vh)和轻链(vκ)可变区与从公开可用的数据库(包括vbase和imgt)提取的总计212个独特vh和85种vκ人种系抗体序列进行比对(poiron等人,2010;retter等人,2005)。基于结构的旋转异构能根据分子力学力场评估突变的能量影响。codah使用如由osprey(chen等人,2009;gainza等人,2012)实施的amber力场(pearlman等人,1995;qiu等人,1997)定义的单体和双体能量势。来自西妥昔单抗(pdb代码:1yy8)的晶体结构的fv部分用于参数化这些能量。codah产生了一组43种pareto最优(he等人,2012;parker等人,2013;parker等人,2010)整合的vh/vκ西妥昔单抗变体,即在hsc分数与旋转异构能之间进行最佳权衡的那些(图2a)。基于相互序列差异(图2b)选择这些设计中的五种(图9,c1-c5)。关于代表性序列,还参见以下表1。“n9”表示给定抗体序列内为与人种系序列的精确匹配的九聚体肽的数目。所述值对于组合的重链和轻链给出–“h9”,对于仅重链给出“n9_h”,并且对于仅轻链给出“n9_l”。表1–codah产生的西妥昔单抗变体的hsc分数和序列。实施例7.西妥昔单抗cdr序列作为对比,还使用cdr移植的常规方法构建了一组人源化变体。将西妥昔单抗的cdr(由kabat编号方案定义,参见以下表2)移植到来自数据库的最相似的人种系抗体上。基于免疫球蛋白折叠中的包装的知识(chothia等人,1998)、表面可及性(pedersen等人,1994)、vh/vl的界面区(chothia等人,1985)、vernier区(foote和winter,1992)和其他已知的风险因素(studnicka等人,1994)保留了选择的鼠类框架残基。总计,为每条链选择了四种cdr移植设计(图9,g1-g4)。表2–西妥昔单抗cdr序列cdr序列hcdr1nygvh(seqidno:13)hcdr2viwsggntdyntpfts(seqidno:14)hcdr3altyydyefay(seqidno:15)lcdr1rasqsigtnih(seqidno:16)lcdr2yasesis(seqidno:17)lcdr3qqnnnwptt(seqidno:18)基因构建、蛋白质表达和抗体纯化在codah和cdr移植抗体两者的内部设计之后,商业服务提供商签约合成、克隆、通过hek细胞中的瞬时转染表达并且纯化所有构建体(migsllc,lebanon,nh,usa)。除了具有联合优化的vh/vκ对的五种codah设计(图9,c1-c5)之外,还构建了交叉vh/vκ对,从而产生了总计25种codah抗体的20个交叉对(也绘制在图2a中)。cdr移植没有优选的对,因此四个cdr-移植的vh同样与四个cdr-移植的vκ中的每一个配对(图9,g1-g5),总计16对。平均而言,cdr移植和codah人源化抗体设计具有相似的人性水平。它们的平均hsc分数(codah:83.8和移植:83.7)在所有设计中相似(图2b和图3c),并且优于西妥昔单抗(75.2)。然而,codah设计倾向于具有针对人种系九聚体的更精确匹配(与西妥昔单抗:14[1+13]相比,codah:57.8[vh21.4+vκ36.4]和移植:47.8[20+27.8];图3d和图4)。此外,最优化的codah设计(c2或c3vh和c1vκ)与人种系链高度相似(图9),与最接近的种系抗体链仅具有13个位置差异(对于vh为7,对于vκ为+6,不包括cdr环),而在最相似的移植设计(g3vh和g4vκ)与其相应的种系序列之间存在16个位置差异(7+9)。为了便于与传统的cdr移植进行比较,允许的突变被限于来自一小组最相似的种系序列的那些:对于vh为三个(ighv4-4、34和59),并且对于vκ为2个(igkv6d-21和41)。在互补决定区(cdr)内不允许突变,如使用abnum程序的kabat编号方案所定义的(abhinandan和martin,2008)。对允许的突变没有施加进一步限制。ighv4-4、ighv4-34、ighv4-59、igkv6d-21和igkv6d-41的代表性人种系序列在以下表3中示出。表3–选择人种系序列实施例3.热稳定性和结合亲和力使用来自appliedbiosystems的abi7500快速实时pcr系统,通过差示扫描荧光法(dsf)(niesen,berglund和vedadi,2007)分析了格式化为fab片段的所有构建体的相对稳定性。将蛋白质和sypro橙在pbs中稀释。最终蛋白质浓度是100μg/ml,并且最终染料浓度是5x。pcr梯度从25℃-98℃运行,每摄氏度平衡1分钟。使用预设的tamra参数量化荧光。为了消除来自fc变性的混杂信号,使用重组fab片段测定热稳定性。由于所述fab中的一些展示多转变解链曲线,因此通过分析局部转变来计算分级解链温度,忽略在任意选择的阈值以下稳定的那些(即,指示相对较小的解折叠)。例如,从最小强度至超过总荧光信号的20%的第一局部平台计算tm20*(忽略低于第一局部转变20%的转变和任何高于第一局部转变的转变,在观察到的情况下)。同样测定tm10*和tm50*的值,而tm100*表示最小强度与最大强度之间的中点。尽管不存在fc区,但大多数cdr-移植构建体和codah构建体中的一种表现出由两个或更多个转变组成的复杂解链曲线(图5中的叠加;图6a-6d中的个体)。为了便于比较热稳定性,选择变性阈值以忽略低于20%最大荧光强度的转变(tm20*);表s1考虑了其他阈值。使用tm20*截止值,五种pareto最优codah设计表现出比亲本西妥昔单抗模板高3.2℃至6.3℃的解链温度,并且除两个之外的所有交叉配对的codah构建体同样表现出增强的热稳定性(图7,图10)。g2vh/g2vκcdr移植设计在本研究中表现出任何抗体的单一最高tm20*,但所有其他cdr移植设计表现出等于或小于西妥昔单抗的tm20*值的tm20*值(图7,图10)。另外,codah设计绝大多数表现出单一转变解链曲线(图5,图6a-6b),而所有cdr移植设计表现出多个转变(图5,图6c-6d)。codah设计的热稳定性在统计学上显著优于移植设计的热稳定性(基于kolmogorov-smirnov检验,p值<10-6)。在fortebiooctetred仪器(fortebio,menlopark,ca,usa)上使用生物层干涉测量法估计所有抗体的egfr结合亲和力。将在磷酸盐缓冲盐水(pbs,137mmnacl,2.6mmkcl,10mmna2hpo4,1.7mmkh2po4,ph7.4)中12.5μg/ml的纯化的igg样品固定在蛋白a尖端(fortebio)上并暴露于pbs中100nm重组可溶性his标记的人egfr(sinobiologicals,northwales,pa,usa)。使用仪器提供的软件确定缔合和解离速率以及平衡亲和力。将样品作为技术重复在两至三个独立实验中进行分析,将估计的kd值标准化至西妥昔单抗亲本抗体的kd值,并将标准化值用于抗体结合活性的相对评级。虽然对fab片段进行热稳定性分析,但用全长igg抗体测量亲和力。所有25种codah设计(pareto最优和交叉对)都保留了亲本西妥昔单抗结合活性(0.7至1.5倍,图7和表1)。相比之下,cdr移植设计表现出在1.2至16倍较弱范围内的广泛估计的结合亲和力(图7)。codah设计展示比移植设计统计上显著更好的kd值(通过kolmogorov-smirnov,p-值<10-6)。总体而言,跨越广泛hsc分数(图2)的25种codah设计表现出一致的实验性能(图7)。在hsc与tm20*或kd之间或在旋转异构能与tm20*或kd之间不存在明显相关性(图8)。维持稳定性和结合亲和力是抗体人源化项目的关键并行目标,但人源化的主要方法仍然主要是经验性的,从而依赖于可产生广泛变化的性能结果的试验和错误优化。例如,使用实验驱动的体外体细胞超突变方法的最近研究产生了cdr-移植西妥昔单抗变体,所述变体具有7℃改进的热稳定性但结合亲和力降低8倍(mcconnell等人,2013;mcconnell等人,2014)。在此,已经证明计算人源化的西妥昔单抗变体始终展示增强的人性、显著改进的热稳定性和接近野生型结合亲和力的组合。虽然codah在利用大的种系序列组库时效率最高,但在此每个位置处的可突变氨基酸仅选自用于对比cdr移植实验的三个vh(ighv4-4、34和59)和两个vκ(igkv6d-21和41)序列。即使在专注于同一组抗体种系序列并且靶向大致相似的位置(图9),计算算法codah倾向于使用更多稳定突变以比直接移植方法更好地起作用。应该注意的是,通过移植的明确排除和隐含地通过计算设计过程中的建模,两种策略都未突变vh/vκ界面区域中的残基。假设在移植设计的解链曲线中观察到的多个转变可能来自结构域间相互作用。令人感兴趣的是,g2和g3vh结构域的p9a突变是移植设计之间明显的差异之一(图9)。西妥昔单抗中位置9的脯氨酸残基似乎与ch1结构域中的两个脯氨酸残基接触(图11),并且突变所述位置可能导致vh与ch1之间的结构域间相互作用的不稳定(等人,2005)。与这种假设一致,携带g2和g3vh的移植构建体通常表现出比西妥昔单抗更低的热稳定性,但是g2vh/g2vκ是如通过tm20*测量的异常稳定的抗体。已知cdr及其相邻残基的修饰可能不利地影响结合亲和力(wiens等人,1998),并且codah构建体普遍避免与cdr相邻的突变。同样地,除了g2vh链之外,大多数移植构建体排除了cdr相邻突变,其中在位置58、61、63和64处进行了取代。kabat和chothia编号方案采用cdr位置的不同定义,并且特别是kabatcdr-h2显著更长(kabat:残基50-65,和chothia:残基52-56)。对于g2vh,通过chothia编号突变位置与cdr-h2相邻,但通过kabat在cdr-h2内(参见图9,下划线斜体)。这些取代可能是携带g2vh链的设计中亲和力差的主要驱动因素,因为这四种抗体在octet结合研究中都是明显的异常值(kd降低大约11至16倍,图7)。总之,已经证明了基于结构的计算抗体人源化方法codah是直接产生具有高稳定性和结合亲和力的人源化抗体变体的成本有效且可靠的工具。这种工具可证明适用于寻求快速且有效地人源化源自外来宿主的抗体的抗体工程化。参考文献abhinandank.andmartina.c.(2008)analysisandimprovementstokabatandstructurallycorrectnumberingofantibodyvariabledomains.molecularimmunology,45,3832-3839aggarwals.r.(2014)what′sfuelingthebiotechengine-2012to2013.naturebiotechnology,32,32-39bacam.,prestal.g.,o’connors.j.andwellsj.a.(1997)antibodyhumanizationusingmonovalentphagedisplay.journalofbiologicalchemistry,272,10678-10684chenc.-y.,georgievi.,andersona.c.anddonaldb.r.(2009)computationalstructure-basedredesignofenzymeactivity.proceedingsofthenationalacademyofsciences,106,3764-3769choiy.,huac.,sentmanc.l.,ackermanm.e.andbailey-kelloggc.(2015)antibodyhumanizationbystructure-basedcomputationalproteindesign.mabs,1-13chothiac.,gelfandi.andkistera.(1998)structuraldeterminantsinthesequencesofimmunoglobulinvariabledomain.journalofmolecularbiology,278,457-479chothiac.,j.,bruccolerir.andkarplusm.(1985)domainassociationinimmunoglobulinmolecules:thepackingofvariabledomains.journalofmolecularbiology,186,651-663clarkm.(2000)antibodyhumanization:acaseofthe‘emperor’snewclothes’?immunologytoday,21,397-402dall’acquaw.f.,damschroderm.m.,zhangj.,woodsr.m.,widjajal.,yuj.andwuh.(2005)antibodyhumanizationbyframeworkshuffling.methods,36,43-60dennism.s.(2010),currenttrendsinmonoclonalantibodydevelopmentandmanufacturing.springer,pp.9-28.duvallm.,bradleyn.andfiorinir.n.(2011)anovelplatformtoproducehumanmonoclonalantibodies:thenextgenerationoftherapeutichumanmonoclonalantibodiesdiscovery.mabs,3,203-208feldhausm.j.,siegelr.w.,opreskol.k.,colemanj.r.,feldhausj.m.w.,yeungy.a.,cochranj.r.,heinzelmanp.,colbyd.andswersj.(2003)flow-cytometricisolationofhumanantibodiesfromanonimmunesaccharomycescerevisiaesurfacedisplaylibrary.naturebiotechnology,21,163-170footej.andwinterg.(1992)antibodyframeworkresiduesaffectingtheconformationofthehypervariableloops.journalofmolecularbiology,224,487-499frokjaers.andotzend.e.(2005)proteindrugstability:aformulationchallenge.naturereviewsdrugdiscovery,4,298-306gainzap.,robertsk.e.anddonaldb.r.(2012)proteindesignusingcontinuousrotamers.ploscomputationalbiology,8,e1002335gonzalesn.r.,padlane.a.,depascalisr.,schuckp.,schlomj.andkashmiris.v.(2004)sdrgraftingofamurineantibodyusingmultiplehumangermlinetemplatestominimizeitsimmunogenicity.molecularimmunology,41,863-872hardingf.a.,sticklerm.m.,razoj.anddubridger.b.(2010)theimmunogenicityofhumanizedandfullyhumanantibodies.residualimmunogenicityresidesinthecdrregionsmabs,2,256-265hel.,friedmana.m.andbailey-kelloggc.(2012)adivide-and-conquerapproachtodeterminetheparetofrontierforoptimizationofproteinengineeringexperiments.proteins:structure,function,andbioinformatics,80,790-806hermelings.,crommelind.j.,schellekensh.andjiskootw.(2004)structure-immunogenicityrelationshipsoftherapeuticproteins.pharmaceuticalresearch,21,897-903hwangw.y.k.andfootej.(2005)lmmunogenicityofengineeredantibodies.methods,36,3-10jarascha.,kollh.,regulaj.t.,baderm.,papadimitrioua.andkettenbergerh.(2015)developabilityassessmentduringtheselectionofnoveltherapeuticantibodies.journalofpharmaceuticalsciences,104,1885-1898jawav.,cousensl.p.,awwadm.,wakshulle.,kropshoferh.anddegroota.s.(2013)t-celldependentimmunogenicityofproteintherapeutics:preclinicalassessmentandmitigation.clinicalimmunology,149,534-555jonesp.t.,dearp.h.,foofej.,neubergerm.s.andwinterg.(1986)replacingthecomplementarity-determiningregionsinahumanantibodywiththosefromamouse.nature,321,522-525kheehwangw.y.,almagroj.c.,busst.n.,tanp.andfootej(2005)useofhumangermlinegenesinacdrhomology-basedapproachtoantibodyhumanization.methods,36,35-42kirkpatrickp.,grahamj.andmuhsinm.(2004)cetuximab.naturereviewsdrugdiscovery,3,549-550lazarg.a.,desjarlaisj.r.,jacintoj.,karkis.andhammondp.w.(2007)amolecularimmunologyapproachtoantibodyhumanizationandfunctionaloptimization.molecularimmunology,44,1986-1998leee.-c.,liangq.,alih.,baylissl.,beasleya.,bloomfield-gerdest.,bonolil.,brownr.,campbellj.andcarpentera.(2014)completehumanizationofthemouseimmunoglobulinlocienablesefficienttherapeuticantibodydiscovery.naturebiotechnology,32,356-363lij.,sait,bergerm.,chaoq.,davidsond.,deshmukhg.,drozdowskib.,ebelw.,harleys.andhenrym.(2006)humanantibodiesforimmunotherapydevelopmentgeneratedviaahumanbcellhybridomatechnology.proceedingsofthenationalacademyofsciencesoftheunitedstatesofamerica,103,3557-3562lonbergn.(2008),therapeuticantibodies.springer-verlag,pp.69-97.luz.-j.,dengs.-j.,huangd.-g.,hey.,leim.,zhoul.andjinp.(2012)frontieroftherapeuticantibodydiscovery:thechallengesandhowtofacethem.worldjournalofbiologicalchemistry,3,187-196mccaffertyj.,griffithsa.d,winterg.andchiswelld.j.(1990)phageantibodies:filamentousphagedisplayingantibodyvariabledomains.nature,348,552-554mcconnella.d.,spasojevichv.,macomberj.l.,krapfl.p.,chena.,shefferj.c.,berkebilea.,horlickr.a.,nebens.andkingd.j.(2013)anintegratedapproachtoextremethermostabilizationandaffinitymaturationofanantibody.proteinengineeringdesignandselection,26,151-164mcconnella.d.,zhangx.,macomberj.l.,chaub.,shefferj.c.,rahmanians.,haree.,spasojevicv.,horlickr.a.andkingd.j.(2014),mabs.taylor&francis,pp.1274-1282.nelsona.l.,dhimoleae.andreichertj.m.(2010)developmenttrendsforhumanmonoclonalantibodytherapeutics.naturereviewsdrugdiscovery,9,767-774niesenf.h.,berglundh.andvedadim.(2007)theuseofdifferentialscanningfluorimetrytodetectligandinteractionsthatpromoteproteinstability.natureprotocols,2,2212-2221osbournj.,grovesm.andvaughant.(2005)fromrodentreagentstohumantherapeuticsusingantibodyguidedselection.methods,36,61-68parkera.s.,choiy.,griswoldk.e.andbailey-kelloggc.(2013)structure-guideddeimmunizationoftherapeuticproteins.journalofcomputationalbiology,20,152-165parkera.s.,zhengw.,griswoldk.e.andbailey-kelloggc.(2010)optimizationalgorithmsforfunctionaldeimmunizationoftherapeuticproteins.bmcbioinformatics,11,180pearlmand.a.,cased.a.,caldwellj.w.,rossw.s.,cheathamiiit.e.,debolts.,fergusond.,seibelg.andkollmanp.(1995)amber,apackageofcomputerprogramsforapplyingmolecularmechanics,normalmodeanalysis,moleculardynamicsandfreeenergycalculationstosimulatethestructuralandenergeticpropertiesofmolecules.computerphysicscommunications,91,1-41pedersenj.t.,henrya.h.,searles.j.,guildb.c.,roguskam.andreesa.r.(1994)comparisonofsurfaceaccessibleresiduesinhumanandmurineimmunoglobulinfvdomains:implicationforhumanizationofmurineantibodies.journalofmolecularbiology,235,959-973pendleyc.,schantza.andwagnerc.(2003)lmmunogenicityoftherapeuticmonoclonalantibodies.currentopinioninmoleculartherapeutics,5,172-179poironc.,wuy.,ginestouxc.,ehrenmannf.,patriced.andlefrancm.-p.(2010)imgt/mab-db:theimgtdatabasefortherapeuticmonoclonalantibodies.jobim,paper13qiud.,shenkinp.s.,hollingerf.p.andstillw.c.(1997)thegb/sacontinuummodelforsolvation.afastanalyticalmethodforthecalculationofapproximatebornradii.thejournalofphysicalchemistrya,101,3005-3014ratanjik.d.,derrickj.p.,dearmanr.j.andkimberi.(2013)immunogenicityoftherapeuticproteins:influenceofaggregation.journalofimmunotoxicology,11,99-109retteri.,althaush.h.,munchr.andmullerw.(2005)vbase2,anintegrativevgenedatabase.nucleicacidsresearch,33,d671-d674roguskam.a.,pedersenj.t.,keddyc.a.,henrya.h.,searles.j.,lambertj.m.,goldmacherv.s.,blatter,wa,reesa.r.andguildb.c.(1994)humanizationofmurinemonoclonalantibodiesthroughvariabledomainresurfacing.proceedingsofthenationalacademyofsciences,91,969-973rosenberga.s.(2006)effectsofproteinaggregates:animmunologicperspectiye.theaapsjournal,8,e501-e507roskosl.k.,davisc.g.andschwabg.m.(2004)theclinicalpharmacologyoftherapeuticmonoclonalantibodies.drugdevelopmentresearch,61,108-120d.,honeggera.andplückthuna.(2005)domaininteractionsinthefabfragment:acomparativeevaluationofthesingle-chainfvandfabformatengineeredwithvariabledomainsofdifferentstability.journalofmolecularbiology,347,773-789schellekensh.(2002)immunogenicityoftherapeuticproteins:clinicalimplicationsandfutureprospects.clinicaltherapeutics,24,1720-1740studnickag.m.,soaress.,betterm.,williamsr.e.,nadellr.andhorwitza.h.(1994)human-engineeredmonoclonalantibodiesretainfullspecificbindingactivitybypreservingnon-cdrcomplementarity-modulatingresidues.proteinengineering,7,805-814swannp.g.,tolnaym.,muthukkumars.,shapirom.a.,rellahanb.l.andclousek.a.(2008)considerationsforthedevelopmentoftherapeuticmonoclonalantibodies.currentopinioninimmunology,20,493-499wiensg.d.,robertv.a.,whitcombe.a.,o′haret.,stenzel-poorem.p.andrittenbergm.b.(1998)harmfulsomaticmutations:lessonsfromthedarkside.lmmunologicalreviews,162,197-209.另外的实施方案在权利要求内。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1