从人多能干细胞生成心房心肌细胞和心室心肌细胞谱系的制作方法
本申请根据35 U.S.C.§119要求于2016年12月4日提交的美国临时申请序列号62/429,823,以及于2016年12月6日提交的美国临时申请序列号62/430,815的优先权。这些早先提交的专利申请的全部内容在此明确以引用的方式并入本文,包括但不限于说明书、权利要求和摘要中的每一个,以及其任何附图、表或图。
技术领域
本公开提供了生产方法和包含心房心肌细胞、心室心肌细胞的富集群体的组合物,其用于治疗性处理、疾病建模、药物开发以及生物标记物的用途,以及用于鉴定这些富集的亚群的方法。
背景技术:
心脏病研究的目标是更详细地了解心脏病中发生的情况及其原因,并且找到预防损伤或者修复或替换受损心脏组织的方法。现有疗法旨在减缓心力衰竭的进展,而不是恢复丧失的收缩功能。目前,替换丧失的收缩功能的唯一可用的治疗选项是全器官移植,但由于需求大大超过供应,因此已存在作为替代方法的基于干细胞的疗法的相当大兴趣。特别有用的是利用从干细胞分化的心肌细胞用于移植的能力。各种研究已证实,一旦移植,人胚胎干细胞(hESC)衍生的心肌细胞的使用就可以使受损心脏再肌化,并且介导收缩功能中的改善(参见例如Shiba等人(2012))。然而,挑战之一是可能负责诸如移植物相关的室性心动过速等问题的干细胞衍生的心肌细胞群体的混合性质。需要的是进一步分化干细胞以允许形成特定亚型的心肌细胞,例如心室心肌细胞和心房心肌细胞的富集群体,并且允许这些富集的心肌细胞群体用于治疗目的的能力。
技术实现要素:
在一个方面,本发明提供了产生富含心房心肌细胞的心肌细胞群体的方法,所述步骤包括:i.在中胚层诱导培养基中温育多能干细胞,所述中胚层诱导培养基包含至少BMP组分,任选BMP4和有效量的激活素组分,任选激活素A,以生成心房中胚层。在这方面,该方法包括进一步向细胞中添加视黄酸组分,所述视黄酸的添加在中胚层诱导或心血管特化阶段期间加入,并且培养所述细胞,使得生成富含心房心肌细胞的心肌细胞群体。
在一个方面,心房中胚层的特征可以在于所述细胞是RALDH2阳性CD235阴性和CYP26A1阴性中的一种或多种。在一个实施例中,BMP组分与激活素组分以3:2的比率提供。在另一个实施例中,激活素组分以约0.001ng/ml至6ng/ml的量存在,并且所述BMP组分以约3ng/ml至约100ng/ml的量存在。
在一个方面,本发明提供了产生富含心室心肌细胞的心肌细胞群体的方法,所述步骤包括:在中胚层诱导培养基中培养多能干细胞,所述中胚层诱导培养基包含BMP组分,任选BMP4和足以生成心室中胚层的有效量的激活素组分,并且其后,在适合于生成富含心室心肌细胞的心肌细胞群体的培养基中培养所述细胞。在一个实施例中,有效生成心室中胚层的激活素组分的量的特征在于所述心室中胚层是RALDH2阴性、CD235a阳性和CYP26A1阳性中的一种或多种。在另一个实施例中,激活素组分的浓度大于BMP组分的浓度。在一个实施例中,激活素组分以约6ng/ml至20ng/ml的量存在,并且所述BMP以约3ng/ml至约20ng/ml的量存在。
在一个方面,本发明提供了富含心室心肌细胞的心肌细胞群体,其中所述群体基本上不含起搏细胞。在另一个方面,该群体缺乏起搏细胞。在另一个方面,本发明提供了分离的心肌细胞群体:富含心室心肌细胞,其包含至少或约50%的心室心肌细胞、至少或约60%的心室心肌细胞、至少或约70%的心室心肌细胞、至少或约80%的心室心肌细胞、至少或约90%的心室心肌细胞、至少约95%的心室心肌细胞、或至少约99%的心室心肌细胞,优选根据本文所述的方法获得。在本发明的一个方面,分离的群体基本上不含起搏细胞(总细胞的少于5%)。在一个优选实施例中,该群体包括少于1%的起搏细胞、少于0.5%的起搏细胞、少于0.1%的起搏细胞、少于0.01%的起搏细胞、少于0.001%的起搏细胞、0.0001%的起搏细胞,或完全缺乏起搏细胞。虽然不希望受任何理论的束缚,但假定起搏细胞的存在可以在引入患者时诱导肌肉的独立和分开的收缩。在一个优选实施例中,起搏细胞使用目前可用的技术在分离的心室心肌细胞群体中无法检测到。
在一个方面,本发明提供了富含心房心肌细胞的分离的心肌细胞群体,其包含至少或约50%的心房心肌细胞、至少或约60%的心房心肌细胞、至少或约70%的心房心肌细胞、至少或约80%的心房心肌细胞、或至少或约90%的心房心肌细胞、或至少或约95%的心房心肌细胞、或至少或约99%的心房心肌细胞,优选根据本文所述的方法获得。
在一个方面,本发明提供了治疗需要心脏修复的受试者的方法,所述受试者例如患有心力衰竭的受试者或处于心力衰竭的风险中的受试者,所述方法包括向受试者施用本文所述的心室心肌细胞群体。
在一个方面,本发明提供了用于治疗需要心脏修复的受试者中的本文所述的心室心肌细胞群体,所述受试者例如患有心力衰竭的受试者或处于心力衰竭的风险中的受试者。
在一个方面,本发明提供了本文所述的心室心肌细胞群体在制备用于治疗需要心脏修复的受试者的药剂中的用途,所述受试者例如患有心力衰竭的受试者或处于心力衰竭的风险中的受试者。
在一个方面,本发明提供了用于检测细胞群体中的心房中胚层的方法,其包括检测ALDH,优选RALDH2,其中ALDH,优选RALDH2的存在指示心房中胚层。
在一个方面,本发明提供了用于检测细胞群体中的心室中胚层的方法,其包括检测CD235a、CD235b和CYP26A1中的一种或多种,其中CD235a、CD235b和/或CYP26A1的存在指示心室中胚层。
根据下述详细描述,本公开的其它特征和优点将变得显而易见。然而,应当理解,在指示本公开的优选实施例的同时,详细描述和具体例子仅以说明的方式给出,因为在本公开的精神和范围内的各种变化和修改根据该详细描述对于本领域技术人员将变得显而易见。
附图说明
现在将结合附图描述本公开的实施例。
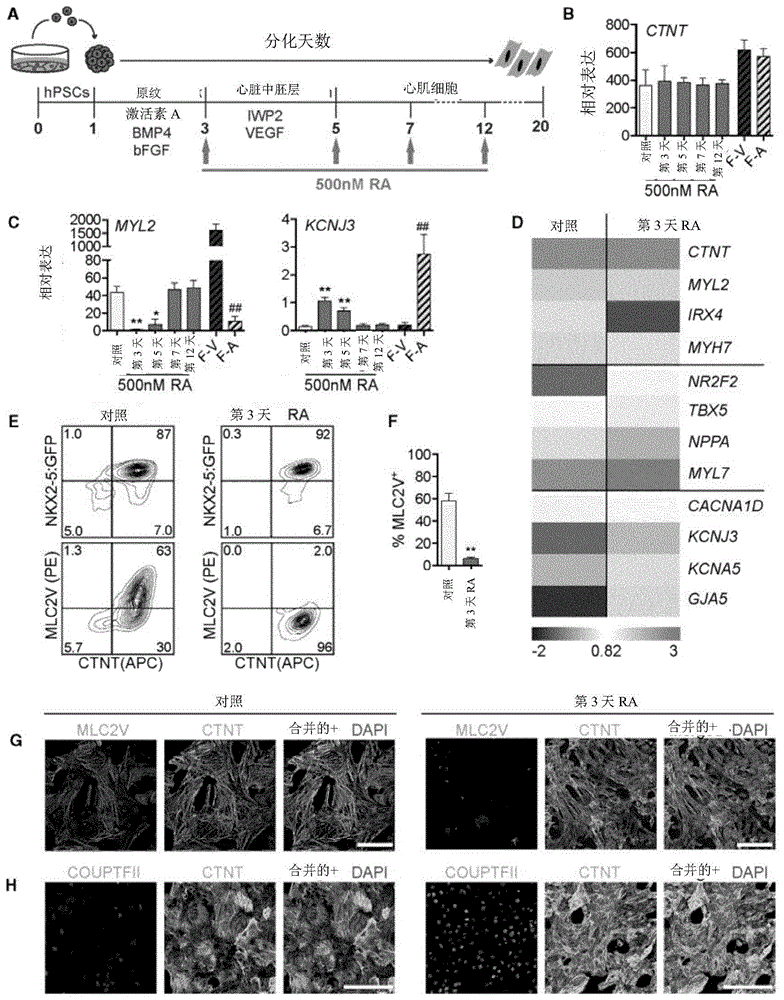
图1.RA信号传导促进心房样心肌细胞发育。(A)hPSC心肌细胞分化方案的示意图,其指示RA添加的发育阶段和时机。(B和C)从第20天EB群体中分离的NKX2-5+SIRPa+CD90-细胞和胎儿组织对照(n=6)中的(B)泛心肌细胞基因以及(C)心室特异性(MYL2)和心房特异性(KCNJ3)基因的表达水平的qRT-PCR分析,所述EB群体用10ng/mL BMP4和6ng/mL激活素A(10B/6A)诱导,并且在指示时间点用RA处理(n=3)(t检验,相对于DMSO对照,*p<0.05和**p<0.01,以及相对于F-A,##p<0.01F-V)。(D)比较从第20天EB(10B/6A诱导的)中分离且在第3天和第5天之间用RA或DMSO(对照)处理的NKX2-5+SIRPa+CD90-细胞的基因表达谱的热图(n=5)。值代表相对于管家基因TBP的表达水平log10。(E)用10B/6A诱导且在第3天和第5天之间用RA或DMSO(对照)处理的第20天EB群体中,NKX2-5+/CTNT+和MLC2V+/CTNT+细胞的比例的代表性流式细胞术分析。(F)显示如所示处理的第20天EB中的MLC2V+CTNT+细胞的平均比例的条形图(t检验,相对于DMSO对照,**p<0.01;n=4)。(G和H)显示在第3天和第5天之间用DMSO(对照)或RA处理的第20天EB(10B/6A诱导的)中的(G)MLC2V和(H)COUPTFII免疫染色的显微照片。细胞用鉴定所有心肌细胞的CTNT和显现所有细胞的DAPI共染色。比例尺代表100mm。对于所有PCR分析,表达值针对管家基因TBP进行标准化。误差条代表SEM。F-V,胎儿心室组织;F-A,胎儿心房组织。还参见图8。
图2.ALDH+生心中胚层的诱导(A)在10B/6A诱导的EB上的PDGFRα+中胚层中的ALDH活性的代表性流式细胞术分析。ALDH抑制剂(DEAB)处理的细胞用作对照。(B和C)在(B)激活素A浓度(在10ng/mL BMP4的存在下0,110ng/mL或(C)BMP4浓度(在2ng/mL激活素A的存在下1-10ng/mL)操纵后(第1-3天)后,第4天ALDH活性和PDGRα表达(左列)以及相应的第20天CTNT表达的代表性流式细胞术分析。(D)用3B/2A诱导的EB中ALDH活性和PDGFRα表达的代表性流式细胞术分析。(E)在10B/6A和3B/2A诱导的EB群体中ALDH1A2和CYP26A1的表达水平的qRT-PCR分析(t检验,*p<0.05和**p<0.01相对于在相应的分化日10B/6A诱导的EB;n=4)。对于所有PCR分析,表达值针对管家基因TBP进行标准化。误差条代表SEM。还参见图9。
图3.视黄醇将AF+中胚层指定为心房命运(A)用于分离和分析从用3B/2A诱导的第4天EB中分离的ALDH+PDGFRα+(级分I)和ALDH-PDGFRα+(级分II)级分的生心潜力的策略的示意图。(B)显示了用于分离ALDH+PDGFRα+(级分I)和ALDH-PDGFRα+(级分II)级分的细胞分选策略的代表性流式细胞术图。(C)上述分离群体内的ALDH1A2表达的qRT-PCR分析(t检验,**p<0.01;n=3)。(D和E)从ROH-、RA-或DMSO(对照)处理的第4天ALDH+PDGFRα+和ALDH-PDGFRα+级分生成的第20天群体中的(D)CTNT+和(E)MLC2V+细胞比例的流式细胞术分析(t检验,*p<0.05和**p<0.01相对于DMSO对照;n=6)。(F和G)在指示处理组的第20天群体中的(F)心室和(G)心房基因的表达水平的qRT-PCR分析(n=6)(t检验,*p<0.05和**p<0.01相对于DMSO对照)。对于所有PCR分析,表达值针对管家基因TBP进行标准化。误差条代表SEM。WNTi,WNT抑制;ROH,视黄醇。还参见图10。
图4.CD235a表达标记物具有心室电位的中胚层(A)用10B/6A(上图)或3B/2A(下图)诱导的EB中的CD235a表达和ALDH活性的代表性流式细胞术分析。(B)显示了用于在第4天时从5B/4A诱导的EB中分离的CD235a+(级分III,心室电位)和ALDH+(级分IV,心房电位)级分的细胞分选策略的代表性流式细胞术图。(C和D)由用ROH、RA或DMSO(对照)处理24小时的第4天ALDH+和CD235a+级分生成的第20天群体中的(C)CTNT+和(D)MLC2V+细胞比例的流式细胞术分析(t检验,*p<0.05和**p<0.01相对于DMSO对照,以及##p<0.01相对于所示样品;n=5)。(E和F)从如所示处理的第4天ALDH+和CD235a+级分生成的第20天群体中的(E)心室和(F)心房基因的表达水平的qRT-PCR分析(n=5)(t检验,*p<0.05和**p<0.01相对于DMSO对照,以及#p<0.05和##p<0.01相对于所示样品)。对于所有PCR分析,表达值针对管家基因TBP进行标准化。误差条代表SEM。还参见图11。
图5CD235a+生心中胚层诱导的优化(A和B)(A)在10ng/mL BMP4的存在下的激活素A浓度(2-20ng/mL)或(B)在12ng/mL激活素的存在下的BMP4浓度(3-20ng/mL)操纵(第1-3天)后,第4天ALDH活性和CD235a表达(左列)以及相应的第20天MLC2V和CTNT表达(右列)的代表性流式细胞术分析。(C)显示了第4天5B/12A-(上图)和3B/2A-诱导的EB(下图)中的ALDH活性和CD235a表达的比例的代表性流式细胞术图。(D和E)来自用ROH、RA或DMSO(对照)处理48小时(第3-5天)的5B/12A-或3B/2A诱导的EB的第20天EB群体中的(D)CTNT+和(E)MLC2V+细胞比例的流式细胞术分析(t检验,*p<0.05和**p<0.01相对于DMSO对照;n=4)。(F和G)用所示处理生成的第20天EB群体中的(F)心室和(G)心房基因的表达水平的qRT-PCR分析(n=4)(t检验,*p<0.05和**p<0.01相对于DMSO对照)。(H)用5B/12A或3B/2A诱导的第20天EB群体中的NKX2-5-CTNT+细胞比例的代表性流式细胞术分析。(I)用5B/12A或3B/2A诱导的第20天EB的自发搏动频率的定量(n=17)(t检验,**p<0.01)。(J)显示了在RA(0.5mM,第3-5天)的存在或不存在下,用5B/12A、10B/6A或3B/2A(第1-3天)诱导的第20天EB群体中的NKX2-5-CTNT+细胞的平均比例的条形图(t检验,*p<0.05相对于所示样品;n=5)。对于所有PCR分析,表达值针对管家基因TBP进行标准化。误差条代表SEM。还参见图12。
图6源自不同中胚层群体的心肌细胞的比较(A和B)从在心室诱导(VI)、混合诱导(MI也称为MM)和心房诱导(AI)条件下(n=5)以及在胎儿组织对照(n=6)中诱导的第20天EB中分离的NKX2-5+SIRPa+CD90-细胞中的(A)泛心肌细胞和(B)心室基因的表达水平的qRT-PCR分析(t检验,*p<0.05和**p<0.01相对于所示样品,##p<0.01F-V相对于F-A)。(C)从第20天未处理或如所示诱导的RA处理的EB(第3-5天)分离的NKX2-5+SIRPa+CD90-细胞中的心房基因的表达水平的qRT-PCR分析(n=4)(t检验,*p<0.05和**p<0.01VI相对于VI+RA。(D)显示了从用VI+RA或AI+RA诱导的20天EB中分离的NKX2-5+SIRPa+CD90-细胞中的COUPTFII的免疫染色的显微照片。细胞用鉴定所有心肌细胞的CTNT和显现所有细胞的DAPI共染色。比例尺代表100mm。(E-G)从如所示诱导的20天EB中分离的NKX2-5+SIRPa+CD90-心肌细胞中的AP测量。(E)从所示组中分离的各个心肌细胞中的自发性AP的代表性记录。(F)从VI(n=18)、VI+RA(n=18)和AI+RA(n=20)EB中分离的心肌细胞中在30%/90%复极化(APD30/90)下的AP持续时间的定量(t检验,*p<0.05和**p<0.01相对于所示样品)。(G)显示了基于记录的AP的分析,每组中的心房(APD30/90<0.3)、心室(APD30/90R 0.3)和不成熟(最大去极化速度[dv/dtmax]<10和周期长度[CL]R 1)心肌细胞比例的条形图。(H-J)从如所示诱导的EB中分离的心肌细胞中的乙酰胆碱激活的内向整流钾电流密度(IKACh)的分析。(H)显示了从AI+RA诱导的EB中分离的心肌细胞中的卡巴胆碱(CCh)敏感电流(IKACh)的代表性记录,所述IKACh定量为在10mM CCh应用(CCh)之后和之前(对照)测量的电流之间的差异(插图:电压方案)。(I)从VI EB中分离的心室心肌细胞(验证的心室样AP形状)、以及从VI+RA和AI+RA EB中分离的心房心肌细胞(验证的心房样AP形状)中的IKACh电流密度的电流-电压关系。(J)每组中在-120mV下记录的最大IKACh电流密度的定量(t检验,*p<0.05,**p<0.01相对于所示样品)。对于所有PCR分析,表达值针对管家基因TBP进行标准化。误差条代表SEM。F-V,胎儿心室组织;F-A,胎儿心房组织;n.s.,不显著。还参见图13。
图7.来自其它hPSC系的心室心肌细胞和心房心肌细胞的生成(A)在心室(5B/6A,上图)或心房(5B/2A,下图)条件下诱导的第4天HES2衍生的EB中的ALDH活性和CD235a表达的代表性流式细胞术分析。(B)在心室条件或心房条件下生成,且从第3天到第5天经受ROH、RA或DMSO(对照)处理的相应第20天EB群体中的CTNT和MLC2V表达的代表性流式细胞术分析。(C和D)从在所示条件下诱导的第20天EB中分离的SIRPa+CD90-细胞中的(C)心室基因和(D)心房基因的表达水平的qRT-PCR(t检验,*p<0.05相对于DMSO对照,#p<0.05和##p<0.01相对于所示样品;n=5)。(E)在心室(4B/4A,上图)或心房(4B/1A+SB,下图)条件下诱导的第4天MSC-iPS1衍生的EB中的ALDH活性和CD235a表达的代表性流式细胞术分析。(F)在心室或心房条件下生成,且从第3天到第5天经受ROH、RA或DMSO(对照)处理的相应第20天EB群体中的CTNT和MLC2V表达的代表性流式细胞术分析。(G和H)从如所示诱导的第20天EB中分离的SIRPa+CD90-细胞中的(G)心室基因和(H)心房基因的表达水平的qRT-PCR分析(t检验,*p<0.05和**p<0.01相对于DMSO对照,##p<0.01相对于所示样品;n=5)。(I)来自hPSC的人心房和心室心肌细胞发育模型。在该模型中,由不同浓度的激活素A和BMP4诱导由CD235a和CYP26A1表达或RALDH2表达和ALDH活性限定的不同中胚层群体。RALDH2+ALDH+,但不是CD235a+CYP26A1+,中胚层可以响应ROH以生成心房样心肌细胞。RA可以将两个中胚层群体指定为心房命运。然而,来自CD235a+中胚层的指定效率低于RALDH2+中胚层,并且所得到的心房表型不是亚最佳的。在不存在类视黄醇信号传导(ROH,RA)的情况下,RALDH2+中胚层可以以低效率产生心室心肌细胞。对于所有PCR分析,表达值针对管家基因TBP进行标准化。误差条代表SEM。SB,SB-431542(结节/激活素A/TGF-b抑制剂);WNTi,WNT抑制。还参见图14。
图8.与图1相关。从hPSC生成心房样心肌细胞。(A)显示用了于在分化的第20天分离SIRPα+NKX2-5+CD90-心肌细胞的细胞分选策略的代表性流式细胞式图。(B-E)QRT-PCR分析的图在图1D中表示为热图,显示了以下的表达水平:从用10B/6A诱导的EB中分离,且在分化的第3天和第5天之间用RA或DMSO(对照)处理的SIRPα+NKX2-5+CD90-心肌细胞中的(B)泛心肌细胞、(C)心室心肌细胞、(D)心房心肌细胞、(E)心脏离子通道和连接蛋白通道基因(n=5)。t检验:*P<0.05,**P<0.01相对于DMSO对照,##P<0.01F-V相对于F-A。(F)在所示分化天数时,用10B/6A诱导的整个EB群体中的视黄酸受体同种型(RARA、RARB和RARG)的表达水平的QRT-PCR分析(n=3)。(G)在第3-5天之间用DMSO(对照)、RA或受体特异性激动剂处理的第20天EB中的CTNT+细胞比例的流式细胞术分析(n=3)。(H)在第3天和第5天之间用所示处理进行处理的第20天EB中的心室特异性基因MYL2的表达水平的QRT-PCR分析(n=3)。t检验:**P<0.01相对于DMSO对照。对于所有PCR分析,表达值针对管家基因TBP进行标准化。误差条代表SEM。F-V:胎儿心室组织,F-A:胎儿心房组织,RA:视黄酸,AM580:RARα-激动剂,AC55649:RARβ-激动剂,CD437:RARγ-激动剂。
图9.与图2相关。10B/6A和3B/2A诱导的中胚层的发育动力学。(A)显示了用3B/2A和10B/6A诱导的EB(第20天)的6孔板每孔生成的平均细胞数目的条形图(n=5)。(B)在用3B/2A或10B/6A诱导(第1-3天)后,在所示分化天数时,EB中的ALDH1A1和ALDH1A3醛脱氢酶同种型的表达动力学的QRT-PCR分析(n=3)。(C)在用3B/2A或10B/6A诱导(第1-3天)后,在所示分化天数时,EB中的原条标记物T(Brachyury)和生心中胚层标记物MESP1的表达动力学的QRT-PCR分析(n=4)。对于所有PCR分析,表达值针对管家基因TBP进行标准化。误差条代表SEM。
图10.3B/2A诱导的中胚层群体中的ALDH活性。作为从用3B/2A诱导的第4天EB中分离的ALDH+PDGFRα+(级分I)和ALDH-PDGFRα+(级分II)细胞的聚集体培养24小时后,ALDH活性的代表性流式细胞术分析。
图11.未分选和分选的中胚层群体中的GYPA表达的分析。(A)在所示分化天数时,3B/2A和10B/6A诱导的EB中的GYPA表达水平的QRT-PCR分析,t检验:**P<0.01相对于所示样品(n=4)。(B)从用5B/4A诱导的第4天EB中分离的ALDH+(级分IV)和CD235a+(级分III)级分中的ALDH1A2、CYP26A1和GYPA的表达水平的QRT-PCR分析。对于所有PCR分析,表达值针对管家基因TBP进行标准化。t检验:**P<0.01(n=3)。误差条代表SEM。
图12.通过操纵中胚层诱导来优化心室分化。
(A和B)在以下操纵(第1-3天)后,在第4天EB中的CD235a+细胞比例(左)和在第20天EB中所得到的CTNT+MLC2V+细胞比例(右)的流式细胞术分析:(A)在10ng/ml BMP4的存在下的激活素A浓度(2-20ng/ml),或(B)在12ng/ml激活素A的存在下的BMP4浓度(3-20ng/ml)(n=6)。t检验:*P<0.05,**P<0.01相对于所示样品。(C)显示了用5B/12A或10B/6A诱导的EB(第20天)的6孔板每孔生成的平均细胞数目的条形图(n=4)。t检验:P>0.05=n.s.,不显著。(D)如所示诱导的EB群体中,在培养的第20天和第40天时的CTNT+MLC2V+细胞比例的流式细胞术分析(n=3)。t检验:P>0.05=n.s.,不显著。误差条代表SEM。
图13.源自不同中胚层群体的心房心肌细胞和心室心肌细胞的表征。(A)在心室诱导(VI)、混合诱导(MI)和心房诱导(AI)条件下诱导的第20天EB中的MLC2V+细胞比例的流式细胞术分析。t检验:**P<0.01相对于所示样品。(B)显示了在由AI和VI生成的第20天EB群体中的MLC2V的免疫染色的显微照片。细胞用鉴定所有心肌细胞的CTNT和显现所有细胞的DAPI共染色。比例尺代表100μm。(C和D)从如所示诱导的第20天EB群体(n=4)和胎儿组织对照(n=6)中分离的NKX2-5+SIRPα+CD90-细胞中的(C)心房和(D)起搏器基因的表达水平的QRT-PCR分析。t检验:*P<0.05,**P<0.01VI相对于VI+RA;AI相对于AI+RA和相对于所示样品,##P<0.01F-V相对于F-A。(E)在VI或AI条件下诱导,且在第3天和第5天之间用所示浓度的RA(0.125-4μΜ)处理的第20天EB中的NKX2-5+SIRPα+细胞比例的流式细胞术分析(n=3)。(F-H)从不同的第20天群体分离的NKX2-5+SIRPα+细胞中的(F)心房基因KCN5A、(G)心室基因MYL2、IRX4以及(H)心房基因KCNJ3、CACNA1D和NR2F2的表达水平的QRT-PCR分析。t检验:在分别的RA浓度(n=4)下,*P<0.05,**P<0.01相对于VI样品。对于所有PCR分析,表达值针对管家基因TBP进行标准化。误差条代表SEM。F-V:胎儿心室组织,F-A:胎儿心房组织,n.s.:不显著。
图14源自HES2和MSC-iPS1hPSC的心房心肌细胞和心室心肌细胞的表征。(A)用4B/1A诱导且随后用或不用SB-431542(SB)处理(第3-5天)的MSC-iPS1衍生的EB中的ALDH活性和CD235a表达的代表性流式细胞术分析。(B-D)从在心室(5B/6A)或心房(5B/2A)条件(第1-3天)下诱导,且在第3天和第5天之间用ROH、RA或DMSO(对照)处理的第20天HES2衍生的EB群体中分离的SIRPα+CD90-细胞中的(B)泛心肌细胞、(C)心室和(D)心房基因的表达水平的QRT-PCR分析。t检验:*P<0.05,**P<0.01相对于DMSO对照,#P<0.05,##P<0.01相对于指示样品(n=5)。(E-G)从在心室(4B/4A)或心房(4B/1A+SB)条件(第1-3天)下诱导,且在第3天和第5天之间用ROH、RA或DMSO(对照)处理的第20天MSC-iPS1衍生的EB群体中分离的SIRPα+CD90-细胞中的(E)泛心肌细胞、(F)心室和(G)心房基因的表达水平的QRT-PCR分析。t检验:*P<0.05,**P<0.01相对于DMSO对照,##P<0.01相对于指示样品(n=5)。对于所有PCR分析,表达值针对管家基因TBP进行标准化。误差条代表SEM。SB:SB-431542(结节/激活素A/TGF抑制剂)
图15.描绘心脏细胞的各种分化途径的示意图。
具体实施方式
定义
如本文使用的,术语“心室心肌细胞”指富含心室细胞或富含具有心室细胞特性的细胞的细胞群体。这些包括表达心室特异性标记物如MYL2、IRX4和/或升高水平的NKX2-5和/或展示心室细胞的电生理特性(例如动作电位)的心肌细胞。
如本文使用的,术语“心房心肌细胞”指富含心房细胞或富含具有类似心房细胞特性的细胞的细胞群体。这些包括表达心房特异性标记物,例如心房离子通道基因KCNJ3、NPPA、GJA5和/或MYL7和/或展示心房细胞的电生理特性(例如动作电位)的心肌细胞。
如本文使用的,术语“心血管中胚层细胞”和“心血管中胚层”指富含中胚层细胞的中胚层细胞群体,所述中胚层细胞相对于其它中胚层细胞具有增加的分化成心血管细胞的潜力。
如本文使用的,术语“心室中胚层细胞”和“心室中胚层”指包含富含中胚层细胞的中胚层细胞的群体,所述中胚层细胞相对于其它中胚层细胞具有增加的分化成心室心肌细胞的潜力。这些包括其为ALDH-、RALDH2-CD235a+、CD235b+和CYP26A1+中的一种或多种的中胚层细胞。
如本文使用的,术语“心房中胚层细胞”和“心房中胚层”指包含富含中胚层细胞的中胚层细胞的群体,所述中胚层细胞相对于其它中胚层细胞具有增加的分化成心房心肌细胞的潜力。这些包括其为ALDH+、RALDH2+、CD235a、CD235b-和CYP26A1中的一种或多种的中胚层细胞。
如本文使用的,术语“心肌细胞”是心脏谱系细胞。心脏谱系细胞通常表达泛心脏特异性标记物cTNT。
如本文使用的,术语“起搏细胞”指心肌细胞,其具有起搏器活性且表达窦房结(SAN)细胞特异性标记物。起搏细胞一般具有比心室心肌细胞更快的搏动频率。起搏细胞不表达NKX2-5。
如本文使用的,术语“NKX2-5”指由NKX2-5基因在人中编码的心脏同源框蛋白NKX2-5。该基因涉及心脏分化,并且在心肌细胞亚型例如心室心肌细胞中表达。NKX2-5的表达可以使用例如对于NKX2-5特异性的抗体或例如通过使用NKX2-5报道构建体来测量。
如本文使用的,术语“BMP组分”意指激活BMP4受体包括例如BMP4和/或BMP2的任何分子,任选任何BMP或者生长和分化因子(GDF)或小分子。
如本文使用的,术语“BMP4”(例如基因ID:652)指骨形态发生蛋白4,例如人BMP4,以及其活性缀合物和/或片段,其可以例如激活BMP4受体信号传导。
如本文使用的,术语“基本上不含起搏细胞”指心肌细胞群体,其中起搏细胞包含总细胞的小于5%、小于1%的起搏细胞、小于0.5%的起搏细胞、小于0.1%的起搏细胞、小于0.01%的起搏细胞、小于0.001%的起搏细胞、或小于0.0001%的起搏细胞,完全缺乏起搏细胞,或者其中起搏细胞经由现有可用的检测方法在心肌细胞群体中无法检测到。虽然不希望受任何理论束缚,但假定心室细胞群体中起搏细胞的存在可以在引入患者时诱导独立和分开的肌肉收缩。
如本文使用的,术语“激活素组分”意指一种或多种组分,或者包含所述组分的组合物,其激活结节信号转导,任选地其具有激活素A活性,例如激活素A和/或结节。
如本文使用的,术语“激活素”或“ActA”指“激活素A”,(例如基因ID:3624),例如人激活素A,以及其活性缀合物和片段或小分子,其可以激活结节信号转导。
术语“视黄酸”或“RA”指示视黄酸。
术语“视黄酸组分”包括介导维生素A功能的化合物,并且包括例如全反式RA(例如Sigma R2625)、9-顺式RA(例如Sigma R4643)和视黄醇(例如Sigma R7632)以及RA类似物(例如RAR激动剂),如AM580、选择性RARα激动剂(Tocris 0760)、AC55649、选择性RARβ激动剂(Tocris2436)和CD437、选择性RARγ激动剂(Tocris 1549)。
如本文使用的,术语“胚状体培养基”是支持PSC的聚集体(例如具有分化成所有三个胚层的细胞的潜力的PSC的漂浮聚集体)或胚状体形成的培养基,并且包含最小培养基,例如StemPro 34(ThermoFisher)、MesoFateTM(Stemgent)、RPMI(ThermoFisher及其它公司)、HES培养基(含有KnockOut Serum Replacement的DMEM/F12,ThermoFisher及其它公司)和例如BMP组分,任选BMP4,并且还任选包含Rho相关蛋白激酶(ROCK)抑制剂。
如本文使用的,术语“胚状体聚集阶段”意指非聚集的hPSC例如用本文所述的胚状体培养基培养,并且用BMP组分以及任选的ROCK抑制剂和/或导致聚集体,例如胚状体(例如,可以分化成所有三个胚层的细胞的PSC的聚集体)的其它组分处理的时间段。组分处理可以是同时的、重叠的或不同的。例如,第一组分可以包含在培养基中,并且第二组分可以在胚状体聚集阶段期间添加到培养基中。
术语“中胚层诱导培养基”可以包括支持心血管中胚层细胞形成的培养基,并且包含最小培养基,例如StemPro 34(ThermoFisher)、MesoFateTM(Stemgent)、RPMI(ThermoFisher及其它公司)。中胚层诱导培养基可以包括另外的组分,例如BMP组分,任选BMP4,激活素组分,任选激活素A,并且可以包括其它组分,例如bFGF。取决于由中胚层产生的心肌细胞的所需命运,可以如本文所教导的调节BMP组分和激活素组分各自的不同浓度。
术语“中胚层诱导阶段”可以描述其中PSC用中胚层诱导培养基培养,包括用BMP组分和激活素组分以及任选的FGF组分和/或其它组分处理,使得PSC分化成中胚层细胞的时间段。BMP和激活素组分处理可以是同时的、重叠的或不同的。例如,第一组分可以在中胚层诱导开始时包括在培养基中,并且第二组分可以在中胚层诱导阶段期间添加到培养基中。
术语“心脏诱导培养基”可以包括支持从中胚层细胞诱导心脏祖细胞的培养基,例如包含例如WNT抑制剂,任选IWP2,VEGF和/或任选的激活素/结节抑制剂,任选SB-431542的StemPro-34最小培养基。取决于所需的细胞类型,心脏诱导培养基还可以包含BMP组分、视黄酸、FGF抑制剂或FGF组分。心脏诱导培养基(也称为标准心脏诱导培养基)的一个实施例是含有0.5μM IWP2、10ng/ml VEGF和任选5.4μM SB-431542的StemPro-34最小培养基。可以使用的其它最小培养基包括MesoFateTM(Stemgent)和RPMI(ThermoFisher及其它公司)。
术语“心脏诱导阶段”可以用于描述其中当用心脏诱导培养基培养,并且例如用BMP组分和RA以及任选的FGF抑制剂或FGF组分和/或导致心血管祖细胞的其它组分处理时,诱导中胚层细胞分化成心脏祖细胞的时间段。处理可以是同时的、重叠的或不同的。例如,第一组分可以包含在培养基中,并且第二组分可以在心脏诱导阶段期间添加到培养基中。
术语“基础培养基”可以包括支持心血管祖细胞和心肌细胞生长的培养基,其包含最小培养基,例如StemPro 34(ThermoFisher)、MesoFateTM(Stemgent)、RPMI(ThermoFisher及其它公司)和例如VEGF。实例1中提供了基础培养基的例子。
术语“基础阶段”可以用于指心血管祖细胞用基础培养基培养,并且用VEGF和/或导致心肌细胞的其它组分处理的时间段。处理可以是同时的、重叠的或不同的。
术语“温育”可以包括维持和/或繁殖细胞群体的任何体外方法,包括单层、珠、烧瓶或3D培养物,任选地,其中如在培养箱中控制环境条件并且任选地涉及细胞的传代。在涉及将细胞与一种或多种组分一起温育的步骤中,组分可以同时、在不同时间、对于重叠时期或不同时期加入。在细胞已开始在例如诱导培养基中培养之后,可以将因子添加到培养基中,或者可以在将培养基加入细胞之前,将因子加入培养基中。此外,可以在温育之间洗涤细胞,例如以减少来自先前温育的组分水平。
术语“培养”可以包括使细胞群体维持和繁殖至少通过一次细胞分裂的任何体外方法,包括单层、珠、烧瓶或3D培养物,任选地,其中如在培养箱中控制环境条件。
如本文使用的,术语“富含”意指包含至少50%、至少60%、或至少70%直到100%的富集细胞类型。在一个实施例中,使用本文所述的方法在第20天培养物中测量富集。
如本文使用的,术语“受试者”包括动物界的所有成员,包括哺乳动物,并且适当地指人。
当应用于细胞时,术语“处理(treat)”、“处理(treating)”、“处理(treatment)”等包括使细胞经受任何种类的过程或条件或者对细胞执行任何种类的操纵或程序。
如本文使用的,当应用于受试者时,术语“治疗”指旨在获得有益或所需结果包括临床结果的方法,并且包括医疗程序和应用,包括药物或其它产物干预。在一个实施例中,治疗指用于植入目的产物施用。有益或所需的临床结果可以包括但不限于减轻或改善一种或多种症状或状况,减轻疾病程度,稳定(即不恶化)疾病状态,预防疾病传播,延迟或减缓疾病进展,改善或缓和疾病状态,以及缓解(无论是部分还是全部),无论是可检测的还是不可检测的。“治疗”还意指与如果不接受治疗的预期存活相比的延长存活。
如本文使用的,术语“心力衰竭”指其中受试者的心脏不能充分泵送以维持受试者体内的合适血流的状况。“处于心力衰竭的风险中”的受试者指具有已知在心力衰竭之前的一种或多种特征的受试者。例如,处于心力衰竭的风险中的受试者可能患有或已患有冠状动脉疾病、先前的心肌梗塞(心脏病发作)、高血压、心房颤动、心脏瓣膜病、过量饮酒、吸烟、肥胖、睡眠呼吸暂停、感染(病毒和/或细菌)、心肌病、心肌炎、先天性心脏缺损、心律失常和/或其它疾病例如但不限于糖尿病、甲状腺机能亢进、甲状腺机能减退、血色素沉着症和/或淀粉样变性。
如本文使用的,术语“心肌梗塞”和“MI”指其中血流减少或停止至心脏的部分的事件,从而由于氧供应的缺乏(缺血)而引起心肌细胞死亡,导致对心肌的损害。
如本文使用的,术语“施用”、“引入”和“移植”在通过导致所引入的细胞在所需部位处的至少部分定位的方法或途径将细胞递送到受试者内的背景下可互换使用。
如本文使用的,术语“多能干细胞”或“PSC”指在不同条件下具有分化成三种生殖细胞层特征性的任何一种细胞类型的能力的细胞,并且包括胚胎干细胞和诱导多能干细胞。多能细胞的特征在于它们使用例如裸鼠畸胎瘤形成测定分化成多于一种细胞类型的能力。多能性还通过胚胎干(ES)细胞标记物的表达加以证明。如本文使用的,多能干可以包括诱导多能干细胞(iPSC)和胚胎干细胞(ESC)。
在一个实施例中,术语“胚胎干细胞”排除了涉及破坏胚胎(例如人胚胎)的干细胞。
如本文使用的,术语“iPSC”和“诱导多能干细胞”可互换使用,并且指例如通过诱导一种或多种基因(包括例如与SOX2(基因ID;6657)、KLF4(基因ID;9314),cMYC(基因ID;4609)、NANOG(基因ID;79923)、LIN28/LIN28A(基因ID;79727)(但不限于此)组合的POU4F1/OCT4(基因ID;5460))的表达,从非多能细胞(通常为成人体细胞)人工衍生(例如,诱导或完全逆转)的多能干细胞。
通过本发明的方法制备、富集或分离的心肌细胞源自多能干细胞。例如,患者的细胞可以在使用前通过引入基因进行遗传修饰,所述基因可以在其暴露于本文所述的分化因子之前、期间或之后控制其分化状态。源自患者的自身组织、适用于本文所述方法中的多能干细胞,增强了源自干细胞的分化组织移植物与患者的相容性。
术语“胚胎干细胞”用于指胚胎胚泡的内细胞团的多能干细胞(参见例如,美国专利号5,843,780、6,200,806)。此类细胞还可以从源自体细胞核移植的胚泡的内细胞团获得(参见例如,美国专利号5,945,577、5,994,619、6,235,970)。胚胎干细胞的区别性特征限定了胚胎干细胞表型。相应地,如果细胞具有胚胎干细胞的一种或多种独特特征,使得该细胞可以与其它细胞区分开,则它具有胚胎干细胞的表型。示例性区别性胚胎干细胞特征包括但不限于基因表达谱、增殖能力、分化能力、对特定培养条件的响应性等等。
如本文使用的,多能干细胞还可以通过引入在干细胞特异性启动子(例如Oct-4),或可能被上调以诱导心肌细胞分化的基因的控制下表达可选择标记物的载体进行遗传修饰。干细胞可以在任何阶段用标记物或基因进行遗传修饰,使得标记物或基因进行到任何培养阶段。标记物可以用于在培养的任何阶段纯化或富集分化的或未分化的干细胞群体。
如本文使用的,术语“药学可接受的载体”包括基本上化学惰性和无毒的组合物,其不干扰药物组合物的生物活性的有效性。合适的药物载体的例子包括但不限于水、盐水溶液、甘油溶液、乙醇、N-(1(2,3-二油氧基)丙基)N,N,N-三甲基氯化铵(DOTMA)、二油酰磷脂酰乙醇胺(DOPE)和脂质体。此类组合物应该含有治疗有效量的化合物,连同合适量的载体,以便提供直接施用于受试者的形式。
在理解本公开的范围时,如本文使用的,术语“浓度”指培养基中物质例如BMP4、激活素A、视黄酸的最终浓度。除非另有说明,否则浓度基于重量/体积比。
如本文使用的,诸如“基本上”、“约”和“大约”的程度术语意指修饰术语的合理偏差量,使得最终结果不显著改变。这些程度术语应该解释为包括修饰术语的至少±5%的偏差,如果该偏差不否定其修饰词的含义。
本文中通过端点叙述的数字范围包括该范围内包含的所有数字和分数(例如1至5包括1、1.5、2、2.75、3、3.90、4和5)。还应理解,所有数字及其分数推测由术语“约”修饰。此外,应理解,除非内容另有明确说明,否则“一个”、“一种”和“该/所述”包括复数指示物。术语“约”意指参考数字的正或负0.1至50%、5-50%或10-40%,优选10-20%,更优选10%或15%。
此外,特定节段中描述的定义和实施例预期适于如本领域技术人员所理解的对于它们合适的本文所述的其它实施例。例如,在下述段落中,更详细地定义了本发明的不同方面。除非明确指出相反,否则如此定义的每个方面可以与任何其它一个或多个方面组合。特别地,指示为优选或有利的任何特征可以与指示为优选或有利的任何其它一个或多个特征组合。
方面和实施例
在一个方面,本发明提供了产生富含心房心肌细胞的心肌细胞群体的方法,所述步骤包括:i.在适合生成聚集体和/或胚状体的培养基中温育多能干细胞,ii.进一步在适合于中胚层诱导的培养基中温育干细胞,其中所述培养基至少包括BMP组分,任选BMP4和激活素组分,任选激活素A,其中BMP组分与激活素组分以3:2的比率提供;iii.进一步向细胞中添加视黄酸组分,所述视黄酸的添加在中胚层诱导或心血管特化阶段期间加入;iv.在合适的培养基中继续所述细胞的生长以生成心肌细胞群体,其中所述心肌细胞群体富含心房心肌细胞。在一些实施例中,BMP与激活素的比率为1.5:1.0(或3:2)。
在一些实施例中,所述BMP组分是BMP4,激活素组分是激活素A,BMP4的浓度是3ng/ml,且激活素A的浓度是2ng/ml。在一些实施例中,所述视黄酸组分是反式视黄酸并且以50nm和5μM之间的浓度添加。在一些实施例中,所述视黄酸组分以500nM的浓度添加。
在一些实施例中,在该方法的第1天时加入BMP组分和激活素组分。在一些实施例中,在该方法的第3天时加入视黄酸组分。在一些实施例中,在该方法的第3天时不将另外的BMP组分加入培养基中。
在一些实施例中,在该方法的第3天时从培养基中排除FGF抑制剂。在一些实施例中,通过该方法产生的细胞用于体外测定中,以筛选可能由潜在治疗化合物引起的心脏毒性。
在一个方面,本发明提供了富集心房心肌细胞的分离的心肌细胞群体,其包含至少或约50%的心房心肌细胞、至少或约60%的心房心肌细胞、至少或约70%的心房心肌细胞、至少或约80%的心房心肌细胞、或者,至少或约90%的心房心肌细胞,优选根据本文所述的方法获得。在一个方面,本发明提供了产生富含心室心肌细胞的心肌细胞群体的方法,所述步骤包括:i.在适合生成聚集体(胚状体)的培养基中温育多能干细胞,ii.在适合于中胚层诱导的培养基中温育聚集的干细胞,其中所述培养基至少包括BMP组分,任选BMP4和激活素组分,任选激活素A,其中激活素组分的浓度大于BMP组分的浓度;iii.在合适的培养基中继续所述细胞的生长以生成心肌细胞群体,其中所述心肌细胞群体富含心室心肌细胞。在一些实施例中,BMP与激活素的比率为约0.3:1.0、约0.5:1.0(或1:2)或约0.8:1.0。
在一些实施例中,通过测量CD235a的水平并且将其与RALDH2的水平进行比较,来确定BMP组分和/或激活素组分的浓度。
在一些实施例中,激活素组分的浓度的选择是基于与表达RALDH2的中胚层细胞相比优先导致更多表达CD235a的中胚层细胞的浓度,并且添加BMP组分以达到比激活素组分的浓度更低的浓度。在一些实施例中,添加BMP组分以达到来自诱导中胚层的最佳心脏发生。
在一些实施例中,所述BMP组分是BMP4,激活素组分是激活素A,BMP4的浓度在3-20ng/ml之间,激活素A的浓度在4-20ng/ml之间,并且激活素A的浓度大于BMP4的浓度。在一些实施例中,BMP4的浓度为10ng/ml,且激活素A的浓度为12ng/ml。
在一个方面,本发明提供了分离的心肌细胞群体:富含心室心肌细胞,其包含至少或约30%的心室心肌细胞、至少或约40%的心室心肌细胞、至少或约50%的心室心肌细胞、至少或约60%的心室心肌细胞、至少或约70%的心室心肌细胞、至少或约80%的心室心肌细胞、或至少或约90%的心室心肌细胞,优选根据本文所述的方法获得。在一个实施例中,富含心室心肌细胞的分离的心肌细胞群体基本上不含起搏细胞。在一个优选实施例中,富含心室心肌细胞的分离的心肌细胞群体缺乏起搏细胞。
根据本发明的分离的心肌细胞群体可以用于筛选潜在治疗活性剂的潜在心脏毒性的方法中,所述治疗活性剂用于治疗心血管病症和任何其它病症。例如,它们提供了可以用于心血管应用的药物筛选中的细胞来源;它们提供了可以用于治疗目的的细胞来源—以恢复心脏功能;修复缺血性心脏和/或再生冠状动脉血管系统;它们可以用于其中需要心脏或冠状动脉血管系统组分的组织工程目的;并且它们可以充当用于研究心血管发育和疾病的研究工具。根据本发明的方法,用于筛选活性剂的分离的心肌细胞群体可以例如包括富含心室心肌细胞的心肌细胞群体。此类心室心肌细胞群体任选包括基本上不含起搏细胞或缺乏起搏细胞的群体。根据本发明的方法,用于筛选活性剂的分离的心肌细胞群体还可以包括富含心房心肌细胞的群体。用于筛选或评估测试化合物或试剂的潜在心脏毒性的此类方法涉及使根据本发明的心肌细胞群体暴露于待测试心脏毒性的化合物。评估的效应包括细胞的活力、收缩性、膜电位和/或其它功能的变化。
使用可以用于移植、细胞疗法或基因疗法的本发明方法产生心肌细胞和心肌细胞祖细胞群体。例如,本发明提供了使用可以用于治疗目的的本发明方法产生的分化细胞,例如在治疗需要心脏修复的受试者的方法中。例如,治疗性修复可以涉及在需要心脏修复的受试者(例如患有心脏病或心脏状况的受试者)中完全或部分地恢复心脏功能。
本发明的另一个方面是治疗或预防心脏病或心脏状况的方法。心脏病通常与心脏功能降低相关,并且包括状况例如但不限于心肌梗塞、心脏肥大和心律失常。在本发明的这个方面,该方法包括向需要心脏修复的受试者内引入本发明的分离的分化的心室心肌细胞和/或能够分化成心室心肌细胞的细胞。可以将分离的心肌细胞移植到受试者的受损心脏组织内。理想地,该方法导致患者中的一些或所有心脏功能的恢复。
在一个方面,本发明提供了治疗患有心力衰竭的受试者的方法,其包括向受试者施用本文所述的心室心肌细胞群体。在一些实施例中,所述受试者患有心肌梗塞。在一些实施例中,心肌梗塞在患者的心室中,并且群体如本文所述。
在一个方面,本发明提供了本文所述的心室心肌细胞群体,其用于治疗患有心力衰竭或处于心力衰竭的风险中的受试者。在一个方面,本发明提供了本文所述的心室心肌细胞群体在制备用于治疗患有心力衰竭或处于心力衰竭的风险中的受试者的药剂中的用途。
在本发明的再一个方面,本发明提供了修复心脏组织的方法,该方法包括当使用本发明的方法治疗时,将本发明的分离的心室心肌细胞或心脏祖细胞和/或能够分化成心室心肌细胞的细胞引入患者的受损心脏组织内。
患者可能患有心脏病或心脏状况。在本发明的修复心脏组织的方法中,可以将分离的心肌细胞移植到患者的受损心脏组织内。理想地,该方法导致患者中的至少一些心脏功能的恢复。
在一个实施例中,本文公开的心室心肌细胞在心肌梗塞后的急性期或心力衰竭的慢性期过程中施用于受试者。通过直接注射或基于导管的递送,将细胞施用于心室中的损伤部位。细胞可以与药学可接受的载体、水凝胶或支架一起配制,例如,以帮助组织中细胞的放置、存活和/或植入。细胞剂量范围可以包括例如每剂量约5亿至20亿个细胞。可以在一个或多个时间点以单剂量或多剂量将细胞施用于受试者,以便治疗受试者。
本发明优选地提供了用于测试干细胞的能力的心肌模型,所述干细胞已使用本发明的方法分化成心肌细胞或心脏祖细胞以恢复心脏功能。为了测试体内心肌细胞移植的有效性,重要的是具有可测量的心脏功能参数的可再现的动物模型。使用的参数应当清楚地区分对照动物和实验动物[参见例如Palmen等人(2001),Cardiovasc.Res.50,516-524中],使得可以充分确定移植的效应。PV关系是心脏泵血能力的量度,并且可以用作移植后改变的心脏功能的读出。
在一个方面,本发明提供了用于检测细胞群体中的心房中胚层的方法,其包括检测RALDH2,其中RALDH2的存在指示心房中胚层。在一个方面,本发明提供了用于检测细胞群体中的心室中胚层的方法,其包括检测CD235a和/或CYP26A1,其中CD235a和/或CYP26A1的存在指示心室中胚层。
本发明提供了分别基于ALDH,优选RALDH2和/或CD235a和/或CD235b,和/或CYP26A1表达用于鉴定心房中胚层或心室中胚层的本发明方法。更具体地,它们可以用于鉴定由中胚层细胞产生的分泌因子,其影响心房或心室细胞群体的心肌细胞增殖、存活、功能和分化。例如,用于鉴定心房心肌细胞或心室心肌细胞群体的本发明方法提供了在分子水平上理解心房和心室中胚层分化,以及鉴定调节分化的新药物靶(例如,信号传导途径)两者的系统。
根据本文公开的一个或多个实施例,视黄酸(RA)在特定的发育时间窗内指定心房心肌细胞,并且从第3-5天起RA向中胚层的应用指定心房心肌细胞。RA浓度范围:50nM-5uM。RA来源:全反式RA,视黄酸受体(RAR)激动剂(AM580用于-α,AC55649用于-β,CD437用于-γ)激动剂浓度:3-300nM用于AM580;0.025-2.5uM AC55649;0.05-5uM CD437。
RALDH2(视黄醇脱氢酶或Aldefluor)是心房中胚层的标记物。通过使用aldefluor测定来监测RALDH2+细胞的比例,以优化心房分化。分析天数:第2-6天。
在第1天时使用激活素A和BMP4的早期中胚层诱导确定在第4天时RALDH2+中胚层细胞的比例。诱导条件是低BMP(1-5ng/ml BMP)和低激活素A(0.1-4ng/ml),最常用的是3ng/ml BMP/2ng/ml激活素A(3B/2A)。
通过在第3-5天时用视黄醇(ROH)处理来显示RALDH2的功能性,所述视黄醇足以诱导心房表型。(视黄醇通过RALDH2转换成RA,RA则指定心房表型)。血型糖蛋白A(CD235a)是心室中胚层的标记物。CD235a专一地在心室中胚层上表达,并且在RALDH2+心房中胚层上不存在。CD235a+细胞不表达RALDH2。CD235a+细胞表达CYP26A1,降解RA的酶,以拮抗RA信号传导且确保心室表型的建立。分析天数:第2-6天。
在第1天时使用激活素A和BMP4的早期中胚层诱导确定在第4天时CD235a+中胚层细胞的比例。诱导条件是高BMP(5-20ng/ml BMP)和高激活素(6-20ng/ml),最常用的是10ng/ml BMP/12ng/ml激活素A(10B/12A)。在第3-5天时用视黄醇(ROH)处理CD235a+细胞不足以诱导心房表型。(这些细胞不能将视黄醇转换成RA,因此细胞发育成心室表型)。CD235a+细胞产生高度富含MLC2V+心室心肌细胞的群体。
心室心肌细胞和心房心肌细胞源自两个不同的中胚层亚群。通过第4天CD235a+细胞和第20天MLC2V+/CTNT+细胞的出现来监测心室分化。通过第4天AF+细胞和第20天MLC2v-/CTNT+细胞的出现来监测心房分化。源自心室中胚层(10B/12A)的第20天群体含有比源自心房中胚层(3B/2A)更高比例的MLC2v+心室心肌细胞。
基因表达分析和单细胞膜片钳分析显示,通过RA处理由心房中胚层(3B/2A+RA)生成的第20天群体含有比通过RA处理由心室中胚层(10B/12A+RA)生成的第20天群体更高比例的心房心肌细胞。
需要指定适当的中胚层亚群以富含所需的心肌细胞亚型。用于心肌梗塞后的细胞替代疗法的心室心肌细胞指定的改善方案。CD235a+心室中胚层(10B/12A)产生高度富含MLC2v+心室心肌细胞而缺乏起搏细胞的群体。与其它异质心肌细胞群体相比,这导致更低的自发搏动频率。
这些是心肌梗塞后的细胞替代疗法的期望特征,因为含有污染性起搏细胞且具有快速自发搏动频率的混合细胞群体可以促使危及生命的心律失常。我们提出我们用于指定心室心肌细胞的新方案优于生成心室细胞和起搏细胞的混合群体的先前方案。
实例
方法和结果
可以如先前所述(例如Kennedy等人,2007)培养人多能干细胞系。为了分化成心脏谱系,可以使用已建立的方案,例如Kattman等人,2011中所述的方案。对程序的各种修改是可能的,包括如WO2016131137所述的那些。在一个实施例中,80%汇合的hPSC培养物可以解离成单细胞,悬浮于含有1ng/ml BMP4和10μM ROCK抑制剂的StemPro-34培养基中,并且在轨道振荡器上温育18小时以生成胚状体(EB)。第二天(分化的第1天),可以将EB转移到中胚层诱导培养基:含有设定浓度的BMP4、和如本文进一步描述的设定浓度的激活素A、以及5ng/ml bFGF的StemPro-34。在分化的第3天时,可以使用IMDM将EB洗涤一次并且悬浮于心脏诱导培养基中:在一个实施例中,心脏诱导培养基可以包括含有0.5μM IWP2、10ng/ml VEGF和任选5.4μM SB-431542(SB,激活素/结节/TGFβ抑制剂)的StemPro-34。心脏诱导培养基还可以任选包括视黄酸(RA),或如本文进一步描述的RA组分。
视黄酸信号传导指定来自hESC的心房样心肌细胞
为了确定视黄酸信号传导是否可以指定用我们的基于胚状体(EB)的方案生成的hPSC衍生的生心群体中的心房命运,全反式视黄酸(RA)在代表下述发育阶段的4个不同时间点添加到分化培养物中:中胚层诱导(第3天)、心血管指定(第5天)、心脏祖细胞发育(第7天)和收缩心肌细胞的出现(第9天)(Kattman等人,2011)(图1A)。HES3 NKX2-5:GFP报告基因hESC系用于这些实验,以允许我们监测且定量心血管发育并且分离GFP+心肌细胞。在培养的第20天时,从分化的群体中分离GFP+SIRPA+CD90-心肌细胞,并且通过RT-qPCR分析指示心房和心室发育的基因的表达。(图1B-D和8B-E)。
RA处理无一显著改变泛心肌细胞标记物CTNT的表达水平,指示不同群体中可比较的心肌细胞含量(图1B)。在第3天和第5天时添加RA导致心室特异性基因MYL2的表达中的显著减少和心房离子通道基因KCNJ3的上调(图1C),提示第20天群体中的心肌细胞命运中的变化。有趣的是,在后期(第7天和第12天)添加RA对这些基因的表达没有作用。另外的室特异性标记物的分析显示,由第3天RA处理的中胚层生成的心肌细胞也表达比未处理组更低水平的心室标记物IRX4和MYH7,而对于心房标记物NR2F2、TBX5、NPPA和MYL7以及心房特异性离子通道CACNA1D、KCNA5和GJA5观察到相反的模式(图1D和8C-E)。对照胎儿组织的分析证实了这些不同基因的心房和心室表达模式。由第3天RA处理的中胚层生成的心肌细胞群体的流式细胞术和免疫染色分析证实了qRT-PCR表达模式,并且它们显示MLC2V+细胞的比例中的急剧减少,以及与由未处理的对照中胚层生成的那种相比,在由第3天RA处理的中胚层生成的群体中高得多频率的COUPTFII+细胞(图1E-H)。
总之,这些发现强烈表明RA信号传导诱导hPSC心脏发生中的命运变化,促进以心室谱系为代价的心房心肌细胞的发育。另外,它们显示RA的这种效应局限于在分化的第3天和第5天之间的早期发育窗,对应于中胚层分化状态。
为了进一步表征RA应答,我们接下来分析了在分化的第2天和第6天之间的群体的3种RA受体(RAR)同种型表达;RAR-α、-β、-γ(分别为图8F中的RARA、RARB和RARG)。所有三个都在响应阶段期间表达,提示RA应答可以通过所有这些来介导(图8F)。为了测试这一点,我们向第3天培养物中添加受体特异性激动剂关于α的AM580、关于β的AC55649或关于γ的CD437代替RA。每种激动剂的添加导致第20天CTNT+群体中MYL2表达的减少,提示通过所有受体同种型的信号传导可以介导命运中的变化(图8G和8H)。
在一些实施例中,RA可以以约0.05μM的浓度添加至约5μM的浓度。在一个实施例中,RA的浓度为500nM(0.5μΜ)。在一个实施例中,添加的RA的浓度为0.05μM至0.01μM。在一个实施例中,添加的RA的浓度为0.01μM至0.1μM。在一些实施例中,添加RA组分。在一些实施例中,RA组分是视黄酸受体(RAR)激动剂。在一些实施例中,RAR激动剂是针对α受体的激动剂。在一些实施例中,RAR激动剂是AM580。在一些实施例中,AM580RAR激动剂以约3nM至约300nM的浓度添加。在一些实施例中,RAR激动剂是针对β受体的激动剂。在一些实施例中,RAR激动剂是AC55649。在一些实施例中,AC55649以约0.025μM至2.5μM的浓度添加。在一些实施例中,RAR激动剂是针对γ受体的激动剂。在一些实施例中,RAR激动剂是CD437。在一些实施例中,CD437RAR激动剂以约0.05μM至约5μM的浓度添加。
RALDH2和CYP26A1表达鉴定中胚层亚群
如果心房命运的指定经由自分泌RA信号传导介导,则产生这些心肌细胞的中胚层群应该展示RALDH活性。为了测试这一点,我们分析了用我们的标准条件(10ng/mL BMP4和6ng/mL激活素A(10B/6A)在不同天数时诱导的PDGFRα中胚层,使用检测所有醛脱氢酶(ALDH),包括三种视黄醛脱氢酶,RALDH1、-2和-3活性的aldefluor测定(Jones等人,1995)。这些分析揭示了在分化的第4天和第5天时小ALDH+PDGFRα+群体的存在(图2A),提示在这些阶段的中胚层亚群可能具有合成RA的能力。在增加ALDH+PDGFRα+群体的大小的尝试中,我们测试了在中胚层诱导步骤期间改变激活素A和BMP4浓度的效应。在恒定浓度的BMP4(10ng/mL)的存在下减少激活素A的量导致在分化的第4天时ALDH+PDGFRα+群体的大小中的显著增加(图2B)。然而,这种增加与生成的CTNT+心肌细胞的比例中的减少有关,提示这些变化促进了非生心命运。因为我们先前已显示,激活素A和BMP4信号传导的比率对于维持最佳生心潜力是重要的(Kattman等人,2011),所以我们接下来改变在激活素A的量(2ng/mL)的存在下的BMP4浓度,所述量诱导最大的ALDH+PDGFRα+群体。将BMP4浓度从10减少到3ng/mL(3B/2A)不影响ALDH+PDGFRα+群体的大小,但它的确增加了在第20天时生成的CTNT+细胞的频率(图2C)。从3B/2A和10B/6A培养物获得可比较的细胞数目,指示操纵不显著影响总心肌细胞输出(图9A)。
用3B/2A诱导的培养物的分析揭示了在分化的第3天时大PDGFRα+中胚层群体的出现,随后为在第4天时ALDH+PDGFRα+群体的发展(图2D)。ALDH+PDGFRα+群体的大小增加直至第5天,然后在第6天时开始降低。分子分析显示RALDH2(ALDH1A2)的表达在用3B/2A诱导的组在分化的第2天和第3天之间急剧增加,然后它经过接下来的7天下降(图2E)。10B/6A诱导的细胞在第3天和第4天时表达显著较低水平的ALDH1A2,与该组中较小比例的ALDH+细胞一致。其它RALDH同种型(ALDH1A1和ALDH1A3)的表达水平显著低于ALDH1A2的表达水平,并且它们在两个群体之间并无不同(图9B)。T(BRACHYURY)和MESP1在10B/6A和3B/2A诱导的群体两者中均显示相似的时间表达模式,指示中胚层诱导的动力学在两组之间并无显著不同(图9C)。在发育中的胚胎中,RA活性的边界和信号传导的持续时间通过局部激动剂合成和降解之间的平衡来建立(Cunningham和Duester,2015;Rydeen和Waxman,2014)。为了确定这种平衡是否在hPSC分化培养物中发挥作用,我们接下来分析了两个群体的CYP26A1的表达,所述CYP26A1是负责RA降解的细胞色素P450家族酶的成员。这些分析揭示了两组之间的显著差异,其中第3天10B/6A诱导的细胞显示比任何其它10B/6A或3B/2A诱导的群体显著更高的表达水平(图2E)。总的来说,这些发现支持以下解释:3B/2A和10B/6A的组合诱导通过ALDH1A2和CYP26A1的表达区别的不同中胚层群体。
视黄醇将ALDH+中胚层指定为心房命运。
为了确定ALDH+细胞是否可以合成RA,从第4天3B/2A诱导的群体中分离ALDH+PDG-FRα+和ALDH-PDGFRα+级分,并且细胞作为视黄醇(ROH)、RA或DMSO(对照)中的聚集体培养24小时(图3A和3B)。ALDH1A2表达隔离到ALDH+部分,证实了基于aldefluor的分选策略对于分离表达RALDH2的细胞的有效性(图3C)。在培养另外15天后,所有组都含有高比例的CTNT+细胞,证实有效的心肌细胞分化(图3D)。未处理的对照生成含有MLC2V+细胞且表达IRX4的心肌细胞群体,证实在不存在RA信号传导的情况下,3B/2A诱导的中胚层具有一些心室生心潜力(图3E和3F)。在用ROH处理后,ALDH+中胚层生成心房样心肌细胞群体,与未处理的对照相比,所述群体具有较低频率的MLC2V+细胞、较低的IRX4表达水平和升高的KCNJ3表达水平(图3E-3G)。ROH和RA处理的ALDH+PDGFRα+衍生的群体中的表达模式是相似的,强烈表明ALDH+细胞能够从ROH合成RA。
令人惊讶的是,尽管在分离时其缺乏ALDH1A2表达(图3B和3C),但我们在ALDH-细胞中观察到对ROH的类似应答(图3E-3F)。这种应答可能是由于大多数ALDH-衍生的群体在24小时聚集培养期间变成ALDH+(图10A),使得细胞能够响应ROH。有趣的是,我们观察到经过相同的24小时时期ALDH+衍生群体中的aldefluor染色中的降低,突出显示了中胚层群体内ALDH活性(RALDH2表达)的动态性质。
总之,这些发现证实3B/2A诱导ALDH+PDG-FRα+(RALDH2+)中胚层,其可响应ROH且生成心房样心肌细胞,支持这种命运的指定经由自分泌RA信号传导介导的观点。
CD235a表达标记产生心室心肌细胞的中胚层。本文考虑CD235b可以替代CD235a作为产生心室中胚层的中胚层标记物,至少由于血型糖蛋白B和血型糖蛋白A的N末端区域的氨基酸序列相似性和/或同一性。
为了能够监测产生心室心肌细胞的表达AYP26A1的中胚层(VM)的发展,我们起始了在该群体上的表面标记物的搜索,所述表面标记物将允许我们将其与ALDH+中胚层区分开。通过抗CD抗体阵列(http://www.ocigc.ca/antibody/)上的先前筛选,我们发现血型糖蛋白A(CD235a)在用10B/6A诱导的第5天生心PDGFRα+细胞的子集上表达(数据未显示)。10B/6A和3B/2A诱导的群体的分析揭示了CD235a+群体在接下来的24小时内增加(>60%),然后经过随后的48小时下降。在第5天时检测到的小比例的ALDH+细胞是CD235a-,指示ALDH+和CD235a+群体是相互排斥的。在3B/2A诱导的群体中在第4天时仅检测到少数CD235a+细胞。qRT-PCR分析揭示了在用10B/6A诱导的组中,在分化的第3天时GYPA(血型糖蛋白A)表达的上调。图11A)。表达水平经过接下来的24小时急剧下降,并且在分析的程序期间保持很低。在3B/2A诱导的群体中仅检测到低水平的表达。基于这些发现,我们假设血型糖蛋白A在中胚层上表达,其促成心室心肌细胞谱系。
为了测试CD235a用于分离心室祖细胞的效用,我们使用具有中等浓度的BMP4和激活素A(5ng/mL BMP4和4ng/mL激活素A[5B/4A])的诱导策略,生成含有CD235a+和ALDH+亚群两者的第4天群体(图4B)。分离CD235a+ALDH-和CD235a-ALDH+级分两者,并且将细胞作为聚集体进行培养。分选级分的qRT-PCR分析显示ALDH1A2在CD235a-ALDH+细胞中以高于CD235a+ALDH-细胞中的水平表达(图11B)。GYPA和CYP26A1表达的水平在两者之间并无显著不同,可能是由于级分在第4天分离时的事实,超过这些基因的峰值表达一天。在ROH和RA的不存在下,两种级分均生成心室样细胞(图4C-4E)。然而,MLC2V+细胞的比例和IRX4的表达在由CD235a+ALDH-中胚层生成的群体中高于CD235a-ALDH+衍生物中。观察到心房基因KCNJ3和NR2F2的逆转模式(图4F)。当在ROH的存在下培养时,CD235a-ALDH+产生心房样心肌细胞群体,其特征在于低频率的MLC2V+细胞;低水平的IRX4表达;升高水平的NPPA、KCNJ3和NR2F2表达(图4D-4F)。相比之下,CD235a+ALDH-细胞显示对ROH无应答,证实在ALDH+细胞的不存在下不能合成RA。如预期的,两个中胚层群体均响应RA并且生成MLC2V-细胞。总的来说,这些发现证实CD235a表达标志着具有心室心肌细胞电位的中胚层群体,其不能响应ROH以生成心房细胞,这是将其与CD235a-ALDH+中胚层区分开的特征。这些发现还提示CD235a+和ALDH+中胚层群体已经被模式化至它们各自的命运,如在RA信号传导的不存在下生成的心肌细胞群体中的心室基因和心房基因的差异表达所示。
心室心肌细胞分化的优化
尽管用10B/6A诱导有利于心室心肌细胞的发育,但在这些条件下生成的中胚层经常含有小比例的ALDH+细胞,并且产生含有可变比例的(40%至60%的MLC2V+细胞的CTNT+群体。为了进一步优化心室心肌细胞发育,我们监测了用不同浓度的激活素A和BMP4诱导的第4天EB群体中的CD235a+级分的大小,并且将其与在第20天时的MLC2V+CTNT+细胞频率进行比较(图5A和5B)。在恒定量的BMP4(10ng/mL)的存在下,将激活素A的浓度从2ng/ml增加到12ng/ml导致第4天CD235a+群体的大小中的增加、ALDH++群体的消除、以及MLC2V+CTNT+细胞比例中的增加(图5A)。
接下来,BMP4的浓度(3-20ng/mL)针对生成最高频率的MLC2V+CTNT+细胞的激活素A的量(12ng/mL)进行改变。BMP4浓度中的变化对CD235a+群体的大小几乎没有影响,但它们的确影响了心室指定。由用最高浓度(20ng/mL)的BMP4诱导的EB生成的第20天群体具有最低频率的MLC2V+CTNT+细胞,而用低浓度的BMP4(5ng/mL[5B/12A])诱导的EB生成最高频率的这些心肌细胞(80%±5%)(图5B和13B)。5B/12A和10B/6A诱导的培养物产生可比较的细胞数目,指示获得MLC2V+CTNT+细胞的富集而不妥协总细胞输出(图12C)。
值得注意的是,激活素A和BMP4的最佳浓度取决于特定批次的细胞因子的活性。鉴于此,需要用每个新批次的细胞因子重复这些滴定,以确定最佳浓度。为了确定培养中的时间是否可以如已报道的(Burridge等人,2014)影响hPSC衍生的心肌细胞群体的MLC2V+含量,我们比较了由用3B/2A、10B/6A和5B/12A诱导的EB生成的第20和40天群体。如图13B中所示,在每个群体中在两个时间点均检测到相似比例的MLC2V+CTNT+心肌细胞,证实培养中的延长时间不影响其在这些条件下的心室含量。总的来说,这些发现指示第4天CD235a+群体的诱导是生成高度富含MLC2V+CTNT+心肌细胞的群体的先决条件。然而,它们还显示,该群体的大小不一定预测在培养第20天时MLC2V+细胞的百分比。用5B/12A诱导的EB群体含有高比例的CD235a+细胞且不含ALDH+细胞(图5C),而用3B/2A诱导的那些具有高频率的ALDH+细胞和少数CD235a+细胞。当在ROH或RA(第3-5天)的不存在或存在下指定并且培养另外15天时,两个群体均展示与通过生成的CTNT+细胞的频率测量的相似的生心潜力(图5D)。
3B/2A诱导的EB响应ROH,且生成心房样心肌细胞群体,其特征在于MLC2V+细胞的丧失、IRX4表达中的减少、以及KCNJ3和NR2F2表达的上调(图5E-5G)。相比之下,5B/12A诱导的EB不响应ROH,与ALDH+细胞的完全不存在一致。如预期的,RA处理能够由这种中胚层诱导心房样心肌细胞表型。
为了确定用于优化心室分化的条件是否影响通常在这些培养物中检测到的NKX2.5-窦房结起搏器样细胞的比例(Birket等人,2015;Protze等人,2017),我们分析群体中NKX2-5-GFP-细胞的存在。如图5H中所示,由优化的5B/12A诱导的EB生成的群体含有比源自10B/6A诱导的那些(图1E)和3B/2A诱导的EB显著更少的NKX2-5-GFP-CTNT+细胞,指示减少的窦房结样起搏细胞(SAN PLC)含量。与3B/2A诱导的EB相比,起搏器含量中的这种降低与5B/12A诱导的EB的自发搏动频率中的显著降低相关(图5I)。与我们先前的发现(Protze等人,2017)一致,RA处理不影响衍生群体中NKX2-5-GFP-细胞的比例(图5J)。
总的来说,这些发现显示5B/12A指定了中胚层亚群,其含有高比例的CD235a+细胞,并且产生高度富含心室心肌细胞且缺乏心房心肌细胞和SANPLC的群体。该亚群也可以被称为心室中胚层。
在一些实施例中,在第20天培养物中使用如本文所述的方法测量时,心室分化的优化导致至少50%、至少60%、至少70%、至少80%、至少90%、至少95%的心室心肌细胞的富集。在一些实施例中,群体基本上不含起搏细胞。在一些实施例中,群体缺乏起搏细胞。
在一些实施例中,优化心室分化的方法通过添加最佳浓度的BMP组分和激活素组分来优化心室中胚层的生成。在一些实施例中,BMP组分是BMP4,并且激活素组分是激活素A。在一些实施例中,BMP4以3ng/ml至20ng/ml的浓度加入。在一些实施例中,激活素A以4ng/ml至20ng/ml的浓度加入。在一个优选实施例中,激活素A以比BMP4更高的浓度加入。在一些实施例中,BMP4以10ng/ml的浓度加入,并且激活素A以12ng/ml的浓度加入。在一些实施例中,在该方法的第1天时加入BMP组分和激活素组分。在一些实施例中,通过测量CD235a的存在或量来确定BMP组分和/或激活素组分的浓度。在一些实施例中,通过测量RALDH2的存在或量来确定BMP组分和/或激活素组分的浓度。在一些实施例中,通过测量CD235a的水平,并且将其与RALDH2的水平相比较,来确定BMP组分和/或激活素组分的浓度。在一些实施例中,激活素组分的浓度基于与表达RALDH2的细胞相比优先导致更多表达CD235a的中胚层细胞的浓度来选择,并且BMP组分以比激活素组分的浓度更低的浓度加入。在一些实施例中,BMP组分的浓度基于与RALDH2相比优先导致更多CD235a的浓度来选择,并且激活素组分以比BMP组分的浓度更高的浓度加入。
由不同中胚层生成的心肌细胞的表征
为了进一步调查不同中胚层群体的生心潜力,我们分离了由EB生成的第20天NKX2-5+SIRPα+CD90-心肌细胞,所述EB用我们的原始细胞因子组合(10B/6A;混合诱导的MI)或对于心室(5B/12A;心室诱导的VI)或心房(3B/2A;心房诱导的AI)命运进行优化的组合诱导。如预期的,CTNT的表达水平在分选的群体中是相似的(图6A)。与源自MI或AI EB的心肌细胞相比,由VI EB生成的心肌细胞表达显著更高水平的与心室肌细胞相关的基因,包括MYL2、IRX4和MYH7(图6B)。源自VI Eb的群体具有最高频率的MCL2V+心肌细胞。(来自VI EB的80%±2%,来自MI EB的56%±4%,以及来自AI EB的25%±5%),提示改善的心室表达谱是部分地由于富集频率的心室样心肌细胞(图13A)。免疫染色分析证实了心肌细胞群体的MLC2V含量中的差异(图13B)。
由RA处理的VI和AI EB生成的心肌细胞(分别为VI+RA和AI+RA)显示与从未处理的EB分离的那些相比,所分析的所有心房基因的表达水平升高(图6C和13C)。来自AI+RA的细胞中KCNA5、KCNJ3、NR2F2和CACNA1D的表达水平与胎儿心房组织中的那些一样高或更高(图6C)。值得注意的是,它们的表达水平也显著高于由VI+RA EB生成的肌细胞中检测到的那些。相比之下,其它心房基因,例如GJA5、NPPA和MYL7,在两个RA处理的心肌细胞群体中以可比较的水平表达,但处于显著低于在胎儿心房组织中检测到的水平(图14C)。起搏器基因TBX3的水平在两个RA处理组中是可比较的,指示观察到的KCNA5、KCNJ3、CACNA1D和NR2F2表达中的差异不是由于心房群体中的污染性起搏细胞(图13D)。
鉴于CD235a+中胚层表达可以降解RA的CYP26A1,心房基因表达中的差异可能是由于到达核受体的活性配体的最终浓度中的差异。为了测试这一点,我们改变用于心房指定的RA浓度,并且分析从每种EB诱导条件生成的分离的NKX2-5+SIRPa+细胞(第20天)(图13E)。将RA浓度从0.5增加到1-2mM的确将来自VI EB的心肌细胞中KCNA5的表达水平增加到与来自AI EB的细胞可比较的水平(图13F)。这些RA浓度也足以完全抑制VI群体中的心室基因MYL2和IRX4的表达(图13G)。相比之下,RA以高达2mM的浓度的加入未能将VI心肌细胞中的KCNJ3、CACNA1D和NR2F2的表达增加到在AI细胞中观察到的水平(图14H)。这些基因的可比较的表达水平仅在由用4mM RA处理的EB生成的心肌细胞中检测到,该浓度导致第20天群体中NKX2-5+SIRPa+细胞的频率中的显著减少(图14E)。这些数据还证实VI和AI中胚层群体不具有相同的潜力。另外,它们突出显示了使用适当的早期诱导策略用于有效指定心室心肌细胞和心房心肌细胞的重要性。为了评价上述群体是否在功能上不同,我们使用膜片钳实验测试了源自VI和AI±RA EB的NKX2-5+SIRPa+CD90-心肌细胞的电生理特征。
表1(与图6相关)源自VI和AI EB的心肌细胞的电生理特征
APA,动作电位幅度;APD30/90,在30%/90%的复极化下的动作电位持续时间;CL,循环长度;DMP,舒张膜电位;dv/dtmax,最大动作电位去极化速度;t检验:*P<0.05,**P<0.01相对于VI自发,以及#P<0.05,##P<0.01相对于VI+RA。从n=5(VI,VI+RA)和n=6(AI+RA)独立分化修补的细胞批次中定量%AP类型±SEM。关于用于分类成AP类型的参数的细节在方法节段中指定。
因为关于MLC2V的流式细胞术分析已经证实在RA的不存在下来自AI EB的心室心肌细胞指定的低效率,所以在膜片钳实验中未进一步分析这些心肌细胞。VI EB衍生的心肌细胞(在RA的不存在下)显示具有快速去极化速度(>10V/s)和长AP持续时间(APD30>50ms)的典型心室动作电位(AP)(图6E和6F)。重要的是,100%的分析细胞显示这种心室表型(图6G)。与VI EB衍生的心肌细胞相比,在RA的存在下从VI或AI EB指定的心肌细胞展示显著更快的搏动频率和更短的APD30,指示心房AP表型(图6E和6F)。然而,VI+RA EB衍生的心肌细胞的APD30和APD90显著长于AI+RA EB衍生的心肌细胞中发现的(APD30,55±20ms相对于13.0±4.8ms;APD90,258±25ms相对于189±18ms)。观察到的AP类型的分类揭示了来自两组的细胞中记录的心房和心室样AP的比例中的显著差异(图6G)。从VI+RA EB中分析的仅62%±5%细胞显示心房模式,其中剩余38%±5%展示心室表型(APD30/90>0.3)。相比之下,AI+RA EB中的大多数(86%±9%)细胞显示心房模式,其中仅6%±6%展示心室AP。从AI+RA EB记录的20个中的一个细胞具有缓慢的去极化速度(<10V/s)和缓慢的搏动频率(50bpm),指示未成熟的心肌细胞。为了进一步表征由两个EB群体生成的心房细胞,我们接下来测量了乙酰胆碱激活的钾电流密度(IKACh),仅集中于展示心房AP表型的细胞(去极化速度>10V/s,APD30/90<0.3)。如预期的,对照VI EB衍生的心室细胞(-RA)展示比由两个群体生成的心房细胞显著更小的IKACh电流密度(图6H-6J)。两个心房心肌细胞群体的比较揭示了有趣的差异,因为源自AI+RA EB的那些显示比源自VI+RA EB的那些显著更高的IKACh电流密度(2.8±0.4pA/pF相对于1.6±0.4pA/pF)。结合上述观察,这些发现指示生成心房细胞的效率和这些细胞的质量取决于生成适当的中胚层群体。
由其它hPSC系生成心房心肌细胞和心室心肌细胞。
为了确定基于ALDH活性和CD235a表达用于优化心房和心室分化的方法是否广泛适用,我们接下来使用它由HES2人胚胎干细胞和MSC-iPS1诱导的多能干细胞系生成这些心肌细胞群体。滴定研究将5B/2A和5B/6A分别鉴定为对于HES2细胞的心房和心室诱导最佳,并且将4B/4A鉴定为对于MSC-iPSC1细胞的心室诱导最佳(图7A、7B、7E和7F;Mendeley http://dx.doi.org/10.17632/7z7d5v2c3w.1)。来自MSC-iPSC1细胞的心房诱导的优化更具挑战性,因为所有细胞因子组合都促进了大量CD235a+群体的发展。这些模式的一种解释是MSC-iPS1细胞具有高水平的内源性结节/激活素A信号传导,导致在所有条件下一些CD235a+细胞的发展。为了测试这一点,我们从第3天到第5天将结节/激活素A/转化生长因子β(TGF-beta)抑制剂SB-431542(SB)加入用4B/1A诱导的细胞中。SB添加的确导致CD235a+细胞中的减少和ALDH+群体的大小中增加,而不影响第4天中胚层的CTNT+MLC2V-生心潜力(图7E、7F和14A),支持MSC-iPS1细胞具有比其它系更高水平的内源性结节/激活素A信号传导的解释。
EB对于来自两个系生成的第20天群体的CD235a+中胚层发育进行优化,所述群体含有高比例的表达IRX4的MLC2V+CTNT+心肌细胞(图7B、7C、7F和7G)。CD235a+中胚层群体无一响应ROH。如预期的,两者均响应RA,并且它们生成了心肌细胞群体,其显示与未处理的对照相比减少的MLC2V含量、MYL2和IRX4表达的下调、以及KCNJ3和NR2F2的上调(图7B-7D、7F-7H和图14B-14G)。对于ALDH+中胚层发育优化的EB响应ROH和RA两者,并且它们生成展示指示心房谱系的表达谱的心肌细胞群体(图7B-7D、7F-7H和14B-14G)。总的来说,这些发现证实,由不同hPSC系生成的ALDH+和CD235a+中胚层群体分别展示心房电位和心室电位,类似于由HES3-NKX2-5eGFP/w系生成的群体。我们使用hPSC分化系统来建模人心脏发育的最早阶段,目标是绘制心房和心室心肌细胞谱系的出现和分离。来自这项工作的发现支持人心脏发育的方案,其中心房和心室心肌细胞源自不同的中胚层群体,其由不同水平的激活素A和BMP4信号传导鉴定,并且可以分别基于ALDH活性(RALDH2)或CD235a/CYP26A1的表达进行鉴定(图7I)。我们提出经由RALDH2+中胚层亚群内的自分泌RA信号传导诱导心房心脏发生,而通过CYP26A1的表达抑制CD235a+中胚层中的途径是心室心肌细胞发育所必需的。尽管RALDH2+和CD235a+群体可以产生两种类型的心肌细胞,但在适当的中胚层诱导后取决于心房细胞和心室细胞的有效生成。总之,这些新了解提供了用于进入人心脏发育的最早阶段的框架,以及用于设计有效生成特定心肌细胞亚型的最佳方案的平台。
我们对于心房指定在中胚层发育阶段期间由RA信号传导介导的观察与关于来自hPSC的心房分化的先前报道(Devalla等人,2015;Zhang等人,2011)以及RA对早期胚胎中描述的心脏发生的时间限制性作用(Moss等人,1998;Xavier-Neto等人,2000)一致。在胚胎中,这个阶段与侧板中胚层中的RA响应性和RALDH2表达细胞群体的出现相关联,所述细胞群体被认为促成心脏管的后部区域且最终产生心房心肌细胞(Hochgreb等人,2003;Moss等人,1998)。高度重叠的RA响应性和RALDH2表达模式提示该中胚层可以合成且响应RA。体内心脏中胚层亚群可以合成RA的概念由Lescroart等人(2014)的研究支持,所述研究显示与早期迁移的心室祖细胞(E6.25-6.75)相比,促成心房发育的迁移的Mesp1+中胚层(E7.25)表达显著更高水平的ALDH1A2(RALDH2)。来自我们的细胞分选实验的发现明确地证实具有心房电位的3B/2A诱导的中胚层的确表达RALDH2并且能够响应ROH,提供了人心房指定通过自分泌RA信号传导介导的令人信服的证据。
关于CD235a+CYP26A1+ALDH-中胚层有效生成心室心肌细胞但不能响应ROH以生成心房细胞的发现,提供了这些心肌细胞亚型源自不同的中胚层群体的强有力证据。在CD235a+和ALDH+中胚层中的CYP26A1和RALDH2的差异表达指示这些hPSC衍生的祖细胞已建立了在RA合成和降解之间的平衡,类似于在发育中的胚胎中沿着心血管祖细胞场的前后轴发现的RA信号传导边界(Cunningham和Duester,2015;Rydeen和Waxman,2014)。目前,尚不了解CD235a中胚层是生成左心室心肌细胞或右心室心肌细胞还是两者的混合物。直到我们能够在体外实现这些群体的更好分辨,难以将它们的发现并入第一个和第二个心脏场模型内,所述模型提议不同的祖先促成左心室和右心室流出道(Buckingham等人,2005;Meilhac等人,2004;Spaeter等人,2013)。然而,我们的发现与Bardot等人(2017)的那些一致,其使用谱系追踪策略来显示FOXA2在小鼠中的表达标志着产生左心室和右心室而不是心房心肌细胞的祖细胞。
通过CD235a表达和ALDH活性定量监测心室和心房祖细胞发育的能力使得我们能够调查调节这两个群体的指定的途径,并且证实BMP4和激活素A信号传导的梯度在这些早期决定中起关键作用。我们对不同hPSC系的分析揭示,心室谱系的指定取决于激活素A与BMP4信号传导的比率高于生成心房谱系所需的比率。这些差异可能反映了这些祖细胞在早期胚胎中暴露的不同信号传导环境。支持这一点的证据由Lescroart等人(2014)的研究提供,所述研究显示与后来发展的心房祖细胞相比较,结节及其下游靶基因PITX2、LEFT1、FGF8、GSC和MIXI(Lee等人,2011)的转录物在早期迁移的左心室祖细胞中富集。
对于最佳心室和心房发育取决于适当中胚层的有效指定的观察强调了理解hPSC分化培养物中的最早发育阶段的重要性。我们的发现显示,谱系发育的效率和在心房心肌细胞的情况下,所生成的细胞的质量两者均受早期诱导步骤的影响。分化培养物中的谱系发育的精确控制对于将hPSC的潜力转化为心血管疾病的治疗应用具有重要意义。例如,缺乏污染性起搏细胞和心房细胞的高度富集的心室心肌细胞将是用于开发基于细胞的疗法的理想候选群体,所述疗法旨在患有心肌梗塞的患者中的心室壁的再肌化。非心室细胞的消除可以减少在hPSC衍生的心肌细胞的混合群体移植后,在动物模型中观察到的心律失常(Chong等人,2014;Shiba等人,2016)。心肌细胞亚群的富集群体的接近对于建模疾病也很重要,所述疾病影响心脏的特定区域,例如心房颤动、肥厚性心肌病和其它室特异性先天性心脏缺损。生成不同心脏群体的能力不仅提供用于这些研究的适当靶细胞,而且还使得能够分析治疗策略对其它心肌细胞亚型的潜在脱靶效应。这些全面分析将提供对于人心血管疾病的了解,这是使用表征不佳的混合群体不可能的。
方法细节
人ESC/iPSC系的定向分化
对于心脏分化,我们使用我们的基于胚状体(EB)的方案的修改版本(Kattman等人,2011)。将以80%-90%汇合的hPSC群体解离成单细胞(TrypLE,ThermoFisher),并且在StemPro-34培养基(ThermoFisher)中在轨道振荡器上重新聚集18小时以形成EB,所述培养基含有青霉素/链霉素(1%,ThermoFisher)、L-谷氨酰胺(2mM,ThermoFisher)、转铁蛋白(150μg/ml,ROCHE)、抗坏血酸(50μg/ml,Sigma)和单硫代甘油(50μg/ml,Sigma)、ROCK抑制剂Y-27632(10μM,TOCRIS)和rhBMP4(1ng/ml,R&D)。在第1天时,将EB转移至中胚层诱导培养基,其由具有上述补充物(-ROCK抑制剂Y-27632)以及以指示浓度的rhBMP4、rhActivinA(R&D)和rhbFGF(5ng/ml,R&D)的StemPro-34组成。在第3天时,收获EB,用IMDM洗涤并且转移至心脏中胚层指定培养基,其由StemPro-34、Wnt抑制剂IWP2(1μM,TOCRIS)和rhVEGF(10ng/mL,R&D)组成。在第5天时,将EB转移至具有rhVEGF(5ng/ml)的StemPro-34另外7天,然后转移至不含另外的细胞因子的StemPro-34培养基另外8天。在第20天时,基于NKX2-5:GFP和SIRPa的表达以及CD90的缺乏,来分析且分离HES3-NKX2-5gfp/w-衍生的心肌细胞。由非转基因hPSC系生成的心肌细胞作为SIRPa+CD90-群体进行分析且分离。培养基每3天进行更换。将培养物在低氧环境(5%CO2、5%O2、90%N2)中培养前12天,并且在接下来的8天中在含氧量正常的环境(5%CO2)中培养,总共20天。EB在分化自始至终在超低附着的6孔培养皿(Corning)中进行培养,用于维持悬浮培养。
心房和心室诱导条件的优化
为了确定最佳的心房诱导条件,激活素A和BMP4浓度的选择基于在第4天时具有最高比例的ALDH+CD235a-细胞的中胚层群体的鉴定,其显示第20天时生成CTNT+MLC2V-心肌细胞的最大潜力。优化后,从第3-5天开始在心房中胚层指定培养基中包括ATRA(0.5μM,Sigma)或视黄醇(2μM,Sigma),用于生成心房心肌细胞。
为了确定最佳的心室诱导条件,激活素A和BMP4浓度的选择基于中胚层群体的鉴定,所述中胚层群体在第20天时含有高比例的CD235a+细胞、不含ALDH+细胞并且生成高比例的CTNT+MLC2V+。
流式细胞术和细胞分选
第2-6天EB用TrypLE在室温(RT)下解离2-4分钟。第20天EB通过在HANKs缓冲液中的2型胶原酶(0.5mg/ml,Worthington)中在RT下温育过夜,随后为如上所述的TrypLE处理来解离。下述抗体用于染色:抗PDG-FRa-PE(R&D Systems,3:50)、抗CD235a-APC(BD PharMingen,1:100)、抗SIRPa-PeCy7(Biolegend,1:1000)、抗CD90-APC(BD PharMingen,1:1000)、CTNT的抗心脏同种型(ThermoFisher Scientific,1:2000)、或抗肌球蛋白轻链2(Abcam,1:1000)。对于未缀合的一抗,下述二抗用于检测:山羊抗小鼠IgG-APC(BD Pharmigen,1:250)或驴抗兔IgG-PE(Jackson ImmunoResearch,1:250)。表2中描述了详细的抗体信息。
表2实验资源。
对于细胞表面标记物分析,将细胞于4℃在FACS缓冲液中染色30分钟,所述FACS缓冲液由含有5%胎牛血清(FCS)(Wisent)和0.02%叠氮化钠的PBS组成。对于细胞内染色,将细胞于4℃用PBS中的4%PFA固定15分钟,随后为于4℃使用90%甲醇的20分钟透化。细胞用含有0.5%BSA(Sigma)的PBS洗涤,并且用FACS缓冲液中的未缀合的一抗于4℃染色过夜。细胞用含有0.5%BSA的PBS洗涤染色,并且用FACS缓冲液中的二抗于4℃染色1小时。
使用LSR II流式细胞仪(BD)分析染色的细胞。对于细胞分选,将染色的细胞保持在具有0.5%FCS的IMDM中,并且使用Influx(BD)、FACSAriall(BD)、MoFlo-XDP(BD)和FACSAria Fusion(BD)在Sickids/UHN流式细胞术设施中进行分选。使用FlowJo软件(Tree Star)分析数据。
Aldefluor测定
根据由制造商提供的说明书执行aldefluorTM测定(STEMCELL Technologies)。简言之,如上所述,将第2-6天EB解离。将细胞以2x106个细胞/ml的浓度在含有0.1%BSA和BAAA底物(0.12mg/ml)的aldefluor测定缓冲液中于37℃染色60分钟。将醛脱氢酶抑制剂DEAB(0.75nM)加入阴性对照样品中。用由具有5%FCS和10%aldefluor测定缓冲液的IMDM组成的冷培养基洗涤细胞。然后用冷洗涤培养基中以上述浓度的针对细胞表面标记物的抗体,将细胞于4℃染色另外20分钟。如上所述分析染色的细胞。在分析期间,将细胞保持在冷洗涤培养基中。对于细胞分选,用KnockOutTM血清替代物(ThermoFisher)替换FCS,以避免血清含有的细胞因子对细胞分化的任何影响。在分选程序自始至终,将细胞维持在含有10%aldefluor测定缓冲液的StemPro-34中。收集分选的细胞并且在含有ROCK抑制剂(10μΜ)、IWP2(0.5μΜ)和rhVEGF(5ng/ml)的StemPro-34中重新聚集。
免疫组织化学
第20天EB如上所述进行解离,并且将细胞铺在预先涂有基质胶(25%v/v,BD)的12mm盖玻片(VWR)上。将细胞培养3-5天以允许形成贴壁细胞单层。细胞用在PBS中的4%PFA在室温下固定10分钟,并且用含有0.3%TritonX、200mM甘氨酸(Sigma)的PBS在RT下透化20分钟。用含有10%FCS、0.1%TritonX和2%BSA的PBS封闭细胞。下述抗体用于染色:CTNT的小鼠抗心脏同种型(ThermoFisher Scientific,1:200)、兔抗人/啮齿类动物肌球蛋白轻链2(Abcam,1:200)、小鼠抗人COUPTF-II(R&D,1:1000)、或兔抗人CTNT(Genway Biotech Inc.,1:1000)。为了检测未缀合的一抗,使用下述二抗:驴抗小鼠IgG-A647(ThermoFisher,1:1000)或驴抗兔IgG-A555(ThermoFisher,1:1000)。详细的抗体信息在关键资源表中描述。细胞用在染色缓冲液中的一抗于4℃染色过夜,所述染色缓冲液由具有0.1%TritonX和0.1%BSA的PBS组成。细胞用染色缓冲液在RT下在轨道振荡器上洗涤15分钟。然后将细胞用在染色缓冲液中的二抗在RT下染色1小时,随后为如上所述的洗涤步骤。使用具有DAPI的SlowFade Gold Antifade试剂(ThermoFisher)固定样品。使用Olympus FluoView 1000激光扫描共焦显微镜分析染色细胞。FV10-ASW软件用于图像采集。
定量实时PCR
使用包括无RNA酶的DNA酶处理的RNAqueous-micro Kit(Ambion),分离来自hPSC衍生的群体的总RNA。使用TRIzol方法(ThermoFisher)分离来自人胎心的解剖的心室组织和心房组织的RNA,并且用DNA酶(Ambion)处理。使用寡核苷酸(dT)引物和随机六聚体以及Superscript III逆转录酶(ThermoFisher),将100ng至1mg的分离RNA逆转录成cDNA。使用QuantiFast SYBR Green PCR试剂盒(QIAGEN),在EP Real-Plex MasterCycler(Eppendorf)上执行QRT-PCR。所有实验都一式两份制备,并且包括范围为25ng/ml至2.5pg/ml的10倍稀释系列的超声处理的人基因组DNA标准,用于评估PCR反应的效率和每种基因相对于管家基因TBP的拷贝数。使用MultiExperiment Viewer(MeV)开源软件生成基因表达数据的热图。
膜片钳
对于使用膜片钳的电生理表征,解离EB,并且如上所述通过FACS分离NKX2-5+SIRPa+CD90-心肌细胞。将分离的细胞悬浮于补充有以1.25-5x105细胞/ml的ROCK抑制剂(10mM)的StemPro-34培养基中,并且通过70mm滤器进行过滤。将40ul这种细胞悬浮液的小滴施加到玻璃盖玻片(3x5mm),所述玻璃盖玻片在30mm培养皿中预先涂有Matrigel(10%v/v)。将细胞在40mL体积中温育16-18小时,以促进细胞附着。然后用2ml StemPro-34培养基淹没培养皿。培养基每4天进行更换。在铺平板后7至14天之间,培养物用于膜片钳记录。在电流和电压钳模式下分别使用标准膜片钳技术测量AP和膜电流(Axopatch 200B,Molecular Devices)。电压和电流用5KHz取样率(DigiData,Molecular Devices)进行记录,并且用pCLAMP软件(Molecular Devices)进行分析。当用移液管溶液填充时,使用尖端电阻为2-5MU的硼硅酸盐玻璃微电极。串联电阻由rv70%补偿。使用全细胞破裂膜片法在RT下记录AP和膜电流,使用下述浴液(mM):NaCl 140、KCl 5.4、CaCl2 1.2、MgCl2 1、葡萄糖10和HEPES 10(pH 7.4,用NaOH调节)。移液管溶液由(mM)组成:天冬氨酸钾120、KCl 20、NaCl 5、MgATP 5和HEPES 10(pH 7.2,用KOH调节)。
在静止心肌细胞中,通过1-3ms长的去极化电流脉冲5-15pA以1Hz的频率引发AP。基于下述参数将自发和刺激的AP进行分类;起搏器样:dv/dtmax<10V/s,心房样:dv/dtmax R 10V/s和APD30/90<0.3,心室样:dv/dtmax R 10V/s和APD30/90R 0.3。乙酰胆碱激活的钾电流(IKACh)表征为CCh敏感电流(由CCh激活)。在加入卡巴胆碱(CCH,10mM)之前和之后测量电流,响应范围从来自-40mV的保持电位的20mV到-120mV的350ms电压斜坡方案(参见相应原始电流迹线中的电压方案插图)。通过从在CCh的存在下记录的电流中减去没有CCh记录的电流来定量IKACh。
定量和统计分析
所有数据都表示为平均值±平均值的标准误(SEM)。指示的样品大小(n)代表生物学重复,其包括独立的细胞培养物重复和各个组织样品。对于单细胞数据(搏动频率定量和膜片钳数据),样品大小(n)代表从R三个独立实验分析的细胞数目。统计方法不用于预先确定样本大小。由于实验的性质,不执行随机化,并且调查者也并非不知情的。通过使用GraphPad Prism6软件中的斯氏t检验(未配对,双尾)确定统计显著性。p<0.05(*/#),结果视为显著的,并且p<0.01(**/##)结果视为非常显著的。所有统计参数都在各自的图和图例中报告。
尽管本文已描述了本发明的优选实施例,但本领域技术人员将理解,可以对其做出变化,而不背离本发明的精神或所附权利要求的范围。本文公开的所有文献,包括下述参考文献列表中的那些,都以引用的方式并入。
- 还没有人留言评论。精彩留言会获得点赞!