用于检测核酸序列变体的方法与流程
发明领域
本发明涉及用于检测靶核酸序列中核酸变体的方法和用于高保真序列扩增的方法。
背景
核酸变体的检测对多种情况而言是重要的,其对疾病的检测和预后极其重要。目前,就检测核酸变体而言有广泛的试验形式。此类试验包括焦磷酸解作用激活的聚合(PAP)、使用LNA阻断剂的试验和cast-PCR试验。
焦磷酸解激活的聚合反应(PAP)可用于检测突变负荷或检测微小残留病。在PAP中,焦磷酸解和DNA聚合酶的聚合反应可通过使用焦磷酸解可激活的寡核苷酸(P*)来有序偶合。所激活的P*可通过DNA聚合作用来延伸。该试验的特异性由焦磷酸解作用和聚合作用共同产生,因为显著的非特异性扩增需要错配焦磷酸解和由DNA聚合酶的错误掺入相结合,而这是极端罕见的事件。(参见,例如,Liu和Sommer,“Pyrophosphorolysis-activated polymerization(PAP):application to allele-specific amplification(焦磷酸解激活的聚合反应(PAP):在等位基因特异性扩增中的应用),”Biotechniques,29(5):1072-6,1078,1080(2000);通过引用全文纳入本文)。
LNA阻断剂也可用在检测和/或定量核酸群中核酸变体的方法中,所述核酸群中野生型核酸丰度较高。这类方法使用高亲和力的短寡核苷酸,所述寡核苷酸靶向野生型而不是少数或突变序列,并起到阻断野生型DNA检测的功能。所述LNA阻断剂探针可与较长的检测探针或PCR引物联用以扩增和/或鉴定所述少数或突变序列。(参见,例如,美国专利申请号20100009355;其通过引用全文纳入本文)。
Cast-PCR也可用作分析不同等位基因之间序列变异的试验。所述方法使用竞争性等位基因特异性TaqMan PCR(“cast-PCR”)来区分核酸变体。Cast-PCR采取在靶核酸序列上进行两个扩增反应。第一反应包括在第一等位基因特异性引物和第一等位基因特异性阻断剂存在下扩增,然后检测扩增产物,所述第一等位基因特异性阻断剂与所述第一等位基因变体互补。第二反应包括在第二等位基因特异性引物和第二等位基因特异性阻断剂存在下扩增,然后检测扩增产物,所述第二等位基因特异性阻断剂与所述第二等位基因变体互补。(参见,例如,美国专利申请号20100221717;其通过引用全文纳入本文)。
上述方法全部都具有不同的难点和局限。用于检测罕见变体的这些方法背后的一个共同问题是酶保真度欠佳。不易区分在复制和相关扩增过程中引入的误差和真实的罕见变体与突变,从而削弱了这些方法的性能。此外,在等位基因特异性引发的情形,例如扩增阻碍突变系统(ARMS,Nucleic Acids Res.17:2503-16(1989))中,扩增中的错误引发会“覆写(over-write)”变体位点并导致欠佳结果。在大多数情况中,上述方法的特异性局限于0.1~5%的等位基因普遍性。甚至在下一代测序方法中也有这种情况,因为使用的聚合酶所引入的差错足以将罕见等位基因检测的灵敏度限制到约3~5%。所有这些试验的关键难题在于,它们的核心是使用DNA聚合酶的扩增方法,这些方法因为失真而引入差错,造成固有背景在1~3%范围或更大,这取决于聚合酶。有少许方法能够获得高得多的特异性水平,例如数码PCR,但是这些方法复杂、昂贵,并且不易于和确证试验或诊断试验交互。并且,数码PCR自身还不适于高度多路复用。
本领域需要能够更有效地检测罕见核酸序列变体的其它试验方法。此外,需要减少与聚合酶相关扩增系统有关的掺入差错的方法。需要开发其它方法,而本发明的方法就提供这种其它试验方法。
技术实现要素:
本发明提供用于检测靶区内是否存在核酸变体的方法。这些方法包括在选择子阻断剂(选择子阻断剂)的存在下用正向引物和反向引物扩增所述靶区。所述选择子阻断剂包括在没有所述核酸变体时与所述靶区互补的序列。所述方法还包括检测所述靶区的扩增,其中所述靶区的扩增指示所述靶区中的所述核酸变体的存在。所述核酸变体可包括缺失、突变或插入。
本发明方法还可提供>1:1000的灵敏度(即,可在1000个拷贝的野生型靶区存在下检测到所述靶区中1个拷贝的核酸变体)。在一些实施方式中,所述灵敏度是>1:1500、>1:2000、>1:2500、>1:3000、>1:3500或>1:4000、>1:5000、>1:10,000、>1:20:000、>1:50:000、>1:100,000、>1:120,000、>1:150,000、>1:200,000、>1:250,000、>1:500,000、>1:750,000、>1:1,000,000或更高的灵敏度。
所述方法还可额外包括与选择子阻断剂一同使用报告子探针。所述报告子探针在存在扩增时提供第一信号,在没有扩增时提供第二信号。本发明还提供反应混合物,所述反应混合物包含正向引物、反向引物、选择子阻断剂和模板多核苷酸,所述模板多核苷酸包含可有核酸变体的靶区。所述选择子阻断剂包括在没有所述核酸变体时与所述靶标区域互补的序列。所述正向引物和所述反向引物可用于扩增所述模板多核苷酸包含所述靶区的区域。所述反应混合物可额外包含报告子探针,其中所述报告子探针在存在扩增时提供第一信号,在没有扩增时提供第二信号。本发明还提供用于进行高保真扩增的方法,在一些实施方式中,所述方法包括将核酸酶耐受引物与高保真聚合酶联用于核酸靶区的扩增。
本发明还提供试剂盒。本发明设想的试剂盒可包含正向引物和选择子阻断剂。所述选择子阻断剂包括在没有所述核酸变体时与所述靶标区域互补的序列。所述正向引物包含与所述靶区的上游区域互补的序列。所述试剂盒还可包含反向引物和报告子探针。还设想试剂盒包含核酸酶耐受引物和高保真聚合酶和含有3’外切核酸酶活性的修复酶。
本发明还涉及下述各项:
1.一种用于检测靶区内是否存在核酸变体的方法,所述方法包括
在选择子阻断剂的存在下用正向引物和反向引物扩增所述靶区,其中所述选择子阻断剂包含除在所述核酸变体出现的位置以外与所述靶区互补的序列,
检测所述靶区的扩增,其中所述靶区的扩增指示所述靶区内所述核酸变体的存在。
2.如项1所述的方法,其特征在于,所述核酸变体包括缺失、突变或插入。
3.如项1所述的方法,其特征在于,所述选择子阻断剂是不可延伸的。
4.如项1所述的方法,其特征在于,所述选择子阻断剂被构建为开关阻断剂。
5.如项1所述的方法,其特征在于,所述选择子阻断剂和正向引物彼此连接或接合成引物-开关。
6.如项1所述的方法,其特征在于,所述选择子阻断剂被保护以抵御3’或5’外切核酸酶活性。
7.如项1所述的方法,其特征在于,所述选择子阻断剂对靶序列的亲和性增加。
8.如项1所述的方法,其特征在于,所述选择子阻断剂不包含PNA或LNA。
9.如项1所述的方法,其特征在于,所述选择子阻断剂包含可检测的实体。
10.如项1所述的方法,其特征在于,所述正向引物的3’端在与所述靶区杂交时位于距离所述靶区中的核酸变体少于约30个核苷酸处。
11.如项1所述的方法,其特征在于,与所述靶区杂交的所述正向引物的3’端和与所述靶区杂交的所述选择子阻断剂的5’端重叠。
12.如项11所述的方法,其特征在于,所述选择子阻断剂的5’端不包含所述核酸变体。
13.如项1所述的方法,其特征在于,所述方法还包括与选择子阻断剂一同的报告子探针,其中所述报告子在存在扩增时提供第一信号,且在没有扩增时提供第二信号。
14.如项1所述的方法,其特征在于,所述方法还包括与所述选择子阻断剂一同的报告子探针,其中所述报告子探针包含荧光标签和淬光剂。
15.如项1所述的方法,其特征在于,所述方法还包括与选择子阻断剂一同的报告子探针,其中,所述报告子探针在其5’端或距离其5’端至多七个核苷酸处包含第一实体,其中所述选择子阻断剂在其3’端包含第二实体,并且,其中当所述选择子阻断剂和所述报告子探针与所述靶区杂交时,所述第一实体和所述第二实体之间发生能量转移。
16.如项1所述的方法,其特征在于,所述方法还包括通过对所述扩增产物获取解链曲线或测序来检测所述靶区的扩增。
17.如项1所述的方法,其特征在于,所述方法还包括通过比较所述扩增产物的量和预定水平来检测所述靶区的扩增,所述预定水平与所述靶区中是否存在所述核酸变体相关联。
18.一种反应混合物,所述反应混合物包含正向引物、反向引物、选择子阻断剂和模板多核苷酸,所述模板多核苷酸包含可能存在核酸变体的靶区,其中所述选择子阻断剂包含在没有核酸变体时与所述靶区互补的序列,并且其中所述正向引物和所述反向引物在扩增包含所述靶区的所述模板多核苷酸的区域中有用。
19.如项18所述的反应混合物,其特征在于,所述反应混合物还包含报告子探针,其中所述报告子在存在扩增时提供第一信号并在没有扩增时提供第二信号。
20.如项18所述的反应混合物,其特征在于,所述反应混合物还包含通过使用所述正向引物和所述反向引物扩增所述模板核苷酸产生的扩增子。
21.一种包含正向引物和选择子阻断剂的试剂盒,其特征在于,所述选择子阻断剂包含在没有核酸变体时与靶区互补的序列,并且其中所述正向引物包含与所述靶区上游的区域互补的序列。
22.如项21所述的试剂盒,其特征在于,所述试剂盒还包含反向引物和报告子探针。
23.如项21所述的试剂盒,其特征在于,所述选择子阻断剂是开关阻断剂。
24.如项21所述的试剂盒,其特征在于,所包含的所述正向引物和选择子阻断剂作为引物开关。
25.如项1所述的方法,其特征在于,所述扩增通过数字PCR进行。
26.一种用于检测靶区内是否存在核酸变体的方法,所述方法包括
在选择子阻断剂的存在下用正向引物和反向引物扩增所述靶区,其中所述选择子阻断剂包含在所述核酸变体存在下与所述靶区互补的序列,
检测所述靶区的扩增,其中所述靶区的扩增指示所述靶区内不存在所述核酸变体。
27.一种反应混合物,所述反应混合物包含正向引物、反向引物、选择子阻断剂和模板多核苷酸,所述模板多核苷酸包含可能存在核酸变体的靶区,其中所述选择子阻断剂包含在所述核酸变体存在下与所述靶区互补的序列,并且其中所述正向引物和所述反向引物在扩增包含所述靶区的所述模板多核苷酸的区域中有用。
28.一种包含正向引物和选择子阻断剂的试剂盒,其特征在于,所述选择子阻断剂包含在所述核酸变体存在下与所述靶区互补的序列,并且其中所述正向引物包含与所述靶区上游的区域互补的序列。
29.一种用于高保真扩增核酸靶区的方法,所述方法包括在扩增反应过程中使用一种或多种选自以下的试剂:核酸酶耐受引物、高保真酶、阻断剂、FRET探针和Flip探针。
附图说明
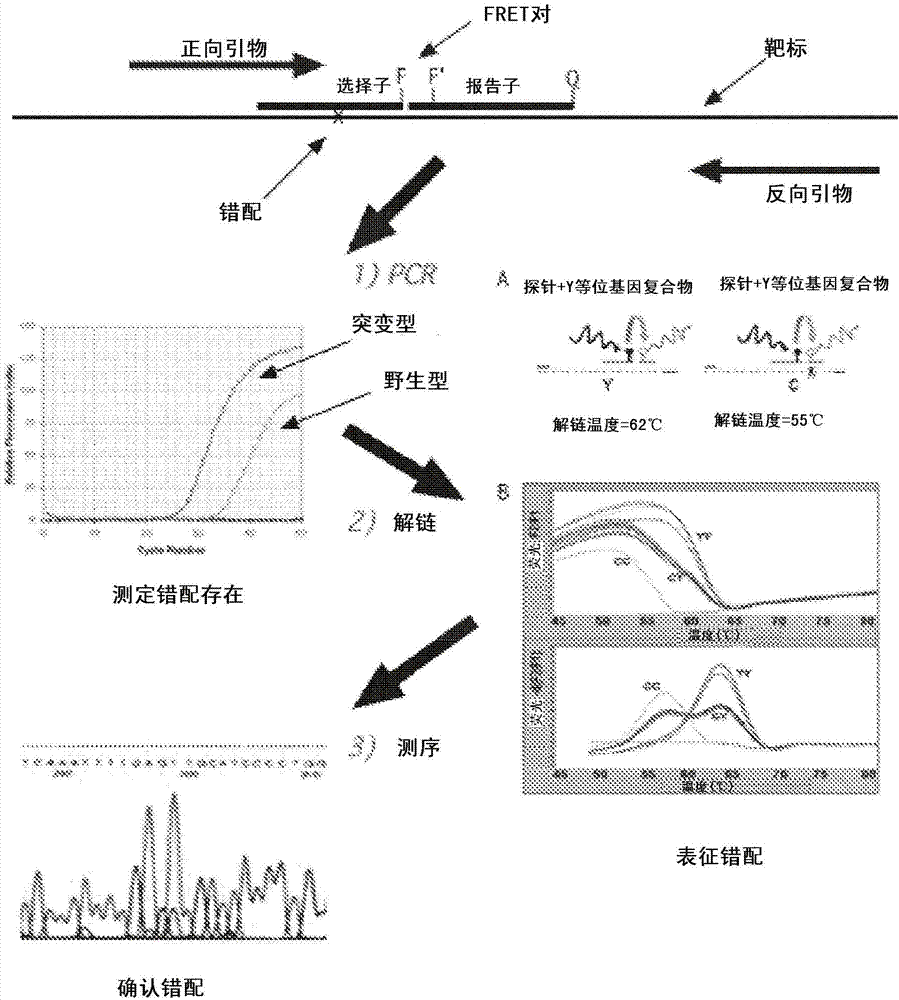
图1.示意性表示本文所述的选择子试验方法。
图2.示意性表示本文所述的选择子附加试验方法。
图3.检测EGFR T790M突变的选择子试验设计。
图4.采用选择子A和报告子A的合成突变型或野生型靶标的解链曲线图显示,所述突变型合成靶标的解链温度显著下降(约13℃)。
图5.采用 DNA聚合酶、Stoffel片段的选择子试验。在所述采用 DNA聚合酶、Stoffel片段的选择子试验中,使用NTC(无模板对照)、100pg H1975(突变)或10ng WBC17088(野生型)DNA。
图6.采用Kapa HS酶的选择子试验。在所述采用Kapa HS DNA聚合酶的选择子试验中,使用NTC(无模板对照),6.6ng WBC 17088(野生型)、带有14pg或28pg H1975(突变)的6.6ng WBC17088(野生型)DNA。图7.检测EGFR T790M突变的选择子附加试验。所述选择子附加试验可由三步组成,其被设计为在过量野生型背景中鉴定突变模板的存在:1)积累PCR产物的实时检测;2)解链曲线分析;和3)测序。
图8.分离经扩增的亚氨基生物素标记链用于解链曲线分析和测序。
图9.所述选择子(SelectorTM)试验是定量的,且过量野生型模板的存在对T790M突变型扩增的影响很小。
图10.野生型扩增受选择子抑制。
图11.A)来自临床肺癌血浆样品的核酸中的EGFR T790M的鉴定。B)扩增数据的标准曲线。
图12.采用从临床肺癌血浆样品制备的cDNA的选择子试验。
图13.A)全血中H1975细胞掺料找回(spike and recovery)后从生物概念公司(Biocept)的CEETM微通道所推出物质的选择子试验。B)所述掺料找回选择子试验反应的解链曲线分析和桑格法(Sanger)测序。图14.A)来自全血中H1975掺料找回试验的经全基因组扩增(WGA)材料的选择子试验。B)采用WGA材料的选择子(SelectorTM)试验反应的测序。图15.A)采用与所述选择子重叠的正向引物(FP14ovl)的选择子试验。B)对采用野生型模板而没有选择子时(图A)或野生型模板和50pg H1975的混合物(图B)的选择子试验测序以校验所述产物的身份。显示T790M特定突变(CAT)的位置。由所示序列下的框指示选择子结合的区域。
图16.采用AmpliTaq Gold DNA聚合酶,在选择子存在下使用野生型模板进行的T790M选择子(SelectorTM)试验反应的桑格法(Sanger)测序。
图17.采用FAM标记的阻断剂和LC-红640标记的锚定子的选择子(SelectorTM)试验。
图18.针对KRAS G12C突变的选择子试验。
图19.采用两个S18间隔子的开关阻断剂构建体。该设计描述于实施例15和16,用于优先扩增T790M相关突变。
图20.使用5-硝基吲哚“桥”来增加变体等位基因区别度的开关阻断剂。该设计显示优先扩增与T790M相关联的变体等位基因。还显示使用成对的淬灭剂和荧光标签的自报告设置(荧光在杂交后增强)。
图21.示例性Flip探针设计的示意图。
发明详述
本发明的方法部分基于如下发现:阻断剂探针可用于以很高的灵敏度检测核酸变体,在一些情况下,所述检测的灵敏度>1:1000。在一些情况下,灵敏度>1:2000。因此,本发明提供用于检测靶标区域内是否存在核酸变体的方法。所述方法包括在选择子阻断剂的存在下用正向引物和反向引物扩增所述靶标区域。在一些实施方式中,所述选择子阻断剂包括在没有所述核酸变体时与所述靶标区域互补的序列。所述方法还包括检测所述靶区的扩增,此处所述靶区的扩增指示所述靶区中的所述核酸变体的存在。
在一些实施方式中,本发明方法的灵敏度>1:1000(即,可从1000个拷贝的靶区检测出1个拷贝的靶标)。在一些实施方式中,所述灵敏度是灵敏度>1:1500、>1:2000、>1:2500、>1:3000、>1:3500或>1:4000、>1:5000、>1:10,000、>1:20:000、>1:50:000、>1:100,000、>1:120,000、>1:150,000、>1:200,000、>1:250,000、>1:500,000、>1:750,000、>1:1,000,000或更高的。在一些实施方式中,可在至少约1000、约1500、约2000、约2500、约3000、约3500、约4000、约5,000、约10,000、约20:000、约50:000、约100,000、约120,000、约150,000、约200,000、约250,000、约500,000、约750,000、约1,000,000个或更多拷贝野生型核酸的存在下检测出1个拷贝的靶核酸,例如核酸变体。根据本发明的方法,“存在扩增”和类似术语及短语可包括扩增和更多、增强或提高的扩增。根据本发明的方法,“没有扩增”和类似术语及短语可包括扩增和更少、减弱或降低的扩增。
在一些实施方式中,所述方法包括在选择子阻断剂存在下用正向引物和反向引物扩增所述靶标区域。在这些实施方式中,所述选择子阻断剂包括在所述核酸变体存在下与所述靶标区域互补的序列。所述方法还包括检测所述靶区的扩增,此处所述靶区的扩增指示所述靶区中没有所述核酸变体。在其它实施方式中,将核酸酶耐受引物与高保真聚合酶和具有3’外切核酸酶修复活性的修复酶联用。
用于扩增核酸序列的一般方法已有详细描述并为本领域所熟知。本发明的方法可使用任何此类方法。在一些实施方式中,所述扩增使用数字PCR方法,如Vogelstein和Kinzler(“Digital PCR(数字PCR),”PNAS,96:9236-9241(1999);其全文通过引用纳入本文)所述的那些。这些方法包括先稀释含有所述靶区的样品再扩增所述靶区。稀释可包括稀释入常规平板、多孔板、纳米孔板中,以及稀释在微垫(micropad)上或以微滴形式稀释。(参见,例如,Beer NR等,“On-chip,real-time,single-copy polymerase chain reaction in picoliter droplets(皮升微滴中的芯片上、实时、单拷贝聚合酶链式反应),”Anal.Chem.79(22):8471-8475(2007);Vogelstein和Kinzler,“Digital PCR(数字PCR),”PNAS,96:9236-9241(1999);以及Pohl和Shih,“Principle and applications of digital PCR(数字PCR的原理和应用),”Expert Review of Molecular Diagnostics,4(1):41-47(2004);上述所有文献通过引用其全文纳入本文)。在一些实施方式中,所述扩增通过数字PCR进行。
在一些情况中,本发明方法用来扩增所述靶区的酶包括但不限于,高保真DNA聚合酶,例如,具有3’-5’外切核酸酶校正能力的DNA聚合酶。所述方法可使用的酶的示例包括但不限于AmpliTaq、Phusion HS II、Deep Vent和Kapa HiFi DNA聚合酶。
可通过本发明方法检测的核酸变体包括所述靶区中的缺失、所述靶区中的突变和/或所述靶区中的插入。缺失包括从所述靶区移除核苷酸碱基。可被检测的缺失包括自所述靶区缺失1、2、3、4或5个核苷酸碱基。突变可包括但不限于取代(例如颠换和转换)、脱碱基位点、交联位点和经化学改变或修饰的碱基。可被检测的突变包括所述靶区内的1、2、3、4、5或更多核苷酸碱基的突变。插入包括添加核苷酸至靶区内。可被检测的插入可包括插入1、2、3、4或5个核苷酸碱基至所述靶区内。在一些实施方式中,可通过本发明的方法检测缺失、突变和/或插入。
本发明的方法还可包括选择子阻断剂的应用。一般而言,所述选择子阻断剂包括与可能存在核苷酸变体的靶区互补的序列。根据本发明,所述选择子阻断剂内的互补序列可以在无任何核酸变体时与靶区完全互补,或与除核酸变体以外的靶区互补(即,部分互补)。在一些实施方式中,所述选择子阻断剂包括与所述靶区互补,但与所述靶区内至少一个核酸变体不互补的序列。在一些其它实施方式中,所述选择子阻断剂包括与所述靶区互补,但与所述靶区内至少两个或更多个核酸变体不互补的序列。在另外的其它实施方式中,所述选择子阻断剂包括与所述靶区互补,但与所述靶区内至少20%、30%、40%、50%、60%、70%、80%、90%、95%或98%的核酸变体不互补的序列。在其它实施方式中,所述选择子阻断剂包括与所述靶区互补,但与某些核酸变体不互补的序列,使得此类错配足以在至少一种或多种核酸变体的存在和不存在之间提供可检测的扩增差异。
所述方法还提供测定没有核酸变体和存在核酸变体相比选择子阻断剂与所述靶区相互作用之间的Tm差异。在一些实施方式中,使没有核酸变体和存在核酸变体相比选择子阻断剂与所述靶区相互作用之间的Tm差异最大化。在一些实施方式中,所述Tm差异是5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20或更多摄氏度。在一些实施方式中,所述Tm差异是10~15摄氏度、11~14摄氏度或12~13摄氏度。在一些实施方式中,所述Tm差异可以是2~3摄氏度。在一些实施方式中,所述核酸变体不存在或存在下的靶区间Tm区别越大,所述核酸不存在或存在下所述靶区的扩增差异就越显著。还可以就解链温度(Tm)来描述互补,此处互补指较多和较少互补序列的梯度,并且包括例如比其它序列更具互补性的序列但没有序列是完全互补的(即,完全和部分互补序列)。互补性较高的序列通常比互补性较低的序列显示更高的Tm(即,显示98%互补性的序列将比显示40%互补性的序列具有较高的Tm)。在本发明的方法中,在与所述靶区相互作用时显示较高序列互补性的序列通常会显示较高的Tm。
在一些实施方式中,例如序列特别富含G/C或A/T时,其Tm和互补性可能是相反的,例如互补性较高但A/T含量高的序列的Tm可能低于互补性较低但G/C含量高的序列。鉴于有关Tm和序列间相互影响的这种信息是本领域熟知且技术人员能够容易地恰当调适本发明方法,所以本发明的方法仍具可行性。
根据本发明,所述选择子阻断剂还可被设计成包含称为“开关序列(switch sequence)”的核酸序列。本发明方法中所述的包含开关序列的选择子阻断剂也被称为“开关阻断剂(switch-blocker)”。
所述开关阻断剂的开关序列是位于所述开关阻断剂的5’区的短核酸序列,并且其包含5个或更多个核苷酸,例如5、6、7、8、9、10、15、20或25或更多个核苷酸。所述开关序列以高亲和性结合靶区。在一些实施方式中,所述开关序列结合于靶区含有一个或多个核酸变体的区段。在一些实施方式中,所述开关序列和所述靶序列之间的1、2、3、4、5、6、7或更多个核酸变体(包括例如,错配、缺失、插入或突变)足以导致在至少一个或多个核酸变体的存在和不存在之间的可检测的扩增差异。在一些实施方式中,所述开关序列和所述靶序列之间的序列差异足以破坏或防止所述开关序列结合所述靶序列。在一些实施方式中,所述开关序列对包含出现核酸变体的一个或多个位置的靶区具有互补性(完全或部分)。在一些其它实施方式中,所述开关序列对除出现核酸变体的至少一个位置以外的靶区具有互补性(完全或部分)。
在一些实施方式中,所述开关阻断剂包含的开关序列连接与所述靶区互补的较长核苷酸序列(称为“长杂交区”)。长杂交区的长度可以是约10、20、30、40、50、60、70、80、90、100或更多个核苷酸。在一些实施方式中,所述长杂交区通过结合邻近或接近所述靶区的互补区来使所述开关阻断剂靶向所述核酸序列靶区。可使用本文所述的连接或接合方法,通过桥接核苷酸序列或通过本领域已知的任何其它连接或接合方法使所述开关序列与所述长杂交区连接或接合。
核酸,例如所述开关序列和所述长杂交区,可通过多种方法被连接或接合在一起。核酸序列的连接或接合可通过多种连接部分和接合方法来实现,此类各种方法都是本领域熟知的,本发明方法可使用此类任何方法。连接或接合可通过合成所述个体核酸元件并使用传统的接合方法将它们接合来实现(Current Protocols in Nucleic Acid Chemistry(《新编核酸化学指南》),2001-2011;和Bioconjugate Techniques(《生物接合技术》),第2版,Hermanson G.,T.,学术出版公司(Academic Press,Inc.),2008)。此类方法可包括零长度(zero-length)交联剂、同双功能交联剂、杂双功能交联剂(例如,NHS/马来酰亚胺杂双功能交联剂)、三功能交联剂和光敏交联剂。同双功能交联剂可包括,例如,胺-胺交联剂、硫氢基-硫氢基交联剂和硫醇-硫醇交联剂。杂双功能交联剂可包括,例如,胺-硫氢基交联剂、羧基-胺交联剂、硫氢基-碳水化合物交联剂、硫氢基-羟基交联剂、胺-硫醇交联剂和胺-羧酸交联剂。在一些实施方式中,所述正向引物和选择子阻断剂是合成的,使得它们包含合适的基团以供与所需交联试剂联用。在一些实施方式中,所述正向引物和选择子阻断剂是使用3’亚磷酰胺、5’亚磷酰胺和亚磷酰胺连接剂合成的,所述亚磷酰胺连接剂包括但不限于间隔子亚磷酰胺(Spacer Phosphoramidite)12和18(格兰研究公司(Glen Research))。
连接剂和交联剂的示例包括但不限于C18二酸基交联剂(例如,二丙烯酸酯和二甲基丙烯酸酯交联剂);Z元件;二[磺基琥珀酰亚胺基]辛二酸酯(BSSS或BS3);二琥珀酰亚胺基辛二酸酯(DSS);二[磺基琥珀酰亚胺基]戊二酸酯(BS2G);二硫代双[琥珀酰亚胺基丙酸酯](DTSP或DSP);(3,3′-二硫代双[磺基琥珀酰亚胺基丙酸酯])(DTSSP);二琥珀酰亚胺基戊二酸酯(DSG);乙二醇双(磺基琥珀酰亚胺基琥珀酸酯);乙二醇双(琥珀酰亚胺基琥珀酸酯);二琥珀酰亚胺基酒石酸酯;和NHS/马来酰亚胺杂双功能连接剂、芳基叠氮化物、二苯甲酮衍生物。
桥接核苷酸序列包括与靶核酸中邻近核苷酸序列对齐,但不通过沃森-克里克氢键相互作用结合所述靶标的互补碱基的那些核苷酸序列。此类碱基包括但不限于,脱氧次黄苷和5-硝基吲哚-2’-脱氧核糖核苷。
本发明还提供向所述开关阻断剂引入可检测标签。在一些实施方式中,所述开关阻断剂可以起报告子探针的作用。
根据本发明,所述选择子阻断剂可以是可延伸或不可延伸的。在一些情况下,所述选择子阻断剂可以通过本领域已知的多种方法修饰以保护抵御3’或5’外切核酸酶活性。所述选择子阻断剂还可包括一种或多种修饰以保护抵御3’或5’外切核酸酶活性,而此类修饰可包括但不限于,2’-O-甲基核糖核苷酸修饰、硫代磷酸酯主链修饰、二硫代磷酸酯主链修饰、氨基磷酸酯主链修饰、甲基膦酸酯主链修饰、3’末端磷酸酯修饰和3’烷基取代。在一些实施方式中,所述选择子阻断剂由于存在一种或多种修饰而耐受3’和/或5’外切核酸酶活性。
本发明方法还提供使用对所述靶序列具有增加的亲和性的选择子阻断剂。所述选择子阻断剂可包括长度增长以及经过化学修饰的选择子阻断剂。此类修饰可包括2’氟(2'-脱氧-2'-氟-核苷)修饰、LNA(锁核酸)、PNA(肽核酸)、ZNA(拉链核酸(Zip Nucleic Acid))、吗啉代、甲基膦酸酯、氨基磷酸酯、聚阳离子偶联物和2’芘修饰。在一些实施方式中,所述选择子阻断剂含有一种或多种修饰,所述修饰包括2’氟修饰(也称2'-脱氧-2'-氟-核苷)、LNA(锁核酸)、PNA(肽核酸)、ZNA(拉链核酸)、吗啉代、甲基膦酸酯、氨基磷酸酯和/或聚阳离子偶联物。在一些实施方式中,所述选择子阻断剂不含PNA或LNA。
所述选择子阻断剂还可包含可检测实体。此类可检测实体可包括例如但不限于,荧光标记和化学发光标记。此类可检测实体还可包括FRET对的成员。在一些实施方式中,所述选择子阻断剂含有可检测实体。
荧光标记可包括但不限于AMCA、DEAC(7-二甲基氨基香豆素-3-羧酸);7-羟基-4-甲基香豆素-3;7-羟基香豆素-3;MCA(7-甲氧基香豆素-4-乙酸);7-甲氧基香豆素-3;AMF(4’-(氨基甲基)荧光素);5-DTAF(5-(4,6-二氯三嗪基)氨基荧光素);6-DTAF(6-(4,6-二氯三嗪基)氨基荧光素);6-FAM(6-羧基荧光素)、5(6)-FAM尸胺;5-FAM尸胺;5(6)-FAM乙二胺;5-FAM乙二胺;5-FITC(FITC异构体I;荧光素-5-异硫氰酸酯);5-FITC尸胺;荧光素-5-马来酰亚胺;5-IAF(5-碘代乙酰胺基荧光素);6-JOE(6-羧基-4',5'-二氯-2',7'-二甲氧基荧光素);5-CR110(5-羧基若丹明110);6-CR110(6-羧基若丹明110);5-CR6G(5-羧基若丹明6G);6-CR6G(6-羧基若丹明6G);5(6)-羧基若丹明6G尸胺;5(6)-羧基若丹明6G乙二胺;5-ROX(5-羧基-X-若丹明);6-ROX(6-羧基-X-若丹明);5-TAMRA(5-羧基四甲基若丹明);6-TAMRA(6-羧基四甲基若丹明);5-TAMRA尸胺;6-TAMRA尸胺;5-TAMRA乙二胺;6-TAMRA乙二胺;5-TMR C6马来酰亚胺;6-TMR C6马来酰亚胺;TR C2马来酰亚胺;TR尸胺;5-TRITC;G异构体(四甲基若丹明-5-异硫氰酸盐);6-TRITC;R异构体(四甲基若丹明-6-异硫氰酸酯);丹酰尸胺(5-二甲基氨基萘-1-(N-(5-氨基戊基))磺酰胺);EDANS C2马来酰亚胺;荧光胺;NBD;和琥珀酰亚胺酯及其衍生物。
化学发光标记可包括但不限于Southern印迹和Western印迹方案所用的那些标记(参见,例如,Sambrook和Russell,Molecular Cloning:A Laboratory Manual(《分子克隆:实验室手册》),(第三版)(2001);其全文通过引用纳入本文)。示例包括但不限于-(2'-螺旋金刚烷)-4-甲氧基-4-(3"-磷酰氧基)苯基-1,2-二氧杂环丁烷(AMPPD);吖啶酯和金刚烷基-稳定的1,2-二氧杂环丁烷及其衍生物。
根据本发明,所述正向引物可被设计成与相对于一个或多个核酸变体的不同合适位置互补(完全或部分)。在一些实施方式中,所述正向引物的3’区与所述靶区中相对于一个或多个核酸变体位置的不同位置互补(完全或部分)。例如,在一些情况下,当与所述靶区杂交时,所述正向引物的3’区可定位在距离所述靶区中的一个或多个核酸变体0、5、10、15、20、25、30、35、40、45、50、55或60个或更多个核苷酸处。在一些实施方式中,在与所述靶区杂交时,所述正向引物的3’区定位在距离所述靶区中的一个或多个核酸变体少于约30个核苷酸处。
在一些情形中,所述正向引物和选择子阻断剂可以竞争与部分或全部靶区杂交,而这可导致灵敏度增加。例如,所述正向引物和选择子阻断剂可有0、5、10、15个或更多个核苷酸重叠。在一些实施方式中,和所述靶区杂交的正向引物的3’区与和所述靶区杂交的选择子阻断剂的5’区重叠。在一些实施方式中,当所述引物和所述选择子阻断剂在所述选择子阻断剂的5’区重叠时,所述重叠区域不包含核酸变体。在一些情况下,所述正向引物和/或所述选择子阻断剂可通过本领域已知的不同方法修饰以保护抵御3’或5’外切核酸酶活性。所述正向引物和/或所述选择子阻断剂可包括一种或多种修饰,而此类修饰可包括但不限于,2’-O-甲基核糖核苷酸修饰、硫代磷酸酯主链修饰、二硫代磷酸酯主链修饰、氨基磷酸酯主链修饰、甲基膦酸酯主链修饰、3’末端磷酸酯修饰和3’烷基取代。在一些实施方式中,所述正向引物和/或所述选择子阻断剂受保护以抵御3’或5’外切核酸酶活性。在一些实施方式中,所述选择子阻断剂和正向引物彼此连接或接合,而该组合也被称作“引物-开关(primer-switch)”。核酸,例如所述正向引物和所述选择子阻断剂,可通过多种方法被连接或接合在一起。核酸序列的连接或接合可通过多种连接部分和接合方法来实现,此类各种方法都是本领域熟知的,本发明方法可使用此类任何方法。连接或接合可通过合成所述个体核酸元件并使用传统的接合方法将它们接合来实现(Current Protocols in Nucleic Acid Chemistry(《新编核酸化学指南》),2001-2011;和Bioconjugate Techniques(《生物接合技术》),第2版,Hermanson G.,T.,学术出版公司(Academic Press,Inc.),2008)。此类方法可包括零长度(zero-length)交联剂、同双功能交联剂、杂双功能交联剂(例如,NHS/马来酰亚胺杂双功能交联剂)、三功能交联剂和光敏交联剂。同双功能交联剂可包括如胺-胺交联剂、硫氢基-硫氢基交联剂和硫醇-硫醇交联剂。杂双功能交联剂可包括如胺-硫氢基交联剂、羧基-胺交联剂、硫氢基-碳水化合物交联剂、硫氢基-羟基交联剂、胺-硫醇交联剂和胺-羧酸交联剂。在一些实施方式中,所述正向引物和选择子阻断剂是合成的,使得它们包含合适的基团以供与所需交联试剂联用。在一些实施方式中,所述正向引物和选择子阻断剂是使用3’亚磷酰胺、5’亚磷酰胺和亚磷酰胺连接剂合成的,所述亚磷酰胺连接剂包括但不限于间隔子亚磷酰胺(Spacer Phosphoramidite)12和18(格兰研究公司(Glen Research))。
连接剂和交联剂的示例包括但不限于C18二酸基交联剂(例如,二丙烯酸酯和二甲基丙烯酸酯交联剂);Z元件;二[磺基琥珀酰亚胺基]辛二酸酯(BSSS或BS3);二琥珀酰亚胺基辛二酸酯(DSS);二[磺基琥珀酰亚胺基]戊二酸酯(BS2G);二硫代双[琥珀酰亚胺基丙酸酯](DTSP或DSP);(3,3′-二硫代双[磺基琥珀酰亚胺基丙酸酯])(DTSSP);二琥珀酰亚胺基戊二酸酯(DSG);乙二醇双(磺基琥珀酰亚胺基琥珀酸酯);乙二醇双(琥珀酰亚胺基琥珀酸酯);二琥珀酰亚胺基酒石酸酯;和NHS/马来酰亚胺杂双功能连接剂、芳基叠氮化物和二苯甲酮衍生物。
根据本发明,当所述正向引物和所述选择子阻断剂通过已知的或之后发现的任何合适手段连接,例如,在“引物-开关”的情形中,所述正向引物和所述选择子阻断剂都可具有与相同靶区互补的序列,不同之处在于,它们在出现核酸变体的位置上有不同。在一些实施方式中,所述引物开关的正向引物具有与所述靶区(出现核酸变体的至少一个位置除外)互补的序列,而所述引物开关的选择子阻断剂则具有与所述相同靶区(包括出现核酸变体的一个或多个位置)互补的序列。在一些其它实施方式中,所述引物开关的正向引物具有与所述靶区(包括出现核酸变体的至少一个或多个位置)互补的序列,而所述引物开关的选择子阻断剂则具有与所述相同靶区(出现核酸变体的至少一个位置除外)互补的序列。在一些实施方式中,所述选择子阻断剂的Tm高于所述正向引物。在一些实施方式中,所述选择子阻断剂的Tm低于所述正向引物。
本发明的方法还提供将所述选择子阻断剂与报告子探针联用,或与作为报告子探针的所述开关阻断剂联用。在一些实施方式中,所述报告子探针与选择子阻断剂一起使用。
所述报告子探针可以是可延伸的或不可延伸的。在一些情况下,所述报告子探针可以通过本领域已知的多种方法修饰以保护抵御3’或5’外切核酸酶活性。所述报告子探针可包括一种或多种修饰,而此类修饰可包括但不限于,2’-O-甲基核糖核苷酸修饰、硫代磷酸酯主链修饰、二硫代磷酸酯主链修饰、氨基磷酸酯主链修饰、甲基膦酸酯主链修饰、3’末端磷酸酯修饰和3’烷基取代。在一些实施方式中,所述报告子探针受保护抵御3’或5’外切核酸酶活性。所述报告子探针和所述开关阻断器还可包含荧光标记和淬光剂。荧光标记可包括但不限于本文所述的那些。淬光剂可包括但不限于DABCYL C2胺;DABCYL C2马来酰亚胺;DABCYL酸(4-((4-(二甲基氨基)苯基)偶氮)苯甲酸);DABCYL酸(4-((4-(二甲基氨基)苯基)偶氮)苯甲酸);DABCYL酸(4-((4-(二甲基氨基)苯基)偶氮)苯甲酸);DABCYL琥珀酰亚胺基酯(4-((4-(二甲基氨基)苯基)偶氮)苯甲酸,琥珀酰亚胺基酯);DABCYL琥珀酰亚胺基酯(4-((4-(二甲基氨基)苯基)偶氮)苯甲酸,琥珀酰亚胺基酯);DABSYL氯化物(4-二甲基氨基偶氮苯-4-磺酰氯);DNP胺;DNP马来酰亚胺;DNP-X酸(6-(2,4-二硝基苯基)氨基己酸);DNP-X酸,SE(6-(2,4-二硝基苯基)氨基己酸,琥珀酰亚胺基酯)及其衍生物。在一些实施方式中,当所述报告子探针与所述选择子阻断剂一起使用时,所述报告子探针仅包含荧光标记。在一些实施方式中,当所述报告子探针与所述选择子阻断剂一起使用时,所述报告子探针包含荧光标记和淬光剂。在一些实施方式中,所述报告子在存在扩增时提供第一信号,在没有扩增时提供第二信号。所述第一和第二信号可以,例如,由于所述报告子探针与所述靶区杂交和所述报告子探针不与所述靶区杂交而出现。
所述报告子探针的5’端和所述选择子阻断剂的3’端可包括允许发生能量转移的实体。所述5’可在所述5’端处或距离所述5’端1、2、3、4、5、6或7个或更多个核苷酸处包含允许能量转移的实体。在一些实施方式中,所述允许能量转移的实体位于距离所述5’端5个核苷酸处。在一些实施方式中,当所述报告子与所述选择子阻断剂联用时,所述报告子探针在其5’端包含第一实体,而所述选择子阻断剂在其3’端包含第二实体,使得当所述选择子阻断剂和所述报告子探针与所述靶区杂交时,在所述第一实体和所述第二实体之间能发生能量转移。所述3’端可在所述3’端处或距离所述3’端1、2、3、4、3、6或7个或更多个核苷酸处包含允许能量转移的实体。
在一些情况下,允许能量转移的所述第一实体和所述第二实体是FRET对的部分。FRET(荧光共振能量转移或共振能量转移)是在两个实体的激发态之间的距离依赖性相互作用,激发能量从供方实体转移至受方实体而不发射光子。FRET对可包括但不限于,6-FAM(供体)和LC Red 640或Alexa Fluor 546(受体);荧光素(供体)和四甲基若丹明(受体);IAEDANS(供体)和荧光素(受体);EDANS(供体)和Dabcyl(受体);荧光素(供体)和荧光素(受体);BODIPY FL(供体)和BODIPY FL(受体);以及荧光素(供体)和QSY 7与QSY 9染料(受体)。
本发明的方法还可进一步包括使用本领域熟知的任何检测方法检测所述靶区的扩增。例如,可通过质谱或通过对所述扩增产物测序,通过获得所述扩增产物的解链曲线来检测。扩增产物的解链曲线随所述扩增产物中核酸变体的类型和数量而有不同。用于测定解链曲线的方法已有详细描述,并且是本领域技术人员熟知的,而本发明的方法可使用测定解链曲线的任何此类方法。使用质谱的方法和用于对核酸测序的方法也都是本领域熟知的。(参见,例如,Sambrook和Russell,Molecular Cloning:A Laboratory Manual(《分子克隆:实验室手册》),(第三版)(2001)和Plum,光学法,Current Protocols in Nucleic Acid Chemistry(《新编核酸化学指南》),2001-2011);上述全部文献通过引用其全文纳入本文)。(参见,例如,Current Protocols in Nucleic Acid Chemistry(《新编核酸化学指南》),2001-2011,尤其是Liquid Chromatography‐Mass Spectrometry Analysis of DNA Polymerase Reaction Products(《DNA聚合酶反应产物的液相色谱-质谱分析》);通过引用其全文纳入本文)。用于核酸测序的方法也是本领域技术人员常用且熟知的,而本发明的方法可使用任何测序方法。(参见,例如,Current Protocols in Molecular Biology(《新编分子生物学指南》),1995-2010;通过引用其全文纳入本文)。在一些实施方式中,解链曲线和测序反应可用来表征所述核酸变体。
本发明的方法还包括通过将所述扩增产物的量和预定水平做比较来检测所述靶区的扩增,所述预定水平与所述靶区中是否存在核酸变体相关联。用于检测扩增或对扩增产物定量的方法是本领域熟知的,并可使用任何此类方法。(参见,例如,Sambrook和Russell,Molecular Cloning:A Laboratory Manual(《分子克隆:实验室手册》),(第三版)(2001)和Gallagher,Current Protocols Essential Laboratory Techniques(《新编基础实验室技术指南》),2008);上述全部文献通过引用其全文纳入本文)。
与所述靶区中是否存在核酸变体相关联的预定水平可通过以足够大的样本数测定对应于所述靶区中核酸变体的标准水平并使用该水平作为预定水平来确定。此外,标准水平信息和用于测定标准水平的方法可获自公共数据库和其它来源。所述预定水平可以是将在用于扩增核酸的给定样品中获得的预定扩增水平,所述核酸在所述靶区内不含核酸变体。所述预定水平还可以是将在用于扩增核酸的给定样品中获得的预定扩增水平,所述核酸在所述靶区内包含核酸变体。(参见,例如,Bunk,D.M.,"Reference Materials and Reference Measurement Procedures:An Overview from a National Metrology Institute(参比材料和参比检测方法:来自国家计量研究院的概观),"Clin.Biochem.Rev.,28(4):131-137(2007);其全文通过引用纳入本文)。与预定水平的比较可通过技术人员已知的任何方法进行,并且在所述比较中可使用任何上述预定水平(参见,例如,Sambrook和Russell,Molecular Cloning:A Laboratory Manual(《分子克隆:实验室手册》)(第三版)(2001);其全文通过引用纳入本文)。
所述扩增产物的定量还可使用本领域已知的任何方法,例如使用核酸标志物如肌动蛋白或GAPDH。所述定量还可基于标准化对照品,可将所述对照品以已知的量加至所述扩增反应。此类方法是为人熟知且经描述的。(参见,例如,Sambrook和Russell,Molecular Cloning:A Laboratory Manual(《分子克隆:实验室手册》)(第三版)(2001);其通过引用全文纳入本文)。
本发明还包括反应混合物。所述反应混合物可包含至少一种核酸酶耐受引物和高保真酶或者具有3’外切核酸酶修复活性的酶组合。所述反应混合物还可包含正向引物、反向引物、选择子阻断剂、引物-开关或开关阻断剂,以及模板多核苷酸,所述模板多核苷酸包括可能存在核酸变体的靶区。在一些实施方式中,所述反应混合物中的选择子阻断剂、引物-开关阻断剂或开关阻断剂可包含在无所述核酸变体时与所述靶区互补的序列。在一些实施方式中,所述反应混合物中的选择子阻断剂、引物-开关阻断剂或开关阻断剂可包含在有所述核酸变体时与所述靶区互补的序列。所述反应混合物中的正向引物和所述反向引物可用于扩增所述模板多核苷酸的包含所述靶区的区域。在一些实施方式中,所述反应混合物还包含报告子探针或开关阻断剂,所述报告子探针或开关阻断剂在存在扩增时提供第一信号,在没有扩增时提供第二信号。在一些实施方式中,所述反应混合物包含由所述正向引物和所述反向引物扩增所述模板核苷酸而产生的扩增子。
本发明还提供试剂盒。本发明设想的试剂盒可包含核酸酶耐受引物和高保真酶或者具有3’外切核酸酶修复活性的酶组合。本发明设想的试剂盒还可包含正向引物、引物-开关、选择子阻断剂或开关阻断剂。在一些实施方式中,所述引物-开关、选择子阻断剂和开关阻断剂在没有所述核酸变体时对所述靶区具有更高的序列互补性,并且所述正向引物包含与所述靶区的上游区域互补的序列。在一些实施方式中,所述引物-开关、选择子阻断剂和开关阻断剂在存在所述核酸变体时对所述靶区具有更高的序列互补性,并且所述正向引物包含与所述靶区的上游区域互补的序列。在一些实施方式中,所述试剂盒还包含反向引物和报告子探针。
本发明还提供用于高保真扩增核酸靶区的方法。此类方法包括试剂在核酸扩增反应中的应用,所述试剂包括核酸酶耐受引物、高保真酶、阻断剂、FRET探针和Flip探针。这些试剂可单独使用或以任何组合使用,并且可与本领域已知的任何核酸扩增方法联用。本发明的这一方面可应用于多种基于聚合酶的扩增系统,包括例如但不限于,PCR、乳液PCR,以及与下一代测序平台相关联的固相扩增。
在一些实施方式中,所述扩增反应中使用核酸酶耐受引物、高保真酶、阻断剂、FRET探针和Flip探针。在一些实施方式中,使用核酸酶耐受引物、高保真酶、阻断剂和FRET探针。在一些实施方式中,使用核酸酶耐受引物、高保真酶和阻断剂。在一些实施方式中,使用核酸酶耐受引物和高保真酶。在一些实施方式中,使用核酸酶耐受引物和阻断剂。
在一些实施方式中,将核酸酶耐受引物、高保真酶、阻断剂和FRET探针中的一种或多种与所述选择子阻断剂、引物-开关、开关阻断剂和/或本文所述的任何其它方法联用。
核酸酶耐受引物包括经修饰以防止被外切核酸酶降解的引物。在一些实施方式中,所述引物已被修饰以保护抵御3’或5’外切核酸酶活性,此类修饰可包括但不限于,2’-O-甲基核糖核苷酸修饰、硫代磷酸酯主链修饰、二硫代磷酸酯主链修饰、氨基磷酸酯主链修饰、甲基膦酸酯主链修饰、3’末端磷酸酯修饰和3’烷基取代。在一些实施方式中,扩增反应中所用的所述引物和/或探针通过一种或多种修饰保护以抵御3’和/或5’外切核酸酶活性。
高保真酶允许靶序列的高保真(高度准确)扩增。在一些实施方式中,所用的酶将包括高保真DNA聚合酶,例如,具有3’-5’外切核酸酶校正能力的DNA聚合酶。所述方法可使用的酶包括但不限于AmpliTaq、Phusion HS II、Deep Vent和Kapa HiFi DNA聚合酶。
阻断剂可包括在扩增反应中能被掺入所述引物和或探针并能防止或抑制复制的任何经修饰的核苷酸或能结合核苷酸的试剂或能结合经修饰核苷酸的试剂中。阻断剂可包括2’氟(2'-脱氧-2'-氟-核苷酸)修饰,核酸酶耐受核苷酸,或具有3’-修饰的核苷酸,所述这些都抑制或防止复制。
核酸酶耐受核苷酸包括但不限于2’-O-甲基核糖核苷酸、硫代磷酸酯核苷酸、二硫代磷酸酯核苷酸、氨基磷酸酯核苷酸和甲基膦酸酯核苷酸。具有3’-修饰的核苷酸包括但不限于3’末端磷酸修饰的核苷酸、3’烷基取代的核苷酸、双脱氧核苷酸。寡核苷酸的2’氟(2'-脱氧-2'-氟-核苷酸)修饰可使用多种荧光标记作为所述氟基团,所述荧光标记包括但不限于AMCA、DEAC(7-二甲基氨基香豆素-3-羧酸);7-羟基-4-甲基香豆素-3;7-羟基香豆素-3;MCA(7-甲氧基香豆素-4-乙酸);7-甲氧基香豆素-3;AMF(4’-(氨基甲基)荧光素);5-DTAF(5-(4,6-二氯三嗪基)氨基荧光素);6-DTAF(6-(4,6-二氯三嗪基)氨基荧光素);6-FAM(6-羧基荧光素)、5(6)-FAM尸胺;5-FAM尸胺;5(6)-FAM乙二胺;5-FAM乙二胺;5-FITC(FITC异构体I;荧光素-5-异硫氰酸酯);5-FITC尸胺;荧光素-5-马来酰亚胺;5-IAF(5-碘代乙酰胺基荧光素);6-JOE(6-羧基-4',5'-二氯-2',7'-二甲氧基荧光素);5-CR110(5-羧基若丹明110);6-CR110(6-羧基若丹明110);5-CR6G(5-羧基若丹明6G);6-CR6G(6-羧基若丹明6G);5(6)-羧基若丹明6G尸胺;5(6)-羧基若丹明6G乙二胺;5-ROX(5-羧基-X-若丹明);6-ROX(6-羧基-X-若丹明);5-TAMRA(5-羧基四甲基若丹明);6-TAMRA(6-羧基四甲基若丹明);5-TAMRA尸胺;6-TAMRA尸胺;5-TAMRA乙二胺;6-TAMRA乙二胺;5-TMR C6马来酰亚胺;6-TMR C6马来酰亚胺;TR C2马来酰亚胺;TR尸胺;5-TRITC;G异构体(四甲基若丹明-5-异硫氰酸盐);6-TRITC;R异构体(四甲基若丹明-6-异硫氰酸酯);丹酰尸胺(5-二甲基氨基萘-1-(N-(5-氨基戊基))磺酰胺);EDANS C2马来酰亚胺;荧光胺;NBD;和琥珀酰亚胺酯及其衍生物。
如上所述,FRET(荧光共振能量转移或共振能量转移)也可用于核酸扩增。FRET对可包括但不限于,6-FAM(供体)和LC Red 640或Alexa Fluor 546(受体);荧光素(供体)和四甲基若丹明(受体);IAEDANS(供体)和荧光素(受体);EDANS(供体)和Dabcyl(受体);荧光素(供体)和荧光素(受体);BODIPY FL(供体)和BODIPY FL(受体);以及荧光素(供体)和QSY 7与QSY 9染料(受体)。
本发明的Flip探针是具有四个区段和两种或更多种标记的自体淬灭探针。第一靶区杂交区段约1~7个碱基,第一标记,第二靶区杂交区段约4~10个碱基,第三靶区杂交区段约4~9个碱基,第四区段约4~10个碱基和第二标记。(参见,例如,图21)。在一些实施方式中,所述第二区段和所述第四区段彼此互补从而在无靶区时所述第二区段和第四区段杂交以定位所述第一和第二标记彼此紧密接近。在一些实施方式中,所述第一标记是荧光团而所述第二标记是淬光剂。在一些实施方式中,所述第一标记是淬光剂而所述第二标记是荧光团。在一些实施方式中,所述荧光团是第一标记而所述淬光剂是第二标记。在一些实施方式中,所述荧光团靠近所述Flip探针的5’端,并且紧密接近位于所述选择子探针3’端的标记以使所述探针不与靶区结合时能有FRET相互作用。在一些实施方式中,所述Flip探针的第一区段被用于“间隔”所述两个标记间的距离以供最佳FRET相互作用。
在一些实施方式中,将所述Flip探针与选择子阻断剂、引物-开关、开关阻断剂和/或本文所述的任何其它方法联用。在这些实施方式中,所述Flip探针被设计成在没有靶标时产生高水平淬光,而在存在靶区时,所述Flip探针被设计成结合所述靶序列并产生显著荧光。在一些实施方式中,与所述靶区的结合使位于所述Flip探针上的荧光吸收物能够通过FRET将能量转移至位于所述选择子阻断剂上的发射物。
用于进行本文所述方法的仪器是容易获得的。此类仪器可包括用于实时PCR和终点PCR试验、乳液PCR、固相PCR、解链曲线分析和测序分析的仪器。此类仪器包括生命技术公司(Life Technologies)7500Fast Dx实时仪器(其还能用于高分辨率解链曲线分析)和3500xl毛细管凝胶仪器。也设想将可用于本发明方法的本领域已知的其它仪器供本领域技术人员在本发明方法实践中使用。
实施例
实施例1.用于EGFR T790M突变检测的选择子试验设计。
所述选择子试验的一种模式使用不对称PCR(采用10~20倍过量反向引物)并通过共振能量转移(FRET)检测所述反向链来进行终点解链曲线分析。所述FRET对是选择子和报告子寡核苷酸,其分别连接6-FAM和LC Red 640或Alexa Fluor 546荧光团。此处所用的选择子寡核苷酸是15聚体(具有2’-氟核糖核苷取代以提高其Tm)。所述选择子与所述野生型序列互补,并且起野生型扩增阻断剂的作用。此外,所述正向引物和选择子之间有六个核苷酸的重叠。所述选择子浓度通常以高4倍的水平使用,以胜过所述正向引物去结合所述野生型模板。由于所述野生型特异性核苷酸的中心位置及其增强的亲和性,所述选择子在突变型和野生型模板之间显示出显著的Tm差异。在选择子A的情况下,该差异为约13℃(也参见图2)。所述报告子被设计成具有的Tm比所述选择子高约10℃,从而其在所述选择子开始脱离(dissociating)的温度下与所述靶标结合。这种解链温度差异使其能够通过解链曲线分析来区分突变型和野生型模板。
实施例2.采用选择子和报告子寡核苷酸探针在Kapa HiFi反应条件下检测野生型和突变合成靶标。
10μl的反应体积混有1×HiFi缓冲液、0.4μM选择子A(带6-FAM标记)、0.4μM报告子A(带LC Red 640标记),0.4μM合成的突变型或野生型靶标。该反应混合物被加热至95℃ 5分钟,然后进行两个如下循环:98℃下30秒、在57℃下30秒。然后进行解离曲线分析(95℃保持1分钟,45℃保持30秒,然后以1%变温至95℃)。在用户定义的LC Red 640通道中检测LC Red 640FRET信号。
实施例3.采用 DNA聚合酶、Stoffel片段(生命技术公司(Life Technologies)),使用PCR进行选择子试验。
所述反应以10μl反应体积进行,其中有1×Stoffel缓冲液(10mM KCl、10mM Tris-HCl,pH 8.3)、4mM MgCl2、0.3mM Cleanamp dNTP(三连生物技术公司(TriLink Biotechnologies))、0.1μM正向引物、1μM反向引物、0.4μM选择子A(带6-FAM标记)、0.4μM报告子B(带Alexa Fluor 546标记)、2U Stoffel片段和所指示量的基因组DNA。所述PCR反应物加载至384孔板。PCR循环在ABI7900HT仪器中完成,循环条件如下:94℃保持3分钟,在进行55个如下循环:94℃下30秒、60℃下30秒,然后进行解离曲线分析(94℃保持1分钟,45℃保持30秒,然后1%变温至94℃)。在TAMRA通道中检测所述Alexa Fluor 546FRET信号。所述PCR反应在ABI 7900HT仪器上运行。该运行结束时的解离曲线分析显示,在突变和野生型产物之间存在约7℃的差异。
实施例4.使用高保真Kapa HS DNA聚合酶在复杂背景中检测突变T790M的选择子试验。
采用Kapa HiFi热启动DNA聚合酶(卡帕生物系统公司(Kapa Biosystems))的PCR以10μl反应体积完成,其中有1×HiFi缓冲液(包含2mM MgCl2和其它成分)、0.3mM dNTP、0.1μM正向引物、2μM反向引物、0.4μM选择子A(带6-FAM标记)、0.4μM报告子A(带LC Red 640标记)、0.4U Kapa HiFi热启动DNA聚合酶和所指示量的基因组DNA。所述PCR反应加载至384孔板。PCR循环在ABI7900HT仪器中完成,循环条件如下:95℃保持5分钟,进行55个如下循环:98℃下30秒、57℃下30秒,然后进行解离曲线分析(95℃保持1分钟,45℃保持30秒,然后1%变温至95℃)。在用户定义的LC Red 640通道中检测LC Red 640FRET信号。在6.6ng野生型DNA的背景中测得14pg和28pg突变型DNA。较大量的突变型DNA(28pg)所得结果10个反应中有9个显示突变型峰,而1个反应在所述野生型的解链温度处显示较低的峰。就14pg突变型和6.6ng野生型而言,10个反应中有6个显示突变型峰,而其余反应显示解链温度接近所述野生型的较低峰。实施例5.针对T790M突变的选择子附加试验。
该试验使用针对野生型扩增的阻断剂(如同所述选择子试验的情况),但就该选择子附加试验而言,所述阻断剂在3’端包含LC Red 640或Alexa Fluor 546荧光团(其同样作为FRET对以供解链曲线分析,见下文)。此外,所述报告子是双标记探针,这允许在退火/延伸步骤过程中实时检测PCR产物的累积。该报告子在5’端处或接近5’端处标记有6-FAM标记,并且在3’端处具有Dabcyl淬光剂。所述报告子的设计使得在靶标不存在时,在退火/延伸条件(56~60℃)下,所述报告子的茎结构产生环,所述环使得所述6-FAM紧密靠近所述Dabcyl淬光剂以产生很低的背景。在扩增子存在下,所述报告子结合打开所述茎-环结构。增加的6-FAM荧光量与扩增子的存在量相关联。使用实时检测来鉴定所述含有大幅过量野生型分子的样品中T790M突变型分子的存在。这通过使Cq值和已知量的T790M突变型和野生型的Cq值相关联来进行。当实时Cq值指示错配存在时,就所述错配存在而言它们被核实。这通过使用亚氨基生物素来选择性捕获两条链中的一条并进行解链曲线分析和测序来完成(见图8)。
亚氨基生物素对亲和素具有pH依赖性的结合常数。在pH 10下它与亲和素树脂结合而在pH 4下它可从亲和素树脂洗脱。使用磁性亲和素珠(斯菲罗公司(Spherotech,Inc.))捕获含亚氨基生物素的链。通过热、低盐和变性剂的联合使非亚氨基生物素化的链与亚氨基生物素化的链分离。在pH 4下从所述磁性亲和素珠洗脱所述分离的亚氨基生物素化的链。然后,通过将所述分离的亚氨基生物素化的链、选择子和报告子(作为FRET对)组合并运行解离曲线(如实施例4所述)来进行解链曲线分析。检测在LC Red 640或Alexa Fluor 546通道中完成。测序反应通过使用所述亚氨基生物素化的链和/或所述非亚氨基生物素化的链,采用终结子(Terminator)v1.1循环测序试剂盒按照生产商说明来进行。测序反应在ABI3730DNA分析仪上运行以供分析。
表1:用于选择子试验的寡核苷酸:
[*指示硫代磷酸酯键;小写字母指示2’-氟核糖核苷]
表2:用于选择子附加试验的寡核苷酸:
[*指示硫代磷酸酯键;小写字母指示2’-氟核糖核苷]
实施例6.使用选择子试验检测复杂野生型基因组背景中的罕见突变。
在所述选择子试验(所有反应都采用选择子)中,在50ng ABR16965基因组DNA(约14000拷贝的野生型对照)存在或不存在下使用递增量的H1975基因组DNA(0.05ng、0.5ng、5ng或50ng,其分别对应于7、70、700和7000拷贝的T790M)。见图9。将扩增数据作图,并在图中显示(左图)。显示50pg H1975和50ng ABR16965的混合物(突变型对野生型拷贝的1:2000混合物)的选择子试验反应的解链曲线分析和测序数据。由序列峰上的箭头显示所述T790M突变的特定核苷酸(A),并由框指示所述选择子结合的区域。结果:
在选择子试验中,在选择子和约14000拷贝的ABR16965基因组DNA(野生型对照)的存在下使用递增量的H1975基因组DNA(从7直至约7000个拷贝)。从扩增数据图中可见,所述野生型对照DNA的存在对所述T790M突变型的扩增影响很小(比较H1975和H1975+ABR16965图)。这表明,所述选择子(SelectorTM)试验在所测试浓度范围显示的线性回归,指示该试验在所测试的范围内是定量的。并且,显示所述突变型解链曲线峰的解链曲线分析和测序结果指示,当50pg H1975(7个拷贝的T790M)与50ng ABR16965(14000个拷贝的EGFR)混合时,可测得所述T790M突变。当较大量的H1975与野生型DNA混合时,也能测得所述T790M突变型(数据未显示)。因此,本文的数据显示,当突变型DNA与野生型DNA以多至1:2000的比例混合时,所述选择子(SelectorTM)试验能够检测所述突变型DNA。
方法:
选择子试验反应在10μl体积中完成,其中有以下成分:0.2μM正向引物(5’-C*A*CCGTGCAR*C*T*C-3’;R=A/G;*指示硫代磷酸酯)、2μM反向引物(5’-T*G*TGTTCCCGGACAT*A*G*T-3’;*指示硫代磷酸酯)、0.3μM选择子6(5’-2'OMe(a*u)*cacgcagcu*c*a*(LCRed640)-3’;*指示硫代磷酸酯;小写字母指示2’-氟核糖核苷)、0.6μM报告子4(5’-u*g*ccc(C7-NH)(6-FAM)TTCGGCTGCcuccu GGAGCCG*A*A*(Dabcyl)-3’;*指示硫代磷酸酯;小写字母指示2’-氟核糖核苷)、3mM MgCl2、0.4mM dNTP、0.4U Kapa HiFi热启动DNA聚合酶(卡帕生物系统公司(Kapa Biosystems),目录号KK2101)、1×HiFi缓冲液、0.2μl ROX参比染料(生命技术公司(LifeTechnologies),目录号12223-012)。PCR反应加载至384孔板,而PCR循环在ABI 7900HT仪器中按以下循环条件完成:95℃保持5分钟,进行55个如下循环:98℃下20秒、61℃下30秒、52℃下1分钟、69℃下15秒,然后进行解离曲线分析(95℃保持1分钟,40℃保持30秒,然后1%变温至95℃)。扩增产物的检测通过在所述52℃循环步骤时监测6-FAM和LCRed640荧光来完成。对于解链曲线分析,在所述40℃~95℃转变过程中监测LCRed640信号。
对于桑格(Sanger)测序,用QIAquick PCR纯化试剂盒(凯杰公司(Qiagen))纯化PCR产物,然后使用终结子v1.1循环测序试剂盒(生命技术公司(LifeTechnologies),目录号4337449)按照生产商说明采用测序引物T790M seq6(CATAGCAGCTGTTTTCCCAGTCATCGACGTTGTAGTCCAGGAGGCAGCCGAA)来完成测序反应。测序反应使用Centri-SepTM柱(生命技术公司(LifeTechnologies),目录号401762)纯化并在3730DNA分析仪上分析。实施例7.使用所述选择子试验抑制野生型扩增的实证。
使用来自肺癌血样的WGA材料的野生型模板完成选择子试验。见图10。显示选择子存在或不存在下的野生型模板扩增。将检测的拷贝绘制入标准曲线,所述标准曲线通过使用H1975基因组DNA标准品在选择子(0.05ng、0.5ng、5ng和50ng)存在或不存在下进行选择子试验而获得(仅显示带选择子的反应中的标准曲线)中作图。
结果:
使用对T790M呈阴性的肺癌血样的WGA材料生成野生型模板。为此,将所述WGA材料预扩增15个循环以产生含有所述T790M突变区的228bp的PCR片段,然后在选择子试验中将该片段用于嵌套式PCR。如图10中的扩增曲线所示,将选择子添加至该选择子试验反应阻断所述野生型模板的扩增,该扩增直至55个循环时仍不可检测。野生型拷贝的数量通过在同一板上用H1975基因组标准品运行标准曲线来测定,并计算为约10800。
方法:
该实验中使用的WGA材料来自肺癌血样,其使用CEETM微通道制备,如图13和14所述。所述WGA材料用正向引物FP19(A*C*CGTGCARCTCA*T*C*A;R=A/G;*指示硫代磷酸酯)和反向引物RP14(G*C*ACGCACACACAT*A*T*C;*指示硫代磷酸酯)在如图1所述的选择子试验反应条件下预扩增,不同之处在于,不使用选择子和报告子,循环完成15个循环并省略解链曲线分析。所得材料用10mM Tris-HCl pH 8.0、0.1mM EDTA稀释50倍,并在选择子存在或不存在下用于选择子试验反应,如图9所述。
实施例8.采用自肺癌患子血浆分离所得核酸的选择子试验。
在T790M选择子试验中使用从肺癌患子血浆样品制备的核酸。该选择子试验反应在选择子存在或不存在下进行。后者的条件允许野生型序列的扩增,并作为所述反应条件和血浆制备中存在核酸的对照。显示所述选择子试验PCR产物的解链曲线分析,标出野生型解链曲线峰和所述突变型的位置。对于选择子PCR反应的解链曲线分析,在扩增后添加选择子和报告子。对所述选择子试验反应产物测序以确定突变型T790M(CAT)或野生型序列(CGT)的存在。在所述序列下标记选择子的框指示选择子结合的位置。
结果:
核酸从肺癌患者的血浆制得,所述选择子试验中选择子不存在或存在。在选择子存在下的PCR结果指示,检测到突变型扩增(参见6-FAM和LCRed640通道中的有选择子反应)。所述突变型序列扩增通过所述扩增产物的解链曲线分析得以进一步确定。所述有选择子反应的解链曲线峰显示其Tm比在所述–选择子反应中观察到的野生型解链曲线峰低约13℃。为了确认突变的存在,对所述有选择子的PCR产物测序,并鉴定出T790M的突变特征。所述无选择子PCR产物的测序结果鉴定为野生型序列。基于标准曲线(图11B),在3mL血浆中发现的T790M拷贝数为577,而发现的EGFR拷贝数为46348。
方法:
将来自肺癌患者(18299)的血液(约8mL)注入CEE-SureTM管(生物概念公司(Biocept,Inc.);包含抗凝集试剂),并在取血48小时内从所述血浆部分制备核酸。为此,将该全血以3000×g室温离心5分钟,并将获得的血浆部分以16000×g于4℃再离心10分钟。使用约3ml所述血浆上清,采用QIAamp循环核酸试剂盒(凯杰公司(Qiagen),目录号55114)按照生产商说明作以下修改来分离核酸:蛋白酶K消化在60℃进行60分钟,省略运载体RNA的添加,并且使用20μl所提供的洗脱缓冲液进行洗脱。
将1微升来自血浆的核酸制品(总体积为约17μl)直接用于10μl前文所述的T790M选择子试验PCR反应中。
为测定在选择子不存在下(参见上文无选择子)进行的选择子试验反应的PCR产物的解链曲线图,在扩增后添加选择子和报告子,并且在前述相同条件下进行解离曲线分析。
将图11A显示的所述血浆核酸反应的扩增数据在标准曲线图上作图。所述标准曲线通过在选择子存在或不存在下采用递增量的H1975基因组DNA进行所述选择子(SelectorTM)试验来获得。所述反应与所述血浆核酸在同一板上进行。
实施例9.源自肺癌患子血浆的mRNA的选择子试验。
将从肺癌患者(18280)核酸样品制备的cDNA如上所述(见实施例8)用于在选择子存在或不存在下进行所述选择子试验。使用所述cDNA的反应以一式两份进行。所述反应之一显示选择子存在下的扩增。在相同图中显示50pg H1975的扩增(在选择子存在下,T790M约7个拷贝)。所述扩增产物的解链曲线图对应于突变型,并且测序确认了所述扩增PCR产物中T790M突变的存在。
方法:
使用Superscript III第一链合成系统(生命技术公司(LifeTechnologies),目录号18080-051)从临床肺癌样品的经DNA酶I处理核酸制备cDNA。使用由所述试剂盒提供的寡(dT),并且按照生产商说明进行所述合成。
结果:
我们检测到来自肺癌血浆样品的所述cDNA制备物中存在T790M突变型。在3mL血浆中检测到约8个RNA拷贝的T790M。
实施例10.回收自生物概念(Biocept)CEETM微通道的细胞的选择子试验。
显示采用全血中H1975的掺料找回试验的扩增数据。参见图13A。所述数据在标准曲线中作图,所述标准曲线获自采用递增量的H1975基因组DNA对照的反应(上图)。在选择子存在下的试验允许对掺料H1975细胞的定量(掺料样A、掺料样B和掺料样C的数量递增),而在选择子不存在下的反应允许对微通道洗脱物中所见背景细胞(WBC)的定量)。
通过解链曲线分析来分析图13A的扩增产物。参见图13B。对于无选择子PCR反应的解链曲线分析,在扩增后添加选择子和报告子。指示突变型和野生型解链曲线峰的位置。所述样品用于桑格(Sanger)测序反应以确定突变型或野生型序列的存在。选择子结合的位置显示在所述序列下。
方法:
在CEE-SureTM管中将递增数量的H1975细胞掺料入全血内。制得暗黄层并用生物素化抗体的混合物孵育,所述生物素化抗体特异性识别包含EpCAM的癌细胞表面上的标志物。然后使暗黄层运行通过链霉亲和素被覆的微通道(CEETM微通道,生物概念公司(Biocept,Inc.))。捕获的H1975细胞通过细胞角蛋白染色来显现并计数,然后从所述通道洗脱。在用蛋白酶消化并使该酶失活之后,取1μl用于所述选择子试验(如实施例9所述)。
结果:
使用生物概念公司(Biocept)的CEETM微通道将掺料H1975细胞自全血回收。掺料样A、掺料样B和掺料样C分别含有0、3和16个细胞/μL微通道洗出液(按洗脱之前和之后所述微通道的CK+染色来判断)。在洗脱和蛋白酶消化后,所述基因组DNA物质用于在选择子存在或不存在下的选择子试验。基于标准曲线,掺料样A、掺料样B和掺料样C中检测到的H1975细胞数分别为0、3和36个/μl微通道洗出液。因此,所述选择子(SelectorTM)试验结果与所述微通道结果紧密匹配。
实施例11.回收自生物概念(Biocept)CEETM微通道并使用WGA扩增的细胞的选择子试验。
使实施例9中分析的相同掺料找回反应全基因组扩增,并在选择子存在下用于所述选择子试验反应。分别含有0、3和16个细胞/微通道洗出液的掺料样A、掺料样B和掺料样C的WGA反应的扩增数据和解链曲线分析示于图14A。所述选择子反应一式两份运行,并显示这两个反应的结果。
对采用显示扩增的WGA材料(掺料样B和掺料样C)所完成选择子试验反应测序以校验所述突变的存在。显示T790M特定突变(CAT)的位置。参见图14B。通过所示序列下的框指示选择子的结合区域。
结果:
使来自上述掺料找回实验的基因组DNA物质全基因组扩增(WGA),并在所述选择子试验中测试所述T790M突变的存在。采用掺料样B和掺料样C样品作为模板,分别含6个H1975细胞或32个H1975细胞用于所述WGA反应(参见方法)测得扩增。不出所料,所述掺料样A(0个H1975细胞)样品不显示扩增。解链曲线分析和测序结果证实了掺料样B和掺料样C样品中的WGA材料中存在T790M突变。因此,所述选择子试验也成功用于来自微通道洗脱细胞的WGA材料,并且低至6个细胞当量得以WGA扩增并用所述选择子试验检测出。
方法:
对洗脱自所述通道的H1975材料进行全基因组扩增,使用Repli-g迷你试剂盒(凯杰公司(Qiagen))按照生产商说明进行。取2微升洗脱自所述微通道的H1975材料(掺料样A:0个细胞/μl,掺料样B:3个细胞/μl,掺料样C:16个细胞/μl)用于所述WGA反应。将所扩增的DNA在10mM Tris-HCl pH 8.0,0.1mM EDTA中稀释至40ng/μl,然后添加至所述选择子试验。如实施例9所述进行所述选择子(SelectorTM)试验,不同之处在于,向所述反应添加1mM EGTA。
实施例12.采用重叠正向引物的选择子试验。
该选择子试验采用与所述选择子重叠的正向引物,使用野生型模板,在选择子存在或不存在下进行。参见图15A。还在选择子和野生型模板存在下测试了50pg H1975的扩增。显示该选择子试验反应的实时PCR和解链曲线分析。对于无选择子PCR反应的解链曲线分析,在扩增后添加选择子和报告子。
结果:
在该选择子试验中使用与所述选择子重叠的正向引物。测试不同量的野生型模板以测定野生型模板扩增被选择子有效阻断,但在相同反应中存在时仍允许50pg H1975突变型基因组DNA有效扩增的野生型模板的量。在所用条件下,经测定,有约800拷贝的野生型模板(基于选择子不存在下绘制的标准曲线;数据未显示)的扩增受阻断,而在相同混合物中存在时约7个突变型拷贝(50pg H1975)能够扩增(参见图15A)。对在选择子不存在下野生型模板的选择子(SelectorTM)试验反应(参见图15B,图A)和在选择子存在下野生型模板和50pg H1975突变型的混合物的选择子(SelectorTM)试验反应(参见图15B,图B)测序以确认所扩增模板的身份。
方法:
准确按照实施例9进行选择子试验反应和测序,不同之处在于,所述选择子试验使用正向引物FP14ovl(C*G*TGCARCTCA*T*C*A;R=A/G;*指示硫代磷酸酯)。如实施例10所述生成所述野生型模板,并显示在10mM Tris-HCl pH8.0,0.1mM EDTA中稀释一千倍的选择子试验数据。
实施例13.低保真酶在扩增中引入序列差错并降低性能。
在该实施例中,使用AmpliTaq金DNA聚合酶替代先前实施例中所用的高保真/修复酶Kapa HiFi热启动DNA聚合酶。在酶的变化以外,反应条件与实施例6中的那些保持一致,不同之处在于将变性稍降至95℃,并在扩增缓冲液中使用3mM Mg++。上述改变皆为了适应所述AmpliTaq酶的需要。在图16中,箭头显示在序列中引入了G>A差错,而这与所述AmpliTaq金的低保真性相关联。还显示在T790M突变中,所示G核苷酸(标记为WT)变成了A。通过所示序列下的框指示选择子的结合区域。当使用所述Kapa HiFi酶进行该相同试验时,既没有出现显著扩增,又没有迹象表明引入任何显著的掺入差错(参见实施例7)。
该实施例说明两个关键因素。首先,当所述选择子试验采用高保真酶如具有3’外切核酸酶修复活性的Kapa HiFi酶时具有更好的性能。由于选择子试验是用于检测罕见事件,由酶引入的任何差错都可能会破坏试验性能。因此,可采取将高保真酶与核酸酶保护的引物、阻断剂和探针联用。第二,在该实施例中,选择子的应用及其抑制野生型信号但允许突变得以扩增的能力为任何聚合酶驱动的扩增反应提供了灵敏度模型。因此,该实施例提供直接证据证明核酸酶耐受引物和高保真酶的组合,或者具有3’外切核酸酶修复活性的酶的组合会改进任何聚合酶依赖性扩增反应的性能,并保持更高程度的序列保真性。这些方法可用于任何PCR反应,包括乳液PCR和固相PCR,并可应用至下一代测序法和平台。
所述选择子试验高度抑制野生型序列由正向引物导致的扩增。同时,所述反向引物仍驱动线性扩增。若在这一综合下来极低水平的扩增期过程中,在所述选择子的足印(foot-print)内发生掺入差错,则由选择子导致的阻断将被减少,并且将发生指数性扩增。此外,当使用AmpliTaq金时,常规会观察到一种或多种误掺入差错。如此,本发明方法使用高保真聚合酶能减少或预防此类差错。
结果:
在选择子存在下使用AmpliTaq金DNA聚合酶和约680拷贝的野生型模板(按实施例7所述制备)进行选择子试验。相同量的野生型模板在所述选择者试验中使用Kapa HiFi热启动DNA聚合酶与选择子存在下没有产生任何可测得的扩增产物(55个扩增循环后)。然而,在相似的循环条件下(并含5mM、7mM或10mM MgCl2)在选择子存在下使用AmpliTaq DNA聚合酶,在每个情况下都观察到了扩增产物和指示突变型产物存在的解链曲线峰(图16未显示数据)。来自个体孔的突变型产物的测序显示,在选择子结合区域中有不同突变(图16)。此处显示的示例是G>A突变。另一个常见的突变是T790M核苷酸G>A变化。这指示选择子的存在可导致对由酶所引入突变的选择性扩增。同样,本发明方法使用高保真聚合酶能减少或预防此类差错。
方法:
选择子试验反应使用所述AmpliTaq DNA聚合酶在具有以下成分的10μl体积中进行:0.2μM正向引物(与实施例6所述相同)、2μM反向引物(与图1所示相同)、0.3μM选择子6(与实施例6所述相同)、0.6μM报告子4(与实施例6所述相同)、5mM MgCl2、0.2mM dNTP、3U AmpliTaq (生命技术公司(LifeTechnologies),目录号4311814)、1×PCR金缓冲液(15mM Tris-HCl pH 8.0,50mM KCl)、0.2μl ROX参比染料(生命技术公司(LifeTechnologies),目录号12223-012)。PCR反应加载至384孔板,而PCR循环在ABI 7900HT仪器中按以下循环条件进行:95℃保持5分钟,进行55个如下循环:95℃下20秒、61℃下30秒、52℃下1分钟、69℃下15秒,然后进行解离曲线分析(95℃保持1分钟,40℃保持30秒,然后1%变温至95℃)。扩增产物的检测通过在所述52℃循环步骤监测6-FAM和LC-Red640荧光来进行。对于解链曲线分析,在所述40℃~95℃转变过程中监测LC-Red640信号。准确按照实施例6的描述进行桑格(Sanger)测序。
实施例14.使用简单FRET报告子系统的选择子试验。
对于在FAM-标记阻断剂(阻断剂8)和LC-Red 640-标记锚定子(锚定子5)存在下的反应,进行选择子试验扩增和解链曲线分析并予以显示。在所示实验中将与所述阻断剂重叠的正向引物(详细参见方法)与实施例6所述的反向引物联用。所述选择子实验使用50pg H1975基因组DNA(含有约7拷贝的T790M突变型)或约1100拷贝的野生型EGFR DNA模板(如实施例7所述制备)进行。在实时PCR图中由箭头指示扩增产物。(NTC:无模板对照)。
结果:
所述选择子试验使用FAM-标记的阻断剂(阻断剂8)、LC-Red 640-标记锚定子(锚定子5)、与所述阻断剂重叠的正向引物和先前实验中所用的反向引物进行。检测到50pg H1975基因组DNA(约7拷贝的T790M突变型)中的突变型扩增,然而,约1100拷贝的野生型EGFR DNA模板被有效阻断且不显示任何扩增。将7拷贝的H1975和约1100拷贝的野生型EGFR混合再次显示突变型扩增。
方法:
选择子试验反应在含有以下成分的10μl体积中进行:0.5μM正向引物(5’-C*G*TGCARCTCA*T*C*A-3’;R=A/G;*指示硫代磷酸酯;与阻断剂重叠)、2μM反向引物(5’-T*G*TGTTCCCGGACAT*A*G*T-3’;*指示硫代磷酸酯)、0.4μM阻断剂8(5’-2'OMe(U*C)*aucacgcagcu*c*a*(6-FAM)-3’;*指示硫代磷酸酯;小写字母指示2’-氟核糖核苷)、0.4μM锚定子5(5’–LC-Red 640-C3-C3*T*GC CCT TCG GCT GCC TC*C*T*C3-3’;*指示硫代磷酸酯;小写字母指示2’-氟核糖核苷:C3是三碳间隔子)、3mM MgCl2、0.4mM dNTP、0.4U Kapa HiFi热启动DNA聚合酶(卡帕生物系统公司(Kapa Biosystems),目录号KK2101)、1×HiFi缓冲液、0.2μl ROX参比染料(生命技术公司(LifeTechnologies),目录号12223-012)。PCR反应加载至384孔板,而PCR循环在ABI 7900HT仪器中按以下循环条件进行:95℃保持5分钟,进行55个如下循环:98℃下20秒、61℃下30秒、52℃下1分钟、69℃下15秒,然后进行解离曲线分析(95℃保持1分钟,40℃保持30秒,然后1%变温至95℃)。扩增产物的检测通过在所述52℃循环步骤监测LC-Red 640荧光来进行。对于解链曲线分析,在所述40℃~95℃转变过程中监测LC-Red 640信号。
实施例15.使用所述选择子试验检测KRAS G12C突变。
在KRAS选择子的存在或不存在下,使用H2122基因组DNA(G12C突变纯合的)和野生型基因组DNA(对照血液17004;约14000拷贝的KRAS)的混合物进行扩增、解链曲线分析和测序结果。在实时PCR图中由箭头指示扩增产物(参见图18)。在所述测序结果中,由箭头指示KRAS G12C突变特异性核苷酸(野生型:C,G12C:A)。通过所示序列下的框指示选择子的结合区域。
结果:
使用50pg H2122基因组DNA(G12C突变纯合的;约14拷贝)和50ng野生型基因组DNA(对照血液17004;约14000拷贝的KRAS)的混合物,在选择子存在下进行针对KRAS G12C突变的选择子试验反应。我们能够检测到突变型扩增,并且所述扩增产物的解链曲线分析显示所述突变型的特征峰(Tm为约52℃)。这通过测序得到证实,所述测序显示G12C突变特异性的C>A核苷酸变化(图18,上图)。相反,相同量的野生型基因组DNA在选择子不存在下显示的解链曲线峰相较于所述突变型移位约12℃至64℃。测序证实在所述扩增产物中存在KRAS野生型特异性的C核苷酸(图18,下图)。
方法:
选择子试验在含有以下成分的10μl体积中进行:0.3μM正向引物(5’-A*T*ATAAACTTGTGGTAGT*T*G*G-3’;*指示硫代磷酸酯)、2μM反向引物(5’-G*C*ATATTAAAACAAGATTT AC*C*T*C-3’;*指示硫代磷酸酯)、0.3μM选择子1(5’-2'OMe(A*G)*cugguggcg*u*a*(LC Red 640)-3’;*指示硫代磷酸酯;小写字母指示2’-氟核糖核酸)、0.5μM报告子2(5’-g*g*caa(6FAM)GAGTGCCuugacgauGGCAC*T*C*(Dabcyl)-3’;*指示硫代磷酸酯;小写字母指示2’-氟核糖核酸)、3mM MgCl2、0.4mM dNTP、0.4U Kapa HiFi热启动DNA聚合酶(卡帕生物系统公司(Kapa Biosystems),目录号KK2101)、1×HiFi缓冲液、0.2μl ROX参比染料(生命技术公司(LifeTechnologies),目录号12223-012)。PCR反应加载至384孔板,而PCR循环在ABI 7900HT仪器中按以下循环条件进行:95℃保持5分钟,进行55个如下循环:98℃下20秒、61℃下30秒、52℃下1分钟、69℃下15秒,然后进行解离曲线分析(95℃保持1分钟,40℃保持30秒,然后1%变温至95℃)。扩增产物的检测通过在所述52℃循环步骤监测6-FAM和LC-Red640荧光来进行。对于解链曲线分析,在所述40℃~95℃转变过程中监测LC-Red640信号。对于桑格(Sanger)测序,用QIAquick PCR纯化试剂盒(凯杰公司(Qiagen))纯化PCR产物,然后使用终结子v1.1循环测序试剂盒(生命技术公司(LifeTechnologies),目录号4337449)按照生产商说明采用测序引物(CATAGCAGCTGTTTTCCCAGTCATCGACGTTGTACGTCCACAAAATGATTCTGAA)来进行测序反应。测序反应使用Centri-SepTM柱(生命技术公司(LifeTechnologies),目录号401762)纯化并在3730DNA分析仪上分析。
使用QIAmp DNA血液迷你试剂盒(凯杰公司(Qiagen),目录号51104),按照生产商提供的针对培养细胞的方案从细胞系(H1975,H2122)制备基因组DNA。使用PAXgene血液DNA试剂盒(PA公司(PreAnalytix),目录号761133)从对照血样(ABR16965,17004)制备基因组DNA,且血液采集在PAXgene血液DNA管(PA公司,目录号761125)中。
实施例16.通过在采用Deep Vent(无外切活性)DNA聚合酶的PCR中使用引物开关寡核苷酸构建体区分点突变。
结果:
评价所述引物-开关寡核苷酸构建体对有单点突变差异的模板序列之间PCR区分的效果。测试用于检测T790M突变的引物-开关构建体。该测试通过使用合成的野生型和突变型靶序列进行。针对这些研究使用引物-开关结构(参见图19),与个体匹配和错配靶标一同,使用采用插入型9染料的实时PCR分析来测试(参见方法部分)。结果显示,相较于野生型,所述突变型T790M等位基因以约4ΔCq优先扩增,获得的对应实时Cq分别为23和27。
方法:
对于这些研究,制备两种单链模板序列。制备称为“野生型”的第一序列(5’-TTGTGTTCCCGGACATAGTCCAGGAGGCAGCCGAAGGGCATGAGCTGCGTGATGAGCTGCACGGTGGAGGTGAGGCAGAT-3’),和称为“T790M”的第二序列(5’-TTGTGTTCCCGGACATAGTCCAGGAGGCAGCCGAAGGGCATGAGCTGCATGATGAGCTGCACGGTGGAGGTGAGGCAGAT-3’)。各PCR混合物使用开关阻断剂引物(3'-ACTACTCGACGTGCCACCTCC-(5')-(S18)-(S18)-ctcatcacgcagctc-(C3)-3';小写字母指示2’-氟核糖核苷;C3是三碳间隔子;S18指示间隔子18(六乙二醇),而(5')指示5'-CCTCCACCGTGCAGCTCATCA-3'的反向合成)作为正向引物,和未修饰的反向引物(5'-CCGGACATAGTCCAGGAGGCAG-3')。各引物以0.2μM浓度用于25μL PCR设定,所述PCR设定包含0.2mM dNTP、1X Thermopol缓冲液(新英格兰生物实验室公司(New England Biolabs);20mM Tris-HCl,10mM(NH4)2SO4,10mM KCl,2mM MgSO4,0.1%曲通(Triton)X-100,pH 8.8@25℃)、1单位的Deep Vent(有外切酶活性)或Deep Vent(无外切酶活性)DNA聚合酶(都来自新英格兰生物实验室公司);2μM 9(插入性染料;生命技术公司(Life Technologies));1.5μM ROX(参比染料;安捷伦(Agilent))和105拷贝的野生型或T790M模板。反应一式三份制备在200μL光学管中,然后在安捷伦(Agilent)MX3005P实时热循环仪上运行。使反应按以下热循环方案进行:95℃@10分钟;40个循环的[95℃@40秒,58℃@30秒,72℃@1分钟];和72℃@7分钟。
实施例17.通过在PCR中使用引物-开关寡核苷酸构建体来区分点突变–热启动II高保真DNA聚合酶和Deep Vent(无外切酶活性)DNA聚合酶之比较
结果:
该研究比较当与实施例16中所用相同的引物-开关结构和靶标同用时的热启动II高保真DNA聚合酶和Deep Vent(无外切酶活性)DNA聚合酶。PCR循环条件与实施例16中所用的那些稍有不同(参见方法),但此外的反应条件都是等同的。使用所述Deep Vent(无外切酶活性)DNA聚合酶时,结果显示所述突变型比野生型优先扩增的ΔCq约为3(24.5对比27.5),而所述Phusion热启动II聚合酶使突变型比野生型优先扩增的ΔCq约为6(22对比28)。该结果指示,与具有3’外切核酸酶活性的聚合酶和缺乏3’外切酶活性的聚合酶同用时,所述引物-开关构建体都起有效作用。还指示优选具有3’外切核酸酶修复活性的酶。
方法:
方法和引物-开关结构与实施例16中相同,有如下不同。所述热启动II高保真DNA聚合酶反应在HF缓冲液(新英格兰生物实验室公司(New England Biolabs))中进行,使用1单位热启动II高保真DNA(新英格兰生物实验室公司)。此外,循环条件为:95℃@3分钟;40个循环的[95℃@40秒,58℃@30秒,72℃@1分钟];和72℃@7分钟。
实施例18.用于T790M选择性扩增的开关阻断剂设计
设计:
设计并合成寡核苷酸以研究所述T790M等位基因相较于野生型的选择性扩增,使用所述开关阻断剂方案之一(参见图20)。制备多种正向引物以允许在退火和延伸温度范围内测试该系统。此外,通过将FAM荧光标签设置在距离5’末端BHQ1(黑洞淬光剂1(Black Hole Quencher 1)淬光剂十七个核苷酸处,将所述开关阻断剂合成为“自报告型”。选择该布置以使杂交后在所述FAM荧光团和BHQ1淬光剂之间产生最优的差异性间隔。杂交后,所述十七个核苷酸的间隔等同于约一个或一个半碱基转变,其将所述两个标签置于所述双链的相对侧,协助达到所述两个标签彼此之间的明显远离。杂交后将出现与所述FAM标签相关联荧光的显著增加。正向引物1:5'-TGCCTCACCTCCACCGTGCA*G*C*T-3'。正向引物2:5'-CCTCACCTCCACCGTGCA*G*C*T-3'。正向引物3:5'-CTCACCTCCACCGTGCA*G*C*T-3'。开关阻断剂:5'-BHQ1*2’OMe(G*A*U)CACGCAGBBBBTGC(FAM)CCTTCGGCTGC-2’OMe(C*U*C)*C3-3'。反向引物:5'-TTGTGTTCCCGGACATAGTCCA*G*G*A-3'[*指示硫代磷酸酯,B:5-硝基吲哚,C3:三碳间隔子]。
使用先前实施例例如实施例6和7中给出的条件评价这些构建体,而在退火和延伸温度范围内测试就此开关阻断剂T790M构建体建立优化的试验条件。应理解,本文所述的实施例和实施方式仅用于说明目的,本领域技术人员应了解据此作出的各种修饰或改变,且它们包括在本申请的主旨和权益以及所附权利要求书的范围内。本文引用的所有发表物、专利和专利申请通过引用全文纳入本文以用于所有目的。
- 还没有人留言评论。精彩留言会获得点赞!