山葡萄SNP分子标记及在遗传图谱构建、白腐病抗性定位中的应用的制作方法
本发明属于植物分子标记制备与应用技术领域,具体涉及一种山葡萄SNP分子标记及在遗传图谱构建、白腐病抗性定位中的应用。
背景技术:
葡萄(Vitis vinifera)是世界重要果树之一,具有较高的营养价值,近年来人们对高品质葡萄的消费量不断增加,2013年全世界总产量为6706.7万吨,栽培面积约700万公顷。另一方面,随着病虫害及各种自然灾害的加剧,严重影响到葡萄的生长发育及品质产量的提高,因此对葡萄的重要品质性状及抗逆性状进行改良,一直是葡萄育种者的重要目标。
研究者选用具有优异特性的种质资源进行杂交及复合杂交,期望获得具有多种优良目标性状的新品种。然而采用常规的杂交育种方法培育一个集合多种优良目标性状的新品种往往需要进行多次杂交及回交等过程,需要花费很长的时间。近年来,分子生物学的快速发展极大的促进了葡萄遗传育种研究进程,通过构建高密度的分子遗传图谱并进行目标性状的QTL定位。遗传连锁图谱是基因定位和分子标记辅助选择的前提和基础,因此构建葡萄的高密度分子遗传图谱,对于提高葡萄育种效率具有重要的促进作用。
最近几年研究开发了二代测序技术(NGS),这种测序技术能够获得分布在基因组上大量的SNP标记,这些标记具有构建高密度遗传连锁图谱的潜力。几种能够发掘大量SNP标记的方法逐渐的发展起来,Sun等(Sun X,Liu D,Zhang X,Li W,Liu H,et al.(2013)SLAF-seq:an efficient method of large-scale De novo SNP discovery and genotyping using high-throughput sequencing.PloS ONE8(3):e58700.)开发了一种简化基因组(SLAF)测序技术(SLAF-seq),这是一种发掘大量的SNP标记和基因分型的有高效方案,并利用这种方法成功构建普通鲤鱼(Cyprinus carpio L.)的遗传连锁图谱。Qi等(Qi ZM,Huang L,Zhu RS,Xin DW,Liu CY,Han X,Jiang HW,Hong WG,Hu GH,Zheng HK,Chen QS.A high-density genetic map for soybean based on specific length amplified fragment sequencing.PloS one.2014Aug 12;9(8):e104871.)采用SLAF-seq技术构建了含有5308个标记的大豆分子遗传图谱,zhang等(Zhang YX,Wang LH,Xin HG,Li DH,Ma CX,Ding X,Hong WG,Zhang XR.Construction of a high-density genetic map for sesame based on large scale marker development by specific length amplified fragment(SLAF)sequencing.BMC Plant Biol.2013Sep 24;13:141)采用SLAF-seq技术构建了包含1233个标记的芝麻高密度分子遗传图谱。
葡萄白腐病在19世纪的意大利被首先报道。但白腐病在何时,通过什么方式传入中国,在文献上还没有经过报道。目前,葡萄白腐病病害在全球各地的葡萄产区均有存在,致使葡萄的产量以及质量受到严重影响。在我国,白腐病的发生也较广泛,该病分布在大部分的葡萄主要产区,并且呈现出一种越来越严重的发病趋势。在我国北方产区,白腐病导致的葡萄果实年损失率约为20%左右,白腐病若未受到较好的控制,病害盛行期间,严重危害着果实和果穗,造成难以估计的损失,甚至失收。鉴于现有技术中尚未见葡萄的高密度分子遗传图谱的构建,因此,对葡萄白腐病抗性基因的定位研究,构建关于葡萄白腐病抗性基因的高密度分子遗传图谱尤为重要。
技术实现要素:
为了解决上述技术问题,本发明提供一种山葡萄SNP分子标记及在遗传图谱构建、白腐病抗性定位中的应用,利用获得的带有基因序列的SNP分子标记,构建获得山葡萄高密度分子遗传图谱,并对葡萄白腐病抗性进行定位研究,该发明在葡萄白腐病性状分子标记辅助育种中具有良好的应用前景。
本发明提供了一种山葡萄SNP分子标记,所述分子标记共计7124个,在葡萄染色体上的位置信息是分布于19条染色体,所述SNP分子标记是按照以下方法获得的:以红地球葡萄为母本,与双优葡萄为父本杂交产生F1代杂交群体,提取各个样品的基因组DNA;利用SLAF-seq技术对母本红地球葡萄、父本双优葡萄以及F1代杂交群体进行基因分型,并对SLAF标签进行过滤和质量评估,其中平均测序深度大于3的都是高质量SLAF标记,筛选出42279个多态性SLAF标签;过滤掉父母本测序深度10×以下的多态性标签,最终获得用于遗传图谱构建的SLAF标签7199个,其中有7124个是SNP分子标记。
本发明还提供了一种山葡萄SNP分子标记在构建山葡萄高密度分子遗传图谱和葡萄白腐病抗性定位中的应用
本发明还提供了一种山葡萄SNP分子标记在遗传图谱构建、白腐病抗性定位中应用的方法,,包括以下步骤:
S1,以红地球葡萄为母本,与双优葡萄为父本杂交产生F1代杂交群体,提取各个样品的基因组DNA;
S2,利用SLAF-seq技术对S1的母本、父本以及F1代杂交群体进行基因分型,并对SLAF标签进行过滤和质量评估,其中平均测序深度大于3的都是高质量SLAF标记,筛选出42279个多态性SLAF标签;过滤掉父母本测序深度10×以下的多态性标签,最终获得用于遗传图谱构建的SLAF标签7199个,其中有7124个是SNP分子标记;
S3,利用S2的7199个筛选出的SLAF标签构建遗传图谱;
S4,对S1的母本、父本以及F1代杂交群体进行白腐病抗性鉴定;
S5,分析S3构建的遗传图谱和S4的白腐病抗性鉴定结果,采用MapQTL5.0进行QTL分析,得到与葡萄白腐病抗性相关的QTL位点;
共得出6个与白腐病抗性相关的QTL位点,其中有两个位点位于第1号连锁群上,分别命名为Rpd1和Rpd2;一个在第7号连锁群上,命名为Rpd3;一个在第11号连锁群上,命名为Rpd4;两个在第15号连锁群上,分别命名为Rpd5和Rpd6。
本发明还提供了一种上述的山葡萄SNP分子标记在葡萄白腐病抗性性状分子标记辅助选育中的应用。
与现有技术相比,本发明提供一种山葡萄SNP分子标记及在遗传图谱构建、白腐病抗性定位中的应用,具有以下有益效果:
基于SLAF技术筛选获得大量带有基因序列的SNP标记,利用这些标记位点构建了山葡萄高密度分子遗传图谱,并对葡萄白腐病抗性进行定位研究,获得了与葡萄白腐病抗性相关的功能标记,该发明在葡萄白腐病性状分子标记辅助育种中具有良好的应用前景。
附图说明
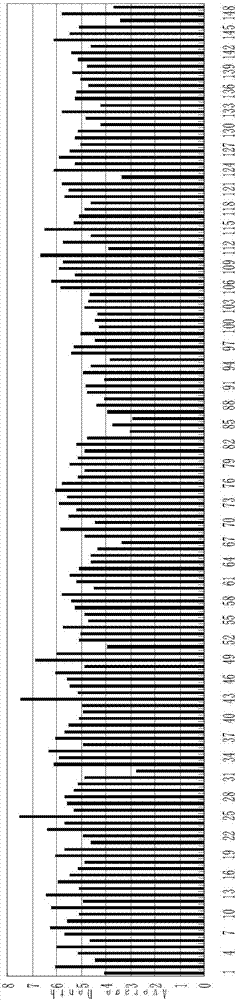
图1为实施例1中测序过程中亲本及子代149个单株中获得的分子标记数量统计图;
其中,横坐标表示149个单株的编号,纵坐标表示分子标记数量在149个单株群体中所占比例;
图2为实施例1中测序过程中亲本及子代149个单株的测序深度统计图;
其中,横坐标表示149个单株的编号,纵坐标表示测序深度在149个单株群体中所占比例;
图3为实施例1中构建的葡萄高密度SNP分子遗传连锁图谱;
其中LG1-LG119代表染色体编号,标尺为遗传距离;
图4为实施例1中与葡萄白腐病抗性相关的QTL位点在构建的遗传图谱上的分布图。
具体实施方式
下面结合附图和具体实施例对本发明进行详细说明,但不应理解为本发明的限制。下述实施例中的实验方法,如无特殊说明,均为常规方法,下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
实施例1
S1,以红地球葡萄为母本,与双优葡萄为父本杂交产生F1代杂交群体,提取基因组DNA。
试验在沈阳农业大学园艺学院进行。以抗寒性、抗病性弱的红地球葡萄为母本,与抗寒性强的双优葡萄为父本杂交产生F1代杂交群体。2009年进行杂交,秋季采收杂交种子,10月至次年2月进行低温层级处理,2010年3月在温室中对杂交种子进行催芽、播种,4月至6月分批次进行移栽、定植。F1代群体共有777株,选取其中149株F1代个体连同亲本用于构建遗传图谱。作图群体及双亲材料现种植于中国辽宁省沈阳市沈阳农业大学葡萄试验基地(126°33′41″E,41°49′24″N)。2013年春季采集F1代群体及双亲幼叶,提取基因组DNA。0.8%琼脂糖凝胶电泳检测基因组DNA浓度和质量。
S2,利用SLAF-seq技术对S1的母本、父本以及F1代杂交群体进行基因分型,并对SLAF标签进行过滤和质量评估,其中平均测序深度大于3的都是高质量SLAF标记,筛选出42279个多态性SLAF标签;过滤掉父母本测序深度10×以下的多态性标签,最终获得用于遗传图谱构建的SLAF标签7199个,其中有7124个是SNP分子标记。具体操作如下:
利用SLAF-seq技术共测序两个亲本和149个后代,测序采用的方法参考Sun X,等(Sun X,Liu D,Zhang X,Li W,Liu H,et al.(2013)SLAF-seq:an efficient method of large-scale De novo SNP discovery and genotyping using high-throughput sequencing.PloS ONE 8(3):e58700.)。每个样本DNA中加入RsaI、HaeIII(NEB,Ipswich,MA,USA)、T4DNA连接酶(NEB)、ATP(NEB)并在37℃条件下保存。将限制性链接反应产物稀释并加入dNTP、Taq DNA连接酶(NEB)和HaeIII引物进行PCR反应。利用E.Z.N.A.循环纯化试剂盒(Omega,London,UK)对PCR产物进行纯化,纯化后的产物加入HaeIII、T4DNA连接酶、ATP并37℃条件下培养。培养后产物利用Quick Spin column(Qiagen,Venlo,Netherlands)再进行纯化,并用2%琼脂糖凝胶电泳检测。利用胶回收试剂盒(Qiagen)对大小在550-600bp的SLAF标签进行回收,回收后的产物加入Phusion Master Mix(NEB)和Solexa Amplification引物进行混样,进行PCR反应。对产物进行电泳并切胶选取目的片段,片段大小为314-414bp,文库质检合格后用Illumina HiSeqTM 2500进行测序。DNA测序reads长度为200bp。
根据测序结果将原始reads分配到群体中,过滤掉低质量的reads(Q<30),最后确定reads长度为100bp*2,并应用软件SOAP2进行测序。将参数r、M、m,和x分别设置为0、4、50和1000,其中,r为0代表没有重复序列,M为4代表此时对照最好,m为50和x为1000代表随机插入序列的大小为50bp-1000bp。在每个SLAF标签中发现,双亲间的多态性标记大多数是SNP标记,所有SLAF标签的基因分型和子代以及亲本SNP位点保持一致。
所有SLAF标记进行四次过滤和质量评估,评估方法参照Sun et al.(Sun X,Liu D,Zhang X,Li W,Liu H,et al.(2013)SLAF-seq:an efficient method of large-scale De novo SNP discovery and genotyping using high-throughput sequencing.PloS ONE 8(3):e58700.)。少于三个SNP标记以及每个样品的平均测序深度大于3的都是高质量SLAF标记。所有SLAF标签中多态性标签有42279个。图谱共用三种类型的分子标记,包括,7124个“SNP_only”标记、7个“InDel_only”标记、68个“SNP&InDel”标记,分别占标记总数的98.96%、0.0972%、0.945%,可见“SNP_only”是主要的标记类型。根据亲本基因型对多态性SLAF标签进行基因型编码,共有27985个标签成功编码,其中可用于遗传图谱构建的多态性标签13738个,为保证遗传图谱质量,过滤掉父母本测序深度10×以下的多态性标签,最终获得用于作图的SLAF标签7199个。
图1为实施例1中测序过程中亲本及子代149个单株中获得的分子标记数量统计图,其中,横坐标表示149个单株的编号,纵坐标表示分子标记数量在149个单株群体中所占比例;图2为实施例1中测序过程中亲本及子代149个单株的测序深度统计图。其中,横坐标表示149个单株的编号,纵坐标表示测序深度在149个单株群体中所占比例。
SLAF多态性标签及在染色体上的分布结果如表1所示,利用这些具有亲本纯合子的标记构建高密度遗传图谱。
表1 SLAF多态性标签及在染色体上的分布
S3,利用S2的7199个筛选出的SLAF标签构建遗传图谱;
根据所有高质量的SLAF标记在染色体上的位置,高通量测序(NGS)数据可能会导致部分基因分型错误或缺失,以至于在很大程度上降低高密度遗传连锁图谱的质量,所以采用High Map Strategy对SLAF标记进行排序并纠正连锁群(LG)内基因分型错误。利用MST map(Detaily MST map algorithm)对标记进行排序,接下来用SMOOTH(SMOOTH algorithm)对基因分型错误进行纠正。所有连锁群的形成都经过以下程序:首先根据标记在染色体上的位置获得标记的初顺序,再根据相邻标记之间的关系利用SMOOTH对基因分型错误或缺失进行纠正,之后再应用MST map对标记排序,SMOOTH校正新排序的基因型。这样进行4个或更多循环之后获得高质量遗传连锁图谱。利用Kosambi函数计算图距。构建的葡萄高密度SNP分子遗传图谱如图3所示
S4,对S1的母本、父本以及F1代杂交群体进行白腐病抗性鉴定
“红地球”ד双优”的后代群体单株及亲本在2015年和2016年时接受白腐菌侵染,利用室内离体叶片接种法对葡萄进行白腐病抗性鉴定。
S5,分析S3构建的遗传图谱和S4的白腐病抗性鉴定结果,采用MapQTL5.0进行QTL分析,得到与葡萄白腐病抗性相关的QTL位点。
结合已构建的“红地球”ד双优”葡萄作图群体高密度遗传连锁图谱数据(图3)和抗性鉴定表型数据,采用MapQTL5.0进行QTL分析,利用区间作图法对性状和基因型进行分析计算,估算出基因位点对性状表型的贡献率等参数。以LOD值≥3.0作为QTL入选的标准。得到与葡萄白腐病抗性相关的QTL位点在遗传连锁图谱上的分布图,如图3所示。这些与葡萄白腐病抗性相关的QTL位点,在双亲整合的遗传图谱上共检测到6个与白腐病抗性相关的QTL位点,如图4所示,图4为实施例1中与葡萄白腐病抗性相关的QTL位点在构建的遗传图谱上的分布图。有两个位点位于第1号连锁群(LG1)上,将其命名为Rpd1(Resistance to Pilidiella diplodiella 1)和Rpd2,两个位点单独存在时的贡献率分别为12.7%和11.9%。一个在第7号连锁群(LG7)上在第7号连锁群(LG7)上检测到了一个QTL位点,命名为Rpd3。贡献率为10.2%;一个在第11号连锁群(LG11)上11号连锁群(LG11)上检测到1个位点,命名为Rpd4,贡献率为14.6%。两个在第15号连锁群(LG15)上在15号连锁群(LG15)上检测到了两个位点分别命名为Rpd5和Rpd6,解释的贡献率分别为50.3%和40.1%。
本发明基于SLAF技术筛选获得大量带有基因序列的SNP标记,利用这些标记位点构建了山葡萄高密度分子遗传图谱,并对葡萄白腐病抗性进行定位研究,获得了与葡萄白腐病抗性相关的功能标记,该发明在葡萄白腐病性状分子标记辅助育种中具有良好的应用前景。
显然,本领域的技术人员可以对本发明进行各种改动和变型而不脱离本发明的精神和范围。这样,倘若本发明的这些修改和变型属于本发明权利要求及其等同技术的范围之内,则本发明也意图包含这些改动和变型在内。
- 还没有人留言评论。精彩留言会获得点赞!