LINC01356作为分子标志物在胃癌中的应用的制作方法
本发明属于生物医药领域,涉及LINC01356作为分子标志物在胃癌中的应用。
背景技术:
胃癌(Gastric Carcinoma)是一种常见消化道恶性肿瘤,具有高发病率及死亡率的特点。在世界范围内的恶性肿瘤中,胃癌发病率排名是居于第5位,而致死率则位居第3位,而我国属于胃癌高发的国家。虽然近年来临床上消化道内镜设备不断发展,诊疗技术也在不断提高,许多胃癌患者能被及时的发现,接受规范的治疗。对于早期的胃癌患者,可以及时进行根治性手术切除治疗,而且统计显示早期患者的手术后5年的临床生存率可达90%(Piazuelo Gorrea P Gastric cancer:overview[J].Colomb Med C Cali),201344(3):192-201.)。然而很多胃癌患者在早期临床症状不明显,并且我国存在部分地区胃镜常规检查普及率不足等原因,在就诊时约有80%的胃癌患者已到晚期,失去了手术机会,并且近年来胃癌年轻化的趋势也不容忽视。而对于非早期的胃癌而言,治疗方法却比较局限,手术治疗的患者的总体生存率仅仅有20%左右:放化疗常用于术前或术后的辅助性治疗,并不能显著提高患者的生存期;而单克隆抗体药物及基因治疗方法等目前尚未成为临床上主导性的治疗方法。因此,除了提高临床早期胃癌诊断,研究胃癌发生和转移的机制,探讨新的干预措施,提高诊疗效果,对于增加患者的存活率,改善患者的生活质量等方面均具有重大的意义。
随着对传统的蛋白编码基因的深入研究以及基因筛查技术的不断发展,发现在人类基因组中仅有5%的RNA是具有蛋白编码功能的,非编码区则占据了95%,其中的大部分可以被转录成长链和短链的非编码RNA。这种现象使得长期以来被认为不具有蛋白编码功能的基因组是无功能的“垃圾序列”的传统观念受到挑战。非编码RNA(non-coding RNA,ncRNA)是指只有极低的编码能力甚至不具有编码能力的RNA,包括snoRNA,rRNA,snRNA,tRNA,microRNA及lncRNA等,其中microRNA和lncRNA是近年被作为热点问题来研究(Ling H,Fabbri M,Calin GA.MicroRNAs and other non-coding RNAs as targets for anticancer drug development.Nat Rev Drug Discov 2013;12:847-865)。长链非编码DNA C(long non-coding RNA,1ncRNA)是指一类RNA分子,其长度大于200nt,不具备编码蛋白功能,却在一些复杂的生物学过程中表现出其特有的功效,在对基因的转录和翻译过程中发挥重要作用以及对担保活动的调控作用等等,而1ncRNA的变异和调节能够导致多种疾病的发生,甚至罹患肿瘤等。近年来,研究表明在肿瘤中lncRNA的异常表达参与了肿瘤的形成及进展,这些异常表达的lncRNA可以作为恶性肿瘤的早期诊断或预后评估的潜在分子标志物(CN 201710127268.5/CN 201710112636.9/CN 201710522694.9)。
目前lncRNA在胃癌中的研究尚停留在起步阶段,探索和发现新的lncRNA及其具体调控机制,可以为胃癌的发病机制研究提供新的理论依据,以及临床上胃癌的诊断和治疗提供新的手段。
技术实现要素:
为了弥补现有技术的不足,本发明的目的之一,在于提供一种与胃癌发生发展相关的lncRNA,从而为胃癌的诊断和治疗提供分子靶标,实现患者的个性化诊断和治疗。
本发明的目的之二,在于提供一种筛选治疗胃癌的药物的方法。
为了实现上述目的,本发明采用如下技术方案:
本发明的第一方面提供了一种试剂,所述试剂能够检测LINC01356基因的水平。
进一步,所述试剂选自:
特异性识别LINC01356的探针;或
特异性扩增LINC01356的引物。
进一步,所述的特异性扩增LINC01356基因的引物序列如SEQ ID NO.1~2所示。
本发明的第二发面提供了一种试剂盒,所述试剂盒包括本发明第一方面所述的检测LINC01356基因的水平的试剂。
本发明的第三方面提供了一种芯片,所述芯片包括本发明第一方面所述检测LINC01356基因的水平的试剂。
本发明的第四方面提供了一种组合物,所述组合物包括有效量的LINC01356的抑制剂。所述抑制剂选自:以LINC01356或其转录本为靶序列、且能够抑制LINC01356基因表达或基因转录的干扰分子,包括:shRNA(小发夹RNA)、小干扰RNA(siRNA)、dsRNA、微小RNA、反义核酸,或能表达或形成所述shRNA、小干扰RNA、dsRNA、微小RNA、反义核酸的构建物。
进一步,所述抑制剂为siRNA,优选的,siRNA的序列如SEQ ID NO.9~10所示。
进一步,所述组合物还包括与所述抑制剂配伍的其他药类以及药学上可接受的载体和/或辅料。
本发明的药物还可与其他治疗胃癌的药物联用,其他治疗性化合物可以与主要的活性成分同时给药,甚至在同一组合物中同时给药。
本发明的第五方面提供了一种筛选治疗胃癌的候选药物的方法,所述方法包括:
用待筛选物质处理表达或含有LINC01356基因的培养体系;和
检测所述体系中LINC01356基因的水平;
其中,若所述待筛选物质可抑制LINC01356基因的水平,则表明该筛选物质是治疗胃癌的候选药物。
进一步,所述培养体系包括(但不限于)细胞体系、亚细胞体系、溶液体系、组织体系、器官体系或动物体系(如动物模型,优选非人哺乳动物的动物模型,如鼠、兔、羊、猴等)等。
本发明的第六方面提供了如下任一项所述的应用:
a.本发明第一方面所述的试剂在制备诊断胃癌的产品中的应用;
b.本发明第二方面所述的试剂盒在制备诊断胃癌的产品中的应用;
c.本发明第三方面所述的芯片在制备诊断胃癌的产品中的应用;
d.本发明第四方面所述的组合物在制备治疗胃癌的药物中的应用;
e.本发明第四方面所述的组合物在制备治疗胃癌侵袭的药物中的应用;
f.本发明第四方面所述的组合物在制备治疗胃癌转移的药物中的应用;
g.本发明第五方面所述的方法在筛选治疗胃癌的候选药物中的应用。
附图说明
图1是利用QPCR检测LINC01356基因在胃癌组织中的表达情况图;
图2是利用QPCR检测LINC01356基因在胃癌细胞系中的表达情况图;
图3是利用QPCR检测LINC01356在胃癌细胞中的转染情况图;
图4是MTS法检测LINC01356基因对胃癌细胞增殖的影响图;
图5是利用Transwell小室检测LINC01356对胃癌细胞迁移和侵袭的影响图;其中
图A是LINC01356对胃癌细胞迁移的影响图;图B是LINC01356对胃癌细胞侵袭的影响图。
具体的实施方式
本发明经过广泛而深入的研究,通过高通量方法,采用目前覆盖数据库最广的lncRNA芯片,检测胃癌标本中lncRNA在肿瘤组织和癌旁组织的表达,通过生物信息学分析,发现其中具有明显表达差异的lncRNA,探讨其与胃癌的发生发展之间的关系,从而为胃癌的诊断及靶向治疗寻找更好的途径和方法。通过筛选,本发明首次发现了胃癌中LINC01356显著性上调,并在大样本qPCR验证中进一步证实LINC01356在胃癌组织中的表达量显著高于癌旁组织。这一发现将进一步丰富胃癌发病机制的研究,也为胃癌的早期诊断及预后检测提供了新的肿瘤标志物和治疗靶点。
LINC01356基因
LINC01356是位于人1号染色短臂1区3带上,本发明中的LINC01356包括野生型、突变型或其片段。在本发明的实施例中,一种代表性的人LINC01356基因的核苷酸序列如目前国际公共核酸数据库GeneBank中LINC01356基因(NR_103746.1)所示。本发明的LINC01356核苷酸全长序列或其片段通常可以用PCR扩增法、重组法或人工合成的方法获得。
本发明可以利用本领域内已知的任何方法测定基因表达。本领域技术人员应当理解,测定基因表达的手段不是本发明的重要方面。可以在转录水平上检测生物标志物的表达水平。
检测技术
本发明的lncRNA使用本领域普通技术人员已知的多种核酸技术进行检测,这些技术包括但不限于:核酸测序、核酸杂交和核酸扩增技术。
本发明所述核酸扩增技术选自聚合酶链式反应(PCR)、逆转录聚合酶链式反应(RT-PCR)、转录介导的扩增(TMA)、连接酶链式反应(LCR)、链置换扩增(SDA)和基于核酸序列的扩增(NASBA)。其中,PCR需要在扩增前将RNA逆转录成DNA(RT-PCR),TMA和NASBA直接扩增RNA。
通常,PCR使用变性、引物对与相反链的退火以及引物延伸的多个循环,以指数方式增加靶核酸序列的拷贝数;RT-PCR则将逆转录酶(RT)用于从mRNA制备互补的DNA(cDNA),然后将cDNA通过PCR扩增以产生DNA的多个拷贝;TMA在基本上恒定的温度、离子强度和pH的条件下自身催化地合成靶核酸序列的多个拷贝,其中靶序列的多个RNA拷贝自身催化地生成另外的拷贝,TMA任选地包括使用阻断,部分、终止部分和其他修饰部分,以改善TMA过程的灵敏度和准确度;LCR使用与靶核酸的相邻区域杂交的两组互补DNA寡核苷酸。DNA寡核苷酸在热变性、杂交和连接的重复多个循环中通过DNA连接酶共价连接,以产生可检测的双链连接寡核苷酸产物;SDA使用以下步骤的多个循环:引物序列对与靶序列的相反链进行退火,在存在dNTPαS下进行引物延伸以产生双链半硫代磷酸化的(hemiphosphorothioated)引物延伸产物,半修饰的限制性内切酶识别位点进行的核酸内切酶介导的切刻,以及从切口3'端进行的聚合酶介导引的物延伸以置换现有链并产生供下一轮引物退火、切刻和链置换的链,从而引起产物的几何扩增。
本发明中的核酸杂交技术包括但不限于原位杂交(ISH)、微阵列和Southern或Northern印迹。原位杂交(ISH)是一种使用标记的互补DNA或RNA链作为探针以定位组织一部分或切片(原位)或者如果组织足够小则为整个组织(全组织包埋ISH)中的特异性DNA或RNA序列的杂交。DNAISH可用于确定染色体的结构。RNAISH用于测量和定位组织切片或全组织包埋内的mRNA和其他转录本(例如,ncRNA)。通常对样本细胞和组织进行处理以原位固定靶转录本,并增加探针的进入。探针在高温下与靶序列杂交,然后将多余的探针洗掉。分别使用放射自显影、荧光显微术或免疫组织化学,对组织中用放射、荧光或抗原标记的碱基标记的探针进行定位和定量。ISH也可使用两种或更多种通过放射性或其他非放射性标记物标记的探针,以同时检测两种或更多种转录本。
将Southern和Northern印迹分别用于检测特异性DNA或RNA序列。使从样本中提取的DNA或RNA断裂,在基质凝胶上通过电泳分离,然后转移到膜滤器上。使滤器结合的DNA或RNA与和所关注的序列互补的标记探针杂交。检测结合到滤器的杂交探针。该程序的一种变化形式是反向Northern印迹,其中固定到膜的底物核酸为分离的DNA片段的集合,而探针是从组织提取并进行了标记的RNA。
本发明中非扩增或扩增的核酸可通过任何常规的手段检测。
芯片、试剂盒
本发明提供了检测中LINC01356基因的表达水平的芯片和试剂盒,其中芯片包括:固相载体;以及有序固定在所述固相载体上的寡核苷酸探针,所述的寡核苷酸探针特异性地对应于LINC01356所示的部分或全部序列。
所述固相载体包括无机载体和有机载体,所述无机载体包括但不限于有硅载体、玻璃载体、陶瓷载体等;所述有机载体包括聚丙烯薄膜、尼龙膜等。
“探针”是指能够用于测量特定基因的表达情况的分子。示例性探针包括PCR引物以及基因特异性DNA寡核苷酸探针,例如固定于微阵列基底上的微阵列探针、定量核酸酶保护检验探针、与分子条形码连接的探针、以及固定于珠上的探针。
本发明中术语“探针”指能与另一分子的特定序列或亚序列或其它部分结合的分子。除非另有指出,“探针”通常指能通过互补碱基配对与另一多核苷酸(往往称为“靶多核苷酸”)结合的多核苷酸探针。根据杂交条件的严谨性,探针能和与该探针缺乏完全序列互补性的靶多核苷酸结合。探针可作直接或间接的标记,其范围包括引物。杂交方式,包括,但不限于:溶液相、固相、混合相或原位杂交测定法。
作为探针,可以使用荧光标记、放射标记、生物素标记等对癌检测用多核苷酸进行了标记的标记探针。多核苷酸的标记方法本身是公知的。可通过如下方法检查试样中是否存在受试核酸:固定受试核酸或者其扩增物,与标记探针进行杂交,洗涤,以及然后测定与固相结合的标记。备选地,还可固定癌检测用多核苷酸,使受试核酸与其杂交,然后应用标记探针等检测结合于固相上的受试核酸。在这种情况下,结合于固相上的癌检测用多核苷酸也称为探针。使用多核苷酸探针测定受试核酸的方法在本领域也是公知的。可以如下进行该方法:在缓冲液中使多核苷酸探针与受试核酸在Tm或者其附近(优选在±4℃以内)接触用于杂交,洗涤,然后测定杂交的标记探针或者与固相探针结合的模板核酸。
在作为探针使用的多核苷酸的大小优选为18个或更多个核苷酸、更优选为20个或更多个核苷酸,以及编码区域的全长或更少。作为引物使用时,该多核苷酸大小优选为18个或更多个核苷酸,以及50个或更少核苷酸。这些探针具有与靶点基因的特定的碱基序列互补的碱基序列。这里,所谓“互补”,只要是杂交即可,可以不是完全互补。这些多核苷酸通常相对于该特定的碱基序列具有80%以上、优选90%以上、更优选95%以上、特别优选100%的同源性。这些探针可以是DNA,也可以是RNA,另外,可以为在其一部分或全部中核苷酸通过PN、LNA、ENA、GNA、TNA等人工核酸置换得到的多核苷酸。
“引物”指短核酸序列,作为具有短的游离3’末端羟基(游离3’羟基)的核酸序列,它可以与互补模板(template)形成碱基对(basepair)并充当复制模板的起点。在本发明中,可以通过以下方式预测食管鳞癌预后:通过进行使用本发明的标记多核苷酸的有义和反义引物的PCR扩增,所需的产物是否产生。可以基于本领域已知内容修改PCR条件和有义引物和反义引物的长度。
本发明的引物或探针可以使用磷酰亚胺固相支持法或其他熟知方法化学合成。也可以使用本领域已知的许多手段修饰所述核酸序列。这些修饰的非限制性实例是甲基化、加帽、用天然核苷酸的一种或多种类似物进行的置换和在核苷酸之间的修饰,例如,修饰不带电荷的连接体(例如,磷酸甲酯、磷酸三酯、磷酰亚胺、氨基甲酸酯等),或修饰带电荷的连接体(例如,硫代磷酸酯、二硫代磷酸酯等)。
如本文所用,“检测基因的表达水平”指确定生物样品中标记基因的mRNA存在及其表达水平以便预测胃癌预后的过程并且通过测量mRNA的量可实现。用于此目的分析方法是但不限于RT-PCR、竞争性RT-PCR(competitiveRT-PCR)、实时RT-PCR(Real-timeRTPCR)、RNA酶保护测定法(RPA;RNaseprotectionassay)、northern印迹法(northernblotting)、DNA微阵列芯片等。
作为一种可选择的实施方式,本发明的试剂盒包括用于扩增LINC01356的特异性引物对;标准DNA模板;PCR反应液。在一个优选的实施方案中,所述特异性引物对包括上游引物和下游引物,序列如SEQ ID NO.1~2所示。
作为更优选的实施方案,所述试剂盒为荧光定量PCR检测试剂盒,所述引物适用于SYBR Green、TaqMan探针、分子信标、双杂交探针、复合探针的检测。
在一个更优选的实施方案中,所述试剂盒中的PCR反应液为荧光定量PCR反应液,并一步包含荧光染料。
在一个更优选的实施方案中,所述荧光定量PCR反应液包括dNTP、Mg2+、Taq酶及buffer缓冲液,所述荧光染料为SYBR Green II,Taq酶为热启动酶。
抑制剂和药物组合物
基于本发明的发现,本发明提供了一种药物组合物,所述药物组合物包含LINC01356的抑制剂。
所述的LINC01356的抑制剂是指任何可降低LINC01356基因水平的物质,这些物质均可用于本发明,作为对于下调LINC01356基因的表达有用的物质,从而可用于治疗胃癌。举例来说,本发明的抑制剂可以是以LINC01356基因为靶序列、且能够抑制LINC01356基因的干扰分子,包括:shRNA(小发夹RNA)、小干扰RNA(siRNA)、dsRNA、微小RNA、反义核酸,或能表达或形成所述shRNA、小干扰RNA、dsRNA、微小RNA、反义核酸的构建物。
作为本发明的一种优选方式,所述LINC01356的抑制剂是一种LINC01356特异性的小干扰RNA分子。如本文所用,所述的“小干扰RNA”是指一种短片段双链RNA分子,能够以同源互补序列的mRNA为靶目标降解特定的mRNA,这个过程就是RNA干扰(RNAinterference)过程。小干扰RNA可以制备成双链核酸的形式,它含有一个正义链和一个反义链,这两条链仅在杂交的条件下形成双链。一个双链RNA复合物可以由相互分离的正义链和反义链来制备。因此,举例来讲,互补的正义链和反义链是化学合成的,其后可通过退火杂交,产生合成的双链RNA复合物。
在筛选有效的siRNA序列时,本发明人通过大量的比对分析,从而找出最佳的有效片段。本发明人设计合成了多种siRNA序列,并将它们分别通过转染试剂转染胃癌细胞系进行验证,选出干扰效果最佳的siRNA,进一步地在细胞水平实验,结果证明对于该siRNA在能有效的抑制细胞中LINC01356基因的表达水平,以及胃癌细胞的增殖。
作为本发明的一种可选方式,所述的SIGLEC10的抑制剂也可以是一种“小发夹RNA(Small hairpin RNA,shRNA)”,其是能够形成发夹结构的非编码小RNA分子,小发夹RNA能够通过RNA干扰途径来抑制基因的表达。如上述,shRNA可以由双链DNA模板来表达。双链DNA模板被插进一个载体,例如质粒或病毒载体,然后在体外或体内连接到一个启动子进行表达。shRNA在真核细胞内DICER酶的作用下,可被切割成小干扰RNA分子,从而进入RNAi途径。“shRNA表达载体”是指一些本领域常规用于构建shRNA结构的质粒,通常该质粒上存在“间隔序列”以及位于“间隔序列”两边的多克隆位点或供替换序列,从而人们可以将shRNA(或类似物)相应的DNA序列通过正向和反向的方式插入多克隆位点或替换其上的供替换序列,该DNA序列转录后的RNA可形成shRNA(ShortHairpin)结构。所述的“shRNA表达载体”目前已经完全可以通过商购的途径购买获得,例如一些病毒载体。
本领域的技术人员熟知的方法能用于构建本发明所需的表达载体。这些方法包括体外重组DNA技术、DNA合成技术、体内重组技术等。所述的表达载体优选地包含一个或多个选择性标记基因,以提供用于选择转化的宿主细胞的表型性状,如卡拉霉素、庆大霉素、潮霉素、氨苄青霉素抗性。
在本发明中,表达载体是本领域已知的各种载体,如市售的载体、包括质粒、粘粒、噬菌体、病毒等。表达载体向宿主细胞中的导入可以使用电穿孔法、磷酸钙法、脂质体法、DEAE葡聚糖法、显微注射、病毒感染、脂质体转染、与细胞膜透过性肽的结合等周知的方法。
药物组合物
本发明中的药物组合物包括有效量的LINC01356的抑制剂、和/或与所述抑制剂配伍的其他药类以及药学上可接受的载体和/或辅料。
药学上可接受的载体包括(但并不限于):稀释剂、赋形剂如乳糖、氯化钠、葡萄糖、尿素、淀粉、水等、填充剂如淀粉、蔗糖等;粘合剂如单糖浆、葡萄糖溶液、淀粉溶液、纤维素衍生物、藻酸盐、明胶和聚乙烯吡咯烷酮;湿润剂如甘油;崩解剂如干淀粉、海藻酸钠、海带多糖粉末、琼脂粉末、碳酸钙和碳酸氢钠;吸收促进剂季铵化合物、十二烷基硫酸钠等;表面活性剂如聚氧化乙烯山梨聚糖脂肪酸酯、十二烷基硫酸钠、硬脂酸单甘油酯、十六烷醇等;致湿剂如甘油、淀粉等;吸附载体如淀粉、乳糖、斑脱土、硅胶、高岭土和皂粘土等;润滑剂如滑石粉、硬脂酸钙和镁、聚乙二醇、硼酸粉末等。
在本发明中,药物组合物可以使用不同的添加剂进行制备,例如缓冲剂、稳定剂、抑菌剂、等渗剂、螯合剂、pH控制剂及表面活性剂。
本发明所述的药物组合物可口服给药、非胃肠道给药、通过吸入喷雾给药、局部给药、直肠给药、鼻给药、颊给药、阴道给药或通过植入的贮药装置给药。优选口服给药或注射给药。本发明的药物组合物可含有任何常用的无毒可药用载体、辅料或赋形剂。在某些情况下,药用酸、碱或缓冲剂可用来调节制剂的pH以提高所配制的化合物或其给药剂型的稳定性。本文所用术语非胃肠道包括皮下、皮内、静脉内、肌内、关节内、动脉内、滑膜内、胸骨内、鞠内、损伤部位内、和颅内注射或输注技术。只要能达到目标组织,本发明所述药物组合物可以通过任何途径给予受体。
本发明药物组合物可以以任何口服剂型的形式口服给药,包括但不限于胶囊、片剂、乳剂和水悬浮液、分散剂和溶液。对于口服片剂,常用载体包括乳糖和玉米淀粉。一般还加入润滑剂例如硬脂酸镁。为了以胶囊形式口服给药,适用的稀释剂包括乳糖和无水玉米淀粉。当口服施用水悬浮液和/或乳液时,可将活性组分悬浮或溶解在油相中,并与乳化剂和/或悬浮剂合并。如果需要的话,可加入一些甜味剂和/或矫味剂和/或着色剂。适当时,可将用于口服给药的剂量单位制剂包微囊。例如,通过在聚合物、蜡等中将颗粒物质包衣或包埋,也可制备所述制剂已延长或维持释放。本发明的药物组合物可以用于降低内源性的LINC01356过表达,通过降低LINC01356的表达,从而治疗因LINC01356表达上调导致的胃癌。
在本发明中,可将抑制LINC01356表达的化合物作为裸RNA与递送试剂一起作为核酸(如重组质粒或病毒载体)给受试者施用,所述核酸包含抑制LINC01356表达的序列。递送试剂可以是亲脂试剂、聚阳离子、脂质体等。
如本文所用,所述“有效量”是指其用量足以治疗疾病,以适用于任何医学治疗的合理的利益/风险比率。组合物的有效剂量水平可以根据受试者的类型、疾病的严重程度、受试者的年龄和性别、药物活性、对药物的敏感性、给药时间,给药途径、排泄率、治疗时间、与组合物联用的药物和医疗领域中其他已知因素来确定。本发明的药物组合物可单独使用或与其它治疗剂组合施用,并且可以与常规的治疗剂依次或同时给药。可采用一种或多种剂型中施用组合物。考虑所有上述因素,在能够表现出最大效果而不引起副作用的最小量下施用组合物至关重要,该最小量可由本领域技术人员容易地确定。
术语“有效的”表示治疗引起受试者体内病理性上调的基因表达下降,病理性下调的基因表达上升或胃癌的大小、流行性(prevalence)或转移潜力降低。当预防性采取所关注的治疗时,术语“有效的”指治疗能够延迟或防止胃肿瘤的形成,或者能延迟、防止或减轻胃癌的临床症状。胃肿瘤的评价可以按标准的临床方案进行。
本发明的药物组合物还可与其他治疗胃癌的药物联用,其他治疗性化合物可以与主要的活性成分同时给药,甚至在同一组合物中同时给药。
本发明的药物组合物还可以以单独的组合物或与主要的活性成分不同的剂量形式单独给予其它治疗性化合物。主要成分的部分剂量可以与其它治疗性化合物同时给药,而其它剂量可以单独给药。在治疗过程中,可以根据症状的严重程度、复发的频率和治疗方案的生理应答,调整本发明药物组合物的剂量。
统计学分析
在本发明的具体实施例中,实验都是按照至少重复3次来完成的,结果数据都是以平均值±标准差的方式来表示,采用SPSS18.0统计软件来进行统计分析的,两者之间的差异采用t检验,认为当P<0.05时具有统计学意义。
下面结合具体的实施例进一步说明本发明,本发明的实施例仅用于解释本发明,并不意味着限制本发明的保护范围。
下述实施例中所使用的实验方法如无特殊说明,均为常规方法。
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
实施例1筛选与胃癌相关的基因标志物
1、样品收集
分别收集8例胃癌癌旁组织和胃癌组织样本,以正常的胃组织3例,全部病例在手术前均未接收化疗和放疗,所有的患者均已知情同意,并取得均通过组织伦理委员会的同意。
2、RNA样品的制备
利用QIAGEN的组织RNA提取试剂盒进行组织RNA的提取,按说明书的具体步骤进行操作。
3、总RNA定量与纯度分析
使用Bio-Red紫外分光光度计测定总RNA在280nm和260nm处的光密度值,当OD260/OD280的值在1.8~2.0时认为总RNA的纯度是可靠的,用于下一步的实验。
4、lncRNA表达芯片分析
利用Arraystar公司的Arraystar Human 1ncRNA Array检测胃癌组织和癌旁组织中lncRNA表达谱的差异。
5、数据分析
利用Agilent GeneSpring软件对芯片结果进行分析,筛选表达量具有显著性差异(标准为该lncRNA在癌与癌旁的表达量相差2倍以上,而且p<0.05)的lncRNA。
6、结果
结果显示,LINC01356在胃癌患者中呈现差异性表达,与癌旁组织以及正常胃组织相比,其在癌组织中的表达水平显著上调,P值为9.92E-13。
实施例2 QPCR测序验证LINC01356基因的差异表达
1、对LINC01356基因差异表达进行大样本QPCR验证。按照实施例1中的样本收集方式选择胃癌癌旁组织和胃癌组织各50例以及正常胃部组织10例。
2、RNA提取
利用QIAGEN的组织RNA提取试剂盒提取RNA样品,具体操作详见说明书。
3、QPCR
1)反应体系:
RNA模板1μl,随机引物1μl,双蒸水加至12μl,混匀,低转速离心,65℃5min,然后放在冰上冷却。然后加入5×反应缓冲液4μl,RNA酶抑制剂(20U/μl)1μl,10mM dNTP混合液2μl,AMV反转录酶(200U/μl)1μl;充分混匀并进行离心处理;
2)逆转录反应条件
25℃5min,42℃60min,70℃5min。
3)聚合酶链反应
引物设计:
根据Genebank中LINC01356基因和GAPDH基因的编码序列设计QPCR扩增引物,由博迈德生物公司合成。具体引物序列如下:
LINC01356基因:
正向引物为5’-TGCCTAACAGAGAACAAT-3’(SEQ ID NO.1);
反向引物为5’-AGTCAGTGAATGGAGATAG-3’(SEQ ID NO.2)。
GAPDH基因:
正向引物为5’-AATCCCATCACCATCTTCCAG-3’(SEQ ID NO.3);
反向引物为5’-GAGCCCCAGCCTTCTCCAT-3’(SEQ ID NO.4)。
配制PCR反应体系:
2×qPCR混合液12.5μl,基因引物2.0μl,反转录产物2.5μl,ddH2O 8.0μl。
PCR反应条件:95℃10min,(95℃15s,60℃60s)×40个循环,60℃5min延伸反应。75℃至95℃,每20s升温1℃,绘制溶解曲线。以SYBR Green作为荧光标记物,在Light Cycler荧光定量PCR仪上进行PCR反应,通过融解曲线分析和电泳确定目的条带,ΔΔCT法进行相对定量。
4、ROC曲线分析
使用R语言中的pROC包分析LINC01356的受试者工作特征,计算二项精确置信空间,绘制ROC曲线。
5、结果
QPCR结果如图1所示,与胃癌癌旁组织相比,LINC01356在胃癌组织中表达上调,差异具有统计学意义(P<0.01);ROC分析结果显示,LINC01235的ROC曲线下面积(AUC)值高达0.92312,且阳性检出率=上调表达例数/总检测例数×100%=46/50=92%,提示LINC01356可应用于胃癌的诊断,且LINC01356应用于胃癌的诊断具有较高的准确性。
实施例3 LINC01356在胃癌细胞系中的表达情况
1、细胞培养
人永生化胃粘膜上皮细胞系GES-1、人胃癌细胞系HGC-27、MGC-803、AGS(均购自广州莱德尔生物科技有限公司)在含10%胎牛血清和1%P/S的RPMI1640培养基于37℃、5%CO2、相对湿度为90%的培养箱中培养。2-3天换液1次,使用0.25%含EDTA的胰蛋白酶常规消化传代,取处于对数生长期的细胞用于实验。
2、RNA的提取与浓度测定
使用QIAGEN的细胞RNA提取试剂盒提取细胞总RNA,具体操作参照说明书。
3、QPCR具体步骤同实施例2
4、结果
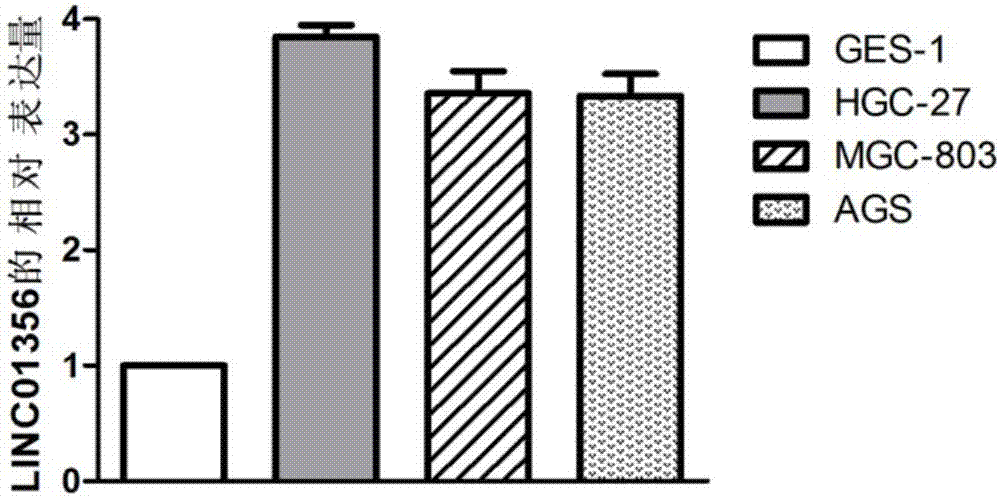
结果如图2所示,与胃粘膜上皮细胞相比,LINC01356基因在胃癌细胞HGC-27、MGC-803、AGS中表达均上调,差异具有统计学意义(P<0.01),选择HGC-27细胞进行后续的实验,研究LINC01356对胃癌细胞的作用。
实施例4 LINC01356基因的沉默
1、细胞培养步骤同实施例3
2、siRNA的设计
针对LINC01356基因的序列设计siRNA,设计的siRNA序列如下所示:
阴性对照siRNA序列(siRNA-NC):
正义链:5’-UUCUCCGAACGUGUCACGU-3’(SEQ ID NO.5),
反义链:5’-ACGUGACACGUUCGGAGAA-3’(SEQ ID NO.6);
siRNA1:
正义链:5’-AUUAUCCUCUGUAAUCCUCAC-3’(SEQ ID NO.7),
反义链:5’-GAGGAUUACAGAGGAUAAUCU-3’(SEQ ID NO.8);
siRNA2:
正义链:5’-AUGUGUUUGGAUUCCAAUCUG-3’(SEQ ID NO.9),
反义链:5’-GAUUGGAAUCCAAACACAUCC-3’(SEQ ID NO.10);
siRNA3:
正义链为5’-AAGAGAAAAAGGAAAAGCCAC-3’(SEQ ID NO.11),
反义链为5’-GGCUUUUCCUUUUUCUCUUCC-3’(SEQ ID NO.12)
siRNA4:
正义链为5’-UUUGUGAUUCUUCAGUUACUU-3’(SEQ ID NO.13),
反义链为5’-GUAACUGAAGAAUCACAAAAG-3’(SEQ ID NO.14)
3、转染
将HGC-27细胞按2×105/孔接种到六孔细胞培养板中,在37℃、5%CO2培养箱中细胞培养24h;在无双抗、含10%FBS的DMEM培养基中,转染按照脂质体转染试剂3000(购自于Invitrogen公司)的说明书转染。
实验分为空白对照组(HGC-27)、阴性对照组(siRNA-NC)和实验组(siRNA1、siRNA2、siRNA3、siRNA4),其中阴性对照组siRNA与LINC01356基因的序列无同源性,浓度为20nM/孔,同时分别进行转染。
4、QPCR检测LINC01356基因的转录水平
4.1细胞总RNA的提取
使用QIAGEN细胞RNA提取试剂盒提取细胞中的总RNA,具体步骤详见说明书。
4.2逆转录步骤同实施例2。
4.3 QPCR扩增步骤同实施例2。
5、结果
结果如图3显示,与HGC-27和转染空载siRNA-NC组相比,实验组(siRNA1~4)能降低LINC01356的水平,其中siRNA2的效果最为显著,因此选择siRNA2进行后续实验。
实施例5 LINC01356基因对胃癌细胞增殖的影响
采用MTS实验检测LINC01356基因对胃癌细胞增殖能力影响。
1、细胞培养与转染步骤同实施例4。
2、各组处理的细胞经胰酶消化后重悬细胞、计数,调整细胞浓度为l×105/ml按100μl/孔的密度接种于96孔板,即每孔细胞数为1×104个。
3、待细胞到达相应的检测时间点(0d、24h、48h、72h、96h)后,按10μL/孔加入CelITiter96AQ单溶液细胞增殖检测(MTS)试剂,微量振荡器振荡1~2min;置于5%CO2、37℃的细胞培养箱中孵育4h。
4、酶标仪读板,在490nm波长测定其吸光度(A)值。
5、结果
结果如图4所示,与对照相比,实验组(siRNA2)的细胞生长速度明显低于对照组的细胞的生长速度,差异具有统计学意义(P<0.05),上述结果表明降低LINC01356的表达抑制胃癌细胞的增殖,提示LINC01356可作为分子靶点应用于胃癌的治疗。
实施例6细胞迁移及侵袭实验
1、Transwell小室制备
无菌条件下Matrigel冰浴融化,用PBS进行20倍稀释,以50μl/孔的体积铺在Transwell小室的聚碳酸酯膜上。37℃放置4h,待Matrigel胶聚合成凝胶后取出,轻轻吸出上层析出液。每孔中加入50μl的含BSA的无血清培养液对基底膜进行水化处理,37℃放置30min。
2、配置细胞悬液
细胞饥饿处理12-24h,胰酶消化离心,使用无血清培养基进行重悬,调整细胞密度为5×l05个/ml。
3、细胞接种
取细胞悬液200μl加入到Transwell小室中,在24孔板下室加入500μl含FBS的DMEM培养基。把细胞放入细胞培养箱中培养24h。
4、染色
细胞在培养结束后使用DAPI染色。把小室细胞先用PBS漂洗2遍,放入DAPI工作液中室温染色5-20min。用PBS漂洗2遍,放入荧光显微镜下观察并计数。
5、结果
结果如图5所示,与对照组相比,实验组的迁移及侵袭细胞数都明显减少,结果说明沉默LINC01356的表达能够抑制胃癌的迁移及侵袭,提示LINC01356可作为靶标应用于胃癌转移以及侵袭的治疗。
上述实施例的说明只是用于理解本发明的方法及其核心思想。应当指出,对于本领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以对本发明进行若干改进和修饰,这些改进和修饰也将落入本发明权利要求的保护范围内。
序列表
<110> 北京泱深生物信息技术有限公司
<120> LINC01356作为分子标志物在胃癌中的应用
<160> 14
<170> SIPOSequenceListing 1.0
<210> 1
<211> 18
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 1
tgcctaacag agaacaat 18
<210> 2
<211> 19
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 2
agtcagtgaa tggagatag 19
<210> 3
<211> 21
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 3
aatcccatca ccatcttcca g 21
<210> 4
<211> 19
<212> DNA
<213> 人工序列(Artificial Sequence)
<400> 4
gagccccagc cttctccat 19
<210> 5
<211> 19
<212> RNA
<213> 人工序列(Artificial Sequence)
<400> 5
uucuccgaac gugucacgu 19
<210> 6
<211> 19
<212> RNA
<213> 人工序列(Artificial Sequence)
<400> 6
acgugacacg uucggagaa 19
<210> 7
<211> 21
<212> RNA
<213> 人工序列(Artificial Sequence)
<400> 7
auuauccucu guaauccuca c 21
<210> 8
<211> 21
<212> RNA
<213> 人工序列(Artificial Sequence)
<400> 8
gaggauuaca gaggauaauc u 21
<210> 9
<211> 21
<212> RNA
<213> 人工序列(Artificial Sequence)
<400> 9
auguguuugg auuccaaucu g 21
<210> 10
<211> 21
<212> RNA
<213> 人工序列(Artificial Sequence)
<400> 10
gauuggaauc caaacacauc c 21
<210> 11
<211> 21
<212> RNA
<213> 人工序列(Artificial Sequence)
<400> 11
aagagaaaaa ggaaaagcca c 21
<210> 12
<211> 21
<212> RNA
<213> 人工序列(Artificial Sequence)
<400> 12
ggcuuuuccu uuuucucuuc c 21
<210> 13
<211> 21
<212> RNA
<213> 人工序列(Artificial Sequence)
<400> 13
uuugugauuc uucaguuacu u 21
<210> 14
<211> 20
<212> RNA
<213> 人工序列(Artificial Sequence)
<400> 14
uaacugaaga aucacaaaag 20
- 还没有人留言评论。精彩留言会获得点赞!